Limiti di stabilità della fiamma laminare
|
|
|
- Adolfo Pepe
- 7 anni fa
- Visualizzazioni
Transcript
1 Esistono due criteri di stabilità: 1) Capacità della miscela di combustibile e ossidante di supportare la propagazione della fiamma (legata alle velocità chimiche del sistema per cui il rilascio del calore può non essere sufficiente a sostenere la reazione e la propagazione); a) limiti di infiammabilità; b) distanza di spegnimento (quenching); 2) Caratteristiche del flusso della miscela e relazione con la fiamma laminare; La combustione 1 a) LIMITI DI INFIAMMABILITÀ Nel caso delle miscele stechiometriche se si introduce una sorgente di accensione nella miscela anche a temperature molto basse e pressioni intorno al valore atmosferico, il gas intorno alla sorgente raggiunge una temperatura sufficiente a spostare la miscela nella regione di esplosione e a propagare la fiamma anche dopo che la sorgente è stata tolta. Per alcuni valori del rapporto stechiometrico la miscela non è in grado di sostenere la fiamma una volta che la sorgente è stata rimossa o perché è troppo ricca o perché troppo povera. I valori limiti per cui si può ancora avere l autosostentamento della fiamma si chiamano: limite di infiammabilità povero o limite inferiore; limite di infiammabilità ricco o limite superiore; La combustione 2
2 Tali limiti sono legati alla competizione tra la velocità di generazione del calore (che è controllato dalla velocità di reazione e dal calore di reazione della miscela) e lo scambio termico esterno della fiamma. In letteratura sono riportati i limiti relativi all aria e all ossigeno anche se i limiti poveri non cambiano in quanto l ossigeno in eccesso ha le stesse proprieà termofisiche dell azoto. Coward e Jones hanno cercato di standardizzare la procedura per la misura di tali limiti consigliando l utilizzo di un tubo di vetro di 2 pollici (per evitare effetti di parete in tubi più piccolo) e lungo 4 piedi (per verificare la propagazione indefinita della fiamma) accesa da una candela o da una piccola fiamma a pochi millimetri dall ingresso. È importante precisare la direzione di propagazione della fiamma. Si può assumere in prima approssimazione che una fiamma non possa propagarsi verso il basso in una miscela contenuta in un tubo verticale se la corrente di convezione che si produce è più veloce della velocità di fiamma. La combustione 3 Pertanto, i limiti della propagazione verso l alto sono leggermente più ampi rispetto a quelli verso il basso ovvero rispetto a quelli misurati in un tubo orizzontale. Tabella sui limiti di infiammabilità. La combustione 4
3 Esiste in realtà un effetto della temperatura per cui i limiti si allargano all aumentare di essa e la variazione è non lineare per gli idrocarburi. Il limite superiore è all incirca pari a 3 volte il valore stechiometrico mentre il limite inferiore è pari al 50% dello stechiometrico. Il limite inferiore (o povero) è uguale in aria o in ossigeno mentre il limite superiore è maggiore in ossigeno a causa delle maggiori temperature che derivano dall assenza di azoto. La combustione 5 La presenza di gas non combustibile o di vapore (es. CO 2, N 2 or Ar) porta ad avvicinare i due limiti con efficienza diversa a seconda dell inerte utilizzato: CO 2 > N 2 > Ar (o He) L effetto degli additivi mostrato in figura è legato al calore specifico via via crescente che agisce sulla riduzione della temperatura finale e quindi sulla velocità di propagazione. N.B. I limiti superiori sono più sensibili ai diluenti inerti rispetto ai limiti inferiori. I composti alogenati influenzano entrambi i limiti e ciò non può essere spiegato solo con il diverso calore specifico. La combustione 6
4 Da questi diagrammi è possibile calcolare la percentuale minima di ossigeno che consente la propagazione della fiamma. Tutte le miscele che giacciono sulle rette parallele hanno un contenuto costante di ossigeno (in quanto è costante la somma inerte + combustibile); la retta tangente al diagramma di infiammabilità è quella che dà la concentrazione minima di ossigeno. Al di sotto del valore critico dell'ossigeno minimo, nessuna miscela combustibilearia-diluente risulta infiammabile. Nell esempio in questione la retta tangente rappresenta una serie di miscele in cui la somma costante di combustibile e diluente vale 75% circa. L ossigeno minimo sarà pertanto quello contenuto nel residuo 25% di aria, cioè 25 x 0,21 = 5,25%. Per miscele di metano ossigeno e CO2 la percentuale minima di ossigeno è 14.6%, per miscele diluite con azoto è 12.1%, nel caso di argon la percentuale minima di ossigeno è pari al 9.8% La combustione 7 Il fatto che il limite superiore sia maggiormente influenzato dalla presenza di additivi può essere spiegato considerando gli step competitivi per le possibili catene di branching: H + H + M H2 + M (64) H + O OH + O (62) 2 La ricombinazione presente nella reazione (64) aumenta al ridursi della temperatura e all aumentare della concentrazione del terzo corpo M. All aumentare della concentrazione di diluente la reazione diventa più veloce rispetto alla (62). L effetto dei composti alogenati è molto forte: bastano poche percentuali per rendere il sistema non infiammabile. Ciò è dovuto al fatto che gli alogenati funzionano da catalizzatori nel ridurre la concentrazione di H necessario per lo schema di branching. La combustione 8
5 Gli idrocarburi alogenati hanno legami molto deboli che si rompono facilmente liberando l atomo di alogeno. Tale atomo sottrae rapidamente l idrogeno atomico dal combustibile secondo il seguente schema in cui X rappresenta il generico alogeno (F, Cl, Br o I) HX + H H 2 + X (65) X + X + M X2 + M (66) X2 + H HX + X (67) H + H H Queste reazioni sono molto veloci e corrispondono ad una ricombinazione dell idrogeno in cui il composto alogenato funge da catalizzatore. Infatti il composto si ritrova inalterato alla fine del processo. 2 La combustione 9 Anche l anidride solforosa SO 2 funziona da inibitore sui limiti di infiammabilità a causa dei seguenti meccanismi che comportano la rimozione dei radicali O e H. 1) SO2 + O + M SO3+ M (69) SO3+ O SO2 + O2 (70) O + O O2 2) SO2 + H + M HSO2 + M (71) HSO + OH SO + O (72) 3) SO2 + O + M SO3+ M SO3+ O + M HSO3+ M (73) (74) HSO + M SO + H O (75) H + OH H2O H + H + O H2O La combustione 10
6 EFFETTO DELLA PRESSIONE Per idrocarburi semplici (etano, propano, pentano) i limiti superiori si allargano linearmente con la pressione mentre i limiti poveri inizialmente si allargano leggermente e poi si restringono ma le variazioni dei limiti inferiori sono sempre molto limitate. Per pressioni al di sotto di quella atmosferica i due limiti convergono fino a raggiungere un valore di pressione al di sotto del quale non è possibile la propagazione della fiamma. I risultati alle basse pressioni sono comunque dipendenti fortemente dal diametro del tubo usato per le misure. La combustione 11 EFFETTO DELLO SCAMBIO TERMICO I limiti di infiammabilità sono legati alla perdita di calore. Nel caso del becco Bunsen, le perdite legate ai fissaggi sono trascurabili per cui la maggiore fonte di dispersione termica è costituita dal calore radiativo. Tale calore radiativo nel campo degli infrarossi è legato principalmente alla radiazione di legame di CO2, H2O e CO. Poiché in vicinanza dei limiti di infiammabilità la dissociazione è trascurabile, all aumentare della pressione non c è un rilevante aumento della temperatura. La perdita di calore radiativo in una banda spettrale vibrazionale varia come la quinta potenza della temperatura. Questa variazione deve essere confrontata con la variazione della velocità di reazione con la temperatura che va come l esponenziale exp(-e/rt). Per molti idrocarburi l energia di attivazione e i range di temperatura sono tali che le due variazioni siano molto prossimo. La combustione 12
7 L equazione della radiazione contiene, però, un termine di emissività che è proporzionale alla pressione totale. Quando la pressione aumenta l emissività aumenta e le perdite di calore aumentano linearmente. Nel caso di miscele povere il sistema è globalmente del primo ordine a causa dell eccesso di aria per cui la velocità globale varia linearmente con la pressione per cui la velocità di rilascio del calore e lo scambio termico radiativo aumentano allo stesso modo. Ciò spiega il fatto che la pressione abbia un influenza molto scarsa sul limite inferiore di infiammabilità. Nel caso di miscela ricca la reazione è del secondo ordine per cui il rilascio di calore aumenta più velocemente dello scambio termico per cui il limite superiore tende ad allargarsi. La combustione 13 DISTANZA DI QUENCHING Per studiare lo spegnimento si misura il diametro di quenching d t in questo modo: Si stabilisce una fiamma laminare nel bruciatore Bunsen; Si arresta istantaneamente il flusso di gas; Se la fiamma si propaga in giù si sostituisce il tubo con uno di diametro più piccolo; Si diminuisce il diametro del tubo finché la fiamma non riesce più a propagarsi in giù; Il diametro massimo per cui non si ha il ritorno di fiamma si chiama distanza di spegnimento. La combustione 14
8 I fattori che influenzano lo spegnimento nel tubo sono: a) La diffusione delle specie; Al diminuire del diametro del tubo aumenta il numero di collisioni tra i radicali attivi che vengono così distrutti; b) La diffusione del calore; Al diminuire del diametro del tubo aumenta il rapporto superficie/volume per cui aumenta il peso delle perdite di calore; N.B. La distruzione dei radicali è influenzata dalle condizioni e dal materiale di cui è costituito il tubo per cui non è ppossibile determinare in modo analitico la distanza di spegnimento. La combustione 15 Intuitivamente si può supporre che esista una correlazione inversa tra la velocità di fiamma e la distanza di spegnimento. Poiché S L varia con il rapporto di equivalenza ci si può aspettare la variazione in figura. Si può notare anche l effetto della temperatura sulla distanza di spegnimento. All aumentare della temperatura la distanza diminuisce perché si riducono le perdite di calore e le specie non vengono prontamente deattivate. La combustione 16
9 Effetto della pressione La distanza di quenching è inversamente proporzionale alla pressione anche se in alcuni casi si possono avere correlazioni diverse. All aumentare della pressione aumentano le collisioni a parete per cui aumenta la de-attivazione dei radicali. La linea tratto-punto orizzontale rappresenta i limiti di infiammabilità ottenibili ad una data pressione subatmosferica in tubi di diametro diverso. La combustione 17 STABILIZZAZIONE DELLA FIAMMA Consideriamo una fiamma che si propaga in un tubo al variare della velocità del flusso. Quando i gas premiscelati freschi fluiscono in direzione opposta alla propagazione della fiamma ma con la stessa velocità, la fiamma diventa stazionaria rispetto al tubo. Se la velocità dei gas freschi aumenta, la fiamma fuoriesce dal tubo e si posiziona in qualche punto all uscita del tubo. Se il tubo è verticale si ottiene la forma in figura. In questo tipo di bruciatore si assume che la fiamma sia premiscelata all uscita e che il flusso sia laminare. Per quel che riguarda la stabilità il bruciatore può essere considerato come un pozzo di calore e di radicali che, nella maggior parte dei casi stabilizza la fiamma. Flusso premiscelato Gas combusti Zona luminosa Zona scura La combustione 18
10 Quando la velocità dei gas freschi è aumentata fino a superare quella della fiamma, il fronte di fiamma assume una forma conica e all aumentare della velocità diminuisce l angolo al vertice del cono. Questa diminuzione è tale che la componente di velocità del flusso ortogonale alla fiamma sia uguale alla velocità di fiamma. Vicino al bordo la velocità è minore rispetto al centro del tubo per cui in alcuni vicino al bordo la velocità di fiamma e la velocità di flusso diventano uguali (punti in cui avviene l ancoramento della fiamma). La fiamma è molto vicina al bordo e la sua velocità è controllata dalla perdita di calore e radicali a parete. Se la velocità del flusso è ulteriormente aumentata, il contorno della fiamma si allontana dal bruciatore, le perdite al bordo diminuiscono, la velocità di fiamma aumenta per cui si raggiunge un nuovo punto di stabilità. Flusso premiscelato Gas combusti Zona luminosa Zona scura La combustione 19 Quando il flusso è tale che la fiamma si allontani dal bordo, si ha l ingresso dell aria esterna per cui la miscela si diluisce, la velocità di fiamma si abbassa e la fiamma raggiunge il suo limite di BLOW-OFF. Se la velocità del flusso viene gradualmente ridotta, si raggiunge una condizione in cui la velocità di fiamma è maggiore della velocità del flusso in alcuni punti del bruciatore. In queste condizioni la fiamma si propaga verso il basso e si raggiunge il cosiddetto limite di FLASHBACK. Prima di raggiungere tale limite la fiamma si inclina perché la contropressione della fiamma crea un disturbo sul flusso e solo nella regione in cui la velocità del flusso si riduce si ha l ingresso della fiamma nel bruciatore. Flusso premiscelato Gas combusti Zona luminosa Zona scura La combustione 20
11 A causa dei limiti imposti dal tubo il flusso è meno incline a distorcersi per cui la fiamma non riesce a propagarsi oltre e si ha l inclinazione della fiamma riportata in figura. Possiamo quindi concludere che nei bruciatori la fiamma laminare è stabilizzata solo entro certi limiti di velocità del flusso. Vediamo ora in dettaglio i fenomeni di blowoff e flashback. La combustione 21 BLOWOFF E FLASHBACK Se si assume che nel tubo si instauri un flusso di Poiseuille, la velocità sarà zero alla parete e massima al centro del flusso. Le dimensioni lineari della regione di parete sono molto piccole (1mm per miscele aria-metano) rispetto la diametro del tubo per cui il profilo di velocità in prossimità della parete può essere considerato lineare. Si assume, inoltre, che le linee di flusso del getto di combustibile siano parallele all asse del tubo, che si formi un onda di combustione nel flusso e che il bordo dell onda si avvicini al bordo del bruciatore. Lungo il profilo della fiamma la velocità di combustione raggiunge il suo massimo valore S L 0 La combustione 22
12 Avvicinandosi al bordo della fiamma la velocità di combustione diminuisce per effetto della perdita di calore e radicali alla parete. Se la frangia della fiamma è molto vicina al bordo del tubo (posizione 1) in ogni linea di flusso la velocità di combustione è più piccola della velocità del gas e la fiamma è spinta via dal flusso di gas. Quando la distanza dall uscita del tubo aumenta, la perdita di calore e di portatori di catena diminuisce per cui la velocità di combustione aumenta. Alla fine si raggiunge la posizione 2 in cui la velocità di combustione uguaglia quella del gas in corrispondenza di alcuni punti del profilo dell onda. La fiamma in questa condizione è in equilibrio rispetto all uscita del tubo. La combustione 23 Se la fiamma è spinta fino ad una distanza maggiore (posizione 3), la velocità di combustione diventa maggiore della velocità del gas per cui l onda si allontana dalla posizione di equilibrio (BLOW OFF). Consideriamo ora l andamento della velocità di fiamma in funzione della distanza nell ipotesi che la fiamma sia entrata nel tubo. La distanza dalla parete del bruciatore viene chiamata distanza di penetrazione (metà del diametro di spegnimento d T ). Se u 1 rappresenta la velocità media nel tubo e la linea indicata con u 1 rappresenta il grafico di velocità vicino alle pareti del tubo, non esiste alcun punto in cui la velocità locale di fiamma sia maggiore della velocità locale del gas. La combustione 24
13 Pertanto qualsiasi fiamma che si instauri nel tubo tenderà ad uscire. Nel caso in cui la velocità media è u3 si ha il fenomeno di FLASH BACK. La velocità u2 rappresenta la velocità minima del flusso prima che avvenga il ritorno di fiamma. Si può dimostrare che, assumendo il profilo lineare nello strato limite: λ 1 d p c ρ S p Nel caso del blowoff è più difficile trovare una espressione analitica in quanto non esiste qualcosa di simile allo strato limite ma esiste un confine libero. L La combustione 25 Quando il flusso di gas nel tubo aumenta, la posizione di equilibrio si allontana dal bordo. Si è visto che aumentando la distanza dal bordo, la miscela si diluisce progressivamente per interdiffusione con l aria atmosferica circostante e la velocità di combustione in corrispondenza delle linee di flusso più esterne diminuisce. Questo effetto è evidenziato dall aumento del ritiro della frangia di fiamma dalla posizione 1 alla posizione 3. Quanto la fiamma si allontana ulteriormente dal bordo di uscita del tubo perde meno calore e radicali per cui si può estendere più vicino ad un ipotetico spigolo. Esiste comunque una posizione di equilibrio finale oltre la quale l effetto sulla velocità di combustione dovuto all aumentata distanza dal bruciatore è superata dall effetto di diluizione. La combustione 26
14 Se il gradiente di velocità nello strato limite è così grande da allontanare l onda di combustione da questa posizione, la velocità del gas diventa superiore a quella di fiamma in ogni linea di flusso e l onda di combustione vola via come mostrato in figura. Il diagramma segue l ipotesi che la velocità di fiamma S L 0 è la velocità dopo che il gas è stato diluito a causa dello spostamento del fronte di fiamma oltre la velocità u 3 che diventa la velocità di BLOWOFF La combustione 27 Nell ipotesi di flusso laminare (flusso di Poiseuille) il profilo di velocità lungo il diametro del tubo è dato da: u = n R r 2 2 ( ) Dove n si ricava imponendo che la portata volumetrica sia: R Q= 2 π rudr n= 2 Q / π R 0 4 Il gradiente necessario per il calcolo del blowoff o del flashback è: g 4Q uav u = lim( du/ dr) = = 4 = 8 π R R d FB, r R 3 av La combustione 28
15 I dati sperimentali relativi a blowoff e flashback si rappresentano in funzione della velocità media di flashback u av,f. È possibile stimare la distanza di penetrazione (spessore di spegnimento) dalle pareti del bruciatore osservando il raggio di arresto (cutoff) per ogni valore della miscela. Lo sviluppo dei gradienti di flashback e blowoff suggerisce di rappresentare i dati come nelle figure di sotto. Dall esame di queste figure si nota che la curva di blowoff è molto più ripida rispetto a quella di flashback. Per miscele ricche le curve di blowoff continuano a salire invece di diminuire dopo che è stato raggiunto il valore stechiometrico nel caso di esperimenti effettuati in aria La combustione 29 Infatti, la diffusione dell aria nella miscela man mano che la fiamma si allontana dal bordo aumenta la velocità locale della fiamma rispetto alla miscela inizialmente ricca. Se gli esperimenti sono condotti in azoto, g B ha un valore di massimo in corrispondenza della miscela stechiometrica. Per quanto riguarda le fiamme lifted, quando la velocità del gas diminuisce, avviene il cosiddetto dropback e la fiamma riprende la sua normale posizione al bordo del bruciatore. Quando, invece, si aumenta la velocità si raggiunge una condizione in qui la fiamma si spegne. La combustione 30
16 Comprendere i limiti di stabilità è importante nel progetto dei becchi Bunsen e dei fornelli da cucina a combustibile gassoso. Nel progetto di un bruciatore Bunsen è desiderabile avere il massimo range di velocità di flusso senza incontrare problemi di stabilità. Il problema è stabilire il valore ottimale del diametro del tubo. Innanzitutto il tubo deve essere almeno il doppio della distanza di penetrazione che è maggiore della distanza di spegnimento. Inoltre, la velocità media deve essere almeno il doppio della velocità di fiamma altrimenti non si forma un preciso cono di Bunsen. Gli studi sperimentali hanno dimostrato, inoltre, che se la velocità media è cinque volte SL, il combustibile penetra la punta del cono di Bunsen. Se il numero di Re del gas all interno del tubo supera 2000 il flusso può diventare turbolento. Se si rappresenta la velocità media in funzione del diametro d tenendo conto di tutte queste limitazioni si ottiene la seguente figura: La combustione 31 Comprendere i limiti di stabilità è importante nel progetto dei becchi Bunsen e dei fornelli da cucina a combustibile gassoso. In questa figura la zona tratteggiata rappresenta quella in cui si ha la variabilità del flusso senza problemi di stabilità. La massima variabilità corrisponde al diametro di 1 cm per cui il diametro del becco Bunsen è sempre uguale ad 1 cm. La combustione 32
17 I bruciatori dei fornelli sono molto simili ai becchi Bunsen. Il combustibile porta con se l aria e i due si mescolano prima di raggiungere l anello del bruciatore coi i fori per la fiamma. Questa situazione si può schematizzare come un eiettore. Per un eiettore la portata totale di miscela può essere correlata alla velocità del combustibile immesso nel sistema attraverso la conservazione della quantità di moto: mu = mu u ( ρ u A) = u( ρ u A) m m f f m m m m f f f f 2 2 mum fuf con Af / Am ρ = αρ α = La combustione 33 Consideriamo gli andamenti di g B e g F per tali bruciatori. Fissiamo il diametro di uscita in modo tale da ottenere una miscela ricca corrispondente alla linea tratteggiata in figura. Quando il rapporto di miscela è fissato a tale valore, non si può mai avere il ritorno di fiamma nel fornello. Se si cambia il tipo di combustibile possono nascere delle complicazioni. Il rapporto volumetrico combustibile/aria nell iniettore è dato da: F/ A= ( u A )/( u A ) f f m m La combustione 34
18 Se assumiamo che la miscela sia costituita essenzialmente da aria e trascuriamo la variazione della densità della miscela al variare della quantità di combustibile, dall equazione della quantità di moto si trova: F/ A= ( ρ / ρ ) α 1/2 1/2 Il rapporto stechiometrico molare (o volumetrico) del combustibile è strettamente proporzionale al peso molecolare gli idrocarburi di nostro interesse: m ( F/ A) (1/ PMf) (1/ ρ ) stoich f f La combustione 35 F / A φ = α ( F / A) st 1/ 2 1/ 2 f 1/ 2 m Passando da un combustibile più pesante ad un combustibile più leggero, il rapporto di equivalenza si riduce e si ottiene la linea trattopunto. Per cui si possono avere problemi di ritorno di fiamma oppure di spegnimento. Per passare dal GPL al gas naturale è necessario allargare i fori del fornello. Passando, invece, da un gas più leggero ad un gas più pesante non si hanno problemi di stabilità ma la miscela diventa troppo ricca e si hanno sprechi di combustibile. ρ ρ La combustione 36
Principali Caratteristiche di un Combustore GT
 Principali Caratteristiche di un Combustore GT Diversamente dei sistemi di combustione tradizionali i combustori per Turbine a Gas hanno la particolarità di operare con: elevate temperature in ingresso;
Principali Caratteristiche di un Combustore GT Diversamente dei sistemi di combustione tradizionali i combustori per Turbine a Gas hanno la particolarità di operare con: elevate temperature in ingresso;
Introduzione alla combustione
 La combustione 1 La combustione 2 La combustione 3 La combustione 4 La combustione 5 La combustione 6 La combustione 7 La combustione 8 La combustione 9 La combustione 10 La combustione 11 La combustione
La combustione 1 La combustione 2 La combustione 3 La combustione 4 La combustione 5 La combustione 6 La combustione 7 La combustione 8 La combustione 9 La combustione 10 La combustione 11 La combustione
Esperienza del viscosimetro a caduta
 Esperienza del viscosimetro a caduta Parte del corso di fisica per CTF dr. Gabriele Sirri sirri@bo.infn.it http://ishtar.df.unibo.it/uni/bo/farmacia/all/navarria/stuff/homepage.htm Esperienza del viscosimetro
Esperienza del viscosimetro a caduta Parte del corso di fisica per CTF dr. Gabriele Sirri sirri@bo.infn.it http://ishtar.df.unibo.it/uni/bo/farmacia/all/navarria/stuff/homepage.htm Esperienza del viscosimetro
Combustione 2H 2 CO 2. Entalpie standard di combustione
 La combustione è una reazione di ossidoriduzione esotermica in cui si ha l'ossidazione di un combustibile da parte di un comburente (ossigeno presente nell aria), con sviluppo di calore e radiazioni luminose.
La combustione è una reazione di ossidoriduzione esotermica in cui si ha l'ossidazione di un combustibile da parte di un comburente (ossigeno presente nell aria), con sviluppo di calore e radiazioni luminose.
Combustione. Energia chimica. Energia termica Calore. Combustibili fossili
 Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Combustione La combustione è un processo di ossidazione rapido con produzione di luce e calore, con trasformazione di energia chimica in energia termica Energia chimica Combustibili fossili Energia termica
Allargamento di riga
 Allargamento di riga Le linee spettrali hanno un allargamento in frequenza (larghezza spettrale di riga). Le forme delle curve sono descritte da una funzione di forma di riga g( ) che fornisce anche la
Allargamento di riga Le linee spettrali hanno un allargamento in frequenza (larghezza spettrale di riga). Le forme delle curve sono descritte da una funzione di forma di riga g( ) che fornisce anche la
REFORMING dei COMBUSTIBILI
 MODELLAZIONE e SIMULAZIONE dei SISTEMI ENERGETICI REFORMING dei COMBUSTIBILI Ing. Vittorio Tola DIMCM - Dipartimento di Ingegneria Meccanica, Chimica e dei Materiali PRODUZIONE di IDROGENO Negli ultimi
MODELLAZIONE e SIMULAZIONE dei SISTEMI ENERGETICI REFORMING dei COMBUSTIBILI Ing. Vittorio Tola DIMCM - Dipartimento di Ingegneria Meccanica, Chimica e dei Materiali PRODUZIONE di IDROGENO Negli ultimi
Esercitazione 2 Ciclo a vapore a recupero
 Esercitazione 2 Ciclo a vapore a recupero Lo scopo di questa esercitazione è la progettazione di un ciclo a recupero: l impianto è composto da un ciclo a vapore ad un livello di pressione che utilizza
Esercitazione 2 Ciclo a vapore a recupero Lo scopo di questa esercitazione è la progettazione di un ciclo a recupero: l impianto è composto da un ciclo a vapore ad un livello di pressione che utilizza
Fondamenti di combustione [1-32]
![Fondamenti di combustione [1-32] Fondamenti di combustione [1-32]](/thumbs/70/63741257.jpg) Politecnico di Milano Facoltà di Ingegneria Industriale Corso di Laurea in Ingegneria Aerospaziale Insegnamento di Propulsione Aerospaziale Anno accademico 2011/12 Capitolo 3 sezione d Fondamenti di combustione
Politecnico di Milano Facoltà di Ingegneria Industriale Corso di Laurea in Ingegneria Aerospaziale Insegnamento di Propulsione Aerospaziale Anno accademico 2011/12 Capitolo 3 sezione d Fondamenti di combustione
Università di Roma Tor Vergata
 Università di Roma Tor Vergata Facoltà di Ingegneria Dipartimento di Ingegneria Industriale Corso di: TERMOTECNICA TRASMISSIONE DEL CALORE: RESISTENZA DI CONTATTO Ing. G. Bovesecchi gianluigi.bovesecchi@gmail.com
Università di Roma Tor Vergata Facoltà di Ingegneria Dipartimento di Ingegneria Industriale Corso di: TERMOTECNICA TRASMISSIONE DEL CALORE: RESISTENZA DI CONTATTO Ing. G. Bovesecchi gianluigi.bovesecchi@gmail.com
L equilibrio chimico
 L equilibrio chimico Un equilibrio dinamico: la velocità in una direzione è bilanciata dalla velocità nell altra. Sebbene non si osservi alcun cambiamento macroscopico molta attività è in corso 1 La differenza
L equilibrio chimico Un equilibrio dinamico: la velocità in una direzione è bilanciata dalla velocità nell altra. Sebbene non si osservi alcun cambiamento macroscopico molta attività è in corso 1 La differenza
5. Calcolo termodinamico e fluidodinamico di progetto di un riscaldatore d aria con fluidi in controcorrente.
 5. Calcolo termodinamico e fluidodinamico di progetto di un riscaldatore d aria con fluidi in controcorrente. Si vuole effettuare il dimensionamento di un riscaldatore d aria con fluidi in controcorrente
5. Calcolo termodinamico e fluidodinamico di progetto di un riscaldatore d aria con fluidi in controcorrente. Si vuole effettuare il dimensionamento di un riscaldatore d aria con fluidi in controcorrente
Caratteristiche del tubo ricevitore
 Caratteristiche del tubo ricevitore Il tubo ricevitore ha la funzione di trasferire al fluido che scorre al suo interno la massima parte dell energia solare concentrata dagli specchi parabolici, garantendo
Caratteristiche del tubo ricevitore Il tubo ricevitore ha la funzione di trasferire al fluido che scorre al suo interno la massima parte dell energia solare concentrata dagli specchi parabolici, garantendo
Cinetica di una reazione chimica. Studio della velocità con cui avviene una reazione e dei fattori che la influenzano.
 Cinetica di una reazione chimica Studio della velocità con cui avviene una reazione e dei fattori che la influenzano. RILEVANZA TEORICA: permette di ottenere informazioni sul meccanismo di reazione UTILITA
Cinetica di una reazione chimica Studio della velocità con cui avviene una reazione e dei fattori che la influenzano. RILEVANZA TEORICA: permette di ottenere informazioni sul meccanismo di reazione UTILITA
Transizione di fase liquido-vapore
 Lezione 15 1. L equilibrio chimico dinamico 2. Reazioni chimiche e costante di equilibrio 3. Legge di azione di massa 4. Equilibrio in fase gassosa 5. Fattori che influenzano l equilibrio: il principio
Lezione 15 1. L equilibrio chimico dinamico 2. Reazioni chimiche e costante di equilibrio 3. Legge di azione di massa 4. Equilibrio in fase gassosa 5. Fattori che influenzano l equilibrio: il principio
1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido.
 UNITÀ 8 LA MECCANICA DEI FLUIDI 1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido. 3. La pressione atmosferica. 4. La legge di Stevino. 5. La legge di Pascal. 6. La forza di Archimede.
UNITÀ 8 LA MECCANICA DEI FLUIDI 1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido. 3. La pressione atmosferica. 4. La legge di Stevino. 5. La legge di Pascal. 6. La forza di Archimede.
12/03/2013. Aria umida. Proprietà e trasformazioni
 Aria umida Proprietà e trasformazioni 1 Costituente Concentrazione volumetrica (%) Massa molecolare [kg/ kmol] Azoto (N 2 ) 78,084 28,0134 Ossigeno (O 2 ) 20,9476 31,9988 Argon (Ar) 0,934 39,948 Anidride
Aria umida Proprietà e trasformazioni 1 Costituente Concentrazione volumetrica (%) Massa molecolare [kg/ kmol] Azoto (N 2 ) 78,084 28,0134 Ossigeno (O 2 ) 20,9476 31,9988 Argon (Ar) 0,934 39,948 Anidride
ESAME DI AERODINAMICA 13/7/2009
 ESAME DI AERODINAMICA 3/7/2009 Una presa d aria supersonica è progettata per funzionare a M = 2.6. se la sezione d ingresso ha un area A i = 0.58m 2, la sezione di gola in m 2 è: (b).32 (c).2 (d).4 (e).078
ESAME DI AERODINAMICA 3/7/2009 Una presa d aria supersonica è progettata per funzionare a M = 2.6. se la sezione d ingresso ha un area A i = 0.58m 2, la sezione di gola in m 2 è: (b).32 (c).2 (d).4 (e).078
EQUILIBRIO CHIMICO. Nella reazione omogenea e reversibile: v 1 A (g) + B (g) v 2. C (g) + D (g)
 EQUILIBRIO CHIMICO Nella reazione omogenea e reversibile: v 1 A (g) + B (g) v 2 C (g) + D (g) le velocità della reazione diretta e inversa sono esprimibili in funzione delle concentrazioni dei reagenti
EQUILIBRIO CHIMICO Nella reazione omogenea e reversibile: v 1 A (g) + B (g) v 2 C (g) + D (g) le velocità della reazione diretta e inversa sono esprimibili in funzione delle concentrazioni dei reagenti
Esercitazione 4 Cicli a vapore avanzati
 Esercitazione 4 Cicli a vapore avanzati Questa esercitazione prevede il confronto di 5 diverse configurazioni relative ad un ciclo a vapore USC. Per effettuare i calcoli è stato utilizzato il programma
Esercitazione 4 Cicli a vapore avanzati Questa esercitazione prevede il confronto di 5 diverse configurazioni relative ad un ciclo a vapore USC. Per effettuare i calcoli è stato utilizzato il programma
Inquinamento ARIA. Inquinamento ARIA. Inquinamento ARIA. Inquinamento ARIA
 COMBUSTIONE: principi Processo di ossidazione di sostanze contenenti C ed H condotto per ottenere energia termica (calore) C,H + O 2 calore + gas comb. COMBUSTIBILE + COMBURENTE CALORE + RESIDUI [ARIA]
COMBUSTIONE: principi Processo di ossidazione di sostanze contenenti C ed H condotto per ottenere energia termica (calore) C,H + O 2 calore + gas comb. COMBUSTIBILE + COMBURENTE CALORE + RESIDUI [ARIA]
delle curve isoterme dell anidride carbonica
 COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
Cinetica chimica. studia la velocità a cui decorrono le reazioni chimiche una velocità è la variazione di una proprietà per unità di tempo:
 Cinetica chimica Cosa è la velocità di reazione e fattori che la influenzano Effetto concentrazione e temperatura Equazione di Arrhenius Molecolarità reazione. Energia di attivazione e catalisi Cinetica
Cinetica chimica Cosa è la velocità di reazione e fattori che la influenzano Effetto concentrazione e temperatura Equazione di Arrhenius Molecolarità reazione. Energia di attivazione e catalisi Cinetica
Apparato respiratorio. Anatomia
 Apparato respiratorio Anatomia 1 Le vie aeree: di conduzione e di scambio 3 L Trachea, bronchi principali, bronchioli (diametro 1 mm) sono dotati di struttura cartilaginea ad anello incompleto e fibre
Apparato respiratorio Anatomia 1 Le vie aeree: di conduzione e di scambio 3 L Trachea, bronchi principali, bronchioli (diametro 1 mm) sono dotati di struttura cartilaginea ad anello incompleto e fibre
PASSAGGIO DEL CALORE E DIFFUSIONE DEL VAPORE
 Francesco Nicolini 259407, Giulia Voltolini 26354 9 Marzo 206, 0:30 3:30 PASSAGGIO DEL CALORE E DIFFUSIONE DEL VAPORE. CALCOLO DELLA POTENZA TERMICA Q Il calcolo della potenza termica in regime stazionario
Francesco Nicolini 259407, Giulia Voltolini 26354 9 Marzo 206, 0:30 3:30 PASSAGGIO DEL CALORE E DIFFUSIONE DEL VAPORE. CALCOLO DELLA POTENZA TERMICA Q Il calcolo della potenza termica in regime stazionario
Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali
 Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali Corso di Laurea in Chimica A.A. 2013/14 Test di autovalutazione 2 ottobre 2013 Cognome: Nome: Matematica e logica 1.
Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali Corso di Laurea in Chimica A.A. 2013/14 Test di autovalutazione 2 ottobre 2013 Cognome: Nome: Matematica e logica 1.
Reversibilità delle Reazioni Chimiche
 Reversibilità delle Reazioni Chimiche Pioggia ricca in CO 2 Terreno carsico, ricco in carbonato di calcio CaCO 3 CO 2(aq) + H 2 O (l) + CaCO 3(s) Ca 2+ (aq) + 2 HCO 3 - (aq) Nel Sottosuolo: Acqua ricca
Reversibilità delle Reazioni Chimiche Pioggia ricca in CO 2 Terreno carsico, ricco in carbonato di calcio CaCO 3 CO 2(aq) + H 2 O (l) + CaCO 3(s) Ca 2+ (aq) + 2 HCO 3 - (aq) Nel Sottosuolo: Acqua ricca
Calore specifico. Il calore che deve essere fornito per aumentare di un grado centigrado un chilogrammo della sostanza è il calore specifico:
 Calore specifico L aumento (diminuzione) di temperatura in una sostanza è proporzionale all energia fornita (sottratta) alla sostanza sotto forma di calore: Il calore che deve essere fornito per aumentare
Calore specifico L aumento (diminuzione) di temperatura in una sostanza è proporzionale all energia fornita (sottratta) alla sostanza sotto forma di calore: Il calore che deve essere fornito per aumentare
EQUILIBRIO CHIMICO [riprendere la lezione: equazioni (inciso)]
![EQUILIBRIO CHIMICO [riprendere la lezione: equazioni (inciso)] EQUILIBRIO CHIMICO [riprendere la lezione: equazioni (inciso)]](/thumbs/88/116323111.jpg) EQUILIBRIO CHIMICO [riprendere la lezione: equazioni (inciso)] a A + b B c C + d D Caso particolare: V d = k d [A] m *[B] n V i = k i [C] o *[D] p La velocità delle due reazioni dipende da k (d o i) (legata
EQUILIBRIO CHIMICO [riprendere la lezione: equazioni (inciso)] a A + b B c C + d D Caso particolare: V d = k d [A] m *[B] n V i = k i [C] o *[D] p La velocità delle due reazioni dipende da k (d o i) (legata
Apparato respiratorio
 Apparato respiratorio Anatomia Le vie aeree: di conduzione e di scambio 3 L Trachea, bronchi principali, bronchioli (diametro 1 mm) sono dotati di struttura cartilaginea ad anello incompleto e fibre muscolari
Apparato respiratorio Anatomia Le vie aeree: di conduzione e di scambio 3 L Trachea, bronchi principali, bronchioli (diametro 1 mm) sono dotati di struttura cartilaginea ad anello incompleto e fibre muscolari
Apparato respiratorio. Anatomia
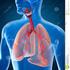 Apparato respiratorio Anatomia 1 Le vie aeree: di conduzione e di scambio 3 L Trachea, bronchi principali, bronchioli (diametro 1 mm) sono dotati di struttura cartilaginea ad anello incompleto e fibre
Apparato respiratorio Anatomia 1 Le vie aeree: di conduzione e di scambio 3 L Trachea, bronchi principali, bronchioli (diametro 1 mm) sono dotati di struttura cartilaginea ad anello incompleto e fibre
1.Pressione di un Gas
 1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
( pi + σ ) nds = 0 (3)
 OLUZIONE IMULAZIONE EAME 0 DICEMBRE 05 I Parte Domanda (5 punti) Un fluido incomprimibile viene pompato in tubo orizzontale di lunghezza L e diametro D. La differenza di pressione agli estremi del tubo
OLUZIONE IMULAZIONE EAME 0 DICEMBRE 05 I Parte Domanda (5 punti) Un fluido incomprimibile viene pompato in tubo orizzontale di lunghezza L e diametro D. La differenza di pressione agli estremi del tubo
La misura della temperatura
 Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Calore e temperatura 1. La misura della temperatura 2. La dilatazione termica 3. La legge fondamentale della termologia 4. Il calore latente 5. La propagazione del calore La misura della temperatura La
Dinamica dei Fluidi. Moto stazionario
 FLUIDODINAMICA 1 Dinamica dei Fluidi Studia il moto delle particelle di fluido* sotto l azione di tre tipi di forze: Forze di superficie: forze esercitate attraverso una superficie (pressione) Forze di
FLUIDODINAMICA 1 Dinamica dei Fluidi Studia il moto delle particelle di fluido* sotto l azione di tre tipi di forze: Forze di superficie: forze esercitate attraverso una superficie (pressione) Forze di
Esercitazione di Meccanica dei fluidi con Fondamenti di Ingegneria Chimica. Scambio di materia (II)
 Esercitazione di Meccanica dei fluidi con Fondamenti di Ingegneria himica Esercitazione 6 (FI) - 1 Gennaio 016 Scambio di materia (II) Esercizio 1 Evaporazione di acqua da una piscina Stimare la perdita
Esercitazione di Meccanica dei fluidi con Fondamenti di Ingegneria himica Esercitazione 6 (FI) - 1 Gennaio 016 Scambio di materia (II) Esercizio 1 Evaporazione di acqua da una piscina Stimare la perdita
Velocità di reazione. Consideriamo una generica reazione
 Velocità di reazione. Consideriamo una generica reazione Esprimiamo perciò la velocità di un processo chimico in un certo periodo di tempo tramite il rapporto tra la variazione di concentrazione di un
Velocità di reazione. Consideriamo una generica reazione Esprimiamo perciò la velocità di un processo chimico in un certo periodo di tempo tramite il rapporto tra la variazione di concentrazione di un
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 25-26 2009 Programma: a che punto siamo? Tre tipi di Sistema Un richiamo Sistema isolato: Non scambia energia e materia
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 25-26 2009 Programma: a che punto siamo? Tre tipi di Sistema Un richiamo Sistema isolato: Non scambia energia e materia
Corso di Laurea in Medicina e Chirurgia Prova scritta di Fisica del 8/9/2017
 Corso di Laurea in Medicina e Chirurgia Prova scritta di Fisica del 8/9/2017 Nome: Cognome: N. matricola: * Segnare con una x la risposta corretta, svolgere i problemi nei fogli allegati scrivendo le formule
Corso di Laurea in Medicina e Chirurgia Prova scritta di Fisica del 8/9/2017 Nome: Cognome: N. matricola: * Segnare con una x la risposta corretta, svolgere i problemi nei fogli allegati scrivendo le formule
Trasmissione del calore:
 Trasmissione del calore: - Conduzione - Convezione - Irraggiamento Cos è la Convezione: È lo scambio di calore che avviene tra una superficie e un fluido che si trovano a diversa temperatura e in movimento
Trasmissione del calore: - Conduzione - Convezione - Irraggiamento Cos è la Convezione: È lo scambio di calore che avviene tra una superficie e un fluido che si trovano a diversa temperatura e in movimento
La cinetica chimica. Velocità media di reazione
 La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
Lezione di Combustione
 Lezione di Combustione Introduzione Da un punto di vista chimico-fisico la combustione è un processo reattivo fortemente esotermico Generalmente le temperature in gioco sono particolarmente elevate e dipendono
Lezione di Combustione Introduzione Da un punto di vista chimico-fisico la combustione è un processo reattivo fortemente esotermico Generalmente le temperature in gioco sono particolarmente elevate e dipendono
SOLUZIONE DELL EQUAZIONE DI FOURIER PER PER PIASTRA SOTTILE CON SORGENTE TERMICA IN MOTO UNIFORME
 SOLUZIONE DELL EUAZIONE DI FOURIER PER PER PIASTRA SOTTILE CON SORGENTE TERMICA IN MOTO UNIFORME Luca Ghezzi May 2 Abstract L equazione del calore di Fourier è risolta analiticamente nel caso di un mezzo
SOLUZIONE DELL EUAZIONE DI FOURIER PER PER PIASTRA SOTTILE CON SORGENTE TERMICA IN MOTO UNIFORME Luca Ghezzi May 2 Abstract L equazione del calore di Fourier è risolta analiticamente nel caso di un mezzo
STATICA E DINAMICA DEI FLUIDI
 STATICA E DINAMICA DEI FLUIDI Pressione Principio di Pascal Legge di Stevino Spinta di Archimede Conservazione della portata Teorema di Bernoulli Legge di Hagen-Poiseuille Moto laminare e turbolento Stati
STATICA E DINAMICA DEI FLUIDI Pressione Principio di Pascal Legge di Stevino Spinta di Archimede Conservazione della portata Teorema di Bernoulli Legge di Hagen-Poiseuille Moto laminare e turbolento Stati
Stati di aggregazione della materia. dal microscopico al macroscopico: struttura. interazioni GASSOSO. proprietà SOLIDO LIQUIDO
 Stati di aggregazione della materia GASSOSO dal microscopico al macroscopico: struttura interazioni proprietà SOLIDO LIQUIDO Lo stato gassoso È uno dei tre stati di aggregazione della materia, caratterizzato
Stati di aggregazione della materia GASSOSO dal microscopico al macroscopico: struttura interazioni proprietà SOLIDO LIQUIDO Lo stato gassoso È uno dei tre stati di aggregazione della materia, caratterizzato
Interpretazione gas-cinetica delle reazioni termolecolari
 Interpretazione gas-cinetica delle reazioni termolecolari Una reazione termolecolare è del tipo: A + B + C P Le interpretazioni secondo la legge di azione di massa e secondo la legge empirica di Arrhenius
Interpretazione gas-cinetica delle reazioni termolecolari Una reazione termolecolare è del tipo: A + B + C P Le interpretazioni secondo la legge di azione di massa e secondo la legge empirica di Arrhenius
ESAME DI AERODINAMICA 16/4/2007
 ESAME DI AERODINAMICA 6/4/2007 Un ala a pianta ellittica e distribuzione ellittica di portanza ha allungamento 6 ed apertura alare 2 m. Quando si muove in aria alla velocità di 50 km/h e sviluppa un C
ESAME DI AERODINAMICA 6/4/2007 Un ala a pianta ellittica e distribuzione ellittica di portanza ha allungamento 6 ed apertura alare 2 m. Quando si muove in aria alla velocità di 50 km/h e sviluppa un C
Modi di Trasmissione del Calore
 Modi di Trasmissione del Calore Trasmissione del Calore - 1 La Trasmissione del calore, fra corpi diversi, o all interno di uno stesso corpo, può avvenire secondo 3 diverse modalità: - Conduzione - Convezione
Modi di Trasmissione del Calore Trasmissione del Calore - 1 La Trasmissione del calore, fra corpi diversi, o all interno di uno stesso corpo, può avvenire secondo 3 diverse modalità: - Conduzione - Convezione
Flussi Di Rayleigh. 1 Definizione del flusso di Rayleigh
 Flussi Di Rayleigh 1 Definizione del flusso di Rayleigh Il flusso di Rayleigh descrive molti casi di interesse pratico come i processi di combustione nelle camere di combustione o il moto di un fluido
Flussi Di Rayleigh 1 Definizione del flusso di Rayleigh Il flusso di Rayleigh descrive molti casi di interesse pratico come i processi di combustione nelle camere di combustione o il moto di un fluido
Esperimenti con i semiconduttori: caratteristica corrente-tensione di una batteria solare in funzione dell irraggiamento. Fondamenti teorici
 Esperimenti con i semiconduttori: caratteristica corrente-tensione di una batteria solare in funzione dell irraggiamento Fondamenti teorici Una cella solare è un fotodiodo con struttura appositamente disegnata
Esperimenti con i semiconduttori: caratteristica corrente-tensione di una batteria solare in funzione dell irraggiamento Fondamenti teorici Una cella solare è un fotodiodo con struttura appositamente disegnata
Verifica dei Concetti 18.1
 Verifica dei Concetti 18.1 Domanda: Se un materiale metallico viene raffreddato a partire dalla sua temperatura di fusione con velocità estremamente rapida, si formerà un solido non cristallino (un vetro
Verifica dei Concetti 18.1 Domanda: Se un materiale metallico viene raffreddato a partire dalla sua temperatura di fusione con velocità estremamente rapida, si formerà un solido non cristallino (un vetro
Ing. Enrica Cattaneo
 Ing. Enrica Cattaneo Università di Genova- Facoltà di Architettura INPS- DIREZIONE REGIONALE LIGURIA- CATE IMPIANTI AD ALTA EFFICIENZA ENERGETICA CALDAIA A CONDENSAZIONE 1 Sistemi di generazione La teoria
Ing. Enrica Cattaneo Università di Genova- Facoltà di Architettura INPS- DIREZIONE REGIONALE LIGURIA- CATE IMPIANTI AD ALTA EFFICIENZA ENERGETICA CALDAIA A CONDENSAZIONE 1 Sistemi di generazione La teoria
I gas. Le caratteristiche dei gas. La legge di Boyle
 I gas Le caratteristiche dei gas Lo stato aeriforme è definito come uno dei tre stati della materia. Lo stato aeriforme può essere costituito da vapore o da gas. Un vapore è diverso da un gas in quanto
I gas Le caratteristiche dei gas Lo stato aeriforme è definito come uno dei tre stati della materia. Lo stato aeriforme può essere costituito da vapore o da gas. Un vapore è diverso da un gas in quanto
Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali
 Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali Corso di Laurea in Chimica A.A. 2011/12 Test di autovalutazione 3 ottobre 2011 Cognome: Nome: Matematica e logica 1.
Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali Corso di Laurea in Chimica A.A. 2011/12 Test di autovalutazione 3 ottobre 2011 Cognome: Nome: Matematica e logica 1.
a) compressione adiabatica fino alla pressione p 2 = kg/cm 2 ;
 PROBLEMI I primi tre problemi sono tratti dal libro P. Fleury, J.P. Mathieu, Esercizi di Fisica, Zanichelli (Bologna, 1970) che contiene i testi e le relative soluzioni, indicati dal loro numero e pagina
PROBLEMI I primi tre problemi sono tratti dal libro P. Fleury, J.P. Mathieu, Esercizi di Fisica, Zanichelli (Bologna, 1970) che contiene i testi e le relative soluzioni, indicati dal loro numero e pagina
Flussi Di Fanno. 1 Definizione del flusso di Fanno
 Flussi Di Fanno 1 Definizione del flusso di Fanno Si consideri un flusso adiabatico all interno di un condotto a sezione costante, in presenza di attrito e senza scambio di lavoro con l esterno. Tale regime
Flussi Di Fanno 1 Definizione del flusso di Fanno Si consideri un flusso adiabatico all interno di un condotto a sezione costante, in presenza di attrito e senza scambio di lavoro con l esterno. Tale regime
Prova A. Problema 2 Nel piano xy è presente una distribuzione ρ piana di correnti:
 Prova A Problema Un sottile tubo può ruotare intorno al suo centro su un tavolo orizzontale liscio. Il tubo contiene una sbarretta della stessa lunghezza e della stessa massa del tubo il cui centro di
Prova A Problema Un sottile tubo può ruotare intorno al suo centro su un tavolo orizzontale liscio. Il tubo contiene una sbarretta della stessa lunghezza e della stessa massa del tubo il cui centro di
Gli Incendi Boschivi. Tecniche Antincendio Boschivo La combustione dei materiali. Realizzato e curato dal. Relatore: Sovrintendente Innocenti Maurizio
 Gli Incendi Boschivi Tecniche Antincendio Boschivo La combustione dei materiali Relatore: Sovrintendente Innocenti Maurizio Realizzato e curato dal Centro Operativo AIB per la Lombardia Curno (BG) 24035
Gli Incendi Boschivi Tecniche Antincendio Boschivo La combustione dei materiali Relatore: Sovrintendente Innocenti Maurizio Realizzato e curato dal Centro Operativo AIB per la Lombardia Curno (BG) 24035
Cavo Carbonio. Sergio Rubio Carles Paul Albert Monte
 Cavo o Sergio Rubio Carles Paul Albert Monte o, Rame e Manganina PROPRIETÀ FISICHE PROPRIETÀ DEL CARBONIO Proprietà fisiche del o o Coefficiente di Temperatura α o -0,0005 ºC -1 o Densità D o 2260 kg/m
Cavo o Sergio Rubio Carles Paul Albert Monte o, Rame e Manganina PROPRIETÀ FISICHE PROPRIETÀ DEL CARBONIO Proprietà fisiche del o o Coefficiente di Temperatura α o -0,0005 ºC -1 o Densità D o 2260 kg/m
Equilibrio chimico. Equilibri dinamici Legge azione di massa, Kc, Kp, Equilibri eterogenei Principio di Le Chatelier
 Equilibrio chimico Equilibri dinamici Legge azione di massa, Kc, Kp, Equilibri eterogenei Principio di Le Chatelier Data la reazione generica: A + B C Seguendo nel tempo le variazioni di concentrazione
Equilibrio chimico Equilibri dinamici Legge azione di massa, Kc, Kp, Equilibri eterogenei Principio di Le Chatelier Data la reazione generica: A + B C Seguendo nel tempo le variazioni di concentrazione
Statica ed equilibrio dei corpi
 Statica ed equilibrio dei corpi Avendo stabilito le leggi che regolano il moto dei corpi è possibile dedurre le leggi che regolano il loro equilibrio in condizioni statiche, cioè in assenza di movimento.
Statica ed equilibrio dei corpi Avendo stabilito le leggi che regolano il moto dei corpi è possibile dedurre le leggi che regolano il loro equilibrio in condizioni statiche, cioè in assenza di movimento.
delle curve isoterme dell anidride carbonica
 COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
Meccanica dei fluidi
 Programma Parte I Meccanica dei Fluidi Proprietà generali dei Fluidi; Il Principio di Pascal; La legge di Stevino per i liquidi pesanti; Il Principio di Archimede; Il moto dei fluidi; Legge di Bernoulli;
Programma Parte I Meccanica dei Fluidi Proprietà generali dei Fluidi; Il Principio di Pascal; La legge di Stevino per i liquidi pesanti; Il Principio di Archimede; Il moto dei fluidi; Legge di Bernoulli;
La lezione di oggi. I fluidi reali La viscosità Flussi laminare e turbolento. La resistenza idrodinamica
 1 La lezione di oggi I fluidi reali La viscosità Flussi laminare e turbolento La resistenza idrodinamica 2 La lezione di oggi Forze di trascinamento nei fluidi La legge di Stokes La centrifuga 3 ! Viscosità!
1 La lezione di oggi I fluidi reali La viscosità Flussi laminare e turbolento La resistenza idrodinamica 2 La lezione di oggi Forze di trascinamento nei fluidi La legge di Stokes La centrifuga 3 ! Viscosità!
Perdite di energia per frizione di sali fusi ad alta temperatura
 Perdite di energia per frizione di sali fusi ad alta temperatura Erminia Leonardi 3/1/ Le perdite di energia per frizione in un fluido sono in generale una funzione complessa della geometria del sistema,
Perdite di energia per frizione di sali fusi ad alta temperatura Erminia Leonardi 3/1/ Le perdite di energia per frizione in un fluido sono in generale una funzione complessa della geometria del sistema,
Lo stato gassoso gas. Caratteristiche dello stato gassoso. liquido. solido. assenza di volume proprio forma fluida
 Lo stato gassoso gas liquido solido assenza di volume proprio forma fluida Caratteristiche dello stato gassoso Capacità di occupare tutto lo spazio a disposizione Distanze molto grandi tra le particelle
Lo stato gassoso gas liquido solido assenza di volume proprio forma fluida Caratteristiche dello stato gassoso Capacità di occupare tutto lo spazio a disposizione Distanze molto grandi tra le particelle
ESAME DI AERODINAMICA 12/12/2006
 ESAME DI AERODINAMICA 12/12/2006 La velocità indotta nel piano y-z passante per l origine da un filamento vorticoso rettilineo semi-infinito disposto lungo l asse x e con origine in x=0, rispetto a quella
ESAME DI AERODINAMICA 12/12/2006 La velocità indotta nel piano y-z passante per l origine da un filamento vorticoso rettilineo semi-infinito disposto lungo l asse x e con origine in x=0, rispetto a quella
Equilibri e Principio di Le Chatelier
 Equilibri e Principio di Le Chatelier Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY
Equilibri e Principio di Le Chatelier Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY
ESERCIZI ESERCIZI. 1) Il valore della costante di equilibrio K p. 4) Per la reazione di equilibrio: CO (g) + 1/2 O 2 (g) è CO 2 (g) p CO2 a.
 1) Il valore della costante di equilibrio K p dipende: a. dalle pressioni parziali all equilibrio di reagenti e prodotti b. dalla composizione all equilibrio del sistema di reazione c. dalla pressione
1) Il valore della costante di equilibrio K p dipende: a. dalle pressioni parziali all equilibrio di reagenti e prodotti b. dalla composizione all equilibrio del sistema di reazione c. dalla pressione
Retta Tangente. y retta tangente. retta secante y = f(x) f(x )
 Retta Tangente f(x ) 1 y P 1 retta secante y = f(x) y retta tangente y = f(x) f(x ) 0 P 0 f(x ) 0 P 0 O x 0 x 1 x quando P tende a P 0 1 O x 0 x Consideriamo una funzione continua f. Siano P 0 = (x 0,
Retta Tangente f(x ) 1 y P 1 retta secante y = f(x) y retta tangente y = f(x) f(x ) 0 P 0 f(x ) 0 P 0 O x 0 x 1 x quando P tende a P 0 1 O x 0 x Consideriamo una funzione continua f. Siano P 0 = (x 0,
Esercizi sui Gas. Insegnamento di Chimica Generale CCS CHI e MAT
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/ Esercizio 1 Un
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/ Esercizio 1 Un
Scuola Galileiana di Studi Superiori Anno 2018/2019 Prova di Chimica
 Scuola Galileiana di Studi Superiori Anno 2018/2019 Prova di Chimica 1. Una soluzione contiene 0.1 mol/l di ammoniaca (pk b = 4.75) e 0.2 mol/l di metilammina (pk b = 3.26). Quanti ml di HCl 0.1 M si devono
Scuola Galileiana di Studi Superiori Anno 2018/2019 Prova di Chimica 1. Una soluzione contiene 0.1 mol/l di ammoniaca (pk b = 4.75) e 0.2 mol/l di metilammina (pk b = 3.26). Quanti ml di HCl 0.1 M si devono
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
Esercizi sui Gas. Insegnamento di Chimica Generale CCS CHI e MAT. A.A. 2015/2016 (I Semestre)
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio 1 Un campione
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio 1 Un campione
energia Cos è? è un lavoro.
 energia Cos è?! L energia NON si vede, NON si tocca, ma è qualcosa che è dentro, all interno della materia stessa e la rende capace di compiere un lavoro.! ENERGIA E LA CAPACITA' DI UN CORPO O DI UN SISTEMA
energia Cos è?! L energia NON si vede, NON si tocca, ma è qualcosa che è dentro, all interno della materia stessa e la rende capace di compiere un lavoro.! ENERGIA E LA CAPACITA' DI UN CORPO O DI UN SISTEMA
CO 2 NO 2 SO 2 CH 4. He Ne Ar H 2 N 2 O 2 Cl 2
 Lo stato gassoso I gas sono materiali caratterizzati dalla mancanza di forma e volume propri. Assumono la forma ed il volume del recipiente che li contiene e sono facilmente comprimibili. Le sostanze gassose
Lo stato gassoso I gas sono materiali caratterizzati dalla mancanza di forma e volume propri. Assumono la forma ed il volume del recipiente che li contiene e sono facilmente comprimibili. Le sostanze gassose
Cinetica chimica. Cinetica chimica
 REAZIONI GLOBALI ED ELEMENTARI: Le reazioni chimiche avvengono quando le molecole di una specie collidono con le molecole di un altra specie e, per effetto di alcune di queste collisioni si formano una
REAZIONI GLOBALI ED ELEMENTARI: Le reazioni chimiche avvengono quando le molecole di una specie collidono con le molecole di un altra specie e, per effetto di alcune di queste collisioni si formano una
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Le soluzioni e il loro comportamento
 2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
2017 Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli soluto / volume soluzione MOLALITA (m) moli soluto
Sussidi didattici per il corso di PROGETTAZIONE, COSTRUZIONI E IMPIANTI. Prof. Ing. Francesco Zanghì ELEMENTI DI IDRAULICA AGGIORNAMENTO 26/11/2013
 Sussidi didattici per il corso di PROGETTAZIONE, COSTRUZIONI E IMPIANTI Prof. Ing. Francesco Zanghì ELEMENTI DI IDRAULICA AGGIORNAMENTO 26/11/2013 L'idraulica è la scienza che studia l'utilizzazione dei
Sussidi didattici per il corso di PROGETTAZIONE, COSTRUZIONI E IMPIANTI Prof. Ing. Francesco Zanghì ELEMENTI DI IDRAULICA AGGIORNAMENTO 26/11/2013 L'idraulica è la scienza che studia l'utilizzazione dei
Atmosfera terrestre ...
 L atmosfera terrestre si comporta, in prima approssimazione, esattamente come un FILTRO che si interpone tra un sistema ottico con rivelatore e una sorgente celeste. In pratica uno strato di un dielettrico
L atmosfera terrestre si comporta, in prima approssimazione, esattamente come un FILTRO che si interpone tra un sistema ottico con rivelatore e una sorgente celeste. In pratica uno strato di un dielettrico
Transizioni liquido-solido: Aspetti cinetici
 Transizioni liquido-solido: Aspetti cinetici Prof.G.Marletta Chimica Fisica dei Materiali II e Laboratorio Laurea Magistrale in Chimica dei Materiali Università di Catania A.A. 2011/2012 1- Caratteri generali
Transizioni liquido-solido: Aspetti cinetici Prof.G.Marletta Chimica Fisica dei Materiali II e Laboratorio Laurea Magistrale in Chimica dei Materiali Università di Catania A.A. 2011/2012 1- Caratteri generali
L irraggiamento termico
 L irraggiamento termico Trasmissione del Calore - 42 Il calore può essere fornito anche mediante energia elettromagnetica; ciò accade perché quando un fotone, associato ad una lunghezza d onda compresa
L irraggiamento termico Trasmissione del Calore - 42 Il calore può essere fornito anche mediante energia elettromagnetica; ciò accade perché quando un fotone, associato ad una lunghezza d onda compresa
2. CALCOLO DELL'ANIDRIDE CARBONICA NEI GAS DI SCARICO
 2. CALCOLO DELL'ANIDRIDE CARBONICA NEI GAS DI SCARICO E' noto che la combustione di un combustibile fossile produce anidride carbonica (CO 2 ), rinvenibile dunque nei prodotti della combustione. Nella
2. CALCOLO DELL'ANIDRIDE CARBONICA NEI GAS DI SCARICO E' noto che la combustione di un combustibile fossile produce anidride carbonica (CO 2 ), rinvenibile dunque nei prodotti della combustione. Nella
ECONOMIA APPLICATA ALL INGEGNERIA (Docente: Prof. Ing. Donato Morea)
 ESERCIZIO n. 1 - Scelte di consumo (scelta ottimale, variazione di prezzo, variazione di reddito) Un consumatore ha preferenze rappresentate dalla seguente funzione di utilità: a) Determinare la scelta
ESERCIZIO n. 1 - Scelte di consumo (scelta ottimale, variazione di prezzo, variazione di reddito) Un consumatore ha preferenze rappresentate dalla seguente funzione di utilità: a) Determinare la scelta
Esame di Chimica Generale 19 Febbraio 2013
 Esame di Chimica Generale 19 Febbraio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 19 Febbraio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
MECCANICA DEI FLUIDI
 MECCANICA DEI FLUIDI Un fluido è un corpo che non ha una forma propria. La sua forma dipende da altri corpi che lo contengono (per esempio un recipiente, una condotta, ). Un fluido è composto da molte
MECCANICA DEI FLUIDI Un fluido è un corpo che non ha una forma propria. La sua forma dipende da altri corpi che lo contengono (per esempio un recipiente, una condotta, ). Un fluido è composto da molte
In condizioni di equilibrio energetico questo è bilanciato dal trasporto totale (W) di energia verso il polo Nord F φ AO.
 Trasporto meridionale di energia Se R TOA λ, φ è il flusso radiativo netto (W/m 2 ) alla sommità dell atmosfera, allora in un settore di lato dφdλ assorbe una potenza netta (W) pari a R TOA λ, φ a 2 cos
Trasporto meridionale di energia Se R TOA λ, φ è il flusso radiativo netto (W/m 2 ) alla sommità dell atmosfera, allora in un settore di lato dφdλ assorbe una potenza netta (W) pari a R TOA λ, φ a 2 cos
 EQUILIBRI ACIDO-BASE Trattamento grafico Diagrammi Logaritmici Costruzione della matrice comune a tutti i diagrammi logaritmici: Per definizione, log [H 3 O + ] = ph e log [OH ] = ph 14, per cui log [H
EQUILIBRI ACIDO-BASE Trattamento grafico Diagrammi Logaritmici Costruzione della matrice comune a tutti i diagrammi logaritmici: Per definizione, log [H 3 O + ] = ph e log [OH ] = ph 14, per cui log [H
Perché un aereo vola? Prof. G. Graziani Dipartimento Ingegneria Meccanica e Aerospaziale Sapienza Università di Roma
 Perché un aereo vola? Prof. G. Graziani Dipartimento Ingegneria Meccanica e Aerospaziale Sapienza Università di Roma Domanda: Perché un aeroplano dal peso di molte tonnellate riesce a volare? Ø L aerodinamica
Perché un aereo vola? Prof. G. Graziani Dipartimento Ingegneria Meccanica e Aerospaziale Sapienza Università di Roma Domanda: Perché un aeroplano dal peso di molte tonnellate riesce a volare? Ø L aerodinamica
ESAME DI AERODINAMICA 16/4/2007
 ESAME DI AERODINAMICA 6/4/2007 Un ala a pianta ellittica e distribuzione ellittica di portanza ha allungamento 6 ed apertura alare 2 m. Quando si muove in aria alla velocità di 50 km/h e sviluppa un C
ESAME DI AERODINAMICA 6/4/2007 Un ala a pianta ellittica e distribuzione ellittica di portanza ha allungamento 6 ed apertura alare 2 m. Quando si muove in aria alla velocità di 50 km/h e sviluppa un C
La costante di equilibrio di una reazione chimica è un parametro molto utile:
 La costante di equilibrio di una reazione chimica è un parametro molto utile: se il rapporto tra le concentrazioni dei prodotti e dei reagenti corrisponde al valore della costante di equilibrio, il sistema
La costante di equilibrio di una reazione chimica è un parametro molto utile: se il rapporto tra le concentrazioni dei prodotti e dei reagenti corrisponde al valore della costante di equilibrio, il sistema
Nuovo Codice D.M. 3/08/2015: L analisi del rischio incendio Ing. Paolo Persico
 Nuovo Codice D.M. 3/08/2015: L analisi del rischio incendio Ing. Paolo Persico Cagliari, 14 febbraio 2018 Il nuovo codice mette in relazione in modo diretto ed esplicito Incendio Occupanti R vita = f (δ
Nuovo Codice D.M. 3/08/2015: L analisi del rischio incendio Ing. Paolo Persico Cagliari, 14 febbraio 2018 Il nuovo codice mette in relazione in modo diretto ed esplicito Incendio Occupanti R vita = f (δ
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
PER ESERCITARSI Parte 2. Esercizi su Corpo rigido, variabili angolari, momenti, fluidi, termodinamica
 PER ESERCITARSI Parte 2 Esercizi su Corpo rigido, variabili angolari, momenti, fluidi, termodinamica ESERCIZIO n.1 Due forze uguali ed opposte sono applicate ad un oggetto lungo rette di azione tra loro
PER ESERCITARSI Parte 2 Esercizi su Corpo rigido, variabili angolari, momenti, fluidi, termodinamica ESERCIZIO n.1 Due forze uguali ed opposte sono applicate ad un oggetto lungo rette di azione tra loro
Docente: Alessandro Melchiorri Slides delle lezioni: oberon.roma1.infn.it/alessandro/astro2014
 Astronomia Lezione 11/12/2014 Docente: Alessandro Melchiorri e.mail:alessandro.melchiorri@roma1.infn.it Slides delle lezioni: oberon.roma1.infn.it/alessandro/astro2014 Quali sono i processi nucleari? Nucleosintesi:
Astronomia Lezione 11/12/2014 Docente: Alessandro Melchiorri e.mail:alessandro.melchiorri@roma1.infn.it Slides delle lezioni: oberon.roma1.infn.it/alessandro/astro2014 Quali sono i processi nucleari? Nucleosintesi:
