Esprime l attitudine di un atomo ad attrarre verso di sé gli elettroni; è correlata all energia di ionizzazione e all affinità elettronica.
|
|
|
- Benedetta Costantino
- 6 anni fa
- Visualizzazioni
Transcript
1 ELETTRONEGATIVITA
2 Esprime l attitudine di un atomo ad attrarre verso di sé gli elettroni; è correlata all energia di ionizzazione e all affinità elettronica. Differenza di elettronegatività Tipo di legame >2 ev Ionico >0 e <2 ev Covalente polarizzato 0 Covalente puro
3 IL LEGAME CHIMICO Esistono diversi tipi di legame chimico: 1) IONICO 2) COVALENTE a) PURO o OMEOPOLARE o OMOPOLARE b) POLARE c) DATIVO 3) METALLICO 4) A IDROGENO ( ponte-idrogeno ) 5) DEBOLE (forze di Van der Waals)
4 Perché gli elementi reagiscono fra loro? Energia di ionizzazione: energia necessaria per allontanare un elettrone da un elemento : Primaria Secondaria Affinità elettronica: energia che si libera quando viene aggiunto un elettrone ad un atomo neutro X + e- X- Es. Cl, O M M + + e - Es. Na, Ca, Al
5 Na tende a cedere un elettrone formando Na + Cl tende ad acquistare un elettrone formando Cl - Na + Cl NaCl (cloruro di sodio) deriva dall attrazione fra cariche di segno opposto SOLIDI IONICI: formano un reticolo cristallino stabilizzato da interazioni elettrostatiche, duri, ottimi conduttori di elettricità Mg tende a cedere due elettroni formando Mg 2+ F tende ad acquistare un elettrone formando F- MgF 2 (fluoruro di magnesio)
6 0 < elettronegatività > 2 Molecole Il legame covalente si instaura grazie alla condivisione di una coppia di elettroni. H H H H (H 2 ) Cl + Cl Cl Cl Cl 2 O O O 2 Legame covalente puro N N N 2 H 2, N 2, O 2, F 2, Cl 2, Br 2, I 2 Molecole biatomiche
7 ORBITALI E LEGAMI Il legame chimico fra due elementi presuppone di collocare i due elettroni di legame tra i 2 atomi, ma non è possibile descrivere esattamente la posizione degli elettroni, ma si può prevedere solo la probabilità di trovarlo in una data regione dello spazio associata a un orbitale MOLECOLARE. 1 esempio: H 2 Teoria del legame di valenza sovrapposizione di orbitali atomici Orbitale molecolare = somma di orbitali atomici
8 2 esempio: HF il legame s può essere formato dall appaiamento degli elettroni di due orbitali s, come in H 2, di un orbitale s con un orbitale p, come in HF, o di due orbitali p, come la molecola biatomica degli alogeni
9 3 esempio: N 2 OK per un elettrone, ma gli altri 2???
10 Gli altri elettroni appaiarsi solo lateralmente, formando un legame p, con gli elettroni distribuiti entro i lobi, con unica densità elettronica, mentre la nube ha la forma di 2 lobi. dunque:
11 Esempi di legame singolo (σ), doppio (σ + π), triplo (σ + 2π)
12 ESEMPI 1 legame 2 legame 1s 1s s H 2 2p 2p s O 2 2p 2 p p O 2 N 2 legame triplo (uno s e due p) H 2 O due legami s entrambi 1s-2p 1s-2p
13 FORMA DELLE MOLECOLE: cenni La forma di una molecola si ottiene unendo con linee rette i nuclei degli atomi legati fra loro. Per definire la forma si deve tenere conto del fatto che gli elettroni dello strato esterno si respingono e si localizzano alla massima distanza l uno dall altro. Inoltre, la repulsione fra coppie di elettroni non condivisi è maggiore di quella fra una coppia non condivisa e una impegnata in un legame, che a sua volta è maggiore di quella fra due coppie impegnate in un legame. Le molecole biatomiche sono lineari Le molecole poliatomiche sono generalmente tridimensionali ma anche lineari (CO 2 ) o planari (BF 3 ). H 2 O sembra planare ma ha doppietti non condivisi che la fanno essere tetraedrica.
14 N di legami covalenti Forma Angoli di legame Esempio 2 Lineare 180 Anidride carbonica (CO 2 ) 3 Trigonale planare 120 Trifluoruro di boro (BF 3 ) 4 Tetraedrica 109 Metano (CH 4 ) 5 Bipiramide trigonale Pentacloruro di fosforo (PCl 5 ) 6 Ottaedrica 90 Esafluoruro di zolfo (SF 6 ) FORMA DELLE MOLECOLE
15 M O L E C O L E Esempio: H Cl Legame covalente POLARIZZATO P O L A R I Baricentro delle cariche + NON corrisponde a baricentro delle cariche DIPOLO: Grandezza vettoriale che possiede perciò MODULO, DIREZIONE e VERSO
16 Una MOLECOLA con UN legame POLARIZZATO E SICURAMENTE POLARE!! Es. :HCl, HF Una molecola con n > 1 legami POLARIZZATI può essere POLARE o APOLARE, a seconda della RISULTANTE delle diverse COMPONENTI del MOMENTO DIPOLARE! Esempi: Formalismo di LEWIS: il doppietto non condiviso viene rappresentato con un trattino
17 L E G A M E a I D R O G E N O IMPORTANTISSIMO!! E un particolare legame che infonde una forza di coesione supplementare: questa forza rende i composti che l IDROGENO (H) forma con gli elementi del gruppo VA, VIA, e VIIA (cioè N, O, ed F) molto più ALTOBOLLENTI del previsto. Infatti per tutti i CONGENERI del gruppo si ha che la T di ebollizione (Teb.) cresce con il Peso Molecolare, quindi con NH 3, H 2 O e HF si dovrebbe avere la più bassa Teb. del gruppo. Invece NON E COSI!!
18 Cloro, un gas Bromo, liquido Iodio, solido A temperatura ambiente e a pressione atmosferica, elementi diversi si trovano in stati di aggregazione diversi Forze di coesione Energia cinetica Energia cinetica Stato solido Stato liquido Stato gassoso Forze di coesione
19
20 L E G A M E a I D R O G E N O effetti macroscopici
21 ELETTRONEGATIVITA
22 NH 3, H 2 O, HF L essere più ALTOBOLLENTI del previsto è legato al fatto che N, O, ed F sono molto più elettronegativi di H e quindi i legami H-N, H-O, H-F, sono molto polari, e H risulta quasi come H+. Il quasi-protone H + attira la nuvola elettronica degli atomi N, O, F di molecole adiacenti per cui si instaura una sorta di legame a 3 che si può propagare lungo la struttura macroscopica della sostanza (vedi acqua e ghiaccio). Questo legame implica sempre la presenza di IDROGENO, che fa da PONTE tra due atomi PIU ELETTRONEGATIVI e perciò viene denominato LEGAME o PONTE a IDROGENO (ponte-h)
23 PONTE a IDROGENO (ponte H) Ha un basso valore energetico, che oscilla tra 10 e 40 kj/mole, ma sufficiente a CONFERIRE importantissime PROPRIETA STRUTTURALI e FUNZIONALI alla molecola che lo possiede. Può essere INTRAMOLECOLARE (proteine) o INTERMOLECOLARE (acqua, ghiaccio)
24 LEGAME a IDROGENO o ponte-h È un tipo particolare di legame intermolecolare che si stabilisce fra l atomo di idrogeno che partecipa ad un legame polare e l atomo elettronegativo di una molecola contigua. È il più forte fra i legami di natura dipolare. È molto importante nelle molecole in cui l idrogeno è legato ad azoto, ossigeno o fluoro, in particolare H 2 O e macromolecole biologiche come DNA e proteine. Atomo donatore H O H H O H Legame idrogeno Atomo accettore Struttura dell acqua
25 H 2 O ponti-h (4) INTER-MOLECOLARI -elica PROTEINE ponti-h INTRA-MOLECOLARI le conferiscono la struttura SECONDARIA foglietto
26 Perché il ghiaccio galleggia sull acqua? Il ghiaccio è meno denso dell acqua a causa dello stabilirsi del legame idrogeno fra le molecole d acqua a formare una struttura ordinata
27 QUIZ Il legame chimico; indicare l unica frase corretta: A. il legame singolo tra due atomi può essere sia di tipo sigma (σ) che pi-greco (π) B. un legame a idrogeno è sempre più debole di un legame covalente C. un legame triplo è formato da un legame σ ed due legami π D. un legame doppio è formato da un legame σ ed un legame ionico Per legame ionico di intende la forza di attrazione: A. tra gli atomi negli elementi B. tra gli elettroni e i protoni in qualsiasi atomo C. tra gli ioni dello stesso elemento D. tra ioni di segno opposto nei composti Cl-Cl rappresenta la molecola biatomica di cloro; il legame che la caratterizza è: A. Covalente puro B. Ionico C. Covalente polare D. A Idrogeno
28 Forze intramolecolari Legame covalente Legame ionico Legame dativo puro polarizzato LEGAMI Forze intermolecolari Interazione ione-ione Interazione ione-dipolo Interazione dipolo-dipolo Interazione ione-dipolo indotto Forze di dispersione di London Legame idrogeno
29 Vapore acqueo Acqua di lago Neve, ghiaccio Stessa composizione chimica (H 2 O) Diverse proprietà fisiche Forze di coesione intermolecolari
30 STECHIOMETRIA - LA MOLE 1 MOLE (1 mol) è l unità di misura utile a conteggiare GRANDI numeri di atomi, ioni, e molecole. 1 MOLE = numero degli atomi presenti in 12 g esatti di 12 C La mole, pur riferendosi agli atomi di carbonio, vale come unità di misura per tutte le specie chimiche. E una grandezza adimesionale e rappresenta sempre lo stesso numero (di atomi, ioni, molecole). 1 MOLE = 12 g 12 u.m.a. (g) = 12 g 12 x 1.66 x g = 6.023x particelle (di 12 C) 1 MOLE Cl 2 = g 2 x x 1.66 x g = x molecole di Cl 2 1 mole significa sempre x entità, o oggetti. Questo numero viene chiamato Numero di Avogadro, N A
31 RIASSUMENDO Massa, proprietà estensiva, si misura in grammi, g n di moli, n = g / P.A. o g / P.M. Concentrazione : prop. intensiva che lega due proprietà estensive, massa e volume Concentrazione = g / Vol oppure n / Vol Molarità = n / litro
32 Le soluzioni sono miscele in cui una sostanza (il soluto) è disciolto in un altra sostanza (il solvente) Soluto Solvente Esempio Gas Gas Aria Gas Liquido Acqua gasata Liquido Liquido Vino Solido Liquido Acqua salata Solido Solido Ottone
33 H 2 + O 2 H 2 O Reagenti: 2 atomi di H 2 atomi di O Prodotti: 2 atomi di H 1 atomo di O H 2 + O 2 2H 2 O Reagenti: 2 atomi di H 2 atomi di O Prodotti: 4 atomi di H 2 atomi di O 2H 2 + O 2 2H 2 O Bilanciamo prima O e poi H ESEMPI BILANCIAMENTO EQUAZIONI CHIMICHE CH 4 + O 2 CO 2 + H 2 O Reagenti : 1 atomo di C 4 atomi di H 2 atomi di O Prodotti: 1 atomo di C 2 atomi di H 3 atomi di O CH 4 + O 2 CO 2 + 2H 2 O Reagenti : 1 atomo di C 4 atomi di H 2 atomi di O Prodotti: 1 atomo di C 4 atomi di H 4 atomi di O CH 4 + 2O 2 CO 2 + 2H 2 O Bilanciamo prima H e poi O I coefficienti stechiometrici indicano QUANTE molecole partecipano alla reazione
34 Qual è la massa di una mole di CO 2? 1 C = 12 g/mole 2 O = 2 16 = 32 g/mole 1 mole CO 2 = = 44 g Quante moli sono presenti in 27 g di H 2 O? 2 H = = 2.0 g/mole 1 O = 16 = 16 g/mole 1 mole H 2 O = 18 g 27 g / 18 g = 1.5 moli 2 H 2 + O 2 2 H 2 O 2 molecole di H molecola di O 2 2 molecole di H 2 O 2 moli di H mole di O 2 2 moli di H 2 O
35 ESERCIZI Quante moli di NH 3 ci sono in un campione di g? (P.M. 17) moli, cioè n = g/pm Quale massa in grammi dovrebbe essere pesata per un esperimento che richiede 1.24 moli di H 2 O 2? (P.M. 34) g, cioè g = n x PM
36 Parte della chimica che studia le variazioni energetiche che accompagnano tutti i processi chimici L energia può esistere in varie forme: energia termica, potenziale, cinetica, chimica Prima legge della termodinamica in un sistema isolato l energia può essere convertita da una forma all altra ma non può essere distrutta La quantità complessiva di energia e materia presente nell universo è costante Lo STATO TERMODINAMICO di un sistema è definito da un insieme di proprietà note come FUNZIONI DI STATO il cui valore dipende soltanto dallo stato del sistema e non dal percorso mediante il quale esso è stato raggiunto (Es. P, V, T). Variazione di un una funzione di stato X ΔX = X f X i Se X aumenta ΔX è positivo, se X diminuisce ΔX è negativo
37 Equazioni termochimiche C 2 H 5 OH (l) + 3O 2 (g) 2CO 2 (g) + 3H 2 O(l) ΔH = kj 2CO 2 (g) + 3H 2 O(l) C 2 H 5 OH (l) + 3O 2 (g) ΔH = kj I coefficienti stechiometrici indicano le moli di reagenti e prodotti Il ΔH è per mole di reazione La reazione di combustione dell etanolo è esotermica La reazione inversa è endotermica La variazione standard di entalpia ΔH 0 per una reazione rappresenta il valore di ΔH quando il numero di moli indicato dei reagenti, tutti nel loro stato standard (1 atm, 298K), si trasforma completamente nel numero di moli indicato dei prodotti, anche questi tutti nel loro stato standard. Stato standard: forma pura più stabile alla pressione di 1 atm, a 298K e, per le soluzioni, alla concentrazione di 1M.
38 LEGGE DI HESS: la variazione di entalpia, ΔH, di una reazione è indipendente dal percorso attraverso cui la reazione avviene Tale legge permette di calcolare le variazioni di entalpia per reazioni per le quali sarebbe difficile misurare il valore sperimentale. ESEMPIO C (grafite) + ½O 2 (g) CO(g) ΔH reaz =? C (grafite) + O 2 (g) CO 2 (g) ΔH reaz = kj/mol CO(g) + ½O 2 (g) CO 2 (g) ΔH reaz = -283 kj/mol C (grafite) + O 2 (g) CO 2 (g) ΔH reaz = kj/mol CO 2 (g) CO(g) + ½O 2 (g) ΔH reaz = +283 kj/mol C(grafite) + ½O 2 (g) CO(g) ΔH reaz = kj/mol
39 Che cosa mi dice se una reazione avverrà spontaneamente o no? Una reazione chimica è spontanea quando avviene senza che ci sia alcuna influenza esterna. Ciò si verifica quando i prodotti della reazione sono termodinamicamente più stabili dei reagenti Reazione spontanea Reazione non spontanea Molte reazioni spontanee liberano energia sotto forma di calore ma non tutte le reazioni esotermiche sono spontanee perché c è un altro fattore che gioca un ruolo fondamentale nel determinare la spontaneità di una reazione: l ENTROPIA!
40 SECONDO PRINCIPIO DELLA TERMODINAMICA Qualunque processo spontaneo si accompagna ad un incremento dell ENTROPIA (S) dell universo. S universo = S ambiente + S sistema > 0 L entropia è una grandezza termodinamica che esprime il grado di disordine di un sistema. La variazione di entropia che accompagna una trasformazione chimica è pari a: S = q / T dove q è il calore assorbito dal sistema per aumentare il disordine q = T S Se l entropia di un sistema aumenta durante una trasformazione chimica, la spontaneità del processo è favorita ma non assicurata. Infatti è l entropia dell universo che aumenta durante un processo spontaneo. Es. congelamento dell acqua La variazione di entropia standard di una reazione può essere determinata dalle entropie assolute dei reagenti e dei prodotti
41 H < O S > O
42 G = H - T S L energia libera di Gibbs è la grandezza termodinamica che indica la spontaneità di una reazione. Qualunque processo che si svolge spontaneamente porta ad una diminuzione dell energia libera ( G < 0) G < 0 la reazione avviene spontaneamente (reazione esoergonica) G = 0 la miscela di reazione è all equilibrio (non avviene alcuna reazione) G > 0 la reazione non avviene spontaneamente ma è necessario fornire energia (reazione endoergonica)
43 G = H - T S G = - R T ln Keq H < 0 S > 0 Spontanea a ogni temperatura H > 0 S > 0 Spontanea ad alta temperatura H < 0 S < 0 Spontanea a bassa temperatura Esotermica H > 0 S < 0 Mai spontanea Endotermica
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2
 ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
ESERCIZI PREPARATORI PER IL COMPITO DI CHIMICA MODULO 2 69 Il blocco s delle Tavola periodica è costituito dai seguenti elementi a) metalli di transizione b) metalli alcalini c) alogeni d) metalli alcalini
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Legame chimico e proprietà delle sostanze
 I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
I solidi hanno volume e forma propria. Stati di aggregazione della materia stato solido stato liquido stato gassoso Il loro volume dipende da temperatura e pressione e in generale aumenta leggermente all
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
ESEMPI DI QUIZ sulle precedenti lezioni
 ESEMPI DI QUIZ sulle precedenti lezioni I numeri quantici sono: A.2 B.5 C.6 D.4 Il numero di neutroni è pari a: A.Il numero di protoni B.Il numero di elettroni C.Il numero di nuclei D.La differenza fra
ESEMPI DI QUIZ sulle precedenti lezioni I numeri quantici sono: A.2 B.5 C.6 D.4 Il numero di neutroni è pari a: A.Il numero di protoni B.Il numero di elettroni C.Il numero di nuclei D.La differenza fra
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame.
 Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Il legame dativo o coordinativo: lo stesso atomo fornisce i due elettroni di legame. Non necessariamente i due elettroni che concorrono alla formazione del legame devono provenire da entrambi gli atomi
Elettronegatività Elettronegatività
 Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A Prova scritta del corso di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2012-2013 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2012-2013 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
Dinamica delle reazioni chimiche (attenzione: mancano i disegni)
 Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
LEGAMI INTERMOLECOLARI LEGAMI INTERMOLECOLARI
 I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
FORZE INTERMOLECOLARI o LEGAMI DEBOLI
 FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
FRZE INTERMLECLARI o LEGAMI DEBLI 1 Le forze intermolecolari sono forze attrattive tra entità discrete come atomi o molecole, dette anche legami o interazioni deboli (E
 ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
ELETTRONEGATIVITA CAPACITA DI UN ATOMO DI ATTIRARE UNA COPPIA DI ELETTRONI DI LEGAME DETERMINANDO COSI IL TIPO DI LEGAME CHE SI VIENE A FORMARE. DERIVA DA ALTRE DUE GRANDEZZE I. Energia di ionizzazione:
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Molecole e legami. Chimica generale
 Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Molecole e legami Chimica generale Atomi e molecole È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti in natura
Esercizi sulle Forze Intermolecolari
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sulle Forze Intermolecolari Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Capitolo 16 L energia si trasferisce
 Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
scienza che studia la struttura della materia e le sue trasformazioni
 scienza che studia la struttura della materia e le sue trasformazioni PROPRIETA DELLA MATERIA: -Proprietà fisiche Ø Massa Ø Volume Ø Temperatura Ø Forma Ø Colore Ø Durezza -Proprietà chimiche PROPRIETA
scienza che studia la struttura della materia e le sue trasformazioni PROPRIETA DELLA MATERIA: -Proprietà fisiche Ø Massa Ø Volume Ø Temperatura Ø Forma Ø Colore Ø Durezza -Proprietà chimiche PROPRIETA
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Introduzione alla chimica organica. 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole
 Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Forze intermolecolari
 Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
Forze intermolecolari Le forze intermolecolari sono forze attrattive tra molecole, tra ioni o tra ioni e molecole. In assenza di tali forze tutte le molecole sarebbero gas le molecole possono stabilire
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
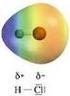 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
Tensione di vapore evaporazione
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Limiti del criterio della variazione entropia
 Limiti del criterio della variazione entropia S universo = S sistema + S ambiente > 0 (nei processi irreversibili) S universo = S sistema + S ambiente = 0 (nei processi reversibili) Dalla valutazione di
Limiti del criterio della variazione entropia S universo = S sistema + S ambiente > 0 (nei processi irreversibili) S universo = S sistema + S ambiente = 0 (nei processi reversibili) Dalla valutazione di
MOLECOLE. 2 - i legami chimici. Prof. Vittoria Patti
 MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
MOLECOLE 2 - i legami chimici Prof. Vittoria Patti Gli stati di aggregazione della materia STATO SOLIDO molecole ravvicinate, struttura ordinata, volume proprio, forma propria STATO LIQUIDO molecole
H 2 O 2 (aq) 2e - + O 2 (g) H + (aq) MnO 2 (s) +2e H + (aq Mn 2+ (aq) +2 H 2 O (l).
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Legame Chimico. Legame Chimico
 Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Legame Chimico Fra due atomi o gruppi di atomi esiste un legame chimico se le forze agenti tra essi danno luogo alla formazione di un aggregato di atomi sufficientemente stabile da consentire di svelarne
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
Legame covalente. H 1s un protone e un elettrone
 Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Interazioni deboli. Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012
 Interazioni deboli 1 Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012 Legami deboli o interazioni deboli La forza di un legame chimico viene stabilita in base alla energia del
Interazioni deboli 1 Sylvia S. Mader Immagini e concetti della biologia Zanichelli editore, 2012 Legami deboli o interazioni deboli La forza di un legame chimico viene stabilita in base alla energia del
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
LEGAME CHIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici.
 LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
LEGAME CIMICO In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
TERMODINAMICA E TERMOCHIMICA
 TERMODINAMICA E TERMOCHIMICA La TERMODINAMICA è una scienza chimico-fisica che studia le trasformazioni dell energia. La TERMOCHIMICA è una particolare branca della termodinamica che valuta quantitativamente
TERMODINAMICA E TERMOCHIMICA La TERMODINAMICA è una scienza chimico-fisica che studia le trasformazioni dell energia. La TERMOCHIMICA è una particolare branca della termodinamica che valuta quantitativamente
CAPITOLO 4 STRUTTURE MOLECOLARI
 APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
APITL 4 STRUTTURE MLELARI 4.1 (a) Di seguito è mostrata la struttura di Lewis di P 3. Nella teoria VSEPR il numero di coppie di elettroni attorno all atomo centrale è fondamentale per determinare la struttura.
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Corso di Chimica Generale CL Biotecnologie
 Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova
 CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
CORSO DI LAUREA IN INGEGNERIA CIVILE A.A. 2008-2009 Prova scritta del corso di Chimica A-K Compito prova Cognome e nome.... n di matricola Nei quesiti a risposta multipla, verranno ANNULLATI i quesiti
PERCORSI ABILITANTI SPECIALI CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA
 PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
PERCORSI ABILITANTI SPECIALI 2014 - CLASSE A033 TEST FINALE DEL CORSO DI CHIMICA Cognome Nome Numero progressivo sul registro 1. Viene disciolto zucchero in un certo volume di acqua pura fino a che si
relazioni tra il calore e le altre forme di energia.
 Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
TERMODINAMICA CHIMICA
 TERMODINAMICA CHIMICA Si definisce FUNZIONE DI STATO una variabile il cui valore dipende solo dallo stato iniziale e finale del sistema e non dal cammino percorso nella trasformazione effettuata Sono funzioni
TERMODINAMICA CHIMICA Si definisce FUNZIONE DI STATO una variabile il cui valore dipende solo dallo stato iniziale e finale del sistema e non dal cammino percorso nella trasformazione effettuata Sono funzioni
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
ATOMI E MOLECOLE. Psicobiologia Lezione nr. 1. Prof. Lasaponara
 ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
ATOMI E MOLECOLE Psicobiologia Lezione nr. 1 Prof. Lasaponara La struttura dell atomo I legami chimici e le molecole I componenti elementari della materia vivente 20 miliardi di anni fa Caratteristiche
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame
 IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
IL LEGAME CHIMICO Regola dell'ottetto e suo superamento Legame ionico Covalenza e ordine di legame Carica formale Risonanza ElettronegativitÄ e polaritä del legame 1 IL LEGAME CHIMICO Il legame chimico
= Atomo di idrogeno (H) molecola dell idrogeno (H 2 )
 IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
IL LEGAME CHIMICO Si chiama legame chimico ciò che tiene unito un atomo ad un altro e si forma sempre fra almeno due atomi. Per indicare che due atomi sono legati, si interpone un trattino fra i loro simboli
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Per esempio, possiamo osservare il legame ionico nella molecola di cloruro di sodio. Il cloro e il sodio hanno le seguenti strutture di Lewis:
 IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
IL LEGAME IONICO In natura solo i gas nobili presentano atomi allo stato libero. Tutte le altre sostanze consistono di molecole che sono aggregazioni di atomi. Le forze che tengono uniti gli atomi in una
VIRT&L-COMM IL LEGAME CHIMICO. TFA II Ciclo a.a.2014/2016. Dott. Angela Casu ISSN:
 IL LEGAME CHIMICO TFA II Ciclo a.a.2014/2016 Dott. Angela Casu UN VIDEO INTRODUTTIVO Per vedere il video CLICCA QUI Sommario 1. Il legame chimico 2. L elettronegatività 3. Il legame ionico 4. Composti
IL LEGAME CHIMICO TFA II Ciclo a.a.2014/2016 Dott. Angela Casu UN VIDEO INTRODUTTIVO Per vedere il video CLICCA QUI Sommario 1. Il legame chimico 2. L elettronegatività 3. Il legame ionico 4. Composti
1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno 5. Legami a confronto
 Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Unità n 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia
 Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Capitolo 12 Le forze intermolecolari e gli stati condensati della materia 1. Le forze intermolecolari 2. Molecole polari e apolari 3. Le forze dipolo-dipolo e le forze di London 4. Il legame a idrogeno
Il legame chimico I: il legame covalente. Capitolo 9
 Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Il legame chimico. Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici
 Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 8 La chimica dell acqua 3 Sommario 1. Come si formano i legami chimici 2. I legami covalenti ionici 3. La molecola dell acqua
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 16 novembre Compito A
 POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 16 novembre 2012. Compito A Avvertenze: scrivere le soluzioni sull apposito oglio che va completato con tutti i
POLITECNICO DI MILANO ING. ENG AER MEC. Corso di FONDAMENTI DI CHIMICA I PROVA IN ITINERE 16 novembre 2012. Compito A Avvertenze: scrivere le soluzioni sull apposito oglio che va completato con tutti i
IBRIDAZIONE. MODELLO DELL ORBITALE di LEGAME
 IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
IBRIDAZIONE MODELLO DELL ORBITALE di LEGAME Approccio più semplice per descrivere la struttura elettronica di una specie sfruttando il concetto di orbitale. METANO Gli atomi nel formare legami usano elettroni
2 - Perche i solidi ionici sono fragili mentre i solidi metallici sono duttili e malleabili? Motivare
 POLITECNICO DI MILANO ING. ENGAESMEC Corso di ONDAMENTI DI CHIMICA sez. MOM RAE, docente Cristian Gambarotti a.a. 2012/2013 I PROVA IN ITINERE 16112012 A 1 Considerando un generico atomo plurielettronico,
POLITECNICO DI MILANO ING. ENGAESMEC Corso di ONDAMENTI DI CHIMICA sez. MOM RAE, docente Cristian Gambarotti a.a. 2012/2013 I PROVA IN ITINERE 16112012 A 1 Considerando un generico atomo plurielettronico,
PROPRIETA DEI MATERIALI
 PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2.
PROPRIETA DEI MATERIALI Una proprietà è la risposta di un materiale ad una sollecitazione esterna. Per i materiali solidi le proprietà possono raggrupparsi in sei differenti categorie: 1. Meccaniche 2.
Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio:
 Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
Reazioni chimiche Una reazioni chimica esprime il numero e il tipo di specie che si combinano ed il risultato della combinazione. Esempio: CH 4 + 2O 2 CO 2 + 2H 2 O La reazione chimica è formata da reagenti
Termodinamica. Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico
 Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
Massa atomica. Unità di massa atomica: 1/12 della massa del 12 C
 Massa atomica Unità di massa atomica: 1/12 della massa del 12 C Il peso atomico, o più correttamente la massa atomica dei vari elementi si riporta sotto forma di una media ponderata tra i vari isotopi
Massa atomica Unità di massa atomica: 1/12 della massa del 12 C Il peso atomico, o più correttamente la massa atomica dei vari elementi si riporta sotto forma di una media ponderata tra i vari isotopi
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
PROPRIETÀ PERIODICHE DEGLI ELEMENTI
 PROPRIETÀ PERIODICHE DEGLI ELEMENTI 1) Energia di ionizzazione E ion Energia necessaria per sottrarre ad un atomo, allo stato di gas monoatomico, un elettrone A (g) d A + (g) + e - E ion processo endotermico
PROPRIETÀ PERIODICHE DEGLI ELEMENTI 1) Energia di ionizzazione E ion Energia necessaria per sottrarre ad un atomo, allo stato di gas monoatomico, un elettrone A (g) d A + (g) + e - E ion processo endotermico
Le sostanze chimiche prof. Matteo Scapellato
 1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
1. Fenomeni fisici e fenomeni chimici a) Fenomeno fisico: è una trasformazione che non cambia la natura delle sostanze 1 b) Fenomeno chimico o reazione chimica: è una trasformazione che cambia la natura
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia. Massa atomica MOLE. a.a.
 Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia Massa atomica MOLE a.a. 2016-17 MATERIA costituita da ATOMI Miscele OMOGENEE o soluzioni Hanno la
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
Chimica. La scienza che studia le trasformazioni della materia. Acqua (ghiaccio) Acqua (Liquido) Trasformazione Fisica
 Nozioni di Base Chimica La scienza che studia le trasformazioni della materia Acqua (ghiaccio) ----- Acqua (Liquido) Trasformazione Fisica Metano + Ossigeno -- Anidride Carbonica + Acqua Trasformazione
Nozioni di Base Chimica La scienza che studia le trasformazioni della materia Acqua (ghiaccio) ----- Acqua (Liquido) Trasformazione Fisica Metano + Ossigeno -- Anidride Carbonica + Acqua Trasformazione
PROGRAMMAZIONE DISCIPLINARE INDIVIDUALE a. s / 14. Elenco moduli Argomenti Strumenti / Testi Letture. Le proprietà fisiche della materia.
 Pagina 1 di 6 DISCIPLINA: SCIENZE INTEGRATE : CHIMICA INDIRIZZO: 2TU DOCENTE : prof. Paola Leggeri Elenco moduli Argomenti Strumenti / Testi Letture 1 LE FORME DELLA MATERIA Le proprietà fisiche della
Pagina 1 di 6 DISCIPLINA: SCIENZE INTEGRATE : CHIMICA INDIRIZZO: 2TU DOCENTE : prof. Paola Leggeri Elenco moduli Argomenti Strumenti / Testi Letture 1 LE FORME DELLA MATERIA Le proprietà fisiche della
Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo
 1 Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo Limitazioni della prima legge della termodinamica 2 E = q + w E universo = E sistema + E ambiente E sistema =
1 Entropia e secondo principio della termodinamica: prevedere la spontaneità di un processo Limitazioni della prima legge della termodinamica 2 E = q + w E universo = E sistema + E ambiente E sistema =
CHIMICA: studio della struttura e delle trasformazioni della materia
 CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
CHIMICA: studio della struttura e delle trasformazioni della materia 1 Materia (materali) Sostanze (omogenee) Processo fisico Miscele Elementi (atomi) Reazioni chimiche Composti (molecole) Miscele omogenee
Atomi e molecole. Gli atomi degli elementi si trovano in natura generalmente combinati tra loro in molecole o composti ionici
 IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
IL LEGAME CHIMICO Atomi e molecole È estremamente difficile trovare in natura una sostanza formata da singoli atomi isolati Solo i gas nobili sono presenti in natura come gas monoatomici Gli atomi degli
Università degli studi di MILANO Facoltà di AGRARIA. El. di Chimica e Chimica Fisica. Mod. 1 CHIMICA. Mod. 2 CHIMICA FISICA.
 Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Università degli studi di MILANO Facoltà di AGRARIA El. di Chimica e Chimica Fisica Mod. 1 CHIMICA Mod. 2 CHIMICA FISICA Lezione 4 Anno Accademico 2010-2011 Docente: Dimitrios Fessas Si riconoscono così
Il legame ionico legame ionico
 Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 15 Le forze intermolecolari e gli stati condensati della materia 3 Sommario 1. Le forze intermolecolari 2. Molecole polari e
M M n+ + n e - X + n e - X n-
 IL LEGAME IONICO 1 Il legame ionico Descrizione generale La formazione di NaCl La valenza ionica L energia reticolare: definizione e esempio di calcolo Proprietà dei solidi ionici Il legame ionico si realizza
IL LEGAME IONICO 1 Il legame ionico Descrizione generale La formazione di NaCl La valenza ionica L energia reticolare: definizione e esempio di calcolo Proprietà dei solidi ionici Il legame ionico si realizza
Fra le poche eccezioni notiamo i gas nobili che sono particolarmente stabili e non reattivi.
 LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
LEGAME CHIMICO Solo raramente si trovano in natura sostanze costituite da atomi isolati. In genere gli atomi si trovano combinati fra loro in composti molecolari, ionici o metallici. Fra le poche eccezioni
Lezione 3 - Legame chimico
 Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI. A cura della prof. C. Viscardi
 I LEGAMI CIMICI A cura della prof. C. Viscardi 1 ATOMI E MOLECOLE È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti
I LEGAMI CIMICI A cura della prof. C. Viscardi 1 ATOMI E MOLECOLE È estremamente difficile trovare in natura una sostanza formata solamente da atomi semplici Solo i gas inerti dell ottavo gruppo sono presenti
Siena, 10 Giugno 2015 Sandra Defazio Serena Fedi
 CLASSE I A Costruzione Ambiente e Territorio omogenei ed eterogenei e curva di riscaldamento di un miscuglio. nobili. Distinzione fra molecole e atomi. Principio di conservazione della massa. Teoria atomica
CLASSE I A Costruzione Ambiente e Territorio omogenei ed eterogenei e curva di riscaldamento di un miscuglio. nobili. Distinzione fra molecole e atomi. Principio di conservazione della massa. Teoria atomica
SOLUZIONI E CONCENTRAZIONE
 SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
SOLUZIONI E CONCENTRAZIONE Miscela omogenea di due o più sostanze: solvente (presente in maggiore quantità) + soluto In genere il solvente è liquido (es.acqua) mentre il soluto può essere solido, liquido,
Idrogeno (H) Azoto (N) La materia è costituita da elementi chimici. In natura sono presenti 92 elementi
 Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Gli organismi sono fatti da MATERIA*. (*qualsiasi cosa che occupa uno spazio e ha una massa) Gli antichi filosofi greci dicevano che la materia deriva da 4 ingredienti di base o ELEMENTI (ARIA, ACQUA,
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
Le proprietà periodiche degli elementi
 Le proprietà periodiche degli elementi 1 2 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 3 Numerazione gruppi
Le proprietà periodiche degli elementi 1 2 1 Numerazione gruppi IUPAC Numero atomico Simbolo Peso atomico Metallo Semimetallo Non metallo 1s 2s2p 3s3p 4s3d4p 5s4d5p 6s4f5d6p 7s5f6d7p 3 Numerazione gruppi
Termochimica reazione esotermica: cede calore all ambiente 2Al + Fe 2 O 3 Al 2 O 3 + 2Fe 2Mg + CO 2 2MgO + C
 Termochimica reazione esotermica: cede calore all ambiente 2Al + Fe 2 O 3 Al 2 O 3 + 2Fe 2Mg + CO 2 2MgO + C Thermite.mov Magco2.mov reazione endotermica: assorbe calore dall ambiente Endo2.mov Ba (OH)
Termochimica reazione esotermica: cede calore all ambiente 2Al + Fe 2 O 3 Al 2 O 3 + 2Fe 2Mg + CO 2 2MgO + C Thermite.mov Magco2.mov reazione endotermica: assorbe calore dall ambiente Endo2.mov Ba (OH)
