Fenomeni di trasporto Esercitazione sul trasporto di materia per convezione
|
|
|
- Geronimo Cappelletti
- 6 anni fa
- Visualizzazioni
Transcript
1 Fenomeni di trasporto Esercitazione sul trasporto di materia per convezione Problemi stazionari 1. Anidride carbonica viene fatta gorgogliare attraverso acqua in un recipiente di volume totale pari a 2 litri. Acqua viene inviata nel sistema con una portata volumetrica pari a 2 l/s. Le bolle di gas hanno un diametro d pari a 1 mm. Si supponga altresì che nel recipiente siano presenti 1000 bolle di gas, e che il coefficiente di trasporto in fase liquida, k c, sia esprimibile attraverso una relazione del tipo: k c 0. 1 D g d dove è la densità dell acqua la viscosità, e D la diffusività dell anidride carbonica in acqua, pari a 10-5 cm 2 /s. Calcolare la concentrazione di anidride carbonica nel liquido in uscita dal recipiente. Problema 1 Problema 2 2. In un fermentatore avviene una reazione ossidativa provocata da batteri; la velocità di reazione per unità di volume è proporzionale alla concentrazione di ossigeno disciolto nell'acqua con una costante cinetica di s -1. Una corrente d'aria alla pressione di 1 atm e 25 C viene fatta gorgogliare nel fermentatore. Le bolle di gas hanno un diametro di 0.5 cm e sono presenti nel numero di 700 per litro di acqua. Il coefficiente di trasporto in fase liquida k c per una singola bolla è esprimibile mediante la relazione D v k c d dove D è la diffusività dell'ossigeno in acqua, v e d sono la velocità di risalita ed il diametro della bolle, rispettivamente. La velocità di risalita di una bolla può essere calcolata dalla seguente espressione empirica valida per bolle separate di gas in acqua v d dove d deve essere espresso in cm, e la velocità v è in cm/s. Calcolare la concentrazione di ossigeno disciolto nell'acqua in condizioni stazionarie. Supponete di potere, con accorgimenti costruttivi abbastanza costosi, diminuire il diametro delle bolle, mantenendo costante la frazione volumetrica di gas nel sistema e tutti gli altri parametri. Per quale diametro delle bolle non conviene seguire più tale politica? 3. Si consideri una corrente di aria (p=1 atm; T=25 C) di portata volumetrica G contenente CO 2 con pressione parziale p CO2. Per ridurre il contenuto di CO 2 in aria si può pensare di utilizzare l apparecchiatura di geometria cilindrica (con area di base A), descritta in Figura. La corrente gassosa da purificare viene posta a contatto con una fase liquida acquosa, alimentata all assorbitore con portata volumetrica L ed inizialmente priva di CO 2. Sia la fase gassosa sia la fase liquida sono perfettamente miscelate, e caratterizzate da coefficienti di trasporto di materia uguali e pari a
2 k c k c, L k c, G 0. 1 cm / sec Si assuma inoltre che la relazione di equilibrio liquido-vapore per la CO 2 sia esprimibile attraverso la legge di Henry: p H x CO 2 CO 2 con H=1400 atm. Si determinino le concentrazioni di CO 2 nella fase liquida e gassosa uscenti dall apparecchiatura Dati: G=1 lt/sec; p CO2 =0.2 atm; A=1 m 2 ; L=4 lt/sec. 4. Si consideri uno strato di acqua stagnante a contatto con aria a pressione atmosferica e 25 C profondo 5 cm, sul cui fondo è presente un biofilm di spessore pari a 5 mm. L ossigeno necessario per la respirazione dei microrganismi nel biofilm, dopo avere raggiunto il pelo libero, diffonde nel liquido, per poi diffondere nel biofilm e reagire strada venire utilizzato strada facendo dai microrganismi. Dopo avere tracciato un profilo qualitativo di concentrazione nelle varie fasi (aria, acqua, biofilm), si determini il consumo di ossigeno nel biofilm in condizioni stazionarie per unità di superficie di biofilm sapendo che: (i) il coefficiente di trasporto di O2 dall aria verso il pelo libero del liquido è pari a 0.1 cm/s, (ii) il coefficiente di partizione aria-acqua è pari a 30 (O2 meno solubile nell acqua), (iii) il coefficiente di diffusione di O2 nell acqua è pari a cm 2 /s, (iv) il coefficiente di partizione acqua-biofilm è pari a 4 (O2 meno solubile nel biofilm), (v) il coefficiente di diffusione dell O2 nel biofilm è pari a cm 2 /s, (vi) la velocità di consumo di ossigeno nel biofilm è del primo ordine nella concentrazione di O2 con costante cinetica pari a 0.1 min 1. Si stabilisca se esistono meccanismi che offrono una resistenza trascurabile al trasporto. Ad un certo punto si arresta il consumo di O2 a causa della morte dei microrganismi nel biofilm. Si determini il profilo di concentrazione nello stato stazionario che ne risulta. 5. Dall alto di una colonna di aerazione (alta 5 m e con un con volume pari a 20 m 3 ) viene immessa una soluzione acquosa (non contenente O2) con portata pari a 13 litri/s. Dal fondo della colonna viene gorgogliata aria con portata pari a 250 litri/min mentre la portata di gas uscente dall alto della colonna è pari al 95% della portata gorgogliata e contiene O2 con una percentuale molare del 19%. Sapendo che (i) la pressione è atmosferica, (ii) la temperatura è di 25 C, (iii) la solubilità di O2 è pari a 8.69 mg/litro, (iv) non vi è alcuna reazione chimica, si determini il coefficiente di trasporto kla nella colonna. 6. Per lo studio della cinetica di una reazione enzimatica in fase liquida A B si vuole adoperare un reattore continuo da laboratorio del tipo a basket. Il reattore è dotato di un
3 albero rotante cui sono applicati quattro cestelli contenenti complessivamente 100 pellet porosi in cui è immobilizzato l enzima. Il reattore viene alimentato con una portata Q=0.1 litri/h di una soluzione acquosa contenente il substrato A ad una concentrazione c0= 100 mmol/litro. La reazione è caratterizzata da una cinetica Michaelis-Menten, r = vmax c/(km+c), con vmax=5 mmol/(s litro) e km=500 mmol/litro. I pellet di catalizzatore sono sfere con un raggio R=0.3 cm e la diffusività di A nella sfere è D= cm 2 /s. Sapendo che il coefficiente di trasporto di materia kc nella fase acquosa è pari a 0.1 cm/s. calcolare la concentrazione di A in uscita dal reattore in condizioni stazionarie e le moli di B prodotte nel reattore per unità di tempo. Si stabilisca se le resistenze esterne al trasporto possono essere considerate trascurabili. 7. Per determinare il coefficiente di trasporto di materia kla nell apparecchiatura schematizzata in figura si può adottare il così detto oxygen-balance method, ovvero misurare la portata di ossigeno nella fase gassosa in uscita. Utilizzando i dati riportati in figura, e sapendo che (i) la portata di ossigeno nella fase gassosa in uscita è pari a 9.9 l/min, (ii) non vi è alcuna reazione nell apparecchiatura, (iii) ci si trova in condizioni stazionarie, (iv) vi è perfetta miscelazione, si calcoli il coefficiente di trasporto kla, nonché la concentrazione di ossigeno in fase liquida. Q=4 l/min (no O 2 ) O 2 1atm, 30 C Volume liquido = 100 l O 2 1 atm, 30 C, 10 l/min 8. In una colonna di aerazione (alta 1.6 m e con un diametro di base di 30 cm) viene gorgogliato ossigeno puro (p=1 atm, T=25 C) al fine di ossigenare in continuo una soluzione acquosa che viene immessa dall alto della colonna (e prelevata dal fondo) con una portata pari a 0.5 litri/s. Lungo la colonna sono distribuiti alcuni elettrodi ad ossigeno che permettono di determinare la concentrazione di ossigeno disciolto in fase liquida. Si stimi il coefficiente di trasporto di materia medio all interno della colonna sapendo che in condizioni stazionarie l elettrodo posizionato all uscita della colonna indica una percentuale di saturazione del 90%. 9. La concentrazione di anidride carbonica nelle soluzioni acquose provenienti da fermentatori può essere prossima al valore di saturazione (essendo l anidride carbonica uno dei prodotti della respirazione dei microrganismi). Per ridurre la concentrazione di CO 2 si può pensare di inviare la corrente in uscita dal reattore in una apparecchiatura in cui viene fatto gorgogliare un gas privo di CO 2, in modo da trasferire CO 2 dalla fase liquida alla fase gassosa, un operazione di trasferimento di materia nota con il nome di stripping. Si consideri un apparecchiatura di stripping continua che operi in condizioni stazionarie. La portata della soluzione acquosa in ingresso è pari a 10 litri/min ed in essa la concentrazione di CO 2 è pari a
4 0.04 mol/litro. Il gas privo di CO 2 viene gorgogliato con una portata pari a 100 litri/min. I coefficienti di trasporto in fase liquida ed in fase gas sono uguali fra loro e pari a 1 cm/s, mentre la superficie complessiva delle bolle è pari a 0.5 m 2. Ai fini del calcolo della forza spingente per il trasporto dalla fase liquida alla fase gas si assuma che la fase liquida sia perfettamente miscelata. Per quanto riguarda le bolle, queste entrano con una concentrazione nulla di CO 2, mentre diversa da zero (ed incognita) è la concentrazione di CO 2 quando le bolle raggiungono il pelo libero. Per semplicità si assuma che ai fini del calcolo della forza spingente la concentrazione nelle bolle sia pari alla media aritmetica tra ingresso ed uscita. Si calcoli la concentrazione di CO 2 nella corrente liquida in uscita dall apparecchiatura nell ipotesi che le portate volumetriche di liquido e di gas in uscita siano approssimabili a quelle in ingresso. Si ripeta lo stesso calcolo nel caso in cui la forza spingente media sia espressa attraverso una media logaritmica. 10. Un enzima viene immobilizzato in particelle sferiche porose di 4 mm di diametro per catalizzare la reazione A B. La cinetica di tale reazione si può considerare del primo ordine con costante cinetica pari a 3 min 1. Il coefficiente di diffusione di A nelle particelle porose è pari a 10 5 cm 2 /s. Il processo viene condotto in un PFR da 100 litri alimentato con una portata di 1 L/min di una soluzione acquosa contenente il reagente A in concentrazione 2M. In tale reattore è presente un letto fisso di sferette catalitiche tale da realizzare un grado di vuoto nel PFR pari al 50% (grado di vuoto = volume fluido/volume totale). Si calcoli la conversione di A in condizioni stazionarie nell ipotesi che il meccanismo di trasporto convettivo del substrato A dal fluido verso la superficie delle particelle offra una resistenza trascurabile rispetto al meccanismo diffusivo all interno delle particelle. Si verifichi l ipotesi di trascurabilità delle resistenze esterne al trasporto sapendo che il coefficiente di trasporto di materia esterno è pari a 5 cm/min. 11. Una corrente acquosa (priva di ossigeno) avente portata pari a 100 litri/h viene ossigenata in una apparecchiatura a perfetta miscelazione in cui viene gorgogliato ossigeno a pressione atmosferica. Sapendo che (i) il coefficiente di trasporto di materia kl a è pari a 2 h 1, (ii) nel recipiente il liquido occupa un volume di 10 litri, (iii) la temperatura è pari a 20 C, si calcoli la concentrazione di ossigeno nella corrente in uscita dall apparecchiatura. Per ridurre i costi di esercizio del processo di ossigenazione si può pensare di gorgogliare aria al posto dell ossigeno puro. Tuttavia, per fare in modo che si produca acqua ossigenata con la stessa portata e la stessa concentrazione di ossigeno del caso precedente, occorre aumentare i costi di impianto, ovvero lavorare con una apparecchiatura più grande. Si determini il volume di liquido nell apparecchiatura tale da raggiungere questo obiettivo. 12. Una corrente gassosa contenente un composto A alla concentrazione c0=1 mole/lt è alimentata in un reattore catalitico a letto fisso con una portata Q=10 lt/s. La reazione A B irreversibile e praticamente atermica avviene sulla superficie esterna di un catalizzatore non poroso con una cinetica del primo ordine r=-kc dove r è la velocità di reazione
5 superficiale in moli/cm 2 s, c è la concentrazione di A e k=0.058 cm/s. Il volume del letto catalitico è V=300 lt, mentre l area dell interfaccia solido-gas per unità di volume è a=200 m -1. Il coefficiente di trasporto di materia nelle condizioni operative è kc=0.05 cm/s. Calcolare la concentrazione di A in uscita dal reattore. Problemi in transitorio 1) Sul fondo di un batch contenente 0.5 litri di acqua viene posta una sottile piastrina di zucchero alta 5 mm ed a sezione quadrata con spigolo pari a 5 cm. Sapendo che la densità dello zucchero è 1.6 g/cm 3 e la sua solubilità è 2 g/cm 3, si stabilisca se la piastrina si scioglierà completamente, e si calcoli la concentrazione di zucchero in acqua in condizioni stazionarie. Sapendo che il coefficiente kc che regola il trasporto dello zucchero in fase liquida è pari a 10 3 cm/s, si calcoli il tempo necessario per raggiungere le condizioni stazionarie sopramenzionate, ipotizzando che la sola altezza della piastrina sia variabile nel tempo (ovvero che lo zucchero si trasferisca in fase liquida solo attraverso la faccia superiore della piastrina). 2) Si consideri un batch contenente 100 litri di un mezzo nutriente acquoso in equilibrio con aria a pressione atmosferica e temperatura pari a 30 C, ovvero contenente ossigeno alla concentrazione di 8.05 mg/lt. Al tempo t=0 si comincia a gorgogliare O2 puro (p=1 atm, T=30 C) ed, al fine di determinare il coefficiente di trasporto di materia kla, si misura la concentrazione di ossigeno in fase liquida durante il transitorio. Sapendo che dopo 20 s, la concentrazione è pari a 0.35cS (dove cs è il valore di saturazione con O2 puro pari 38.4 mg/lt), si stimi il coefficiente di trasporto kla. 3) In un recipiente contenente 5 litri di una soluzione acquosa a 25 C viene gorgogliato ossigeno puro a pressione atmosferica e 25 C. Il coefficiente di trasporto di materia kla è pari a 0.1 s 1. Si determini la concentrazione di ossigeno nella soluzione in condizioni stazionarie nei seguenti casi: batch senza reazione; continuo senza reazione, con una corrente in ingresso avente portata pari a 1.5 l/h e una concentrazione di ossigeno pari al 10% del valore di saturazione; continuo con reazione caratterizzata da una velocità di consumo di ossigeno del primo ordine nella concentrazione di ossigeno in fase liquida e costante cinetica pari ad 30 min 1. La corrente di alimentazione è la stessa del punto precedente. Con riferimento all ultimo caso, si discuta cosa succede se ad un certo punto viene interrotto il gorgogliamento di ossigeno. In particolare si calcoli la concentrazione di ossigeno nella corrente in uscita nel nuovo stato stazionario che si viene a determinare, e si valuti il tempo caratteristico del transitorio che precede questo nuovo stato stazionario. Si determini infine il valore della concentrazione di ossigeno nella corrente in uscita dopo un tempo pari al tempo caratteristico appena individuato.
6 4) Per determinare il coefficiente di trasporto di materia kl a in un apparecchiatura batch (senza reazione) dal cui fondo si gorgoglia ossigeno si pensa di utilizzare la seguente procedura sperimentale. Per un certo tempo si gorgoglia ossigeno, fino a raggiungere una concentrazione di ossigeno in fase liquida pari a 10 mg/l. Da questo istante in poi si vira ad azoto. Sapendo che dopo 1 minuto, la concentrazione di ossigeno è 6 mg/lt si stimi kl a. 5) Una piastrina di glucosio viene investita tangenzialmente da una corrente di acqua pura ad una velocità v. Lo spessore iniziale della piastrina è δ0 mentre la sua larghezza e la sua lunghezza sono W e L, rispettivamente. Si determini il tempo necessario a sciogliere completamente la piastrina, nell ipotesi di variazione uniforme dello spessore. Dati: v =5 cm/s; δ0=2mm; W=10 cm; L=5cm. Dati glucosio: densità 1.54 g/cm3; diffusività in acqua= cm2/s; Solubilità in acqua=0.45 g/cm3.
( pi + σ ) nds = 0 (3)
 OLUZIONE IMULAZIONE EAME 0 DICEMBRE 05 I Parte Domanda (5 punti) Un fluido incomprimibile viene pompato in tubo orizzontale di lunghezza L e diametro D. La differenza di pressione agli estremi del tubo
OLUZIONE IMULAZIONE EAME 0 DICEMBRE 05 I Parte Domanda (5 punti) Un fluido incomprimibile viene pompato in tubo orizzontale di lunghezza L e diametro D. La differenza di pressione agli estremi del tubo
Esercitazione di Meccanica dei fluidi con Fondamenti di Ingegneria Chimica. Scambio di materia (II)
 Esercitazione di Meccanica dei fluidi con Fondamenti di Ingegneria himica Esercitazione 6 (FI) - 1 Gennaio 016 Scambio di materia (II) Esercizio 1 Evaporazione di acqua da una piscina Stimare la perdita
Esercitazione di Meccanica dei fluidi con Fondamenti di Ingegneria himica Esercitazione 6 (FI) - 1 Gennaio 016 Scambio di materia (II) Esercizio 1 Evaporazione di acqua da una piscina Stimare la perdita
Bilanci macroscopici. Esercizi dal libro Fenomeni di Trsporto, Bird, Stewart, Lightfoot
 Bilanci macroscopici Esercizi dal libro Fenomeni di Trsporto, Bird, Stewart, Lightfoot 7A 7B 7C 7D 7E 7F Esercizio 1 Due recipienti, le cui basi si trovano su uno stesso piano, sono messi in comunicazione
Bilanci macroscopici Esercizi dal libro Fenomeni di Trsporto, Bird, Stewart, Lightfoot 7A 7B 7C 7D 7E 7F Esercizio 1 Due recipienti, le cui basi si trovano su uno stesso piano, sono messi in comunicazione
ESERCITAZIONE 6. Dr.ssa Valeria Monti Corso di Laurea in Chimica e Tecnologia Farmaceutiche Fisica a.a
 ESERCITAZIONE 6 Dr.ssa Valeria Monti Corso di Laurea in Chimica e Tecnologia Farmaceutiche Fisica a.a. 2016 2017 Fluidi : Esercizio 1 Un arteria di raggio R 1 = 2.5 mm è parzialmente bloccata da una placca.
ESERCITAZIONE 6 Dr.ssa Valeria Monti Corso di Laurea in Chimica e Tecnologia Farmaceutiche Fisica a.a. 2016 2017 Fluidi : Esercizio 1 Un arteria di raggio R 1 = 2.5 mm è parzialmente bloccata da una placca.
Esercitazione di Meccanica dei fluidi con Fondamenti di Ingegneria Chimica. Reattori ideali isotermi (I)
 Esercitazione di Meccanica dei fluidi con Fondamenti di Ingegneria himica Esercitazione 5 (FI) - 4 Gennaio 6 - Integrazione Reattori ideali isotermi (I) Reattore atch a volume costante (densità costante)
Esercitazione di Meccanica dei fluidi con Fondamenti di Ingegneria himica Esercitazione 5 (FI) - 4 Gennaio 6 - Integrazione Reattori ideali isotermi (I) Reattore atch a volume costante (densità costante)
Trasferimento di ossigeno nei bioreattori. In particolare avremo:
 Trasferimento di ossigeno nei bioreattori In particolare avremo: 1. resistenza di trasferimento nella fase gassosa. Questo è generalmente trascurabile dato che la velocità del trasferimento del gas in
Trasferimento di ossigeno nei bioreattori In particolare avremo: 1. resistenza di trasferimento nella fase gassosa. Questo è generalmente trascurabile dato che la velocità del trasferimento del gas in
PRINCIPI DI INGEGNERIA BIOCHIMICA ESERCITAZIONI NUMERICHE A.A
 Cinetica enzimatica applicata 1) Progettare un protocollo di prove sperimentali che, impiegando un reattore CSTR a membrana ultrafiltrante, consentano la determinazione dei parametri cinetici di un enzima
Cinetica enzimatica applicata 1) Progettare un protocollo di prove sperimentali che, impiegando un reattore CSTR a membrana ultrafiltrante, consentano la determinazione dei parametri cinetici di un enzima
Scritto n. 1-10/06/2016
 Scritto n. 1-1/6/16 Esercizio n. 1 Solubilizzazione di un gas In un recipiente chiuso, rappresentato nello schema, è posta inizialmente una certa massa m di un liquido puro. Al tempo t= si comincia ad
Scritto n. 1-1/6/16 Esercizio n. 1 Solubilizzazione di un gas In un recipiente chiuso, rappresentato nello schema, è posta inizialmente una certa massa m di un liquido puro. Al tempo t= si comincia ad
Diffusione e osmosi. Roberto Cirio. Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico Corso di Fisica
 Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Roberto Cirio Corso di Laurea in Chimica e Tecnologia Farmaceutiche Anno accademico 2007 2008 Corso di Fisica La lezione di oggi Sostanze sciolte in liquidi, se utilizzate con membrane, hanno comportamenti
Meccanica dei Fluidi con Fondamenti di Ingegneria Chimica Prova in Itinere Tema A 23 Novembre 2012
 Meccanica dei Fluidi con Fondamenti di Ingegneria Chimica Proa in Itinere Tema A 3 Noembre 01 Esercizio 1 Tubazione scabra in ghisa Si consideri la tubazione in ghisa (indice di scabrezza ε=0.10 mm) disegnata
Meccanica dei Fluidi con Fondamenti di Ingegneria Chimica Proa in Itinere Tema A 3 Noembre 01 Esercizio 1 Tubazione scabra in ghisa Si consideri la tubazione in ghisa (indice di scabrezza ε=0.10 mm) disegnata
è completamente immerso in acqua. La sua
 In un tubo scorre in regime stazionario un liquido ideale con densità 1.00 10 3 kg/m 3 ; in un punto A il tubo ha raggio R A = 2.00 cm, la velocità di scorrimento è v A = 5.00 m/se la pressione è P A =
In un tubo scorre in regime stazionario un liquido ideale con densità 1.00 10 3 kg/m 3 ; in un punto A il tubo ha raggio R A = 2.00 cm, la velocità di scorrimento è v A = 5.00 m/se la pressione è P A =
Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto
 Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto 1 Teoria del film (Lewis, 1924) Si assume che il trasporto di materia avvenga in uno strato
Teorie per il calcolo dei coefficienti di trasporto di materia (interfaccia fluido-fluido) Fenomeni di Trasporto 1 Teoria del film (Lewis, 1924) Si assume che il trasporto di materia avvenga in uno strato
Le soluzioni e il loro comportamento
 A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
A. A. 2016 2017 1 CCS Scienze geologiche CCS Biologia Le soluzioni e il loro comportamento PERCENTUALE IN peso (% p/p) PERCENTUALE IN volume (% v/v) PERCENTUALE IN peso/volume (% p/v) MOLARITA (M) moli
Leggi ricavate da osservazioni sperimentali : mantenendo costante due dei 4 parametri, come variano gli altri due?
 Le leggi dei gas Lo stato gassoso è caratterizzato da mancanza di forma e volume propri, e dalla tendenza a occupare tutto il volume disponibile. Lo stato di un gas dipende da 4 parametri: Volume (V) Pressione
Le leggi dei gas Lo stato gassoso è caratterizzato da mancanza di forma e volume propri, e dalla tendenza a occupare tutto il volume disponibile. Lo stato di un gas dipende da 4 parametri: Volume (V) Pressione
Lo stato gassoso. Particelle con volume proprio trascurabile puntiformi
 Lo stato gassoso Gas ideale (o perfetto) Particelle in movimento (casuale) Particelle con volume proprio trascurabile puntiformi Assenza di interazioni tra le particelle trasformazioni fisiche e non chimiche
Lo stato gassoso Gas ideale (o perfetto) Particelle in movimento (casuale) Particelle con volume proprio trascurabile puntiformi Assenza di interazioni tra le particelle trasformazioni fisiche e non chimiche
sin( xn ) cos( xn) 1... a...
 Scritto n. 3-9/9/6 Esercizio n. Fitting lineare trigonometrico Sono disponibili i seguenti dati sperimentali: :..5.8..3. 3. 4. y: 3.5...3 -. -5. -7.5 6. Si vogliono descrivere questi dati utilizzando una
Scritto n. 3-9/9/6 Esercizio n. Fitting lineare trigonometrico Sono disponibili i seguenti dati sperimentali: :..5.8..3. 3. 4. y: 3.5...3 -. -5. -7.5 6. Si vogliono descrivere questi dati utilizzando una
ESERCITAZIONE 7. Dr.ssa Valeria Monti Corso di Laurea in Chimica e Tecnologia Farmaceutiche Fisica a.a
 ESERCITAZIONE 7 Dr.ssa Valeria Monti Corso di Laurea in Chimica e Tecnologia Farmaceutiche Fisica a.a. 2016 2017 Esercizio 1 Calcolare la densità dell ossigeno a 0 C e alla pressione di 1 atm. Esercitazione
ESERCITAZIONE 7 Dr.ssa Valeria Monti Corso di Laurea in Chimica e Tecnologia Farmaceutiche Fisica a.a. 2016 2017 Esercizio 1 Calcolare la densità dell ossigeno a 0 C e alla pressione di 1 atm. Esercitazione
Acque superficiali. Parte 4 (13)
 Corso di: DINAMICA DEGLI INQUINANTI Acque superficiali Parte 4 (13) Università di Roma Tor Vergata Anno Accademico 2009-2010 ing. Simona Berardi ARGOMENTI TRATTATI: Inquinamento dei fiumi Bilancio dell
Corso di: DINAMICA DEGLI INQUINANTI Acque superficiali Parte 4 (13) Università di Roma Tor Vergata Anno Accademico 2009-2010 ing. Simona Berardi ARGOMENTI TRATTATI: Inquinamento dei fiumi Bilancio dell
- Equilibri omogenei: tutte le sostanze che partecipano alla reazione fanno parte della stessa fase:
 ESERCITAZIONE 9 EQUILIBRI Reazioni di equilibrio: reazioni che possono avvenire in entrambi i sensi; la reazione diretta di formazione dei prodotti ha una velocità proporzionale alla concentrazione iniziale
ESERCITAZIONE 9 EQUILIBRI Reazioni di equilibrio: reazioni che possono avvenire in entrambi i sensi; la reazione diretta di formazione dei prodotti ha una velocità proporzionale alla concentrazione iniziale
Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali
 Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali Corso di Laurea in Chimica A.A. 2013/14 Test di autovalutazione 2 ottobre 2013 Cognome: Nome: Matematica e logica 1.
Università degli Studi di Perugia Facoltà di Scienze Matematiche Fisiche e Naturali Corso di Laurea in Chimica A.A. 2013/14 Test di autovalutazione 2 ottobre 2013 Cognome: Nome: Matematica e logica 1.
1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido.
 UNITÀ 8 LA MECCANICA DEI FLUIDI 1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido. 3. La pressione atmosferica. 4. La legge di Stevino. 5. La legge di Pascal. 6. La forza di Archimede.
UNITÀ 8 LA MECCANICA DEI FLUIDI 1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido. 3. La pressione atmosferica. 4. La legge di Stevino. 5. La legge di Pascal. 6. La forza di Archimede.
N. MATRICOLA: CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO PRE-APPELLO 18 DICEMBRE 2014 ESERCIZIO 1
 A NOME: N. MATRICOLA: CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO PRE-APPELLO 18 DICEMBRE 2014 Informazioni sulla valutazione delle risposte: nel caso di domande con risposte multiple,
A NOME: N. MATRICOLA: CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO PRE-APPELLO 18 DICEMBRE 2014 Informazioni sulla valutazione delle risposte: nel caso di domande con risposte multiple,
Corso di Sicurezza e Protezione Ambientale nell Industria di Processo Modulo di Sicurezza nell Industria di Processo Prove di Esame
 PROVA SCRITTA 16/6/2014 Si deve procedere allo stoccaggio di acetone in un serbatoio cilindrico di altezza pari a 2.43 m e diametro di 1.52 m. Il recipiente deve essere inertizzato con azoto puro prima
PROVA SCRITTA 16/6/2014 Si deve procedere allo stoccaggio di acetone in un serbatoio cilindrico di altezza pari a 2.43 m e diametro di 1.52 m. Il recipiente deve essere inertizzato con azoto puro prima
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
Rapporto tra soluto e solvente o soluzione
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
L equilibrio chimico
 L equilibrio chimico Un equilibrio dinamico: la velocità in una direzione è bilanciata dalla velocità nell altra. Sebbene non si osservi alcun cambiamento macroscopico molta attività è in corso 1 La differenza
L equilibrio chimico Un equilibrio dinamico: la velocità in una direzione è bilanciata dalla velocità nell altra. Sebbene non si osservi alcun cambiamento macroscopico molta attività è in corso 1 La differenza
I gas. Le caratteristiche dei gas. La legge di Boyle
 I gas Le caratteristiche dei gas Lo stato aeriforme è definito come uno dei tre stati della materia. Lo stato aeriforme può essere costituito da vapore o da gas. Un vapore è diverso da un gas in quanto
I gas Le caratteristiche dei gas Lo stato aeriforme è definito come uno dei tre stati della materia. Lo stato aeriforme può essere costituito da vapore o da gas. Un vapore è diverso da un gas in quanto
ESERCIZI ESERCIZI. 1) Il valore della costante di equilibrio K p. 4) Per la reazione di equilibrio: CO (g) + 1/2 O 2 (g) è CO 2 (g) p CO2 a.
 1) Il valore della costante di equilibrio K p dipende: a. dalle pressioni parziali all equilibrio di reagenti e prodotti b. dalla composizione all equilibrio del sistema di reazione c. dalla pressione
1) Il valore della costante di equilibrio K p dipende: a. dalle pressioni parziali all equilibrio di reagenti e prodotti b. dalla composizione all equilibrio del sistema di reazione c. dalla pressione
E' assegnato un sistema di 3 equazioni algebriche non lineari in tre incognite x 1, x 2 e x 3 :
 Esercizio n.1 Matrice Jacobiana 3x3 E' assegnato un sistema di 3 equazioni algebriche non lineari in tre incognite x 1, x e x 3 : f x, x, x ) = sin x + ) x x 6 = 1 1 3 1 3 f x, x, x ) = e x = 3x1 1 3 3
Esercizio n.1 Matrice Jacobiana 3x3 E' assegnato un sistema di 3 equazioni algebriche non lineari in tre incognite x 1, x e x 3 : f x, x, x ) = sin x + ) x x 6 = 1 1 3 1 3 f x, x, x ) = e x = 3x1 1 3 3
STATO LIQUIDO. Sono presenti forze intermolecolari ma in misura minore rispetto ai solidi. Le molecole possono scorrere tra loro
 Lo stato liquido STATO LIQUIDO Sono presenti forze intermolecolari ma in misura minore rispetto ai solidi Le molecole possono scorrere tra loro Ordine delle molecole solo a corto raggio Viscosità Resistenza
Lo stato liquido STATO LIQUIDO Sono presenti forze intermolecolari ma in misura minore rispetto ai solidi Le molecole possono scorrere tra loro Ordine delle molecole solo a corto raggio Viscosità Resistenza
Rev. 02/13. Antonio Coviello. ITIS Fermi TV
 ASSORBIMENTO Rev. 02/13 Antonio Coviello ITIS Fermi TV SCHEMA COSTRUTTIVO TORRE DI ASSORBIMENTO CON RIEMPIMENTO ASS-ES01: Biossido di Zolfo / Aria / Acqua Una portata di 125 Kmoli/h di aria contenente
ASSORBIMENTO Rev. 02/13 Antonio Coviello ITIS Fermi TV SCHEMA COSTRUTTIVO TORRE DI ASSORBIMENTO CON RIEMPIMENTO ASS-ES01: Biossido di Zolfo / Aria / Acqua Una portata di 125 Kmoli/h di aria contenente
STATICA E DINAMICA DEI FLUIDI
 STATICA E DINAMICA DEI FLUIDI Pressione Principio di Pascal Legge di Stevino Spinta di Archimede Conservazione della portata Teorema di Bernoulli Legge di Hagen-Poiseuille Moto laminare e turbolento Stati
STATICA E DINAMICA DEI FLUIDI Pressione Principio di Pascal Legge di Stevino Spinta di Archimede Conservazione della portata Teorema di Bernoulli Legge di Hagen-Poiseuille Moto laminare e turbolento Stati
-LEGGE DI AZIONE DELLE MASSE-
 -LEGGE DI AZIONE DELLE MASSE- STATO DI EQUILIBRIO: in un sistema chiuso a temperatura uniforme si instaura uno stato di equilibrio quando le proprietà macroscopiche (P,, concentrazioni, ) sono costanti.
-LEGGE DI AZIONE DELLE MASSE- STATO DI EQUILIBRIO: in un sistema chiuso a temperatura uniforme si instaura uno stato di equilibrio quando le proprietà macroscopiche (P,, concentrazioni, ) sono costanti.
Esame di Chimica Generale 16 Luglio 2015
 Esame di Chimica Generale 16 Luglio 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 16 Luglio 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
II prova in itinere di Fisica Applicata ( )A
 Cognome Nome Firma Matricola Gruppo II prova in itinere di Fisica Applicata (13-01-2009)A Domande da 1) a 10): +2.6 punti per risposta esatta e -0.6 punti risposta errata. Domande da 11) a 13): fino a
Cognome Nome Firma Matricola Gruppo II prova in itinere di Fisica Applicata (13-01-2009)A Domande da 1) a 10): +2.6 punti per risposta esatta e -0.6 punti risposta errata. Domande da 11) a 13): fino a
Corso di Termofluidodinamica
 Corso di Termofluidodinamica Modulo di Termodinamica Tecnica A.A. 2014-2015 - Esercizi di preparazione alla prima prova intermedia Problema N. 1 Un serbatoio deve essere dimensionato per contenere 200
Corso di Termofluidodinamica Modulo di Termodinamica Tecnica A.A. 2014-2015 - Esercizi di preparazione alla prima prova intermedia Problema N. 1 Un serbatoio deve essere dimensionato per contenere 200
Esercizi Grandezze, Vettori e Meccanica
 Esercizi Grandezze, Vettori e Meccanica 1. Trasformare le seguenti misure nelle unità del S.I.: l = 73.8 km l = 10 6 cm l = 0.34 mm v = 43 km/h v = 20 cm/s v = 3 10 2 mm/s a = 10 km/h 2 a = 10 cm/s 2 ν
Esercizi Grandezze, Vettori e Meccanica 1. Trasformare le seguenti misure nelle unità del S.I.: l = 73.8 km l = 10 6 cm l = 0.34 mm v = 43 km/h v = 20 cm/s v = 3 10 2 mm/s a = 10 km/h 2 a = 10 cm/s 2 ν
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Gas. Chimica generale ed Inorganica: Chimica Generale. I palloni ad aria calda
 Gas I palloni ad aria calda Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-2 Illustrando la pressione esercitata da un
Gas I palloni ad aria calda Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-2 Illustrando la pressione esercitata da un
Esame di Chimica Generale 20 Aprile 2011
 Esame di Chimica Generale 20 Aprile 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 20 Aprile 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Chimica e Tecnologia Farmaceutiche Esercitazioni di Fisica a.a Emanuele Biolcati
 Esercitazione 5 Dr. Monica Casale Chimica e Tecnologia Farmaceutiche Esercitazioni di Fisica a.a. 2010-2011 Emanuele Biolcati Ringraziamenti speciali a Monica Casale per la preparazione delle slides Fluidi
Esercitazione 5 Dr. Monica Casale Chimica e Tecnologia Farmaceutiche Esercitazioni di Fisica a.a. 2010-2011 Emanuele Biolcati Ringraziamenti speciali a Monica Casale per la preparazione delle slides Fluidi
IMPIANTI DELL INDUSTRIA DI PROCESSO ESERCITAZIONE N. 2. Bilanci di energia
 1 IMPIANTI DELL INDUSTRIA DI PROCESSO ESERCITAZIONE N. 2 Bilanci di energia 1. Calcolare la quantità di calore ceduta da 1 m 3 di aria a TPS nel raffreddamento da 500 C a 0 C, alla pressione costante di
1 IMPIANTI DELL INDUSTRIA DI PROCESSO ESERCITAZIONE N. 2 Bilanci di energia 1. Calcolare la quantità di calore ceduta da 1 m 3 di aria a TPS nel raffreddamento da 500 C a 0 C, alla pressione costante di
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
v = Δ[P] = _ Δ[S] S P
![v = Δ[P] = _ Δ[S] S P v = Δ[P] = _ Δ[S] S P](/thumbs/98/137173050.jpg) CINETICA ENZIMATICA Gli esperimenti di cinetica enzimatica si basano sulla determinazione della velocità di reazione, misurata come variazione della concentrazione del prodotto o del reagente in un dato
CINETICA ENZIMATICA Gli esperimenti di cinetica enzimatica si basano sulla determinazione della velocità di reazione, misurata come variazione della concentrazione del prodotto o del reagente in un dato
Cavo Carbonio. Sergio Rubio Carles Paul Albert Monte
 Cavo o Sergio Rubio Carles Paul Albert Monte o, Rame e Manganina PROPRIETÀ FISICHE PROPRIETÀ DEL CARBONIO Proprietà fisiche del o o Coefficiente di Temperatura α o -0,0005 ºC -1 o Densità D o 2260 kg/m
Cavo o Sergio Rubio Carles Paul Albert Monte o, Rame e Manganina PROPRIETÀ FISICHE PROPRIETÀ DEL CARBONIO Proprietà fisiche del o o Coefficiente di Temperatura α o -0,0005 ºC -1 o Densità D o 2260 kg/m
Esercizi di Elettricità
 Università di Cagliari Laurea Triennale in Biologia Corso di Fisica Esercizi di Elettricità 1. Quattro cariche puntiformi uguali Q = 160 nc sono poste sui vertici di un quadrato di lato a. Quale carica
Università di Cagliari Laurea Triennale in Biologia Corso di Fisica Esercizi di Elettricità 1. Quattro cariche puntiformi uguali Q = 160 nc sono poste sui vertici di un quadrato di lato a. Quale carica
Miscele di gas (Esercizi del testo) e Conduzione
 Miscele di gas (Esercizi del testo) e Conduzione 1. Determinare la resistenza termica complessiva di un condotto cilindrico di lunghezza L = 10 m, diametro interno D i = 4 mm e spessore s = 1 mm, realizzato
Miscele di gas (Esercizi del testo) e Conduzione 1. Determinare la resistenza termica complessiva di un condotto cilindrico di lunghezza L = 10 m, diametro interno D i = 4 mm e spessore s = 1 mm, realizzato
Lezione 10 Moto dei fluidi
 Lezione 10 Moto dei fluidi Caratterizzazione del moto Consideriamo soltanto il caso di liquidi in moto nei condotti. Parametri descrittivi del moto: Portata Q di un condotto: è il volume di liquido che
Lezione 10 Moto dei fluidi Caratterizzazione del moto Consideriamo soltanto il caso di liquidi in moto nei condotti. Parametri descrittivi del moto: Portata Q di un condotto: è il volume di liquido che
Scambi gassosi e regolazione del respiro
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ventilazione polmonare Ruolo del Sistema Respiratorio: 1 2 - fornire O 2 - rimuovere
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ventilazione polmonare Ruolo del Sistema Respiratorio: 1 2 - fornire O 2 - rimuovere
CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO PRE-APPELLO 19 DICEMBRE 2015
 NOME: N. MATRICOLA: CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO PRE-APPELLO 19 DICEMBRE 2015 Informazioni sulla valutazione delle risposte: nel caso di domande con risposte multiple,
NOME: N. MATRICOLA: CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO PRE-APPELLO 19 DICEMBRE 2015 Informazioni sulla valutazione delle risposte: nel caso di domande con risposte multiple,
Lezione 6 Sistemi gassosi e scambio di calore
 Lezione 6 Sistemi gassosi e scambio di calore 5. Equazione del stato del gas perfetto e teoria cinetica dei gas Equazione di stato del gas perfetto: Serway, Cap 6 Teoria cinetica dei gas: P V = NkT = nrt
Lezione 6 Sistemi gassosi e scambio di calore 5. Equazione del stato del gas perfetto e teoria cinetica dei gas Equazione di stato del gas perfetto: Serway, Cap 6 Teoria cinetica dei gas: P V = NkT = nrt
SOLUZIONE DEL COMPITO A DI CHIMICA DEL
 SOLUZIONE DEL COMPITO A DI CHIMICA DEL 05-07-13 1A) 33.5 g di ioduro di sodio e 33.0 g di iodio vengono sciolti in acqua trattati con 17.9 L (a c.n.) di cloro; si formano iodato di sodio, acido iodico
SOLUZIONE DEL COMPITO A DI CHIMICA DEL 05-07-13 1A) 33.5 g di ioduro di sodio e 33.0 g di iodio vengono sciolti in acqua trattati con 17.9 L (a c.n.) di cloro; si formano iodato di sodio, acido iodico
I Gas e Loro Proprietà (II)
 I Gas e Loro Proprietà (II) 2017 10 miles 0.2 atm 4 miles 0.5 atm Sea level 1 atm Dario Bressanini Gas e reazioni chimiche Determinare il volume di CO 2 prodotto a 37 0 C e 1.0 atm quando 5.6 g di glucosio
I Gas e Loro Proprietà (II) 2017 10 miles 0.2 atm 4 miles 0.5 atm Sea level 1 atm Dario Bressanini Gas e reazioni chimiche Determinare il volume di CO 2 prodotto a 37 0 C e 1.0 atm quando 5.6 g di glucosio
SOLUZIONI COMPITO A CHIMICA
 SOLUZIONI COMPITO A CHIMICA 16-01-2012 1A) Il permanganato di ammonio si può ottenere dalla reazione tra permanganato di bario e solfato di ammonio, filtrando il precipitato di solfato di bario che si
SOLUZIONI COMPITO A CHIMICA 16-01-2012 1A) Il permanganato di ammonio si può ottenere dalla reazione tra permanganato di bario e solfato di ammonio, filtrando il precipitato di solfato di bario che si
EQUILIBRIO CHIMICO. Nella reazione omogenea e reversibile: v 1 A (g) + B (g) v 2. C (g) + D (g)
 EQUILIBRIO CHIMICO Nella reazione omogenea e reversibile: v 1 A (g) + B (g) v 2 C (g) + D (g) le velocità della reazione diretta e inversa sono esprimibili in funzione delle concentrazioni dei reagenti
EQUILIBRIO CHIMICO Nella reazione omogenea e reversibile: v 1 A (g) + B (g) v 2 C (g) + D (g) le velocità della reazione diretta e inversa sono esprimibili in funzione delle concentrazioni dei reagenti
ESERCIZI DI TERMODINAMICA. costante di equilibrio della reazione. costante di equilibrio della reazione
 ESECIZI DI EMODINAMICA Esercizio Calcolare a c.s. la costante di equilibrio della seguente reazione: CO (g) + H CH OH (g) H f (kj/mole) CH OH (g) -, CO (g) -,5 H (g) S (J/mole K) CH OH (g) 6,8 CO (g) 97,9
ESECIZI DI EMODINAMICA Esercizio Calcolare a c.s. la costante di equilibrio della seguente reazione: CO (g) + H CH OH (g) H f (kj/mole) CH OH (g) -, CO (g) -,5 H (g) S (J/mole K) CH OH (g) 6,8 CO (g) 97,9
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato liquido
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato liquido Lo stato liquido Liquidi: energia dei moti termici confrontabile con quella delle forze coesive. Limitata libertà di movimento delle molecole, che
FISICA per SCIENZE BIOLOGICHE, A.A. 2014/2015 Prova scritta del 1 luglio 2016
 FISICA per SCIENZE BIOLOGICHE, A.A. 2014/2015 Prova scritta del 1 luglio 2016 1) Una guida verticale semicircolare liscia ha raggio R = 3 m e poggia su un piano orizzontale scabro, come mostrato in figura.
FISICA per SCIENZE BIOLOGICHE, A.A. 2014/2015 Prova scritta del 1 luglio 2016 1) Una guida verticale semicircolare liscia ha raggio R = 3 m e poggia su un piano orizzontale scabro, come mostrato in figura.
Esame di Chimica Generale 15 Giugno 2011
 Esame di Chimica Generale 15 Giugno 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 15 Giugno 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
LA MATERIA ED I SUOI STATI
 LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
Scambi gassosi e regolazione del respiro
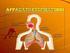 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
4) Un punto materiale si muove nel piano con legge oraria data dalle due relazioni: x=3t+1, y=2t. Qual è l equazione della traiettoria?
 Esercizi 1) Il modulo della differenza dei due vettori indicati nella figura vale a) 10 b) 3 d) 2 1 1 2) Siano dati due vettori di modulo pari a 3 e 6. Se l angolo tra di essi è di π/3 rad, il loro prodotto
Esercizi 1) Il modulo della differenza dei due vettori indicati nella figura vale a) 10 b) 3 d) 2 1 1 2) Siano dati due vettori di modulo pari a 3 e 6. Se l angolo tra di essi è di π/3 rad, il loro prodotto
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezione 34 2009 Programma: a che punto siamo? Definizione di soluzione Una soluzione è una miscela omogenea di due o più sostanze
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezione 34 2009 Programma: a che punto siamo? Definizione di soluzione Una soluzione è una miscela omogenea di due o più sostanze
Esame di Chimica Generale 19 Febbraio 2013
 Esame di Chimica Generale 19 Febbraio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 19 Febbraio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
SCHEDE TECNICHE RELATIVE AGLI IMPIANTI DI ABBATTIMENTO IMPIANTO DI ABBATTIMENTO AD UMIDO
 SCHEDE TECNICHE RELATIVE AGLI IMPIANTI DI ABBATTIMENTO IMPIANTO DI ABBATTIMENTO AD UMIDO Punto di emissione n. Temperatura di emissione ( C) Altezza geometrica di emissione (m) Portata massima di progetto
SCHEDE TECNICHE RELATIVE AGLI IMPIANTI DI ABBATTIMENTO IMPIANTO DI ABBATTIMENTO AD UMIDO Punto di emissione n. Temperatura di emissione ( C) Altezza geometrica di emissione (m) Portata massima di progetto
Inizio: n. Dalla legge dei gas perfetti PV = nrt si ha: n. Per la legge della conservazione della massa si ha: n
 ESERCIZIO 1 In un recipiente del volume di 1, L mantenuto alla temperatura costante di 1 C, sono contenute inizialmente,5 moli di zolfo. Nel recipiente viene aggiunto CO alla pressione parziale di 3,1
ESERCIZIO 1 In un recipiente del volume di 1, L mantenuto alla temperatura costante di 1 C, sono contenute inizialmente,5 moli di zolfo. Nel recipiente viene aggiunto CO alla pressione parziale di 3,1
Esercitazioni di fisica I fluidi
 Corso di Laurea in Scienze e Tecnologie Biologiche Esercitazioni di fisica I fluidi (pt. 1: fluidostatica e fluidi ideali) Luca Brombal luca.brombal@phd.units.it 16/11/2017 #1 Legno e granito Un blocco
Corso di Laurea in Scienze e Tecnologie Biologiche Esercitazioni di fisica I fluidi (pt. 1: fluidostatica e fluidi ideali) Luca Brombal luca.brombal@phd.units.it 16/11/2017 #1 Legno e granito Un blocco
CORSO DI CHIMICA. Esercitazione del 7 Giugno 2016
 CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
Gas. Caratteristiche tipiche dei gas rispetto a solidi e liquidi. Leggi dei gas: legge di Boyle, legge di Charles, legge di Avogadro
 Gas Caratteristiche tipiche dei gas rispetto a solidi e liquidi Definizione di pressione Unità di misura della pressione Leggi dei gas: legge di Boyle, legge di Charles, legge di Avogadro Equazione di
Gas Caratteristiche tipiche dei gas rispetto a solidi e liquidi Definizione di pressione Unità di misura della pressione Leggi dei gas: legge di Boyle, legge di Charles, legge di Avogadro Equazione di
Esame di Chimica Generale 15 Giugno 2016
 Esame di Chimica Generale 15 Giugno 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 15 Giugno 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Temperatura. Il legame con le grandezze microscopiche è di tipo statistico. Pressione Volume Temperatura
 Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
. Proprietà degli stati della materia Aeriforme Liquido Solido
 . Proprietà degli stati della materia Aeriforme Liquido Solido Volume variabile in funzione del recipiente Volume definito Volume definito Forma del recipiente Forma del recipiente Forma propria Miscibili
. Proprietà degli stati della materia Aeriforme Liquido Solido Volume variabile in funzione del recipiente Volume definito Volume definito Forma del recipiente Forma del recipiente Forma propria Miscibili
Equilibri e Principio di Le Chatelier
 Equilibri e Principio di Le Chatelier Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY
Equilibri e Principio di Le Chatelier Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY
ISIS A PONTI Gallarate
 4 A TCB 1 IL CROMATOGRAMMA: E il tracciato che descrive l andamento del segnale del rivelatore in funzione del tempo o del volume di eluente a partire dall istante in cui la miscela viene introdotta nella
4 A TCB 1 IL CROMATOGRAMMA: E il tracciato che descrive l andamento del segnale del rivelatore in funzione del tempo o del volume di eluente a partire dall istante in cui la miscela viene introdotta nella
N. MATRICOLA: CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO APPELLO 12 GENNAIO 2016 ESERCIZIO 1
 NOME: N. MATRICOLA: CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO APPELLO 12 GENNAIO 2016 Informazioni sulla valutazione delle risposte: nel caso di domande con risposte multiple,
NOME: N. MATRICOLA: CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO APPELLO 12 GENNAIO 2016 Informazioni sulla valutazione delle risposte: nel caso di domande con risposte multiple,
Dinamica dei fluidi viscosi
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Dinamica dei fluidi viscosi 14/3/2006 Ripartizione del sangue portata totale NQ diametro iniziale D diametro d dei rami secondari
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Dinamica dei fluidi viscosi 14/3/2006 Ripartizione del sangue portata totale NQ diametro iniziale D diametro d dei rami secondari
Università degli Studi di Perugia Dipartimento di Chimica, Biologia e Biotecnologie
 Università degli Studi di Perugia Dipartimento di Chimica, Biologia e Biotecnologie Corso di Laurea in Chimica A.A. 2014/15 Test di autovalutazione 23 Settembre 2014 Cognome: Nome: Matematica e Logica
Università degli Studi di Perugia Dipartimento di Chimica, Biologia e Biotecnologie Corso di Laurea in Chimica A.A. 2014/15 Test di autovalutazione 23 Settembre 2014 Cognome: Nome: Matematica e Logica
LA DIFFUSIONE. M At 1 A. dm dt
 LA DIFFUSIONE Il trasferimento di massa, all interno di un solido, di un liquido o di un gas o di un altra fase solida è detto diffusione ( trasporto di materiale mediante movimento di atomi). La diffusione
LA DIFFUSIONE Il trasferimento di massa, all interno di un solido, di un liquido o di un gas o di un altra fase solida è detto diffusione ( trasporto di materiale mediante movimento di atomi). La diffusione
I liquidi. Viscosità Energia superficiale Pressione di vapore Temperatura di fusione Temperatura di ebollizione. Liquidi puri (proprietà) Liquidi
 I liquidi Liquidi puri (proprietà) Viscosità Energia superficiale ressione di vapore emperatura di fusione emperatura di ebollizione Liquidi Soluzioni (proprietà) Liquido id + Liquidoid Liquido + Gas Liquido
I liquidi Liquidi puri (proprietà) Viscosità Energia superficiale ressione di vapore emperatura di fusione emperatura di ebollizione Liquidi Soluzioni (proprietà) Liquido id + Liquidoid Liquido + Gas Liquido
Termochimica. La termochimica si occupa dell effetto termico associato alle reazioni chimiche. E i = energia interna molare H i = entalpia molare
 Termochimica La termochimica si occupa dell effetto termico associato alle reazioni chimiche. + +... + +... E i energia interna molare H i entalpia molare ( + +...) ( + +...) ν ( + +...) ( + +...) ν 1
Termochimica La termochimica si occupa dell effetto termico associato alle reazioni chimiche. + +... + +... E i energia interna molare H i entalpia molare ( + +...) ( + +...) ν ( + +...) ( + +...) ν 1
Esame di Chimica Generale 10 Aprile 2015
 Esame di Chimica Generale 10 Aprile 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 10 Aprile 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Nell eq. di Bernoulli per fluidi reali cosa rappresenta ( ) nel
 NOME: N. MATRICOLA: CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO 15 GENNAIO 2015 Informazioni sulla valutazione delle risposte: nel caso di domande con risposte multiple, più di
NOME: N. MATRICOLA: CONTROLLO E SICUREZZA DEI PROCESSI PRODUTTIVI IN AMBITO FARMACEUTICO 15 GENNAIO 2015 Informazioni sulla valutazione delle risposte: nel caso di domande con risposte multiple, più di
Equilibrio chimico. Equilibri dinamici Legge azione di massa, Kc, Kp, Equilibri eterogenei Principio di Le Chatelier
 Equilibrio chimico Equilibri dinamici Legge azione di massa, Kc, Kp, Equilibri eterogenei Principio di Le Chatelier Data la reazione generica: A + B C Seguendo nel tempo le variazioni di concentrazione
Equilibrio chimico Equilibri dinamici Legge azione di massa, Kc, Kp, Equilibri eterogenei Principio di Le Chatelier Data la reazione generica: A + B C Seguendo nel tempo le variazioni di concentrazione
Reazioni lente e reazioni veloci
 CINETICA CHIMICA Reazioni lente e reazioni veloci Cinetica Chimica Studio della velocità di reazione (v) Che cos è la velocità di reazione? è la diminuzione della concentrazione molare del reagente nell
CINETICA CHIMICA Reazioni lente e reazioni veloci Cinetica Chimica Studio della velocità di reazione (v) Che cos è la velocità di reazione? è la diminuzione della concentrazione molare del reagente nell
PERDITE DI CARICO CONTINUE
 PERDITE DI CARICO CONTINUE La dissipazione di energia dovuta all'attrito interno ed esterno dipende da: velocità del liquido [m/s] dal tipo di liquido e dalle pareti della vena fluida, secondo un coefficiente
PERDITE DI CARICO CONTINUE La dissipazione di energia dovuta all'attrito interno ed esterno dipende da: velocità del liquido [m/s] dal tipo di liquido e dalle pareti della vena fluida, secondo un coefficiente
Se si mescolano 24,50 g. di NaCl in polvere e 100,00 g. di acqua:
 A. Si mescolano 15,30 g. di zucchero con 5,65 g. di NaCl dopo averli pesati. Determinare: A. Le percentuali dei due componenti B. Gli errori assoluti e relativi compiuti sulle due pesate C. L errore assoluto
A. Si mescolano 15,30 g. di zucchero con 5,65 g. di NaCl dopo averli pesati. Determinare: A. Le percentuali dei due componenti B. Gli errori assoluti e relativi compiuti sulle due pesate C. L errore assoluto
Esercizio 1 Esercizio 2
 GAS IDEALI Dell ossigeno, supposto gas ideale con k = 1.4 cost, evolve secondo un ciclo costituito dalle seguenti trasformazioni reversibili: Compressione isoterma dallo stato 1 (p1 = 0.9 bar; v1 = 0.88
GAS IDEALI Dell ossigeno, supposto gas ideale con k = 1.4 cost, evolve secondo un ciclo costituito dalle seguenti trasformazioni reversibili: Compressione isoterma dallo stato 1 (p1 = 0.9 bar; v1 = 0.88
Il sistema respiratorio
 Il sistema respiratorio Utilizzo di ossigeno e produzione di anidride carbonica da parte delle cellule a livello mitocondriale con la produzione di ATP Zona di conduzione Zona respiratoria Funzioni non
Il sistema respiratorio Utilizzo di ossigeno e produzione di anidride carbonica da parte delle cellule a livello mitocondriale con la produzione di ATP Zona di conduzione Zona respiratoria Funzioni non
Corso di Fondamenti di Chimica dei Materiali Ingegneria Gestionale II appello, 15 febbraio 2019
 Corso di Fondamenti di Chimica dei Materiali Ingegneria Gestionale II appello, 15 febbraio 2019 Esercizio 1 Si consideri una sottile lastra di alluminio di spessore 0.05 mm e superficie 500 mm 2. Sapendo
Corso di Fondamenti di Chimica dei Materiali Ingegneria Gestionale II appello, 15 febbraio 2019 Esercizio 1 Si consideri una sottile lastra di alluminio di spessore 0.05 mm e superficie 500 mm 2. Sapendo
Esame di Chimica Generale 19 Giugno 2013
 Esame di Chimica Generale 19 Giugno 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 19 Giugno 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Equilibri chimici. Chimica
 Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata Equilibri chimici Equilibrio Chimico Studio
Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata Equilibri chimici Equilibrio Chimico Studio
Distribuzione e Temperatura. Pressione di Vapore. Evaporazione
 Evaporazione Le molecole del Liquido hanno una distribuzione di energia cinetica. Una frazione di molecole della superficie del liquido ha energia cinetica sufficiente per sfuggire all attrazione attrazione
Evaporazione Le molecole del Liquido hanno una distribuzione di energia cinetica. Una frazione di molecole della superficie del liquido ha energia cinetica sufficiente per sfuggire all attrazione attrazione
delle curve isoterme dell anidride carbonica
 COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
Prova A. Problema 2 Nel piano xy è presente una distribuzione ρ piana di correnti:
 Prova A Problema Un sottile tubo può ruotare intorno al suo centro su un tavolo orizzontale liscio. Il tubo contiene una sbarretta della stessa lunghezza e della stessa massa del tubo il cui centro di
Prova A Problema Un sottile tubo può ruotare intorno al suo centro su un tavolo orizzontale liscio. Il tubo contiene una sbarretta della stessa lunghezza e della stessa massa del tubo il cui centro di
con C A concentrazione del gas disciolto La PA è quindi funzione lineare della concentrazione. La pressione parziale è: P A = Y * Ptot.
 ASSORBIMENTO E una operazione unitaria la cui finalità è l eliminazione di un soluto volatile contenuto in una miscela gassosa. Il solvente liquido scende dall alto mentre la miscela gassosa entra dal
ASSORBIMENTO E una operazione unitaria la cui finalità è l eliminazione di un soluto volatile contenuto in una miscela gassosa. Il solvente liquido scende dall alto mentre la miscela gassosa entra dal
Esercitazione su elettricità
 Esercitazione su elettricità Due sferette metalliche A e B poste nel vuoto a una distanza di 10 m hanno la stessa carica positiva. Il modulo della forza elettrica che A applica a B è 10 3 N. Calcola la
Esercitazione su elettricità Due sferette metalliche A e B poste nel vuoto a una distanza di 10 m hanno la stessa carica positiva. Il modulo della forza elettrica che A applica a B è 10 3 N. Calcola la
Lezione n. 11. Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
