Il termometro è tarato in gradi Fahrenheit, scala usata per esempio negli Stati Uniti d America.
|
|
|
- Eduardo Rizzo
- 5 anni fa
- Visualizzazioni
Transcript
1 Problemi di paragrafo La temperatura dell acqua diminuisce durante la fase di misurazione. Per minimizzare questo effetto occorre un termometro dotato di una prontezza adeguata, riempito con un liquido che si dilati velocemente. Inoltre, la massa del termometro deve essere trascurabile rispetto a quella dell acqua. Il termometro è tarato in gradi Fahrenheit, scala usata per esempio negli Stati Uniti d America. t 5 ( 9 T F ) C 5 ( 86 ) C 9 0 C 065 C K 8 K l oro fonde a una temperatura maggiore 5 T f 0 C 6 K T e 77 K ΔT K. 6 L aumento di temperatura in gradi Celsius è pari all aumento di temperatura in Kelvin: ΔT 0 C 0 K T f + ΔT 98 K + 0 K 8 K T f (8 7) C 45 C. 7 T K 7 K T F F,8 8 T K 45 F F,8 e quando T F T C T si ha + 7 K 506 K t C ( T K 7) C ( 506 7) C C. T F 9 5 T + C T F 9 5 T + C F 4 T T 40 C 40 F. 5 F Zanichelli 05
2 9 0 Sul concetto di equilibrio termico e sul fenomeno della variazione del volume del liquido sottoposto a una variazione di temperatura. Per il principio zero della termodinamica, entrambe si porteranno all equilibrio termico con il tavolo (e più in generale con l ambiente), quindi raggiungeranno la stessa temperatura. Proporzionalità diretta. 4 Si piega dalla parte del rame poiché il rame, a parità di differenza di temperatura, si allunga meno dello zinco. 5 Δl l i λ Fe ΔT ( 8,750 m) 0 6 C 6 55,0,5 l l i ( + λδt ) 5,47km C 7 Δl l i λδt Δt Δl l i λ t t 0 + Δt ,5 cm ( 55 cm) 6,5 0 6 C C,8 0 C Δb b i λδt ( 00 cm) C 00 C 0 C C 60 C 65 C 9 mm 6 0 cm 5,50 km Zanichelli 05
3 analogamente Δh h i λδt ( 67 cm) C ΔS S i λδt ( 67 cm) 00 cm 9 65 C ( C ) 65 C 0 cm ΔS 0,70% S i Invertendo la relazione per la dilatazione lineare si ottiene: Δt ΔS S i λ ΔS S i λ 0,0070 9, cm C,9 0 C 0 La superficie totale iniziale è data da: S i ( 40 mm) ( 05 mm) 4( 5 mm)(0 mm), 0 4 mm ΔS S i λδt (, 0 4 mm )(,9 0 5 C )( 5 C),5 mm La variazione percentuale è data dal rapporto tra la variazione di superficie e la superficie iniziale: ΔS,5 mm S i, 0 4 mm 0,0% Le due grandezze sono direttamente proporzionali. Dal grafico si ricava il coefficiente angolare della retta: Δy 0,004 0,00 Δx ( 00 50) C,0 0 5 C. Questo valore è il doppio del coefficiente di dilatazione lineare della ghisa, in accordo con la relazione σ λ, dove σ rappresenta il coefficiente di dilatazione superficiale. Il raggio del foro all interno della rondella aumenta come se la rondella non avesse il foro e fosse un disco d alluminio sottoposto a riscaldamento. Sia il foro che la rondella si espandono con lo stesso coefficiente di dilatazione: d d i ( + λδt ) ( 0,05 mm) + ( 0 6 C )( 85 C 0 C) 0,0 mm ( l i ) ( + λ Δt) ( l i ) ( + λ Δt) ( l i ) Δt ( l i ) λ ( l i ) λ ( l i ) 4 da cui si ricava 0,70 m 0,69 m ( C ) 0,69 m 0,70 m C l l i + l i λδt il coefficiente angolare della retta è l i λ e dal grafico si ricava 8 0 C Zanichelli 05
4 l i λ 5 80,5 mm 800,5 mm 00 C 0 C,5 0 mm C λ,5 0 mm C 0 6 C 800,5 mm λ Cu C mentre λ Zn C quindi il materiale che si dilata maggiormente è lo zinco. 6 ΔV αδt ΔV αδt. 7 È impossibile far uscire l anello dal cilindro, a causa della dilatazione termica. L azoto liquido è a una temperatura di 95 C. 8 Il coefficiente di dilatazione lineare per il ferro è λ 0 6 C ; essendo α λ, risulta α C. Dalla relazione per la dilatazione volumica si ottiene: Δt ΔV α V V (,4,) cm C α, cm 9 5 cm ΔV λδt ( 8,0 0 5 cm ) C ΔV 0,00 8,0 0 5 cm 0 ( C ) t t i + Δt ( ) C 475 C 5 0 C. ( 54 cm) ( 45 cm) 8,0 0 5 cm Δt ΔV λ 5 80 cm C 80 cm ( 8,0 0 5 cm ) ΔV λ Δt e V π D h 4 ΔV 0,0 cm λ 4 π D hδt 4 Il materiale potrebbe essere il vetro, vedi tabella pag C 6, 0 cm 4 C π (,8 cm cm) ( 80 C 0 C) 8,9 0 6 C Il volume iniziale viene calcolato come somma dei volumi di un parallelepipedo e di una piramide: A b h + A h b (,80 cm) ( 5,40 cm) (,80 cm) ( 4,cm) +, cm 4 Zanichelli 05
5 V V La variazione percentuale di volume è i ΔV Applicando la relazione inversa per la dilatazione volumica si ottiene: Δt ΔV α 0, A causa di un comportamento anomalo, il volume dell acqua aumenta al diminuire della temperatura fra 4 C e 0 C; nel congelatore il volume aumenterebbe di circa il 0% fino a rompere il vetro. Il coefficiente di dilatazione cubica del mercurio è α Hg,8 0 4 C mentre quello del vetro è α vetro,7 0 5 C. Quindi, a parità di temperatura, il mercurio si dilata molto di più del vetro. 4 A parità di tutti gli altri fattori α Hg,8 0 4 C e α alcool 0 4 C, quindi l alcool si dilata più del mercurio e riempie il capillare a temperature minori. Di conseguenza la portata di un termometro ad alcool è minore. 5 ΔV αδt 70 L C C V l 000 cm e 4 V cm 750 cm ΔV 50 cm Dalla relazione per la dilatazione volumica si ottiene: Δt ΔV α 50 cm 98 C 750 cm T ΔV olio αδt (,0 dm ) 0,7 0 C ΔV vetro λδt (,0 dm ) 9,0 0 6 C l olio fuoriuscito è C 0 C. (, 0 C ) C 8 C. Se V V + ΔV olio si ha Δd d d d m /V m /V V V d m /V V ΔV olio ΔV vetro 8,8,08 (,,) cm 0,0045 0,5%,cm C,8 0 dm 8,8 cm C,08 0 dm,08 cm cm 7,7 cm ΔV V 8 ΔV benz ΔV Al ( α benz λ Al ) Δt, ,8 cm 08,8 cm,4%. C ( 5,0 L )( 4,0 8,0) C 0,4 L. 5 Zanichelli 05
6 9 Il volume del capillare con r d / è ΔV π r h π Dalla relazione per la dilatazione volumica si ottiene l intervallo di temperatura apprezzabile con la massima variazione di volume consentita. Per il mercurio: ΔT ΔV 4, cm C α Hg 8,0 0 cm approssimata per difetto 40 ΔV ΔV vino ΔV vetro ( α λ )ΔT e l area di base del collo cilindrico è A b π d / 4 Il volume, trattandosi di un recipiente rigido e chiuso ermeticamente. 4 Una trasformazione isocora. 4 La differenza è che la costante α ha lo stesso valore per tutti i gas mentre per i solidi e i liquidi varia da sostanza a sostanza. 44 Le temperature assolute degli stati iniziale e finale. V 0 è il volume occupato dal gas alla temperatura di 0 C e t la temperatura a cui il gas occupa il volume V ,80 0 cm ( 7,50 cm) 4, cm (,8 0 4 C ) 05 C T T 0 + ΔT (0 + 05) C 5 Per l alcool: ΔT ΔV 4, cm α alcool 8,0 0 cm T T 0 + ΔT ( ) C 59 C ( 0 4 C ) h ΔV ( α λ )Δt 54,5 0 cm A b πd / 4 V T V T T T i V T 0,80 ml 9 K 55 K 49 C ( ,0 0 6 ) C T V i 800 K 0,70 ml 400 K. π ( 4, cm) / 4 C 8,4 cm. 6 Zanichelli 05
7 47 V V 0 (+ αt ); V V 0 (+ αt ) V V + αt + αt,50 L 48 Dalla legge di Gay-Lussac si ottiene α V V ( 4,8,5) L 0 V 0 t,5 L α 7 C 0,0066 C,7 0 C I due risultati quindi coincidono fino alla seconda cifra significativa ΔT Dato che per ogni km di altitudine la temperatura varia di 0 K, l altitudine richiesta è di circa km. 5 T 56 C 9 K Dalla legge di Gay-Lussac: L altezza raggiunta dal pistone si ottiene dividendo il volume finale per la superficie di base, con r, dm C 7 C V T S b h T S b h i h,5 cm 5 K h 6 cm 9 K T V + 0 C 7 C,8 L ( 5 C) 0,00665 C,7 0 C K 68 K. K 0 K. C 05 K V T 8,5 dm ( 05 K 9 K ) 9, dm h V π r 9, dm,7 dm 7 cm.,4, dm 4 C 87 K 7 Zanichelli 05
8 V 0,0 V T V T V 5 Le temperature assolute degli stati iniziale e finale. p 0 è la pressione del gas alla temperatura di 0 C e t la temperatura a cui il gas ha pressione p. 54 All aumentare della temperatura, a volume costante, aumenta la pressione del gas, talvolta infiammabile, contenuto all interno della bomboletta, con il pericolo di esplosione. 55 p p 0 + αt 56 p p 0 + αt p + αt t p p + αt p p p 0 ( + αt),7 0 5 Pa 57 t 0 C T 9 K; p p T T T α + t α 5,5 05 Pa 5,0 0 5 Pa + 7 C t 8 C T K,5 atm ( 9 K K ),7 atm. 0,0 T,0,0( 87 K) 9 K 0 C. ( 7 C) 0 Pa. ( 7 C +6 C) 7 C 45 C. 58 p p 0 ( + α t) t α p 0 mmhg p 0 (7 C) 000 mmhg C. 59 T 8, C 9, K ; T 4,7 C 07,7 K p p T T (,5 0 5 Pa) 07,7 K 9, K 60 T C 85 K ; T 5 C 08 K p p ( 8,5 atm) ( 08 K) T 9, atm T 85 K La variazione percentuale di pressione è:,7 0 5 Pa. 8 Zanichelli 05
9 6 Δp p p ( 9, 8,5)atm 0,08 8,% p p 8,5 atm A pressione costante vale la legge di Gay-Lussac e la variazione percentuale di volume è uguale alla variazione percentuale di pressione (vedi prima e seconda legge di Gay-Lussac): ΔV 8,% ΔV 0,08V V 0 Il coefficiente angolare è dato dal rapporto tra le variazioni di pressione e temperatura: Δp ( 0,5 0,50) atm 0,008 atm C Δt C Dall equazione della retta y q + mx, con q p 0 0,50 atm e m 0,008 atm C - si ha: p 0,50 atm + ( 0,008 atm C )t p 0 α 0,50 atm 0,008 atm C 7 C 6 La trasformazione A B è una trasformazione isoterma T B T A 0 K. La trasformazione Dal grafico si ricavano p B 0,0 0 5 Pa 6 B C è una trasformazione isocora e vale la legge di Gay-Lussac e Pressione e volume sono inversamente proporzionali e il grafico che rappresenta questa trasformazione è un ramo d iperbole. 64 Per la legge di Stevino, la pressione diminuisce muovendosi dal fondo verso la superficie, quindi le bollicine diventano più grandi, come previsto dalla legge di Boyle (minor pressione, maggiore volume). 65 V p i p ,0 05 Pa p C 0,0 0 5 Pa TC T B p C 0 K p B 0,0 0 5 Pa ( 9,8 0 5 m ) (, 0 5 Pa),4 0 5 Pa p V p i / p p atm. i i 6,0 0 5 m 60 cm 0 K p B T B p C T C Per la legge di Boyle: p i pv p i p V V 9 Zanichelli 05
10 68 p V p V V p V p 69 0 kpa,8 L 90 kpa 6,87 0 L ΔV Δp + ΔV + Δp p V V kpa 0 kpa + 0,0 L,8 L + 5 kpa 90 kpa 6,87 0 L L. V 0,69 ± 0,04 p 0,04 L V tot 4 V ( p ) f 4 p V tot 4V ( p ) f p 4 p f ( p ) f + ( p ) f 4 p + p 70 La trasformazione A B è a volume costante V A V B 0,0 0 m Dalla legge di Boyle applicata alla trasformazione B C si ottiene p B V B p C V C V C p V ( 0, Pa) ( 0,0 0 m ) B B 0,80 0 m p C 0,0 0 5 Pa La trasformazione C D è a volume costante V D V C 0,80 0 m 7 T 0 C 9 K; T 5 C 5 K 7 4 ( 5 atm ) ( 400 ml ) pv p i V pv 8,0 atm i i p,0 atm ( 0 atm) 9 atm, 0 m 5 K Dalla legge di Gay-Lussac V V T T, 0 m 9 K,5 0 m 7 No, è valida solo se le temperature sono espresse nella scala Kelvin. 74 Si espande salendo e si arresta quando la densità dell aria è uguale alla densità dell elio nel palloncino. 0 Zanichelli 05
11 75 p V p i T V p i T p 50 kpa 4, L 00 kpa ( 7+ 0 ) C ( 7+ 5) C,0 L 76 p V p i V p V i p t T 7 K p V p i ( 0 kpa) 0,09 m 0 kpa ( 7 K) 7+ 7,0 C 0,04 m ( 7 K) ( 65 K) ( 7 K) 9 C. 77 p V p i T p p i V T 0 kpa 00% 7% ( 7+ 8,0 ) K 4 kpa 7+,0 K 78 A 7, 0 m C 96 K T 65 C 8 K V 0,99 è il volume finale p p i T ( V, Pa) 8 K, 0 5 Pa 96 K 0,99 p F A F pa (, 05 Pa) ( 7, 0 m ) 8,5 0 N 79 d d 0 m /V m /V 0 V 0 V d d 0 V 0 V d 0 p T 0 p 0 T,5 kg m 80,40 0 ( 5 Pa) ( 7 K) (,0 0 5 Pa) 7 K + 57,0 K,4 kg m 8 u + u + 6 u 4 u m 4 u 5,7 0 5 kg, kg u N M m (,0 kg),8 (5, kg) Zanichelli 05
12 x + 6 u 60 u x u 56 u Consultando la tavola periodica, vediamo che l elemento ignoto è il Ferro Sì, perché eseguendo il rapporto tra una massa in grammi numericamente uguale alla massa atomica o molecolare di una data sostanza si ottiene sempre il numero di Avogadro. N A 6, Atomi di ossigeno: Atomi di piombo: 87 N O N Am m A N Pb N Am m A ( 6,0 0 mol ) g Il numero di atomi contenuti nel blocco è pari a 6 g mol, 0 4 ( 6,0 0 mol ) 8 g Dalla tavola periodica la massa molare dello zinco è n m ( M, 0 g) 49 mol 65,4 g mol N nn A 49 mol 6,0 0 mol 07 g mol, La massa molare della molecola di glucosio è 6 g mol + g mol g mol 80 g mol e il numero n di moli è pari a n m glucosio 5g 0,08 mol M glucosio 80 g mol,0 0 5 atomi M 65,4 g mol Zanichelli 05
13 89 90 Una mole di gas a 0 C e alla pressione atmosferica normale occupa sempre un volume di,4 L. 9 Il prodotto pv risulterebbe uguale a zero e questo implicherebbe, matematicamente, una pressione nulla o un volume nullo, o entrambi; tutte situazioni fisicamente impossibili. 9 Si ha un aumento di pressione V e p p i pv T p i p i T p i T T 95 V π D p nrt V Δp h π( 7,0 0 m) ( 0,9 m),4 0 m ( 9 K) 8,5 J mol K 4,8 mol Δn n + ΔT T + Δh 0, 0 6 Pa 0 6 Pa p,5 ± 0,,4 0 m, Pa h + Δd 0, d p 4,8 + K 9 K + cm 9 cm + 0,5 cm 4 cm, Pa 96 pv nrt V nrt p Se p è costante, da (,5 mol ) 8,5 J mol K, 0 5 Pa pv nrt 7+5 si ottiene: K L Zanichelli 05
14 V V T T T T V V 97 T V nrt / p p V Raggio tubo r, 0 m Lunghezza tubo l 4,8 0 m Temperatura iniziale: 0 C 9 K ( 8 L) nr, 0 5 Pa,5 mol 8,5 J mol K Il volume del tubo, che resta costante, è pari al volume di un cilindro: V π r l π, 0 m Il numero di moli è n p i 5, 0 Pa R 8, J mol K ( 4,8 0 m), 0 4 m (, 0 4 m ) 9 K 5, 0 4 mol Dall equazione di stato si ricava la pressione massima p nrt ( V 5, 0 4 mol) ( 8, J mol K ) ( 500 K) 6 0 kpa, 0 4 m 98 In,0 m di aria in condizioni standard sono contenute n pv (,0 0 5 Pa) (,0 m ) i i 4 mol di aria R 8, J mol K 9 K Il numero di moli di Argon è 4 0,95% 4,0 0 mol Le nuove condizioni di pressione e temperatura sono: T 7 K e p p i % p i 0, 99 Dall equazione di stato del gas perfetto si ha V nrt 4,0 0 mol p 7,9 0 4 Pa p i 0,78p i 7,9 0 4 Pa ( 8, J mol K ) 7 K Per lo stato A: p A 6,0 0 5 Pa ; V A,0 0 m T A p A V A nr 6,0 0 5 Pa 0,5 mol (,0 0 m ) ( 8, J mol K ) 4, 0 K Per lo stato B: V B 0 0 m ; T B T A 40 K 40K 8, J mol K p B nrt 0,5 mol B V B ( 0 0 m ) Per lo stato C: V C 0 0 m ; T C T D,8 0 K,8 0 5 Pa, 0 m 5 K 6 C 4 Zanichelli 05
15 80K 8, J mol K p C nrt 0,5 mol C V C 0 0 m Per lo stato D: V D,0 0 m ; p D 4,0 0 5 Pa T D p D V D nr 4,0 0 5 Pa 0,5 mol (,0 0 m ) ( 8, J mol K ),8 0 K., 0 5 Pa Zanichelli 05
16 Problemi generali m nm CH4 pv RT M CH 4 84, mol 6 g mol 4,49 kg Δm Δp p + ΔV V + ΔT T kg m 4,5 ± 0, ( Pa) 4,5 0 m m ( 8, J mol K )( 8 K) atm 5 atm + 0, L 4,5 L + K 8 K ( + 4 ) g mol 0, kg 4 ΔV αδt m ρ αδt 5 0, kg 8,96 0 kg m ( C )( 00 C 0 C) 4, m 6 Dividendo membro a membro p i p f V f T f 88,5 K p f nrt f e p i nr, si ottiene: 4,5 4,50 4, Pa 9 K,0 05 Pa p i p 0 + gdh h p i p 0 dg Pa ( 9,8 m s ) 6 m 4,50 05,0 0 5,0 0 kg m 6 Zanichelli 05
17 7 Δl l i 0, 0,000 Dalla legge di dilatazione lineare: dato λ C, si ottiene Δt Δl l i λ 0,000 C C La temperatura a cui bisogna sottoporre il bicchiere sottostante è: t t 0 + Δt (0 + ) C 5 C 5 0 C 8 90 C 6 K T 0 C 9 K Raggio del barattolo: r,5 0 m Capacità del barattolo: V TOT 5,0 0 4 m Altezza della marmellata h, 0 m Quando il coperchio viene chiuso, trascurando la leggera deformazione del coperchio verso l interno, si ha una trasformazione a volume costante per cui dalla legge di Gay-Lussac: p p i T (,0 05 Pa) (9 K) 8, 0 4 Pa (6 K) Il volume occupato dall aria (V 0 ), dopo che il barattolo è stato riempito di marmellata fino all altezza di cm, è dato dalla differenza tra la capacità del barattolo (V TOT ) e il volume della marmellata ( πr h ): 9 n p 0 V 0 RT 0 (,0 0 5 Pa) m ( 8, J mol K ) 6 K T(mattina): T 0 5 C 98 K T( pomeriggio): T 5 C 08 K T(notte): T C 94 K ΔV dm V V dm V( mattina): V 0 V( pomeriggio): V V( notte): Δl l i λδt Δl l i λδt 0,000 V 0 V TOT πr h (5,0 0 4 m ) π,5 0 m (5, , 0 4 ) m m V (, 0 m) 0 mol Dalla legge di Gay-Lussac per la prima trasformazione V V 0 T V 0 T 0 V 0 98K T 0 V T V 08K Dalla legge di Gay-Lussac per la seconda trasformazione 7 Zanichelli 05
18 V V T V T V 08K T V T V 94K Si ha un sistema di equazioni in incognite: V 0 98K V 08K V 0 98 K V 08K 08 K V 98 K 44 dm 08 K V V 94K (4 + ) dm 44 dm V V V ( dm ) 94 K 4 dm 4 K 0 Dall equazione di stato dei gas perfetti T pv nr, 0 5 Pa 7, mol Pressione iniziale: (,5 0 m ) ( 8, J mol K ) 50 K 7 C,4 0 C Temperatura iniziale: T 0 C 95 K Temperatura finale: T 0 C 9 K Raggio della pallina: Il volume inziale della pallina, immaginata come una sfera, è pari a Dall equazione di stato del gas perfetto n p V,0 0 5 Pa 0 0 RT 0 8, J mol K (,4 0 4 m ) ( 95 K) 5,7 0 mol Il volume finale può essere calcolato dall equazione di stato del gas perfetto, ricavando la pressione alla profondità di 5 m dalla legge di Stevino generalizzata: p p 0 + dgh,0 0 5 Pa + (00 kg m )(9,8 m s )(5m),5 0 5 Pa V nrt p ( 8, J mol K ) 9 K 5,7 0 mol,5 0 5 Pa 4 dm La spinta di Archimede F A d 0 gv deve almeno eguagliare il peso della massa da sollevare mg e il peso dell aria calda contenuta nella mongolfiera dgv: m d 0 gv mg + dgv V ( d d 0 ) 850 kg (,5 0,887) kg m,5 0 m La massa dell aria contenuta nella mongolfiera è pari a M Vd (,5 0 m )(0,887 kg m ), 0 kg e il numero n di moli è n M, 0 kg M mol 0,0896 kg mol 7,66 04 mol p 0,0 atm,0 0 5 Pa r, 0 m V 0 V 0 4 π r 4 (,4) (, 0 m),4 0 4 m 5,6 0 5 m 8 Zanichelli 05
19 p i nrt 9 K (,5 mol ) 8, J mol K 0,90 atm 40 0 m Δl l 0 λδt ( 0,0 m) C 4 pv 5 nrt e A 65 C N NRT n pv N N ( 6 0 mol ) 00 K N V pn A RT 0 8 Pa 8,5 J mol K ),8 0 4 m 0 4 m La trasformazione A B è isocora V B V A La trasformazione B Cè isoterma T C 650 K La trasformazione D A è isobara p D p A Dalla seconda legge di Gay-Lussac applicata alla trasformazione A B si ha Stato A Stato B Stato C Stato D p (bar),8,9,,8 T (K) V (dm ) A molecole 0 m p B p A T B,9 bar T A Dalla prima legge di Guy-Lussac applicata alla trasformazione D A V D V A T D 60 dm V C 60 dm T A Dalla legge di Boyle applicata alla trasformazione B C p C p B V B T C, bar 9 Zanichelli 05
20 Test A C A 4 C 5 D 6 B 7 A 8 C 9 D 0 A D D C 4 D 5 C 6 B 7 D 8 D 9 D 0 Zanichelli 05
Lo stato gassoso e le sue proprietà
 Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Il termoscopio. Il termoscopio è uno strumento che serve per decidere, in modo oggettivo, se un corpo è più caldo o più freddo di un altro.
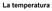 La temperatura Il termoscopio Il termoscopio è uno strumento che serve per decidere, in modo oggettivo, se un corpo è più caldo o più freddo di un altro. In quale vaschetta c è l acqua più calda? temperatura
La temperatura Il termoscopio Il termoscopio è uno strumento che serve per decidere, in modo oggettivo, se un corpo è più caldo o più freddo di un altro. In quale vaschetta c è l acqua più calda? temperatura
UNITÀ 1 La temperatura. Test
 Test 1 Quale delle seguenti affermazioni è vera? A Il termoscopio è un termometro con una scala graduata. B Il termometro è un termoscopio con la scala graduata. C Il termoscopio visualizza variazioni
Test 1 Quale delle seguenti affermazioni è vera? A Il termoscopio è un termometro con una scala graduata. B Il termometro è un termoscopio con la scala graduata. C Il termoscopio visualizza variazioni
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
GAS. Forze di legame intermolecolari ridotte Stato altamente disordinato
 I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
LE LEGGI DEI GAS. Prof. Michele Barcellona
 LE LEGGI DEI GAS Prof. Michele Barcellona STATO DI UN GAS Lo stato di un gas dipende dalle seguenti grandezze: Massa (in moli) Volume V Pressione P Temperatura T LE TRASFORMAZIONI DI UN GAS La modifica
LE LEGGI DEI GAS Prof. Michele Barcellona STATO DI UN GAS Lo stato di un gas dipende dalle seguenti grandezze: Massa (in moli) Volume V Pressione P Temperatura T LE TRASFORMAZIONI DI UN GAS La modifica
Leggi dei gas Equazione di stato dei gas perfetti
 Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
UNIVERSITÀ DEGLI STUDI DI TERAMO
 UNIVERSITÀ DEGLI STUDI DI TERAMO FACOLTÀ DI MEDICINA VETERINARIA CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di FISICA MEDICA A.A. 2015 /2016 Docente: Chiucchi Riccardo mail:rchiucchi@unite.it
UNIVERSITÀ DEGLI STUDI DI TERAMO FACOLTÀ DI MEDICINA VETERINARIA CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di FISICA MEDICA A.A. 2015 /2016 Docente: Chiucchi Riccardo mail:rchiucchi@unite.it
= cost a p costante V 1 /T 1 =V 2 /T 2 LEGGE DI GAY-LUSSAC: Un sistema allo stato gassoso è definito da 4. mmhg (torr), bar.
 GAS IDEALI Un sistema allo stato gassoso è definito da 4 parametri: OLUME () l, m 3 PRESSIONE (p) Pa, atm, mmhg (torr), bar QUANTITA DI SOSTANZA (n) mol TEMPERATURA (T) K Sperimentalmente sono state determinate
GAS IDEALI Un sistema allo stato gassoso è definito da 4 parametri: OLUME () l, m 3 PRESSIONE (p) Pa, atm, mmhg (torr), bar QUANTITA DI SOSTANZA (n) mol TEMPERATURA (T) K Sperimentalmente sono state determinate
Leggi ricavate da osservazioni sperimentali : mantenendo costante due dei 4 parametri, come variano gli altri due?
 Le leggi dei gas Lo stato gassoso è caratterizzato da mancanza di forma e volume propri, e dalla tendenza a occupare tutto il volume disponibile. Lo stato di un gas dipende da 4 parametri: Volume (V) Pressione
Le leggi dei gas Lo stato gassoso è caratterizzato da mancanza di forma e volume propri, e dalla tendenza a occupare tutto il volume disponibile. Lo stato di un gas dipende da 4 parametri: Volume (V) Pressione
Il prodotto della pressione per il volume di una determinata massa gassosa è direttamente proporzionale alla temperatura assoluta: PV = KT
 ESERCITAZIONE 5 LEGGI DEI GAS Le leggi che governano i rapporti che si stabiliscono tra massa, volume, temperatura e pressione di un gas, sono leggi limite, riferite cioè ad un comportamento ideale, cui
ESERCITAZIONE 5 LEGGI DEI GAS Le leggi che governano i rapporti che si stabiliscono tra massa, volume, temperatura e pressione di un gas, sono leggi limite, riferite cioè ad un comportamento ideale, cui
Lo stato gassoso. Particelle con volume proprio trascurabile puntiformi
 Lo stato gassoso Gas ideale (o perfetto) Particelle in movimento (casuale) Particelle con volume proprio trascurabile puntiformi Assenza di interazioni tra le particelle trasformazioni fisiche e non chimiche
Lo stato gassoso Gas ideale (o perfetto) Particelle in movimento (casuale) Particelle con volume proprio trascurabile puntiformi Assenza di interazioni tra le particelle trasformazioni fisiche e non chimiche
GAS. Forze di legame intermolecolari ridotte Stato altamente disordinato
 I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
Unità 1. La temperatura
 Unità 1 La temperatura 1. Il termometro La sensazione di caldo e di freddo è soggettiva: per renderla misurabile si usa il termoscopio. È un recipiente di vetro con tappo forato e tubicino, contenente
Unità 1 La temperatura 1. Il termometro La sensazione di caldo e di freddo è soggettiva: per renderla misurabile si usa il termoscopio. È un recipiente di vetro con tappo forato e tubicino, contenente
Lo stato gassoso. L atmosfera terrestre è il sistema gassoso in cui siamo immersi
 Lo stato gassoso L atmosfera terrestre è il sistema gassoso in cui siamo immersi I gas sono comprimibili (ampi spazi vuoti tra le particelle?) I gas si espandono facilmente riempiendo rapidamente lo spazio
Lo stato gassoso L atmosfera terrestre è il sistema gassoso in cui siamo immersi I gas sono comprimibili (ampi spazi vuoti tra le particelle?) I gas si espandono facilmente riempiendo rapidamente lo spazio
Stati di aggregazione della materia
 Stati di aggregazione della materia A seconda della natura dei legami tra gli atomi o delle forze tra le molecole si possono avere diversi stati di aggregazione della materia SOLIDO LIQUIDO GAS PLASMA
Stati di aggregazione della materia A seconda della natura dei legami tra gli atomi o delle forze tra le molecole si possono avere diversi stati di aggregazione della materia SOLIDO LIQUIDO GAS PLASMA
FISICA. Termodinamica GAS PERFETTI. Autore: prof. Pappalardo Vincenzo docente di Matematica e Fisica
 FISICA Termodinamica GAS PERFETTI Autore: prof. Pappalardo Vincenzo docente di Matematica e Fisica SISTEMI, STATI E VARIABILI TERMODINAMICHE Tutto ciò che circonda un sistema, che può influenzare e modificare
FISICA Termodinamica GAS PERFETTI Autore: prof. Pappalardo Vincenzo docente di Matematica e Fisica SISTEMI, STATI E VARIABILI TERMODINAMICHE Tutto ciò che circonda un sistema, che può influenzare e modificare
Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ
 Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ Qual è la differenza fra calore e temperatura? La temperatura dipende dallo stato di agitazione termica di un corpo; perciò è una grandezza fisica caratteristica
Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ Qual è la differenza fra calore e temperatura? La temperatura dipende dallo stato di agitazione termica di un corpo; perciò è una grandezza fisica caratteristica
T = t o (1.1) Nella scala kelvin il ghiaccio fonde a 273 K e l acqua bolle a 373 K. Un grado kelvin è uguale a un grado celsius
 Termologia. La temperatura è la grandezza fisica che misura lo stato termico di un sistema fisico (un corpo). 2. Scale termometriche. - Scala Celsius ( o C). Proposta nel 742. 0 o C è la temperatura di
Termologia. La temperatura è la grandezza fisica che misura lo stato termico di un sistema fisico (un corpo). 2. Scale termometriche. - Scala Celsius ( o C). Proposta nel 742. 0 o C è la temperatura di
L equilibrio dei gas
 L equilibrio dei gas Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura 1 L equilibrio dei gas Un gas esercita una pressione sul recipiente che
L equilibrio dei gas Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura 1 L equilibrio dei gas Un gas esercita una pressione sul recipiente che
Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più
 I Fluidi Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più comunemente forze di coesione) che caratterizzano
I Fluidi Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più comunemente forze di coesione) che caratterizzano
TEORIA CINETICA DEI GAS IDEALI
 TEORIA CINETICA DEI GAS IDEALI T R AT TO DA: I P ro b l e m i D e l l a F i s i c a - C u t n e l l, J o h n s o n, Yo u n g, S t a d l e r Z a n i c h e l l i e d i t o r e La F i s i c a di A m a l d
TEORIA CINETICA DEI GAS IDEALI T R AT TO DA: I P ro b l e m i D e l l a F i s i c a - C u t n e l l, J o h n s o n, Yo u n g, S t a d l e r Z a n i c h e l l i e d i t o r e La F i s i c a di A m a l d
PROBLEMI E QUESITI DI TERMOLOGIA (SOLUZIONI)
 1 PROBLEMI E QUESITI DI TERMOLOGIA (SOLUZIONI) Qui di seguito viene riportata la risoluzione dei problemi presentati nel file Unità omonimo (enunciati). Si raccomanda di prestare molta attenzione ai ragionamenti
1 PROBLEMI E QUESITI DI TERMOLOGIA (SOLUZIONI) Qui di seguito viene riportata la risoluzione dei problemi presentati nel file Unità omonimo (enunciati). Si raccomanda di prestare molta attenzione ai ragionamenti
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
-GAS IDEALI- Le particelle che costituiscono un gas ideale:
 -GAS IDEALI- Le particelle che costituiscono un gas ideale: sono in movimento continuo e casuale hanno un volume trascurabile rispetto al volume totale a disposizione del gas non interagiscono fra loro
-GAS IDEALI- Le particelle che costituiscono un gas ideale: sono in movimento continuo e casuale hanno un volume trascurabile rispetto al volume totale a disposizione del gas non interagiscono fra loro
PROBLEMI E QUESITI DI TERMOLOGIA (ENUNCIATI) INTRODUZIONE a cura di Nicola SANTORO
 1 PROBLEMI E QUESITI DI TERMOLOGIA (ENUNCIATI) INTRODUZIONE a cura di Nicola SANTORO I problemi ed i quesiti di Termologia che seguono sono il frutto di esperienze da me compiute principalmente nei licei
1 PROBLEMI E QUESITI DI TERMOLOGIA (ENUNCIATI) INTRODUZIONE a cura di Nicola SANTORO I problemi ed i quesiti di Termologia che seguono sono il frutto di esperienze da me compiute principalmente nei licei
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 2. La carta d identità delle sostanze SEGUI LA MAPPA descrivere atomica 1 descrivere
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 2. La carta d identità delle sostanze SEGUI LA MAPPA descrivere atomica 1 descrivere
i tre stati di aggregazione
 Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
Temperatura e Calore -temperatura -calore e calore specifico -lavoro in termodinamica -trasformazioni termodinamiche -trasformazioni di stato -energia interna 1 i tre stati di aggregazione solido Ordine
temperatura ambientale massa totale d aria contenuta nella stanza temperatura raggiunta nella stanza dalla massa d aria pressione atmosferica
 Esercizio n.21 di pagina 26. L 1 = 6 m L 2 = 8 m L 3 = 10 m t 0F = 20 F M = 28.8 kg/kmol = 28.8 g/mol m =? t 1F = 75 F p a = 1.013 10 5 Pa temperatura ambientale massa molecolare media dell aria massa
Esercizio n.21 di pagina 26. L 1 = 6 m L 2 = 8 m L 3 = 10 m t 0F = 20 F M = 28.8 kg/kmol = 28.8 g/mol m =? t 1F = 75 F p a = 1.013 10 5 Pa temperatura ambientale massa molecolare media dell aria massa
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
( 160 mol) ( 8,31 J/(mol K) ) = 600 K
 6** T A nr Trasormazione isocora: ( 10 5 Pa) ( m ) ( 160 mol) ( 8,1 J/(mol K) ) 00 K P (10 5 Pa) 4 B A 1 1 4 5 V (m ) Trasormazione isobara: P (10 5 Pa) 4 A B 1 1 4 5 V (m ) Sì, poiché i due stati B e
6** T A nr Trasormazione isocora: ( 10 5 Pa) ( m ) ( 160 mol) ( 8,1 J/(mol K) ) 00 K P (10 5 Pa) 4 B A 1 1 4 5 V (m ) Trasormazione isobara: P (10 5 Pa) 4 A B 1 1 4 5 V (m ) Sì, poiché i due stati B e
Liceo Scientifico Statale Severi Salerno
 Liceo Scientifico Statale Severi Salerno VERIFICA SCRITTA DI FISICA Docente: Pappalardo Vincenzo Data: 08//208 Classe: 4D. Esercizio Una massa di piombo di 2 kg alla temperatura iniziale di 00 C viene
Liceo Scientifico Statale Severi Salerno VERIFICA SCRITTA DI FISICA Docente: Pappalardo Vincenzo Data: 08//208 Classe: 4D. Esercizio Una massa di piombo di 2 kg alla temperatura iniziale di 00 C viene
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
La temperatura e il calore
 La temperatura e il calore Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti nel nostro laboratorio Questo simbolo significa che l esperimento si può realizzare
La temperatura e il calore Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti nel nostro laboratorio Questo simbolo significa che l esperimento si può realizzare
Esercitazione 7. Soluzione. Il sistema è isolato, quindi l energia totale si conserva. Applicando il primo principio della termodinamica si ottiene:
 Esercitazione 7 Esercizio 1 Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 di acqua a 80 C. Quale sarà, all
Esercitazione 7 Esercizio 1 Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 di acqua a 80 C. Quale sarà, all
SISTEMA TERMODINAMICO STATO TERMODINAMICO
 SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
ATOMI E MOLECOLE. ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche.
 1 ATOMI E MOLECOLE ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche. SIMBOLO ATOMICO= 1 o 2 lettere che identificano elemento A= numero di massa (protoni+neutroni) Z=
1 ATOMI E MOLECOLE ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche. SIMBOLO ATOMICO= 1 o 2 lettere che identificano elemento A= numero di massa (protoni+neutroni) Z=
CAPITOLO 22 IL PRIMO PRINCIPIO DELLA TERMODINAMICA
 Problemi)di)paragrafo) 1) La temperatura rimane costante e il volume a disposizione dell aria diminuisce. Quindi la velocità media delle molecole non varia, ma le molecole impiegano meno tempo a percorrere
Problemi)di)paragrafo) 1) La temperatura rimane costante e il volume a disposizione dell aria diminuisce. Quindi la velocità media delle molecole non varia, ma le molecole impiegano meno tempo a percorrere
Lo stato gassoso gas. Caratteristiche dello stato gassoso. liquido. solido. assenza di volume proprio forma fluida
 Lo stato gassoso gas liquido solido assenza di volume proprio forma fluida Caratteristiche dello stato gassoso Capacità di occupare tutto lo spazio a disposizione Distanze molto grandi tra le particelle
Lo stato gassoso gas liquido solido assenza di volume proprio forma fluida Caratteristiche dello stato gassoso Capacità di occupare tutto lo spazio a disposizione Distanze molto grandi tra le particelle
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
Temperatura. Il legame con le grandezze microscopiche è di tipo statistico. Pressione Volume Temperatura
 Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
La temperatura. La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso
 1 La temperatura La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso Qualunque sia lo stato di aggregazione, le particelle (molecole o atomi) di cui è fatta
1 La temperatura La materia può trovarsi in tre stati diversi di aggregazione diversi: solido, liquido e gassoso Qualunque sia lo stato di aggregazione, le particelle (molecole o atomi) di cui è fatta
1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido.
 UNITÀ 8 LA MECCANICA DEI FLUIDI 1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido. 3. La pressione atmosferica. 4. La legge di Stevino. 5. La legge di Pascal. 6. La forza di Archimede.
UNITÀ 8 LA MECCANICA DEI FLUIDI 1. I fluidi e le loro caratteristiche. 2. La pressione in un fluido. 3. La pressione atmosferica. 4. La legge di Stevino. 5. La legge di Pascal. 6. La forza di Archimede.
Liceo Scientifico Statale Severi Salerno
 Liceo Scientifico Statale Severi Salerno VERIFICA SCRITTA DI FISICA Docente: Pappalardo Vincenzo Data: 08/11/2018 Classe: 4D 1. Esercizio Una massa di ghiaccio di 50g e alla temperatura di 0 C viene posta
Liceo Scientifico Statale Severi Salerno VERIFICA SCRITTA DI FISICA Docente: Pappalardo Vincenzo Data: 08/11/2018 Classe: 4D 1. Esercizio Una massa di ghiaccio di 50g e alla temperatura di 0 C viene posta
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3 1 GLI STATI DI AGGREGAZIONE DELLA MATERIA 2 I composti chimici
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3 1 GLI STATI DI AGGREGAZIONE DELLA MATERIA 2 I composti chimici
I gas. ChimicaGenerale_lezione10
 I gas Nel 1630 fu usato per la prima volta il termine gas: Van Helmont che lo inventò, pensava però che non fosse possibile contenere un gas in un recipiente, perché aveva una natura e una composizione
I gas Nel 1630 fu usato per la prima volta il termine gas: Van Helmont che lo inventò, pensava però che non fosse possibile contenere un gas in un recipiente, perché aveva una natura e una composizione
GAS IDEALI E REALI. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche:
 GAS IDEALI E REALI Gas ideale. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche: - non ha forma, ne volume proprio; - e comprimibile.
GAS IDEALI E REALI Gas ideale. Prendiamo ora in considerazione un sistema particolare termodinamico: il gas. Un gas è un fluido con le seguenti caratteristiche: - non ha forma, ne volume proprio; - e comprimibile.
Soluzioni degli esercizi
 Soluzioni degli esercizi Compito 1. Formula risolutiva: Q = (Q 1 +Q 2 +Q 3 +Q 4 +Q 5 )/5 Valor medio della quantità di calore = 0.556E+02 J Formula risolutiva: C = Q/ΔT con ΔT = variazione temperatura
Soluzioni degli esercizi Compito 1. Formula risolutiva: Q = (Q 1 +Q 2 +Q 3 +Q 4 +Q 5 )/5 Valor medio della quantità di calore = 0.556E+02 J Formula risolutiva: C = Q/ΔT con ΔT = variazione temperatura
2 Una sbarra ha l 0: se la sua varia di t, la diviene l = l 0 (1 + λ t), dove λ è una costante, detta coefficiente di, che dipende dal materiale.
 I concetti fondamentali 1 Nel Sistema Internazionale l unità di misura per la temperatura è il In questa scala, detta scala assoluta, la variazione di 1 è identica a quella di 1 Però la temperatura del
I concetti fondamentali 1 Nel Sistema Internazionale l unità di misura per la temperatura è il In questa scala, detta scala assoluta, la variazione di 1 è identica a quella di 1 Però la temperatura del
TERMOLOGIA & TERMODINAMICA I
 TERMOLOGIA & TERMODINAMICA I 1 Meccanica: studia il moto dei corpi e le cause che lo genera Grandezze meccaniche: massa, velocità, accelerazione, forza, energia Struttura atomica dei gas: particelle tutte
TERMOLOGIA & TERMODINAMICA I 1 Meccanica: studia il moto dei corpi e le cause che lo genera Grandezze meccaniche: massa, velocità, accelerazione, forza, energia Struttura atomica dei gas: particelle tutte
TERMOLOGIA esercizi risolti Classi quarte L.S.
 TERMOLOGIA esercizi risolti Classi quarte L.S. In questa dispensa verrà riportato lo svolgimento di alcuni esercizi inerenti la termologia e le leggi dei gas. Riprendiamo alcuni concetti utili. Temperatura
TERMOLOGIA esercizi risolti Classi quarte L.S. In questa dispensa verrà riportato lo svolgimento di alcuni esercizi inerenti la termologia e le leggi dei gas. Riprendiamo alcuni concetti utili. Temperatura
VIII ESERCITAZIONE. Soluzione
 VIII ESERCITAZIONE 1. Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 d di acqua a 80 C. Quale sarà, all equilibrio,
VIII ESERCITAZIONE 1. Una massa m g = 20 g di ghiaccio a 0 C è contenuta in un recipiente termicamente isolato. Successivamente viene aggiunta una massa m a = 80 d di acqua a 80 C. Quale sarà, all equilibrio,
Stati di aggregazione della materia. dal microscopico al macroscopico: struttura. interazioni GASSOSO. proprietà SOLIDO LIQUIDO
 Stati di aggregazione della materia GASSOSO dal microscopico al macroscopico: struttura interazioni proprietà SOLIDO LIQUIDO Lo stato gassoso È uno dei tre stati di aggregazione della materia, caratterizzato
Stati di aggregazione della materia GASSOSO dal microscopico al macroscopico: struttura interazioni proprietà SOLIDO LIQUIDO Lo stato gassoso È uno dei tre stati di aggregazione della materia, caratterizzato
LA MATERIA ED I SUOI STATI
 LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
Solidi, liquidi e gas. 0 In natura le sostanze possono trovarsi in tre stati di aggregazione:
 Solidi, liquidi e gas 0 In natura le sostanze possono trovarsi in tre stati di aggregazione: Caratteristiche di un fluido FLUIDO sostanza senza forma propria (assume la forma del recipiente che la contiene)
Solidi, liquidi e gas 0 In natura le sostanze possono trovarsi in tre stati di aggregazione: Caratteristiche di un fluido FLUIDO sostanza senza forma propria (assume la forma del recipiente che la contiene)
Università degli Studi di Firenze Facoltà di Scienze Mat., Fis. e Nat. Corso di Laurea in Matematica
 Università degli Studi di Firenze Facoltà di Scienze Mat., Fis. e Nat. Corso di Laurea in Matematica Appunti del corso di Laboratorio di Fisica 1 Anno Accademico 2008-2009 Prof. Andrea Stefanini Appunti
Università degli Studi di Firenze Facoltà di Scienze Mat., Fis. e Nat. Corso di Laurea in Matematica Appunti del corso di Laboratorio di Fisica 1 Anno Accademico 2008-2009 Prof. Andrea Stefanini Appunti
Le trasformazioni principali. Marina Cobal - Dipt.di Fisica - Universita' di Udine 1
 Le trasformazioni principali Universita' di Udine 1 Trasformazioni notevoli: un elenco Le trasformazioni reversibili sono evidentemente infinite Hanno molta importanza alcune trasformazioni fondamentali
Le trasformazioni principali Universita' di Udine 1 Trasformazioni notevoli: un elenco Le trasformazioni reversibili sono evidentemente infinite Hanno molta importanza alcune trasformazioni fondamentali
 http://www.fis.unipr.it/corsi/fisicacing/cinformatica/ Da compilare dal 15/10/06 in poi Termodinamica Temperatura e Calore I Principio della Termodinamica Teoria cinetica dei gas II Principio della
http://www.fis.unipr.it/corsi/fisicacing/cinformatica/ Da compilare dal 15/10/06 in poi Termodinamica Temperatura e Calore I Principio della Termodinamica Teoria cinetica dei gas II Principio della
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
STATO GASSOSO. parte I a. - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio
 STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
Calore, lavoro e trasformazioni termodinamiche (1)
 Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
STATICA DEI FLUIDI. 3 ) fino ad una distanza di 5 cm dall orlo. Nei due rami del
 SCHEDA PER IL RECUPERO DI FISICA DEL PRIMO PERIODO anno scolastico 2014-15 STATICA DEI FLUIDI Pressione Leggi il libro di testo (vol. 1) al cap. 11, prova a rispondere alle domande della scheda di verifica
SCHEDA PER IL RECUPERO DI FISICA DEL PRIMO PERIODO anno scolastico 2014-15 STATICA DEI FLUIDI Pressione Leggi il libro di testo (vol. 1) al cap. 11, prova a rispondere alle domande della scheda di verifica
Calore e Temperatura
 PROGETTO POTENZIAMENTO DEL LABORATORIO DI FISICA LEZIONI ATTIVE Calore e Temperatura PREREQUISITO Ripetiamo il concetto di ENERGIA DEFINIZIONE TIPOLOGIE TRASFORMAZIONE DISPONIBILITA E CONSUMO FORZE DISSIPATIVE
PROGETTO POTENZIAMENTO DEL LABORATORIO DI FISICA LEZIONI ATTIVE Calore e Temperatura PREREQUISITO Ripetiamo il concetto di ENERGIA DEFINIZIONE TIPOLOGIE TRASFORMAZIONE DISPONIBILITA E CONSUMO FORZE DISSIPATIVE
LICEO CLASSICO VITTORIO EMANUELE II
 LICEO CLASSICO VITTORIO EMANUELE II Via San Sebastiano, 51 NAPOLI Classe 2 Liceo Sezione C P r o f. s s a D a n i e l a S o l P r o g r a m m a d i F i s i c a s v o l t o n e l l a. s. 2 0 1 5 / 2 0 1
LICEO CLASSICO VITTORIO EMANUELE II Via San Sebastiano, 51 NAPOLI Classe 2 Liceo Sezione C P r o f. s s a D a n i e l a S o l P r o g r a m m a d i F i s i c a s v o l t o n e l l a. s. 2 0 1 5 / 2 0 1
Sistemi Gassosi. GAS = specie che occupa tutto lo spazio disponibile. VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 )
 Sistemi Gassosi GAS = specie che occupa tutto lo spazio disponibile VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 ) PRESSIONE = forza per unità di superficie Unità di misura: Forza Newton (N)
Sistemi Gassosi GAS = specie che occupa tutto lo spazio disponibile VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 ) PRESSIONE = forza per unità di superficie Unità di misura: Forza Newton (N)
Applicando al pistone una forza esterna, si esercita una pressione p ext sul fluido immediatamente sottostante al pistone.
 IL PRINCIPIO DI PASCAL Consideriamo un fluido incomprimibile come in figura contenuto in un cilindro chiuso superiormente da un pistone. Applicando al pistone una forza esterna, si esercita una pressione
IL PRINCIPIO DI PASCAL Consideriamo un fluido incomprimibile come in figura contenuto in un cilindro chiuso superiormente da un pistone. Applicando al pistone una forza esterna, si esercita una pressione
STATICA DEI FLUIDI G. ROBERTI
 STATICA DEI FLUIDI G. ROBERTI FLUIDI G. Roberti Definizione:sostanze che assumono la forma dei recipienti che le contengono oppure Definizione: sostanze che si deformano senza che si compia lavoro ΔV /
STATICA DEI FLUIDI G. ROBERTI FLUIDI G. Roberti Definizione:sostanze che assumono la forma dei recipienti che le contengono oppure Definizione: sostanze che si deformano senza che si compia lavoro ΔV /
CdL Professioni Sanitarie A.A. 2012/2013. Unità 9: Gas e processi di diffusione
 L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
L. Zampieri Fisica per CdL Professioni Sanitarie A.A. 12/13 CdL Professioni Sanitarie A.A. 2012/2013 Gas Unità 9: Gas e processi di diffusione Equazione di stato dei gas perfetti Trasformazioni termodinamiche
Meccanica dei Fluidi. stati di aggregazione della materia: solidi liquidi gas. fluidi assumono la forma del contenitore
 Meccanica dei luidi stati di aggregazione della materia: solidi liquidi gas fluidi assumono la forma del contenitore Caratteristiche di un fluido LUIDO sostanza senza forma propria (assume la forma del
Meccanica dei luidi stati di aggregazione della materia: solidi liquidi gas fluidi assumono la forma del contenitore Caratteristiche di un fluido LUIDO sostanza senza forma propria (assume la forma del
Lezione 9. Statica dei fluidi
 Lezione 9 Statica dei fluidi Meccanica dei fluidi Un fluido e un corpo che non ha una forma definita, ma che, se e contenuto da un contenitore solido, tende a occupare (riempire) una parte o tutto il volume
Lezione 9 Statica dei fluidi Meccanica dei fluidi Un fluido e un corpo che non ha una forma definita, ma che, se e contenuto da un contenitore solido, tende a occupare (riempire) una parte o tutto il volume
La temperatura e il calore. Documento riadattato da MyZanichelli.it Isabella Soletta Febbraio 2012 Parte 1/3
 La temperatura e il calore Documento riadattato da MyZanichelli.it Isabella Soletta Febbraio 2012 Parte 1/3 Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti
La temperatura e il calore Documento riadattato da MyZanichelli.it Isabella Soletta Febbraio 2012 Parte 1/3 Questo simbolo significa che l esperimento si può realizzare con materiali o strumenti presenti
Termodinamica. include: traslazionale, rotazionale e vibrazionale di atomi e molecole. mondo macroscopico [oggetti complessi esseri viventi]
![Termodinamica. include: traslazionale, rotazionale e vibrazionale di atomi e molecole. mondo macroscopico [oggetti complessi esseri viventi] Termodinamica. include: traslazionale, rotazionale e vibrazionale di atomi e molecole. mondo macroscopico [oggetti complessi esseri viventi]](/thumbs/92/109342364.jpg) ermodinamica studio delle trasformazioni reciproche di energia: Ø energia meccanica [lavoro, energia cinetica e potenziale] Ø energia interna-termica [forma disordinata di energia, moto molecole] E int
ermodinamica studio delle trasformazioni reciproche di energia: Ø energia meccanica [lavoro, energia cinetica e potenziale] Ø energia interna-termica [forma disordinata di energia, moto molecole] E int
Termodinamica Chimica
 Universita degli Studi dell Insubria Termodinamica Chimica I Gas Ideali dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini Proprietà di un Gas Può essere compresso facilmente Esercita
Universita degli Studi dell Insubria Termodinamica Chimica I Gas Ideali dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini Proprietà di un Gas Può essere compresso facilmente Esercita
SCALA TERMOMETRICA CELSIUS
 TERMOLOGIA TEMPERATURA LA TEMPERATURA E UN INDICE DELLA SENSAZIONE FISIOLOGICA DI CALDO/FREDDO. A LIVELLO MICROSCOPICO E INDICE DELLO STATO DI AGITAZIONE TERMICA MOLECOLARE, ESSENDO PROPORZIONALE ALLA
TERMOLOGIA TEMPERATURA LA TEMPERATURA E UN INDICE DELLA SENSAZIONE FISIOLOGICA DI CALDO/FREDDO. A LIVELLO MICROSCOPICO E INDICE DELLO STATO DI AGITAZIONE TERMICA MOLECOLARE, ESSENDO PROPORZIONALE ALLA
1 I gas perfetti COORDINATE TERMODINAMICHE
 Durante un viaggio può capitare di vedere i pezzi di un pneumatico esploso. Succede più spesso d estate o d inverno? Secondo te qual è la causa dell esplosione? Quando l aria contenuta in un pneumatico
Durante un viaggio può capitare di vedere i pezzi di un pneumatico esploso. Succede più spesso d estate o d inverno? Secondo te qual è la causa dell esplosione? Quando l aria contenuta in un pneumatico
TERMOLOGIA CALORE TEMPERATURA DILATAZIONE TERMICA
 CALORE TEMPERATURA DILATAZIONE TERMICA L impulso degli studi della termologia si sono avuti negli ultimi tre secoli. Anders Celsius e William Thomson Kelvin, sono due fisici a cui sono dovute le proposte
CALORE TEMPERATURA DILATAZIONE TERMICA L impulso degli studi della termologia si sono avuti negli ultimi tre secoli. Anders Celsius e William Thomson Kelvin, sono due fisici a cui sono dovute le proposte
Stati d aggregazione della materia
 Stati d aggregazione della materia SOLIDO: Forma e volume propri. GASSOSO: Forma e volume del recipiente in cui è contenuto. LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. Parametri
Stati d aggregazione della materia SOLIDO: Forma e volume propri. GASSOSO: Forma e volume del recipiente in cui è contenuto. LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. Parametri
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica. FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti. Esercitazione del 26/10/2010
 CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti Esercitazione del 6/0/00 ARGOMENTI TRATTATI DURANTE LA LEZIONE Equazione di stato dei
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti Esercitazione del 6/0/00 ARGOMENTI TRATTATI DURANTE LA LEZIONE Equazione di stato dei
Gas. Vapore. Forma e volume del recipiente in cui è contenuto. un gas liquido a temperatura e pressione ambiente. microscopico MACROSCOPICO
 Lo Stato Gassoso Gas Vapore Forma e volume del recipiente in cui è contenuto. un gas liquido a temperatura e pressione ambiente MACROSCOPICO microscopico bassa densità molto comprimibile distribuzione
Lo Stato Gassoso Gas Vapore Forma e volume del recipiente in cui è contenuto. un gas liquido a temperatura e pressione ambiente MACROSCOPICO microscopico bassa densità molto comprimibile distribuzione
Liceo Scientifico Statale Severi Salerno
 Liceo Scientifico Statale Seeri Salerno VERIFICA SCRITTA DI FISICA Docente: Pappalardo Vincenzo Data: 8/05/09 Classe: 3B. Esercizio Una massa di ghiaccio di 50g e alla temperatura di 0 C iene posta in
Liceo Scientifico Statale Seeri Salerno VERIFICA SCRITTA DI FISICA Docente: Pappalardo Vincenzo Data: 8/05/09 Classe: 3B. Esercizio Una massa di ghiaccio di 50g e alla temperatura di 0 C iene posta in
1.Pressione di un Gas
 1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
Il Gas Ideale. Il gas ideale é un'astrazione
 Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
Problemi e domande d esame tratte dalle prove di accertamento in itinere degli anni precedenti
 Problemi e domande d esame tratte dalle prove di accertamento in itinere degli anni precedenti Problema 1 Un disco omogeneo di massa m=2 kg e raggio R= 0.3 m ruota in un piano orizzontale intorno all asse
Problemi e domande d esame tratte dalle prove di accertamento in itinere degli anni precedenti Problema 1 Un disco omogeneo di massa m=2 kg e raggio R= 0.3 m ruota in un piano orizzontale intorno all asse
10. LA MISURA DELLA TEMPERATURA
 1. LA MISURA DELLA TEMPERATURA 1.1 L organizzazione della materia Tutte le sostanze sono composte da atomi. Quando due o più atomi si legano assieme formano molecole. Atomi o molecole sono le unità (particelle)
1. LA MISURA DELLA TEMPERATURA 1.1 L organizzazione della materia Tutte le sostanze sono composte da atomi. Quando due o più atomi si legano assieme formano molecole. Atomi o molecole sono le unità (particelle)
Il primo principio della termodinamica
 1 Il primo principio della termodinamica Il primo principio della termodinamica Nelle lezioni precedenti abbiamo visto che per far innalzare la temperatura di un sistema vi sono due possibilità: fornendo
1 Il primo principio della termodinamica Il primo principio della termodinamica Nelle lezioni precedenti abbiamo visto che per far innalzare la temperatura di un sistema vi sono due possibilità: fornendo
Termoscopio di Galileo Sfrutta la dilatazione termica dell aria contenuta al suo interno.
 Danno informazioni sullo stato termico di un corpo (ma non ne misurano la temperatura): a contatto con esso, assumono la sua stessa temperatura (si dice che raggiungono l equilibrio termico). Termoscopio
Danno informazioni sullo stato termico di un corpo (ma non ne misurano la temperatura): a contatto con esso, assumono la sua stessa temperatura (si dice che raggiungono l equilibrio termico). Termoscopio
Un po di storia. Nel 1600 (Galilei muore nel 1642) si capisce che i gas non sono eterei. Si studiano nel contempo i fenomeni termici
 Temperatura 1 Un po di storia Nel 1600 (Galilei muore nel 1642) si capisce che i gas non sono eterei Torricelli (1608-1647) crea il vuoto Newton diceva che non poteva esistere in Natura Si studiano nel
Temperatura 1 Un po di storia Nel 1600 (Galilei muore nel 1642) si capisce che i gas non sono eterei Torricelli (1608-1647) crea il vuoto Newton diceva che non poteva esistere in Natura Si studiano nel
1-Sia un gas a t = -100 C ed alla pressione P= 10 atm.calcolare la pressione se la temperatura viene portata a 20 C.
 http://www. I GAS : ESERCIZI 1-Sia un gas a t = -100 C ed alla pressione P= 10 atm.calcolare la pressione se la temperatura viene portata a 20 C. da quanto espresso si evince che il numero di moli è costante
http://www. I GAS : ESERCIZI 1-Sia un gas a t = -100 C ed alla pressione P= 10 atm.calcolare la pressione se la temperatura viene portata a 20 C. da quanto espresso si evince che il numero di moli è costante
Calorimetria. Principio zero Trasformazioni termodinamiche Lavoro termodinamico
 Calorimetria Principio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una particella è definito quando per ogni istante siano note, la posizione (x,
Calorimetria Principio zero Trasformazioni termodinamiche Lavoro termodinamico Stato di un sistema In Meccanica: lo stato di una particella è definito quando per ogni istante siano note, la posizione (x,
Meccanica dei fluidi (1) Statica dei fluidi Lezione 10, 6/11/2018, JW
 Meccanica dei fluidi (1) Statica dei fluidi Lezione 10, 6/11/2018, JW 14.1-14.5 1 Fluidi Sostanza che può scorrere Prende la forma del contenitore nel quale è confinata non sempre immediatamente, e.g.
Meccanica dei fluidi (1) Statica dei fluidi Lezione 10, 6/11/2018, JW 14.1-14.5 1 Fluidi Sostanza che può scorrere Prende la forma del contenitore nel quale è confinata non sempre immediatamente, e.g.
COS E IL TERMOMETRO?
 COS E IL TERMOMETRO? O Un termometro è uno strumento di misura atto a misurare la temperatura, oppure le variazioni di temperatura. A seconda della proprietà usata i termometri sfruttano il principio zero
COS E IL TERMOMETRO? O Un termometro è uno strumento di misura atto a misurare la temperatura, oppure le variazioni di temperatura. A seconda della proprietà usata i termometri sfruttano il principio zero
Statica dei fluidi & Termodinamica: I principio, gas perfetti e trasformazioni, calore
 Statica dei fluidi & Termodinamica: I principio, gas perfetti e trasformazioni, calore Legge di Stevino La pressione in un liquido a densità costante cresce linearmente con la profondità Il principio di
Statica dei fluidi & Termodinamica: I principio, gas perfetti e trasformazioni, calore Legge di Stevino La pressione in un liquido a densità costante cresce linearmente con la profondità Il principio di
1) Che cos é la pressione? Qual è la sua unità di misura nel S.I.?
 1) Che cos é la pressione? Qual è la sua unità di misura nel S.I.? 2) Da che cosa dipende la pressione esercitata da un oggetto di massa m poggiato su di una superficie? 3) Che cos è un fluido? 4) Come
1) Che cos é la pressione? Qual è la sua unità di misura nel S.I.? 2) Da che cosa dipende la pressione esercitata da un oggetto di massa m poggiato su di una superficie? 3) Che cos è un fluido? 4) Come
Lez 14 16/11/2016. Lezioni in didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617
 Lez 14 16/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Esperienza di Joule E. Fiandrini Fis. Sper. e 2 Esperienza di Joule
Lez 14 16/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Esperienza di Joule E. Fiandrini Fis. Sper. e 2 Esperienza di Joule
