I - < Br - < S 2- < SCN - <Cl - < F - < UREA, OH - < ox, O 2- < H 2 O < NCS - < py < NH 3 < en < bpy, phen < NO 2- < CN - < CO.
|
|
|
- Lucio Valle
- 4 anni fa
- Visualizzazioni
Transcript
1 I - < Br - < S 2- < SCN - <Cl - < F - < UREA, OH - < ox, O 2- < H 2 O < NCS - < py < NH 3 < en < bpy, phen < NO 2- < CN - < CO Forza del legante
2 Caso di complessi d n Quanti assorbimenti ci sono nello spettro elettronico? Lo spettro mostra più bande di assorbimento, perché quando c è più di un elettrone d ci sono repulsioni elettroneelettrone da considerare. L energia delle bande non dipende solo dal D o (anche da repulsioni e - -e - ) Dallo spettro non si può direttamente ottenere il Do d 2
3 Cr 3+ è un d 3 CrL 6 Do = E = hn 1 (a)[cr(en) 3 ] 3+ (b)[cr(ox) 3 ] (c)[crf 6 ] 3- I - < Br - < S 2- < SCN - <Cl - < F - < UREA, OH - < ox, O 2- < H 2 O < NCS - < py < NH 3 < en < bpy, phen < NO 2- < CN - < CO (a) (b) Aumento progressivo della frequenza n 1 passando da atomo donatore F a O a N. (c )
4 Fattori che influenzano il D o Stato di ossidazione del metallo natura dello ione metallico Natura del legante Numero e geometria dei leganti
5 Stato di ossidazione dello ione metallico La grandezza di D o aumenta con l aumentare della carica ionica sullo ione metallico centrale. complesso Stato ossidazione D o (cm -1 ) [CrF 6 ] [CrF 6 ] [Fe(CN) 6 ] [Fe(CN) 6 ] [Ru(H 2 O) 6 ] Metallo con elevata carica (elevato stato di ossidazione) trattiene più fortemente gli elettroni rimasti. Interazioni degli elettroni negli orbitali d del metallo con leganti in campo ottaedrico sono più forti e lo splitting D o è maggiore. Lunghezze di legame metallo-legante nel complesso diminuiscono all aumentare dello stato di ossidazione. Ciò ha implicazioni pratiche Cr(III)-L legame più corto di Cr(II)-L [Ru(H 2 O) 6 ] Tabella 11.6 Huheey pag 422
6 Fattori che influenzano il D o Stato di ossidazione del metallo Natura dello ione metallico Natura del legante Numero e geometria dei leganti
7 Natura dello ione metallico d 6 basso spin d 6 alto spin CFSE = (0.4 x 6)Do 3P = 2.4 Do 3P CFSE = (0.4 x 4 0.6x 2)Do P = 0,4Do P
8 Natura dello ione metallico 4d 5d Legame metallo-legante aumenta di forza all aumentare delle dimensioni dell orbitale d del metallo. La forza di un legame dipende dalla sovrapposizione degli orbitali. 3d Scendendo lungo un gruppo il D o aumenta. [M(NH 3 ) 6 ] 3+ M=Co, Rh, Ir Complessi preferiscono configurazioni a basso spin quando i metalli sono di 2 a e 3 a serie di transizione A parità di stato di ossidazione del metallo e a parità di leganti
9 Una componente importante di P è la repulsione coulombiana tra gli elettroni quando vengono accoppiati. All aumentare delle dimensioni dell orbitale, la repulsione tra gli elettroni accoppiati decresce Huheey pag 417 La grandezza di questo contributo decresce scendendo lungo un gruppo (cioè all aumentare di n). I complessi con ioni metallici della seconda e terza serie di transizione tenderanno allo stato di basso spin
10 L altro termine da considerare di P è la perdita dell energia di scambio quando si appaia. Elettroni con spin parallelo si «evitano» e si schermano di meno tra loro nei confronti del nucleo. Pertanto l attrazione elettrone-nucleo è maggiore. A ciò è dovuta l extra stabilità delle configurazioni a spin parallelo. Nei complessi la configurazione d 5 ha la massima perdita di energia di scambio quando si costringe ad appaiare. Spesso quindi i complessi di ioni metallici d 5 sono ad alto spin. Per seconda e terza serie di transizione questo fattore è meno importante rispetto alla prima
11 n Complesso Stato di ossidazione del metallo Do (cm -1 ) [CoF 6 ] [RhF 6 ] [IrF 6 ] Complesso Stato di ossidazione del metallo Do (cm -1 ) [Co(NH 3 ) 6 ] [Rh(NH 3 ) 6 ] [Ir(NH 3 ) 6 ] Ci si muove SOLO scendendo un gruppo A parità di stato di ossidazione A parità di natura dei leganti n Complesso Stato di ossidazione del metallo Do (cm -1 ) [Fe(H 2 O) 6 ] [Ru(H 2 O) 6 ] Tabella 11.6 Huheey pag 422
12
13 Fattori che influenzano il D Stato di ossidazione del metallo natura dello ione metallico Natura del legante: serie spettrochimica Numero e geometria dei leganti
14 Geometria tetraedrica z x y I leganti giacciono sui vertici del cubo che contiene il tetraedro. Gli assi x,y,z intercettano il centro delle facce del cubo
15 I leganti non si avvicinano direttamente ad alcun orbitale d del metallo Sono più vicini agli orbitali t 2 che hanno i lobi lungo le bisettrici e sono diretti verso gli spigoli del cubo che agli e che sono diretti verso i centri delle facce.
16 Campo dei leganti di simmetria tetraedrica conservazione dell energia totale: energia media è costante (0.4x3)D T = 1.2D T Schema di energia è inverso rispetto a quello ottaedrico (-0.6x2)D T = -1.2D T
17 Contrariamente al caso della simmetria ottaedrica non si tiene conto mai di P (energia di appaiamento). Perché?
18 D T ~ 4 / 9 D O 1) Il numero di leganti è 4 e non 6 2) Nessun orbitale d punta direttamente verso i leganti Essendo il D T più basso rispetto al D o i complessi tetraedrici sono sempre e solo ad alto spin (D t < P)
19 Geometria piano-quadrata Huheey: pag 419 Geometria pianoquadrata è un caso limite della distorsione tetragonale
20 Geometria piano-quadrata x 2 -y 2 e g x 2 -y 2 z 2 D Favorita da ioni metallici con configurazione d 8. Se il campo è forte lo splitting compensa gli svantaggi sterici e anche Ni(II) diventa piano quadrato xy xy Pd(II), Pt(II) sempre piano quadrati t 2g z 2 xz, yz d 8 : d 2 zyd 2 zxd 2 z 2d2 xy xz, yz D dipende dalla forza del legante Allontanamento dei leganti z
21 I composti alogenati dei metalli 3d sono tutti tetraedrici (ad es. NiCl 4 2- ) perché ad esempio cloruro è ingombrante e a campo debole. Complessi di Ni 2+ con leganti a campo molto forte sono piano quadrati, come ad es. Ni(CN) 4 2- (d x2-y2 è destabilizzato molto, finchè sta vuoto di elettroni la geometria è la piano quadrata) d 8 paramagnetico diamagnetico
22 Applicazioni della Teoria del Campo Cristallino Pur non essendo un modello reale interpreta le proprietà ottiche e magnetiche dei composti di coordinazione e anche alcune proprietà termodinamiche. Ad esempio : 1) l andamento delle energie di idratazione della prima riga di transizione del blocco d: M H 2 O [M(H 2 O) 6 ] 2+ DH idr cresce col diminuire del raggio ionico (da Ca Mn Zn) LFSE Andamento tipico a campana
23 Energie reticolari di MX 2 Da Ca (II) a Zn(II)ci si aspetta una graduale crescita della energia reticolare derivante dalla diminuzione del raggio ionico. In realtà, mentre per gli ioni Ca (II)I (d 0 ), Mn (II) (d 5 campo debole) e Zn (II) (d 10 ) l andamento è quasi rettilineo (CFSE = 0), per gli altri ioni vi sono deviazioni
24 2) Stabilità degli stati di ossidazione: influenza di CFSE sul potenziale redox di una coppia FORZA DEL LEGANTE Potenziale di riduzione diminuisce [Co(H 2 O) 6 ] 3+ + e - [Co(H 2 O) 6 ] 2+ E 0 = V Co(II) stabile [Co(phen) 3 ] 3+ + e - [Co(phen) 3 ] 2+ E 0 = V [Co(NH 3 ) 6 ] 3+ + e - [Co(NH 3 ) 6 ] 2+ E 0 = V Co(III) stabile [Co(CN) 6 ] 3+ + H 2 O + e - [Co(CN) 5 H 2 O] 2+ + CN - E 0 = V Co(II) d 7 : stabilità di Co(III) che è un d 6 dipende da CFSE quindi dalla forza del legante
25 HS Co (II) LS Co (II) LS Co (III) E e g e g t 2g t 2g stato intermedio HS: 0,8 Do 1,8 Do 2,4 Do
26 Limiti della Teoria del Campo Cristallino La serie spettrochimica dei leganti è una serie puramente sperimentale e il modello CFT non riesce a spiegarlo e il comportamento dei leganti è indipendente dal metallo I leganti anionici (I - ) sono a campo debole: lo splitting d-d non deriva da semplici interazioni tra cariche puntiformi. OH - < H 2 O <.NH 3 anche se NH3 < H2O (momento dipolare). Discutere il legame in termini di interazioni elettrostatiche distorce la realtà. Occorre tenere in considerazione il contributo covalente tra metallo e legante.
Chimica Inorganica Biologica Composti di coordinazione. Simmetria Ottaedrica
 Simmetria Ottaedrica Simmetria Ottaedrica Simmetria Ottaedrica L E media degli orbitali d rimane invariata Δ O = 10 Dq [Ti(H 2 O) 6 ] 3+ Ti 3+ d 1 Simmetria Ottaedrica Δ o Δ ο = hν 20300cm 1 Simmetria
Simmetria Ottaedrica Simmetria Ottaedrica Simmetria Ottaedrica L E media degli orbitali d rimane invariata Δ O = 10 Dq [Ti(H 2 O) 6 ] 3+ Ti 3+ d 1 Simmetria Ottaedrica Δ o Δ ο = hν 20300cm 1 Simmetria
Elettroni del metallo negli orbitali d
 Elettroni del metallo negli orbitali d Complessi ottaedrici i primi 3 elettroni entrano nei 3 orbitali t 2g, secondo la regola di Hund il quarto elettrone ha due possibilità: entrare in un orbitale e g,
Elettroni del metallo negli orbitali d Complessi ottaedrici i primi 3 elettroni entrano nei 3 orbitali t 2g, secondo la regola di Hund il quarto elettrone ha due possibilità: entrare in un orbitale e g,
Esercizi sui Complessi Metallici
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Complessi Metallici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizi
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Complessi Metallici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizi
Teoria del campo cristallino corretta (ACFT) (Teoria del campo dei leganti)
 Teoria del campo cristallino corretta (ACFT) (Teoria del campo dei leganti) la teoria del campo cristallino (CFT) adotta un modello fisico irreale considerando i leganti come cariche puntiformi un modello
Teoria del campo cristallino corretta (ACFT) (Teoria del campo dei leganti) la teoria del campo cristallino (CFT) adotta un modello fisico irreale considerando i leganti come cariche puntiformi un modello
Roberta Pierattelli. Metalli in Biologia. Qualche richiamo di chimica generale e inorganica
 Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
Composti di coordinazione
 Composti di coordinazione Nelle molecole di un COMPOSTO DI COORDINAZIONE l atomo centrale e legato ad un numero di atomi superiore al suo numero di ossidazione. Lo studio dei composti di coordinazione
Composti di coordinazione Nelle molecole di un COMPOSTO DI COORDINAZIONE l atomo centrale e legato ad un numero di atomi superiore al suo numero di ossidazione. Lo studio dei composti di coordinazione
Evidenze sperimentali della CFSE. interpretazione dei dati di suscettività magnetica (alto/basso spin)
 Evidenze sperimentali della CFSE interpretazione dei dati di suscettività magnetica (alto/basso spin) interpretazione degli spettri UV-Vis interpretazione di dati termodinamici (entalpie di idratazione,
Evidenze sperimentali della CFSE interpretazione dei dati di suscettività magnetica (alto/basso spin) interpretazione degli spettri UV-Vis interpretazione di dati termodinamici (entalpie di idratazione,
Chimica Inorganica e Laboratorio
 Chimica Inorganica e Laboratorio Le diapositive seguenti sono tratte dai lucidi utilizzati in aula per le lezioni del corso di Chimica Inorganica e Laboratorio. Nelle diapositive impiegate a lezione possono
Chimica Inorganica e Laboratorio Le diapositive seguenti sono tratte dai lucidi utilizzati in aula per le lezioni del corso di Chimica Inorganica e Laboratorio. Nelle diapositive impiegate a lezione possono
Stabilità dei complessi
 Stabilità dei complessi v stabilità o instabilità termodinamica di un complesso è una misura del grado in cui un complesso è presente all equilibrio insieme alle sue specie costituenti, ossia allo ione
Stabilità dei complessi v stabilità o instabilità termodinamica di un complesso è una misura del grado in cui un complesso è presente all equilibrio insieme alle sue specie costituenti, ossia allo ione
Cr Mn Fe Co Ni Cu Zn. Chimica Inorganica Biologica Vita ed Energia
 Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Coordinazione ottaedrica (interazioni di tipo )
 Coordinazione ottaedrica (interazioni di tipo ) Il metallo di transizione ha 6 orbitali atomici adatti a dare interazioni di tipo (d z2, d x2-y2, s, p x, p y, p z ) e 6 orbitali atomici adatti a dare interazioni
Coordinazione ottaedrica (interazioni di tipo ) Il metallo di transizione ha 6 orbitali atomici adatti a dare interazioni di tipo (d z2, d x2-y2, s, p x, p y, p z ) e 6 orbitali atomici adatti a dare interazioni
7. Paramagnetic transition metal ions
 Magnetochimica AA 013-014 7. Paramagnetic transition metal ions Struttura elettronica dei metalli di transizione Ioni liberi Contributi all Hamiltoniano: 1- Repulsione inter-elettronica (V ER ). Il contributo
Magnetochimica AA 013-014 7. Paramagnetic transition metal ions Struttura elettronica dei metalli di transizione Ioni liberi Contributi all Hamiltoniano: 1- Repulsione inter-elettronica (V ER ). Il contributo
COMPLESSI DEI METALLI DI TRANSIZIONE LEZIONE 7
 COMPLESSI DEI METALLI DI TRANSIZIONE LEZIONE 7 METALLI DI TRANSIZIONE Elementi che formano almeno uno ione con un sottoguscio d parzialmente riempito di elettroni Configurazione elettronica (n-1)d x ns
COMPLESSI DEI METALLI DI TRANSIZIONE LEZIONE 7 METALLI DI TRANSIZIONE Elementi che formano almeno uno ione con un sottoguscio d parzialmente riempito di elettroni Configurazione elettronica (n-1)d x ns
La struttura elettronica dei complessi
 La struttura elettronica dei complessi La struttura degli atomi polielettronici presenta, rispetto all atomo di H, una maggiore complessità dovuta alla repulsione interelettronica La descrizione di un
La struttura elettronica dei complessi La struttura degli atomi polielettronici presenta, rispetto all atomo di H, una maggiore complessità dovuta alla repulsione interelettronica La descrizione di un
Chimica Analitica con elementi di statistica Lezione n 3
 Chimica Analitica con elementi di statistica Lezione n 3 Christian Durante E-mail: christian.durante@unipd.it Tel. 049-8275112 Zona quadrilatero ufficio 00 215 02 142 (orario di ricevimento: tutti I giorni
Chimica Analitica con elementi di statistica Lezione n 3 Christian Durante E-mail: christian.durante@unipd.it Tel. 049-8275112 Zona quadrilatero ufficio 00 215 02 142 (orario di ricevimento: tutti I giorni
Il Legame Coordinativo Sali doppi e Complessi KCl MgCl 2 6H 2 O (carnalite) Fe(CN) 2 4KCN (ferrocianuro di potassio) I Sali doppi in soluzione perdono
 Il Legame Coordinativo Sali doppi e Complessi KCl MgCl 2 6H 2 O (carnalite) Fe(CN) 2 4KCN (ferrocianuro di potassio) I Sali doppi in soluzione perdono la loro identità e la soluzione mostra le proprietà
Il Legame Coordinativo Sali doppi e Complessi KCl MgCl 2 6H 2 O (carnalite) Fe(CN) 2 4KCN (ferrocianuro di potassio) I Sali doppi in soluzione perdono la loro identità e la soluzione mostra le proprietà
Anno Accademico
 Anno Accademico 2011-12 A. CERIOTTI Complesso Definizione: è una specie chimica (neutra o carica) in cui un atomo centrale (metallo di transizione o elemento non di transizione) è circondato da altri atomi
Anno Accademico 2011-12 A. CERIOTTI Complesso Definizione: è una specie chimica (neutra o carica) in cui un atomo centrale (metallo di transizione o elemento non di transizione) è circondato da altri atomi
ELEMENTI DI TRANSIZIONE
 ELEMENTI DI TRANSIZIONE Teoria del campo dei leganti (del campo cristallino e dell orbitale molecolare) Proprietà magnetiche dei composti dei metalli di transizione Spettroscopia di assorbimento elettronico
ELEMENTI DI TRANSIZIONE Teoria del campo dei leganti (del campo cristallino e dell orbitale molecolare) Proprietà magnetiche dei composti dei metalli di transizione Spettroscopia di assorbimento elettronico
Numeri di coordinazione e relative geometrie
 Numeri di coordinazione e relative geometrie Il numero di atomi legati direttamente ad un atomo è il numero di coordinazione di quell atomo, che può far parte di un complesso, di un composto oppure far
Numeri di coordinazione e relative geometrie Il numero di atomi legati direttamente ad un atomo è il numero di coordinazione di quell atomo, che può far parte di un complesso, di un composto oppure far
I Composti di Coordinazione
 I Composti di Coordinazione COMPLESSI perché sembrano non ubbidire alle usuali regole di valenza Identificati dalla fine del XIX secolo da Alfred Werner (premio Nobel per la chimica nel 1913) Egli combinò
I Composti di Coordinazione COMPLESSI perché sembrano non ubbidire alle usuali regole di valenza Identificati dalla fine del XIX secolo da Alfred Werner (premio Nobel per la chimica nel 1913) Egli combinò
COMPOSTI DI COORDINAZIONE
 CMPSTI DI CRDIAZIE Gli elementi di transizione hanno proprietà che variano relativamente poco andando da sinistra a destra lungo la tavola periodica; hanno inoltre la caratteristica di avere orbitali d
CMPSTI DI CRDIAZIE Gli elementi di transizione hanno proprietà che variano relativamente poco andando da sinistra a destra lungo la tavola periodica; hanno inoltre la caratteristica di avere orbitali d
Ione cianuro, CN - monodentato, si coordina tramite l atomo di C (coppia elettronica più
 Ione cianuro, CN - come donatore (base) σ è più forte del CO; quando agisce da legante monodentato, si coordina tramite l atomo di C (coppia elettronica più disponibile); (donatore di 2e - come anione,
Ione cianuro, CN - come donatore (base) σ è più forte del CO; quando agisce da legante monodentato, si coordina tramite l atomo di C (coppia elettronica più disponibile); (donatore di 2e - come anione,
PROPRIETÀ PERIODICHE DEGLI ELEMENTI
 PROPRIETÀ PERIODICHE DEGLI ELEMENTI 1) Energia di ionizzazione E ion Energia necessaria per sottrarre ad un atomo, allo stato di gas monoatomico, un elettrone A (g) d A + (g) + e - E ion processo endotermico
PROPRIETÀ PERIODICHE DEGLI ELEMENTI 1) Energia di ionizzazione E ion Energia necessaria per sottrarre ad un atomo, allo stato di gas monoatomico, un elettrone A (g) d A + (g) + e - E ion processo endotermico
ORBITALE ATOMICO. Forma
 L ATOMO ORBITALE ATOMICO n (numero quantico principale) Energia e Dimensione l (numero quantico azimutale) Forma m l (numero quantico magnetico) Orientazione nello spazio l dipende da n assume n valori:
L ATOMO ORBITALE ATOMICO n (numero quantico principale) Energia e Dimensione l (numero quantico azimutale) Forma m l (numero quantico magnetico) Orientazione nello spazio l dipende da n assume n valori:
Teoria del campo cristallino (CFT)
 Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
Complessi con gruppi M-O 2
 Complessi con gruppi M-O 2 complessi in cui sono presenti formalmente, come leganti, le specie ridotte dell ossigeno molecolare O 2 (12e - ), ossia: O 2 - (13e - ) legante ione superossido ; O 2 2- (14e
Complessi con gruppi M-O 2 complessi in cui sono presenti formalmente, come leganti, le specie ridotte dell ossigeno molecolare O 2 (12e - ), ossia: O 2 - (13e - ) legante ione superossido ; O 2 2- (14e
ATOMO POLIELETTRONICO. Numero quantico di spin m s
 ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
ATOMO POLIELETTRONICO La teoria fisico-matematica che ha risolto esattamente il problema dell atomo di idrogeno non è in grado di descrivere con uguale precisione l atomo polielettronico. Problema: interazioni
Distorsioni dalla geometria ideale. in complessi a leganti diversi aventi proprietà di legame molto
 Distorsioni dalla geometria ideale in complessi a leganti diversi aventi proprietà di legame molto differenti (in posizioni distanti nella serie spettrochimica), es. trans-ml 4 L es. fac-ml L distorsione
Distorsioni dalla geometria ideale in complessi a leganti diversi aventi proprietà di legame molto differenti (in posizioni distanti nella serie spettrochimica), es. trans-ml 4 L es. fac-ml L distorsione
REGISTRO DELLE LEZIONI
 UNIVERSITÀ DEGLI STUDI DI GENOVA Dipartimento di Chimica e Chimica Industriale Corso di laurea in Chimica e Tecnologie Chimiche REGISTRO DELLE LEZIONI dell INSEGNAMENTO o MODULO UFFICIALE Nome: Laboratorio
UNIVERSITÀ DEGLI STUDI DI GENOVA Dipartimento di Chimica e Chimica Industriale Corso di laurea in Chimica e Tecnologie Chimiche REGISTRO DELLE LEZIONI dell INSEGNAMENTO o MODULO UFFICIALE Nome: Laboratorio
Caratteristiche del CO
 Metallo Carbonili Metallo carbonile omoleptico è un composto contenente solamente leganti CO Sono noti quasi tutti i metallo carbonili degli elementi del blocco d Non si conoscono quelli di Pd e Pt, stabili
Metallo Carbonili Metallo carbonile omoleptico è un composto contenente solamente leganti CO Sono noti quasi tutti i metallo carbonili degli elementi del blocco d Non si conoscono quelli di Pd e Pt, stabili
Transizioni elettroniche per uno ione. Transizioni elettroniche per uno ione metallico in campo dei leganti
 Transizioni elettroniche per uno ione metallico in campo dei leganti d 2 ion Electron-electron repulsion Transizioni elettroniche per uno ione Applichiamo i concetti del modello del campo dei leganti ad
Transizioni elettroniche per uno ione metallico in campo dei leganti d 2 ion Electron-electron repulsion Transizioni elettroniche per uno ione Applichiamo i concetti del modello del campo dei leganti ad
Composti di coordinazione
 Composti di coordinazione detti anche ioni complessi o complessi di coordinazione sono costituiti da un metallo (generalmente uno ione ione) di transizione coordinato (legato) da uno o più leganti (molecole
Composti di coordinazione detti anche ioni complessi o complessi di coordinazione sono costituiti da un metallo (generalmente uno ione ione) di transizione coordinato (legato) da uno o più leganti (molecole
N.C. = 5. bipiramidale trigonale: (2 leganti assiali + 3 leganti equatoriali), es. [SiF 5 ] -
![N.C. = 5. bipiramidale trigonale: (2 leganti assiali + 3 leganti equatoriali), es. [SiF 5 ] - N.C. = 5. bipiramidale trigonale: (2 leganti assiali + 3 leganti equatoriali), es. [SiF 5 ] -](/thumbs/62/48088990.jpg) N.C. = 5 bipiramidale trigonale: (2 leganti assiali + 3 leganti equatoriali), es. [SiF 5 ] - piramidale a base quadrata: (1 legante apicale + 4 leganti basali), es. [BrF 5 ] pentagonale planare: (5 leganti
N.C. = 5 bipiramidale trigonale: (2 leganti assiali + 3 leganti equatoriali), es. [SiF 5 ] - piramidale a base quadrata: (1 legante apicale + 4 leganti basali), es. [BrF 5 ] pentagonale planare: (5 leganti
DISSOLUZIONE DEI SALI IN ACQUA
 1 DISSLUZINE DEI SALI IN ACQUA 1. La dissoluzione di un sale è un equilibrio. 2. Diversi Sali hanno diverse solubilità (K ps ). 3. La solubilità dipende dall energia del reticolo ionico (U) e dall entalpia
1 DISSLUZINE DEI SALI IN ACQUA 1. La dissoluzione di un sale è un equilibrio. 2. Diversi Sali hanno diverse solubilità (K ps ). 3. La solubilità dipende dall energia del reticolo ionico (U) e dall entalpia
FORMAZIONE DI LEGAMI. Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato.
 FORMAZIONE DI LEGAMI Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato. Presa r come distanza internucleare si osserva che l'energia
FORMAZIONE DI LEGAMI Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato. Presa r come distanza internucleare si osserva che l'energia
CRISTALLOCHIMICA. La cristallochimica è la disciplina che studia le correlazioni tra la struttura cristallina e la composizione chimica dei minerali
 CRISTALLOCHIMICA La cristallochimica è la disciplina che studia le correlazioni tra la struttura cristallina e la composizione chimica dei minerali L atomo H orbitali Livelli energetici Lo ione Lo ione
CRISTALLOCHIMICA La cristallochimica è la disciplina che studia le correlazioni tra la struttura cristallina e la composizione chimica dei minerali L atomo H orbitali Livelli energetici Lo ione Lo ione
Introduzione alla chimica organica. 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole
 Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Introduzione alla chimica organica 1. Regola ottetto 2. Teoria del legame 3. Geometria delle molecole La chimica organica tratta di pochissimi atomi che si possono combinare in moltissimi modi Grande importanza
Capitolo 10: La Tavola Periodica e Alcune Proprietà Atomiche
 Capitolo 10: La Tavola Periodica e Alcune Proprietà Atomiche Classificazione degli Elementi: La Legge Periodica e la Tavola Periodica Mendeleev notò che gli elementi possono essere suddivisi per gruppi
Capitolo 10: La Tavola Periodica e Alcune Proprietà Atomiche Classificazione degli Elementi: La Legge Periodica e la Tavola Periodica Mendeleev notò che gli elementi possono essere suddivisi per gruppi
Quantomeccanica dei Composti di Coordinazione
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 CCS CHI e MAT Quantomeccanica dei Composti di Coordinazione Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/it/education/generalchemistrylessons
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 CCS CHI e MAT Quantomeccanica dei Composti di Coordinazione Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/it/education/generalchemistrylessons
METALLI: bassa energia di ionizzazione bassa affinità elettronica. NON METALLI: elevata energia di ionizzazione elevata affinità elettronica
 METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
METALLI: bassa energia di ionizzazione bassa affinità elettronica NON METALLI: elevata energia di ionizzazione elevata affinità elettronica LEGAME CHIMICO La formazione di legami tra atomi per formare
M M n+ + n e - X + n e - X n-
 IL LEGAME IONICO 1 Il legame ionico Descrizione generale La formazione di NaCl La valenza ionica L energia reticolare: definizione e esempio di calcolo Proprietà dei solidi ionici Il legame ionico si realizza
IL LEGAME IONICO 1 Il legame ionico Descrizione generale La formazione di NaCl La valenza ionica L energia reticolare: definizione e esempio di calcolo Proprietà dei solidi ionici Il legame ionico si realizza
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole
 Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Nel 1926 Erwin Schrödinger propose un equazione celebre e mai abbandonata per il calcolo delle proprietà degli atomi e delle molecole Secondo questa teoria l elettrone può essere descritto come fosse un
Il Legame Ionico. Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B -
 Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
Il Legame Ionico Quando la differenza di elettronegatività fra atomi A e B è molto grande le coppie AB possono essere considerate A + B - A + B - Le coppie di ioni si attraggono elettrostaticamente Il
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto
 1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1.La forma delle molecole 2.La teoria VSEPR 3.Molecole polari e apolari 4.Le forze intermolecolari 5.Legami a confronto 1 1. La forma delle molecole Molte proprietà delle sostanze dipendono dalla forma
1. Elettronegatività 2. Numero di ossidazione 3. Reazioni di ossidoriduzione (REDOX) 4. Bilanciamento redox
 Lezione 10 1. Elettronegatività 2. Numero di ossidazione 3. Reazioni di ossidoriduzione (REDOX) 4. Bilanciamento redox 5. Delocalizzazione elettronica e risonanza Elettronegatività Si definisce elettronegatività
Lezione 10 1. Elettronegatività 2. Numero di ossidazione 3. Reazioni di ossidoriduzione (REDOX) 4. Bilanciamento redox 5. Delocalizzazione elettronica e risonanza Elettronegatività Si definisce elettronegatività
Telerilevamento II. Spettroscopia in riflessione e trasmissione per materiali litoidi e Laboratorio
 Università degli Studi di Parma Programma dell corso integrativo al corso ufficiale dal titolo: Telerilevamento II rivolto agli studenti di Scienze Geologiche e Spettroscopia in riflessione e trasmissione
Università degli Studi di Parma Programma dell corso integrativo al corso ufficiale dal titolo: Telerilevamento II rivolto agli studenti di Scienze Geologiche e Spettroscopia in riflessione e trasmissione
Leganti. Un legante è una qualsiasi molecola o ione che abbia almeno un doppietto di
 Leganti Un legante è una qualsiasi molecola o ione che abbia almeno un doppietto di elettroni disponibile per una donazione. N.B. Il doppietto elettronico può essere già presente sull atomo donatore (es.
Leganti Un legante è una qualsiasi molecola o ione che abbia almeno un doppietto di elettroni disponibile per una donazione. N.B. Il doppietto elettronico può essere già presente sull atomo donatore (es.
Leganti π. Leganti π sono quelli che, oltre ad interazioni di tipo σ, possono dare, con il metallo, interazioni di tipo π:
 Leganti π Leganti π sono quelli che, oltre ad interazioni di tipo σ, possono dare, con il metallo, interazioni di tipo π: leganti π-donatori (basici nel senso di Lewis) leganti π-accettori (acidi nel senso
Leganti π Leganti π sono quelli che, oltre ad interazioni di tipo σ, possono dare, con il metallo, interazioni di tipo π: leganti π-donatori (basici nel senso di Lewis) leganti π-accettori (acidi nel senso
Chimica Inorganica Biologica I composti di coordinazione Richiami di Chimica - Acidi e Basi di Lewis
 I composti di coordinazione Richiami di Chimica - Acidi e Basi di Lewis Acido (LA) Base (LB) accettore di una coppia di elettroni donatore di una coppia di elettroni HOMO LUMO Highest Occupied Molecular
I composti di coordinazione Richiami di Chimica - Acidi e Basi di Lewis Acido (LA) Base (LB) accettore di una coppia di elettroni donatore di una coppia di elettroni HOMO LUMO Highest Occupied Molecular
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Previsione delle geometrie molecolari (Cap. 8)
 Previsione delle geometrie molecolari (Cap. 8) La forma delle molecole La teoria VSEPR Previsione della geometria molecolare Momento di dipolo di molecole poliatomiche Isomeria Ordine di legame 6 0 La
Previsione delle geometrie molecolari (Cap. 8) La forma delle molecole La teoria VSEPR Previsione della geometria molecolare Momento di dipolo di molecole poliatomiche Isomeria Ordine di legame 6 0 La
Isomerie. Isomeri sono composti (non elementi) aventi la stessa composizione stechiometrica e
 Isomerie Isomeri sono composti (non elementi) aventi la stessa composizione stechiometrica e uguale massa molare. Isotopomeri sono composti (non elementi) aventi la stessa composizione stechiometrica ma
Isomerie Isomeri sono composti (non elementi) aventi la stessa composizione stechiometrica e uguale massa molare. Isotopomeri sono composti (non elementi) aventi la stessa composizione stechiometrica ma
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
Lezione 3 - Legame chimico
 Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Lezione 3 - Legame chimico Generalità sul legame chimico Strutture di Lewis Elettronegatività e legame chimico Il legame covalente Gli orbitali molecolari e Il legame ionico Il legame metallico Orbitali
Anno Accademico parte seconda A. CERIOTTI
 Anno Accademico 2011-12 parte seconda A. CERIOTTI CuCO 3 Cu(O) 2 + 2 Cu + 4 PF 6 + 16 C 3 C 4 [Cu(C 3 C) 4 ][PF 6 ] + 3 2 O + CO 2 Legante acetonitrile: C-C 3 Stato di ossidazione formale: Cu (+1) Configurazione
Anno Accademico 2011-12 parte seconda A. CERIOTTI CuCO 3 Cu(O) 2 + 2 Cu + 4 PF 6 + 16 C 3 C 4 [Cu(C 3 C) 4 ][PF 6 ] + 3 2 O + CO 2 Legante acetonitrile: C-C 3 Stato di ossidazione formale: Cu (+1) Configurazione
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi
 LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione8 1 Risonanza * La teoria della risonanza
LE MOLECOLE Per conoscere le proprietà di una sostanza ne dobbiamo conoscere: * la struttura * il tipo di legame presente tra gli atomi ChimicaGenerale_lezione8 1 Risonanza * La teoria della risonanza
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Che cosa è il Legame Chimico
 Che cosa è il Legame Chimico Le molecole sono aggregati stabili ed identici contenenti più atomi La loro geometria non cambia al cambiare dello stato di aggregazione Deve esistere una forma di interazione
Che cosa è il Legame Chimico Le molecole sono aggregati stabili ed identici contenenti più atomi La loro geometria non cambia al cambiare dello stato di aggregazione Deve esistere una forma di interazione
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Onda. A = ampiezza. = lunghezza d onda distanza tra due max o min successivi. = frequenza numero di oscillazioni in 1 sec. Lunghezza d'onda e Ampiezza
 Onda A Lunghezza d'onda e Ampiezza = lunghezza d onda distanza tra due max o min successivi A = ampiezza = frequenza numero di oscillazioni in 1 sec. c = velocità di propagazione della luce nel vuoto (3
Onda A Lunghezza d'onda e Ampiezza = lunghezza d onda distanza tra due max o min successivi A = ampiezza = frequenza numero di oscillazioni in 1 sec. c = velocità di propagazione della luce nel vuoto (3
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Stato di ossidazione formale del metallo
 Stato di ossidazione formale del metallo i metalli di transizione possono dare composti in cui il metallo si trova in stato di ossidazione formale variabile, da +8, [RuO 4 ], a 4, [Cr(CO) 4 ] 4- la carica
Stato di ossidazione formale del metallo i metalli di transizione possono dare composti in cui il metallo si trova in stato di ossidazione formale variabile, da +8, [RuO 4 ], a 4, [Cr(CO) 4 ] 4- la carica
Chimica Inorganica Biologica Composti di coordinazione
 Nomenclatura Chimica Inorganica Biologica Si nomina prima il catione e poi l anione Si nominano i leganti in ordine alfabetico I nomi dei leganti anionici terminano in -o I leganti neutri mantengono il
Nomenclatura Chimica Inorganica Biologica Si nomina prima il catione e poi l anione Si nominano i leganti in ordine alfabetico I nomi dei leganti anionici terminano in -o I leganti neutri mantengono il
Configurazioni elettroniche e periodicità
 Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
Configurazioni elettroniche e periodicità Le configurazioni elettroniche dei vari elementi sono una funzione periodica del numero atomico Z. Gli elementi che appartengono allo stesso gruppo nella tavola
Regola di Wade. Figura 3.39 Struttura del cluster [Ru 6 (CO) 18
 Regola di Wade Figura 3.39 Struttura del cluster [Ru 6 (CO) 18 18 ] 2- Regola di Wade Gruppo 6 Gruppo 7 Gruppo 8 Gruppo 9 Gruppo 10 Cr, Mo, W Mn, Tc, Re Fe, Ru Os Co, Rh, Ir Ni, Pd, Pt M(CO) 2-2 -1 0 1
Regola di Wade Figura 3.39 Struttura del cluster [Ru 6 (CO) 18 18 ] 2- Regola di Wade Gruppo 6 Gruppo 7 Gruppo 8 Gruppo 9 Gruppo 10 Cr, Mo, W Mn, Tc, Re Fe, Ru Os Co, Rh, Ir Ni, Pd, Pt M(CO) 2-2 -1 0 1
LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI
 LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI Il legame covalente e la geometria delle molecole possono essere descritti dalla teoria del legame di valenza: i legami risultano dalla condivisione di
LEGAME COVALENTE: TEORIA DEGLI ORBITALI MOLECOLARI Il legame covalente e la geometria delle molecole possono essere descritti dalla teoria del legame di valenza: i legami risultano dalla condivisione di
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
PROPRIETA PERIODICHE
 PROPRIETA PERIODICHE Sono tutte quelle proprietà il cui andamento lungo un periodo o lungo un gruppo presenta un andamento periodico. Le più rilevanti sono: 1) Raggi atomici (o ionici) 2) Potenziale di
PROPRIETA PERIODICHE Sono tutte quelle proprietà il cui andamento lungo un periodo o lungo un gruppo presenta un andamento periodico. Le più rilevanti sono: 1) Raggi atomici (o ionici) 2) Potenziale di
COMPOSTI DI COORDINAZIONE
 COMPOSTI DI COORDINAZIONE Teoria di Werner I metalli, specie quelli di transizione, presentano due tipi di valenza Valenza primaria: numero di elettroni che l atomo cede nella formazione dello ione metallico
COMPOSTI DI COORDINAZIONE Teoria di Werner I metalli, specie quelli di transizione, presentano due tipi di valenza Valenza primaria: numero di elettroni che l atomo cede nella formazione dello ione metallico
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 13 I legami chimici 3 Sommario (I) 1. L energia di legame 2. I gas nobili e la regola dell ottetto 3. Il legame covalente 4.
STRUTTURA ATOMICA. tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica
 STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
STRUTTURA ATOMICA tutti gli atomi hanno un nucleo carico positivamente che possiede quasi tutta la massa atomica il nucleo è composto da protoni e neutroni che hanno massa = 1 nella scala dei pesi atomici
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Sommario delle lezioni Legami chimici
 Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Capitolo 11 I legami chimici
 Capitolo 11 I legami chimici ai capito? pag. 55 a4, b3, c1, d Mg deve perdere elettroni per assumere la configurazione di Ne e ogni atomo di cloro può acquistare solo 1 elettrone. Ba + Ba + + ; Ba pag.
Capitolo 11 I legami chimici ai capito? pag. 55 a4, b3, c1, d Mg deve perdere elettroni per assumere la configurazione di Ne e ogni atomo di cloro può acquistare solo 1 elettrone. Ba + Ba + + ; Ba pag.
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legami multipli M=L e M L
 Legami multipli M=L e M L con leganti carbonilici e nitrosilici (L = CO, NO) l ordine di legame formale M-C e M-N varia tra 1 e 2. con altri leganti (L = O, S, NR nitreni, N, CR 2 carbeni, CR carbini)
Legami multipli M=L e M L con leganti carbonilici e nitrosilici (L = CO, NO) l ordine di legame formale M-C e M-N varia tra 1 e 2. con altri leganti (L = O, S, NR nitreni, N, CR 2 carbeni, CR carbini)
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
Perché H 2 e non H? He e non He 2? H 2 O e non H 3 O?
 IL LEGAME CHIMICO Perché H 2 e non H? He e non He 2? H 2 O e non H 3 O? Configurazione degli elettroni diversa ed energeticamente più favorevole di quella degli atomi isolati? Ionico (trasferimento di
IL LEGAME CHIMICO Perché H 2 e non H? He e non He 2? H 2 O e non H 3 O? Configurazione degli elettroni diversa ed energeticamente più favorevole di quella degli atomi isolati? Ionico (trasferimento di
CENNI TEORIA ORBITALE MOLECOLARE
 CENNI TEORIA ORBITALE MOLECOLARE Teoria più avanzata: spiega anche perché O 2 è paramagnetico. Ne illustreremo la applicazione solo per molecole biatomiche E 2 del secondo periodo. Orbitali molecolari:
CENNI TEORIA ORBITALE MOLECOLARE Teoria più avanzata: spiega anche perché O 2 è paramagnetico. Ne illustreremo la applicazione solo per molecole biatomiche E 2 del secondo periodo. Orbitali molecolari:
I gas nobili esistono (solo) allo stato di gas monoatomico
 I gas nobili esistono (solo) allo stato di gas monoatomico In condizioni normali non formano composti, dimostrando che i loro atomi non tendono a legarsi (inerzia chimica) Legame chimico G. N. Lewis (1916):
I gas nobili esistono (solo) allo stato di gas monoatomico In condizioni normali non formano composti, dimostrando che i loro atomi non tendono a legarsi (inerzia chimica) Legame chimico G. N. Lewis (1916):
Zolfo (Z = 16) Conf. Elettronica 1s 2 2s 2 2p 6 3s 2 3p 4 Conf. Elettronica esterna 3s 2 3p 4
 TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
TAVOLA PERIODICA DEGLI ELEMENTI Gli elementi sono ordinati nella tavola periodica secondo numero atomico crescente ed in base alle loro proprietà chimico-fisiche che seguono un andamento periodico. Gli
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
Telerilevamento II. Spettroscopia in riflessione e trasmissione per materiali litoidi e Laboratorio
 Università degli Studi di Parma Programma dell corso integrativo al corso ufficiale dal titolo: Telerilevamento II rivolto agli studenti di Scienze Geologiche e Spettroscopia in riflessione e trasmissione
Università degli Studi di Parma Programma dell corso integrativo al corso ufficiale dal titolo: Telerilevamento II rivolto agli studenti di Scienze Geologiche e Spettroscopia in riflessione e trasmissione
Metalli di Transizione (Serie d )
 Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Metalli di Transizione (Serie d ) Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/
Scuola di Ingegneria Industriale e dell Informazione Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Metalli di Transizione (Serie d ) Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
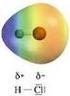 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
Comunicazioni Docente - Studenti
 Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
Comunicazioni Docente - Studenti 1. Lista di distribuzione: francesco.musiani.chimgenbiotech 2. Scrivere (moderatamente) a: francesco.musiani@unibo.it 3. Avvisi sul sito del docente: https://www.unibo.it/sitoweb/francesco.musiani
LEGAME COVALENTE. ( Elettronegatività tra gli atomi < 2)
 LEGAME COVALENTE ( Elettronegatività tra gli atomi < 2) Le sostanze molecolari hanno un tipo di legame che non comporta l acquisto o la cessione di e - ma la condivisione diunacoppiadie - tragliatomi Non
LEGAME COVALENTE ( Elettronegatività tra gli atomi < 2) Le sostanze molecolari hanno un tipo di legame che non comporta l acquisto o la cessione di e - ma la condivisione diunacoppiadie - tragliatomi Non
Forme molecolari - Teoria VSEPR Teoria della repulsione dei doppietti elettronici di valenza
 Lezione 8 1. Teoria VSEPR 2. Il legame chimico 3. Legame covalente - Valence Bond 4. Legami e 5. Sovrapposizione di orbitali atomici 6. Intro IBRIDAZIONE Forme molecolari - Teoria VSEPR Teoria della repulsione
Lezione 8 1. Teoria VSEPR 2. Il legame chimico 3. Legame covalente - Valence Bond 4. Legami e 5. Sovrapposizione di orbitali atomici 6. Intro IBRIDAZIONE Forme molecolari - Teoria VSEPR Teoria della repulsione
Il tipo di legame chimico influenza in maniera fondamentale le caratteristiche macroscopiche del materiale.
 Il tipo di legame chimico influenza in maniera fondamentale le caratteristiche macroscopiche del materiale. 1 Nei materiali si distinguono cinque tipi di legame. Nei ceramici solo tre sono importanti:
Il tipo di legame chimico influenza in maniera fondamentale le caratteristiche macroscopiche del materiale. 1 Nei materiali si distinguono cinque tipi di legame. Nei ceramici solo tre sono importanti:
I legami chimici. Perché si formano i legami? Perché si formano i legami? 16/01/2019. Come e perché gli atomi si legano tra loro
 I legami chimici Come e perché gli atomi si legano tra loro Perché si formano i legami? In natura, se non in casi eccezionali, non si trovano atomi liberi. Per separare due atomi legati è necessario fornire
I legami chimici Come e perché gli atomi si legano tra loro Perché si formano i legami? In natura, se non in casi eccezionali, non si trovano atomi liberi. Per separare due atomi legati è necessario fornire
Classificazione dei materiali solidi in base ai legami interatomici! Metalli Ceramici Polimeri
 Classificazione dei materiali solidi in base ai legami interatomici! Metalli Ceramici Polimeri (a) Legami atomici primari o forti legame ionico legame covalente legame metallico (b) Legami atomici e molecolari
Classificazione dei materiali solidi in base ai legami interatomici! Metalli Ceramici Polimeri (a) Legami atomici primari o forti legame ionico legame covalente legame metallico (b) Legami atomici e molecolari
Il legame ionico legame ionico
 Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
Il legame ionico Il legame ionico è il legame che si realizza quando un atomo d un elemento fortemente elettropositivo (e quindi caratterizzato da bassa energia di ionizzazione) si combina con un atomo
