Storia della meccanica quantistica
|
|
|
- Angelica Gambino
- 9 anni fa
- Просмотров:
Транскрипт
1 Storia della meccanica quantistica Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia
2 La quantizzazione della luce La quantizzazione della materia La nuova meccanica quantistica
3 La quantizzazione della luce
4 Nel Seicento e nel Settecento si sono confrontate due teorie sulla natura della luce: la teoria corpuscolare (Newton) e quella ondulatoria (Huygens), entrambe capaci di interpretare alcuni fenomeni. Ad inizio Ottocento, con gli esperimenti di Young e di Fresnel, si è affermata la teoria ondulatoria. In seguito, Maxwell ha previsto che la luce dovesse essere un onda elettromagnetica. Successivamente, altri esperimenti hanno messo in evidenza una natura più complessa.
5 1859 Gustav Kirchhoff elabora il concetto di corpo nero: un corpo cavo con un foro minuscolo che assorbe perfettamente qualunque radiazione. Le pareti interne, se riscaldate, possono emettere radiazione attraverso il foro.
6 Studiando la radiazione emessa ad una data temperatura, è possibile risalire alle lunghezze d onda della radiazione all interno della cavità. Kirchhoff pone il problema del corpo nero: studiare, a qualsiasi temperatura, la distribuzione dell intensità emessa al variare della lunghezza d onda della radiazione.
7 1893 Wilhelm Wien scopre che la lunghezza d onda max, a cui l intensità di radiazione emessa è massima, e la temperatura T sono inversamente proporzionali. Nel 1896 elabora una legge, detta legge di spostamento, che descrive la distribuzione dell intensità della radiazione emessa al variare di e di T.
8 1900 Dopo una lunga controversia sulla validità sperimentale della legge di Wein, Heinrich Rubens e Ferdinand Kurlbaum verificano che la legge di distribuzione di Wein non è adatta a descrivere i risultati sperimentali ad alte temperature e ad elevate lunghezze d onda.
9 1900 Max Planck elabora una nuova legge sulla distribuzione del corpo nero che si adatta bene ai dati sperimentali. Immagina le pareti del corpo nero come un insieme di oscillatori di frequenze differenti, che si attivano a seconda della temperatura. Quando gli oscillatori interagiscono con la radiazione, assorbono o emettono pacchetti di energia multipli di una certa quantità, proporzionale alla loro frequenza. È l ipotesi della quantizzazione dell energia scambiata dagli oscillatori.
10 L ipotesi di Planck è in contrasto con la fisica classica, secondo cui un oscillatore potrebbe emettere o assorbire energie di qualunque valore. La distribuzione dell intensità della radiazione emessa è data da:
11 1905 Albert Einstein riprende lo studio di Planck ma va oltre. Avanza l ipotesi che sia quantizzata non solo l energia scambiata dagli oscillatori del corpo nero ma anche l energia della radiazione stessa. È l ipotesi della quantizzazione dell energia del campo elettromagnetico (e quindi della luce). Un quanto di luce avrebbe un energia Per quasi vent anni nessuno crede all ipotesi di Einstein.
12 Con la sua ipotesi, Einstein spiega l effetto fotoelettrico, osservato nel 1887 da Hertz. Quando un metallo viene irradiato con della luce, è possibile estrarre da esso elettroni se la frequenza della radiazione è superiore ad un certo valore. Per Einstein, ciò avviene quando l energia della radiazione, E = h è superiore al lavoro di estrazione dell elettrone dal metallo.
13 1923 Arthur Compton invia raggi X verso bersagli di diversi elementi. Per alcuni elementi, i raggi X vengono deviati, urtando elettroni del bersaglio. La frequenza dei raggi X diffusi risulta essere minore di quella dei raggi incidenti. Misurando la quantità di moto e l energia degli elettroni colpiti, l unica spiegazione è che la radiazione sia quantizzata. L esistenza del quanto di luce di Einstein, ossia del fotone, è finalmente verificata.
14 La quantizzazione della materia
15 Il dibattito sulla natura della materia ha origini filosofiche antichissime e vede da una parte gli atomisti (Democrito) e dall altra i sostenitori della continuità della materia e dell assenza del vuoto (Aristotele). Nell Ottocento, Maxwell e Boltzmann hanno applicato la teoria atomica per lo studio statistico delle proprietà dei gas, ottenendo risultati in accordo con i dati sperimentali. Tra la fine dell Ottocento e l inizio del Novecento, nuovi studi hanno portato all affermazione definitiva della teoria atomica.
16 1895 Wilhelm Röntgen scopre i raggi X: facendo passare una corrente elettrica ad alta tensione in un tubo di vetro in cui è fatto il vuoto, una radiazione sconosciuta illumina uno schermo. Ponendo una mano su una lastra esposta ai raggi X, si può evidenziare il contorno delle ossa. I raggi X possono trasformare un gas in un conduttore.
17 1896 Joseph John Thomson interpreta i raggi X come radiazione elettromagnetica Studia i raggi catodici, ossia i raggi che vanno da un catodo ad un anodo, soggetti ad una certa d.d.p., in un tubo con aria molto rarefatta. Interpreta i raggi catodici come corpuscoli di carica negativa. È la scoperta dell elettrone.
18 1897 In un celebre esperimento, Thomson misura il rapporto e/m tra la carica e la massa dell elettrone Thomson propone un modello atomico a panettone : gli elettroni sono immaginati come particelle negative immerse in una materia positiva uniforme.
19 1909 Rutherford, Geiger ed Ernest Marsden bombardano un foglio d oro con particelle (nuclei di elio). La maggior parte delle particelle procedono diritte o vengono deflesse di pochi gradi; alcune tuttavia subiscono deviazioni considerevoli. Tali deviazioni sono incompatibili con il modello atomico di Thomson.
20 1911 Rutherford spiega la deviazione delle particelle con un altro modello atomico. Ipotizza la presenza di un nucleo di carica positiva, in cui è concentrata la maggior parte della massa atomica, circondato da elettroni. Gli elettroni si muoverebbero di moto circolare uniforme attorno al nucleo, analogamente a come i pianeti ruotano attorno al Sole. Si parla di modello planetario.
21 Il modello atomico di Rutherford non tiene conto, tuttavia, del fatto che una particella carica accelerata irradia energia. Un elettrone collasserebbe sul nucleo in un tempo molto piccolo.
22 1912 Niels Bohr inventa il concetto di stati stazionari: gli elettroni sono confinati su orbite in cui non possono emettere né assorbire energia. Sono permesse soltanto le orbite il cui momento angolare L = mrv è multiplo di h/2 : Di conseguenza, per l elettrone dell atomo di idrogeno, i livelli energetici possibili sono: con E 0 = - 13,6 ev è l energia dello stato fondamentale
23 Una rappresentazione delle orbite elettroniche permesse nell atomo di idrogeno secondo Bohr: Il modello di Bohr prevede la quantizzazione dell energia e del momento angolare dell elettrone.
24 Quando un elettrone assorbe energia (un fotone), può saltare ad un orbita più elevata. Successivamente, emettendo energia, può transitare ad un orbita inferiore. Gli spettri atomici che si possono osservare irradiando un atomo sono dovuti alle energie che un elettrone cede quando transita verso orbite inferiori. La frequenza della lunghezza d onda osservata è data da:
25 Con questa teoria, Bohr riesce ad interpretare le serie di righe spettrali dell atomo di idrogeno osservate, separatamente, da Balmer, Lyman e Paschen. Per atomi più complessi, a partire dall elio, l accordo tra teoria ed esperimento non è così buono.
26 1913 Arnold Sommerfeld integra il modello di Bohr. Prevede la possibilità che l elettrone percorra orbite ellittiche, oltre che circolari. Oltre al numero quantico principale n, introduce il numero quantico orbitale l, che può assumere valori interi da 0 ad n-1.
27 Introduce anche il numero quantico magnetico m, che può assumere valori interi da n ad n, per spiegare l effetto Zeeman, ossia la separazione delle righe spettrali sotto l azione di un campo magnetico esterno. Il modello atomico di Sommerfeld riesce a spiegare molti risultati sperimentali non previsti da quello di Bohr. Lo stesso Bohr ne riconosce la validità.
28 1914 James Franck e Gustav Hertz misurano la corrente tra elettrodi immersi in un gas di mercurio, in funzione della d.d.p. V tra essi. La corrente ha dei cambiamenti netti ad intervalli di 4,9 V. Quando l energia di un elettrone è un multiplo di 4,9 ev, esso produce un salto energetico tra due livelli del mercurio, così la sua energia si smorza. È una conferma del modello di Bohr.
29 1923 Wolfgang Pauli introduce un quarto numero quantico, inizialmente detto bivalenza, per spiegare le restrizioni al numero di elettroni presenti in ogni guscio di energia. Enuncia il principio di esclusione: due elettroni non possono avere quattro numeri quantici tutti uguali.
30 1925 Samuel Goudsmit e George Uhlenbeck interpretano la bivalenza come una proprietà intrinseca dell elettrone, a cui danno il nome di spin. Un elettrone può avere spin up o spin down a seconda che ruoti in verso orario o antiorario attorno al nucleo atomico. Il concetto di spin, a differenza dei primi tre numeri atomici, non è interpretabile in termini classici. Si avverte l esigenza di una nuova teoria quantistica complessiva.
31 1923 Louis De Broglie avanza l ipotesi del dualismo onda-particella: non solo ai fotoni ma a tutte le particelle è associata un onda. Gli elettroni possono percorrere orbite le cui lunghezze siano multiple della loro lunghezza d onda.
32 1927 Clinton Davisson e Lester Germer scoprono la diffrazione degli elettroni: l ipotesi di De Broglie è verificata. Le lunghezze d onda degli elettroni misurate sono in accordo con quelle previste da De Broglie.
33 La nuova meccanica quantistica
34 1925 Werner Heisenberg cerca di definire una nuova teoria complessiva con la quale spiegare tutti i risultati sperimentali. Parte dalla separazione in fisica tra grandezze osservabili e grandezze che non lo sono. L orbita di un elettrone non è osservabile, pertanto abbandona la rappresentazione di elettroni in rotazione attorno ad un nucleo.
35 Le frequenze di transizione mn tra due livelli di energie E m ed E n, possono essere rappresentate da una tabella del tipo: m m2 1n 2n mn Heisenberg immagina l elettrone come un oscillatore di cui si può osservare la posizione q e la quantità di moto p e associa alle due osservabili altre due tabelle. La teoria di Heisenberg regge solo se si ammette che pq sia diverso da qp.
36 1925 Max Born, con l aiuto del matematico Pascual Jordan, riconosce nelle tabelle di Heisenberg uno strumento matematico ancora poco conosciuto dai fisici: le matrici. La teoria di Heisenberg deve prevedere che: pq qpi h I 2 dove i è un numero immaginario e I è la matrice identità. Pauli, adottando la nuova teoria, riesce a calcolare tutto lo spettro dell idrogeno, riproducendo i dati sperimentali.
37 1925 Paul Dirac elabora indipendentemente una teoria simile a quella di Heisenberg, Born e Jordan, giungendo alle stesse conclusioni. Riesce a precedere gli altri tre di qualche giorno nella pubblicazione dei suoi risultati.
38 1926 Erwin Schrödinger propone un modello differente dalla meccanica delle matrici. Rifacendosi a De Broglie, poiché ad ogni particella è associata un onda, introduce una funzione d onda Tale funzione deve soddisfare l equazione d onda: Born interpreta (x) 2 come la densità di probabilità che un elettrone si trovi in un certo punto ad un dato istante. Schrödinger non condivide tale interpretazione.
39 Due teorie per la meccanica quantistica si confrontano: 1) La meccanica delle matrici di Heisenberg-Born-Jordan e Dirac, basata sulle particelle e sul concetto di discontinuità; 2) La meccanica ondulatoria di Schrödinger, basata sulle onde e la continuità. Entrambe le teorie riproducono bene gli spettri sperimentali ma si rifanno a due concezioni differenti. La meccanica delle matrici è una teoria radicalmente nuova rispetto alla fisica classica; la meccanica ondulatoria si concilia meglio con la vecchia fisica. Einstein si schiera con il modello di Schrödinger e respinge l interpretazione probabilistica di Born.
40 1927 Heisenberg enuncia il principio di indeterminazione: In ogni misura della posizione e della quantità di moto di una particella, il prodotto dell'incertezza sulla posizione e di quella sulla quantità di moto non può mai essere inferiore ad una certa quantità. Il principio di Heisenberg, insieme alla meccanica delle matrici, costituisce un modello teorico della meccanica quantistica, detto interpretazione di Copenhagen. Einstein contesta questo risultato.
41 Negli anni successivi, Bohr ed Einstein si scontrano più volte sui risultati della meccanica quantistica. Per Bohr, la meccanica quantistica è un modello completo. La fisica può dare solo uno studio approssimato della realtà: È sbagliato pensare che compito della fisica sia scoprire com'è fatta la natura. La fisica ha per oggetto ciò che possiamo dire sulla natura. Per Einstein, invece, la meccanica quantistica è soltanto una prima teoria, che andrà integrata con una teoria complessiva, in grado di descrivere la realtà: Persisto a credere alla possibilità di un modello della realtà: vale a dire, di una teoria che rappresenti gli eventi stessi e non soltanto le probabilità del loro verificarsi.
42 1935 Schrödinger si schiera con Einstein ed enuncia il paradosso del gatto: Immaginiamo un gatto in una stanza dove c'è un contatore Geiger contenente una sostanza radioattiva che, in un certo intervallo di tempo, ha una probabilità ½ di decadere e ½ di non decadere. Se avviene il decadimento, si aziona un martello che rompe una fiala di veleno che uccide il gatto. Se non avviene, il gatto resta vivo.
43 Stando alla meccanica quantistica, l'unico modo di verificare se il gatto sia vivo o morto è di fare una misurazione. Fintanto che la misurazione non avviene, il gatto è sia vivo che morto, contro il senso comune, che dice che esso deve essere vivo o morto.
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
La nascita della fisica moderna. (un racconto di inizio 900)
 La nascita della fisica moderna (un racconto di inizio 900) Sviluppo storico della fisica tra fine 800 e il 1927 Fisica sperimentale fine 800 Fisica teorica fine 800 1900 1905 1911 1913 1916 1924 1925-1927
La nascita della fisica moderna (un racconto di inizio 900) Sviluppo storico della fisica tra fine 800 e il 1927 Fisica sperimentale fine 800 Fisica teorica fine 800 1900 1905 1911 1913 1916 1924 1925-1927
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
La struttura della materia
 La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
Lezioni di Meccanica Quantistica
 Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa [email protected] www.edizioniets.com
Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa [email protected] www.edizioniets.com
L atomo di Bohr. Argomenti. Al tempo di Bohr. Spettri atomici 19/03/2010
 Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
La complessa semplicità dell'atomo di idrogeno!
 La complessa semplicità dell'atomo di idrogeno Bergamo, venerdì 1 Febbraio 2013 Stefano Covino INAF - Osservatorio Astronomico di Brera Un po di terminologia Atomo (dal greco, indivisibile): atomismo (Leucippo,
La complessa semplicità dell'atomo di idrogeno Bergamo, venerdì 1 Febbraio 2013 Stefano Covino INAF - Osservatorio Astronomico di Brera Un po di terminologia Atomo (dal greco, indivisibile): atomismo (Leucippo,
La teoria del corpo nero
 La teoria del corpo nero Max Planck Primo Levi 2014 Roberto Bedogni INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
La teoria del corpo nero Max Planck Primo Levi 2014 Roberto Bedogni INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9
 Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9 Esercizio PAG 198 ES 1 PAG 198 ES 2 PAG 198 ES 3 PAG 198 ES 4 PAG 198 ES 5 PAG 198 ES 6 PAG 198 ES 7 PAG 198 ES 8 PAG
Pinzani, Panero, Bagni Sperimentare la chimica Soluzioni degli esercizi Capitolo 9 Esercizio PAG 198 ES 1 PAG 198 ES 2 PAG 198 ES 3 PAG 198 ES 4 PAG 198 ES 5 PAG 198 ES 6 PAG 198 ES 7 PAG 198 ES 8 PAG
Università Primo Levi
 Università Primo Levi Primo Levi 2013 Le forze fondamentali e la fisica dei quanta INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
Università Primo Levi Primo Levi 2013 Le forze fondamentali e la fisica dei quanta INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Misura del momento magnetico dell elettrone
 FACOLTÀ Università degli Studi di Roma Tre DI SCIENZE MATEMATICHE, FISICHE E NATURALI Corso di Laurea in Fisica Misura del momento magnetico dell elettrone Candidato: Andrea Sciandra Matricola 4480 Relatore:
FACOLTÀ Università degli Studi di Roma Tre DI SCIENZE MATEMATICHE, FISICHE E NATURALI Corso di Laurea in Fisica Misura del momento magnetico dell elettrone Candidato: Andrea Sciandra Matricola 4480 Relatore:
Quarta unità didattica. Disposizione degli elettroni nell atomo
 Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Unità Didattica 3. L atomo di idrogeno
 Diapositiva 1 Unità Didattica 3 L atomo di idrogeno Questa unità contiene informazioni sull atomo di idrogeno, i modelli di Tomson, Ruterford e Bor, l esperimento di Frank-Hertz e infine la formula di
Diapositiva 1 Unità Didattica 3 L atomo di idrogeno Questa unità contiene informazioni sull atomo di idrogeno, i modelli di Tomson, Ruterford e Bor, l esperimento di Frank-Hertz e infine la formula di
Corso di CHIMICA LEZIONE 2
 Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
La Meccanica Quantistica
 La Meccanica Quantistica Se quando pensiamo a un atomo ci immaginiamo qualcosa di questo tipo Dobbiamo rivedere le nostre idee LA CRISI DELLA FISICA CLASSICA La crisi della fisica classica Un secolo fa
La Meccanica Quantistica Se quando pensiamo a un atomo ci immaginiamo qualcosa di questo tipo Dobbiamo rivedere le nostre idee LA CRISI DELLA FISICA CLASSICA La crisi della fisica classica Un secolo fa
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Sulla nascita di questo libro. Introduzione 1
 Indice Sulla nascita di questo libro V Introduzione 1 1 Luce e materia 7 Che cos è veramente la luce? 7 Ma qui che cosa oscilla? 9 Che cosa sono la frequenza e la lunghezza d onda della luce? 11 Che cos
Indice Sulla nascita di questo libro V Introduzione 1 1 Luce e materia 7 Che cos è veramente la luce? 7 Ma qui che cosa oscilla? 9 Che cosa sono la frequenza e la lunghezza d onda della luce? 11 Che cos
CORSO DI LAUREA IN OTTICA E OPTOMETRIA
 CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
Bohr e la struttura dell atomo. Lezioni 11-12
 Bohr e la struttura dell atomo Lezioni 11-12 Onde elettromagnetiche Radiazione Elettromagnetica raggi X e raggi > 10 3 Hz
Bohr e la struttura dell atomo Lezioni 11-12 Onde elettromagnetiche Radiazione Elettromagnetica raggi X e raggi > 10 3 Hz
Modelli atomici. Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle.
 Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
FISICA QUANTISTICA LIMITI AL MODELLO ATOMICO DI RUTHERFORD. e - Per spiegare la disposizione degli elettroni nell atomo (STRUTTURA ELETTRONICA)
 LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
Fisica atomica. Marcello Borromeo corso di Fisica per Farmacia - Anno Accademico
 Fisica atomica Nel 1905 Einstein sostiene che la luce viaggia in pacchetti di energia, chiamati fotoni Ogni fotone ha energia proporzionale alla propria frequenza E = hν: h = 6.626 10 34 J s è chiamata
Fisica atomica Nel 1905 Einstein sostiene che la luce viaggia in pacchetti di energia, chiamati fotoni Ogni fotone ha energia proporzionale alla propria frequenza E = hν: h = 6.626 10 34 J s è chiamata
L energia assorbita dall atomo durante l urto iniziale è la stessa del fotone che sarebbe emesso nel passaggio inverso, e quindi vale: m
 QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
QUESITI 1 Quesito Nell esperimento di Rutherford, una sottile lamina d oro fu bombardata con particelle alfa (positive) emesse da una sorgente radioattiva. Secondo il modello atomico di Thompson le particelle
STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA
 pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
pg 1 STRUTTURA ATOMICA E CONFIGURAZIONE ELETTRONICA Per capire il comportamento degli atomi dobbiamo studiare il comportamento dei suoi elettroni L'atomo e le sue particelle NON sono direttamente visibili
Quadro di Riferimento della II prova di Fisica dell esame di Stato per i Licei Scientifici
 Quadro di Riferimento della II prova di Fisica dell esame di Stato per i Licei Scientifici Il presente documento individua le conoscenze, abilità e competenze che lo studente dovrà aver acquisito al termine
Quadro di Riferimento della II prova di Fisica dell esame di Stato per i Licei Scientifici Il presente documento individua le conoscenze, abilità e competenze che lo studente dovrà aver acquisito al termine
Natura ondulatoria della luce. Natura corpuscolare della luce
 Natura ondulatoria della luce Data 1803 Autore Thomas Young Esperimento Un fascio di luce solare viene fatto passare da un foro e davanti a questo foro vi è un pannello con due fenditure verticali (coperte
Natura ondulatoria della luce Data 1803 Autore Thomas Young Esperimento Un fascio di luce solare viene fatto passare da un foro e davanti a questo foro vi è un pannello con due fenditure verticali (coperte
6) Modello atomico a ORBITALI
 6) Modello atomico a ORBITALI PREMESSA: LIMITI DEL MODELLO DI BOHR (pag. 94 par.3) Applicando il concetto di quantizzazione dell E all atomo, Bohr ipotizzò che un atomo potesse esistere solo in determinati
6) Modello atomico a ORBITALI PREMESSA: LIMITI DEL MODELLO DI BOHR (pag. 94 par.3) Applicando il concetto di quantizzazione dell E all atomo, Bohr ipotizzò che un atomo potesse esistere solo in determinati
INDICE 1. LA CRISI DELLA FISICA CLASSICA
 INDICE 1. LA CRISI DELLA FISICA CLASSICA 1.1 Modelli atomici... 1 1.2 Il problema delle dimensioni atomiche e del collasso per irraggiamento 4 1.3 Difficoltà connesse con i calori specifici... 7 1.4 L
INDICE 1. LA CRISI DELLA FISICA CLASSICA 1.1 Modelli atomici... 1 1.2 Il problema delle dimensioni atomiche e del collasso per irraggiamento 4 1.3 Difficoltà connesse con i calori specifici... 7 1.4 L
Interferenza di elettroni e! Principio di Indeterminazione
 Interferenza di elettroni e! Principio di Indeterminazione Paolo Pendenza Corso PAS, 10 luglio 2014 Anche nelle scienze non si possono scoprire nuove terre se non si è pronti a lasciarsi indietro il porto
Interferenza di elettroni e! Principio di Indeterminazione Paolo Pendenza Corso PAS, 10 luglio 2014 Anche nelle scienze non si possono scoprire nuove terre se non si è pronti a lasciarsi indietro il porto
3. Struttura dell atomo
 Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
May 5, 2013. Fisica Quantistica. Monica Sambo. Sommario
 May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
Misura del rapporto carica massa dell elettrone
 Relazione di: Pietro Ghiglio, Tommaso Lorenzon Laboratorio di fisica del Liceo Scientifico L. da Vinci - Gallarate Misura del rapporto carica massa dell elettrone Lezioni di maggio 2015 Lo scopo dell esperienza
Relazione di: Pietro Ghiglio, Tommaso Lorenzon Laboratorio di fisica del Liceo Scientifico L. da Vinci - Gallarate Misura del rapporto carica massa dell elettrone Lezioni di maggio 2015 Lo scopo dell esperienza
Il metodo scientifico
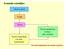 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
La Matematica del Mondo dei Quanti
 La Matematica del Mondo dei Quanti Gerardo Morsella Dipartimento di Matematica Scienza Orienta 2017 Università di Roma Tor Vergata 13 febbraio 2017 Gerardo Morsella (Mat) La Matematica del Mondo dei Quanti
La Matematica del Mondo dei Quanti Gerardo Morsella Dipartimento di Matematica Scienza Orienta 2017 Università di Roma Tor Vergata 13 febbraio 2017 Gerardo Morsella (Mat) La Matematica del Mondo dei Quanti
Introduzione al corso di Fisica dei Semiconduttori
 Introduzione al corso di Fisica dei Semiconduttori Mara Bruzzi 8 settembre 016 1 a lezione : dualismo onda-corpuscolo a.l ipotesi di Planck e il corpo nero b.effetto Fotoelettrico c. Primi modelli atomici
Introduzione al corso di Fisica dei Semiconduttori Mara Bruzzi 8 settembre 016 1 a lezione : dualismo onda-corpuscolo a.l ipotesi di Planck e il corpo nero b.effetto Fotoelettrico c. Primi modelli atomici
Capitolo 2. Cenni alla Composizione e Struttura dell atomo
 Master in Verifiche di qualità in radiodiagnostica, medicina nucleare e radioterapiar Capitolo 2 Cenni alla Composizione e Struttura dell atomo 24 Atomi, Molecole,, e Ioni L idea di Atomo è antica come
Master in Verifiche di qualità in radiodiagnostica, medicina nucleare e radioterapiar Capitolo 2 Cenni alla Composizione e Struttura dell atomo 24 Atomi, Molecole,, e Ioni L idea di Atomo è antica come
LA CRISI DELLA FISICA CLASSICA
 LA CRISI DELLA FISICA CLASSICA I a Parte: - Comportamento corpuscolare della luce II a Parte: - Il modello atomico - Comportamento ondulatorio della materia III a Parte: - Dualità onda-particella: esperimento
LA CRISI DELLA FISICA CLASSICA I a Parte: - Comportamento corpuscolare della luce II a Parte: - Il modello atomico - Comportamento ondulatorio della materia III a Parte: - Dualità onda-particella: esperimento
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Il corpo nero e l ipotesi di Planck
 Il corpo nero e l ipotesi di Planck La crisi della fisica classica Alla fine del XIX secolo ci sono ancora del fenomeni che la fisica classica non riesce a spiegare: lo spettro d irraggiamento del corpo
Il corpo nero e l ipotesi di Planck La crisi della fisica classica Alla fine del XIX secolo ci sono ancora del fenomeni che la fisica classica non riesce a spiegare: lo spettro d irraggiamento del corpo
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
2bis. I modelli atomici
 2bis. I modelli atomici 2.1 Il modello di Thomson 2.2 Il modello di Rutherford; 2.3 Il dualismo particella-onda; 2.4 Il modello di Bohr 2.5 Il modello a orbitali 2.6 Il riempimento degli orbitali e le
2bis. I modelli atomici 2.1 Il modello di Thomson 2.2 Il modello di Rutherford; 2.3 Il dualismo particella-onda; 2.4 Il modello di Bohr 2.5 Il modello a orbitali 2.6 Il riempimento degli orbitali e le
LA RIVOLUZIONE QUANTISTICA
 LA RIVOLUZIONE QUANTISTICA Franco Prati Università dell Insubria - Como NINDA URUK Il pane dei Sumeri Ricerca scientifica ed epistemologia 5 dicembre 2012 Congresso Internazionale dei Fisici in onore di
LA RIVOLUZIONE QUANTISTICA Franco Prati Università dell Insubria - Como NINDA URUK Il pane dei Sumeri Ricerca scientifica ed epistemologia 5 dicembre 2012 Congresso Internazionale dei Fisici in onore di
LASER. Light Amplification by Stimulated Emission of Radiation. Introduzione. Assorbimento, emissione spontanea, emissione stimolata
 LASER Light Amplification by Stimulated Emission of Radiation Introduzione. Assorbimento, emissione spontanea, emissione stimolata Cenni storici 1900 Max Planck introduce la teoria dei quanti (la versione
LASER Light Amplification by Stimulated Emission of Radiation Introduzione. Assorbimento, emissione spontanea, emissione stimolata Cenni storici 1900 Max Planck introduce la teoria dei quanti (la versione
IL MODELLO ATOMICO DI BOHR
 IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
IL MODELLO ATOMICO DI BOHR LA LUCE Un valido contributo alla comprensione della struttura dell atomo venne dato dallo studio delle radiazioni luminose emesse dagli atomi opportunamente sollecitati. Lo
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi stato fondamentale stati eccitati
 4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
4. Lo spettro discreto: emissione e assorbimento di luce da parte di atomi Accanto allo spettro continuo che i corpi emettono in ragione del loro stato termico, si osservano spettri discreti che sono caratteristici
CHIMICAMENTE. Lezioni del prof. Puletti Classe II B
 CHIMICAMENTE Lezioni del prof. Puletti Classe II B Scuola Media PIO X Artigianelli A.S. 2011-2012 PERCORSO - cos è la materia e da cosa è costituita - le particelle atomiche fondamentali: protoni, neutroni
CHIMICAMENTE Lezioni del prof. Puletti Classe II B Scuola Media PIO X Artigianelli A.S. 2011-2012 PERCORSO - cos è la materia e da cosa è costituita - le particelle atomiche fondamentali: protoni, neutroni
Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti.
 1. La natura elettrica della materia Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti. La carica elettrica può essere positiva o
1. La natura elettrica della materia Lo strofinio di qualsiasi oggetto provoca la comparsa su di esso di una carica elettrica che può attrarre piccoli oggetti. La carica elettrica può essere positiva o
I modelli atomici da Dalton a Bohr
 1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
1 Espansione 2.1 I modelli atomici da Dalton a Bohr Modello atomico di Dalton: l atomo è una particella indivisibile. Modello atomico di Dalton Nel 1808 John Dalton (Eaglesfield, 1766 Manchester, 1844)
Un introduzione alla Meccanica Quantistica
 Un introduzione alla Meccanica Quantistica La Teoria che nessuno capisce! Chiunque non resti sconvolto dalla teoria quantistica, sicuramente NON L HA CAPITA N. Bohr Quanto piu` la teoria dei quanti incontra
Un introduzione alla Meccanica Quantistica La Teoria che nessuno capisce! Chiunque non resti sconvolto dalla teoria quantistica, sicuramente NON L HA CAPITA N. Bohr Quanto piu` la teoria dei quanti incontra
Particelle Subatomiche
 GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
GLI ATOMI Particelle Subatomiche ELEMENTI I diversi atomi sono caratterizzati da un diverso numero di protoni e neutroni; il numero di elettroni è sempre uguale al numero dei protoni (negli atomi neutri)
Il principio di indeterminazione di Heisenberg
 Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
Il principio di indeterminazione di Heisenberg Il prodotto degli errori nella determinazione contemporanea della quantità di moto (q = mv) e della posizione di un corpo in movimento è almeno uguale a h
PROFILO IN USCITA PER IL PRIM0 ANNO FISICA Sezioni internazionale ad opzione Inglese (L,M,N,O,P,Q)
 PROFILO IN USCITA PER IL PRIM0 ANNO Premessa Come stabilito dal Collegio dei docenti e conformemente con gli obiettivi della attuale sperimentazione, la programmazione seguirà, principalmente, la scansione
PROFILO IN USCITA PER IL PRIM0 ANNO Premessa Come stabilito dal Collegio dei docenti e conformemente con gli obiettivi della attuale sperimentazione, la programmazione seguirà, principalmente, la scansione
Come vediamo. La luce: aspetti fisici. Cos è la luce? Concetti fondamentali:
 La luce in fisica La luce: aspetti fisici Cos è la luce? Concetti fondamentali: - velocità, ampiezza, lunghezza d onda - assorbimento - riflessione -rifrazione - diffrazione - indice di rifrazione - temperatura
La luce in fisica La luce: aspetti fisici Cos è la luce? Concetti fondamentali: - velocità, ampiezza, lunghezza d onda - assorbimento - riflessione -rifrazione - diffrazione - indice di rifrazione - temperatura
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
GLI ORBITALI ATOMICI I numeri quantici Le funzioni d onda Ψ n, soluzioni dell equazione d onda, sono caratterizzate da certe combinazioni di numeri quantici: n, l, m l, m s n = numero quantico principale,
Spettroscopia. Spettroscopia
 Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
Spettroscopia Spettroscopia IR Spettroscopia NMR Spettrometria di massa 1 Spettroscopia E un insieme di tecniche che permettono di ottenere informazioni sulla struttura di una molecola attraverso l interazione
Tutta la materia è fatta da particelle piccolissime, invisibili ed indivisibili dette ATOMI;
 Tutta la materia è fatta da particelle piccolissime, invisibili ed indivisibili dette ATOMI; ELEMENTO: sostanza formata da un solo tipo di atomi, tutti uguali e con le stesse proprietà chimiche; COMPOSTO:
Tutta la materia è fatta da particelle piccolissime, invisibili ed indivisibili dette ATOMI; ELEMENTO: sostanza formata da un solo tipo di atomi, tutti uguali e con le stesse proprietà chimiche; COMPOSTO:
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. Le particelle fondamentali
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 7 Le particelle dell atomo 1. La natura elettrica della materia 2. Le particelle fondamentali
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
ESAME DI STATO DI LICEO SCIENTIFICO - SCIENTIFICO TECNOLOGICO 2010 Corso Sperimentale Progetto Brocca Tema di Fisica
 ESAME DI STATO DI LICEO SCIENTIFICO - SCIENTIFICO TECNOLOGICO 2010 Corso Sperimentale Progetto Brocca Tema di Fisica La prova Il candidato svolga una relazione su uno solo dei seguenti due temi, a sua
ESAME DI STATO DI LICEO SCIENTIFICO - SCIENTIFICO TECNOLOGICO 2010 Corso Sperimentale Progetto Brocca Tema di Fisica La prova Il candidato svolga una relazione su uno solo dei seguenti due temi, a sua
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI
 CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
CHIMICA E SCIENZA E TECNOLOGIA DEI MATERIALI ELETTRICI Elettrici I anno - III Quadr. a.acc. 2006/07 Laboratorio: Laboratorio Materiali piano S-1 26/04/2007 Chimica e Scienza e Tecnologia dei Materiali
Storia delle scoperte delle cariche elettriche
 Storia delle scoperte delle cariche elettriche Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia VI secolo a.c. Talete osserva che l'ambra, strofinata con un panno di lana, è capace
Storia delle scoperte delle cariche elettriche Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia VI secolo a.c. Talete osserva che l'ambra, strofinata con un panno di lana, è capace
Introduzione ai fenomeni quantistici
 Introduzione ai fenomeni quantistici Tratto da: The Feynman lectures on physics, vol. 3 Marco Bonvini Nicodemo Magnoli Meccanica: Keplero (1608-1619) Galilei (1630) Newton (1687) Termodinamica: Kelvin
Introduzione ai fenomeni quantistici Tratto da: The Feynman lectures on physics, vol. 3 Marco Bonvini Nicodemo Magnoli Meccanica: Keplero (1608-1619) Galilei (1630) Newton (1687) Termodinamica: Kelvin
Produzione dei raggi X
 I RAGGI X Produzione dei raggi X Tubo a raggi X Emissione per frenamento Emissione per transizione Spettro di emissione pag.1 Lunghezza d onda, frequenza, energia (fm) λ (m) 10 14 RAGGI GAMMA ν 10 12 (Å)
I RAGGI X Produzione dei raggi X Tubo a raggi X Emissione per frenamento Emissione per transizione Spettro di emissione pag.1 Lunghezza d onda, frequenza, energia (fm) λ (m) 10 14 RAGGI GAMMA ν 10 12 (Å)
Esp. 4: Spettrofotometro
 Esp. 4: Spettrofotometro Spettrofotometria Reticolo di diffrazione d sinϑ = mλ Schermo Nel nostro esp. Si acquisisce al variare dell angolo l intensità luminosa. Noi riusciamo a misurare solo il primo
Esp. 4: Spettrofotometro Spettrofotometria Reticolo di diffrazione d sinϑ = mλ Schermo Nel nostro esp. Si acquisisce al variare dell angolo l intensità luminosa. Noi riusciamo a misurare solo il primo
Fisica delle Apparecchiature per Radioterapia, lez. III RADIOTERAPIA M. Ruspa 1
 RADIOTERAPIA 14.01.11 M. Ruspa 1 Con il termine RADIOTERAPIA si intende l uso di radiazioni ionizzanti altamente energetiche (fotoni X o gamma, elettroni, protoni) nel trattamento dei tumori. La radiazione
RADIOTERAPIA 14.01.11 M. Ruspa 1 Con il termine RADIOTERAPIA si intende l uso di radiazioni ionizzanti altamente energetiche (fotoni X o gamma, elettroni, protoni) nel trattamento dei tumori. La radiazione
LICEO SCIENTIFICO VITO VOLTERRA
 LICEO SCIENTIFICO VITO VOLTERRA DIPARTIMENTO DI FISICA ORIETTA DI BIAGIO Penso si possa tranquillamente affermare che nessuno capisce la meccanica quantistica Richard P. Feynman Premio Nobel nel 1963 Quelli
LICEO SCIENTIFICO VITO VOLTERRA DIPARTIMENTO DI FISICA ORIETTA DI BIAGIO Penso si possa tranquillamente affermare che nessuno capisce la meccanica quantistica Richard P. Feynman Premio Nobel nel 1963 Quelli
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 7 Le particelle dell atomo 3 Sommario (I) 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 7 Le particelle dell atomo 3 Sommario (I) 1. La natura elettrica della materia 2. La scoperta delle proprietà elettriche 3. Le
Indice. Elettrostatica in presenza di dielettrici Costante dielettrica Interpretazione microscopica 119. capitolo. capitolo.
 Indice Elettrostatica nel vuoto. Campo elettrico e potenziale 1 1. Azioni elettriche 1 2. Carica elettrica e legge di Coulomb 5 3. Campo elettrico 8 4. Campo elettrostatico generato da sistemi di cariche
Indice Elettrostatica nel vuoto. Campo elettrico e potenziale 1 1. Azioni elettriche 1 2. Carica elettrica e legge di Coulomb 5 3. Campo elettrico 8 4. Campo elettrostatico generato da sistemi di cariche
1. L'esperienza di Rutherford Dal Seicento all'ottocento si sviluppò lo studio delle strutture microscopiche, grazie ai microscopi ottici.
 Il modello atomico 1. L'esperienza di Rutherford Dal Seicento all'ottocento si sviluppò lo studio delle strutture microscopiche, grazie ai microscopi ottici. I microscopi ottici, tuttavia, non vedono attraverso
Il modello atomico 1. L'esperienza di Rutherford Dal Seicento all'ottocento si sviluppò lo studio delle strutture microscopiche, grazie ai microscopi ottici. I microscopi ottici, tuttavia, non vedono attraverso
Effetto Zeeman anomalo
 Effetto Zeeman anomalo Direzione del campo B esempio: : j=3/2 Direzione del campo B j=1+1/2 = 3/2 s m j =+3/2 m j =+1/2 l m j =-1/2 m j =-3/2 La separazione tra i livelli é diversa l e µ l antiparalleli
Effetto Zeeman anomalo Direzione del campo B esempio: : j=3/2 Direzione del campo B j=1+1/2 = 3/2 s m j =+3/2 m j =+1/2 l m j =-1/2 m j =-3/2 La separazione tra i livelli é diversa l e µ l antiparalleli
ESERCIZI W X Y Z. Numero di massa Neutroni nel nucleo Soluzione
 ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
ESERCIZI 1) La massa di un elettrone, rispetto a quella di un protone, è: a. uguale b. 1850 volte più piccola c. 100 volte più piccola d. 18,5 volte più piccola 2) I raggi catodici sono: a. radiazioni
Lo Spettro Elettromagnetico
 Spettroscopia 1 Lo Spettro Elettromagnetico Lo spettro elettromagnetico è costituito da un insieme continuo di radiazioni (campi elettrici e magnetici che variano nel tempo, autogenerandosi) che va dai
Spettroscopia 1 Lo Spettro Elettromagnetico Lo spettro elettromagnetico è costituito da un insieme continuo di radiazioni (campi elettrici e magnetici che variano nel tempo, autogenerandosi) che va dai
13 ottobre Prof. Manlio Bellesi
 XV OLIMPIADI ITALIANE DI ASTRONOMIA MODENA 2015 13 ottobre 2014 Prof. Manlio Bellesi Fin dalle origini gli esseri umani hanno osservato il cielo. Cosmologie, miti, religioni, aspirazioni e sogni hanno
XV OLIMPIADI ITALIANE DI ASTRONOMIA MODENA 2015 13 ottobre 2014 Prof. Manlio Bellesi Fin dalle origini gli esseri umani hanno osservato il cielo. Cosmologie, miti, religioni, aspirazioni e sogni hanno
LE PARTICELLE ELEMENTARI: loro scoperta
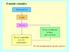 LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
LE PARTICELLE ELEMENTARI: loro scoperta Atomo: composto da particelle elementari più piccole (protoni, neutroni, elettroni) Atomi di elementi diversi contengono le STESSE particelle, ma in numero diverso
