Boehringer Ingelheim Sinossi del Protocollo - Versione 1.0 del 05 Febbraio 2010 Studio N di 11 SINOSSI DEL PROTOCOLLO
|
|
|
- Michelina Morelli
- 7 anni fa
- Visualizzazioni
Transcript
1 1 di 11 SINOSSI DEL PROTOCOLLO Titolo dello : Studio randomizzato di fase III con con aggiunta di paclitaxel settimanale verso monochemioterapia a scelta in seguito a monoterapia con in pazienti con tumore del polmone non a piccole cellule nei quali sia fallito un trattamento precedente con erlotinib o gefitinib. Coordinatori Internazionali: Professor Martin Schuler, M.D. Innere Klinik Tumorforschung Westdeutsches Tumorzentrum Universitätsklinikum Essen Hufelandstrasse Essen, Germany Phone: +49 (0201) Fax: +49 (0201) Sai-Hong Ignatius Ou, M.D., Ph.D. Div. of Hematol.-Med. Oncology Chao Family Comprehensive Cancer Center UCI 101 City Drive, Bldg 56, RT 81 Orange, CA USA Phone: Fax: Coordinatore Nazionale: Dr. Filippo DE MARINIS U.O.C. di Pneumologia ad Indirizzo Oncologico I Ospedale San Camillo e Forlanini Piazza Carlo Forlanini, ROMA Centri: In Italia: Fase Clinica: Metodologia: Multicentrico 9 centri III Studio randomizzato, in aperto, controllato verso farmaco attivo Obiettivo: Valutare l efficacia e la sicurezza di con aggiunta di paclitaxel settimanale verso una monochemioterapia a scelta in pazienti con tumore del polmone non a piccole cellule (NSCLC) di stadio IIIb o IV, che abbiano avuto un beneficio da una monoterapia con BIBW 2992 dopo il fallimento di almeno una prima linea di trattamento chemioterapico e che abbiano precedentemente ricevuto un trattamento con erlotinib o gefitinib. Pazienti con una nota mutazione EGFR attivante o un tempo alla progressione 6 mesi durante il trattamento con erlotinib o gefitinib sono eleggibili senza precedente terapia chemioterapica.
2 2 di 11 N. Pazienti Totale: Cira 900 pazienti arruolati (Parte A) 300 pazienti randomizzati (Parte B) per trattamento: Parte A (monoterapia ): 900 pazienti Parte B Braccio 1 - (/qd + paclitaxel settimanale): 200pazienti Braccio 2 - (chemioterapia a scelta es paclitaxel o pemetrexed): 100 pazienti Farmaco sperimentale: Parte A: Parte B / Braccio 1: + paclitaxel settimanale dosaggio: Parte A: 50 mg qd Parte B / Braccio 1: 40 mg qd + paclitaxel (80 mg/m 2 ) Modalità di somministrazione : Farmaco di confronto: dosaggio: Modalità di somministrazione : Durata del trattamento: Diagnosi e principali criteri di inclusione: : Orale, continuo una volta al giorno Paclitaxel: e.v, settimanale Parte B / Braccio 2: Singolo agente chemioterapico a scelta es. Paclitaxel o Pemetrexed secondo schema terapeutico Paclitaxel: e.v. settimanale Pemetrexed: e.v. ogni 21 giorni Parte A: trattamento continuo con fino alla progressione della patologia o tossicità Parte B: trattamento fino ad ulteriore progressione o tossicità eccessiva Parte A 1. Pazienti con diagnosi patologica confermata di NSCLC stadio IIIb (con conferma citologica di versamento pleurico o pericardico) o stadio IV che hanno fallito un trattamento precedente con erlotinib (Tarceva ) o gefitinib (Iressa ); 2. Pazienti che hanno ricevuto e fallito almeno una prima linea di chemioterapia citotossica per patologia avanzata o metastatica; tuttavia i seguenti pazienti sono elegibili senza chemioterapia precedente:
3 3 di 11 Diagnosi e principali criteri di inclusione: a) Pazienti con mutazione di EGFR rilevata con metodi riconosciuti dopo una terapia con TKIs reversibili; b) Pazienti con beneficio clinico (stabilizzazione della patologia o risposta antitumorale) da trattamento con erlotinib (Tarceva ) o gefitinib (Iressa ) per 6 mesi; 3. Punteggio del Eastern Cooperative Oncology Group (ECOG) tra 0 2; 4. Pazienti con almeno una lesione tumorale accuratamente misurabile tramite risonanza magnetica (MRI) o tomografia computerizzata (TC) in almeno una dimensione e con diametro di 20 mm, utilizzando le tecniche convenzionali, oppure 10 mm con TC spirale in accordo al RECIST 1.1; 5. Pazienti di entrambe i sessi di età 18 anni; 6. Aspettativa di vita di almeno 12 settimane; 7. Consenso informato scritto in accordo alle linee guida ICH-GCP. Parte B 1. Beneficio clinico (stabilizzazione della patologia o risposta antitumorale) della durata di oltre 12 settimane nella Parte A dello ; 2. Pazienti progrediti nella Parte A in accordo con RECIST 1.1; 3. Firma del nuovo consenso informato, incluso il consenso per il campionamento dei biomarcatori, prima dell inclusione nella Parte B dello ; Criteri di esclusione: 1. Trattamento precedente con ; 2. Chemio-, ormonoterapia (diversi dai corticosteroidi necessari per la terapia non tumorale di mantenimento o come premedicazione prima della chemioterapia) o immunoterapia nelle 4 settimane precedenti al consenso; 3. Metastasi celebrali attive (stabili per < 4 settimane, sintomatiche o leptomeningee). Terapia con desametasone sarà permessa se somministrato come dose stabile per almeno un mese prima della randomizzazione;
4 4 di 11 Criteri di esclusione: 4. Recenti disordini gastrointestinali acuti o significativi con sintomo principale di diarrea e.s. malattia di Crohn, malassorbimento o CTCAE di grado > 2, diarrea di qualunque eziologia al basale; 5. Pazienti con qualsiasi altra malattia a rischio di vita o disfunzioni di sistema o d organo, che nell opinione dello sperimentatore, possano o compromettere la sicurezza del paziente o interferire con la valutazione della sicurezza del farmaco sperimentale; 6. Diagnosi di altri tumori (diversi da tumori non melanomatosi della pelle e tumori cervicali in situ) che richiedano terapie; 7. Radioterapia nelle 2 settimane precedenti al trattamento con il farmaco sperimentale; 8. Presenza o storia di patologie cardiovascolari clinicamente significative come ipertensione non controllata, insufficienza cardiaca congestizia di grado 3 della classificazione New York Heart Association (NYHA), angina instabile, aritmia mal controllata. Infarto del miocardio entro i sei mesi precedenti la randomizzazione. 9. Funzionalità cardiaca del ventricolo sinistro con frazione di eiezione a riposo minore del 50% misurata con MUGA (multigated blood pool imaging of the heart/multigated acquisition scan) o con ecocardiogramma; 10. Trattamento precedente con antracicline con una dose cumulativa di doxorubicina (o equivalente) 400 mg/m 2 ; 11. Conta assoluta dei neutrofili (ANC) 1500 / mm 3 ; 12. Conta delle piastrine 100,000 / mm 3 ; 13. Bilirubina 1.5 mg / dl (>26 µmol / L, SI unità equivalenti); 14. Aspartato amino transferasi (AST) or alanina amino transferasi (ALT) tre volte il limite superiore di normalità (se correlato a metastasi epatiche cinque volte il limite superiore di normalità); 15. Creatinina sierica 1.5 volte il limite superiore di normalità o clearance creatinina calcolata/misurata 45 ml/min; 16. Donne o uomini fertili che non vogliano utilizzare un metodo contraccettivo accettabile dal punto di vista medico durante lo ; 17. Donne gravide o in allattamento; 18. Pazienti non in grado di attenersi alle procedure del protocollo; 19. Pazienti con qualsiasi infezione attiva seria inclusi Human Immunodeficiency Virus (HIV), epatite B attiva o epatite C attiva; 20. Noto o sospetto abuso attivo di farmaci o alcolici; 21. Malattie Polmonari Interstiziali (ILD) pre-esistente o in atto; 22. Polineuropatia periferica di grado superiore a 2.
5 5 di 11 Restrizioni: Restrizioni per (Parte A e Parte B/Braccio 1) Pazienti in trattamento con (Parte A) o /paclitaxel (Parte B/Braccio 1) non potranno ricevere altri farmaci antitumorali sperimentali, chemioterapia, immunoterapia, ormonoterapia (eccetto megestrolo acetato o corticosteroidi somministrati come antiemetici, per il trattamento del dolore o inappetenza), radioterapia (eccetto radioterapia palliativa per lesioni non- target) dalla firma del consenso alla visita EOT. Restrictions per monochemioterapia (Parte B/Braccio 2) Pazienti in trattamento con monochemioterapia non potranno ricevere altri farmaci antitumorali, chemioterapia, immunoterapia, ormonoterapia (eccetto megestrolo acetato o corticosteroidi somministrati come antiemetici, per il trattamento del dolore o inappetenza), terapia di supporto per NSCLC o radioterapia (eccetto radioterapia palliativa per lesioni nontarget) dalla firma del consenso alla visita EOT. Criteri di valutazione dell efficacia: Endpoint primario: Tempo di sopravvivenza (Overall Survival -OS) dalla data di randomizzazione alla data di morte del paziente randomizzato al trattamento con terapia combinata /paclitaxel oppure chemioterapia di confronto. Endpoints secondari: 1. Sopravvivenza libera da malattia (Progression Free Survival - PFS) determinata dal Response Criteria in Solid Tumours (RECIST) 1.1, rispettivamente per la Parte A e Parte B; 2. Beneficio clinico a 3 mesi definito come sopravvivenza senza progressione a 3 mesi, rispettivamente per la Parte A e Parte B; 3. Risposta obiettiva (risposta completa [CR], risposta parziale [PR]) in seguito a monoterapia con in accordo a RECIST 1.1; 4. Risposta obiettiva (CR, PR) in seguito a terapia combinata di / paclitaxel oppure chemioterapia di confronto in seguito a progressione in accordo a RECIST 1.1; 5. Tempo alla risposta obiettiva, rispettivamente per la Parte A e la Parte B; 6. HRQOL definito come il tempo al deterioramento dei tre sintomi di tosse, dispnea e dolore secondo questionari del European Organization for Research and Treatment of Cancer (EORTC) QLQ-LC13 e QLQ C30 Criteri per la valutazione della sicurezza: Endpoint secondario: Tollerabilità di valutata in termini di incidenza e intensità di eventi avversi, secondo la scala Common Terminology Classification for Adverse Events (CTCAE versione 3.0) del National Cancer Institute nord americano, rispettivamente per la Parte A e Parte B.
6 6 di 11 Metodi statistici: Le analisi finali del tempo di sopravvivenza e degli obiettivi secondari saranno effettuate quando verranno osservate 170 morti fra tutti i pazienti randomizzati. Il Log-rank test, stratificato per (1) la durata del beneficio clinico di erlotinib o gefitinib ( 6 mesi verso < 6 mesi) e (2) sesso, sarà utilizzato per testare l effetto di con livello di significatività di 0,025 nel test ad una coda. Schema del disegno dello Studio Parte A N = 900 Pazienti con: - NSCLC di stadio IIIB/IV - Progessione dopo chemioterapia ed EGFR TKI - ECOG 0-2 Monoterapia 50 mg orale una volta al giorno fino a progressione Parte B N = 300 Pazienti con beneficio per > 3mesi con Randomizzazione 2:1 + Paclitaxel 80mg/m 2 settimanale Singolo agente chemioterapico a scelta dello sperimentatore (es Paclitaxel o Pemetrexed)
7 FLOW CHART Parte A 7 di 11 Screening (S) Cicli di Trattamento 1 Fine del Trattamento Follow-up Ciclo 1 Ciclo 2 Ciclo 3 e oltre Visita (V) SV A-V1-x A-V2-x A-V1-x A-V2-x A-V1-x A-EOT 3 A-FU x 4 Giorni Fino a -28 Giorno 1 2 Giorno 15 2 Giorno 1 2 Giorno 15 2 Giorno 1 2 l ultima 0-14 giorni dopo somministrazione Consenso Informato 5 X Dati demografici X Storia clinica X Revisione dei criteri di in-/esclusione X Campione di sangue per l analisi di mutazione EGFR 6 (mandatorio ) X Biopsia tumorale per analisi di mutazione EGFR 7 (opzionale) X Campione di sangue per banca di DNA 8 (opzionale) X EOT + 28 (±7) giorni Verifica HRQOL e cure domiciliari X X X X X 9 Esame fisico completo 10 X X Esame fisico limitato X X X X X X Segni vitali X X X X X X X X ECOG X X X X X X X X ECG digitale a 12 derivazioni 11 X X X 11 X ECHO o MUGA 12 X X Analisi di lab. per la sicurezza 13 X X X X X X X X Test di gravidanza X Valutazione del tumore 14 X Vedere schema pianificazione sotto 14 Terapie concomitanti X X X X X X X X Verifica della compliance X X X X X Eventi avversi e cure errogate X X X X X X X X 15 Fornitura del farmaco () 16 X X X Trattamento con Continuo una volta al giorno Conclusione trattamento del farmaco sperimentale X Completamento dello X
8 8 di A: Parte A, V: Visita, X: numero del ciclo. Tutti i cicli hanno una durata di 4 settimane (28 giorni). I pazienti potranno continuare il trattamento per un numero illimitato di cicli, fino al raggiungimento dei criteri per l interruzione del trattamento (Sezione 6.3.1). 2. (± 3 giorni). Ogni nuovo ciclo dovrà iniziare entro 28 ± 3 giorni dal Giorno 1 del ciclo precedente. 3. Nel caso in cui la decisione di interrompere prematuramente sia presa nel corso di una visita pianificata, effettuare la Visita di Fine Trattamento (EOT) al posto della visita pianificata. In alternativa tra 0 14 giorni dall ultima somministrazione. I pazienti eleggibili per la Parte B dello, dopo la progressione nella Parte A, dovranno effettuare la visita di Screening per la Parte B al posto della vista EOT. Tali pazienti continueranno il trattamento con allo stesso dosaggio assunto nella Parte A senza interruzione e fino alla randomizzazione nella parte B. 4. X è il numero di visite di FU I pazienti non eleggibili per la Parte B dovranno effettuare la visita di Follow-Up (FU) al giorno 28 (±7) dopo la vista di EOT. Solo i pazienti con AEs correlati non risolti effettueranno visite di Follow-Up aggiuntive ad intervalli di 28 (±7) giorni o prima (se necessario) fino alla risoluzione o alla decisione da parte dello sperimentatore e del Clinical Trial Monitor di interrompere il FU. 5. Il Consenso Informato scritto deve essere ottenuto prima dell esecuzione di una qualsiasi procedura di screening specifica del protocollo, incluso il consenso per il campione di sangue per la banca del DNA(opzionale), le analisi per le mutazioni EGFR su biopsia tumorale (opzionale) e su sangue (obbligatorio e dove possibile). 6. Un singolo campione di sangue per il test delle mutazioni EGFR è obbligatorio dove possibile e deve essere effettuato alla visita 1 del Ciclo Se disponibile, il materiale tumorale conservato presso il centro, richiesto per l analisi di mutazione EGFR, dovrà essere raccolto alla Visita 1, Ciclo 1 (opzionale). 8. Il campione di sangue per la banca di DNA dovrà essere prelevato alla Visita 1, Ciclo 1 (opzionale). Dovrà essere ottenuto un consenso aggiuntivo. 9. La verifica del HRQOL sarà effettuata solo durante la prima Visita di FU. 10. Include l altezza /cm (solo allo screening) e peso (kg) (Sezione 5.2.5). 11. Sarà effettuato un elettrocardiogramma digitale a 12 derivazioni a riposo alla visita di Screening e alla visita EOT. L ECG sarà ripetuto al Giorno 15 del Ciclo 1, al Giorno 1 del Ciclo 3 e successivamente ogni 8 settimane, o prima se clinicamente necessario. 12. Per i centri tedeschi, solo ECHO. 13. Include ematologia e biochimica su siero ad ogni visita. I risultati da precedenti test di laboratorio potranno essere utilizzati alla visita di Screening se effettuati entro una settimana dall inclusione nello (Sezione 5.2.4). 14. Le valutazioni dell estensione di malattia tumorale dovranno includere TC del torace e dell addome e se clinicamente indicato, immagini di altre aree sospette o conosciute di malattia (e.g. pelvi o cervello) tramite un metodo appropriato (Sezione 5.1.3). La stessa tecnica radiografica dovrà essere utilizzata per l intera durata dello. In caso di una metastasi ossea sospetta (ma non confermata) allo screening, la valutazione dell estensione di malattia allo screening dovrà includere una TC ossea. Se le lesioni ossee sono già note o confermate allo screening, è necessario conferma attraverso relative immagini (raggi-x o CT scan). Le relative immagini dovranno essere acquisite ad ogni valutazione del tumore (Sezione 5.1.3). La valutazione dell estensione di malattia tumorale sarà effettuata alla Visita di Screening e successivamente ogni 6 settimane fino alla progressione, all inizio di un ulteriore trattamento o alla prima visita di FU. La valutazione del tumore non dovrà essere effettuata alla Visita di Screening se risultano disponibili altre valutazioni valide effettuate durante la normale pratica clinica all interno della finestra temporale concessa (entro 28 giorni prima dell inizio del trattamento). In caso di uscita dallo o di interruzione / ritardo nella somministrazione del trattamento, mantenere le tempistiche iniziali pianificate per la valutazione del tumore. In Germania, la valutazione del tumore per i pazienti eleggibili senza trattamenti chemioterapici precedenti seguirà solo gli standard istituzionali. 15. Se non risolto entro la Visita EOT, oppure in caso di nuovo AE correlato al farmaco o morte. 16. Sarà fornito all inizio di ogni ciclo un nuovo flacone di.
9 FLOW CHART: Parte B Screening (S) 1 Cicli di Trattamento 2 Fine del trattamento Follow-up 9 di 11 Periodo di osservazione Visita (V) SV B-V1-x 3 B-V2-x 3 B-V3-x 3 B-V4-x 3 B-EOT 4 B-FU-x 5,6 B-OP-x 7 Giorni Giorno 1 Giorno 8 Giorno 15 Giorno giorni dopo l ultima somministrazio ne EOT + 28 (±7) giorni Nuovo consenso informato e revisione dei criteri di in- /esclusione 1 X Randomizzazione 8 X Campione di sangue per l analisi di mutazione EGFR 9 (mandatorio ) X Biopsia tumorale per analisi di mutazione EGFR e analisi di resistenza genetica 10 (opzionale ) X Verifica HRQOL e cure domiciliari X X X X Esame fisico completo 11 X X Esame fisico limitato 11 X X X X X Segni vitali X X X X X X X ECOG X X X X X X X ECG digitale a 12 derivazioni 12 X X 12 X ECHO o MUGA 13 X X Analisi di lab. per la sicurezza 14 X X X X X X X Valutazione del tumore 15 X Vedere schema alla nota 15 Terapie concomitanti X X X X X X X Eventi avversi e cure errogate X X X X X X X Fornitura del/i farmaco/i sperimentale/i 16 X 1 X (Parte B, Braccio 1) X 1 Continuo una volta al giorno Somministrazione Paclitaxel (Parte B, Braccio 1) 17 X X X X 17 Chemioterapia (Parte B, Braccio 2) 18 X 18 Verifica della compliance X X X X Conclusione trattamento con farmaco sperimentale X Completamento dello X Raccolta delle informazioni sullo stato vitale X FU + 30 (±7) giorni
10 10 di La visita di Screening dovrà avvenire durante la visita pianificata per la determinazione della progressione (Parte A) o appena possibile (entro 14 giorni). I pazienti dovranno continuare con lo stesso trattamento e la stessa dose assunta nella Parte A (monoterapia ) fino alla randomizzazione. Un nuovo flacone di dovrà essere fornito al paziente che necessiterà di ulteriore farmaco sperimentale per continuare la terapia. Durante lo screening saranno rivisti i criteri di inclusione/esclusione, in particolare quelli specifici per la Parte B dello. Un nuovo consenso informato, incluso il consenso per il test delle mutazioni EGFR su sangue (obbligatorio e ove possibile) e il test dei biomarcatori da campione di tessuto (opzionale), dovranno essere firmati prima della randomizzati alla Parte B dello. I pazienti che non supererranno lo screening e non saranno eleggibili per la Parte B effettueranno la vista di FU come descritto nella Parte A. 2. Ciascun ciclo ha durata di 4 settimane (28 giorni). 3. X: numero di Ciclo, V: Visita, B:Parte B (± 3 giorni). Ogni nuovo ciclo dovrà avvenire entro 28 ±3 giorni dal Giorno 1 del precedente ciclo giorni dopo l ultima somministrazione. 5. X è il numero di visita di Follow-Up. 6. Tutti i pazienti dovranno effettuare la prima Visita di Follow-Up 28 (±7) giorni dopo la visita di EOT. I pazienti senza progressione e che non avranno iniziato altre terapie dovranno effettuare ulteriori Visite di Follow-Up ogni 28 (±7) giorni fino alla progressione o all inizio di un ulteriore trattamento. 7. X è il numero delle Visite nel Periodo di Osservazione. Ogni 30 giorni (± 7 giorni) dopo l ultima Visita di FU fino alla morte o perdita di contatto con il paziente. Le informazioni raccolte riguarderanno la progressione, ulteriori trattamenti e la morte. Le informazioni dovranno essere raccolte in cartella clinica o tramite contatto telefonico con il paziente. Non è richiesta una visita di formale. Il Periodo di Osservazione terminerà dopo la morte di tutti i pazienti oppure al quinto anno dopo l ultima visita di FU, qualunque avvenga per prima. 8. I pazienti dovranno essere randomizzati il prima possibile dopo la Visita di Screening. I trattamenti (Braccio 1 o Braccio 2) dovranno iniziare il prima possibile, e comunque entro 5 giorni, dalla data di randomizzazione. 9. Un singolo campione di sangue per l analisi delle mutazioni EGFR è mandatorio ove possibile; il campione dovrà essere ottenuto alla Visita 1, Ciclo Dovrà essere fatto tutto il possibile per ottenere una nuova biopsia tumorale da tumore primario o metastasi, per l analisi delle mutazioni EGFR, alla Visita 1, Ciclo1(opzionale). 11. Include il peso (kg)(sezione 5.2.5). 12. Sarà effettuato un elettrocardiogramma digitale a 12 derivazioni a riposo alla visita di Screening e alla visita EOT. L ECG sarà ripetuto al Giorno 15 del Ciclo 1 e successivamente ogni 8 settimane o prima, se clinicamente necessario, per il Braccio 1; se ritenuto necessario dallo sperimentatore per il Braccio Allo Screening, EOT e in qualsiasi altro momento se indicato clinicamente. Nei centri tedeschi, solo ECHO. 14. Include ematologia e biochimica su siero da effettuare ad ogni visita sino all ultima visita di FU. I risultati da precedenti test di laboratorio potranno essere utilizzati alla visita di Screening se effettuati entro una settimana dall inclusione nella Parte B dello (Sezione 5.2.4). 15. Le valutazioni dell estensione di malattia tumorale dovranno includere TC del torace e dell addome e se clinicamente indicato, immagini di altre aree sospette di malattia (e.g. pelvi o cervello) tramite un metodo appropriato (Sezione 5.1.3). La stessa tecnica radiografica dovrà essere utilizzata per l intera durata dello. In caso di una metastasi ossea sospetta (ma non confermata) allo screening, la valutazione dell estensione di malattia allo screening dovrà includere una TC ossea. Se le lesioni ossee sono già note o confermate allo screening, è necessario conferma attraverso relative immagini (raggi-x o CT scan). Le relative immagini dovranno essere acquisite ad ogni valutazione del tumore (Sezione 5.1.3) La valutazione dell estensione di malattia tumorale sarà effettuata alla Visita di Screening e successivamente ogni 6 settimane fino alla progressione, all inizio di un ulteriore trattamento, alla perdita di contatto con il paziente o la morte. La valutazione del tumore non dovrà essere effettuata alla Visita di Screening se risultano disponibili altre valutazioni valide effettuate durante la normale pratica clinica (i.e l ultima valutazioni dell estensione di malattia tumorale della Parte A indicativa di progressione ed entro le 4 settimane prima della randomizzazione). Il risultato della valutazione sarà considerato basale da utilizzare nel confronto con le valutazioni future, nel determinare la progressione del tumore per la Parte B. Le visite per la valutazione dell estensione del tumore potrebbero non coincidere con le visite di pianificate in quanto i pazienti assegnati al Braccio 2 potrebbero non avere visite settimanali. Tuttavia, se il paziente dovesse trovarsi presso il centro nella stessa settimana della visita pianificata,si potranno contemporaneamente effettuare le valutazioni dell estensione del tumore. In Germania, la valutazione del tumore per i pazienti eleggibili e senza trattamenti chemioterapici precedenti, seguirà solo gli standard istituzionali.
11 11 di Alla visita di Screening si dovrà fornire un nuovo flacone di ai pazienti che necessitino di altro farmaco sperimentale per assicurare la continuità terapeutica fino alla randomizzazione. Durante la fase di trattamento, si dovrà fornire farmaco all inizio di ogni ciclo nuovo. 17. Per i farmaci di pretrattamento, dovranno essere seguite le indicazioni riportare sull etichetta o nel sommario delle caratteristiche del prodotto. I farmaci di pretrattamento standard includono desametasone 20 mg intravenoso (IV), difenidramina 50 mg e ranitidina 50 mg IV o cimetidina 300 mg IV 30 minuti prima di paclitaxel settimanale; tuttavia, è permessa una riduzione nella dose di desametasone se il paziente non mostra segni di ipersensitività. Ai pazienti sarà concesso di sospendere il trattamento ogni ottava settimana (7 settimane trattati / 1 settimana a riposo). 18. Dipende dalla chemioterapia scelta dallo sperimentatore. Le Visite nei giorni 8,15, 22 potrebbero essere opzionali se la chemioterapia scelta dallo sperimentatore è ben tollerata (e.s. nessuna tossicità di grado 3 o superiore) e nel caso in cui non ci fossero somministrazioni nei giorni 8, 15 o 22. La sospensione del trattamento sarà concessa ai pazienti che assumono chemioterapia settimanale (7 settimane trattamento / 1 settimana a riposo) a discrezione dello sperimentatore; comunque il periodo di riposo non deve superare 1 settimana.
EMR Merck KGaA, Darmstadt, Germania. Fase clinica IIIb
 1/7 Sinossi Titolo della Numero della NEXT NSCLC ErbituX Trial Sperimentazione in aperto, randomizzata, multinazionale, di fase IIIb, di valutazione dell attività e della sicurezza di cetuximab come terapia
1/7 Sinossi Titolo della Numero della NEXT NSCLC ErbituX Trial Sperimentazione in aperto, randomizzata, multinazionale, di fase IIIb, di valutazione dell attività e della sicurezza di cetuximab come terapia
STUDIO RANDOMIZZATO DI FASE II CON CARBOPLATINO E PACLITAXEL +/- CETUXIMAB NEL CARCINOMA DELLA CERVICE AVANZATO E/O RECIDIVATO
 Multicentre Italian Trials in Ovarian Cancer MITO CERV-2 STUDIO RANDOMIZZATO DI FASE II CON CARBOPLATINO E PACLITAXEL +/- CETUXIMAB NEL CARCINOMA DELLA CERVICE AVANZATO E/O RECIDIVATO NONA RELAZIONE DI
Multicentre Italian Trials in Ovarian Cancer MITO CERV-2 STUDIO RANDOMIZZATO DI FASE II CON CARBOPLATINO E PACLITAXEL +/- CETUXIMAB NEL CARCINOMA DELLA CERVICE AVANZATO E/O RECIDIVATO NONA RELAZIONE DI
Sinossi Protocollo LEGA Versione No. 1 Finale, 11 Novembre 2011
 1. SINOSSI 1.1. Identificativi del Protocollo Prodotto: Indicazione: Codice Protocollo: EudraCT No.: 2011-005537-39 Titolo dello Studio: 1.2. Razionale dello Studio Combinazioni chemioterapiche: Epirubicina
1. SINOSSI 1.1. Identificativi del Protocollo Prodotto: Indicazione: Codice Protocollo: EudraCT No.: 2011-005537-39 Titolo dello Studio: 1.2. Razionale dello Studio Combinazioni chemioterapiche: Epirubicina
ALGORITMI E PERCORSI TERAPEUTICI CARCINOMI DEL POLMONE NON-MICROCITOMA (NSCLC)
 ALGORITMI E PERCORSI TERAPEUTICI CARCINOMI DEL POLMONE NON-MICROCITOMA (NSCLC) Data di aggiornamento: Luglio 2014 Indicazione a supporto cure palliative senza terapia oncologica specifica in pazienti con
ALGORITMI E PERCORSI TERAPEUTICI CARCINOMI DEL POLMONE NON-MICROCITOMA (NSCLC) Data di aggiornamento: Luglio 2014 Indicazione a supporto cure palliative senza terapia oncologica specifica in pazienti con
SINOSSI Protocollo MO19390 SAIL
 SINOSSI Protocollo MO19390 SAIL TITOLO INDICAZIONE OBIETTIVI DISEGNO DELLO STUDIO Studio in aperto con bevacizumab (Avastin ) in combinazione con un regime chemioterapico contenente platino per il trattamento
SINOSSI Protocollo MO19390 SAIL TITOLO INDICAZIONE OBIETTIVI DISEGNO DELLO STUDIO Studio in aperto con bevacizumab (Avastin ) in combinazione con un regime chemioterapico contenente platino per il trattamento
II GOIM Prof. Giuseppe Colucci Direttore Dipartimento Oncologia Medica Istituto Tumori G.PaoloII, Bari
 1 Sinossi TITOLO FASE CLINICA SPONSOR CENTRO COORDINATORE AREA TERAPEUTICA OBIETTIVI Strategia terapeutica ottimale nei pazienti con tumore del colon-retto metastatico K ras wild type: cetuximab in associazione
1 Sinossi TITOLO FASE CLINICA SPONSOR CENTRO COORDINATORE AREA TERAPEUTICA OBIETTIVI Strategia terapeutica ottimale nei pazienti con tumore del colon-retto metastatico K ras wild type: cetuximab in associazione
(CRICKET) - EUDRACT Gruppo Oncologico Nord-Ovest (G.O.N.O.)
 APPENDI II: SINOSSI (ITALIAN VERSION) STUDIO DI FASE II, A SINGOLO BRACCIO, DI TERAPIA DI III LINEA CON RECHALLENGE DI CETUIMAB ED IRINOTECANO IN PAZIENTI CON CARCINOMA COLORETTALE METASTATICO KRAS, NRAS
APPENDI II: SINOSSI (ITALIAN VERSION) STUDIO DI FASE II, A SINGOLO BRACCIO, DI TERAPIA DI III LINEA CON RECHALLENGE DI CETUIMAB ED IRINOTECANO IN PAZIENTI CON CARCINOMA COLORETTALE METASTATICO KRAS, NRAS
ZACTIMA è un marchio commerciale del gruppo di società AstraZeneca.
 Protocollo di studio clinico Numero edizione 1 Uno studio di fase III, internazionale, randomizzato, in doppio cieco, a gruppi paralleli, multicentrico per valutare l efficacia di ZD6474 (ZACTIMA ) più
Protocollo di studio clinico Numero edizione 1 Uno studio di fase III, internazionale, randomizzato, in doppio cieco, a gruppi paralleli, multicentrico per valutare l efficacia di ZD6474 (ZACTIMA ) più
Dott. Francesco Fiorica
 Dottorato di ricerca XXII ciclo Università degli Studi di Catania: Approccio Oncologico Multimodale in età geriatrica FATTIBILITA ED EFFICACIA DI UN TRATTAMENTO DI RADIOTERAPIA IN PAZIENTI ANZIANI CON
Dottorato di ricerca XXII ciclo Università degli Studi di Catania: Approccio Oncologico Multimodale in età geriatrica FATTIBILITA ED EFFICACIA DI UN TRATTAMENTO DI RADIOTERAPIA IN PAZIENTI ANZIANI CON
Sinossi Protocollo Sperimentale GOIM 21002
 1 Sinossi Protocollo Sperimentale GOIM 21002 STUDIO MULTICENTRICO DI FASE II SULL UTILIZZO DI NANOPARTICLE ALBUMIN- BOUND PACLITAXEL (ABX) IN ASSOCIAZIONE A CAPECITABINA NEL TRATTAMENTO DI PRIMA LINEA
1 Sinossi Protocollo Sperimentale GOIM 21002 STUDIO MULTICENTRICO DI FASE II SULL UTILIZZO DI NANOPARTICLE ALBUMIN- BOUND PACLITAXEL (ABX) IN ASSOCIAZIONE A CAPECITABINA NEL TRATTAMENTO DI PRIMA LINEA
SINOSSI. Studio di Fase II: Obiettivo primario Determinare l attività antitumorale della combinazione in termini di tempo alla progressione
 SINOSSI TITOLO Studio di fase I-II con Lapatinib in combinazione con capecitabina e vinorelbina come seconda linea di trattamento in pazienti con carcinoma mammario con iperespressione di ErbB2 localmente
SINOSSI TITOLO Studio di fase I-II con Lapatinib in combinazione con capecitabina e vinorelbina come seconda linea di trattamento in pazienti con carcinoma mammario con iperespressione di ErbB2 localmente
Commissione Regionale Farmaco LAPATINIB
 Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
Commissione Regionale Farmaco (D.G.R. 1540/2006 e D.G.R. 490 dell 11 aprile 2011) Documento relativo a: LAPATINIB Settembre 2011 Indicazioni registrate Lapatinib Il lapatinib ha ricevuto la seguente estensione
1 Sinossi. Numero dello studio EMR Merck KGaA, Darmstadt, Germania. Fase di studio
 1 Sinossi Titolo dello studio Uno studio aperto, randomizzato, di Fare II in soggetti affetti da carcinoma polmonare a piccole cellule malattia estesa (ED-SCLC), dopo una risposta iniziale (risposta completa
1 Sinossi Titolo dello studio Uno studio aperto, randomizzato, di Fare II in soggetti affetti da carcinoma polmonare a piccole cellule malattia estesa (ED-SCLC), dopo una risposta iniziale (risposta completa
SINOSSI DEL PROTOCOLLO ML21868
 TITOLO SPONSOR FASE CLINICA INDICAZIONE OBIETTIVI SINOSSI DEL PROTOCOLLO ML21868 Studio clinico randomizzato di fase II con bevacizumab (AVASTIN ) in combinazione con gemcitabina o con dosi ridotte di
TITOLO SPONSOR FASE CLINICA INDICAZIONE OBIETTIVI SINOSSI DEL PROTOCOLLO ML21868 Studio clinico randomizzato di fase II con bevacizumab (AVASTIN ) in combinazione con gemcitabina o con dosi ridotte di
SINOSSI DEL PROTOCOLLO
 SINOSSI DEL PROTOCOLLO TITOLO DELLO STUDIO: CODICE DEL PROTOCOLLO: SPONSOR: FASE DELLO STUDIO: CENTRI PARTECIPANTI ALLO STUDIO: PERIODO DI STUDIO PIANIFICATO (PRIMO ARRUOLAMENTO ULTIMO PAZIENTE USCITO
SINOSSI DEL PROTOCOLLO TITOLO DELLO STUDIO: CODICE DEL PROTOCOLLO: SPONSOR: FASE DELLO STUDIO: CENTRI PARTECIPANTI ALLO STUDIO: PERIODO DI STUDIO PIANIFICATO (PRIMO ARRUOLAMENTO ULTIMO PAZIENTE USCITO
SINOSSI DEL PROTOCOLLO
 SINOSSI DEL PROTOCOLLO Titolo Numero di protocollo Studio multicentrico, in aperto, randomizzato e adattivo di palifosfamide-tris, un nuovo DNA crosslinker, in combinazione con chemioterapia con carboplatino
SINOSSI DEL PROTOCOLLO Titolo Numero di protocollo Studio multicentrico, in aperto, randomizzato e adattivo di palifosfamide-tris, un nuovo DNA crosslinker, in combinazione con chemioterapia con carboplatino
SINOSSI PROTOCOLLO STUDIO OSSERVAZIONALE
 SINOSSI PROTOCOLLO STUDIO OSSERVAZIONALE Studio prospettico, non interventistico, di coorte, sul rischio di tromboembolismo venoso (TEV) in pazienti sottoposti a un nuovo trattamento chemioterapico per
SINOSSI PROTOCOLLO STUDIO OSSERVAZIONALE Studio prospettico, non interventistico, di coorte, sul rischio di tromboembolismo venoso (TEV) in pazienti sottoposti a un nuovo trattamento chemioterapico per
SINOSSI DEL PROTOCOLLO NUMERO BO25460
 SINOSSI DEL PROTOCOLLO NUMERO BO25460 TITOLO Studio di fase III randomizzato, in doppio cieco, controllato con placebo, diretto a confrontare la terapia di mantenimento di prima linea con Tarceva e la
SINOSSI DEL PROTOCOLLO NUMERO BO25460 TITOLO Studio di fase III randomizzato, in doppio cieco, controllato con placebo, diretto a confrontare la terapia di mantenimento di prima linea con Tarceva e la
STUDI CLINICI IN CORSO nella MIELOFIBROSI
 Quinta Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Sabato 9 Maggio 2015 STUDI CLINICI IN CORSO nella MIELOFIBROSI Paola Guglielmelli Laboratorio Congiunto MMPC, AOU
Quinta Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche Sabato 9 Maggio 2015 STUDI CLINICI IN CORSO nella MIELOFIBROSI Paola Guglielmelli Laboratorio Congiunto MMPC, AOU
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
Protocollo clinico. Codice dello studio: FIL R2-B Fase II Numero EudraCT: VERSIONE N MARZO 2012
 Fondazione Italiana Linfomi ONLUS Sede legale : piazza Turati 5, 15121 - Alessandria Segreteria: c/o S.C. Ematologia Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Via Venezia 16, 15121 Alessandria
Fondazione Italiana Linfomi ONLUS Sede legale : piazza Turati 5, 15121 - Alessandria Segreteria: c/o S.C. Ematologia Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Via Venezia 16, 15121 Alessandria
IMAGE GUIDED RADIATION THERAPY (IGRT) DEL TUMORE DEL POLMONE NON A PICCOLE CELLULE CON IPOFRAZIONAMENTO DELLA DOSE (IGIM Trial)
 Versione 04.06.2012 PROTOCOLLO DI STUDIO IMAGE GUIDED RADIATION THERAPY (IGRT) DEL TUMORE DEL POLMONE NON A PICCOLE CELLULE CON IPOFRAZIONAMENTO DELLA DOSE (IGIM Trial) COORDINATORE PROGETTO DI RICERCA
Versione 04.06.2012 PROTOCOLLO DI STUDIO IMAGE GUIDED RADIATION THERAPY (IGRT) DEL TUMORE DEL POLMONE NON A PICCOLE CELLULE CON IPOFRAZIONAMENTO DELLA DOSE (IGIM Trial) COORDINATORE PROGETTO DI RICERCA
SINOSSI DEL PROTOCCOLO
 Protocollo GO27821, versione 2 SINOSSI DEL PROTOCCOLO TITOLO: NUMERO DI PROTOCOLLO: STUDIO DI FASE II, RANDOMIZZATO, MULTICENTRICO, IN DOPPIO CIECO, CONTROLLATO VERSO PLACEBO, PER VALUTARE L'EFFICACIA
Protocollo GO27821, versione 2 SINOSSI DEL PROTOCCOLO TITOLO: NUMERO DI PROTOCOLLO: STUDIO DI FASE II, RANDOMIZZATO, MULTICENTRICO, IN DOPPIO CIECO, CONTROLLATO VERSO PLACEBO, PER VALUTARE L'EFFICACIA
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR ERLOTINIB
 RICHIESTA DI INSERIMENTO IN PTR DI ATC L01XE03 (TARCEVA ) Presentata da Componente Commissione Prontuario Terapeutico Regionale In data 13 Dicembre 2006 Per le seguenti motivazioni (sintesi): Tarceva non
RICHIESTA DI INSERIMENTO IN PTR DI ATC L01XE03 (TARCEVA ) Presentata da Componente Commissione Prontuario Terapeutico Regionale In data 13 Dicembre 2006 Per le seguenti motivazioni (sintesi): Tarceva non
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 RICHIESTA DI INSERIMENTO IN PTR DI SILDENAFIL G04BE03 (REVATIO ) Presentata da Commissione Terapeutica Provinciale Sassari In data novembre 2008 Per le seguenti motivazioni (sintesi) Trattamento di pazienti
RICHIESTA DI INSERIMENTO IN PTR DI SILDENAFIL G04BE03 (REVATIO ) Presentata da Commissione Terapeutica Provinciale Sassari In data novembre 2008 Per le seguenti motivazioni (sintesi) Trattamento di pazienti
Studio AMAROS SOMMARIO
 Studio AMAROS SOMMARIO Studio di fase III il cui principale obiettivo è dimostrare nelle pazienti con metastasi ai linfonodi ascellari, diagnosticate tramite biopsia con linfonodo sentinella, equivalente
Studio AMAROS SOMMARIO Studio di fase III il cui principale obiettivo è dimostrare nelle pazienti con metastasi ai linfonodi ascellari, diagnosticate tramite biopsia con linfonodo sentinella, equivalente
SINOSSI. EudraCT number Versione del protocollo Version Octobre 2013
 SINOSSI Codice Studio Titolo IELSG38 EudraCT number 2012 004896 38 Versione del protocollo Version 1.3 18 Octobre 2013 Farmaci in studio Sponsor Fase Disegno Coordinatori Studio di fase II di combinazione
SINOSSI Codice Studio Titolo IELSG38 EudraCT number 2012 004896 38 Versione del protocollo Version 1.3 18 Octobre 2013 Farmaci in studio Sponsor Fase Disegno Coordinatori Studio di fase II di combinazione
STUDIO CLINICO di Fase II MYETT MYocet Endoxan Taxotere Trastuzumab. Sinossi del protocollo
 1 STUDIO CLINICO di Fase II MYETT MYocet Endoxan Taxotere Trastuzumab Sinossi del protocollo Titolo Protocollo: Studio di fase II con doxorubicina liposomiale più ciclofosfamide in associazione a trastuzumab,
1 STUDIO CLINICO di Fase II MYETT MYocet Endoxan Taxotere Trastuzumab Sinossi del protocollo Titolo Protocollo: Studio di fase II con doxorubicina liposomiale più ciclofosfamide in associazione a trastuzumab,
STUDIO PANDA. Sinossi
 Titolo Studio di fase II randomizzato di prima linea con FOLFO/panitumumab e 5FU/panitumumab in pazienti anziani con carcinoma colorettale metastatico RAS e BRAF wild-type. Versione 2.2 del 18.04.2016
Titolo Studio di fase II randomizzato di prima linea con FOLFO/panitumumab e 5FU/panitumumab in pazienti anziani con carcinoma colorettale metastatico RAS e BRAF wild-type. Versione 2.2 del 18.04.2016
Studio SENIORS Trial sull effetto di nebivololo su mortalità e ospedalizzazioni per malattie cardiovascolari in pazienti anziani con insufficienza
 Trial sull effetto di nebivololo su mortalità e ospedalizzazioni per malattie cardiovascolari in pazienti anziani con insufficienza cardiaca (1) Introduzione (1) Età media dei pazienti con insufficienza
Trial sull effetto di nebivololo su mortalità e ospedalizzazioni per malattie cardiovascolari in pazienti anziani con insufficienza cardiaca (1) Introduzione (1) Età media dei pazienti con insufficienza
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
Cardiotossicità del trattamento del carcinoma mammario: l uso di sistemi informativi correnti
 Cardiotossicità del trattamento del carcinoma mammario: l uso di sistemi informativi correnti Cuccaro F., Autelitano M., Bertù L., Randi G., Chiaffarino F., Ghilardi S., Leone R., Filipazzi L., Bonini
Cardiotossicità del trattamento del carcinoma mammario: l uso di sistemi informativi correnti Cuccaro F., Autelitano M., Bertù L., Randi G., Chiaffarino F., Ghilardi S., Leone R., Filipazzi L., Bonini
RUOLO DEL PERSONALE INFERMIERISTICO
 «GESTIONE AMBULATORIALE DELLE TERAPIE DI SUPPORTO» RUOLO DEL PERSONALE INFERMIERISTICO NEL PAZIENTE AMBULATORIALE NICOLETTA VIRGILI L AMBULATORIO DI TERAPIE DI SUPPORTO E URGENZE SVILUPPO DELL ONCOLOGIA
«GESTIONE AMBULATORIALE DELLE TERAPIE DI SUPPORTO» RUOLO DEL PERSONALE INFERMIERISTICO NEL PAZIENTE AMBULATORIALE NICOLETTA VIRGILI L AMBULATORIO DI TERAPIE DI SUPPORTO E URGENZE SVILUPPO DELL ONCOLOGIA
N cartella N ricovero Cognome Nome Data di nascita DICHIARAZIONE DI AVVENUTA INFORMAZIONE ED ESPRESSIONE DEL CONSENSO A TRATTAMENTO CHEMIOTERAPICO
 Io sottoscritto/a, nato/a il a nel pieno possesso delle mie facoltà dichiaro di essere stato/a informato/a in modo dettagliato, chiaro e comprensibile, dal Dottor, sui seguenti punti: 1. diagnosi : La
Io sottoscritto/a, nato/a il a nel pieno possesso delle mie facoltà dichiaro di essere stato/a informato/a in modo dettagliato, chiaro e comprensibile, dal Dottor, sui seguenti punti: 1. diagnosi : La
Lezione 2 Come leggere l articolo scientifico
 Analisi critica della letteratura scientifica Lezione 2 Come leggere l articolo scientifico Struttura dell articolo Introduzione Metodi Risultati e Discussione Perché è stato fatto? Come è stato condotto?
Analisi critica della letteratura scientifica Lezione 2 Come leggere l articolo scientifico Struttura dell articolo Introduzione Metodi Risultati e Discussione Perché è stato fatto? Come è stato condotto?
Studio ID: FIL_FOLL12 VERSIONE E DATA: VERSIONE LUGLIO 2012 EUDRACT NUMBER:
 Studio multicentrico, randomizzato di fase III per valutare l efficacia di una strategia di mantenimento modulata sulla base della risposta al trattamento di induzione con chemioimmunoterapia standard
Studio multicentrico, randomizzato di fase III per valutare l efficacia di una strategia di mantenimento modulata sulla base della risposta al trattamento di induzione con chemioimmunoterapia standard
Sinossi di studio clinico Codice: GECP06/01 Pag. 1 di 5
 Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
Codice: GECP06/01 Pag. 1 di 5 Studio aperto randomizzato multicentrico di fase III di confronto tra il trattamento con Erlotinib (Tarceva ) e la chemioterapia nei pazienti affetti da carcinoma non a piccole
LE COMPETENZE DELL INFERMIERE IN TUTTE LE FASI DEL PDTA PER PAZIENTI CON TUMORE DEL COLON RETTO. La radioterapia. Giovanna Pusceddu, infermiera
 LE COMPETENZE DELL INFERMIERE IN TUTTE LE FASI DEL PDTA PER PAZIENTI CON TUMORE DEL COLON RETTO La radioterapia Giovanna Pusceddu, infermiera Chi sono gli operatori in radioterapia Medici radioterapisti
LE COMPETENZE DELL INFERMIERE IN TUTTE LE FASI DEL PDTA PER PAZIENTI CON TUMORE DEL COLON RETTO La radioterapia Giovanna Pusceddu, infermiera Chi sono gli operatori in radioterapia Medici radioterapisti
STUDIO PROSPETTICO DI FASE II DI TERAPIA MIELOABLATIVA AD ALTE DOSI, CON SUPPORTO DI CELLULE STAMINALI PERIFERICHE, IN PAZIENTI ANZIANI
 STUDIO PROSPETTICO DI FASE II DI TERAPIA MIELOABLATIVA AD ALTE DOSI, CON SUPPORTO DI CELLULE STAMINALI PERIFERICHE, IN PAZIENTI ANZIANI ( 65 E
STUDIO PROSPETTICO DI FASE II DI TERAPIA MIELOABLATIVA AD ALTE DOSI, CON SUPPORTO DI CELLULE STAMINALI PERIFERICHE, IN PAZIENTI ANZIANI ( 65 E
PROTOCOLLI GOIRC-SPONSORED FARM6PMFJM
 PROTOCOLLI -SPONSORED FARM6PMFJM Multicenter phase III randomized study of cisplatin and etoposide with or without bevacizumab as first-line treatment in extensive stage (ED) small cell lung cancer (SCLC).
PROTOCOLLI -SPONSORED FARM6PMFJM Multicenter phase III randomized study of cisplatin and etoposide with or without bevacizumab as first-line treatment in extensive stage (ED) small cell lung cancer (SCLC).
Ruolo dell Infermiere nella gestione di un Trial clinico
 Ricerca clinica Studi di fase I, II, III 3 Ruolo dell Infermiere nella gestione di un Trial clinico Processo Approvazione Attivazione Susanna Bassi Infermiera di ricerca, Ematologia Dh Ospedale di Circolo
Ricerca clinica Studi di fase I, II, III 3 Ruolo dell Infermiere nella gestione di un Trial clinico Processo Approvazione Attivazione Susanna Bassi Infermiera di ricerca, Ematologia Dh Ospedale di Circolo
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
BAY 43-9006/13266 - SINOSSI DEL PROTOCOLLO
 BAY 43-9006/13266 - SINOSSI DEL PROTOCOLLO Nome dello sponsor Nome del prodotto finito Nome del principio attivo Titolo dello studio Sperimentatore Principale Centri dello studio pianificati Periodo di
BAY 43-9006/13266 - SINOSSI DEL PROTOCOLLO Nome dello sponsor Nome del prodotto finito Nome del principio attivo Titolo dello studio Sperimentatore Principale Centri dello studio pianificati Periodo di
V Congresso Nazionale AIIO Bari, maggio 2016
 V Congresso Nazionale AIIO Bari, 27 28 maggio 2016 ACTION: trial multicentrico clusterizzato e randomizzato di fase III per valutare se il programma Rispettare le scelte migliori la qualità della vita
V Congresso Nazionale AIIO Bari, 27 28 maggio 2016 ACTION: trial multicentrico clusterizzato e randomizzato di fase III per valutare se il programma Rispettare le scelte migliori la qualità della vita
LA PREVENZIONE DELLA BPCO
 Claudio M.Sanguinetti LA PREVENZIONE DELLA BPCO Consulente Pneumologo Casa di Cura Quisisana Già Direttore UOC Pneumologia- UTIR Az.Compl.Ospedaliero San Filippo Neri ROMA PREVENZIONE PRIMARIA DELLA BPCO
Claudio M.Sanguinetti LA PREVENZIONE DELLA BPCO Consulente Pneumologo Casa di Cura Quisisana Già Direttore UOC Pneumologia- UTIR Az.Compl.Ospedaliero San Filippo Neri ROMA PREVENZIONE PRIMARIA DELLA BPCO
Università degli Studi di Torino Facoltà di Medicina e Chirurgia
 Università degli Studi di Torino Facoltà di Medicina e Chirurgia RUOLO DELLA RISONANZA MAGNETICA DI PERFUSIONE E DI DIFFUSIONE NELLA VALUTAZIONE PRECOCE DELLA RISPOSTA AL TRATTAMENTO RADIOCHIRURGICO DELLE
Università degli Studi di Torino Facoltà di Medicina e Chirurgia RUOLO DELLA RISONANZA MAGNETICA DI PERFUSIONE E DI DIFFUSIONE NELLA VALUTAZIONE PRECOCE DELLA RISPOSTA AL TRATTAMENTO RADIOCHIRURGICO DELLE
LINEE GUIDA TERAPEUTICHE TUMORE DELLA PROSTATA
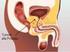 LINEE GUIDA TERAPEUTICHE TUMORE DELLA PROSTATA Data di aggiornamento: novembre 2013 TERAPIA PRIMARIA RISCHIO MOLTO BASSO: (previa biopsia) T1a Follow-up urologico Chirurgia RISCHIO MOLTO BASSO: T1c e Gleason
LINEE GUIDA TERAPEUTICHE TUMORE DELLA PROSTATA Data di aggiornamento: novembre 2013 TERAPIA PRIMARIA RISCHIO MOLTO BASSO: (previa biopsia) T1a Follow-up urologico Chirurgia RISCHIO MOLTO BASSO: T1c e Gleason
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
Linfomi di Hodgkin e Linfomi anaplastici sistemici ricaduti e refrattari
 Linfomi di Hodgkin e Linfomi anaplastici sistemici ricaduti e refrattari Meldola 24 Settembre 2016 Sabati Ematologici della Romagna Letizia Gandolfi Istututo di Ematologia e Oncologia L. & A. Seràgnoli
Linfomi di Hodgkin e Linfomi anaplastici sistemici ricaduti e refrattari Meldola 24 Settembre 2016 Sabati Ematologici della Romagna Letizia Gandolfi Istututo di Ematologia e Oncologia L. & A. Seràgnoli
SINOSSI STUDIO IRST ITACa: Italian Trial in Advanced Colorectal Cancer
 SINOSSI STUDIO IRST 153 01 - ITACa: Italian Trial in Advanced Colorectal Cancer Titolo Responsabile dello studio Centri partecipanti Background e razionale Strategia di terapia sistemica nel carcinoma
SINOSSI STUDIO IRST 153 01 - ITACa: Italian Trial in Advanced Colorectal Cancer Titolo Responsabile dello studio Centri partecipanti Background e razionale Strategia di terapia sistemica nel carcinoma
SINOSSI DELLO STUDO TITOLO DELLO STUDIO
 SINOSSI DELLO STUDO TITOLO DELLO STUDIO Studio clinico randomizzato e controllato, in aperto, per comparare l efficacia analgesica di percorsi terapeutici effettuati con ossicodone, fentanyl e buprenorfina
SINOSSI DELLO STUDO TITOLO DELLO STUDIO Studio clinico randomizzato e controllato, in aperto, per comparare l efficacia analgesica di percorsi terapeutici effettuati con ossicodone, fentanyl e buprenorfina
PROTOCOLLI ATTIVI U.O. ONCOLOGIA IMOLA (al 30/03/2017)
 POLMONE PROTOCOLLO TS-IRST PROTOCOLLI ATTIVI U.O. ONCOLOGIA IMOLA (al 30/03/2017) Protocollo Descrizione protocollo Breve Sinossi Studio HighTySy randomizzato, di fase II, in aperto, disegnato per confrontare
POLMONE PROTOCOLLO TS-IRST PROTOCOLLI ATTIVI U.O. ONCOLOGIA IMOLA (al 30/03/2017) Protocollo Descrizione protocollo Breve Sinossi Studio HighTySy randomizzato, di fase II, in aperto, disegnato per confrontare
Fondazione Italia Fondazione It alia Linf omi Linf ONLUS
 Fondazione Italiana Linfomi ONLUS Sede legale : piazza Turati 5, 15121 - Alessandria Segreteria: c/o S.C. Ematologia Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Via Venezia 16, 15121 Alessandria
Fondazione Italiana Linfomi ONLUS Sede legale : piazza Turati 5, 15121 - Alessandria Segreteria: c/o S.C. Ematologia Azienda Ospedaliera Santi Antonio e Biagio e Cesare Arrigo, Via Venezia 16, 15121 Alessandria
- Non allergie farmacologiche - Ex fumatore - Tonsillectomia
 M.G. 44 anni, 79 Kg, 177 cm Anamnesi generale: - Non allergie farmacologiche - Ex fumatore - Tonsillectomia Agosto 2008: ENUCLEORESEZIONE RENALE SINISTRA di neoformazione di 42x59 mm in stadio clinico
M.G. 44 anni, 79 Kg, 177 cm Anamnesi generale: - Non allergie farmacologiche - Ex fumatore - Tonsillectomia Agosto 2008: ENUCLEORESEZIONE RENALE SINISTRA di neoformazione di 42x59 mm in stadio clinico
IL CARCINOMA DEL COLON - RETTO METASTICO TRA RICERCA E PRATICA CLINICA: NUOVI AGGIORNAMENTI
 IL CARCINOMA DEL COLON - RETTO METASTICO TRA RICERCA E PRATICA CLINICA: NUOVI AGGIORNAMENTI CAGLIARI CAESAR S HOTEL 10 OTTOBRE 2015 Alessio Cubeddu Manuela Dettori CASO CLINICO N 1 PAZIENTE RAS WT NON
IL CARCINOMA DEL COLON - RETTO METASTICO TRA RICERCA E PRATICA CLINICA: NUOVI AGGIORNAMENTI CAGLIARI CAESAR S HOTEL 10 OTTOBRE 2015 Alessio Cubeddu Manuela Dettori CASO CLINICO N 1 PAZIENTE RAS WT NON
SCHEDA DI VALUTAZIONE PER L INSERIMENTO DI FARMACI NON PRESENTI NEL PTR
 RICHIESTA DI INSERIMENTO IN PTR DI SORAFENIB L01XE05 (Nexavar ) Presentata da Commissione Terapeutica Provinciale di Sassari In data gennaio 2009 Per le seguenti motivazioni: Sorafenib modifica lo standard
RICHIESTA DI INSERIMENTO IN PTR DI SORAFENIB L01XE05 (Nexavar ) Presentata da Commissione Terapeutica Provinciale di Sassari In data gennaio 2009 Per le seguenti motivazioni: Sorafenib modifica lo standard
Ruolo della Radioterapia Stereotassica guidata dalla PET/CT con colina in pazienti con recidiva di adenocarcinoma prostatico oligometastatico
 Ruolo della Radioterapia Stereotassica guidata dalla PET/CT con colina in pazienti con recidiva di adenocarcinoma prostatico oligometastatico Paola Cocuzza Azienda Ospedaliero Universitaria Pisana Trattamento
Ruolo della Radioterapia Stereotassica guidata dalla PET/CT con colina in pazienti con recidiva di adenocarcinoma prostatico oligometastatico Paola Cocuzza Azienda Ospedaliero Universitaria Pisana Trattamento
Sinossi Prot.GOIM 2802
 1 Sinossi Prot.GOIM 2802 TRATTAMENTO DI I LINEA CON BEVACIZUMAB + FOLFOX4 O XELOX2 NEL CARCINOMA COLORETTALE. STUDIO DI FASE II RANDOMIZZATO Ricercatore responsabile: Evaristo Maiello Dipartimento di Oncoematologia
1 Sinossi Prot.GOIM 2802 TRATTAMENTO DI I LINEA CON BEVACIZUMAB + FOLFOX4 O XELOX2 NEL CARCINOMA COLORETTALE. STUDIO DI FASE II RANDOMIZZATO Ricercatore responsabile: Evaristo Maiello Dipartimento di Oncoematologia
Versione PROTOCOLLO DI STUDIO
 Versione 04.06.2012 PROTOCOLLO DI STUDIO Studio randomizzato di fase III di chemio-radioterapia nel carcinoma squamoso dell orofaringe in stadio localmente avanzato: IGRT-IMRT con moderato ipofrazionamento
Versione 04.06.2012 PROTOCOLLO DI STUDIO Studio randomizzato di fase III di chemio-radioterapia nel carcinoma squamoso dell orofaringe in stadio localmente avanzato: IGRT-IMRT con moderato ipofrazionamento
Coordinatori Michela Cinquini, Simon Spazzapan. Presentatori Valentina Fanotto, Marta Pestrin, Alessia Levaggi
 2- QUESITO GRADE: Nelle pazienti con carcinoma mammario triplo negativo, candidate a chemioterapia neoadiuvante, è raccomandabile un regime contenente platino? Coordinatori Michela Cinquini, Simon Spazzapan
2- QUESITO GRADE: Nelle pazienti con carcinoma mammario triplo negativo, candidate a chemioterapia neoadiuvante, è raccomandabile un regime contenente platino? Coordinatori Michela Cinquini, Simon Spazzapan
MORTALITÀ A TRENTA GIORNI DALL INTERVENTO PER TUMORE MALIGNO DEL FEGATO PROTOCOLLO OPERATIVO
 MORTALITÀ A TRENTA GIORNI DALL INTERVENTO PER TUMORE MALIGNO DEL FEGATO PROTOCOLLO OPERATIVO - Definizione Per struttura di ricovero o area di residenza: proporzione di morti a trenta giorni dall intervento
MORTALITÀ A TRENTA GIORNI DALL INTERVENTO PER TUMORE MALIGNO DEL FEGATO PROTOCOLLO OPERATIVO - Definizione Per struttura di ricovero o area di residenza: proporzione di morti a trenta giorni dall intervento
La BPCO e le comorbilità. Federico Sciarra
 La BPCO e le comorbilità Federico Sciarra La BPCO, essendo una malattia cronica con caratteristiche di infiammazione sistemica, facilmente coesiste con altre patologie sia acute che croniche, che influenzano
La BPCO e le comorbilità Federico Sciarra La BPCO, essendo una malattia cronica con caratteristiche di infiammazione sistemica, facilmente coesiste con altre patologie sia acute che croniche, che influenzano
LA GESTIONE DEL FALLIMENTO DOPO TERAPIA RADICALE
 LA GESTIONE DEL FALLIMENTO DOPO TERAPIA RADICALE Dr.ssa Nice Bedini S.C. Radioterapia 1 Milano, 28.11.2009 Indice Definizione di recidiva biochimica dopo chirurgia Definizione di recidiva biochimica dopo
LA GESTIONE DEL FALLIMENTO DOPO TERAPIA RADICALE Dr.ssa Nice Bedini S.C. Radioterapia 1 Milano, 28.11.2009 Indice Definizione di recidiva biochimica dopo chirurgia Definizione di recidiva biochimica dopo
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione
 Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
IL RUOLO DELLA RADIOTERAPIA NEL DOLORE ONCOLOGICO. S.C. Radioterapia ASL TO4 Ivrea Maria Rosa La Porta
 IL RUOLO DELLA RADIOTERAPIA NEL DOLORE ONCOLOGICO S.C. Radioterapia ASL TO4 Ivrea Maria Rosa La Porta Compressione midollare L esordio può essere: - Acuto (circa 48 ore) nel 22% dei casi - Nel 61% dei
IL RUOLO DELLA RADIOTERAPIA NEL DOLORE ONCOLOGICO S.C. Radioterapia ASL TO4 Ivrea Maria Rosa La Porta Compressione midollare L esordio può essere: - Acuto (circa 48 ore) nel 22% dei casi - Nel 61% dei
I criteri RECIST: Assessement guidelines per CRC
 Hot topics in clinical research Verona, 30 Novembre 2013 I criteri RECIST: Assessement guidelines per CRC Francesco Grossi U.O.S. Tumori Polmonari IRCCS Azienda Ospedaliera Universitaria San Martino IST
Hot topics in clinical research Verona, 30 Novembre 2013 I criteri RECIST: Assessement guidelines per CRC Francesco Grossi U.O.S. Tumori Polmonari IRCCS Azienda Ospedaliera Universitaria San Martino IST
Università del Piemonte Orientale. Corso di Laurea in Medicina e Chirurgia. Corso di Statistica Medica. I modelli di studio
 Università del Piemonte Orientale Corso di Laurea in Medicina e Chirurgia Corso di Statistica Medica I modelli di studio Corso di laurea in medicina e chirurgia - Statistica Medica Disegno dello studio
Università del Piemonte Orientale Corso di Laurea in Medicina e Chirurgia Corso di Statistica Medica I modelli di studio Corso di laurea in medicina e chirurgia - Statistica Medica Disegno dello studio
STUDIO GRUPPO ITALIANO PANCREAS GIP-2
 STUDIO ITALIANO MULTICENTRICO RANDOMIZZATO DI FASE III DI CONFRONTO TRA LA COMBINAZIONE DI 5- FLUOROURACILE/ACIDO FOLINICO, OXALIPLATINO E IRINOTECAN (FOLFOXIRI) VERSO GEMCITABINA NEL TRATTAMENTO ADIUVANTE
STUDIO ITALIANO MULTICENTRICO RANDOMIZZATO DI FASE III DI CONFRONTO TRA LA COMBINAZIONE DI 5- FLUOROURACILE/ACIDO FOLINICO, OXALIPLATINO E IRINOTECAN (FOLFOXIRI) VERSO GEMCITABINA NEL TRATTAMENTO ADIUVANTE
PROFILASSI ANTITROMBOTICA IN CHIRURGIA GENERALE
 CHIRURGIA GENERALE MAGGIORE (tutti gli interventi di durata > 30 minuti o di chirurgia addominale) TIPO DI PATOLOGIA TIPO DI CHIRURGIA MIRE (tutti gli interventi di durata < 30 minuti, esclusa la chirurgia
CHIRURGIA GENERALE MAGGIORE (tutti gli interventi di durata > 30 minuti o di chirurgia addominale) TIPO DI PATOLOGIA TIPO DI CHIRURGIA MIRE (tutti gli interventi di durata < 30 minuti, esclusa la chirurgia
Specialità: Mabthera (Roche SpA) Forma farmaceutica: 1fl ev 500mg - Prezzo: euro fl 10ml 100mg - Prezzo: euro
 RITUXIMAB Linfoma non-hodgkin: La terapia di mantenimento per pazienti con linfoma follicolare ricaduto/refrattario che rispondono a terapia di induzione con chemioterapia con o senza Rituximab. (09-01-2007)
RITUXIMAB Linfoma non-hodgkin: La terapia di mantenimento per pazienti con linfoma follicolare ricaduto/refrattario che rispondono a terapia di induzione con chemioterapia con o senza Rituximab. (09-01-2007)
EFFICACIA E TOLLERABILITÀ DI UN COMPOSTO A BASE DI POLICOSANOLI VEGETALI, RISO ROSSO FERMENTATO, GAMMA ORIZANOLO, RESVERATROLO,
 EFFICACIA E TOLLERABILITÀ DI UN COMPOSTO A BASE DI POLICOSANOLI VEGETALI, RISO ROSSO FERMENTATO, GAMMA ORIZANOLO, RESVERATROLO, CoQ10, AC. FOLICO E VITAMINA E IN SOGGETTI CON DISLIPIDEMIA MODERATA IN PREVENZIONE
EFFICACIA E TOLLERABILITÀ DI UN COMPOSTO A BASE DI POLICOSANOLI VEGETALI, RISO ROSSO FERMENTATO, GAMMA ORIZANOLO, RESVERATROLO, CoQ10, AC. FOLICO E VITAMINA E IN SOGGETTI CON DISLIPIDEMIA MODERATA IN PREVENZIONE
SINOSSI. Titolo. Coordinatori e Promotori dello studio
 SINOSSI Titolo PLERIXAFOR (PLX) IN MODALITA ON DEMAND PER LA RACCOLTA DI CELLULE STAMINALI EMOPOIETICHE AUTOLOGHE IN PAZIENTI AFFETTI DA MIELOMA MULTIPLO DA LINFOMA CHE MOSTRINO POVERA MOBILIZZAZIONE DOPO
SINOSSI Titolo PLERIXAFOR (PLX) IN MODALITA ON DEMAND PER LA RACCOLTA DI CELLULE STAMINALI EMOPOIETICHE AUTOLOGHE IN PAZIENTI AFFETTI DA MIELOMA MULTIPLO DA LINFOMA CHE MOSTRINO POVERA MOBILIZZAZIONE DOPO
Responsabile: Prof. Stefano Milani SINTESI DEL PROTOCOLLO DI STUDIO
 Assegno di Ricerca dal titolo: Sperimentazione, studio, sviluppo e collaudo di nuovi metodi di prevenzione avanzata del cancro al colon-retto mediante colonscopia virtuale in modalità di telediagnosi.
Assegno di Ricerca dal titolo: Sperimentazione, studio, sviluppo e collaudo di nuovi metodi di prevenzione avanzata del cancro al colon-retto mediante colonscopia virtuale in modalità di telediagnosi.
ALLEGATOA alla Dgr n del 03 novembre 2014 pag. 1/5
 giunta regionale 9^ legislatura ALLEGATOA alla Dgr n. 2056 del 03 novembre 2014 pag. 1/5 PRESCRIZIONE DI PRODOTTI IMMUNOTERAPICI PROVVISTI DI AIC INDICATI NEL TRATTAMENTO DELLA RINITE ALLERGICA NELLA REGIONE
giunta regionale 9^ legislatura ALLEGATOA alla Dgr n. 2056 del 03 novembre 2014 pag. 1/5 PRESCRIZIONE DI PRODOTTI IMMUNOTERAPICI PROVVISTI DI AIC INDICATI NEL TRATTAMENTO DELLA RINITE ALLERGICA NELLA REGIONE
Gruppo Italiano per lo Studio dei Linfomi
 Gruppo Italiano per lo Studio dei Linfomi PROTOCOLLO: R-COMP05 STUDIO DI FASE II PER IL TRATTAMENTO DI PAZIENTI CON LINFOMA MARGINALE SPLENICO CON LA COMBINAZIONE DI CICLOFOSFAMIDE, VINCRISTINA, DOXORUBICINA
Gruppo Italiano per lo Studio dei Linfomi PROTOCOLLO: R-COMP05 STUDIO DI FASE II PER IL TRATTAMENTO DI PAZIENTI CON LINFOMA MARGINALE SPLENICO CON LA COMBINAZIONE DI CICLOFOSFAMIDE, VINCRISTINA, DOXORUBICINA
Quando eseguire l ecografia dell aorta? Perché durante un ecocardiogramma?
 Quando eseguire l ecografia dell aorta? Perché durante un ecocardiogramma? A. Sulla e R. Lumare Unità Operativa di Cardiologia UTC P.O. San Giovanni di Dio Crotone ncontri Pitagorici di Cardiologia 2012
Quando eseguire l ecografia dell aorta? Perché durante un ecocardiogramma? A. Sulla e R. Lumare Unità Operativa di Cardiologia UTC P.O. San Giovanni di Dio Crotone ncontri Pitagorici di Cardiologia 2012
Studio di fase II con Ribomustin in combinazione con Bortezomib e Rituximab (WM-BBR)
 Studio di fase II con Ribomustin in combinazione con Bortezomib e Rituximab (WM-BBR) in pazienti affetti da linfoma non Hodgkin linfoplasmocitico/morbo di Waldenstrom in seconda linea. Lorella Orsucci
Studio di fase II con Ribomustin in combinazione con Bortezomib e Rituximab (WM-BBR) in pazienti affetti da linfoma non Hodgkin linfoplasmocitico/morbo di Waldenstrom in seconda linea. Lorella Orsucci
CARCINOMA DEL POLMONE NON A PICCOLE CELLULE ( NSCLC )
 IL RUOLO DELLA RADIOTERAPIA NEL CANCRO DEL POLMONE Dott.ssa Sofia Meregalli S.C. RADIOTERAPIA ED ONCOLOGIA - A.O. SAN GERARDO- MONZA Introduzione La radioterapia (RT) è uno delle modalità di trattamento
IL RUOLO DELLA RADIOTERAPIA NEL CANCRO DEL POLMONE Dott.ssa Sofia Meregalli S.C. RADIOTERAPIA ED ONCOLOGIA - A.O. SAN GERARDO- MONZA Introduzione La radioterapia (RT) è uno delle modalità di trattamento
METASTATICO: NUOVE TERAPIE
 MELANOMA CUTANEO METASTATICO: NUOVE TERAPIE Andrea Pietro Sponghini S.C. Oncologia A.O.U. Maggiore della Carità Novara 1975-2010: CHEMIOTERAPIA E IL-2 La ricerca di base porta ad una nuova conoscenza.
MELANOMA CUTANEO METASTATICO: NUOVE TERAPIE Andrea Pietro Sponghini S.C. Oncologia A.O.U. Maggiore della Carità Novara 1975-2010: CHEMIOTERAPIA E IL-2 La ricerca di base porta ad una nuova conoscenza.
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Novembre 2015 TECFIDERA (DIMETILFUMARATO): NUOVE MISURE PER MINIMIZZARE IL RISCHIO DI
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Novembre 2015 TECFIDERA (DIMETILFUMARATO): NUOVE MISURE PER MINIMIZZARE IL RISCHIO DI
Insufficienza cardiaca cronica (ICC)
 Insufficienza cardiaca cronica (ICC) Dr. med Nicola Ferrari Medico capoclinica CCT 19 novembre 2011 Classi funzionali NYHA (New York Heart Association) Parametro di giudizio: sintomo Dispnea 1 2 3 4 Nessuna
Insufficienza cardiaca cronica (ICC) Dr. med Nicola Ferrari Medico capoclinica CCT 19 novembre 2011 Classi funzionali NYHA (New York Heart Association) Parametro di giudizio: sintomo Dispnea 1 2 3 4 Nessuna
Sesto San Giovanni, 26 settembre 2015
 Sesto San Giovanni, 26 settembre 2015 TUMORI DELLA MAMMELLA: TERAPIA MEDICA Dr. Claudio Vergani U. O. di Oncologia P. O. Città di Sesto Sesto S. Giovanni - Milano TERAPIA MEDICA Adiuvante: - in fase postoperatoria
Sesto San Giovanni, 26 settembre 2015 TUMORI DELLA MAMMELLA: TERAPIA MEDICA Dr. Claudio Vergani U. O. di Oncologia P. O. Città di Sesto Sesto S. Giovanni - Milano TERAPIA MEDICA Adiuvante: - in fase postoperatoria
RIVISTA: lnt Journal of lmpotence Research (2006) 18, MJ. Dresser, D. Desai, S. Gidwani, AD. Seftel, NB. Modi O B I E T T I V I
 I D E N T I F I C A T I V O A R T I C O L O TITOLO: Dapoxetine, a novel treatment for premature ejaculation, does not have pharmacokinetic interactions with phosphodiesterase-5 inhibitors Dapoxetina, nuovo
I D E N T I F I C A T I V O A R T I C O L O TITOLO: Dapoxetine, a novel treatment for premature ejaculation, does not have pharmacokinetic interactions with phosphodiesterase-5 inhibitors Dapoxetina, nuovo
ULTRAFILTRAZIONE NELLO SCOMPENSO CARDIACO, UNA NUOVA OPPORTUNITA PROTOCOLLO OPERATIVO DELL OSPEDALE DI AOSTA
 SCOMPENSO CARDIACO TRA ORMONI E CLINICA AOSTA 5 MARZO 2010 ULTRAFILTRAZIONE NELLO SCOMPENSO CARDIACO, UNA NUOVA OPPORTUNITA PROTOCOLLO OPERATIVO DELL OSPEDALE DI AOSTA ALESSANDRO LISI S.C. MEDICINA GENERALE
SCOMPENSO CARDIACO TRA ORMONI E CLINICA AOSTA 5 MARZO 2010 ULTRAFILTRAZIONE NELLO SCOMPENSO CARDIACO, UNA NUOVA OPPORTUNITA PROTOCOLLO OPERATIVO DELL OSPEDALE DI AOSTA ALESSANDRO LISI S.C. MEDICINA GENERALE
Linee guida per il planning nel carcinoma del polmone. Radiotherapy and Oncology 71 (2004)
 Linee guida per il planning nel carcinoma del polmone Radiotherapy and Oncology 71 (2004) 139-146 Linee guida per il planning nel carcinoma del polmone Posizionamento del paziente Acquisizione delle immagini
Linee guida per il planning nel carcinoma del polmone Radiotherapy and Oncology 71 (2004) 139-146 Linee guida per il planning nel carcinoma del polmone Posizionamento del paziente Acquisizione delle immagini
DERMO ONCOLOGIA MELANOMA MALIGNO CUTANEO: PET TAC quando. Dr. Pietro Bianchi - U.O.C. Medicina Nucleare USL 1- Massa Carrara
 DERMO ONCOLOGIA MELANOMA MALIGNO CUTANEO: PET TAC quando Dr. Pietro Bianchi - U.O.C. Medicina Nucleare USL 1- Massa Carrara Melanoma: PET-TC quando? Sangue membrana cellulare Cellula FDG FDG Esochinasi
DERMO ONCOLOGIA MELANOMA MALIGNO CUTANEO: PET TAC quando Dr. Pietro Bianchi - U.O.C. Medicina Nucleare USL 1- Massa Carrara Melanoma: PET-TC quando? Sangue membrana cellulare Cellula FDG FDG Esochinasi
AGOPUNTURA CINESE TRADIZIONALE COME SUPPORTIVE CARE IN CORSO DI CHEMIOTERAPIA ANTIBLASTICA SISTEMICA
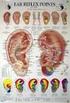 AGOPUNTURA CINESE TRADIZIONALE COME SUPPORTIVE CARE IN CORSO DI CHEMIOTERAPIA ANTIBLASTICA SISTEMICA Dott.ssa Benedetta Benedetti Tutor Scuola Tao U.O. Medicina Oncologica Direttore Dr. F. Artioli U.O.
AGOPUNTURA CINESE TRADIZIONALE COME SUPPORTIVE CARE IN CORSO DI CHEMIOTERAPIA ANTIBLASTICA SISTEMICA Dott.ssa Benedetta Benedetti Tutor Scuola Tao U.O. Medicina Oncologica Direttore Dr. F. Artioli U.O.
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE.
 Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
Farmaci biologici nel trattamento della psoriasi: differenze nei criteri di valutazione tra USA e UE. Renato Bertini Malgarini, Giuseppe Pimpinella, Luca Pani 10 dicembre 2012- Istituto Superiore di Sanità
Linfoma di Hodgkin (LH) Criticità della registrazione
 corso per operatori dei Registri Tumori AIRTUM I TUMORI EMATOLOGICI criticità nella diagnosi, registrazione e classificazione Linfoma di Hodgkin (LH) Criticità della registrazione Simona Nuzzo Registro
corso per operatori dei Registri Tumori AIRTUM I TUMORI EMATOLOGICI criticità nella diagnosi, registrazione e classificazione Linfoma di Hodgkin (LH) Criticità della registrazione Simona Nuzzo Registro
Diabete di tipo 2 scompensato in terapia insulinica intensiva: risoluzione di un caso clinico con il calcolatore di bolo
 Diabete di tipo 2 scompensato in terapia insulinica intensiva: risoluzione di un caso clinico con il calcolatore di bolo Presentazione del caso DDM è un sacerdote di 43 anni, giunto per la prima volta
Diabete di tipo 2 scompensato in terapia insulinica intensiva: risoluzione di un caso clinico con il calcolatore di bolo Presentazione del caso DDM è un sacerdote di 43 anni, giunto per la prima volta
ADENOCARCINOMA DEL RETTO
 ADENOCARCINOMA DEL RETTO GASTOENTEROLOGO- PATOLOGO CHIRURGO-RADIOLOGO- PATOLOGO GIOG ONCOLOGO-PATOLOGO- RADIOLOGO RADIOTERAPISTA 1. esame endoscopico richiesto dal Curante e/o per screening programmato.
ADENOCARCINOMA DEL RETTO GASTOENTEROLOGO- PATOLOGO CHIRURGO-RADIOLOGO- PATOLOGO GIOG ONCOLOGO-PATOLOGO- RADIOLOGO RADIOTERAPISTA 1. esame endoscopico richiesto dal Curante e/o per screening programmato.
c) CRO si impegna a corrispondere all'azienda, con la sola esclusione delle spese inerenti lo smaltimento del prodotto residuo scaduto, quanto segue:
 Allegato alla determinazione n. 523 del 20.11.2011 Al Direttore Generale Dr. Paolo Morello Marchese Azienda Ospedaliera Universitaria Senese Strada delle Scotte, 14 53100 Siena p.c. Egregio Dr. Michele
Allegato alla determinazione n. 523 del 20.11.2011 Al Direttore Generale Dr. Paolo Morello Marchese Azienda Ospedaliera Universitaria Senese Strada delle Scotte, 14 53100 Siena p.c. Egregio Dr. Michele
Intercettare il paziente con bisogni palliativi. Dr. Marco Barchetti
 Intercettare il paziente con bisogni palliativi Dr. Marco Barchetti Considerazioni Nella pratica clinica quotidiana si rende sempre più necessaria l identificazione di criteri clinici che conducano a considerare
Intercettare il paziente con bisogni palliativi Dr. Marco Barchetti Considerazioni Nella pratica clinica quotidiana si rende sempre più necessaria l identificazione di criteri clinici che conducano a considerare
Risk Management in Clinical RADIOTHERAPY. TREVISO 10 DICEMBRE 2014 Dr. G.Franchin RT-CRO
 Risk Management in Clinical RADIOTHERAPY TREVISO 10 DICEMBRE 2014 Dr. G.Franchin RT-CRO MANAGEMENT AND CLINICAL GOVERNANCE RISK ASSESSMENT /QUALITY MANAGEMENT SYSTEM/RADIOTHERAPY ERROR/NEAR MISS REPORTING
Risk Management in Clinical RADIOTHERAPY TREVISO 10 DICEMBRE 2014 Dr. G.Franchin RT-CRO MANAGEMENT AND CLINICAL GOVERNANCE RISK ASSESSMENT /QUALITY MANAGEMENT SYSTEM/RADIOTHERAPY ERROR/NEAR MISS REPORTING
Produttività, capacità di attrarre risorse e trasferibilità
 Produttività, capacità di attrarre Trials clinici Anno 2008 Studio Gisas: aripiprazolo, olanzapina e aloperidolo nel trattamento a lungo termine della schizofrenia Lo studio si propone di valutare l utilità
Produttività, capacità di attrarre Trials clinici Anno 2008 Studio Gisas: aripiprazolo, olanzapina e aloperidolo nel trattamento a lungo termine della schizofrenia Lo studio si propone di valutare l utilità
Radioterapia nelle metastasi encefaliche. Case Report. A.R. Marsella. S.C. Radioterapia Oncologica - A.S.L. TA/1
 Radioterapia nelle metastasi encefaliche Case Report A.R. Marsella S.C. Radioterapia Oncologica - A.S.L. TA/1 Caratteristiche del Paziente Donna di 45 anni in buone condizioni generali affetta da metastasi
Radioterapia nelle metastasi encefaliche Case Report A.R. Marsella S.C. Radioterapia Oncologica - A.S.L. TA/1 Caratteristiche del Paziente Donna di 45 anni in buone condizioni generali affetta da metastasi
Diagnostica e livelli essenziali di assistenza
 Diagnostica e livelli essenziali di assistenza Bologna 3 dicembre 2012 Antonio Brambilla Costi, volumi, variabilità Quasi 70 milioni di prestazioni di diagnostica, visite e laboratorio Fonte: Sistema Informativo
Diagnostica e livelli essenziali di assistenza Bologna 3 dicembre 2012 Antonio Brambilla Costi, volumi, variabilità Quasi 70 milioni di prestazioni di diagnostica, visite e laboratorio Fonte: Sistema Informativo
Confronto fra soggetti o entro soggetti?
 Confronto fra soggetti o entro soggetti? Metodo epidemiologici per la clinica _efficacia / 2 Gli studi crossover Periodo 1 Periodo 2 R A N D O M A B A B Valutazione Tempo 1 0 1 1 2 0 2 1 Metodo epidemiologici
Confronto fra soggetti o entro soggetti? Metodo epidemiologici per la clinica _efficacia / 2 Gli studi crossover Periodo 1 Periodo 2 R A N D O M A B A B Valutazione Tempo 1 0 1 1 2 0 2 1 Metodo epidemiologici
Algoritmi e percorsi terapeutici dei Carcinomi del Polmone
 Algoritmi e percorsi terapeutici dei Carcinomi del Polmone Standard Individualizzata Sperimentale Stadio Ia/Ib T1-2a N0 M0 radicale) CHIR con resezione sub-lobare, solo stadio Ib CHIR con VATS campionamento
Algoritmi e percorsi terapeutici dei Carcinomi del Polmone Standard Individualizzata Sperimentale Stadio Ia/Ib T1-2a N0 M0 radicale) CHIR con resezione sub-lobare, solo stadio Ib CHIR con VATS campionamento
