SCHEDE ESERCITAZIONI IN LABORATORIO
|
|
|
- Maria Repetto
- 9 anni fa
- Visualizzazioni
Transcript
1 SCHEDE ESERCITAZIONI IN LABORATORIO
2 ALCALIMETRIA (dosaggio dell acido fosforico) Ritirare il pesafiltri contenente il potassio idrogeno ftalato (KHC 8 H 4 O 4 ), sostanza madre per la standardizzazione della soluzione di sodio idrossido (NaOH). Lasciarlo raffreddare in essiccatore per circa 20 minuti. - standardizzazione della soluzione di NaOH Pesare, in vetro da orologio, circa 0,8 g di potassio idrogeno ftalato (sostanza madre) annotandone il peso esatto. Travasare quantitativamente (aiutandosi con l imbuto per il travaso delle polveri) in beuta da 250 ml lavando vetrino ed imbuto con circa 50 ml di acqua distillata e agitando fino a completa dissoluzione del sale. Aggiungere 3 gocce di indicatore (fenolftaleina) e titolare con la soluzione di NaOH fino a colorazione rosa persistente (30 secondi) della soluzione. Annotare il volume esatto di titolante impiegato e calcolare il titolo della soluzione standard di sodio idrossido. Eseguire almeno tre titolazioni distinte e trascrivere sulla etichetta della bottiglia il titolo medio calcolato e la data della standardizzazione. - dosaggio dell acido fosforico Ritirare la beuta contenente la soluzione del campione in analisi. Travasarne quantitativamente il contenuto in pallone tarato da 250 ml (aiutandosi con l imbuto di vetro a gambo corto), lavando accuratamente la beuta e l imbuto stesso. Portare esattamente a volume di 250 ml con acqua distillata e rendere omogenea la soluzione mescolandola più volte per inversione. - Titolazione primo protone: prelevare, in beuta da 250 ml, circa 40 ml della soluzione in analisi, annotando il volume esatto. Aggiungere 1 goccia di indicatore arancio metile e 5 gocce di indicatore verde di bromocresolo. Titolare con la soluzione standard di NaOH fino a viraggio dell indicatore: colorazione della soluzione verde con tonalità azzurra (scomparsa della tonalità gialla). Annotare il volume esatto di titolante impiegato e calcolare la quantità totale (grammi) di acido fosforico nel campione in analisi. Eseguire almeno due titolazioni distinte. - Titolazione primo + secondo protone: prelevare, in beuta da 250 ml, circa 20 ml della soluzione in analisi, annotando il volume esatto. Aggiungere 2 gocce di indicatore fenolftaleina e 2 gocce di indicatore α-naftolftaleina. Titolare con la soluzione standard di NaOH fino a viraggio dell indicatore: colorazione della soluzione viola con tonalità rossa (scomparsa tonalità blu). Annotare il volume esatto di titolante impiegato e calcolare la quantità totale (grammi) di acido fosforico nel campione in analisi. Eseguire almeno due titolazioni distinte. Consegnare il risultato finale compilando una breve relazione seguendo lo schema prefissato (lasciare distinti i valori trovati nella titolazione al primo ed al secondo punto di equivalenza).
3 ACIDIMETRIA (standardizzazione soluzione HCl) - Ritirare il pesafiltri contenente il sodio carbonato (Na 2 CO 3 ) sostanza madre per la standardizzazione della soluzione di acido cloridrico. Lasciare raffreddare in essiccatore per circa 20 minuti. - Ritirare la beuta contenente la soluzione di HCl e travasarne quantitativamente il contenuto in pallone tarato da 250 ml. Portare esattamente a volume con acqua distillata e rendere omogenea la soluzione mescolandola più volte per inversione. - standardizzazione della soluzione di HCl Pesare, in vetro da orologio, circa 200 mg Na 2 CO 3 (sostanza madre) annotandone il peso esatto. Travasare quantitativamente (aiutandosi con l imbuto per il travaso delle polveri) il sale in una beuta da 250 ml, lavando vetrino ed imbuto con circa 50 ml di acqua distillata ed agitando fino alla sua completa dissoluzione. Aggiungere 3 gocce di indicatore (fenolftaleina) e titolare con la soluzione di HCl fino a scomparsa della colorazione (il volume di titolante usato ha solo un valore orientativo, non definitivo per il calcolo del titolo della soluzione di HCl). Aggiungere alla stessa soluzione 3 gocce di indicatore (rosso metile) e continuare la titolazione fino a nuovo viraggio (da giallo ad aranciorossastro). Sospendere la titolazione e bollire la soluzione per qualche minuto. Poi raffreddare sotto acqua corrente e completare la titolazione fino a viraggio completo dell indicatore (da giallo a rosso). Se per quest ultima operazione è stato necessario aggiungere più di 5 o 6 gocce di titolante, ripetere l operazione di riscaldamento. Annotare il volume esatto di titolante impiegato e calcolare il titolo della soluzione standard di HCl. Eseguire almeno tre titolazioni distinte. Consegnare il risultato finale compilando una breve relazione seguendo lo schema prefissato.
4 ARGENTOMETRIA (dosaggio dei cloruri) -Ritirare il pesafiltri contenente il sodio cloruro (NaCl), sostanza madre per la standardizzazione della soluzione di argento nitrato (AgNO 3 ). Lasciare raffreddare in essiccatore. - Ritirare la bottiglia con la soluzione di argento nitrato da titolare (circa 0,1 M). - Preparare una soluzione di ammonio tiocianato (circa 0,1 M) pesando (bilancia tecnica) circa 4,5 g di NH 4 NCS e sciogliendoli in circa 600 ml di acqua distillata. Conservare in bottiglia di vetro con etichetta recante il numero di banco ed il contenuto. Standardizzazione della soluzione di argento nitrato (metodo di Mohr) Pesare circa 200 mg di NaCl (sostanza madre) annotando il peso esatto. Travasare quantitativamente (aiutandosi con l imbuto per il travaso delle polveri) in beuta da 250 ml lavando vetrino ed imbuto con circa 50 ml di acqua distillata. Mescolare fino a completa dissoluzione del sale, aggiungere 1 ml di indicatore (K 2 CrO 4 soluzione al 5%) e titolare con la soluzione di argento nitrato fino a viraggio dell indicatore: precipitato bianco-sporco per inizio precipitazione di argento cromato (Ag 2 CrO 4 ) di colore rosso. Annotare il volume esatto di titolante impiegato e calcolare il titolo della soluzione standard di argento nitrato. Eseguire almeno tre titolazioni distinte e trascrivere sulla etichetta della bottiglia il titolo medio calcolato e la data della standardizzazione. Nota: poiché la formazione di argento cromato regredisce piuttosto lentamente, è necessario evitare locali eccessi di Ag + durante la titolazione, specialmente in prossimità del punto di equivalenza (agitare la soluzione in modo continuo e vigoroso). Standardizzazione della soluzione di ammonio tiocianato. Prelevare in beuta da 250 ml circa 35 ml di soluzione standard di argento nitrato, annotandone il volume esatto. Aggiungere 2-3 ml di acido nitrico (6 M) e 1-2 ml di indicatore allume ferrico [soluzione satura di NH 4 Fe(SO 4 ) 2 ]. Titolare con la soluzione di ammonio tiocianato, agitando vigorosamente specialmente nei pressi del punto di equivalenza, fino a viraggio dell indicatore: colore della soluzione da giallo chiaro a rosso arancio persistente. Annotare il volume esatto di titolante impiegato e calcolare il titolo della soluzione standard di ammonio tiocianato (noto il volume prelevato ed il titolo della soluzione di argento nitrato). Eseguire almeno tre titolazioni distinte e trascrivere sulla etichetta della bottiglia il titolo medio calcolato e la data della standardizzazione. Dosaggio dei cloruri (metodo di Volhard) Ritirare il campione da analizzare e, dopo raffreddamento in essiccatore, pesarne con accuratezza una quantità calcolata in modo da utilizzare circa 30 ml di soluzione titolante (NH 4 NCS) [una pre-analisi eseguita su circa 150 mg di campione consentirà di calcolare il peso ottimale per le successive analisi]. Travasare quantitativamente in beuta, lavando vetrino ed imbuto con circa 25 ml di acqua distillata, agitando fino a completa dissoluzione del campione. Aggiungere 3-4 ml di acido nitrico (6 M) e poi, lentamente e sotto continua agitazione, circa 50 ml di soluzione standard AgNO 3 annotandone il volume esatto. Riscaldare fino ad incipiente ebollizione per consentire la coagulazione del precipitato (soluzione sovrastante perfettamente limpida) e poi raffreddare la beuta sotto acqua corrente. Aggiungere 2 ml di indicatore (allume ferrico) e titolare con la soluzione standard di ammonio tiocianato, agitando vigorosamente specialmente nei pressi del punto di equivalenza, fino a viraggio relativamente stabile dell indicatore (la colorazione leggermente giallo-arancio della soluzione tende lentamente a decolorarsi per la reazione di spostamento cloruro/tiocianato). Annotare il volume esatto di titolante impiegato e calcolare la percentuale dei cloruri (espressa come NaCl) nel campione in analisi (essendo noto il volume prelevato ed il titolo della soluzione di argento nitrato). Eseguire almeno tre titolazioni distinte. Consegnare il risultato finale compilando la consueta relazione.
5 CHELOMETRIA (standardizzazione soluzione EDTA) Ritirare il pesafiltri contenente il calcio carbonato (CaCO 3 ), sostanza madre per la standardizzazione della soluzione di EDTA. Lasciare raffreddare in essiccatore. - Ritirare la beuta contenente la soluzione di EDTA e travasarne quantitativamente il contenuto in pallone tarato da 250 ml. Portare esattamente a volume con acqua distillata e rendere omogenea la soluzione mescolandola più volte per inversione. Standardizzazione della soluzione di EDTA (metodo per spostamento) - Preparazione di una soluzione magnesio-edta 1:1 Prelevare in beuta circa 30 ml di soluzione 0,1 M di magnesio cloruro. Aggiungere 5 ml di tampone ammoniacale (ph = 10) e una punta di spatola (0,1 g) di indicatore NET (miscela all 1% di Nero Eriocromo T in NaCl). Titolare con la soluzione di EDTA fino a viraggio da rosso a blu. - Procedimento per la standardizzazione: Pesare circa 400 mg di CaCO 3 (sostanza madre) annotandone il peso esatto. Travasare quantitativamente (aiutandosi con l imbuto per il travaso delle polveri) in beuta da 250 ml lavando vetrino ed imbuto con circa 30 ml di acqua distillata. Aggiungere goccia a goccia HCl 2N fino a completa dissoluzione del sale e poi qualche goccia in eccesso. Bollire cautamente la soluzione per alcuni minuti(eliminazione della CO 2 ) e quindi, dopo raffreddamento, neutralizzarla con soluzione di ammonio idrossido 1:1 (leggero odore di ammoniaca). Aggiungere 7-8 ml di soluzione di complesso magnesio-edta, 5 ml di tampone ammoniacale e 0,1 g di indicatore. Titolare con la soluzione di EDTA fino a viraggio da rosso a blu. Annotare il volume esatto di titolante impiegato e calcolare il titolo della soluzione standard di EDTA. Eseguire almeno tre titolazioni distinte. Consegnare il risultato finale compilando una breve relazione seguendo lo schema prefissato.
6 PERMANGANOMETRIA (dosaggio del ferro) - Ritirare dalla stufa il pesafiltri contenente il sodio ossalato (Na 2 C 2 O 4 ), sostanza madre per la standardizzazione della soluzione di KMnO 4. Lasciare raffreddare in essiccatore. - filtrare la soluzione di potassio permanganato preparata, almeno 24 ore prima, pesando circa 2,5 g di KMnO 4 e sciogliendoli in beaker da 1 L con circa 750 ml di acqua distillata. Coprire il beaker con un vetro da orologio e bollire cautamente per circa 30 minuti. Lasciare raffreddare la soluzione e conservarla, coperta, nell armadietto). Per questa operazione predisporre, sull apposito anello, l imbuto di vetro per filtrazioni (gambo lungo) con dentro un piccolo batuffolo di lana di vetro. Filtrare lentamente la soluzione di permanganato, avendo cura di non agitarla, in modo da lasciare l eventuale deposito sul fondo del beaker. La soluzione filtrata viene raccolta in bottiglia di vetro scuro, perfettamente pulita e il più possibile asciutta. Rendere omogenea la soluzione mescolando più volte per inversione. Mettere un etichetta con numero di banco e contenuto della bottiglia. Standardizzazione della soluzione di KMnO 4 Pesare con accuratezza circa 0,2-0,3 g di Na 2 C 2 O 4 e trasferirli quantitativamente in beaker da 400 ml. Diluire a circa 200 ml ed aggiungere 20 ml di soluzione di acido solforico (1:4). Titolare con la soluzione di permanganato applicando il seguente procedimento: aggiungere prima 1 ml di soluzione di permanganato, riscaldare a circa 60 C, e poi completare la titolazione fino a colorazione della soluzione appena rosa (persistente almeno 30 secondi). Annotare il volume esatto di titolante impiegato e calcolare il titolo della soluzione standard di permanganato. Eseguire almeno tre titolazioni distinte e trascrivere sulla etichetta della bottiglia il titolo medio calcolato e la data della standardizzazione. Nota: per evitare reazioni secondarie, la titolazione deve essere eseguita sotto costante agitazione (con bacchetta di vetro) evitando la formazione di locali eccessi di reattivo titolante. Dosaggio del ferro (metodo di Zimmerman-Reinhardt) Completata la standardizzazione del permanganato, ritirare il campione da analizzare. Pesare con accuratezza circa 1,5 g di campione e trasferirli quantitativamente in beuta da 250 ml con circa 50 ml di acqua. Aggiungere 10 ml di HCl (1:1), scaldare la soluzione fino ad incipiente ebollizione e poi aggiungere (sempre a caldo) una soluzione di stagno(ii) cloruro (SnCl 2 ), goccia a goccia, agitando, fino a completa scomparsa della eventuale colorazione gialla della soluzione [quantitativa riduzione del ferro(iii) a ferro(ii)] più 2 gocce in eccesso. Raffreddare la soluzione sotto acqua corrente ed aggiungere, rapidamente, 10 ml di soluzione di mercurio(ii) cloruro (HgCl 2 ): si dovrà formare un piccolo precipitato bianco di calomelano (Hg 2 Cl 2 ) (eliminazione dell'eccesso di riducente aggiunto). Lasciare a riposo per 5 minuti. Nota: se non si formasse precipitato (SnCl 2 aggiunto in quantità insufficiente) oppure se il precipitato fosse di colore grigio (SnCl 2 aggiunto in quantità esageratamente in eccesso) sarà necessario ricominciare l'analisi dal principio. Travasare quantitativamente la soluzione in beaker da 600 ml diluendola a circa 300 ml con acqua. Aggiungere 25 ml di soluzione di Zimmerman-Reinhardt e titolare, a freddo, agitando con bacchetta di vetro, con la soluzione standard di permanganato fino a colorazione della soluzione appena rosa, stabile per almeno secondi (la presenza di Hg 2 Cl 2 può causare la lenta riduzione della goccia di permanganato in eccesso). Annotare il volume esatto di titolante impiegato e calcolare la percentuale di ferro (espressa come Fe) nel campione in analisi. Eseguire almeno tre titolazioni distinte. Consegnare il risultato finale compilando una breve relazione seguendo lo schema prefissato.
7 PERMANGANOMETRIA (dosaggio del calcio) Ritirare dalla stufa il pesafiltri contenente il sodio ossalato (Na 2 C 2 O 4 ), sostanza madre per la standardizzazione della soluzione di KMnO 4. Lasciare raffreddare in essiccatore. Nell attesa: - filtrare la soluzione di potassio permanganato preparata durante la precedente analisi. Per questa operazione predisporre, sull apposito anello, l imbuto di vetro per filtrazioni (gambo lungo) con dentro un piccolo batuffolo di lana di vetro. Filtrare lentamente la soluzione di permanganato, avendo cura di non agitarla, in modo da lasciare l eventuale deposito sul fondo del beaker. La soluzione filtrata viene raccolta in bottiglia di vetro scuro, perfettamente pulita e il più possibile asciutta. Rendere omogenea la soluzione mescolando più volte per inversione. Mettere un etichetta con numero di banco e contenuto della bottiglia. Standardizzazione della soluzione di KMnO 4 Pesare con accuratezza circa 0,2-0,3 g di Na 2 C 2 O 4 e trasferirli quantitativamente in beaker da 400 ml. Diluire a circa 200 ml ed aggiungere 20 ml di soluzione di acido solforico (1:4). Titolare con la soluzione di permanganato applicando il seguente procedimento: aggiungere prima 1 ml di soluzione di permanganato, riscaldare a circa 60 C, e poi completare la titolazione fino a colorazione della soluzione appena rosa (persistente almeno 30 secondi). Annotare il volume esatto di titolante impiegato e calcolare il titolo della soluzione standard di permanganato. Eseguire almeno tre titolazioni distinte e trascrivere sulla etichetta della bottiglia il titolo medio calcolato e la data della standardizzazione. Nota: per evitare reazioni secondarie, la titolazione deve essere eseguita sotto costante agitazione (con bacchetta di vetro) evitando la formazione di locali eccessi di reattivo titolante. Dosaggio del calcio (metodo permanganometrico via ossalato) Travasare la soluzione contenente il calcio in beaker da 400 ml e diluire fino a circa 200 ml con acqua. Aggiungere 4 gocce di indicatore rosso metile, acidificare con HCl conc. fino a viraggio (da giallo a rosso) più 1 ml in eccesso. Riscaldare la soluzione fino quasi all ebollizione, aggiungere 3 g di ammonio ossalato disciolti nella minima quantità di acqua, rendere omogenea la soluzione e neutralizzarla, sotto costante agitazione, con ammoniaca 1:1 (fino a nuovo viraggio dell indicatore da rosso a giallo). Lasciare digerire il precipitato (CaC 2 O 4 ) per almeno 1 ora a circa 60/70 C, controllando che il ph della soluzione non vari apprezzabilmente. Filtrare per decantazione (filtro a fascia azzurra) e lavare il precipitato con piccole porzioni di acqua fredda fino a scomparsa dello ione ossalato in eccesso (1 ml di soluzione filtrata + 5 gocce di H 2 SO 4 (1:4) + 1 goccia di soluzione diluita di permanganato non deve, dopo riscaldamento, essere meno intensamente colorata di un bianco dei reattivi). Dopo la scomparsa dell eccesso dello ione ossalato anche dal filtro, mettere il beaker contenente il precipitato di calcio ossalato sotto l imbuto e trattare il filtro con circa 20 ml di acido solforico (1:4) caldo, a piccole porzioni, per sciogliere tutto il precipitato in esso contenuto. Bucare poi il filtro con una bacchetta di vetro appuntita e lavare il filtro con getto d acqua in modo da asportare anche meccanicamente anche eventuali tracce di precipitato non disciolto con il trattamento acido. Diluire la soluzione a circa 200 ml con acqua, riscaldare fino a completa dissoluzione del precipitato e titolare a circa 60 C con soluzione standard di potassio permanganato fino al primo rosa persistente. Aggiungere alla soluzione il filtro e, se questa si decolora, continuare la titolazione fino a nuovo rosa persistente per almeno secondi. Dal volume di permanganato utilizzato e dal suo titolo determinare la quantità (equivalenti) di ossalato titolati e, da questi, la quantità (mg) di calcio contenuta nel campione in analisi. Consegnare i risultati con la consueta relazione.
8 DICROMATOMETRIA (dosaggio del ferro) Ritirare dalla stufa il pesafiltri contenente il potassio dicromato (K 2 Cr 2 O 7 ) sostanza madre per la preparazione della soluzione standard del titolante Lasciare raffreddare in essiccatore. Preparazione della soluzione standard di K 2 Cr 2 O 7 Pesare con accuratezza circa 1,2 g di K 2 Cr 2 O 7 e trasferirli quantitativamente in matraccio tarato da 250 ml con l'aiuto di 50 ml di acqua. Portare in soluzione il sale e poi aggiungere acqua fino al volume esatto di 250 ml. Mescolare accuratamente (per inversione). Calcolare il titolo esatto (N) della soluzione ed annotarlo sul quaderno. La reazione per il calcolo del peso equivalente del dicromato è la seguente Cr 2 O H e 2 Cr H 2 O Dosaggio del ferro Ritirare il pesafiltri contenente il campione da analizzare. Pesare con accuratezza circa 1 g di campione e trasferirlo quantitativamente in beuta da 250 ml con circa 50 ml di acqua. Aggiungere 10 ml di HCl (1:1), scaldare la soluzione fino ad incipiente ebollizione e poi aggiungere (sempre a caldo) una soluzione di stagno(ii) cloruro (SnCl 2 ), goccia a goccia, agitando, fino a completa scomparsa della eventuale colorazione gialla della soluzione [quantitativa riduzione del ferro(iii) a ferro(ii)] più 2 gocce in eccesso. Raffreddare la soluzione sotto acqua corrente ed aggiungere, rapidamente, 10 ml di soluzione di mercurio(ii) cloruro (HgCl 2 ): si dovrà formare un piccolo precipitato bianco di calomelano (Hg 2 Cl 2 ) (eliminazione dell'eccesso di riducente aggiunto). Lasciare a riposo per 5 minuti. Nota: se non si formasse precipitato (SnCl 2 aggiunto in quantità insufficiente) oppure se il precipitato fosse di colore grigio (SnCl 2 aggiunto in quantità esageratamente in eccesso) sarà necessario ricominciare l'analisi dal principio. Aggiungere 25 ml di acido solforico 2 N, 5 ml di acido fosforico concentrato (85%) e 7 gocce di indicatore (soluzione all 1% di difenilammina in acido solforico concentrato). Titolare con la soluzione standard di K 2 Cr 2 O 7 sotto costante agitazione fino a viraggio da verde (colore del cromo(iii) formatosi per riduzione del dicromato) a grigio-verde con riflessi viola-porpora (il viraggio e' netto ma non molto stabile nel tempo). Annotare il volume esatto di titolante impiegato e calcolare la percentuale di ferro (espressa come Fe) nel campione in analisi. Eseguire almeno tre titolazioni distinte. Consegnare il risultato finale compilando una breve relazione seguendo lo schema prefissato. nota: è consigliabile aggiungere l indicatore verso la fine della titolazione per evitare che locali eccessi di titolante possano distruggere l indicatore stesso durante la titolazione. Per lo stesso motivo, è necessario titolare molto lentamente in prossimità del punto di equivalenza, agitando bene la soluzione.
9 IODOMETRIA (dosaggio del rame) - Ritirare dalla stufa il pesafiltri contenente il potassio dicromato (K 2 Cr 2 O 7 ) sostanza madre per la standardizzazione di una soluzione di sodio tiosolfato (0,1 N), preparata almeno 24 ore prima, pesando circa 15 g di Na 2 S 2 O 3 e sciogliendoli in beaker da 600 ml con circa 300 ml di acqua. Aggiungere 3 g di sodio tetraborato (Na 2 BB4O 7 10H 2 O) e, dopo dissoluzione, travasare la soluzione in bottiglia di vetro scuro. Aggiungere altri 300 ml di acqua e mescolare bene la soluzione. - Ritirare la beuta contenente la soluzione di rame(ii) da analizzare e travasarne quantitativamente il contenuto in matraccio tarato da 250 ml. Portare a volume con acqua e mescolare la soluzione per inversione fino a renderla omogenea. Standardizzazione dalla soluzione di sodio tiosolfato Pesare circa 0,2 g di K 2 Cr 2 O 7 (sostanza madre) annotandone il peso esatto. Travasarli quantitativamente in beuta a tappo a smeriglio con l aiuto di circa 50 ml di H 2 O. Aggiungere a questa soluzione 6 ml di HC1 conc. e, dopo mescolamento, con cautela, una punta di spatola di NaHCO 3. Terminato lo sviluppo gassoso (CO 2 ), senza agitare, aggiungere circa 3 g di potassio ioduro (KI), chiudere la beuta con il tappo, mescolare e lasciare a riposo al buio (dentro l armadietto) per circa 5 minuti. Trascorso questo tempo, aprire con cautela la beuta lavando accuratamente il tappo e le pareti con soluzione di KI al 2% (preparata a parte) al fine di impedire perdite di iodio (volatile). Titolare con soluzione di tiosolfato, prima fino a colorazione della soluzione giallo-verde (giallo per la presenza di iodio libero ancora non titolato + verde per il cromo(iii) formatosi per riduzione del dicromato ad opera dello ioduro) e poi, dopo aggiunta di circa 2 ml di soluzione di indicatore (salda d amido) fino a nuovo viraggio da blu-verde [blu per il complesso di adsorbimento dello iodio sull amido + verde del cromo(iii)] a verde netto. Annotare il volume esatto di titolante impiegato e calcolare il titolo (N) della soluzione standard di tiosolfato. Eseguire almeno tre titolazioni distinte e trascrivere sulla etichetta della bottiglia il titolo medio calcolato e la data della standardizzazione. Dosaggio del rame Prelevare in beuta a tappo smeriglio, circa 40 ml di soluzione di rame annotandone il volume esatto. Aggiungere qualche goccia (in genere 1-2 sono sufficienti) di ammoniaca (1:1) fino ad incipiente intorbidamento della soluzione e poi 5 ml di acido acetico glaciale. Aggiungere ancora circa 3 g di KI, chiudere la beuta, mescolare e lasciare a riposo, al buio, per circa 5 minuti. Trascorso questo tempo, aprire con cautela la beuta lavando accuratamente il tappo e le pareti con la soluzione di KI al 2%.Titolare con la soluzione standard di tiosolfato, prima fino a colorazione della soluzione giallo chiaro e poi, dopo aggiunta di circa 2 ml di soluzione di indicatore (salda d amido) fino a scomparsa del colore azzurro. Infine aggiungere circa 2 g di ammonio tiocianato (NH 4 SCN), agitare bene e, nella eventualità di un ritorno del colore azzurro, completare ancora la titolazione fino a nuova scomparsa di questo colore. Annotare il volume esatto di titolante impiegato e calcolare la quantità totale (grammi) di rame nel campione in analisi. Eseguire almeno tre titolazioni distinte. Consegnare il risultato finale compilando una breve relazione seguendo lo schema prefissato.
10 DOSAGGIO del FERRO (dosaggio gravimetrico) Ritirare la beuta contenente il campione in analisi e travasarne quantitativamente il contenuto in beaker da 400 ml. Aggiungere 1 ml (20 gocce) di HCl conc. e diluire a circa 200 ml con acqua. Aggiungere 1-2 ml di HNO 3 conc. e riscaldare la soluzione all ebollizione per 2 minuti. Sospendere il riscaldamento, aggiungere circa 3 g di ammonio nitrato e, dopo dissoluzione del sale, ammoniaca (1:1) lentamente, agitando, fino a completa precipitazione del ferro idrossido (Fe(OH) 3 ), più un leggero eccesso (odore di ammoniaca). Lasciare digerire il precipitato nel beaker coperto con vetro da orologio per circa 30 minuti, mantenendo la temperatura intorno ai 70 C (attenzione a non fare bollire la soluzione) e agitando frequentemente (alla fine del processo di digestione il precipitato deve depositarsi abbastanza rapidamente, lasciando la soluzione limpida). Controllare che il ph della soluzione non sia variato (leggero odore di ammoniaca ancora presente) e filtrare la soluzione ancora calda (filtro a fascia nera), per decantazione (raccogliere la soluzione filtrata in contenitore pulito, controllare che sia perfettamente limpida e poi scartarla). Lavare il precipitato con porzioni (ciascuna di circa 30 ml) di soluzione acquosa al 2% di ammonio nitrato, resa leggermente alcalina per aggiunta di qualche goccia di ammoniaca) fino a scomparsa dello ione cloruro dalle acque di lavaggio (saggio argentometrico) e filtrando ogni volta per decantazione (raccogliere la soluzione filtrata in contenitore pulito, controllare che sia perfettamente limpida e poi scartarla). Completata l operazione di lavaggio (scomparso lo ione cloruro anche dal filtro), trasferire quantitativamente il precipitato di ferro idrossido nel filtro aiutandosi prima con la soluzione di lavaggio e poi recuperando l eventuale precipitato aderente alle pareti del beaker con piccoli pezzetti di carta ricavati da un altro filtro leggermente umidi (questi pezzetti di carta, contenenti parte del precipitato, sono raccolti nel filtro contenente il resto del precipitato). Ripiegare il filtro su se stesso (per impedire perdite di precipitato), metterlo su un vetro da orologio (contrassegnato con il numero del banco) ed asciugarlo in stufa a 120 C. Introdurre il filtro asciutto nel crogiolo (a peso costante e noto) e carbonizzarlo cautamente sulla fiamma (tenendo il crogiolo inclinato sul triangolo refrattario); calcinare poi al calor rosso (ruotando ogni tanto il crogiolo con le apposite pinze fino a completa scomparsa dei residui carboniosi). Infine portare a costanza di peso in muffola (850 C). Dal peso di Fe 2 O 3 trovato risalire alla quantità (mg) di ferro contenuta nel campione in analisi. Consegnare il risultato con la consueta relazione.
METODO DI VOLHARD. Nel metodo di Volhard gli ioni argento sono titolati con una soluzione standard di ione tiocianato: Ag + + SCN - AgSCN
 METODO DI VOLHARD Il metodo viene impiegato per la determinazione di ioni alogenuro quali I -, Cl -, Br -. Un eccesso noto di soluzione standard di nitrato di argento AgNO 3 viene aggiunto al campione
METODO DI VOLHARD Il metodo viene impiegato per la determinazione di ioni alogenuro quali I -, Cl -, Br -. Un eccesso noto di soluzione standard di nitrato di argento AgNO 3 viene aggiunto al campione
ESPERIENZA 4. Permanganometria
 ESPERIENZA 4 Permanganometria Il permanganato di potassio è uno dei titolanti più frequentemente usati nell analisi volumetrica per via redox. Può essere usato in soluzione acida, neutra o leggermente
ESPERIENZA 4 Permanganometria Il permanganato di potassio è uno dei titolanti più frequentemente usati nell analisi volumetrica per via redox. Può essere usato in soluzione acida, neutra o leggermente
OSSIDAZIONI CON PERMANGANATO DI POTASSIO
 OSSIDAZIONI CON PERMANGANATO DI POTASSIO Il permanganato di potassio è agente ossidante forte di colore viola intenso. In soluzioni fortemente acide (ph ~1) è ridotto a Mn 2+ incolore. MnO 4 + 8H + + 5e
OSSIDAZIONI CON PERMANGANATO DI POTASSIO Il permanganato di potassio è agente ossidante forte di colore viola intenso. In soluzioni fortemente acide (ph ~1) è ridotto a Mn 2+ incolore. MnO 4 + 8H + + 5e
TITOLAZIONI PER PRECIPITAZIONE
 PRECIPITOMETRIA TITOLAZIONI PER PRECIPITAZIONE Le titolazioni per precipitazione sono un alternativa alle analisi gravimetriche (non trattate in questo insegnamento) che, nonostante l accuratezza possono
PRECIPITOMETRIA TITOLAZIONI PER PRECIPITAZIONE Le titolazioni per precipitazione sono un alternativa alle analisi gravimetriche (non trattate in questo insegnamento) che, nonostante l accuratezza possono
Esperienza n. 1 TITOLAZIONI ACIDO-BASE
 Esperienza n. 1 TITOLAZIONI ACIDO-BASE Preparazione e standardizzazione di una soluzione circa 0.1 M di HCl Preparazione di 1 L di HCl circa 0.1 M. Utilizzando un cilindro da 10 ml, prelevare X ml di HCl
Esperienza n. 1 TITOLAZIONI ACIDO-BASE Preparazione e standardizzazione di una soluzione circa 0.1 M di HCl Preparazione di 1 L di HCl circa 0.1 M. Utilizzando un cilindro da 10 ml, prelevare X ml di HCl
ESPERIENZA 2. Argentometria
 ESPERIENZA 2 Argentometria Le titolazioni argentometriche riguardano principalmente l analisi degli alogenuri. Il dosaggio di anioni (in particolare Cl - ) che formano con Ag + un sale poco solubile viene
ESPERIENZA 2 Argentometria Le titolazioni argentometriche riguardano principalmente l analisi degli alogenuri. Il dosaggio di anioni (in particolare Cl - ) che formano con Ag + un sale poco solubile viene
SCHEDA per l esperienza ACIDO-BASE
 SCHEDA per l esperienza ACIDO-BASE NaOH ca. 0.1 M Seconda fase: standardizz. con KHFt Massa pesata NaOH: g Dissoluzione: in ca. litri di acqua deionizzata bollita Prima titolazione: massa pesata di KHFt:
SCHEDA per l esperienza ACIDO-BASE NaOH ca. 0.1 M Seconda fase: standardizz. con KHFt Massa pesata NaOH: g Dissoluzione: in ca. litri di acqua deionizzata bollita Prima titolazione: massa pesata di KHFt:
A) Preparazione di una soluzione di Na 2 S 2 O N (0.1 M)
 UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2015/16 Laurea triennale in CHIMICA ANALITICA I E LABORATORIO CHIMICA INDUSTRIALE Preparazione e standardizzazione di una soluzione di Esercitazione n
UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2015/16 Laurea triennale in CHIMICA ANALITICA I E LABORATORIO CHIMICA INDUSTRIALE Preparazione e standardizzazione di una soluzione di Esercitazione n
Sostanze inorganiche: determinazioni qualitative
 Carbonati e Bicarbonati Indicare il tipo di sostanza basandosi sulle caratteristiche alla calcinazione e le prove di solubilità e il ph. Sodio carbonato anidro Na 2 CO 3 (F.U. X Edizione, European Pharmacopeia
Carbonati e Bicarbonati Indicare il tipo di sostanza basandosi sulle caratteristiche alla calcinazione e le prove di solubilità e il ph. Sodio carbonato anidro Na 2 CO 3 (F.U. X Edizione, European Pharmacopeia
1. Metodo di Mohr 2. Metodo di Volhard 3. Metodo di Fajans
 ARGENTOMETRIA I metodi argentometrici si basano sulla precipitazione di un sale d argento poco solubile. Come reattivo titolante si impiega una soluzione di AgNO 3. I principali metodi sono: 1. Metodo
ARGENTOMETRIA I metodi argentometrici si basano sulla precipitazione di un sale d argento poco solubile. Come reattivo titolante si impiega una soluzione di AgNO 3. I principali metodi sono: 1. Metodo
Metodo VII.1. Determinazione dello ione cloro in assenza di sostanza organica
 METODI VII METODI DI DETERMINAZIONE DEL CLORO Metodo VII.1 Determinazione dello ione cloro in assenza di sostanza organica 1. Oggetto Il presente documento stabilisce il procedimento da seguire per dosare
METODI VII METODI DI DETERMINAZIONE DEL CLORO Metodo VII.1 Determinazione dello ione cloro in assenza di sostanza organica 1. Oggetto Il presente documento stabilisce il procedimento da seguire per dosare
ESPERIENZA 3. Chelometrica
 ESPERIENZA 3 Chelometria I complessoni sono agenti leganti polidentati che formano chelati con i cationi nel rapporto stechiometrico 1:1 e possono quindi essere impiegati in numerose titolazioni. I complessoni
ESPERIENZA 3 Chelometria I complessoni sono agenti leganti polidentati che formano chelati con i cationi nel rapporto stechiometrico 1:1 e possono quindi essere impiegati in numerose titolazioni. I complessoni
PRIMA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida e Via Secca) Ricerca dei Cationi Calcio, Magnesio,
PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida e Via Secca) Ricerca dei Cationi Calcio, Magnesio,
A) Determinazione gravimetrica di manganese(ii) e di zinco(ii)
 UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2015/16 Laurea triennale in CHIMICA ANALITICA I E LABORATORIO CHIMICA INDUSTRIALE Determinazione della percentuale di manganese(ii) e Esercitazione n 15
UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2015/16 Laurea triennale in CHIMICA ANALITICA I E LABORATORIO CHIMICA INDUSTRIALE Determinazione della percentuale di manganese(ii) e Esercitazione n 15
Regolamento concernente la produzione e il commercio di sale da cucina iodurato, di sale iodato e di sale iodurato e iodato.
 D.M. 10 agosto 1995, n. 562. i Regolamento concernente la produzione e il commercio di sale da cucina iodurato, di sale iodato e di sale iodurato e iodato. (pubbl. in Gazz. Uff. n. 302 del 29 dicembre
D.M. 10 agosto 1995, n. 562. i Regolamento concernente la produzione e il commercio di sale da cucina iodurato, di sale iodato e di sale iodurato e iodato. (pubbl. in Gazz. Uff. n. 302 del 29 dicembre
+ NO 2 + 3H 2 O = Ce +3 + NO 3 + 2H 3 O +, b) 0.478 g
 1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
Titolazione acido debole (diprotico)
 Titolazione acido debole (diprotico) Calcolo ph spontaneo (acido debole da solo) H 2 O + H 2 O H 3 O + + OH - H 2 B + H 2 O HB - + H 3 O + HB - + H 2 O B 2- + H 3 O + 5 incognite 5 equazioni indipendenti
Titolazione acido debole (diprotico) Calcolo ph spontaneo (acido debole da solo) H 2 O + H 2 O H 3 O + + OH - H 2 B + H 2 O HB - + H 3 O + HB - + H 2 O B 2- + H 3 O + 5 incognite 5 equazioni indipendenti
CHIMICA ANALITICA II con LABORATORIO IL LABORATORIO
 CHIMICA ANALITICA II con LABORATORIO IL LABORATORIO Federico Marini Dept. Chemistry, University of Rome La Sapienza, Rome, Italy Assegnazione dei posti e presa in carico del corredo Assegnazione dei posti
CHIMICA ANALITICA II con LABORATORIO IL LABORATORIO Federico Marini Dept. Chemistry, University of Rome La Sapienza, Rome, Italy Assegnazione dei posti e presa in carico del corredo Assegnazione dei posti
GARA NAZIONALE DI CHIMICA XVI EDIZIONE. 5-6 Maggio 2017 CHIETI PROVA PRATICA
 GARA NAZIONALE DI CHIMICA XVI EDIZIONE 5-6 Maggio 2017 CHIETI PROVA PRATICA Pag. 1 REGOLAMENTO DELLA PROVA PRATICA Il punteggio massimo della prova pratica è così suddiviso: 1) 15.00 punti per la determinazione
GARA NAZIONALE DI CHIMICA XVI EDIZIONE 5-6 Maggio 2017 CHIETI PROVA PRATICA Pag. 1 REGOLAMENTO DELLA PROVA PRATICA Il punteggio massimo della prova pratica è così suddiviso: 1) 15.00 punti per la determinazione
PREPARAZIONE E STANDARDIZZAZIONE DI 2l di soluzione di KMnO4 0,025N fc
 1 TITOLO: PREPARAZIONE E STANDARDIZZAZIONE DI 2l di soluzione di KMnO4 0,025N fc METODO: STANDARDIZZAZIONE a) mediante sostanza madre FeSO4 7H20 b) mediante sostanza madre (COOH)2 2H20 b1) con metodo BRIGHT
1 TITOLO: PREPARAZIONE E STANDARDIZZAZIONE DI 2l di soluzione di KMnO4 0,025N fc METODO: STANDARDIZZAZIONE a) mediante sostanza madre FeSO4 7H20 b) mediante sostanza madre (COOH)2 2H20 b1) con metodo BRIGHT
Sostanze organiche: determinazioni qualitative
 Acido acetilsalicilico (European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (143 C) Aggiungere 4 ml di NaOH soluzione dil. a 0,2 gr della sostanza in esame e bollire per 3 minuti.
Acido acetilsalicilico (European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (143 C) Aggiungere 4 ml di NaOH soluzione dil. a 0,2 gr della sostanza in esame e bollire per 3 minuti.
PRIMA ESPERIENZA DI LABORATORIO. Prof. Antonio Lavecchia
 PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida) Ricerca dei Cationi Calcio, magnesio Ricerca degli
PRIMA ESPERIENZA DI LABORATORIO Prof. Antonio Lavecchia Prima Esperienza di Laboratorio Analisi Qualitativa Elementare di Sostanze Inorganiche (Via Umida) Ricerca dei Cationi Calcio, magnesio Ricerca degli
Metodo VI.1. Determinazione del potassio solubile in acqua
 METODI VI METODI DI DETERMINAZIONE DEL POTASSIO Metodo VI.1 Determinazione del potassio solubile in acqua 1. Oggetto Il presente documento stabilisce il procedimento da seguire per dosare il potassio
METODI VI METODI DI DETERMINAZIONE DEL POTASSIO Metodo VI.1 Determinazione del potassio solubile in acqua 1. Oggetto Il presente documento stabilisce il procedimento da seguire per dosare il potassio
Titolazioni Redox. Analisi volumetrica basata su una reazione di ossido-riduzione. La somma delle due coppie coniugate ossido-riduttive
 Titolazioni Redox Analisi volumetrica basata su una reazione di ossido-riduzione Ossidante (accettore di elettroni si riduce) Riducente (donatore di elettroni si ossida) ox 1 + ne - rid 1 rid 2 ox 2 +
Titolazioni Redox Analisi volumetrica basata su una reazione di ossido-riduzione Ossidante (accettore di elettroni si riduce) Riducente (donatore di elettroni si ossida) ox 1 + ne - rid 1 rid 2 ox 2 +
Esercitazione 1 PEROSSIDI IN OLIO D OLIVA
 Esercitazione 1 TITOLAZIONE ACIDO ACETICO IN ACETO E PEROSSIDI IN OLIO D OLIVA Acido acetico in aceto 2 L esperienza consiste nel misurare il grado di acidità di un aceto. L'aceto è una soluzione acquosa
Esercitazione 1 TITOLAZIONE ACIDO ACETICO IN ACETO E PEROSSIDI IN OLIO D OLIVA Acido acetico in aceto 2 L esperienza consiste nel misurare il grado di acidità di un aceto. L'aceto è una soluzione acquosa
PERMANGANOMETRIA GENERALITA :
 PERMANGANOMETRIA GENERALITA : Il permanganato di potassio è l'ossidante più usato nelle analisi volumetriche di ossidoriduzione. VANTAGGI: E' un ossidante forte e quindi sono molte le sostanze che possono
PERMANGANOMETRIA GENERALITA : Il permanganato di potassio è l'ossidante più usato nelle analisi volumetriche di ossidoriduzione. VANTAGGI: E' un ossidante forte e quindi sono molte le sostanze che possono
DETERMINAZIONE DUREZZA ACQUA
 DETERMINAZIONE DUREZZA ACQUA Le acque contengono disciolti un gran numero di sali e quindi sono presenti molti cationi metallici, tra cui quelli polivalenti che sono i responsabili della durezza. Contribuiscono
DETERMINAZIONE DUREZZA ACQUA Le acque contengono disciolti un gran numero di sali e quindi sono presenti molti cationi metallici, tra cui quelli polivalenti che sono i responsabili della durezza. Contribuiscono
A) Preparazione di una soluzione di NaOH 0.05 M
 UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2016/17 Laurea triennale in Preparazione e standardizzazione di una soluzione di Esercitazione n 2 NaOH 0.05 M. Determinazione della concentrazione di
UNIVERSITA DEGLI STUDI DI NAPOLI FEDERICO II A.A. 2016/17 Laurea triennale in Preparazione e standardizzazione di una soluzione di Esercitazione n 2 NaOH 0.05 M. Determinazione della concentrazione di
Metodi per stabilire il Punto di Equivalenza. Metodo Gay Lussac/Mulder: metodo del punto chiaro
 Metodi per stabilire il Punto di Equivalenza Metodo Gay Lussac/Mulder: metodo del punto chiaro Metodo preciso introdotto dall autore e corretto da Mulder. Consiste nell aggiungere il reattivo precipitante
Metodi per stabilire il Punto di Equivalenza Metodo Gay Lussac/Mulder: metodo del punto chiaro Metodo preciso introdotto dall autore e corretto da Mulder. Consiste nell aggiungere il reattivo precipitante
Fe(OH) 3. Mn(OH) 2 2H 2 O
 III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
III Gruppo: Comprende quei cationi che precipitano selettivamente come idrossidi insolubili a ph = 9 (esclusi quelli del I e II Gruppo). Il reattivo precipitante è NH 4 OH/NH 4 Cl (soluzione tampone a
Sostanze organiche: determinazioni qualitative
 Fenolo ((European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (41-42 C) Identificazione A. REAZIONE con acqua di Bromo. N.B. Si lavora sotto cappa! Aggiungere a 1 ml della soluzione
Fenolo ((European Pharmacopoeia IV th, F.U. X edizione) Determinare il punto di fusione (41-42 C) Identificazione A. REAZIONE con acqua di Bromo. N.B. Si lavora sotto cappa! Aggiungere a 1 ml della soluzione
1)Calcolare il ph di una soluzione che contenga al9%(w/w)naoh ed abbia una densità pari a 1.098g/ml.
 Compito di Analisi dei farmaci I Bari,3 febbraio 1999 1)Calcolare il ph di una soluzione che contenga al9%(w/w)naoh ed abbia una densità pari a 1.098g/ml. 1)Quale deve essere la sensibilità della bilancia
Compito di Analisi dei farmaci I Bari,3 febbraio 1999 1)Calcolare il ph di una soluzione che contenga al9%(w/w)naoh ed abbia una densità pari a 1.098g/ml. 1)Quale deve essere la sensibilità della bilancia
Compito di analisi dei farmaci I. Bari,9 settembre 1998
 Compito di analisi dei farmaci I Bari,9 settembre 1998 1) L acido formico in una soluzione 0.1 M è dissociato per il 4.6%.50 ml di questa soluzione si diluiscono a 250 ml con acqua e si titolano con NaOH
Compito di analisi dei farmaci I Bari,9 settembre 1998 1) L acido formico in una soluzione 0.1 M è dissociato per il 4.6%.50 ml di questa soluzione si diluiscono a 250 ml con acqua e si titolano con NaOH
2.1 Iodimetria-iodometria
 .1 Iodimetria-iodometria Sono metodi analitici basati su reazioni di ossidoriduzione in cui una delle due coppie redox è I / I - Equazione della semireazione di riduzione dello iodio I + e - I - E = 0,535
.1 Iodimetria-iodometria Sono metodi analitici basati su reazioni di ossidoriduzione in cui una delle due coppie redox è I / I - Equazione della semireazione di riduzione dello iodio I + e - I - E = 0,535
P ARAMETRI FISICI, CHIMICI E CHIMICO-FISICI PARAMETRI FISICI, CHIMICI E CHIMICO-FISICI
 2000 - PARAMETRI FISICI, CHIMICI E CHIMICO-FISICI Questa parte prevede in primo luogo misure di parametri caratteristici delle proprietà fisiche, chimiche e chimico-fisiche di un campione. Alcune di queste
2000 - PARAMETRI FISICI, CHIMICI E CHIMICO-FISICI Questa parte prevede in primo luogo misure di parametri caratteristici delle proprietà fisiche, chimiche e chimico-fisiche di un campione. Alcune di queste
Preparazione di soluzioni a titolo approssimato e a titolo noto
 Esperienza n. 1 Laboratorio di Chimica Generale Preparazione di soluzioni a titolo approssimato e a titolo noto OBBIETTIVI Lo scopo di questa esperienza è quello di preparare una soluzione a concentrazione
Esperienza n. 1 Laboratorio di Chimica Generale Preparazione di soluzioni a titolo approssimato e a titolo noto OBBIETTIVI Lo scopo di questa esperienza è quello di preparare una soluzione a concentrazione
ESERCITAZIONI ) Standardizzazione di una soluzione di HCl mediante Na 2 CO 3 2) Dosaggio dei carbonati mediante titolazione con HCl
 ESERCITAZIONI 4+5 1) Standardizzazione di una soluzione di HCl mediante Na 2 2) Dosaggio dei carbonati mediante titolazione con HCl Viene eseguita in primo luogo la standardizzazione di una soluzione di
ESERCITAZIONI 4+5 1) Standardizzazione di una soluzione di HCl mediante Na 2 2) Dosaggio dei carbonati mediante titolazione con HCl Viene eseguita in primo luogo la standardizzazione di una soluzione di
CORSO DI LAUREA IN BIOLOGIA ECOLOGICA. Esercitazioni di Laboratorio di Chimica Generale ed Inorganica
 CORSO DI LAUREA IN BIOLOGIA ECOLOGICA Esercitazioni di Laboratorio di Chimica Generale ed Inorganica Anno Accademico 2002-2003 1 ESERCITAZIONE Titolazione di una soluzione di HCl con una soluzione di NaOH
CORSO DI LAUREA IN BIOLOGIA ECOLOGICA Esercitazioni di Laboratorio di Chimica Generale ed Inorganica Anno Accademico 2002-2003 1 ESERCITAZIONE Titolazione di una soluzione di HCl con una soluzione di NaOH
RICONOSCIMENTO degli ELEMENTI PRESENTI in un CAMPIONE INCOGNITO
 RICONOSCIMENTO degli ELEMENTI PRESENTI in un CAMPIONE INCOGNITO OBIETTIVO: individuare gli elementi presenti in un campione solido inorganico di composizione incognita. Approccio al problema: l analisi
RICONOSCIMENTO degli ELEMENTI PRESENTI in un CAMPIONE INCOGNITO OBIETTIVO: individuare gli elementi presenti in un campione solido inorganico di composizione incognita. Approccio al problema: l analisi
CORSO DI LAUREA IN FARMACIA. DISPENSE DI LABORATORIO DEL CORSO DI ANALISI DEI MEDICINALI I A.A. 2013/2014 Prof.ssa ERIKA DEL GROSSO
 CORSO DI LAUREA IN FARMACIA DISPENSE DI LABORATORIO DEL CORSO DI ANALISI DEI MEDICINALI I A.A. 2013/2014 Prof.ssa ERIKA DEL GROSSO ANNOTAZIONI GENERALI: OGNI STUDENTE DEVE AVERE UN PROPRIO QUADERNO DI
CORSO DI LAUREA IN FARMACIA DISPENSE DI LABORATORIO DEL CORSO DI ANALISI DEI MEDICINALI I A.A. 2013/2014 Prof.ssa ERIKA DEL GROSSO ANNOTAZIONI GENERALI: OGNI STUDENTE DEVE AVERE UN PROPRIO QUADERNO DI
1 Durezza totale dell acqua
 1 Durezza totale dell acqua Materiale occorrente: una pipetta a una tacca da 100 ml; una buretta di Schellbach; una beuta. Reattivi: soluzione titolata di EDTA sale disodico 0,0100 M; indicatore nero eriocromo
1 Durezza totale dell acqua Materiale occorrente: una pipetta a una tacca da 100 ml; una buretta di Schellbach; una beuta. Reattivi: soluzione titolata di EDTA sale disodico 0,0100 M; indicatore nero eriocromo
Determinazione del Cu in pigmenti
 FACOLTÁ DI SCEINZE E TECNOLOGIE Determinazione del Cu in pigmenti I. Rossetti, G. Cappelletti, C. Crippa Introduzione I pigmenti a base di rame sono stati utilizzati fin dall antichità per impartire una
FACOLTÁ DI SCEINZE E TECNOLOGIE Determinazione del Cu in pigmenti I. Rossetti, G. Cappelletti, C. Crippa Introduzione I pigmenti a base di rame sono stati utilizzati fin dall antichità per impartire una
Titolazioni di Precipitazione
 Titolazioni di Precipitazione Le titolazioni di precipitazione si basano su reazioni che generano composti poco solubili L agente titolante è anche detto agente precipitante La velocità di formazione di
Titolazioni di Precipitazione Le titolazioni di precipitazione si basano su reazioni che generano composti poco solubili L agente titolante è anche detto agente precipitante La velocità di formazione di
LABORATORIO DI CHIMICA
 LABORATORIO DI CHIMICA Presentazione 3 a ESPERIENZA Titolazione Acido-Base ANALISI VOLUMETRICA Tipi di titolazioni Esistono diversi tipi di titolazione, classificati in funzione della reazione su cui si
LABORATORIO DI CHIMICA Presentazione 3 a ESPERIENZA Titolazione Acido-Base ANALISI VOLUMETRICA Tipi di titolazioni Esistono diversi tipi di titolazione, classificati in funzione della reazione su cui si
LABORATORIO DI CHIMICA ANALITICA I ESERCITAZIONI AA
 LABORATORIO DI CHIMICA ANALITICA I ESERCITAZIONI 1-2-3-4-5 AA 2016-2017 ph Esercitazione 1: TITOLO DEL HCl CON CARBONATO SODICO Introduzione CO 3 2- + 2H + = H 2 O + CO 2 Carbonato 0,1 M + HCl 0,1000 M
LABORATORIO DI CHIMICA ANALITICA I ESERCITAZIONI 1-2-3-4-5 AA 2016-2017 ph Esercitazione 1: TITOLO DEL HCl CON CARBONATO SODICO Introduzione CO 3 2- + 2H + = H 2 O + CO 2 Carbonato 0,1 M + HCl 0,1000 M
Classe 5 ch B a.s.2007/08 ANALISI DELLA BIRRA
 ANALISI DELLA BIRRA DETRMINAZIONE DELL ACIDITÀ L acidità della birra è dovuta in parte ad acidi organici vari (specialmente lattico), in parte a fosfati acidi, e, specialmente nelle birre mal conservate,
ANALISI DELLA BIRRA DETRMINAZIONE DELL ACIDITÀ L acidità della birra è dovuta in parte ad acidi organici vari (specialmente lattico), in parte a fosfati acidi, e, specialmente nelle birre mal conservate,
ANALISI CHIMICO FARMACEUTICA I. Impieghi di acidimetria e alcalimetria nella EUROPEAN PHARMACOPOEIA 6.0
 Impieghi di acidimetria e alcalimetria nella EUROPEAN PHARMACOPOEIA 6.0 SODIO CARBONATO ANIDRO SODIUM CARBONATE, ANHYDROUS Natrii carbonas anhydricus DETERMINAZIONE QUANTITATIVA Disciogliere 1,000 g in
Impieghi di acidimetria e alcalimetria nella EUROPEAN PHARMACOPOEIA 6.0 SODIO CARBONATO ANIDRO SODIUM CARBONATE, ANHYDROUS Natrii carbonas anhydricus DETERMINAZIONE QUANTITATIVA Disciogliere 1,000 g in
RICERCA RICERCA DEGLI ANIONI
 RICERCA DEGLI ANIONI 1 SOSTANZA INIZIALE Na 2 CO 3 Ricerca: ACETATI SOLFITI CARBONATI TARTRATI SOLUZIONE ALCALINA Limpida Incolore RESIDUO Si scarta Ricerca: SOLFATI OSSALATI ARSENIATI NITRITI NITRATI
RICERCA DEGLI ANIONI 1 SOSTANZA INIZIALE Na 2 CO 3 Ricerca: ACETATI SOLFITI CARBONATI TARTRATI SOLUZIONE ALCALINA Limpida Incolore RESIDUO Si scarta Ricerca: SOLFATI OSSALATI ARSENIATI NITRITI NITRATI
XVII ZOLFO. Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE. Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI
 XVII ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI XVII - ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE 1. Principio Il campione viene
XVII ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI XVII - ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE 1. Principio Il campione viene
Sintesi verde malachite
 Sintesi verde malachite Prima di eseguire qualsiasi esperimento proposto è opportuno verificare che tutte le buone abitudini di sicurezza vengano applicate e rispettate. Prestare attenzione ai pittogrammi
Sintesi verde malachite Prima di eseguire qualsiasi esperimento proposto è opportuno verificare che tutte le buone abitudini di sicurezza vengano applicate e rispettate. Prestare attenzione ai pittogrammi
Acido 3,5-dinitrosalicilico Glucosio Acido 3-amino-5-nitrosalicilico Acido gluconico (Incolore-giallo leggero)
 1 Determinazione di zuccheri riducenti e di amido in banana in relazione alle condizioni di conservazione (Corso di Fisiologia della produzione e della post-raccolta) In banana durante il processo di maturazione
1 Determinazione di zuccheri riducenti e di amido in banana in relazione alle condizioni di conservazione (Corso di Fisiologia della produzione e della post-raccolta) In banana durante il processo di maturazione
Università degli Studi di Torino CORSO DI CHIMICA GENERALE ED INORGANICA C. Schede di valutazione relative alle esercitazioni pratiche in laboratorio
 Università degli Studi di Torino CORSO DI CHIMICA GENERALE ED INORGANICA C Schede di valutazione relative alle esercitazioni pratiche in laboratorio Anno accademico 2006-2007 Dott.ssa Elena Ghibaudi Dott.
Università degli Studi di Torino CORSO DI CHIMICA GENERALE ED INORGANICA C Schede di valutazione relative alle esercitazioni pratiche in laboratorio Anno accademico 2006-2007 Dott.ssa Elena Ghibaudi Dott.
ESERCITAZIONI. 1) Standardizzazione di una soluzione di HCl mediante Na 2 CO 3 2) Dosaggio dei carbonati mediante titolazione con HCl
 ESERCITAZIONI 1) Standardizzazione di una soluzione di HCl mediante Na 2 2) Dosaggio dei carbonati mediante titolazione con HCl Viene eseguita in primo luogo la standardizzazione di una soluzione di HCl
ESERCITAZIONI 1) Standardizzazione di una soluzione di HCl mediante Na 2 2) Dosaggio dei carbonati mediante titolazione con HCl Viene eseguita in primo luogo la standardizzazione di una soluzione di HCl
Esercitazione 6. Chimica biologica del Fe. Il Ferro ) 2 (SO 4 6H 2. Fe(NH 4
 Esercitazione Preparazione del sale di Mohr Fe(NH 4 ) 2 (SO 4 ) 2 H 2 O Chimica biologica del Fe In un uomo di 75 kg sono presenti 4 g di Fe Nei Paesi occidentali ne assumiamo 15 mg/d Il Ferro Configurazione
Esercitazione Preparazione del sale di Mohr Fe(NH 4 ) 2 (SO 4 ) 2 H 2 O Chimica biologica del Fe In un uomo di 75 kg sono presenti 4 g di Fe Nei Paesi occidentali ne assumiamo 15 mg/d Il Ferro Configurazione
Prima esperienza di Laboratorio. Alcune reazioni del rame
 Prima esperienza di Laboratorio Alcune reazioni del rame Prelevare 20 cm 3 di soluzione di solfato di rame pentaidrato (CuSO 4 5H 2 O) e versarli in una provetta Da questa riserva di rame, preleverete
Prima esperienza di Laboratorio Alcune reazioni del rame Prelevare 20 cm 3 di soluzione di solfato di rame pentaidrato (CuSO 4 5H 2 O) e versarli in una provetta Da questa riserva di rame, preleverete
Regolamento della Gara Nazionale di Chimica per gli Istituti Tecnici. Regolamento della prova pratica
 Regolamento della Gara Nazionale di Chimica per gli Istituti Tecnici La Gara è costituita da: una prova scritta multidisciplinare con domande a risposta multipla inerenti i programmi delle materie di indirizzo
Regolamento della Gara Nazionale di Chimica per gli Istituti Tecnici La Gara è costituita da: una prova scritta multidisciplinare con domande a risposta multipla inerenti i programmi delle materie di indirizzo
3016 Ossidazione dell acido ricinoleico (dall olio di ricino) con permanganato di potassio per formare acido azelaico
 6 Ossidazione dell acido ricinoleico (dall olio di ricino) con permanganato di potassio per formare acido azelaico CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.)
6 Ossidazione dell acido ricinoleico (dall olio di ricino) con permanganato di potassio per formare acido azelaico CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.)
TITOLAZIONE DI PRECIPITAZIONE
 TITOLAZIONE DI PRECIPITAZIONE Nelle titolazioni di precipitazione si ha la formazione di un sale poco solubile. Il K ps sostituisce il K w dell acqua ed il pme o il px sostituiscono rispettivamente il
TITOLAZIONE DI PRECIPITAZIONE Nelle titolazioni di precipitazione si ha la formazione di un sale poco solubile. Il K ps sostituisce il K w dell acqua ed il pme o il px sostituiscono rispettivamente il
Esperienza n. 3. Analisi di una miscela di NaHCO 3 e Na 2 CO 3
 Esperienza n. 3 Laboratorio di Chimica Analisi di una miscela di NaHCO 3 e Na 2 CO 3 OBBIETTIVI Lo scopo di questa esperienza è quello di risalire alla composizione percentuale di una miscela di carbonato
Esperienza n. 3 Laboratorio di Chimica Analisi di una miscela di NaHCO 3 e Na 2 CO 3 OBBIETTIVI Lo scopo di questa esperienza è quello di risalire alla composizione percentuale di una miscela di carbonato
Bari,7 luglio 1999 Compito di Analisi dei Farmaci I
 Bari,7 luglio 1999 Compito di Analisi dei Farmaci I Quale quantità di potassio bromato dovrà essere pesata per liberare una quantità di iodio che reagisca con 30 ml di sodio tiosolfato, del quale 42.56
Bari,7 luglio 1999 Compito di Analisi dei Farmaci I Quale quantità di potassio bromato dovrà essere pesata per liberare una quantità di iodio che reagisca con 30 ml di sodio tiosolfato, del quale 42.56
CORSO DI LABORATORIO DI CHIMICA Corso di Laurea triennale in Chimica Industriale
 CORSO DI LABORATORIO DI CHIMICA Corso di Laurea triennale in Chimica Industriale ESERCITAZIONE N 4 bis Stati di ossidazione del manganese Il manganese è un tipico elemento di transizione del blocco d.
CORSO DI LABORATORIO DI CHIMICA Corso di Laurea triennale in Chimica Industriale ESERCITAZIONE N 4 bis Stati di ossidazione del manganese Il manganese è un tipico elemento di transizione del blocco d.
ALOGENURI (Cl -, Br -, I - ) 1
 ALOGENURI (Cl -, Br -, I - ) 1 Cloruri, bromuri e ioduri di tutti i metalli, eccetto quelli di Pb +,Ag + e Hg + (I), sono solubili in H O. Cloruri, bromuri e ioduri di Pb +,Ag + e Hg + (I) sono inoltre
ALOGENURI (Cl -, Br -, I - ) 1 Cloruri, bromuri e ioduri di tutti i metalli, eccetto quelli di Pb +,Ag + e Hg + (I), sono solubili in H O. Cloruri, bromuri e ioduri di Pb +,Ag + e Hg + (I) sono inoltre
H N. Mn 2+ +.. Fe 3+ +.. H 2 O
 CHIMICA ANALITICA- PROVA SCRITTA 3 FEBBRAIO 2005-1a. Quanti microlitri di 1-nonene (densità 1-nonene = 0.73 g/ml) bisogna prelevare per preparare 50 ml di soluzione di concentrazione 1000 ppm in metanolo
CHIMICA ANALITICA- PROVA SCRITTA 3 FEBBRAIO 2005-1a. Quanti microlitri di 1-nonene (densità 1-nonene = 0.73 g/ml) bisogna prelevare per preparare 50 ml di soluzione di concentrazione 1000 ppm in metanolo
Determinazione di zuccheri riducenti e di amido in banana in relazione alle condizioni di conservazione
 1 Determinazione di zuccheri riducenti e di amido in banana in relazione alle condizioni di conservazione In banana durante il processo di maturazione avviene la trasformazione di amido in zuccheri riducenti
1 Determinazione di zuccheri riducenti e di amido in banana in relazione alle condizioni di conservazione In banana durante il processo di maturazione avviene la trasformazione di amido in zuccheri riducenti
Esperienza n. 5 Preparazione di (NH 4 ) 2 [Cu(C 2 O 4 ) 2 ] 2H 2 O
![Esperienza n. 5 Preparazione di (NH 4 ) 2 [Cu(C 2 O 4 ) 2 ] 2H 2 O Esperienza n. 5 Preparazione di (NH 4 ) 2 [Cu(C 2 O 4 ) 2 ] 2H 2 O](/thumbs/73/68788801.jpg) Esperienza n. 5 Preparazione di (NH ) 2 [Cu(C 2 O ) 2 ] 2H 2 O OBBIETTIVI Lo scopo di questa esperienza è quello di preparare il sale complesso (NH)2[Cu(C2O)2] 2H2O. INTRODUZIONE Il (NH)2[Cu(C2O)2] 2H2O
Esperienza n. 5 Preparazione di (NH ) 2 [Cu(C 2 O ) 2 ] 2H 2 O OBBIETTIVI Lo scopo di questa esperienza è quello di preparare il sale complesso (NH)2[Cu(C2O)2] 2H2O. INTRODUZIONE Il (NH)2[Cu(C2O)2] 2H2O
ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA ] / [H 2 PO 4- ] HPO 4
![ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA ] / [H 2 PO 4- ] HPO 4 ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA ] / [H 2 PO 4- ] HPO 4](/thumbs/55/35880910.jpg) ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA Si titola con NaOH. H 3 PO 4 H + + H 2 PO 4 - K a1 = 1.1 x 10-2 = [H + ] [H 2 PO 4- ] / [H 3 PO 4 ] H 2 PO 4- H + + HPO 4 2- K a2 = 7.5
ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA Si titola con NaOH. H 3 PO 4 H + + H 2 PO 4 - K a1 = 1.1 x 10-2 = [H + ] [H 2 PO 4- ] / [H 3 PO 4 ] H 2 PO 4- H + + HPO 4 2- K a2 = 7.5
TITOLAZIONI TITOLAZIONI ACIDO-BASE
 TITOLAZIONI TITOLAZIONI ACIDO-BASE titolazione nella quale sono coinvolti un acido e una base. La reazione generica è la seguente: Ac1 + Bas2 Ac2 + Bas1 con produzione della base e dell acido coniugato.
TITOLAZIONI TITOLAZIONI ACIDO-BASE titolazione nella quale sono coinvolti un acido e una base. La reazione generica è la seguente: Ac1 + Bas2 Ac2 + Bas1 con produzione della base e dell acido coniugato.
Preparazione di Potassio triossalatoferrato triidrato
 Potassio triossalatoferrato triidrato Preparare l ossalato di bario: preparare una soluzione sciogliendo in acqua 5,0 gr di cloruro di bario biidrato e una soluzione sciogliendo 2,93 gr di ossalato di
Potassio triossalatoferrato triidrato Preparare l ossalato di bario: preparare una soluzione sciogliendo in acqua 5,0 gr di cloruro di bario biidrato e una soluzione sciogliendo 2,93 gr di ossalato di
LABORATORIO ANALISI DEI FARMACI 1 A.A. 2013/2014
 CORSO DI LAUREA IN CTF LABORATORIO ANALISI DEI FARMACI 1 A.A. 2013/2014 PROF.ssa GIANNA ALLEGRONE Ogni studente dovrà descrivere sul proprio quaderno di laboratorio le esperienze non appena vengono eseguite
CORSO DI LAUREA IN CTF LABORATORIO ANALISI DEI FARMACI 1 A.A. 2013/2014 PROF.ssa GIANNA ALLEGRONE Ogni studente dovrà descrivere sul proprio quaderno di laboratorio le esperienze non appena vengono eseguite
Determinazione percentuale di CaCO3 in un guscio d uovo.
 Determinazione percentuale di CaCO3 in un guscio d uovo. Il CaCO3 presente nel guscio d uovo reagisce con l acido cloridrico secondo la seguente reazione chimica: CaCO3 + 2HCl CaCl2 + H2CO3 Carbonato di
Determinazione percentuale di CaCO3 in un guscio d uovo. Il CaCO3 presente nel guscio d uovo reagisce con l acido cloridrico secondo la seguente reazione chimica: CaCO3 + 2HCl CaCl2 + H2CO3 Carbonato di
ESERCIZI SU. le soluzioni e la loro composizione
 ESERCIZI SU le soluzioni e la loro composizione martedì 15 dicembre 2015 Composizione delle soluzioni definita da grandezze di primario interesse fisico Composizione percentuale in massa % di A = (m A
ESERCIZI SU le soluzioni e la loro composizione martedì 15 dicembre 2015 Composizione delle soluzioni definita da grandezze di primario interesse fisico Composizione percentuale in massa % di A = (m A
Sintesi di due pigmenti inorganici
 Sintesi di due pigmenti inorganici Contenuti 1. Introduzione 2. Materiali 3. Condizioni operative Introduzione Pigmenti, definizione: Sostanza colorata insolubile di origine naturale e artificiale usata
Sintesi di due pigmenti inorganici Contenuti 1. Introduzione 2. Materiali 3. Condizioni operative Introduzione Pigmenti, definizione: Sostanza colorata insolubile di origine naturale e artificiale usata
PROVA PRATICA GARA NAZIONALE DI CHIMICA
 Via Luosi n. 23 41124 Modena Tel: 059211092 059236398 Fax: 059226478 E-mail: [email protected] Pagina web: www.fermi.mo.it GARA NAZIONALE DI CHIMICA XII EDIZIONE ISTITUTI TECNICI INDUSTRIALI INDIRIZZO CHIMICO
Via Luosi n. 23 41124 Modena Tel: 059211092 059236398 Fax: 059226478 E-mail: [email protected] Pagina web: www.fermi.mo.it GARA NAZIONALE DI CHIMICA XII EDIZIONE ISTITUTI TECNICI INDUSTRIALI INDIRIZZO CHIMICO
COSTITUENTI INORGANICI NON METALLICI
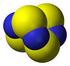 4140. Solfato I solfati presenti in natura derivano in larga misura dalla trasformazione dei solfuri naturali. Si ritrovano prevalentemente nei sedimenti evaporitici come gesso (Ca 2H 2 O) o anidride (Ca
4140. Solfato I solfati presenti in natura derivano in larga misura dalla trasformazione dei solfuri naturali. Si ritrovano prevalentemente nei sedimenti evaporitici come gesso (Ca 2H 2 O) o anidride (Ca
3011 Sintesi dell acido eritro-9,10-diidrossistearico dall acido oleico
 311 Sintesi dell acido eritro-9,1-diidrossistearico dall acido oleico COOH KMnO 4 HO COOH NaOH HO C 18 H 34 O 2 (282.5) KMnO 4 (158.) NaOH (4.) C 18 H 36 O 4 (316.5) Riferimento in letteratura: Lapworth,
311 Sintesi dell acido eritro-9,1-diidrossistearico dall acido oleico COOH KMnO 4 HO COOH NaOH HO C 18 H 34 O 2 (282.5) KMnO 4 (158.) NaOH (4.) C 18 H 36 O 4 (316.5) Riferimento in letteratura: Lapworth,
Gazzetta ufficiale dell'unione europea REGOLAMENTI
 8.10.2016 L 273/5 REGOLAMENTI REGOLAMENTO DI ESECUZIONE (UE) 2016/1784 DELLA COMMISSIONE del 30 settembre 2016 recante modifica del regolamento (CEE) n. 2568/91 relativo alle caratteristiche degli oli
8.10.2016 L 273/5 REGOLAMENTI REGOLAMENTO DI ESECUZIONE (UE) 2016/1784 DELLA COMMISSIONE del 30 settembre 2016 recante modifica del regolamento (CEE) n. 2568/91 relativo alle caratteristiche degli oli
COSTITUENTI INORGANICI NON METALLICI
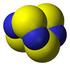 4090. Cloruro Numerosi cloruri si trovano in natura come minerali, fra questi i più abbondanti sono: salgemma e sale marino (NaCl), silvite (KCl), carnallite (KMgCl 3 6H 2 O). Lo ione cloruro costituisce
4090. Cloruro Numerosi cloruri si trovano in natura come minerali, fra questi i più abbondanti sono: salgemma e sale marino (NaCl), silvite (KCl), carnallite (KMgCl 3 6H 2 O). Lo ione cloruro costituisce
Rapporto tra soluto e solvente o soluzione
 Rapporto tra soluto e solvente o soluzione Dissoluzione delle sostanze Concentrazione espressa in unità chimiche : Molarità Frazione molare Concentrazione espressa in unità fisiche : Percentuale in
Rapporto tra soluto e solvente o soluzione Dissoluzione delle sostanze Concentrazione espressa in unità chimiche : Molarità Frazione molare Concentrazione espressa in unità fisiche : Percentuale in
M di acido formico (Ka =
 14 gennaio 2002 1. Calcolare quanti microlitri di soluzione 0.001 M di Pb 2+ (PA 207) devono essere prelevati per preparare una soluzione di concentrazione pari a 10 ppm e volume 50 ml. 2. Calcolare la
14 gennaio 2002 1. Calcolare quanti microlitri di soluzione 0.001 M di Pb 2+ (PA 207) devono essere prelevati per preparare una soluzione di concentrazione pari a 10 ppm e volume 50 ml. 2. Calcolare la
I.T.I.S. E. FERMI _ MODENA
 I.T.I.S. E. FERMI _ MODENA Programma svolto del corso di Analisi Chimica, Elab. Dati e Laboratorio Classe 3^C a.s. 2011-12 Docenti: Giorgia Messori, Claudia Tacconi I l libro di testo utilizzato è stato
I.T.I.S. E. FERMI _ MODENA Programma svolto del corso di Analisi Chimica, Elab. Dati e Laboratorio Classe 3^C a.s. 2011-12 Docenti: Giorgia Messori, Claudia Tacconi I l libro di testo utilizzato è stato
Sintesi dell acetanilide
 Sintesi dell acetanilide N 2 Cl N + + C 3 benzenammina anidride etanoica N - fenilacetammide acido etanoico (anilina) (anidride acetica) (acetanilide) (acido acetico) d = 1,02 g/ml d = 1,08 g/ml PM = 135
Sintesi dell acetanilide N 2 Cl N + + C 3 benzenammina anidride etanoica N - fenilacetammide acido etanoico (anilina) (anidride acetica) (acetanilide) (acido acetico) d = 1,02 g/ml d = 1,08 g/ml PM = 135
Analisi di farmaci inorganici XI esercitazione di laboratorio
 Analisi di farmaci inorganici XI esercitazione di laboratorio Iodosan Goccemed Principio attivo: Tipo prodotto: Gruppo merceologico: Impiego terapeutico: Forma farmaceutica: I2 (iodio elementare). parafarmaco
Analisi di farmaci inorganici XI esercitazione di laboratorio Iodosan Goccemed Principio attivo: Tipo prodotto: Gruppo merceologico: Impiego terapeutico: Forma farmaceutica: I2 (iodio elementare). parafarmaco
APPLICAZIONE DI RIDUCENTI IN VOLUMETRICA
 APPLICAZIONE DI RIDUCENTI IN VOLUMETRICA Le sostanze riducenti reagiscono con l O 2 dell aria, per questo motivo è meglio conservarle in atmosfera inerte. Metodo: agente riducente non standardizzato +
APPLICAZIONE DI RIDUCENTI IN VOLUMETRICA Le sostanze riducenti reagiscono con l O 2 dell aria, per questo motivo è meglio conservarle in atmosfera inerte. Metodo: agente riducente non standardizzato +
COMPITO DI ANALISI DEI FARMACI I BARI,14 GIUGNO 1999
 COMPITO DI ANALISI DEI FARMACI I BARI,14 GIUGNO 1999 1)Un campione da 24.7 L di aria estratta nelle vicinanze di un forno è stato passato su pentossido di iodio a 150 C dove CO è stato trasformato in CO
COMPITO DI ANALISI DEI FARMACI I BARI,14 GIUGNO 1999 1)Un campione da 24.7 L di aria estratta nelle vicinanze di un forno è stato passato su pentossido di iodio a 150 C dove CO è stato trasformato in CO
Analisi chimica dei materiali ferrosi Determinazione del nichel negli acciai e nelle ghise Metodo gravimetrico o volumetrico
 CD.: 543.21: 546.74: 669.13/.14 543.24: 546.74: 669.13/.14 Marzo 1982 Analisi chimica dei materiali ferrosi Determinazione del nichel negli acciai e nelle ghise Metodo gravimetrico o volumetrico EURONORM
CD.: 543.21: 546.74: 669.13/.14 543.24: 546.74: 669.13/.14 Marzo 1982 Analisi chimica dei materiali ferrosi Determinazione del nichel negli acciai e nelle ghise Metodo gravimetrico o volumetrico EURONORM
