Il trasporto dell ossigeno
|
|
|
- Olimpia Lamberti
- 7 anni fa
- Visualizzazioni
Transcript
1 Prof. Giorgio Sartor Il trasporto dell ossigeno Copyright by Giorgio Sartor. All rights reserved. Versione mar 2016 Trasporto dell ossigeno egli organismi aerobi il trasporto dell ossigeno avviene ad opera di PIGMETI RESPIRATORI Proteine coniugate con metalli che legano O 2, lo trasportano attraverso i fluidi, lo convogliano nei tessuti dove viene rilasciato ed utilizzato. V gsartor Il trasporto dell ossigeno - 2-1
2 I pigmenti respiratori Pigmento Colore Struttura Sito per O 2 Localizzazione Mioglobina (Mb) - Proteina Eme Fe ++ 1O 2 /1Fe ++ Muscolo Emoglobina (Hb) Rosso Proteina Eme Fe ++ 1O 2 /1Fe ++ Globuli rossi Soluzione Clorocruorina (Ch) Verde Proteina Eme Fe ++ 1O 2 /1Fe ++ Soluzione Emeritrina (Hr) Violetto Incolore Proteina Fe ++ 1O 2 /2Fe ++ Soluzione (Globuli rossi) Emocianina (Hc) Blu Incolore Proteina Cu ++ 1O 2 /2Cu ++ Soluzione V gsartor Il trasporto dell ossigeno I pigmenti respiratori Pigmento Mioglobina (Mb) Emoglobina (Hb) Clorocruorina (Ch) Emeritrina (Hr) Emocianina (Hc) V gsartor Il trasporto dell ossigeno - 4-2
3 I pigmenti respiratori Pigmento Mioglobina (Mb) Emoglobina (Hb) Clorocruorina (Ch) Emeritrina (Hr) Emocianina (Hc) V gsartor Il trasporto dell ossigeno Proteine multimeriche I pigmenti respiratori dedicati al trasporto dell ossigeno sono formati da più subunità: Mioglobina, immagazzina O 2, una subunità Emoglobina, trasporta O 2, da 2 a 10 subunità a secondo dell organismo Emocianina, trasporta O 2, da 1 6 subunità a 8 6 subunità a secondo dell organismo La presenza di più subunità rende il legame dell O 2 cooperativo permettendone un trasporto efficiente. V gsartor Il trasporto dell ossigeno - 6-3
4 Aria Perché i pigmenti respiratori Volume occupato da 1 mole di gas: 22.4 L (STP) Contenuto di gas in 1 litro di aria: 1/22.4 = moli = 45 mmoli Solo 21% dei gas dell aria è O 2, quindi 45 21/100 = 9.5 mmoli Acqua o plasma Solubilità di O 2 in acqua (α): 1.4 x 10-6 moli L -1 mmhg -1 (a 37 C) [O 2 ] = α x PO 2 = 1.4 x 10-6 x 150 = moli o 0.21 mmoli Emoglobina (160 g/l, globuli rossi concentrati) PM = 16,000 [Hb ]= 160/16,000 = 10 mm Sangue (50% plasma + 50% globuli rossi) Plasma: [O 2 ] = 0.21 mm Emoglobina: [O 2 ] = 10 mm Sangue: [O 2 ] = ( ) + (10 0.5) = = mmoli (2% + 98%) 98% dell O 2 del sangue è legato a Hb, 2% è disciolto nel plasma. V gsartor Il trasporto dell ossigeno Cellule specializzate Globuli rossi Prive di nucleo Alto contenuto in Hb Previene l effetto osmotico V gsartor Il trasporto dell ossigeno - 8-4
5 Legame con l ossigeno Dipende da po 2 Alta po 2 PR + O 2 PR-O 2 O SATURATO Bassa po 2 SATURATO V gsartor Il trasporto dell ossigeno Legame con l ossigeno Dipende da po 2 V gsartor Il trasporto dell ossigeno
6 Mioglobina ed Emoglobina Le funzioni biologiche delle due proteine sono diverse: Mioglobina: lega strettamente l O 2 e lo rende disponibile SOLO quando la po 2 èmolto bassa (muscolo, cetacei in immersione). Emoglobina: lega l O 2 quando la po 2 è alta (polmoni, branchie) rilascia l O 2 quando la po 2 è bassa (tessuti, cellule). La struttura delle due proteine è diversa: Mioglobina: monomero con gruppo prostetico (eme) che complessa uno ione Fe 2+. Emoglobina: tetramero (nei mammiferi) fatto di subunità (α 2 β 2 ) ognuna delle quali è simile alla mioglobina e contiene un gruppo prostetico (eme) che complessa uno ione Fe 2+. V gsartor Il trasporto dell ossigeno Mioglobina e emoglobina V gsartor Il trasporto dell ossigeno
7 Mioglobina Trasporto dell O 2, immagazzinamento nella cellula. Due parti: proteina gruppo prostetico Proteina: 155 aminoacidi, ~ 17 kda. Compatta, globina. 75% α-elica. V gsartor Il trasporto dell ossigeno Mioglobina Trasporto dell O 2, immagazzinamento nella cellula. Due parti: proteina gruppo prostetico Proteina: 155 aminoacidi, ~ 17 kda. Compatta, globina. 75% α-elica. V gsartor Il trasporto dell ossigeno
8 Gruppo eme Il gruppo eme è composta di porfirina e Fe 2+. La porfirina è un gruppo non polare, ci sono inoltre due gruppi polari di propionato. La porfirina lega O 2, CO. CO è 10,000 volte più affine alla porfirina del O 2. Propionato O O CH 3 CH 3 CH2 Fe ++ O O CH 3 CH 2 CH 3 Fe ++ V gsartor Il trasporto dell ossigeno Gruppo eme Lo ione Fe ++ coordina sei atomi. Quattro atomi di azoto del gruppo eme Una molecola di ligando Ossiemoglobina lega O 2 Deossiglobina lega H 2 O Carbossiglobina lega CO. Un atomo di azoto dall His prossimale. V gsartor Il trasporto dell ossigeno
9 Gruppo eme Lo ione Fe ++ coordina sei atomi. Quattro atomi di azoto del gruppo eme Una molecola di ligando Ossiemoglobina lega O 2 Deossiglobina lega H 2 O Carbossiglobina lega CO. Un atomo di azoto dall His prossimale. V gsartor Il trasporto dell ossigeno Gruppo eme Lo ione Fe ++ coordina sei atomi. Quattro atomi di azoto del gruppo eme Una molecola di ligando Ossiemoglobina lega O 2 Deossiglobina lega H 2 O Carbossiglobina lega CO. Un atomo di azoto dall His prossimale. V gsartor Il trasporto dell ossigeno
10 Gruppo eme Lo ione Fe ++ coordina sei atomi. Quattro atomi di azoto del gruppo eme Una molecola di ligando Ossiemoglobina lega O 2 Deossiglobina lega H 2 O Carbossiglobina lega CO. Un atomo di azoto dall His prossimale. V gsartor Il trasporto dell ossigeno Gruppo eme Lo ione Fe ++ coordina sei atomi. Quattro atomi di azoto del gruppo eme Una molecola di ligando Ossiemoglobina lega O 2 Deossiglobina lega H 2 O Carbossiglobina lega CO. Un atomo di azoto dall His prossimale. V gsartor Il trasporto dell ossigeno
11 Ligandi al gruppo eme Lo spazio compreso tra il Fe ++ His distale permette il legame di ligandi bimolecolari (O 2, CO) solo con angoli di legame diversi da 180. Il legame tra il Fe ++ e il ligando con questo angolo è più labile di quello a 180. O O V gsartor Il trasporto dell ossigeno Ligandi al gruppo eme Lo spazio compreso tra il Fe ++ His distale permette il legame di ligandi bimolecolari (O 2, CO) solo con angoli di legame diversi da 180. Il legame tra il Fe ++ e il ligando con questo angolo è più labile di quello a 180. V gsartor Il trasporto dell ossigeno
12 Ligandi al gruppo eme Lo spazio compreso tra il Fe ++ His distale permette il legame di ligandi bimolecolari (O 2, CO) solo con angoli di legame diversi da 180. Il legame tra il Fe ++ e il ligando con questo angolo è più labile di quello a 180. C O V gsartor Il trasporto dell ossigeno Ligandi al gruppo eme Lo spazio compreso tra il Fe ++ His distale permette il legame di ligandi bimolecolari (O 2, CO) solo con angoli di legame diversi da 180. Il legame tra il Fe ++ e il ligando con questo angolo è più labile di quello a 180. V gsartor Il trasporto dell ossigeno
13 Interazione eme proteina Il gruppo eme stabilizza il ripiegamento della proteina. Il legame è del tipo interazione idrofobica. I gruppi propionato sono presenti nella superficie. Gruppi carbossilici del propionato V gsartor Il trasporto dell ossigeno Mioglobina La proteina circonda completamente il gruppo eme. Funzione della proteina: aumentare la solubilità del gruppo eme. Impedisce l ossidazione del gruppo eme (Fe 2+ Fe 3+ ) La metamioglobina (Fe 3+ ) è inattiva. Diminuisce il legame di CO. V gsartor Il trasporto dell ossigeno
14 Mioglobina La proteina circonda completamente il gruppo eme. Funzione della proteina: aumentare la solubilità del gruppo eme. Impedisce l ossidazione del gruppo eme (Fe 2+ Fe 3+ ) La metamioglobina (Fe 3+ ) è inattiva. Diminuisce il legame di CO. V gsartor Il trasporto dell ossigeno Ossidazione del Fe ++ Il legame del Fe ++ attraverso la proteina impedisce l ossidazione a Fe +++ a seguito del legame con l ossigeno: 2 eme-fe ++ + ½ 2O 2 + 2H + 2 eme-fe H 2 O O Fe++ 2 Fe ++ + ½ O 2 + 2H + 2 Fe H 2 O Fe ++ O V gsartor Il trasporto dell ossigeno
15 Ossidazione del Fe ++ Il legame del Fe ++ attraverso la proteina impedisce l ossidazione a Fe +++ a seguito del legame con l ossigeno: 2 eme-fe ++ + ½ 2O 2 + 2H + 2 eme-fe H 2 O O Fe++ 2 Fe ++ + ½ O 2 + 2H + 2 Fe H 2 O Fe ++ O V gsartor Il trasporto dell ossigeno Emoglobina, enzima honoris causa In tutti gli animali superiori il metabolismo è aerobico, Assunzione diretta di O 2 efficace solo in organismi unicellulari, Emoglobina (Hb): trasporta O 2 dai polmoni ai tessuti, Mioglobina (Mb): presente nei tessuti muscolari, funge da deposito di O 2, Se non ci fosse Hb, il cuore dovrebbe pompare sangue ad un flusso >100 maggiore. Ci sono organismi superiori che non hanno emoglobina? V gsartor Il trasporto dell ossigeno
16 Pesci antartici Temperatura corporea bassa ( 1.7 C) l acqua salata congela a 1.8 C Solubilità O 2 0.3% Basso metabolismo essun pigmento respiratorio Risparmio di sintesi proteica Bassa viscosità del sangue Facile da pompare Poca spesa energetica V gsartor Il trasporto dell ossigeno obel V gsartor Il trasporto dell ossigeno
17 Il colore del sangue Il colore della proteina è diverso a seconda del fatto che l ossigeno sia o no legato al Fe ++. V gsartor Il trasporto dell ossigeno Il colore del sangue Deossiglobine Ossiglobine Carbossiglobine Metaglobine V gsartor Il trasporto dell ossigeno
18 Mioglobina e emoglobina V gsartor Il trasporto dell ossigeno Similarità strutturale Emoglobina e mioglobina Le quattro subunità della emoglobina sono strutturalmente simili alla mioglobina, Il legame con l ossigeno avviene sempre attraverso lo ione Fe ++ del gruppo eme V gsartor Il trasporto dell ossigeno
19 Emoglobina Proteina tetramerica Dimero di dimeri, (αβ) 2 Le catene α, β sono simili alla Mb. Ogni catena contiene un gruppo eme. Ogni gruppo eme lega un O 2. L interfaccia αβ è diversa dall interfaccia αα e ββ. Legami a ponte salino stabilizzano la struttura deossi. V gsartor Il trasporto dell ossigeno Il legame con l ossigeno ella mioglobina Mb + O 2 MbO 2 K D = [Mb] [O 2 ] [MbO 2 ] Si definisce la saturazione frazionale (γo 2 ) la frazione di siti che hanno ossigeno legato: γo 2 = [MbO 2 ] [Mb] + [O 2 ] γo 2 = [O 2 ] K D + [O 2 ] V gsartor Il trasporto dell ossigeno
20 Il legame con l ossigeno ell emoglobina O 2 O 2 O 2 O 2 Hb Hb(O 2 ) Hb(O 2 ) 2 Hb(O 2 ) 3 Hb(O 2 ) 4 O 2 O 2 O 2 O 2 K D = [Hb] [O 2 ]n [Hb(O 2 ) n ] Si definisce la saturazione frazionale (γo 2 ) la frazione di siti che hanno ossigeno legato: γo 2 = n[hb(o 2 ) n ] n([hb] + [Hb(O 2 ) n ] γo 2 = [O 2 ] n K D + [O 2 ] n V gsartor Il trasporto dell ossigeno Saturazione e po 2 HbO 2 /(Hb+HbO 2 ), % o unità 100% P 0.5 = 3 mmhg Mioglobina Emoglobina P 0.5 = mmhg 50% 0% 0 P Pressione parziale di O 2 o tensione di O 2 o po 2 (mmhg, torr o kpa) V gsartor Il trasporto dell ossigeno
21 Cooperatività γo 2 = [O 2 ] n K D + [O 2 ] n n = costante di Hill n = 1 nessuna cooperatività n > 1 cooperatività positiva n < 1 cooperatività negativa Per l emoglobina n 2.5 V gsartor Il trasporto dell ossigeno Legame dell ossigeno a Hb: Cooperatività Il legame dell ossigeno alla Hb nello stato deossi avviene con una data affinità (K D ) Le molecole di ossigeno che si legano successivamente hanno un affinità maggiore per il sito di legame. Ciò viene definito come cooperatività positiva. Avviene solo in proteine multimeriche. Il coefficiente di Hill ha un valore vicino al numero delle subunità. Il vantaggio è che l affinità del legame è sensibile a piccole variazioni in concentrazioni del ligando. V gsartor Il trasporto dell ossigeno
22 Immagazzinamento e trasporto La mioglobina è un ottimo sistema per immagazzinare O 2 : riesce a caricarsi di ossigeno anche a bassi valori di po 2 per tenerlo strettamente legato P 0.5 (γo 2 = 0.5) a po 2 = 2.8 torr. L emoglobina è un ottimo sistema per trasportare l O 2 : Si carica di O 2 quando po 2 è alta, cede O 2 quando po 2 è basso P 0.5 (γo 2 = 0.5) a po 2 = torr. V gsartor Il trasporto dell ossigeno HbO 2 /(Hb+HbO 2 ) Saturazione 100% O 2 ceduto da MbO 2 O 2 ceduto da Hb(O 2 ) n 0% 0 Sangue venoso Sangue arterioso po 2 (mmhg) V gsartor Il trasporto dell ossigeno
23 Modello Molecolare ello stato deossi il Fe ++ è fuori dal piano del gruppo eme. Il legame con O 2, sposta il Fe ++. Trascina la His prossimale e l elica. Il movimento altera l interfaccia α/β Å His93 (prossimale) His64 (distale) H T Fe++ H 0.33 Å Piano del gruppo eme H Fe++ O O His64 (distale) H His93 (prossimale) 0.22 Å R Stato deossi = stato T (Tense) Stato ossi = stato R (Relaxed) V gsartor Il trasporto dell ossigeno Modello Molecolare L alterazione dell interfaccia α/β provoca la variazione dell affinità nelle subunità adiacenti Å His93 (prossimale) His64 (distale) H Fe++ H 0.33 Å Piano del gruppo eme H Fe++ O O His64 (distale) H His93 (prossimale) 0.22 Å Stato deossi = stato T (Tense) Stato ossi = stato R (Relaxed) T R V gsartor Il trasporto dell ossigeno
24 V gsartor Il trasporto dell ossigeno α 2 β 1 β 2 α 1 V gsartor Il trasporto dell ossigeno
25 α 2 β 1 β 2 α 1 V gsartor Il trasporto dell ossigeno Deossiemoglobina V gsartor Il trasporto dell ossigeno
26 Ossiemoglobina V gsartor Il trasporto dell ossigeno Transizione T R ella transizione fra lo stato T (deossigenata) e lo stato R (ossigenata) la coppia di subunità α 1 β 1 si comporta come un unica subunità. V gsartor Il trasporto dell ossigeno
27 Transizione T R α 2 β 1 α 2 β 1 I maggiori riarrangiamenti avvengono all interfaccia tra i due dimeri α 2 /β 1 e α 1 /β 2. V gsartor Il trasporto dell ossigeno Transizione T R ella proteina deossigenata esiste un legame idrogeno tra Asp nell elica e His amino terminale. Il piccolo movimento causato dal legame con l ossigeno viene amplificato attraverso una ridistribuzione dei legami idrogeno all interfaccia α 2 /β 1 V gsartor Il trasporto dell ossigeno
28 Transizione T R His146 Asp94 His146 Asp94 Il legame dell ossigeno sposta lo ione Fe ++ il quale si trascina l elica e si rompe il legame idrogeno tra Asp94 e His146. V gsartor Il trasporto dell ossigeno Transizione T R α 2 stato T α 2 stato R β 1 stato R β 1 stato R Cambia quindi la distribuzione dei legami idrogeno all interfaccia α/β e cambia quindi lo stato della subunità adiacente che passa da T a R con aumento dell affinità per O 2. V gsartor Il trasporto dell ossigeno
29 V gsartor Il trasporto dell ossigeno T/R Sito T/R Tetramero Tetramero V gsartor Il trasporto dell ossigeno
30 Regolazione ph Effetto Bohr Effetto Root CO 2 Formazione di bicarbonato, (anidrasi carbonica) Formazione di carbammati Cl - Scambio Cl - /HCO 3 - Formazione di ponti salini Composti fosforilati 2,3 bifosfoglicerato Inositoli fosfati ATP, GTP V gsartor Il trasporto dell ossigeno Effetto Bohr L affinità per l O 2 è sensibile al ph. ph acido; diminuzione dell affinità. Il ponte salino tra Asp94 e His146 si forma solo nello stato T. L eccesso di H + forma il ponte salino e favorisce lo stato deossi. His146 Asp94 1 γo ph = 7.5 ph = 7.2 ph = po 2 V gsartor Il trasporto dell ossigeno
31 CO 2 ed effetto Bohr el tessuto La CO 2 è legata alla Hb per formare un carbammato o convertita in bicarbonato dall enzima Anidrasi Carbonica (EC ). Sistema tampone del sangue La Hb lega 2 H + ogni 4 O 2 rilasciati (effetto Bohr). ei polmoni Bassa pco 2 la reazione avviene in senso opposto CO 2 e H + rilasciati da Hb Aumenta l affinità per O 2 CO 2 2CO 2 + H 2 O Anidrasi carbonica EC POLMOI 2H 2 CO 3 2HCO H + 4O 2 SAGUE Hb 4O 2 Hb 2H + TESSUTO 4O 2 2HCO H + Anidrasi carbonica EC H 2 CO 2CO H 2 O Metabolismo V gsartor Il trasporto dell ossigeno HbH + O 2 H + + Hb-H-COO - HbO 2 + H + HCO H + HbO 2 Hb-H 2 + O 2 Anidrasi carbonica EC H 2 O + CO 2 CO 2 CO 2 Krebs Ciclo di HbO 2 Hb + O 2 O 2 ADH ADP Hb + Cl - HbCl - H 2 O AD + K + ATP HCO 3 - Cl - Lento a + H 2 O + CO 2 V gsartor Il trasporto dell ossigeno
32 Anidrasi carbonica V gsartor Il trasporto dell ossigeno Effetto Root ei mammiferi l aumento di acidità provoca l effetto Bohr con una diminuzione di affinità per O 2 attraverso un aumento della K m apparente, ei pesci l aumento di acidità provoca anche l effetto Root con una diminuzione della massima quantità di O 2 che si può legare (varia la V max apparente). L acidosi, metabolica (acido lattico) o respiratoria (CO 2 ) porta ad una riduzione dell affinità dell Hb per O 2, IMPORTATE PER IL RIEMPIMETO DELLA VESCICA ATATORIA. Root RW. The respiratory function of the blood of marine fishes. Biol Bull 61: , V gsartor Il trasporto dell ossigeno
33 Effetto Borh ed effetto Root V gsartor Il trasporto dell ossigeno Emoglobine di pesci Al contrario dei mammiferi nei pesci c è una grande varietà di emoglobine e nel meccanismo di modulazione del legame con l ossigeno per adattarsi alle differenti condizioni ambientali Convenzionalmente le emoglobine dei pesci si dividono in due categorie elletroforetiche: Emoglobine catodiche con punto isoelettrico alto (pi 8) Emoglobine anodiche con punto isolettrico basso (pi 8) Con differenti proprietà di modulazione del legame con l O 2 V gsartor Il trasporto dell ossigeno
34 Emoglobine di pesci L anguilla europea (Anguilla anguilla) viene considerata come specie modello con due distinte emoglobine: Una Hb catodica la cui affinità con l O 2 è debolmente influenzata dal ph (piccolo effetto Bohr) Una Hb anodica che ha una minore affinità per l O 2 e con un grande effetto Bohr e Root. Oltre a nuotare, striscia. V gsartor Il trasporto dell ossigeno Effetto Root e galleggiamento Il gas che riempie la vescica natatoria è principalmente O 2 La Hb dei pesci è estremamente sensibile all acidità, l ambiente acido a causa della produzione di acido lattico o CO 2 Il valore della costante di Hill, n γo 2 = [O 2 ] n K D + [O 2 ] n diminuisce fino a valori al disotto dell unità (cooperatività negativa) con rilascio (fino al 80%) dell ossigeno legato all Hb in prossimità della vescica natatoria. V gsartor Il trasporto dell ossigeno
35 H 2 O + CO 2 AnCarb H + + HCO 3 - H + + HbO 2 HHb + O 2 Cl - Sangue HCO 3 - Cl - H + H+ H + + HCO 3 - H 2 O + CO 2 AnCarb Endotelio ADP ATP Glucoso a + H + Lattato + H + GlicolisiG6P Piruvato CO 2 Cellule della ghiandola del gas Krebs PPO Lume della vescica natatoria O 2 Adattato da:the Generation of Hyperbaric Oxygen Tensions in Fish. Bernd Pelster. ews Physiol. Sci. (2001), 16, V gsartor Il trasporto dell ossigeno Effetto Bohr ed effetto Root L aumento di acidità nei mammiferi provoca l effetto Bohr con una diminuzione di affinità per O 2 (varia la K m apparente), In altri organismi (pesci) l aumento di acidità provoca l effetto Root con una diminuzione della massima quantità di O 2 che si può legare (varia la V max apparente). V gsartor Il trasporto dell ossigeno
36 Modulazione ed adattamento In altura Composti fosforilati Il 2,3 bifosfoglicerato (2,3-BPG) è un sottoprodotto della glicolisi. La sua presenza è un segnale di necessità di O 2. Si lega alla forma T nella regione cationica. Una volta legato favorisce la forma deossi, favorisce quindi il rilascio di O 2 al tessuto. V gsartor Il trasporto dell ossigeno
37 Altra vista del 2,3-BPG ei mammiferi il 2,3- BPG funziona come una zeppa che favorisce lo stato T dell emoglobina. Forza il rilascio di O 2 nel tessuto. È largamente responsabile dell adattamento all altitudine. V gsartor Il trasporto dell ossigeno Altra vista del 2,3-BPG ei mammiferi il 2,3- BPG funziona come una zeppa che favorisce lo stato T dell emoglobina. Forza il rilascio di O 2 nel tessuto. È largamente responsabile dell adattamento all altitudine. V gsartor Il trasporto dell ossigeno
38 Composti fosforilati Il 2,3 bifosfoglicerato (2,3-BPG) è un sottoprodotto della glicolisi. La sua presenza è un segnale di necessità di O 2. Si lega alla forma T nella regione cationica. Una volta legato favorisce la forma deossi, favorisce quindi il rilascio di O 2 al tessuto. V gsartor Il trasporto dell ossigeno Modulazione In altri organismi (Pesci teleostei, elasmobranchi, rettili ecc.) tale effetto viene provocato da altri composti fosforilati: Inositoli fosfati, ATP, GTP. V gsartor Il trasporto dell ossigeno
39 Tutorial Per visualizzare un tutorial su mioglobina ed emoglobina visitare il sito: Utilizzando il plugin CHIME per IE e FFx, scaricabile da: V gsartor Il trasporto dell ossigeno Crediti e autorizzazioni all utilizzo Questo materiale è stato assemblato da informazioni raccolte dai seguenti testi di Biochimica: CHAMPE Pamela, HARVEY Richard, FERRIER Denise R. LE BASI DELLA BIOCHIMICA [ISB ] Zanichelli ELSO David L., COX Michael M. I PRICIPI DI BIOCHIMICA DI LEHIGER - Zanichelli GARRETT Reginald H., GRISHAM Charles M. BIOCHIMICA con aspetti molecolari della Biologia cellulare - Zanichelli VOET Donald, VOET Judith G, PRATT Charlotte W FODAMETI DI BIOCHIMICA [ISB ] - Zanichelli E dalla consultazione di svariate risorse in rete, tra le quali: Kegg: Kyoto Encyclopedia of Genes and Genomes Brenda: Protein Data Bank: Rensselaer Polytechnic Institute: Il materiale è stato inoltre rivisto e corretto dalla Prof. Giancarla Orlandini dell Università di Parma alla quale va il mio sentito ringraziamento. Questo ed altro materiale può essere reperito a partire da: oppure da gsartor.org/ Il materiale di questa presentazione è di libero uso per didattica e ricerca e può essere usato senza limitazione, purché venga riconosciuto l autore usando questa frase: Materiale ottenuto dal Prof. Giorgio Sartor Università di Bologna a Ravenna Giorgio Sartor - giorgio.sartor@unibo.it 39
Trasporto dell ossigeno
 Prof. Giorgio Sartor Trasporto dell ossigeno Copyright 2001-2011 by Giorgio Sartor. All rights reserved. Versione 0.1 oct 2011 Trasporto dell ossigeno egli organismi aerobi il trasporto dell ossigeno avviene
Prof. Giorgio Sartor Trasporto dell ossigeno Copyright 2001-2011 by Giorgio Sartor. All rights reserved. Versione 0.1 oct 2011 Trasporto dell ossigeno egli organismi aerobi il trasporto dell ossigeno avviene
Il trasporto dell ossigeno
 Prof. Giorgio Sartor Il trasporto dell ossigeno Copyright 2001-2013 by Giorgio Sartor. All rights reserved. Versione 1.9 mar 2013 Trasporto dell ossigeno egli organismi aerobi il trasporto dell ossigeno
Prof. Giorgio Sartor Il trasporto dell ossigeno Copyright 2001-2013 by Giorgio Sartor. All rights reserved. Versione 1.9 mar 2013 Trasporto dell ossigeno egli organismi aerobi il trasporto dell ossigeno
Mioglobina ed emoglobina
 Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
MOVIMENTO. Motori molecolari. IV Movimento Miosina e actina. Prof. Giorgio Sartor. P04 - Versione 2.0 oct 2013
 Prof. Giorgio Sartor Motori molecolari IV Movimento Miosina e actina Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P04 - Versione 2.0 oct 2013 MOVIMENTO Miosina Actina P04 v. 2.0 gsartor
Prof. Giorgio Sartor Motori molecolari IV Movimento Miosina e actina Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P04 - Versione 2.0 oct 2013 MOVIMENTO Miosina Actina P04 v. 2.0 gsartor
Prof. Giorgio Sartor. Invertebrati marini. I nutrienti. Fonti di carbonio ed energia. Fonte di carbonio. Fonte di energia. Composti organici.
 Prof. Giorgio Sartor Invertebrati marini I nutrienti Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.1 nov 2008 Fonti di carbonio ed energia Organismo Fonte di carbonio Fonte di
Prof. Giorgio Sartor Invertebrati marini I nutrienti Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.1 nov 2008 Fonti di carbonio ed energia Organismo Fonte di carbonio Fonte di
Modulo 4. Una proteina in azione
 Modulo 4 Una proteina in azione Mioglobina ed emoglobina: un esempio di funzionamento di una proteina La funzione della maggior parte della proteine globulari è mediata dall interazione reversibile con
Modulo 4 Una proteina in azione Mioglobina ed emoglobina: un esempio di funzionamento di una proteina La funzione della maggior parte della proteine globulari è mediata dall interazione reversibile con
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO
 EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Trasporto dell ossigeno In tutti gli animali superiori, il metabolismo è aerobico L energia che si può estrarre dal glucosio
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
Prof. Giorgio Sartor. Il metabolismo. Metabolismo. È il processo che permette di ricavare energia da legami chimici (sottoforma di
 Prof. Giorgio Sartor Il metabolismo Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.4 oct 2008 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Prof. Giorgio Sartor Il metabolismo Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.4 oct 2008 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro.
 Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine:
 La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
Le proteine che legano ossigeno:
 Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
Le proteine che legano ossigeno: . I cristalli si ottengono per precipitazione lenta della molecola da una soluzione, in condizioni che non dovrebbero alterare la sua struttura Un cristallo proteico È
Nel corso dell evoluzione, con il passaggio dalla. progressivamente differenziati due meccanismi. un sistema circolatorio adeguato;
 PROTEINE RESPIRATORIE EMOGLOBINA & MIOGLOBINA Nel corso dell evoluzione, con il passaggio dalla vita anaerobia alla vita aerobia si sono progressivamente differenziati due meccanismi che sono in grado
PROTEINE RESPIRATORIE EMOGLOBINA & MIOGLOBINA Nel corso dell evoluzione, con il passaggio dalla vita anaerobia alla vita aerobia si sono progressivamente differenziati due meccanismi che sono in grado
STRUTTURA E FUNZIONE
 STRUTTURA E FUNZIONE O 2 non solubile in acqua Esistono due proteine che permettono il trasporto di O 2 nel corpo emoglobina (Hb) si trova nei globuli rossi Trasporta anche CO 2 and H + Mioglobina (Mb)
STRUTTURA E FUNZIONE O 2 non solubile in acqua Esistono due proteine che permettono il trasporto di O 2 nel corpo emoglobina (Hb) si trova nei globuli rossi Trasporta anche CO 2 and H + Mioglobina (Mb)
Emoglobina e mioglobina
 Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Emoglobina e mioglobina Per molti organismi, l O 2 è una molecola di importanza vitale: l'ossigeno è infatti l'accettore finale degli elettroni, che "fluendo" attraverso i complessi della catena respiratoria,
Il metalloma Struttura e reattività di metalloproteine. Il trasporto dell O 2
 Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
Il metalloma Struttura e reattività di metalloproteine Il trasporto dell O 2 Il trasporto dell ossigeno Nel sangue la solubilità dell O 2 è molto maggiore che in H 2 O In H 2 O la solubilità è 6.59 cm
Prof. Giorgio Sartor. Il metabolismo. Metabolismo. È il processo che permette di ricavare energia da legami chimici (sottoforma di
 Prof. Giorgio Sartor Il metabolismo Copyright 2001-2017 by Giorgio Sartor. All rights reserved. Versione 1.6.1 Mar-17 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Prof. Giorgio Sartor Il metabolismo Copyright 2001-2017 by Giorgio Sartor. All rights reserved. Versione 1.6.1 Mar-17 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Struttura delle proteine
 Struttura delle proteine I II III Copyright 2001-2015 by Giorgio Sartor. All rights reserved. Versione 1.0.2 oct 2015 Struttura quaternaria Èil livello di organizzazione per il quale si formano strutture
Struttura delle proteine I II III Copyright 2001-2015 by Giorgio Sartor. All rights reserved. Versione 1.0.2 oct 2015 Struttura quaternaria Èil livello di organizzazione per il quale si formano strutture
Le proteine che legano l ossigenol
 Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Le proteine che legano l ossigenol Protoporfirina IX EME (Fe-protoporfirina IX) L atomo di ferro del gruppo eme può formare sei legami Struttura della mioglobina di capodoglio (J. Kendrew, anni 50)
Esempi di proteine: Mioglobina ed Emoglobina
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Esempi di proteine: Mioglobina ed Emoglobina Mioglobina: caratteristiche generali, funzione
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Esempi di proteine: Mioglobina ed Emoglobina Mioglobina: caratteristiche generali, funzione
Regolano il metabolismo, sia come enzimi, sia come ormoni (insulina, glucagone, ecc.)
 Grazie alla elevata dinamicità delle strutture proteiche (gli atomi sono in continuo movimento fluttuante) e per la capacità che hanno di legarsi in modo selettivo ad altre molecole, le proteine svolgono
Grazie alla elevata dinamicità delle strutture proteiche (gli atomi sono in continuo movimento fluttuante) e per la capacità che hanno di legarsi in modo selettivo ad altre molecole, le proteine svolgono
Esempi di proteine: Mioglobina ed Emoglobina
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica Organica e Biochimica Esempi di proteine: Mioglobina ed Emoglobina Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica Organica e Biochimica Esempi di proteine: Mioglobina ed Emoglobina Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
Trasporto di O 2 nel sangue
 Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Trasporto di O 2 nel sangue Il 97% dell O 2 trasportato nel plasma è chimicamente legato all Hb nei globuli rossi, solo il 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb
Mioglobina Emoglobina
 Mioglobina Emoglobina Eventi successivi i alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione
Mioglobina Emoglobina Eventi successivi i alla comparsa dell O 2 Possibilità di ottenere circa 20 volte più energia dalla combustione del glucosio Sviluppo di un sistema circolatorio per la distribuzione
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Emoglobina e mioglobina
 Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
Emoglobina e mioglobina Per poter parlare in modo comprensibile dell emoglobina (Hb), è utile occuparsi prima della mioglobina (Mb) che è molto simile all emoglobina ma è molto più semplice. Tra emoglobina
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE
 FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
FUNZIONE DELLE PROTEINE RAPPORTO STRUTTURA-FUNZIONE Principi basilari: 1.Le funzioni di molte proteine richiedono il legame reversibile con altre molecole (LIGANDO) Un ligando può essere di natura diversa,
Ogni globina ha una tasca in cui lega un gruppo EME, quindi l Hb può legare e trasportare 4 molecole di O 2
 Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
Emoglobina (Hb): tetramero (le globine si associano formando due copie di dimeri αβ (α 1 β 1 e α 2 β 2 ) che si associano a formare un tetramero attraverso interazioni idrofobiche, legami H e ponti salini
Fisiologia della Respirazione
 Fisiologia della Respirazione 8.Trasporto dei gas nel sangue FGE aa.2016-17 Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità dell O 2 nel sangue: l emoglobina Curva di dissociazione
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue FGE aa.2016-17 Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità dell O 2 nel sangue: l emoglobina Curva di dissociazione
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della
 Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della CO2 in direzione opposta. R = quoziente respiratorio,
Dopo la ventilazione alveolare, il passaggio successivo del processo respiratorio consiste nella diffusione dell O2 dagli alveoli al sangue e della CO2 in direzione opposta. R = quoziente respiratorio,
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 Fisiologia della Respirazione 8.Trasporto dei gas nel sangue Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità
Fisiologia della Respirazione 8.Trasporto dei gas nel sangue Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Obiettivi Necessità di un sistema di trasporto chimico ad alta capacità
Metabolismo dei nucleotidi
 rof. Giorgio Sartor Metabolismo dei nucleotidi 1: introduzione 2: biosintesi de-novo delle purine 3: biosintesi de-novo delle pirimidine 4: catabolismo delle purine 5: catabolismo delle pirimidine 6: sintesi
rof. Giorgio Sartor Metabolismo dei nucleotidi 1: introduzione 2: biosintesi de-novo delle purine 3: biosintesi de-novo delle pirimidine 4: catabolismo delle purine 5: catabolismo delle pirimidine 6: sintesi
ACQUISIZIONE SPERIMENTALE DELLA CONOSCENZA NELLE SCIENZE DELLA NATURA.
 CLM C IN MEDICINA E CHIRURGIA C.I. Metodologia medico-scientifica di base II (Scienze umane 2 Epistemologia) A.A. 2013-2014 I anno, 2 semestre ACQUISIZIONE SPERIMENTALE DELLA CONOSCENZA NELLE SCIENZE DELLA
CLM C IN MEDICINA E CHIRURGIA C.I. Metodologia medico-scientifica di base II (Scienze umane 2 Epistemologia) A.A. 2013-2014 I anno, 2 semestre ACQUISIZIONE SPERIMENTALE DELLA CONOSCENZA NELLE SCIENZE DELLA
Emoglobina e mioglobina
 Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Emoglobina e mioglobina L emoglobina e la mioglobina proteine centrali per l evoluzione La transizione dalla vita anaerobica a quella aerobica rappresenta un passo fondamentale dell'evoluzione perchè ha
Foto funzioni apparato respiratorio
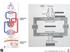 RESPIRAZIONE ESTERNA Foto funzioni apparato respiratorio RESPIRAZIONE INTERNA GLI SCAMBI GASSOSI QUOZIENTE RESPIRATORIO = CO 2 PRODOTTA O 2 CONSUMATO A riposo: Epitelio alveolare 200 ml/min 250 ml/min
RESPIRAZIONE ESTERNA Foto funzioni apparato respiratorio RESPIRAZIONE INTERNA GLI SCAMBI GASSOSI QUOZIENTE RESPIRATORIO = CO 2 PRODOTTA O 2 CONSUMATO A riposo: Epitelio alveolare 200 ml/min 250 ml/min
Trasporto dei gas. Pressioni Volumi
 Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Trasporto dei gas Pressioni Volumi Il 97% dell O 2 trasportato nel plasma si trova chimicamente legato all Hb nei globuli rossi, solo lo 3% è fisicamente disciolto Trasporto O 2 nel plasma Trasporto O
Plasma ph Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca
 Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
Equilibrio acidobase Dieta: Acidi grassi Aminoacidi Assunzione H + CO 2, acido lattico, chetoacidi Plasma ph 7.357.42 Tamponi: LEC: HCO 3 LIC: Proteine, Emoglobina, Fosfati Urina: Fosfati e ammoniaca Ventilazione:
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Trasporto dei gas respiratori nel sangue
 Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
Trasporto dei gas respiratori nel sangue La soluzione dei gas nei liquidi C Legge di Henry acq P gas S gas C acq = quantità di gas disciolta nella fase acquosa P gas = pressione parziale del gas nella
degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l l anidride carbonica tra i polmoni e i tessuti
 l emoglobina degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l e l anidride carbonica tra i polmoni e i tessuti Mioglobina, proteina di deposito,, presente nelle fibrocellule
l emoglobina degli eritrociti è una proteina di trasporto indispensabile per veicolare l ossigeno l e l anidride carbonica tra i polmoni e i tessuti Mioglobina, proteina di deposito,, presente nelle fibrocellule
Gli Enzimi. catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche
 catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
Trasporto O 2 nel sangue
 Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto (determina il valore di po 2 ) Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto (determina il valore di po 2 ) Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb Saturazione Hb 97% 0.3 ml/100ml
Le proteine III. Corso di Biochimica 1. Prof. Giuseppina Pitari
 Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA Email: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
KINESINA. Motori molecolari. V Movimento Kinesina, Dineina su microtubuli. Prof. Giorgio Sartor. P05 - Versione 2.0 oct 2013
 Prof. Giorgio Sartor Motori molecolari V Movimento Kinesina, Dineina su microtubuli Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P05 - Versione 2.0 oct 2013 KINESINA C-terminale (coda) Kinesina
Prof. Giorgio Sartor Motori molecolari V Movimento Kinesina, Dineina su microtubuli Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P05 - Versione 2.0 oct 2013 KINESINA C-terminale (coda) Kinesina
COMPOSIZIONE DELL ARIA ATMOSFERICA SECCA E PRESSIONI PARZIALI DEI GAS - (760 TORR, 15 C)
 COMPOSIZIONE DELL ARIA ATMOSFERICA SECCA E PRESSIONI PARZIALI DEI GAS - (760 TORR, 15 C) COMPOSIZIONE ARIA NELL ATMOSFERA = COSTANTE A PARTE LE VARIAZIONI DELLA QUANTITA DI VAPORE ACQUEO A 0 C 1 torr =
COMPOSIZIONE DELL ARIA ATMOSFERICA SECCA E PRESSIONI PARZIALI DEI GAS - (760 TORR, 15 C) COMPOSIZIONE ARIA NELL ATMOSFERA = COSTANTE A PARTE LE VARIAZIONI DELLA QUANTITA DI VAPORE ACQUEO A 0 C 1 torr =
MIOSINA. Motori molecolari. II Strutture per il movimento Miosina, Kinesina e Dineina. Una struttura per il movimento. Prof.
 Prof. Giorgio Sartor Motori molecolari II Strutture per il movimento Miosina, Kinesina e Dineina Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P02 - Versione 2.0 oct 2013 MIOSINA Una struttura
Prof. Giorgio Sartor Motori molecolari II Strutture per il movimento Miosina, Kinesina e Dineina Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P02 - Versione 2.0 oct 2013 MIOSINA Una struttura
I FLAGELLI NEI BATTERI
 Prof. Giorgio Sartor Motori molecolari VI Flagello batterico Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P06 - Versione 2.0 oct 2013 I FLAGELLI NEI BATTERI Un diverso movimento Un diverso
Prof. Giorgio Sartor Motori molecolari VI Flagello batterico Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P06 - Versione 2.0 oct 2013 I FLAGELLI NEI BATTERI Un diverso movimento Un diverso
I FLAGELLI NEI BATTERI
 Prof. Giorgio Sartor Motori molecolari V Flagello batterico Copyright 2001-2015 by Giorgio Sartor. All rights reserved. M09 - Versione 1.7 oct 2015 I FLAGELLI NEI BATTERI Un diverso movimento Un diverso
Prof. Giorgio Sartor Motori molecolari V Flagello batterico Copyright 2001-2015 by Giorgio Sartor. All rights reserved. M09 - Versione 1.7 oct 2015 I FLAGELLI NEI BATTERI Un diverso movimento Un diverso
Tamponi biologici per il controllo del ph
 Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
Come le cellule traggono energia dal cibo: produzione di ATP
 Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Riabilitativa 2015/2016
 Emoglobina e collageno Spina Riabilitativa 2015/2016 WWW.SUNHOPE.IT Alla grande varietà di strutture tridimensionali corrisponde una grande varietà di funzioni Ogni proteina presenta diversi livelli di
Emoglobina e collageno Spina Riabilitativa 2015/2016 WWW.SUNHOPE.IT Alla grande varietà di strutture tridimensionali corrisponde una grande varietà di funzioni Ogni proteina presenta diversi livelli di
BIOMOLECOLE (PROTEINE)
 BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
BIOMOLECOLE (PROTEINE) Proteine: funzioni Strutturale (muscoli, scheletro, legamenti ) Contrattile (actina e miosina) Di riserva (ovoalbumina) Di difesa (anticorpi) Di trasporto (emoglobina, di membrana)
Scambi gassosi e regolazione del respiro
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I Scambi gassosi e regolazione del respiro Ruolo del Sistema Respiratorio: - fornire O 2 - rimuovere CO 2 Scaricato da www.sunhope.it
PORTA AGLI ORGANI E AI TESSUTI: RIMUOVE: OMEOTERMI INTERVIENE NELLA TERMOREGOLAZIONE FUNZIONI DELLA CIRCOLAZIONE SANGUIGNA IL GLOBULO ROSSO
 FUNZIONI DELLA CIRCOLAZIONE SANGUIGNA IL GLOBULO ROSSO PORTA AGLI ORGANI E AI TESSUTI: a. L OSSIGENO (O 2 ), b. LE SOSTANZE NUTRITIZIE ASSORBITE, c. I SECRETI DELLE GHIANDOLE ENDOCRINE. RIMUOVE: a. L ANIDRIDE
FUNZIONI DELLA CIRCOLAZIONE SANGUIGNA IL GLOBULO ROSSO PORTA AGLI ORGANI E AI TESSUTI: a. L OSSIGENO (O 2 ), b. LE SOSTANZE NUTRITIZIE ASSORBITE, c. I SECRETI DELLE GHIANDOLE ENDOCRINE. RIMUOVE: a. L ANIDRIDE
Rapporto Struttura/Funzione delle Proteine
 Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Rapporto Struttura/Funzione delle Proteine Struttura/Funzione delle Proteine Interazioni proteina-ligando come base della funzione di molte proteine
Macromolecole Biologiche Chimica Biologica A.A. 2010-2011 Rapporto Struttura/Funzione delle Proteine Struttura/Funzione delle Proteine Interazioni proteina-ligando come base della funzione di molte proteine
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE
 VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
VOLUMI POLMONARI DISTRIBUZIONE DELLA PERFUSIONE POLMONARE DISTRIBUZIONE DELLA VENTILAZIONE POLMONARE DEFINIRE LA COMPLIANCE POLMONARE DEFINIRE LE RESISTENZE POLMONARI DEFINIRE IL LAVORO POLMONARE Equazione
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 10
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 10 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 10 Funzioni delle proteine Concetti chiave: La varietà strutturale delle proteine consente loro di svolgere un enorme quantità
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
- CINETICA ENZIMATICA
 - CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
- CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
L EQUILIBRIO ACIDO-BASE NEL SANGUE
 L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
L EQUILIBRIO ACIDO-BASE NEL SANGUE ph fisiologico: 7.35-7.45 ph < 7.35 acidosi ph > 7.45 alcalosi Lezione 24 1 L equazione di Henderson-Hasselbalch HA H + + A - La costante di equilibrio (K) (o costante
1. Controllo dell equilibrio acido-base. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
Prof. Maria Nicola GADALETA FOSFORILAZIONE OSSIDATIVA 4
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche FOSFORILAZIONE
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche FOSFORILAZIONE
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. Prof. Augusto Parente. Lezione 7. DiSTABiF. Corso di Laurea in SCIENZE BIOLOGICHE
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Prof. Augusto Parente Anno Accademico 2014-15 Lezione 7 Mioglobina Emoglobina po
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Prof. Augusto Parente Anno Accademico 2014-15 Lezione 7 Mioglobina Emoglobina po
Respirazione cellulare
 Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Regolazione allosterica
 Macromolecole Biologiche Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Regolazione allosterica Marco Nardini Dipartimento
Macromolecole Biologiche Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Regolazione allosterica Marco Nardini Dipartimento
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
LE REAZIONI DI FISSAZIONE DEL CARBONIO
 LE REAZIONI DI FISSAZIONE DEL CARBONIO Reazioni al buio ogni anno 200 miliardi di tonnellate di CO 2 vengono convertite in biomassa 40% fitoplancton CICLO DI CALVIN ciclo riduttivo dei pentosi fosfati,
LE REAZIONI DI FISSAZIONE DEL CARBONIO Reazioni al buio ogni anno 200 miliardi di tonnellate di CO 2 vengono convertite in biomassa 40% fitoplancton CICLO DI CALVIN ciclo riduttivo dei pentosi fosfati,
Trasporto O 2 nel sangue
 Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb SaturazioneHb 97% 0.3 ml/100ml 19.4
Trasporto O 2 nel sangue 97% legato all Hb nei globuli rossi 3% fisicamente disciolto, determina il valore di po 2 Trasporto O 2 nel plasma Trasporto O 2 legato ad Hb SaturazioneHb 97% 0.3 ml/100ml 19.4
Introduzione all Adattamento
 Seminari di rientamento in Biologia Introduzione all Adattamento Giovanni Cercignani Che cosa intendiamo per adattamento? Questo è forse il paradigma più vasto e generale della biologia, un edificio concettuale
Seminari di rientamento in Biologia Introduzione all Adattamento Giovanni Cercignani Che cosa intendiamo per adattamento? Questo è forse il paradigma più vasto e generale della biologia, un edificio concettuale
2.Controllo dell equilibrio acido-base - II. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
2.Controllo dell equilibrio acidobase II Carlo Capelli Fisiologia Facoltà di Scienze Motorie Università di Verona 1. Tampone bicarbonatoco 2 E il sistema tampone fisiologico più importante [ CO 2] = PCO
Tamponi Biologici. AO/Febbraio 2016
 Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Connessioni. Le cellule cardiache sono unite tra loro da parti più ispessite del sarcolemma dette: Gap - junction
 Muscolo cardiaco Le fibrocellule cardiache sono simili alle fibrocellule muscolari di tipo I (fibre rosse), ma si differenziano, infatti: Sono più piccole Non sono polinucleate Minor massa fibrillare (50%
Muscolo cardiaco Le fibrocellule cardiache sono simili alle fibrocellule muscolari di tipo I (fibre rosse), ma si differenziano, infatti: Sono più piccole Non sono polinucleate Minor massa fibrillare (50%
Gli elementi corpuscolati del sangue sono vere cellule o derivati cellulari.
 I GLOBULI ROSSI Gli elementi corpuscolati del sangue sono vere cellule o derivati cellulari. I globuli rossi sono i più numerosi (5 milioni per mm 3 nell uomo, 4.5 milioni per mm 3 nella donna) sono detti
I GLOBULI ROSSI Gli elementi corpuscolati del sangue sono vere cellule o derivati cellulari. I globuli rossi sono i più numerosi (5 milioni per mm 3 nell uomo, 4.5 milioni per mm 3 nella donna) sono detti
Indice generale 1. Introduzione alla biochimica 2. Acqua, ph, acidi, basi, sali, tamponi
 Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU)
 UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
UNIVERSITÀ DEGLI STUDI DI TERAMO CORSO DI LAUREA IN BIOTECNOLOGIE CORSO MONODISCIPLINARE: BIOCHIMICA (6CFU) Roberto Giacominelli Stuffler IL C.M. BIOCHIMICA È SUDDIVISO IN DUE UNITÀ DIDATTICHE: A) BIOCHIMICA
ph = log 1/[H + ] = log [H + ]
![ph = log 1/[H + ] = log [H + ] ph = log 1/[H + ] = log [H + ]](/thumbs/49/24977942.jpg) ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
ph = log 1/[H ] = log [H ] Sangue arterioso ph = 7.4 Sangue venoso ph = 7.35 ph inferiori = acidosi (limite ph = 6.8) ph superiori = alcalosi (limite ph = 8) ph intracellulare = 6 7.4 ph urina 4.5 8 Produzione
DESTINI METABOLICI DEL PIRUVATO
 DETINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
DETINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Cap.19. Ciclo di Krebs. o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico
 Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Ruolo chiave nella Protein Science Cristallizzata nel 1840 Handbook of Hb crystals 1909 (Reichert & Brown)
 Mb & Hb EMOGLOBINA Ruolo chiave nella Protein Science Cristallizzata nel 1840 Handbook of Hb crystals 1909 (Reichert & Brown) 1 proteina caratterizzata t in ultracentrifuga t 1 proteina a funzione fisiologica
Mb & Hb EMOGLOBINA Ruolo chiave nella Protein Science Cristallizzata nel 1840 Handbook of Hb crystals 1909 (Reichert & Brown) 1 proteina caratterizzata t in ultracentrifuga t 1 proteina a funzione fisiologica
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO. Legame reversibile proteina -ligando
 EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Legame reversibile proteina -ligando Hemoglobin First protein to be crystallized - 1849. First protein to have its mass accurately
EMOGLOBINA, MIOGLOBINA MIOGLOBINA ED EMOGLOBINA NEL TRASPORTO DELL OSSIGENO Legame reversibile proteina -ligando Hemoglobin First protein to be crystallized - 1849. First protein to have its mass accurately
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Equilibrio acido base
 Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Equilibrio acido base In una soluzione acquosa: [H+] x [OH-]= 10-14 M ph= logaritmo in base 10 dell inverso della [ H+] (-log[h+]) Variazioni di ph possono portare a variazioni di molec organiche e al
Carboidrati! Oligosaccaridi Polisaccaridi. B) Carboidrati complessi
 Carboidrati! Sono i composti organici più abbondanti sulla terra Contengono: C, H, O Sono Aldeidi o Chetoni poliossidrilici Possono essere suddivisi in: A) Zuccheri semplici Monosaccaridi B) Carboidrati
Carboidrati! Sono i composti organici più abbondanti sulla terra Contengono: C, H, O Sono Aldeidi o Chetoni poliossidrilici Possono essere suddivisi in: A) Zuccheri semplici Monosaccaridi B) Carboidrati
Le reazioni esoergoniche e quelle endoergoniche del metabolismo cellulare sono legate dalla molecola di ATP.
 1 METABOLISMO CELLULARE Definizione Metabolismo cellulare insieme delle reazioni che producono e necessitano energia nel nostro corpo. Nel metabolismo si distinguono due fasi: Fase catabolica Insieme delle
1 METABOLISMO CELLULARE Definizione Metabolismo cellulare insieme delle reazioni che producono e necessitano energia nel nostro corpo. Nel metabolismo si distinguono due fasi: Fase catabolica Insieme delle
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
La fissazione dell azoto
 La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
La fissazione dell azoto Complesso della nitrogenasi N +10H + + 8e + 16ATP N 2 + 10 H + 8e + 16ATP 2NH 4+ + 16ADP + 16P + H2 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Regolazione della Glicolisi
 Regolazione della Glicolisi Enzimi regolati della glicolisi: 1) esochinasi. da: Champe La esochinasi: ha bassa Km per Glu 0,2mM: questo assicura la captazione anche di poche molecole di glucosio, presenti
Regolazione della Glicolisi Enzimi regolati della glicolisi: 1) esochinasi. da: Champe La esochinasi: ha bassa Km per Glu 0,2mM: questo assicura la captazione anche di poche molecole di glucosio, presenti
Laboratorio Fitness & Wellness
 Laboratorio Fitness & Wellness Anno Accademico 2015/2016 Ewan Thomas, MSc Principi di Bioenergetica e Biomeccanica Metabolismo Catabolismo Processi di degradazione che permettono di liberare energia Anabolismo
Laboratorio Fitness & Wellness Anno Accademico 2015/2016 Ewan Thomas, MSc Principi di Bioenergetica e Biomeccanica Metabolismo Catabolismo Processi di degradazione che permettono di liberare energia Anabolismo
