Corso di Laboratorio di Chimica Generale ed Inorganica Prof. R. Centore. Dispensa: Titolazioni acido-base
|
|
|
- Silvano Biondi
- 7 anni fa
- Visualizzazioni
Transcript
1 Corso di Laboratorio di Chimica Generale ed Inorganica Prof. R. Centore Dispensa: Titolazioni acido-base Prima versione: Settembre 1996; versione aggiornata: Gennaio
2 1. Generalità sulle titolazioni Una titolazione è una tecnica analitica che consente di determinare la concentrazione di una soluzione attraverso operazioni di misura di volumi (analisi volumetrica). La titolazione si basa su una reazione chimica tra due sostanze in soluzione, A e X. La soluzione della sostanza A (titolante) sia a concentrazione nota, mentre la soluzione della sostanza X (titolando) sia a concentrazione incognita (da determinare). La titolazione si basa sulla misura del volume di soluzione titolante che contiene un ammontare di A esattamente equivalente, dal punto di vista stechiometrico, all ammontare di X contenuto in un volume noto di soluzione titolanda. Supponiamo che la reazione tra le sostanze A e X sia schematizzabile come aa + xx prodotti (1) con a e x coefficienti stechiometrici. Siano c A e c X le concentrazioni molari delle due soluzioni, c A essendo nota e c X essendo incognita. Preleviamo ora un volume noto di soluzione titolanda, sia esso v X 0, ed ad esso, eventualmente diluito con un opportuno solvente, aggiungiamo volumi crescenti, misurati, v A di soluzione titolante. Avverrà la reazione (1). Supponiamo, poi, di disporre di un sistema, detto indicatore, in grado di evidenziare l istante in cui abbiamo aggiunto alla soluzione titolanda un volume di soluzione titolante che contiene un numero di moli di titolante, v A c A esattamente uguale, dal punto di vista stechiometrico, alle moli di titolando presenti nel nostro sistema, v X 0 c X cioè l istante, detto punto equivalente della titolazione, in cui vale la relazione v A c A = x a v 0 X c X (2) In questo caso, dalla (2), è possibile ricavare l incognita c X. In definitiva, tale tecnica consente di determinare la concentrazione incognita attraverso misure di volume. Sulla base di questa decsrizione, sia pure estremamente schematica della titolazione, è possibile già definire alcune caratteristiche che la reazione (1) deve avere perché la si possa utilizzare in una titolazione. Anzitutto deve essere una reazione rapida, nel senso che aggiungendo il titolante dalla buretta, questo deve subito reagire con il titolando; la reazione, inoltre, deve essere unica, nel senso che il composto A che viene aggiunto, e della cui soluzione si misura il volume via via aggiunto al titolando, deve reagire con X e solo con esso, altrimenti il numero di moli di A non è in relazione diretta con il numero di moli di X presenti nel volume noto di titolando prelevato inizialmente; la reazione tra i due deve, inoltre, essere per quanto possibile quantitativa; infine, ma non da ultimo, deve poter esistere, per la reazione considerata, un opportuno sistema indicatore. Soddisfano questo requisito alcune reazioni del tipo acido-base, di ossidoriduzione, di precipitazione e alcune reazioni di complessazione. Conseguentemente, avremo titolazioni acido-base, titolazioni redox, titolazioni di precipitazione e di complessazione. 2. Dove nasce l errore di titolazione Nella equazione (2), che vale al punto equivalente della titolazione e solo in esso, le grandezze v A, 0 c A, x, a, v X sono note, c X essendo l unica incognita. Essa può quindi essere determinata, eventualmente con il suo errore, una volta che sia noto l errore sulle altre grandezze che figurano nella (2). Il concetto di errore di titolazione, però, è differente ed ha un significato chimico più profondo. Infatti, l applicazione della (2) si basa sull ipotesi che l aggiunta di titolante dalla buretta sia terminata proprio al punto equivalente, cioè quando vale la (2), ovvero sull ipotesi che il sistema indicatore che noi usiamo sia assolutamente accurato. Ciò, evidentemente, non si verifica mai. In pratica, il sistema indicatore che viene usato comporta sempre un certo errore. In altre parole, l istante in cui noi terminiamo l aggiunta di titolante, e che viene detto punto finale della titolazione, non coincide con il punto equivalente, sicché il volume del punto finale e quello del punto equivalente non coincidono. L errore di titolazione nasce proprio da questo fatto, cioè dal fatto che quando noi terminiamo l aggiunta del titolante dalla buretta, abbiamo aggiunto in realtà un volume un po' più grande o un po' più piccolo di quello del punto equivalente, con il che l applicazione della 2
3 (2) porta a sovrastimare o a sottostimare rispettivamente, la concentrazione incognita del titolando. La chimica analitica si occupa della ricerca delle condizioni opportune per eseguire l analisi, cioè delle condizioni in cui l errore di titolazione così definito viene ad essere inferiore e trascurabile rispetto all errore, di tipo massimo, connesso alla misura dei volumi di titolante e titolando con la massima accuratezza disponibile in laboratorio (ad es. con una buretta); quando ciò succede, l errore di titolazione connesso alla chimica del processo è trascurabile ed il metodo è applicabile. Solo in questo caso, evidentemente, ha senso ricavare l errore su c X attraverso la propagazione dell errore (o se si vuole la regola delle cifre significative) applicata alla (2) tenendo presente l errore (massimo) su c A e gli errori nella misura dei volumi con la buretta (± 0.05 ml). 3. Titolazioni acido-base In una titolazione acido-base, le sostanze A e X della reazione (1) sono un acido e una base, e la reazione chimica è quindi una reazione di neutralizzazione. Se titoliamo un acido, X, con una base, A, all inizio abbiamo una soluzione dell acido, al punto equivalente abbiamo la neutralizzazione dei due, quindi abbiamo una soluzione del sale, e dopo il punto equivalente, se continuiamo ad aggiungere soluzione della base, abbiamo, sostanzialmente, una soluzione della base. E abbastanza evidente che durante la titolazione si hanno variazioni del ph della soluzione; quindi il corso della titolazione può essere seguito attraverso misure di ph. Il sistema indicatore da usare in una titolazione acidobase sarà pertanto un sistema sensibile al ph (indicatore di ph). E opportuno ricordare che, sebbene al punto equivalente di una titolazione acido-base sia avvenuta la neutralizzazione dell acido con la base con formazione del sale, il ph risultante è neutro solo se il sale non dà idrolisi apprezzabile. La possibilità di eseguire con successo una titolazione acido-base si basa sul fatto che, in corrispondenza del punto equivalente della titolazione, si osserva spesso un brusco salto di ph della soluzione, di varie unità; ciò accade perché, al punto equivalente, come si può dimostrare rigorosamente, la capacità tamponante del sistema, che può essere definita come la derivata della concentrazione di titolante aggiunto rispetto al ph, è minima. In altre parole, la curva di titolazione, cioè la curva che riporta il ph della soluzione risultante in funzione del volume di titolante aggiunto, presenta un punto di flesso più o meno pronunciato in corrispondenza del punto equivalente (infatti un punto di flesso della curva di titolazione significa che la derivata seconda è nulla, quindi che la derivata prima, la capacità tamponante in questo caso, è minima o massima). Pertanto, anche se si commette un certo errore nella misura del ph del punto finale, rispetto a quello del punto equivalente, il corrispondente errore sul volume è molto più piccolo, dato che la pendenza della curva ph=f(v t ) è molto alta; conseguentemente è piccolo anche l errore su c X, perché l errore sulla concentrazione, dalla (2), dipende essenzialmente da v A. Ovviamente, quanto maggiore è la pendenza della curva, cioè quanto più pronunciato è il flesso, tanto migliori saranno le condizioni per l analisi, nel senso che a parità di errore nella misura del ph del punto equivalente tanto più basso sarà l errore sul volume del punto equivalente, che è poi, di fatto, la grandezza usata nella (2) per ricavare c X. Evidentemente, le caratteristiche della curva di titolazione, cioè quanto sia pronunciato il punto di flesso nell intorno del punto equivalente, dipendono dalle caratteristiche chimiche del sistema (costanti di dissociazione dell acido o della base) e dalla loro concentrazione. In particolare, 3
4 l accuratezza della determinazione aumenta all aumentare della forza dell acido (o della base) e della sua concentrazione. Una condizione limite (vedi Ciavatta, Lezioni di Chimica Analitica) per la determinazione di protoliti con errore entro ± 0.1%, se l errore sul ph è non maggiore di 0.4 unità attorno al ph del punto equivalente, è K a C Indicatori di ph In una titolazione acido-base, in sostanza, si misura il ph della soluzione risultante in funzione del volume di titolante aggiunto, terminando l aggiunta di titolante quando il ph della soluzione raggiunge il ph del punto equivalente. In realtà, non è necessario misurare il ph in modo continuo, ovvero ad ogni aggiunta di titolante; è sufficiente disporre solo di un sistema che avverta quando si è raggiunto il ph del punto equivalente. A tale scopo, giova osservare che, sebbene la concentrazione della soluzione di titolando non sia conosciuta esattamente, tuttavia è sufficiente conoscerne l ordine di grandezza per poter già fare una stima del ph del punto equivalente corretta entro meno di una unità di ph. Pertanto, si può dire che il ph del punto equivalente di una titolazione acido-base può facilmente essere stimato a priori. E necessario quindi solo poter disporre di un sistema che avverta quando nella soluzione si è raggiunto tale ph. Questo sistema è rappresentato, tradizionalmente, dall indicatore di ph o indicatore acido-base. Un indicatore di ph è costituito da una coppia acido-base, a-b, in cui l acido e la base coniugata hanno differenti colori (indicatori bicolori) o una almeno delle due forme è colorata (indicatore monocolore). L equilibrio protolitico dell indicatore (bicolore) in acqua è da cui ovvero da cui log[ H 3 O + ]=log K i +log [a ] [b ] log[ H 3 O + ]=- log K i +log [b ] [a ] Vediamo ora di capire, o meglio di fare una stima, dell intervallo di ph necessario perché il colore della soluzione cambi da quello acido a quello basico o viceversa. A tale scopo, supponiamo che il colore acido non sia più apprezzabile quando solo la concentrazione di forma basica sia almeno dieci volte maggiore di quella della forma acida [b ] 10 si percepisce solo il colore della forma basica (3) [a ] Introducendo la disuguaglianza (3) nella (2), si ha ph pk i +1 (4) Quindi, per ph pk i +1, il colore della soluzione è quello della forma basica. Analogamente, supponiamo che il colore della forma basica non si apprezzi più quando la concentrazione della forma acida è almeno dieci volte maggiore di quella della forma basica [b ] [a ] 1 si percepisce solo il colore della forma acida (5) 10 Sostituendo la disuguaglianza (5) nella (2) si ha ph pk i 1 (6) Quindi, per ph pk i 1, il colore della soluzione è quello della forma acida. In sostanza, quindi, nelle condizioni enunciate, il colore di una soluzione contenente l indicatore bicolore (a,b) cambia tono in un campo di ph di due unità che giace simmetricamente attorno al valore di pk dell indicatore. Il pk dell indicatore si dice anche esponente dell indicatore, e 4
5 l intervallo (pk-1, pk+1) si chiama intervallo di viraggio dell indicatore. Si dice, allora, che l indicatore ha un intervallo di viraggio di due unità di ph. Si noti, comunque, che dal punto di vista teorico, l intervallo di viraggio non ha alcun significato; esso rappresenta comunque una grandezza soggetta a variazione da parte di differenti sperimentatori. Così, ad esempio, solo se l occhio dello sperimentatore è ugualmente sensibile al colore della forma acida e a quello della forma basica l intervallo di viraggio sarà simmetrico rispetto al pk i. In sostanza, quindi, nel caso di un indicatore bicolore, il colore della soluzione è determinato dal rapporto [ b ] [ a ] Questo rapporto, come si è visto, dipende dal ph; esso, comunque, essendo il rapporto tra due concentrazioni di equilibrio dell acido e della base coniugata, non dipende dalla concentrazione totale dell indicatore. Pertanto, anche l intervallo di viraggio dell indicatore bicolore non dipende dalla quantità di indicatore che si usa. Nel caso invece di un indicatore monocromatico, in cui una sola delle due forme è colorata (p.es. fenolftaleina), il colore della soluzione dipende dalla concentrazione della sola specie colorata ([b] nel caso della fenolftaleina) E evidente che la concentrazione all equilibrio di b dipende dal ph ma anche dalla concentrazione totale di indicatore che si usa; pertanto anche l intervallo di viraggio, in questo caso, dipenderà dalla concentrazione di indicatore che si usa. Così, se per una data concentrazione di fenolftaleina il colore rosa compare a ph=9, con una concentrazione 10 volte maggiore la stessa intensità di colore si osserverà a ph=8. 5. Preparazione della soluzione madre Si è detto, in un paragrafo precedente, che la titolazione consente di determinare la concentrazione incognita di una soluzione (titolando) da misure di volume (di titolando e di titolante). Tuttavia, per poter applicare la (2), è necessario conoscere c A, cioè la concentrazione del titolante. Questa, ovviamente, può a sua volta essere determinata per titolazione con una soluzione che, a sua volta, deve avere concentrazione nota. Si capisce bene, quindi, che ad un certo punto è necessario effettuare una titolazione usando, come titolante, una soluzione la cui concentrazione sia nota accuratamente non attraverso una titolazione ma in altro modo. Tale soluzione si dice soluzione madre, e la sostanza che essa contiene si dice sostanza madre o standard primario. Tipicamente, una soluzione madre viene preparata per pesata (alla bilancia analitica) della sostanza madre e successiva diluizione in matraccio tarato. Usando una bilancia analitica (errore di ± 0.1mg) ed un matraccio tarato da 200 ml (errore ± 0.3 ml) sappiamo che la concentrazione può essere determinata con errore relativo di ± 0.1%, quindi con grande accuratezza (errore assoluto di ± su una soluzione M). Perché ciò possa realmente accadere, tuttavia, la sostanza madre deve avere certi requisiti, come ad esempio a) elevata purezza; b) possibilità di essere pesata accuratamente (quindi, ad esempio, non deve essere igroscopica). La sostanza, inoltre, deve avere caratteristiche chimiche che rendano la sua titolazione eseguibile in modo accurato (errore di titolazione basso). Quando tutti questi requisiti sono soddisfatti la sostanza è effettivamente una sostanza madre. Le analisi per titolazioni acido-base si suddividono in acidimetria e alcalimetria. La acidimetria è la determinazione del contenuto in alcali di un campione, e si effettua disponendo di una soluzione a titolo noto di un acido forte (titolante), di solito acido cloridrico; la alcalimetria, invece, è la determinazione del contenuto in acidi di un campione, e si effettua usando una soluzione a titolo noto di una base forte (titolante), di solito idrossido di sodio. La operazione attraverso la quale viene stabilito il titolo, cioè l esatta concentrazione della soluzione di titolante, viene detta standardizzazione. E evidente che nel caso della acidimetria, che è quello che noi considereremo, la sostanza madre necessaria per standardizzare il titolante, cioè la soluzione di HCl, sarà una base. Una delle sostanze madri più usate per standardizzare soluzioni di acido cloridrico è il bicarbonato di potassio KHCO 3. In questo caso, al punto equivalente si ha una soluzione di acido carbonico, e quindi ci si deve aspettare un ph acido. Si può calcolare che per concentrazioni di bicarbonato dell ordine di 0.1 M il ph del punto equivalente cade intorno a 5. L indicatore adatto è il verde di bromocresolo (viraggio 5
6 dal giallo al blu tra ph 4.0 e 5.6). L accuratezza della determinazione è grandemente migliorata se, arrivati al punto finale, viene scacciata la CO 2 formatasi a seguito della neutralizzazione dell acido. Iinfatti, la CO 2 formatasi in seguito alla neutralizzazione del bicarbonato non ci serve e può essere eliminata; la sua presenza nel sistema, anzi, è dannosa, perché, trattandosi di un acido, può falsare il viraggio dell indicatore, determinando quindi un maggiore errore di titolazione. E chiaro che questo capita sempre, quando la reazione di neutralizzazione porta ad un prodotto che può dare idrolisi; tuttavia, non sempre tale prodotto può essere allontanato dal sistema di reazione. Quando ciò può farsi, come nel caso in esame, la determinazione è molto più accurata. Così, ad esempio, la titolazione dell acetato ( K b 10 9 ) con acido forte, per esempio titolazione di acetato di sodio con acido cloridrico, dà un grande errore di titolazione perché, quando quasi tutto lo ione acetato è stato neutralizzato, si è formato acido acetico che è un acido abbastanza forte ( K a 10 5 ) da far virare l indicatore prima che tutto l acetato venga titolato. Al contrario, la titolazione di acido acetico ( K a 10 5 ) con base forte, NaOH, è accurata perché quando quasi tutto l acido è stato titolato, la base che si è formata, lo ione acetato, è troppo debole ( K b 10 9 ) per influenzare significativamente il ph e quindi il viraggio dell indicatore. In definitiva, l errore di titolazione è tanto più basso quanto maggiore è la forza del protolita che viene titolato. Ciò proprio perché, in tal modo, poco prima del punto equivalente, cioè quando la concentrazione della forma coniugata del protolita da titolare è alta, la sua influenza sul viraggio è bassa, trattandosi di protolita debole, in quanto coniugato di uno forte. Sistema CO 2 / HCO 3 /CO 2 3 : calcolo di equilibri protolitici Occorre tenere presente che, a P e T ambienti, meno dell 1 % della CO 2 totale presente in soluzione si trasforma in H 2 CO 3, sicché la specie da considerare per gli equilibri è proprio la CO 2. CO 2 +2H 2 O=H 3 O + +HCO 3 K 1 = HCO 3 +H 2 O=H 3 O (7) +CO 3 K 2 = Il calcolo del ph di una soluzione di CO 2, per esempio 0.1 M, si fà considerando separatamente i due equilibri, dato che le due costanti differiscono di 4 ordini di grandezza. Il risultato è ph = 3.7. Per il calcolo del ph di una soluzione di bicarbonato, occorre considerare i due equilibri HCO 3 +H 2 O=H 3 O + 2 +CO 3 K 2 = H 3 O + +HCO (8) 3 =CO 2 +2H 2 O K=1 /K 1 Sommando membro a membro si ha 2 HCO 2 3 =CO 2 +H 2 O+CO 3 K 3 =K 2 / K 1 = Si calcolano, applicando questo equilibrio, le concentrazioni di CO 2, HCO 3, CO 3 2. Conoscendo queste concentrazioni si può calcolare la concentrazione di H 3 O + e quindi il ph, applicando uno qualsiasi dei due equilibri (7). 6
A fine titolazione la concentrazione iniziale della soluzione da titolare risulta essere stata pari a:
 Titolazione acido-base Nella pratica di laboratorio è frequente la determinazione del ph incognito di una soluzione. Pensiamo ad esempio di voler conoscere il ph di un campione acquoso derivante da uno
Titolazione acido-base Nella pratica di laboratorio è frequente la determinazione del ph incognito di una soluzione. Pensiamo ad esempio di voler conoscere il ph di un campione acquoso derivante da uno
SOLUZIONI TAMPONE SOLUZIONI TAMPONE
 SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
Misure di ph e titolazione acidobase con metodo potenziometrico
 - Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
- Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + +
 Ionizzazione dell Acqua e ph In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + + L acqua è una sostanza anfiprotica, cioè può sia donare che accettare protoni (ioni H + ). Costante
Ionizzazione dell Acqua e ph In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + + L acqua è una sostanza anfiprotica, cioè può sia donare che accettare protoni (ioni H + ). Costante
CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq) + H 2 O (l)
 2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
20/03/2014 ANALISI VOLUMETRICA ACIDO-BASE PRECIPITAZIONE COMPLESSOMETRICA OSSIDO-RIDUZIONE REQUISITI PER UNA TITOLAZIONE
 ANALISI VOLUMETRICA ACIDO-BASE PRECIPITAZIONE COMPLESSOMETRICA OSSIDO-RIDUZIONE In una titolazione l analita reagisce con un reagente addizionato sotto forma di una soluzione di concentrazione nota (soluzione
ANALISI VOLUMETRICA ACIDO-BASE PRECIPITAZIONE COMPLESSOMETRICA OSSIDO-RIDUZIONE In una titolazione l analita reagisce con un reagente addizionato sotto forma di una soluzione di concentrazione nota (soluzione
Dispense di Analisi Volumetrica
 Dispense di Analisi Volumetrica IIS Gobetti - Marchesini Casale sezione Tecnica Chimica e Materiali Analisi chimica, elaborazione dati e Laboratorio L analisi volumetrica è la procedura o il metodo analitico
Dispense di Analisi Volumetrica IIS Gobetti - Marchesini Casale sezione Tecnica Chimica e Materiali Analisi chimica, elaborazione dati e Laboratorio L analisi volumetrica è la procedura o il metodo analitico
1.2.5 Titolazioni acido-base
 1.2.5 Titolazioni acidobase Queste titolazioni si basano su reazioni di neutralizzazione in cui un acido cede un protone ad una base capace di accettarlo. Nel caso più semplice di un acido forte (es. HCl)
1.2.5 Titolazioni acidobase Queste titolazioni si basano su reazioni di neutralizzazione in cui un acido cede un protone ad una base capace di accettarlo. Nel caso più semplice di un acido forte (es. HCl)
Titolazioni Acido-Base
 Titolazioni Acido-Base Queste slides riportano materiale gentilmente concesso dal Dr. alerio Di Marco- Dip. Scienze Chimiche Univ. Padova Le titolazioni acid base permettono di misurare la concentrazione
Titolazioni Acido-Base Queste slides riportano materiale gentilmente concesso dal Dr. alerio Di Marco- Dip. Scienze Chimiche Univ. Padova Le titolazioni acid base permettono di misurare la concentrazione
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 22 Acidi e basi si scambiano protoni 3 Sommario 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. La forza
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 22 Acidi e basi si scambiano protoni 3 Sommario 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. La forza
Note sulle titolazioni acidimetriche e alcalimetriche di campioni reali e sui calcoli preliminari e successivi
 Note sulle titolazioni acidimetriche e alcalimetriche di campioni reali e sui calcoli preliminari e successivi SUCCO DI LIMONE (Acido Citrico) Il succo di limone contiene acido citrico, ed è questa sostanza
Note sulle titolazioni acidimetriche e alcalimetriche di campioni reali e sui calcoli preliminari e successivi SUCCO DI LIMONE (Acido Citrico) Il succo di limone contiene acido citrico, ed è questa sostanza
ANALISI VOLUMETRICA. si misura il volume di reagente richiesto dalla reazione con l analita TITOLAZIONI
 ANALISI VOLUMETRICA si misura il volume di reagente richiesto dalla reazione con l analita Metodi volumetrici TITOLAZIONI in una titolazione, si aggiungono aliquote di soluzione di reagente a concentrazione
ANALISI VOLUMETRICA si misura il volume di reagente richiesto dalla reazione con l analita Metodi volumetrici TITOLAZIONI in una titolazione, si aggiungono aliquote di soluzione di reagente a concentrazione
Esperienza n 3: Determinazione del grado di acidità dell aceto commerciale
 Esperienza n : Determinazione del grado di acidità dell aceto commerciale Obiettivo: determinare il grado di acidità di un aceto commerciale tramite titolazione con una soluzione di NaOH a titolo noto
Esperienza n : Determinazione del grado di acidità dell aceto commerciale Obiettivo: determinare il grado di acidità di un aceto commerciale tramite titolazione con una soluzione di NaOH a titolo noto
METODI GRAVIMETRICI DI ANALISI
 METODI GRAVIMETRICI DI ANALISI I metodi gravimetrici si basano sulla misura della massa e sono sostanzialmente di due tipi: - nei metodi di precipitazione l analita viene trasformato in un precipitato
METODI GRAVIMETRICI DI ANALISI I metodi gravimetrici si basano sulla misura della massa e sono sostanzialmente di due tipi: - nei metodi di precipitazione l analita viene trasformato in un precipitato
Titolazioni acido- base
 Titolazioni acido- base 1. Titolazione di un acido forte con una base forte : HCl (aq) + NaOH (aq) (a cura di Giuliano Moretti) Escludendo le specie spettatrici la reazione che descrive la titolazione
Titolazioni acido- base 1. Titolazione di un acido forte con una base forte : HCl (aq) + NaOH (aq) (a cura di Giuliano Moretti) Escludendo le specie spettatrici la reazione che descrive la titolazione
1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di
 Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
EQUILIBRI ACIDO-BASE: ESERCIZI RISOLTI. Dott. Francesco Musiani
 EQUILIBRI ACIDO-BASE: ESERCIZI RISOLTI Dott. Francesco Musiani Versione aggiornata al 23.1.2017 1 - Calcolare il poh di soluzioni aventi le seguenti concentrazioni di H 3 O + : 1) 3,1 10-2 M; 2) 1,0 10-4
EQUILIBRI ACIDO-BASE: ESERCIZI RISOLTI Dott. Francesco Musiani Versione aggiornata al 23.1.2017 1 - Calcolare il poh di soluzioni aventi le seguenti concentrazioni di H 3 O + : 1) 3,1 10-2 M; 2) 1,0 10-4
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE
 Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
H N. Mn 2+ +.. Fe 3+ +.. H 2 O
 CHIMICA ANALITICA- PROVA SCRITTA 3 FEBBRAIO 2005-1a. Quanti microlitri di 1-nonene (densità 1-nonene = 0.73 g/ml) bisogna prelevare per preparare 50 ml di soluzione di concentrazione 1000 ppm in metanolo
CHIMICA ANALITICA- PROVA SCRITTA 3 FEBBRAIO 2005-1a. Quanti microlitri di 1-nonene (densità 1-nonene = 0.73 g/ml) bisogna prelevare per preparare 50 ml di soluzione di concentrazione 1000 ppm in metanolo
Argomento Titolazione volumetrica acido-base. Target
 Argomento Titolazione volumetrica acido-base Target Università- Corso di Chimica Analitica Quantitativa Obiettivi: Applicazione del concetto di equilibrio acido-base all analisi quantitativa; Acquisizione
Argomento Titolazione volumetrica acido-base Target Università- Corso di Chimica Analitica Quantitativa Obiettivi: Applicazione del concetto di equilibrio acido-base all analisi quantitativa; Acquisizione
Determinazione percentuale di CaCO3 in un guscio d uovo.
 Determinazione percentuale di CaCO3 in un guscio d uovo. Il CaCO3 presente nel guscio d uovo reagisce con l acido cloridrico secondo la seguente reazione chimica: CaCO3 + 2HCl CaCl2 + H2CO3 Carbonato di
Determinazione percentuale di CaCO3 in un guscio d uovo. Il CaCO3 presente nel guscio d uovo reagisce con l acido cloridrico secondo la seguente reazione chimica: CaCO3 + 2HCl CaCl2 + H2CO3 Carbonato di
ESERCITAZIONI ) Standardizzazione di una soluzione di HCl mediante Na 2 CO 3 2) Dosaggio dei carbonati mediante titolazione con HCl
 ESERCITAZIONI 4+5 1) Standardizzazione di una soluzione di HCl mediante Na 2 2) Dosaggio dei carbonati mediante titolazione con HCl Viene eseguita in primo luogo la standardizzazione di una soluzione di
ESERCITAZIONI 4+5 1) Standardizzazione di una soluzione di HCl mediante Na 2 2) Dosaggio dei carbonati mediante titolazione con HCl Viene eseguita in primo luogo la standardizzazione di una soluzione di
FORZA DI ACIDI E BASI HA + :B HB + + A
 FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
Corso di Laboratorio Integrato di Chimica Generale BIOTEC-2011 Esercizi Svolti su Equilibri acido-base
 Corso di Laboratorio Integrato di Chimica Generale BIOTEC2011 Esercizi Svolti su Equilibri acidobase 1. Quanto vale il ph di una soluzione 0.1 M di CO 2 se si ritiene che essa non esiste più come tale
Corso di Laboratorio Integrato di Chimica Generale BIOTEC2011 Esercizi Svolti su Equilibri acidobase 1. Quanto vale il ph di una soluzione 0.1 M di CO 2 se si ritiene che essa non esiste più come tale
CORSO DI CHIMICA PER L AMBIENTE. Lezione del 5 Maggio 2016
 CORSO DI CHIMICA PER L AMBIENTE Lezione del 5 Maggio 2016 Sali Acidi o Basici La neutralità acido-base dell acqua può essere alterata anche dal discioglimento di alcuni sali. Prendiamo ad esempio NH 4
CORSO DI CHIMICA PER L AMBIENTE Lezione del 5 Maggio 2016 Sali Acidi o Basici La neutralità acido-base dell acqua può essere alterata anche dal discioglimento di alcuni sali. Prendiamo ad esempio NH 4
FOCUS SU EQUILIBRI ACIDO-BASE
 1 Ci sono varie definizioni di acidi e basi, tra le quali meritano di essere ricordate quella di Bronsted e quella di Lewis. Per i nostri fini pratici, ovvero gli esercizi, ci basta però ricordare le definizioni
1 Ci sono varie definizioni di acidi e basi, tra le quali meritano di essere ricordate quella di Bronsted e quella di Lewis. Per i nostri fini pratici, ovvero gli esercizi, ci basta però ricordare le definizioni
Esercitazione 1 PEROSSIDI IN OLIO D OLIVA
 Esercitazione 1 TITOLAZIONE ACIDO ACETICO IN ACETO E PEROSSIDI IN OLIO D OLIVA Acido acetico in aceto 2 L esperienza consiste nel misurare il grado di acidità di un aceto. L'aceto è una soluzione acquosa
Esercitazione 1 TITOLAZIONE ACIDO ACETICO IN ACETO E PEROSSIDI IN OLIO D OLIVA Acido acetico in aceto 2 L esperienza consiste nel misurare il grado di acidità di un aceto. L'aceto è una soluzione acquosa
ESERCIZI SUL ph 3 0,002 0,2 13. 2. Completa la seguente tabella relativa a acidi o basi deboli.
 ESERCIZI SUL ph Livello difficoltà 1 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2. Completa la seguente tabella relativa a acidi o basi
ESERCIZI SUL ph Livello difficoltà 1 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2. Completa la seguente tabella relativa a acidi o basi
TITOLAZIONE ACIDO BASE
 INTRODUZIONE. Analisi volumetrica TITOLAZIONE ACIDO BASE L analisi volumetrica è la procedura o il metodo analitico secondo cui è possibile risalire al titolo (Concentrazione) di un analita in soluzione
INTRODUZIONE. Analisi volumetrica TITOLAZIONE ACIDO BASE L analisi volumetrica è la procedura o il metodo analitico secondo cui è possibile risalire al titolo (Concentrazione) di un analita in soluzione
Esperienza n. 3. Analisi di una miscela di NaHCO 3 e Na 2 CO 3
 Esperienza n. 3 Laboratorio di Chimica Analisi di una miscela di NaHCO 3 e Na 2 CO 3 OBBIETTIVI Lo scopo di questa esperienza è quello di risalire alla composizione percentuale di una miscela di carbonato
Esperienza n. 3 Laboratorio di Chimica Analisi di una miscela di NaHCO 3 e Na 2 CO 3 OBBIETTIVI Lo scopo di questa esperienza è quello di risalire alla composizione percentuale di una miscela di carbonato
NH 3 + H 2 O NH. Gli OH - sono solo quelli provenienti dalla base, perché quelli dell acqua sono molto pochi.
 D71 La costante di dissociazione ionica dell ammoniaca in acqua è uguale a 1.8 10 5. Determinare (a) il grado di dissociazione e (b) la concentrazione in ioni OH d una soluzione di NH 3 0.08 M. NH 3 +
D71 La costante di dissociazione ionica dell ammoniaca in acqua è uguale a 1.8 10 5. Determinare (a) il grado di dissociazione e (b) la concentrazione in ioni OH d una soluzione di NH 3 0.08 M. NH 3 +
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 17 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 17 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione
TITOLAZIONE ACIDO-BASE PER VIA POTENZIOMETRICA
 TITOLAZIONE ACIDO-BASE PER VIA POTENZIOMETRICA La variazione di ph vs V titolante viene seguita per via potenziometrica impiegando un elettrodo sensibile al ph elettrodo a vetro collegato ad un phmetro.
TITOLAZIONE ACIDO-BASE PER VIA POTENZIOMETRICA La variazione di ph vs V titolante viene seguita per via potenziometrica impiegando un elettrodo sensibile al ph elettrodo a vetro collegato ad un phmetro.
Corso di Laurea triennale in Chimica
 Università degli Studi di Cagliari Corso di Laurea triennale in Chimica Chimica Analitica I e Laboratorio 1 (Modulo A) CFU 6 Docente Prof. Davide Atzei SSD CHIM/01 Tel. +39 070 675 4460 Fa. +39 070 675
Università degli Studi di Cagliari Corso di Laurea triennale in Chimica Chimica Analitica I e Laboratorio 1 (Modulo A) CFU 6 Docente Prof. Davide Atzei SSD CHIM/01 Tel. +39 070 675 4460 Fa. +39 070 675
Soluzioni tampone. Se ad un litro di acqua pura (ph=7) vengono aggiunte 0,01 moli di HCl il ph varia da 7 a 2 (ph=-log(0,01) =2,0), ovvero di 5 unità.
 Soluzioni tampone Se ad un litro di acqua pura (ph=7) vengono aggiunte 0,01 moli di HCl il ph varia da 7 a 2 (ph=-log(0,01) =2,0), ovvero di 5 unità. Un tampone è una soluzione che varia in maniera trascurabile
Soluzioni tampone Se ad un litro di acqua pura (ph=7) vengono aggiunte 0,01 moli di HCl il ph varia da 7 a 2 (ph=-log(0,01) =2,0), ovvero di 5 unità. Un tampone è una soluzione che varia in maniera trascurabile
FORMULARIO DI CHIMICA
 ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
Parti svolte dal libro di testo Chimica Analitica Quantitativa
 PROGRAMMA DEL CORSO DI CHIMICA ANALITICA 1 CON LABORATORIO a.a. 2007-2008 E stato seguito il testo: Daniel C. Harris, Chimica Analitica Quantitativa, Seconda Edizione Italiana, Ed. Zanichelli, 2005 mentre
PROGRAMMA DEL CORSO DI CHIMICA ANALITICA 1 CON LABORATORIO a.a. 2007-2008 E stato seguito il testo: Daniel C. Harris, Chimica Analitica Quantitativa, Seconda Edizione Italiana, Ed. Zanichelli, 2005 mentre
Equilibri Acido Base e ph
 Equilibri Acido Base e ph Definizioni di Acido e Base Secondo la teoria di Arrhenius, un acido è una sostanza che dissociandosi in acqua libera ioni H +, una base è invece una sostanza che dissociandosi
Equilibri Acido Base e ph Definizioni di Acido e Base Secondo la teoria di Arrhenius, un acido è una sostanza che dissociandosi in acqua libera ioni H +, una base è invece una sostanza che dissociandosi
+ NO 2 + 3H 2 O = Ce +3 + NO 3 + 2H 3 O +, b) 0.478 g
 1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
PROVA PRATICA GARA NAZIONALE DI CHIMICA
 Via Luosi n. 23 41124 Modena Tel: 059211092 059236398 Fax: 059226478 E-mail: info@fermi.mo.it Pagina web: www.fermi.mo.it GARA NAZIONALE DI CHIMICA XII EDIZIONE ISTITUTI TECNICI INDUSTRIALI INDIRIZZO CHIMICO
Via Luosi n. 23 41124 Modena Tel: 059211092 059236398 Fax: 059226478 E-mail: info@fermi.mo.it Pagina web: www.fermi.mo.it GARA NAZIONALE DI CHIMICA XII EDIZIONE ISTITUTI TECNICI INDUSTRIALI INDIRIZZO CHIMICO
ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA ] / [H 2 PO 4- ] HPO 4
![ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA ] / [H 2 PO 4- ] HPO 4 ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA ] / [H 2 PO 4- ] HPO 4](/thumbs/55/35880910.jpg) ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA Si titola con NaOH. H 3 PO 4 H + + H 2 PO 4 - K a1 = 1.1 x 10-2 = [H + ] [H 2 PO 4- ] / [H 3 PO 4 ] H 2 PO 4- H + + HPO 4 2- K a2 = 7.5
ESERCITAZIONE N 1 DETERMINAZIONE DI ACIDO FOSFORICO NELLA COCA-COLA Si titola con NaOH. H 3 PO 4 H + + H 2 PO 4 - K a1 = 1.1 x 10-2 = [H + ] [H 2 PO 4- ] / [H 3 PO 4 ] H 2 PO 4- H + + HPO 4 2- K a2 = 7.5
EQUILIBRI DI SOLUBILITA
 EQUILIBRI DI SOLUBILITA Solubilità In generale solo una quantità finita di un solido si scioglie in un dato volume di solvente dando luogo ad una soluzione satura, cioè una soluzione in equilibrio con
EQUILIBRI DI SOLUBILITA Solubilità In generale solo una quantità finita di un solido si scioglie in un dato volume di solvente dando luogo ad una soluzione satura, cioè una soluzione in equilibrio con
AUTOIONIZZAZIONE DELL ACQUA
 AUTOIONIZZAZIONE DELL ACQUA H 2 O si comporta da acido e da base anfiprotica CH 3 COOH + H 2 O CH 3 COO - + H 3 O + NH 3 +H 2 O NH 4 + + OH - A1 B2 H 2 O + H 2 O H 3 O + + OH - B1 A1 K eq [ H O ][ OH 3
AUTOIONIZZAZIONE DELL ACQUA H 2 O si comporta da acido e da base anfiprotica CH 3 COOH + H 2 O CH 3 COO - + H 3 O + NH 3 +H 2 O NH 4 + + OH - A1 B2 H 2 O + H 2 O H 3 O + + OH - B1 A1 K eq [ H O ][ OH 3
DETERMINAZIONE della MASSA di ACIDO ACETICO PRESENTE in un 1 L di ACETO
 DETERMINAZIONE della MASSA di ACIDO ACETICO PRESENTE in un 1 L di ACETO OBIETTIVO: determinare i grammi di acido acetico presenti in 1 litro di aceto comune (concentrazione in g/l). Approccio al problema:
DETERMINAZIONE della MASSA di ACIDO ACETICO PRESENTE in un 1 L di ACETO OBIETTIVO: determinare i grammi di acido acetico presenti in 1 litro di aceto comune (concentrazione in g/l). Approccio al problema:
1. Calcolare il peso equivalente di ognuno dei seguenti acidi e basi, assumendo la neutralizzazione completa: H 2 SO 3, H 3 PO 4, LiOH, Zn(OH) 2.
 1. Calcolare il peso equivalente di ognuno dei seguenti acidi e basi, assumendo la neutralizzazione completa: H 2 SO 3, H 3 PO 4, LiOH, Zn(OH) 2. H 2 SO 3 Pm = 2 1 + 32 + 16 3 = 82 H 3 PO 4 Pm = 3 1 +
1. Calcolare il peso equivalente di ognuno dei seguenti acidi e basi, assumendo la neutralizzazione completa: H 2 SO 3, H 3 PO 4, LiOH, Zn(OH) 2. H 2 SO 3 Pm = 2 1 + 32 + 16 3 = 82 H 3 PO 4 Pm = 3 1 +
Teoria di Lewis. Un acido di Lewis è una specie chimica che può formare un legame covalente accettando una coppia di elettroni da un altra specie.
 Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Acidi e basi di Brønsted: richiami
 Acidi e basi di Brønsted: richiami Un acido è una sostanza che può cedere protoni Una base è una sostanza che può accettare protoni. Un acido è forte se in soluzione tutte le molecole dell'acido cedono
Acidi e basi di Brønsted: richiami Un acido è una sostanza che può cedere protoni Una base è una sostanza che può accettare protoni. Un acido è forte se in soluzione tutte le molecole dell'acido cedono
L equilibrio dell acqua
 L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
Acidi e basi ph, costanti di acidità e basicità Idrolisi, soluzioni tampone
 Acidi e basi ph, costanti di acidità e basicità Idrolisi, soluzioni tampone Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental
Acidi e basi ph, costanti di acidità e basicità Idrolisi, soluzioni tampone Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental
ph e indicatori acido-base
 ph e indicatori acido-base La dissociazione ionica dell acqua H 2 O + H 2 O OH - + H 3 O + acido base base acido coniugata coniugato 2 H 2 O (l) OH - (aq) + H 3 O + (aq) Il numero di molecole di acqua
ph e indicatori acido-base La dissociazione ionica dell acqua H 2 O + H 2 O OH - + H 3 O + acido base base acido coniugata coniugato 2 H 2 O (l) OH - (aq) + H 3 O + (aq) Il numero di molecole di acqua
ESTRAZIONE CO. Scopo. Strumenti e sostanze. Principi teorici. Metodica. Calcoli. Malboro gold
 ESTRAZIONE CO Scopo Determinare i milligrammi di CO all interno di una sigaretta Strumenti e sostanze STRUMENTI: Becher, buretta, beuta, pipetta, matraccio, cappa, bilancia, bacchetta di vetro, ragno.
ESTRAZIONE CO Scopo Determinare i milligrammi di CO all interno di una sigaretta Strumenti e sostanze STRUMENTI: Becher, buretta, beuta, pipetta, matraccio, cappa, bilancia, bacchetta di vetro, ragno.
Preparazione di soluzioni a titolo approssimato e a titolo noto
 Esperienza n. 1 Laboratorio di Chimica Generale Preparazione di soluzioni a titolo approssimato e a titolo noto OBBIETTIVI Lo scopo di questa esperienza è quello di preparare una soluzione a concentrazione
Esperienza n. 1 Laboratorio di Chimica Generale Preparazione di soluzioni a titolo approssimato e a titolo noto OBBIETTIVI Lo scopo di questa esperienza è quello di preparare una soluzione a concentrazione
TITOLAZIONI TITOLAZIONI ACIDO-BASE
 TITOLAZIONI TITOLAZIONI ACIDO-BASE titolazione nella quale sono coinvolti un acido e una base. La reazione generica è la seguente: Ac1 + Bas2 Ac2 + Bas1 con produzione della base e dell acido coniugato.
TITOLAZIONI TITOLAZIONI ACIDO-BASE titolazione nella quale sono coinvolti un acido e una base. La reazione generica è la seguente: Ac1 + Bas2 Ac2 + Bas1 con produzione della base e dell acido coniugato.
ANALISI CHIMICO FARMACEUTICA I. Impieghi di acidimetria e alcalimetria nella EUROPEAN PHARMACOPOEIA 6.0
 Impieghi di acidimetria e alcalimetria nella EUROPEAN PHARMACOPOEIA 6.0 SODIO CARBONATO ANIDRO SODIUM CARBONATE, ANHYDROUS Natrii carbonas anhydricus DETERMINAZIONE QUANTITATIVA Disciogliere 1,000 g in
Impieghi di acidimetria e alcalimetria nella EUROPEAN PHARMACOPOEIA 6.0 SODIO CARBONATO ANIDRO SODIUM CARBONATE, ANHYDROUS Natrii carbonas anhydricus DETERMINAZIONE QUANTITATIVA Disciogliere 1,000 g in
mentre l'acetato di sodio si dissocia completamente:
 Un sistema tampone è un sistema che impedisce (o attuisce) significative variazioni di ph per aggiunta di limitate quantità di acidi o basi. Per poter funzionare in entrambi le direzioni, cioè neutralizzare
Un sistema tampone è un sistema che impedisce (o attuisce) significative variazioni di ph per aggiunta di limitate quantità di acidi o basi. Per poter funzionare in entrambi le direzioni, cioè neutralizzare
Intervallo di fiducia del coefficiente angolare e dell intercetta L intervallo di fiducia del coefficiente angolare (b 1 ) è dato da:
 Analisi chimica strumentale Intervallo di fiducia del coefficiente angolare e dell intercetta L intervallo di fiducia del coefficiente angolare (b 1 ) è dato da: (31.4) dove s y è la varianza dei valori
Analisi chimica strumentale Intervallo di fiducia del coefficiente angolare e dell intercetta L intervallo di fiducia del coefficiente angolare (b 1 ) è dato da: (31.4) dove s y è la varianza dei valori
Miscele acido forte + acido debole
 Curve di )tolazione: come cambiano al variare della molarità dei reagen)? Miscele acido forte + acido debole Titolazioni di neutralizzazione: standard primari Per standardizzare una soluzione di /tolante
Curve di )tolazione: come cambiano al variare della molarità dei reagen)? Miscele acido forte + acido debole Titolazioni di neutralizzazione: standard primari Per standardizzare una soluzione di /tolante
DETERMINAZIONI. Acido Citrico. Ka 1 = 4, Ka 2 = 4, Ka 3 = 8,0 10-6
 DETERMINAZIONI Acido Citrico Acido organico tricarbossilico, con costanti acide vicine tra loro; quindi non è possibile dosare i tre protoni separatamente, ma vengono COOH OH COOH COOH PM 192,1 Ka 1 =
DETERMINAZIONI Acido Citrico Acido organico tricarbossilico, con costanti acide vicine tra loro; quindi non è possibile dosare i tre protoni separatamente, ma vengono COOH OH COOH COOH PM 192,1 Ka 1 =
Determinazione dell ACIDITA dell OLIO D 0LIVA
 LABORATORIO INDUSTRIE AGRARIE Istituto d Istruzione Superiore G.Cantoni Treviglio (Bergamo) Unità Didattica: Determinazione dell ACIDITA dell OLIO D 0LIVA a.s. 2011-2012 L acidità è un parametro che indica
LABORATORIO INDUSTRIE AGRARIE Istituto d Istruzione Superiore G.Cantoni Treviglio (Bergamo) Unità Didattica: Determinazione dell ACIDITA dell OLIO D 0LIVA a.s. 2011-2012 L acidità è un parametro che indica
MA + H + MAH + Materiale: 500 cc di soluzione di NaOH 0.01 M 500 cc di soluzione di HCl 0.01 M fresca Metil-arancio (MA) Etanolo Acqua distillata
 Cambiamenti nell aspetto degli spettri di assorbimento elettronico del metilarancio in funzione del ph a seguito della reazione di protonazione del metilarancio. Scopo dell esperimento è osservare la variazione
Cambiamenti nell aspetto degli spettri di assorbimento elettronico del metilarancio in funzione del ph a seguito della reazione di protonazione del metilarancio. Scopo dell esperimento è osservare la variazione
 EQUILIBRI ACIDO-BASE Trattamento grafico Diagrammi Logaritmici Costruzione della matrice comune a tutti i diagrammi logaritmici: Per definizione, log [H 3 O + ] = ph e log [OH ] = ph 14, per cui log [H
EQUILIBRI ACIDO-BASE Trattamento grafico Diagrammi Logaritmici Costruzione della matrice comune a tutti i diagrammi logaritmici: Per definizione, log [H 3 O + ] = ph e log [OH ] = ph 14, per cui log [H
Corso di: Chimica Analitica con Elementi di statistica
 Esercizio 1 Ad una soluzione di FeCl 3 0.1 M viene aggiunto ossalato di potassio; sapendo che si formano i complessi di tipo ML, ML 2 ed ML 3 e che le costanti di formazione globali sono: β = 3.8 10 ;
Esercizio 1 Ad una soluzione di FeCl 3 0.1 M viene aggiunto ossalato di potassio; sapendo che si formano i complessi di tipo ML, ML 2 ed ML 3 e che le costanti di formazione globali sono: β = 3.8 10 ;
SOLUZIONI e DILUIZIONI
 SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
SOLUZIONI e DILUIZIONI Introduzione In chimica viene definita soluzione un sistema in cui due o più sostanze formano un miscuglio omogeneo. Nella maggior parte dei casi una soluzione è costituita da due
Antilogaritmo (logaritmo inverso) Log N = N =antilogaritmo =
 RICHIAMO SUI LOGARITMI Log N= logaritmo di N= esponente x al quale elevare la base 10, tale che: 10 x =N, ovvero: log N = x N=10 x Log 1 = log 10 0 =0 Log 10 = log 10 1 =0 Log 10-2 = -2 Antilogaritmo (logaritmo
RICHIAMO SUI LOGARITMI Log N= logaritmo di N= esponente x al quale elevare la base 10, tale che: 10 x =N, ovvero: log N = x N=10 x Log 1 = log 10 0 =0 Log 10 = log 10 1 =0 Log 10-2 = -2 Antilogaritmo (logaritmo
Acidi Poliprotici. Si definiscono acidi poliprotici, le sostanze in grado di donare più di un protone all acqua:
 Acidi Poliprotici Si definiscono acidi poliprotici, le sostanze in grado di donare più di un protone all acqua: Esempi: Acido solforico H SO >> 1, a 1. x1 Acido carbonico H O.5x1 7, a.69 x1 11 Acido fosforico
Acidi Poliprotici Si definiscono acidi poliprotici, le sostanze in grado di donare più di un protone all acqua: Esempi: Acido solforico H SO >> 1, a 1. x1 Acido carbonico H O.5x1 7, a.69 x1 11 Acido fosforico
ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione
![ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione](/thumbs/57/40353116.jpg) ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
Il Monossido di Di-Idrogeno
 Il Monossido di Di-Idrogeno Equilibri in Soluzione Acquosa In soluzione acquosa, per un equilibrio generico: + + La legge di azione di massa si scrive: = Si usano le concentrazioni molari dei soluti in
Il Monossido di Di-Idrogeno Equilibri in Soluzione Acquosa In soluzione acquosa, per un equilibrio generico: + + La legge di azione di massa si scrive: = Si usano le concentrazioni molari dei soluti in
Materiale occorrente: una bilancia tecnica; due matracci da 250 ml; una pipetta tarata con propipetta.
 Materiale occorrente: una bilancia tecnica; due matracci da 250 ml; una pipetta tarata con propipetta. Reattivi: acido acetico; acetato di sodio; idrossido di ammonio e cloruro di ammonio; acqua distillata.
Materiale occorrente: una bilancia tecnica; due matracci da 250 ml; una pipetta tarata con propipetta. Reattivi: acido acetico; acetato di sodio; idrossido di ammonio e cloruro di ammonio; acqua distillata.
TITOLAZIONI -ANALISI VOLUMETRICA
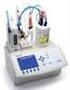 TITOLAZIONI -ANALISI VOLUMETRICA La titolazione è un metodo di analisi volumetrica (basata sulla misura di volumi) che consente di determinare la concentrazione di una soluzione a titolo incognito mediante
TITOLAZIONI -ANALISI VOLUMETRICA La titolazione è un metodo di analisi volumetrica (basata sulla misura di volumi) che consente di determinare la concentrazione di una soluzione a titolo incognito mediante
Gli equilibri di solubilità
 Gli equilibri di solubilità Abbiamo definito la solubilità come la concentrazione della soluzione satura, che è una soluzione il cui il composto in soluzione è in equilibrio con il composto indisciolto.
Gli equilibri di solubilità Abbiamo definito la solubilità come la concentrazione della soluzione satura, che è una soluzione il cui il composto in soluzione è in equilibrio con il composto indisciolto.
Tamponi biologici per il controllo del ph
 Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
Tamponi biologici per il controllo del ph 1 Si definisce una soluzione tampone una soluzione che si oppone alla variazione del ph per aggiunte moderate di acidi o basi Si tratta generalmente di soluzioni
24. PRECIPITAZIONE Prodotto di solubilità (K s )
 24. PRECIPITAZIONE D. In un racconto di Primo Levi, a proposito di un analisi chimica di campioni di roccia, si incontrano queste parole apparentemente prive di senso: «... giù il ferro con ammoniaca,
24. PRECIPITAZIONE D. In un racconto di Primo Levi, a proposito di un analisi chimica di campioni di roccia, si incontrano queste parole apparentemente prive di senso: «... giù il ferro con ammoniaca,
L EQUILIBRIO CHIMICO: EQUILIBRI IN FASE GASSOSA
 L EQUILIBRIO CHIMICO: EQUILIBRI IN FASE GASSOSA L equilibrio chimico può essere descritto in analogia all equilibrio fisico. Ad esempio l equilibrio liquido-vapore è descritto come la condizione particolare
L EQUILIBRIO CHIMICO: EQUILIBRI IN FASE GASSOSA L equilibrio chimico può essere descritto in analogia all equilibrio fisico. Ad esempio l equilibrio liquido-vapore è descritto come la condizione particolare
Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2
![Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2 Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2](/thumbs/57/40353351.jpg) Equilibri ionici in soluzione acquosa L acqua, anche se purissima, rivela una conducibilità elettrica piccola ma misurabile che indica la presenza di ioni. Una ridotta frazione di molecole di acqua è dissociata
Equilibri ionici in soluzione acquosa L acqua, anche se purissima, rivela una conducibilità elettrica piccola ma misurabile che indica la presenza di ioni. Una ridotta frazione di molecole di acqua è dissociata
P ARAMETRI FISICI, CHIMICI E CHIMICO-FISICI PARAMETRI FISICI, CHIMICI E CHIMICO-FISICI
 2000 - PARAMETRI FISICI, CHIMICI E CHIMICO-FISICI Questa parte prevede in primo luogo misure di parametri caratteristici delle proprietà fisiche, chimiche e chimico-fisiche di un campione. Alcune di queste
2000 - PARAMETRI FISICI, CHIMICI E CHIMICO-FISICI Questa parte prevede in primo luogo misure di parametri caratteristici delle proprietà fisiche, chimiche e chimico-fisiche di un campione. Alcune di queste
XVII ZOLFO. Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE. Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI
 XVII ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI XVII - ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE 1. Principio Il campione viene
XVII ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI XVII - ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE 1. Principio Il campione viene
PROPRIETA ACIDO-BASE DELLE SOLUZIONI SALINE
 PROPRIETA ACIDO-BASE DELLE SOLUZIONI SALINE Un sale è un solido ionico contenente un catione diverso da H + e un anione diverso da OH -. I sali sono degli elettroliti forti, cioè in acqua si dissociano
PROPRIETA ACIDO-BASE DELLE SOLUZIONI SALINE Un sale è un solido ionico contenente un catione diverso da H + e un anione diverso da OH -. I sali sono degli elettroliti forti, cioè in acqua si dissociano
1. Metodo di Mohr 2. Metodo di Volhard 3. Metodo di Fajans
 ARGENTOMETRIA I metodi argentometrici si basano sulla precipitazione di un sale d argento poco solubile. Come reattivo titolante si impiega una soluzione di AgNO 3. I principali metodi sono: 1. Metodo
ARGENTOMETRIA I metodi argentometrici si basano sulla precipitazione di un sale d argento poco solubile. Come reattivo titolante si impiega una soluzione di AgNO 3. I principali metodi sono: 1. Metodo
1) Bilanciare la seguente reazione redox con il metodo ionico-elettronico Ag (s) + H + (aq) + NO 3
 A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
A ) Soluzioni Esercizi I esonero del 29/11/2005 1) Bilanciare la seguente reazione redox con il metodo ionicoelettronico Ag (s) + + (aq) + N 3 (aq) Ag + (aq) + N 2 (g) + 2 (l) Calcolare quanti grammi di
Titolazione acido debole (diprotico)
 Titolazione acido debole (diprotico) Calcolo ph spontaneo (acido debole da solo) H 2 O + H 2 O H 3 O + + OH - H 2 B + H 2 O HB - + H 3 O + HB - + H 2 O B 2- + H 3 O + 5 incognite 5 equazioni indipendenti
Titolazione acido debole (diprotico) Calcolo ph spontaneo (acido debole da solo) H 2 O + H 2 O H 3 O + + OH - H 2 B + H 2 O HB - + H 3 O + HB - + H 2 O B 2- + H 3 O + 5 incognite 5 equazioni indipendenti
PIANO DI LAVORO ANNUALE
 PIANO DI LAVORO ANNUALE Classe 3B A.S. 2013/2014 Disciplina: CHIMICA ANALITICA E STRUMENTALE Docente: Prof. Ing Lorenzo Carara Ore settimanali: 4 (2) Libro di testo Rubino, Venzaghi, Cozzi - Stechio &
PIANO DI LAVORO ANNUALE Classe 3B A.S. 2013/2014 Disciplina: CHIMICA ANALITICA E STRUMENTALE Docente: Prof. Ing Lorenzo Carara Ore settimanali: 4 (2) Libro di testo Rubino, Venzaghi, Cozzi - Stechio &
EQUILIBRIO CHIMICO REAZIONI A TERMINE REAZIONI DI EQUILIBRIO 04/11/2015. Reazione: A B
 REAZIONI A TERMINE Reazione: A B REAZIONI DI EQUILIBRIO EQUILIBRIO CHIMICO L'equilibrio chimico è la condizione dipendente dalla temperatura in cui le concentrazioni delle specie chimiche che partecipano
REAZIONI A TERMINE Reazione: A B REAZIONI DI EQUILIBRIO EQUILIBRIO CHIMICO L'equilibrio chimico è la condizione dipendente dalla temperatura in cui le concentrazioni delle specie chimiche che partecipano
NOTE SULLE FUNZIONI CONVESSE DI UNA VARIABILE REALE
 NOTE SULLE FUNZIONI CONVESSE DI UNA VARIABILE REALE ROBERTO GIAMBÒ 1. DEFINIZIONI E PRIME PROPRIETÀ In queste note saranno presentate alcune proprietà principali delle funzioni convesse di una variabile
NOTE SULLE FUNZIONI CONVESSE DI UNA VARIABILE REALE ROBERTO GIAMBÒ 1. DEFINIZIONI E PRIME PROPRIETÀ In queste note saranno presentate alcune proprietà principali delle funzioni convesse di una variabile
IN QUESTA PROVA ANDREMO A DETERMINARE L ACIDITA DI UN CAMPIONE DI LATTE MEDIANTE UNA TITOLAZIONE ACIDO-BASE
 IN QUESTA PROVA ANDREMO A DETERMINARE L ACIDITA DI UN CAMPIONE DI LATTE MEDIANTE UNA TITOLAZIONE ACIDO-BASE Prima di passare però al procedimento vero e proprio è necessario fornire alcune definizioni
IN QUESTA PROVA ANDREMO A DETERMINARE L ACIDITA DI UN CAMPIONE DI LATTE MEDIANTE UNA TITOLAZIONE ACIDO-BASE Prima di passare però al procedimento vero e proprio è necessario fornire alcune definizioni
PROGRAMMAZIONE ANNUALE DI ANALISI CHIMICA
 ISTITUTO TECNICO INDUSTRIALE B. PASCAL PROGRAMMAZIONE ANNUALE DI ANALISI CHIMICA Anno scolastico 2012/13 Classi 4A chim Docenti prof.ssa Emilia Angelini prof.ssa Cristina Giacobbe Finalità Fornire le basi
ISTITUTO TECNICO INDUSTRIALE B. PASCAL PROGRAMMAZIONE ANNUALE DI ANALISI CHIMICA Anno scolastico 2012/13 Classi 4A chim Docenti prof.ssa Emilia Angelini prof.ssa Cristina Giacobbe Finalità Fornire le basi
Reazione tra due acidi
 Reazione tra due acidi Quando si mescolano due o più acidi la soluzione risulterà acida e il suo ph dipende dalla forza degli acidi considerati: Caso di due acidi forti: HCl (aq) H O (solv) = Cl (aq) H
Reazione tra due acidi Quando si mescolano due o più acidi la soluzione risulterà acida e il suo ph dipende dalla forza degli acidi considerati: Caso di due acidi forti: HCl (aq) H O (solv) = Cl (aq) H
M di acido formico (Ka =
 14 gennaio 2002 1. Calcolare quanti microlitri di soluzione 0.001 M di Pb 2+ (PA 207) devono essere prelevati per preparare una soluzione di concentrazione pari a 10 ppm e volume 50 ml. 2. Calcolare la
14 gennaio 2002 1. Calcolare quanti microlitri di soluzione 0.001 M di Pb 2+ (PA 207) devono essere prelevati per preparare una soluzione di concentrazione pari a 10 ppm e volume 50 ml. 2. Calcolare la
PROGRAMMAZIONE DISCIPLINARE D ISTITUTO a.s. 2015/2016
 ISIS"Giulio Natta" Bergamo pag. 1 di 7 Disciplina CHIMICA ANALITICA STRUMENTALE Classe 3^ Chimica, materiali e biotecnologie Articolazione: Chimica dei materiali COMPETENZE DI BASE DEL SECONDO BIENNIO
ISIS"Giulio Natta" Bergamo pag. 1 di 7 Disciplina CHIMICA ANALITICA STRUMENTALE Classe 3^ Chimica, materiali e biotecnologie Articolazione: Chimica dei materiali COMPETENZE DI BASE DEL SECONDO BIENNIO
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I - (aq) + NO 3
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: I (aq) + 3 (aq) + + (aq) I 2(s) + (g) + 2 (l). Calcolare i grammi di I 2 (s) che si ottengono se si formano
Reazioni Acido-Base. Corso di Chimica Generale CCS Ingegneria CHI-MAT A.A. 2015/2016 (I Semestre) LABORATORIO 2
 Corso di Chimica Generale CCS Ingegneria CHI-MAT A.A. 2015/2016 (I Semestre) LABORATORIO 2 Reazioni Acido-Base Prof. Dipartimento CMIC Giulio Natta https://corsi.chem.polimi.it/citterio/ filmati: Equilibri
Corso di Chimica Generale CCS Ingegneria CHI-MAT A.A. 2015/2016 (I Semestre) LABORATORIO 2 Reazioni Acido-Base Prof. Dipartimento CMIC Giulio Natta https://corsi.chem.polimi.it/citterio/ filmati: Equilibri
(1;1) y=2x-1. Fig. G4.1 Retta tangente a y=x 2 nel suo punto (1;1).
 G4 Derivate G4 Significato geometrico di derivata La derivata di una funzione in un suo punto è il coefficiente angolare della sua retta tangente Esempio G4: La funzione = e la sua retta tangente per il
G4 Derivate G4 Significato geometrico di derivata La derivata di una funzione in un suo punto è il coefficiente angolare della sua retta tangente Esempio G4: La funzione = e la sua retta tangente per il
Soluzioni Acido Base Definizione di Brønsted
 acido + base sale + acqua Soluzioni Acido Base Definizione di Brønsted acido: sostanza capace di donare protoni* HCl + H 2 O Cl + H 3 O + * In soluzione, il protone esiste in forma idratata (H 3 O + )
acido + base sale + acqua Soluzioni Acido Base Definizione di Brønsted acido: sostanza capace di donare protoni* HCl + H 2 O Cl + H 3 O + * In soluzione, il protone esiste in forma idratata (H 3 O + )
Acidi e Basi. Capitolo 15
 Acidi e Basi Capitolo 15 Acidi Hanno un sapore agro. L aceto deve il suo sapore all acido acetico Gli agrumi contengono acido citrico. Provocano il cambio di colore nei coloranti vegetali. Reagiscono con
Acidi e Basi Capitolo 15 Acidi Hanno un sapore agro. L aceto deve il suo sapore all acido acetico Gli agrumi contengono acido citrico. Provocano il cambio di colore nei coloranti vegetali. Reagiscono con
Estrazione di pigmenti vegetali da sostanze naturali
 Estrazione di pigmenti vegetali da sostanze naturali Il cavolo rosso deve il suo colore agli antociani o antocianine, che sono una classe di pigmenti idrosolubili appartenente alla famiglia dei flavonoidi.
Estrazione di pigmenti vegetali da sostanze naturali Il cavolo rosso deve il suo colore agli antociani o antocianine, che sono una classe di pigmenti idrosolubili appartenente alla famiglia dei flavonoidi.
Sistemi lineari. Lorenzo Pareschi. Dipartimento di Matematica & Facoltá di Architettura Universitá di Ferrara
 Sistemi lineari Lorenzo Pareschi Dipartimento di Matematica & Facoltá di Architettura Universitá di Ferrara http://utenti.unife.it/lorenzo.pareschi/ lorenzo.pareschi@unife.it Lorenzo Pareschi (Univ. Ferrara)
Sistemi lineari Lorenzo Pareschi Dipartimento di Matematica & Facoltá di Architettura Universitá di Ferrara http://utenti.unife.it/lorenzo.pareschi/ lorenzo.pareschi@unife.it Lorenzo Pareschi (Univ. Ferrara)
Dati sperimentali Nella serie di 10 misurazioni di tempo effettuate, si sono ottenuti i seguenti valori espressi in secondi:
 ESPERIMENTO DI LABORATORIO DI FISICA MISURE DI TEMPO Obiettivo L obiettivo dell esperimento, oltre che familiarizzare con le misure di tempo, è quello di rivelare gli errori casuali, elaborare statisticamente
ESPERIMENTO DI LABORATORIO DI FISICA MISURE DI TEMPO Obiettivo L obiettivo dell esperimento, oltre che familiarizzare con le misure di tempo, è quello di rivelare gli errori casuali, elaborare statisticamente
SCHEDA per l esperienza ACIDO-BASE
 SCHEDA per l esperienza ACIDO-BASE NaOH ca. 0.1 M Seconda fase: standardizz. con KHFt Massa pesata NaOH: g Dissoluzione: in ca. litri di acqua deionizzata bollita Prima titolazione: massa pesata di KHFt:
SCHEDA per l esperienza ACIDO-BASE NaOH ca. 0.1 M Seconda fase: standardizz. con KHFt Massa pesata NaOH: g Dissoluzione: in ca. litri di acqua deionizzata bollita Prima titolazione: massa pesata di KHFt:
Tra nm Nucleotidi mono-fosfato
 Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Bari,7 luglio 1999 Compito di Analisi dei Farmaci I
 Bari,7 luglio 1999 Compito di Analisi dei Farmaci I Quale quantità di potassio bromato dovrà essere pesata per liberare una quantità di iodio che reagisca con 30 ml di sodio tiosolfato, del quale 42.56
Bari,7 luglio 1999 Compito di Analisi dei Farmaci I Quale quantità di potassio bromato dovrà essere pesata per liberare una quantità di iodio che reagisca con 30 ml di sodio tiosolfato, del quale 42.56
Metodo VII.1. Determinazione dello ione cloro in assenza di sostanza organica
 METODI VII METODI DI DETERMINAZIONE DEL CLORO Metodo VII.1 Determinazione dello ione cloro in assenza di sostanza organica 1. Oggetto Il presente documento stabilisce il procedimento da seguire per dosare
METODI VII METODI DI DETERMINAZIONE DEL CLORO Metodo VII.1 Determinazione dello ione cloro in assenza di sostanza organica 1. Oggetto Il presente documento stabilisce il procedimento da seguire per dosare
