Corso di: Chimica Analitica con Elementi di statistica
|
|
|
- Angelina Cocco
- 7 anni fa
- Visualizzazioni
Transcript
1 Esercizio 1 Ad una soluzione di FeCl M viene aggiunto ossalato di potassio; sapendo che si formano i complessi di tipo ML, ML 2 ed ML 3 e che le costanti di formazione globali sono: β = ; β = e β = Determinare a) Le reazioni bilanciate per tutti gli equilibri coinvolti e le rispettive costanti di stabilità b) Il valore numerico delle costanti di stabilità parziali degli equilibri di complessamento c) La frazione di metallo libera quando [Fe +3 ]= M d) La concentrazione di [Fe +3 ] in presenza di una [K 2 C 2 O 4 ]=0.2 M Risultati: c) = 0.25; ) [ ] = Esercizio 2 Determinare la concentrazione di Cu 2+ libero in una soluzione ottenuta mescolando 8.2 g di CH 3 COONa e di 26.2 mg Cu(ClO 4 ) 2 in un litro di H 2 O. Il sale di rame dissocia completamente e forma un complesso con lo ione acetato del tipo ML 2 con le seguenti costanti parziali di formazione: K 1 = ed K 2 = Risolvere il problema definendo gli equilibri parziali e ricavare = [] cioè la frazione di rame metallico non complessato. Considerare ininfluenti eventuali equilibri acido base a carico delle specie presenti. Risultati: = ; [ ] = Esercizio 3 Determinare la concentrazione di Al 3+ all equilibrio dopo aver aggiunto 50 ml di Al M ad una soluzione 50 ml di EDTA 0.05 M il tutto tamponato a ph=4. Si ha che = mentre = Verificare le assunzioni fatte nell esercizio. Risultati: c) = ; d) [ ] = Esercizio 4 Il cromo è un micronutriente presente in tracce nel nostro organismo, la cui carenza diminuisce la sensibilità dell'organismo all'insulina, aumenta il colesterolo ed abbassa le difese immunitarie. Per questo motivo il Cr 3+ può essere integrato nell organismo sotto forma di cromo picolinato. Il Cr 3+ dà con il picolinato (Pic 2- ) un complesso di tipo ML 3 dove la costante di complessazione globale è 3 = Il picolinato a sua volta è sottoposto a due equilibri acido base con K a1 = ed K a2 = Si richiede di: a. scrivere correttamente tutte le reazioni di equilibrio e le relative costanti parziali e globali; b. Valutare la frazione di legante attiva al ph =7.2 (ph muscolare dove è attivo il farmaco); c. Determinare la costante condizionale a ph fisiologico; Risultati: b) = 0.983; c) =
2 Esercizio 5: Il morbo di Wilson è una malattia genetica le cui manifestazioni cliniche dipendono dall accumulo di rame principalmente a livello del fegato e del cervello. La penicillammina (PENH 3 ) è un farmaco ad azione chelante che permette di gestire questa malattia eliminando parte del Cu 2+ in eccesso nell organismo. Si supponga che al ph fisiologico di 7.2 ed alla temperatura di 37 C la concentrazione di Cu 2+ in eccesso sia 0.01 M. Al paziente viene somministrato il farmaco in maniera da ottenere [PENH 3 ]= 0.03 M Determinare La frazione di legante attiva e quella di metallo attiva al ph indicato, la rispettiva costante condizionale e la concentrazione delle specie all equilibrio sapendo che: a. PENH 3 è soggetta a tre equilibri acido base dove K 1 = , K 2 = , K 3 = ; b. Cu 2+ forma un complesso con PEN 3 del tipo ML 2 dove K ML = , K = ; c. nel caso in cui il farmaco non fosse puro ma contenesse EDTA ( -= = ) come impurezza allo 0.1%, la terapia chelante sarebbe efficace lo stesso? Risultati: = ; = c) = ; [ ] = ; [h ] = ; [(h) ] = 0.01 ; [(h) ] = Esercizio 6: Il Mg 2+ è responsabile del buon funzionamento di circa 300 enzimi, coinvolti nei processi energetici, nella sintesi proteica e nella sintesi degli acidi nucleici, nucleotidi, lipidi e carboidrati. Il Magnesio svolge, inoltre, un ruolo importante nella contrazione muscolare, nella gestione dell equilibrio acido-base e dei processi di ossidoriduzione. Il deficit di Magnesio può comportare a livello muscolare e nello sportivo: crampi frequenti, minore resistenza fisica e difficoltà nel recupero e a livello neurologico agitazione nervosa, irritabilità, ansia, insonnia. L assunzione di Mg 2+ può avvenire in caso di necessità con l aiuto di integratori salini in cui è presente in forma complessata ad esempio con il citrato. L acido citrico (CiH 3 ) è un acido triprotico che dà con Mg 2+ un complesso debolmente chelante di tipo MLH dove H è un protone indissociato del legante. Considerando che: Concentrazioni iniziali [Mg ] = M e [CiH ] = M per l' acido citrico = , = e = la costante di complessamento di Mg 2+ con il legante CiH 2 è = secondo la reazione Mg + CiH MgCiH determinare: a. la frazione di legante attiva per la specie CiH 2 a ph = 3.5 (tratto gastrointestinale) e ph = 7.2 (tessuti dove è attivo l integratore); b. la costante condizionale ai due valori di ph valutando se l assunzione dell integratore è efficace per via orale e commentando come dovrebbe essere la stabilità del farmaco per essere efficace. c. Il valore delle concentrazioni all equilibrio per [Mg ], [CiH 2 ] e [MgCiH] a ph = 7.2 d. Verificare le eventuali approssimazioni e scrivere i valori di concentrazioni all equilibrio con il corretto numero di cifre significative. Risultati : a) (3.5) = ; (7.2) = b) (7.2) = ; (3.5) = c) [MgCiH] = M; [Mg ] = , [CiH 2 ]=
3 Esercizio 7 Dati potenziali delle coppie redox / = e / = 0.771, determinare la f.e.m. della pila che si otterrebbe nell ipotesi che una soluzione di H 2 O 2 venisse mescolata con una soluzione di Fe 2+ e l energia libera standard di reazione Esercizio 8 Dati potenziali delle coppie redox / = 1.60 e / = 0.771, determinare la f.e.m. della pila nell ipotesi che una soluzione di Fe 2+ venisse mescolata con una soluzione di, e l energia libera standard di reazione Esercizio 9 Dati potenziali delle coppie redox / = 1.76 e / = 0.77, determinare il potenziale di cella che si otterrebbe da una soluzione di Fe 2+ ed una soluzione standardizzata di : Esercizio 10 Calcolare il valore della costante di equilibrio e la rispettiva costante formale della reazione quando il ph = 2: + + Sapendo che = e = Si consiglia di bilanciare correttamente la reazione prima di proseguire nello svolgimento dell esercizio. Esercizio 11 Si voglia determinare la concentrazione di Fe 2+ in un campione fisiologico (V 0 =50 ml), titolato con una soluzione di agente titolante di Ce M. Il potenziale letto dallo strumento dopo l aggiunta di 10 ml di titolante ma prima del punto equivalente è V. Determinare la concentrazione di Fe 2+ sapendo che / = 1.44 = 0.68 V Risultati a) [Fe 2+ ]= M Esercizio 12 Determinare il potenziale che si ottiene in una titolazione di un campione fisiologico contenente Cu + (V 0 =80 ml, 0.05 M), con una soluzione di agente titolante di MnO 4 0.1M, dopo l aggiunta di a) 3 ml, b) 8 ml e c) 11 ml di titolante. Si consideri la soluzione di titolazione sia tamponata a ph=3 e che i potenziali delle coppie redox siano = 1.51 = Risultati a) E= V; b) E = V; c) E = 1.22 V
4 Esercizio 13 Un filo di ferro ultrapuro (m= ; PM=55.84) viene sciolto in una soluzione di HCl concentrato. La soluzione di Fe 2+ risultante viene titolata utilizzando ml per raggiungere il punto equivalente. Determinare il titolo dell agente titolante qual ora esso fosse: a) Ce 4+ (prodotto Ce 3+ ); b) Cr 2 O 7 2- (prodotto Cr 3+ ) c) MnO 4 - (prodotto Mn 2+ ) d) IO 3 - (prodotto ICl 2 - ) e) V(OH) 4 + (prodotto VO 2+ ) Esercizio ml di una soluzione contenente MnO 4 sono addizionati con un eccesso di ioduro (I ). Avviene la reazione (da bilanciare): MnO + I Mn I L I 3 così prodotto viene titolato con Na 2 S 2 O M. Il viraggio dell'indicatore si osserva per V t = 15 ml. Calcolare la concentrazione ed il numero di moli di MnO presenti inizialmente. Esercizio 15 4 ml di una soluzione contenente Cr 2 O 7 2 sono addizionati con un eccesso di ioduro (I ). Avviene la reazione (da bilanciare): Cr O + I Cr I L I 3 così prodotto viene titolato con Na 2 S 2 O M. Il viraggio dell'indicatore si osserva per V t = 18.3 ml. Calcolare la concentrazione ed il numero di moli di Cr O presenti inizialmente. Esercizio 16 5 ml di una soluzione contenente Cu 2+ sono addizionati con un eccesso di ioduro (I ). Avviene la reazione (da bilanciare): Cu + I I + CuI () L I 3 così prodotto viene titolato con Na 2 S 2 O 3. Il viraggio dell'indicatore si osserva per V t = 17.5 ml. Calcolare il titolo del tiosolfato sapendo il numero di moli iniziali di Cu è M. Esercizio 17 Supponiamo di titolare una soluzione di H 2 O 2 V 0 = 50 ml, 0.025M, con una soluzione di Ce M in soluzione di HCl 0.01 M. In questo ambiente i potenziali formali per le due semireazioni sono H O + 2H + 2e = 2H O E / = V Ce + e Ce E / = 1.44 V
5 A dare la reazione globale: H O + 2H + 2Ce = 2Ce + 2H O Determinare il potenziale che leggerei all elettrodo indicatore dopo l aggiunta di 5 ml di titolante, al punte equivalente e dopo l aggiunta di 28 ml di titolante
+ NO 2 + 3H 2 O = Ce +3 + NO 3 + 2H 3 O +, b) 0.478 g
 1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
H N. Mn 2+ +.. Fe 3+ +.. H 2 O
 CHIMICA ANALITICA- PROVA SCRITTA 3 FEBBRAIO 2005-1a. Quanti microlitri di 1-nonene (densità 1-nonene = 0.73 g/ml) bisogna prelevare per preparare 50 ml di soluzione di concentrazione 1000 ppm in metanolo
CHIMICA ANALITICA- PROVA SCRITTA 3 FEBBRAIO 2005-1a. Quanti microlitri di 1-nonene (densità 1-nonene = 0.73 g/ml) bisogna prelevare per preparare 50 ml di soluzione di concentrazione 1000 ppm in metanolo
[ ] [ ][ H 3 [ A " -SOLUZIONI TAMPONE- [ ] OH " O + K A = A" K i = HA K W = [ H 3
![[ ] [ ][ H 3 [ A -SOLUZIONI TAMPONE- [ ] OH O + K A = A K i = HA K W = [ H 3 [ ] [ ][ H 3 [ A -SOLUZIONI TAMPONE- [ ] OH O + K A = A K i = HA K W = [ H 3](/thumbs/70/62259175.jpg) -SOLUZIONI TAMPONE- Quando abbiamo in soluzione un acido debole ed il suo sale con una base forte ci sono da considerare 3 equilibri in soluzione: 1. HA + H 2 O A - + H 3 2. A - + H 2 O HA + OH - 3. 2H
-SOLUZIONI TAMPONE- Quando abbiamo in soluzione un acido debole ed il suo sale con una base forte ci sono da considerare 3 equilibri in soluzione: 1. HA + H 2 O A - + H 3 2. A - + H 2 O HA + OH - 3. 2H
COMPLESSI coppia di elettroni liberi Ammoniaca L
 COMPLESSI Molti cationi formano complessi in soluzione con sostanze che abbiano una coppia di elettroni liberi (es. atomi di N, O, S) capaci di soddisfare il numero di coordinazione del metallo. Me = metallo
COMPLESSI Molti cationi formano complessi in soluzione con sostanze che abbiano una coppia di elettroni liberi (es. atomi di N, O, S) capaci di soddisfare il numero di coordinazione del metallo. Me = metallo
M di acido formico (Ka =
 14 gennaio 2002 1. Calcolare quanti microlitri di soluzione 0.001 M di Pb 2+ (PA 207) devono essere prelevati per preparare una soluzione di concentrazione pari a 10 ppm e volume 50 ml. 2. Calcolare la
14 gennaio 2002 1. Calcolare quanti microlitri di soluzione 0.001 M di Pb 2+ (PA 207) devono essere prelevati per preparare una soluzione di concentrazione pari a 10 ppm e volume 50 ml. 2. Calcolare la
ESERCIZI DI RIEPILOGO GENERALE
 ESERCIZI DI RIEPILOGO GENERALE 1) Scrivere le formule brute e le formule di Lewis per: ammoniaca; ione ammonio; ione solfato; ione bicarbonato; acido acetico; anidride solforosa. Dove necessario, indicare
ESERCIZI DI RIEPILOGO GENERALE 1) Scrivere le formule brute e le formule di Lewis per: ammoniaca; ione ammonio; ione solfato; ione bicarbonato; acido acetico; anidride solforosa. Dove necessario, indicare
ESERCIZI POTENZIOMETRIA
 ESERCIZI POTENZIOMETRIA A. SPUNTI DI RIFLESSIONE 1. Quali sono i probabili fenomeni che permettono a un elettrodo al platino di assumere il potenziale di una soluzione contenente la coppia Fe 3+ /Fe 2+?
ESERCIZI POTENZIOMETRIA A. SPUNTI DI RIFLESSIONE 1. Quali sono i probabili fenomeni che permettono a un elettrodo al platino di assumere il potenziale di una soluzione contenente la coppia Fe 3+ /Fe 2+?
COMPITO DI ANALISI DEI FARMACI I BARI,14 GIUGNO 1999
 COMPITO DI ANALISI DEI FARMACI I BARI,14 GIUGNO 1999 1)Un campione da 24.7 L di aria estratta nelle vicinanze di un forno è stato passato su pentossido di iodio a 150 C dove CO è stato trasformato in CO
COMPITO DI ANALISI DEI FARMACI I BARI,14 GIUGNO 1999 1)Un campione da 24.7 L di aria estratta nelle vicinanze di un forno è stato passato su pentossido di iodio a 150 C dove CO è stato trasformato in CO
20/03/2014 ANALISI VOLUMETRICA ACIDO-BASE PRECIPITAZIONE COMPLESSOMETRICA OSSIDO-RIDUZIONE REQUISITI PER UNA TITOLAZIONE
 ANALISI VOLUMETRICA ACIDO-BASE PRECIPITAZIONE COMPLESSOMETRICA OSSIDO-RIDUZIONE In una titolazione l analita reagisce con un reagente addizionato sotto forma di una soluzione di concentrazione nota (soluzione
ANALISI VOLUMETRICA ACIDO-BASE PRECIPITAZIONE COMPLESSOMETRICA OSSIDO-RIDUZIONE In una titolazione l analita reagisce con un reagente addizionato sotto forma di una soluzione di concentrazione nota (soluzione
Esercizi - A.A. 2017/2018
 Esercizi - A.A. 2017/2018 Preparazione soluzioni e diluizioni Es. 1 2 ml di piridina (d = 0.892 g/ml) sono disciolti in 80 ml di etanolo (d = 0.79 g/ml). Trovare la % in massa di piridina nella soluzione.
Esercizi - A.A. 2017/2018 Preparazione soluzioni e diluizioni Es. 1 2 ml di piridina (d = 0.892 g/ml) sono disciolti in 80 ml di etanolo (d = 0.79 g/ml). Trovare la % in massa di piridina nella soluzione.
SOLUZIONI TAMPONE SOLUZIONI TAMPONE
 SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
15 aprile 2010 Prova scritta di Chimica Analitica 1 con Laboratorio
 15 aprile 2010 Prova scritta di Chimica Analitica 1 con Laboratorio 1. La concentrazione di ioni cloruro in una soluzione viene determinata con il metodo di olhard. Un aliquota di 25.0 ml della soluzione
15 aprile 2010 Prova scritta di Chimica Analitica 1 con Laboratorio 1. La concentrazione di ioni cloruro in una soluzione viene determinata con il metodo di olhard. Un aliquota di 25.0 ml della soluzione
ANALISI DEI FARMACI I
 ANALISI DEI FARMACI I TESTI CONSIGLIATI Skoog - West - Holler - (Crouch): Fondamenti di chimica analitica Harris: Chimica analitica quantitativa Per la Conduttimetria Cozzi - Protti - Ruaro: Analisi chimica
ANALISI DEI FARMACI I TESTI CONSIGLIATI Skoog - West - Holler - (Crouch): Fondamenti di chimica analitica Harris: Chimica analitica quantitativa Per la Conduttimetria Cozzi - Protti - Ruaro: Analisi chimica
Rapporto tra soluto e solvente o soluzione
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Compito di analisi dei farmaci I. Bari,9 settembre 1998
 Compito di analisi dei farmaci I Bari,9 settembre 1998 1) L acido formico in una soluzione 0.1 M è dissociato per il 4.6%.50 ml di questa soluzione si diluiscono a 250 ml con acqua e si titolano con NaOH
Compito di analisi dei farmaci I Bari,9 settembre 1998 1) L acido formico in una soluzione 0.1 M è dissociato per il 4.6%.50 ml di questa soluzione si diluiscono a 250 ml con acqua e si titolano con NaOH
2. Quanti elettroni sono scambiati nella reazione redox: 2Fe + O 2 (g) + 4H 3 O + = 2Fe H 2 O a. 2 b. 3 c. 4
 1. La f.e.m o forza elettromotrice è indice della tendenza della reazione ad avvenire fino al raggiungimento dell equilibrio, più elevata è la f.e.m e: a. più il sistema è vicino dall equilibrio b. più
1. La f.e.m o forza elettromotrice è indice della tendenza della reazione ad avvenire fino al raggiungimento dell equilibrio, più elevata è la f.e.m e: a. più il sistema è vicino dall equilibrio b. più
ossidazione/riduzione, ossidante/riducente
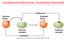 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
APPLICAZIONE DI RIDUCENTI IN VOLUMETRICA
 APPLICAZIONE DI RIDUCENTI IN VOLUMETRICA Le sostanze riducenti reagiscono con l O 2 dell aria, per questo motivo è meglio conservarle in atmosfera inerte. Metodo: agente riducente non standardizzato +
APPLICAZIONE DI RIDUCENTI IN VOLUMETRICA Le sostanze riducenti reagiscono con l O 2 dell aria, per questo motivo è meglio conservarle in atmosfera inerte. Metodo: agente riducente non standardizzato +
1)Calcolare il ph di una soluzione che contenga al9%(w/w)naoh ed abbia una densità pari a 1.098g/ml.
 Compito di Analisi dei farmaci I Bari,3 febbraio 1999 1)Calcolare il ph di una soluzione che contenga al9%(w/w)naoh ed abbia una densità pari a 1.098g/ml. 1)Quale deve essere la sensibilità della bilancia
Compito di Analisi dei farmaci I Bari,3 febbraio 1999 1)Calcolare il ph di una soluzione che contenga al9%(w/w)naoh ed abbia una densità pari a 1.098g/ml. 1)Quale deve essere la sensibilità della bilancia
Esame di Chimica Generale 16 Febbraio 2016
 Esame di Chimica Generale 16 Febbraio 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 16 Febbraio 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
FORMULARIO DI CHIMICA
 ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
ossidazione/riduzione, ossidante/riducente
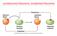 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
1. Calcolare il peso equivalente di ognuno dei seguenti acidi e basi, assumendo la neutralizzazione completa: H 2 SO 3, H 3 PO 4, LiOH, Zn(OH) 2.
 1. Calcolare il peso equivalente di ognuno dei seguenti acidi e basi, assumendo la neutralizzazione completa: H 2 SO 3, H 3 PO 4, LiOH, Zn(OH) 2. H 2 SO 3 Pm = 2 1 + 32 + 16 3 = 82 H 3 PO 4 Pm = 3 1 +
1. Calcolare il peso equivalente di ognuno dei seguenti acidi e basi, assumendo la neutralizzazione completa: H 2 SO 3, H 3 PO 4, LiOH, Zn(OH) 2. H 2 SO 3 Pm = 2 1 + 32 + 16 3 = 82 H 3 PO 4 Pm = 3 1 +
1 Me Me (s) Me + (aq) + e -
 ELETTROCHIMICA 1 Me Me (s) Me + (aq) + e - Me + DOPPIO STRATO (+) (-) all interfaccia elettrodo-soluzione 2 Se inizialmente prevale la reazione 1, la lamina metallica si carica negativamente (eccesso di
ELETTROCHIMICA 1 Me Me (s) Me + (aq) + e - Me + DOPPIO STRATO (+) (-) all interfaccia elettrodo-soluzione 2 Se inizialmente prevale la reazione 1, la lamina metallica si carica negativamente (eccesso di
SOLUBILITA EQUILIBRI ETEROGENEI
 SOLUBILITA EQUILIBRI ETEROGENEI Cosa succede quando si scioglie un sale (NaCl) in acqua Cl - LEGAME IONE DIPOLO Se sciogliamo in un solvente polare (tipo H 2 O) una sostanza ionica(tipo NaCl) questa si
SOLUBILITA EQUILIBRI ETEROGENEI Cosa succede quando si scioglie un sale (NaCl) in acqua Cl - LEGAME IONE DIPOLO Se sciogliamo in un solvente polare (tipo H 2 O) una sostanza ionica(tipo NaCl) questa si
Esame di Chimica Generale del 12 Gennaio 2018
 Esame di Chimica Generale del 12 Gennaio 2018 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale del 12 Gennaio 2018 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
-DEFINIZIONE DI ACIDI E BASI-
 -DEFINIZIONE DI ACIDI E BASI- DEFINIZIONE DI ARRHENIUS ACIDO: rilascia ioni H + HCl H + + Cl - BASE: rilascia ioni OH - NaOH Na + + OH - DEFINIZIONE DI BRÖNSTED ACIDO: rilascia ioni H + BASE: lega ioni
-DEFINIZIONE DI ACIDI E BASI- DEFINIZIONE DI ARRHENIUS ACIDO: rilascia ioni H + HCl H + + Cl - BASE: rilascia ioni OH - NaOH Na + + OH - DEFINIZIONE DI BRÖNSTED ACIDO: rilascia ioni H + BASE: lega ioni
11 luglio 2008 Prova scritta di Chimica Analitica 1 con Laboratorio
 11 luglio 008 Prova scritta di Chimica Analitica 1 con Laboratorio 1. Considerate il seguente sistema elettrodico: Pt Ox Red costituito da una sbarretta di Pt immersa in una soluzione contenente la coppia
11 luglio 008 Prova scritta di Chimica Analitica 1 con Laboratorio 1. Considerate il seguente sistema elettrodico: Pt Ox Red costituito da una sbarretta di Pt immersa in una soluzione contenente la coppia
Agente ossidante è la specie chimica che acquistando elettroni passa ad uno stato di ossidazione inferiore: Es. Ce +4 + e - Ce +3
 OSSIDIMETRIA Titolazioni di ossidoriduzione. Principi: Ossidazione = perdita di elettroni Riduzione = acquisto di elettroni Reazione redox in generale Oss 1 + Rid 2 Rid 1 + Oss 2 Agente ossidante è la
OSSIDIMETRIA Titolazioni di ossidoriduzione. Principi: Ossidazione = perdita di elettroni Riduzione = acquisto di elettroni Reazione redox in generale Oss 1 + Rid 2 Rid 1 + Oss 2 Agente ossidante è la
Calcolare il ph di una sol. di CH 3 NH 2 (aq) 0,300 M
 Calcolare il ph di una sol. di CH 3 NH 2 (aq) 0,300 M CH 3 NH 2 (aq) + H 2 O(l) CH 3 NH 3+ (aq) + OH (aq) K b = [CH 3 NH 3+ ] [OH ] / [CH 3 NH 2 ] = 3,6 * 10-4 [CH 3 NH 2 ] [CH 3 NH 3+ ] [OH ] inizio 0,300
Calcolare il ph di una sol. di CH 3 NH 2 (aq) 0,300 M CH 3 NH 2 (aq) + H 2 O(l) CH 3 NH 3+ (aq) + OH (aq) K b = [CH 3 NH 3+ ] [OH ] / [CH 3 NH 2 ] = 3,6 * 10-4 [CH 3 NH 2 ] [CH 3 NH 3+ ] [OH ] inizio 0,300
Chimica Analitica. Equilibri in soluzione
 Chimica Analitica Equilibri in soluzione Grafico di titolazione Come ricavare la curva di titolazione dalle curve di distribuzione Le curve di distribuzione che abbiamo calcolato servendoci di un foglio
Chimica Analitica Equilibri in soluzione Grafico di titolazione Come ricavare la curva di titolazione dalle curve di distribuzione Le curve di distribuzione che abbiamo calcolato servendoci di un foglio
Corso di Laboratorio Integrato di Chimica Generale BIOTEC-2011 Esercizi Svolti su Equilibri acido-base
 Corso di Laboratorio Integrato di Chimica Generale BIOTEC2011 Esercizi Svolti su Equilibri acidobase 1. Quanto vale il ph di una soluzione 0.1 M di CO 2 se si ritiene che essa non esiste più come tale
Corso di Laboratorio Integrato di Chimica Generale BIOTEC2011 Esercizi Svolti su Equilibri acidobase 1. Quanto vale il ph di una soluzione 0.1 M di CO 2 se si ritiene che essa non esiste più come tale
Acidi e basi di Lewis
 Gli acidi e le basi Acidi e basi di Lewis Acidi di Lewis= specie che possono accettare in compartecipazione una coppia di elettroni da un altra specie. Base di Lewis = specie che può cedere in compartecipazione
Gli acidi e le basi Acidi e basi di Lewis Acidi di Lewis= specie che possono accettare in compartecipazione una coppia di elettroni da un altra specie. Base di Lewis = specie che può cedere in compartecipazione
Complessometria M + L
 Complessometria Analisi volumetrica per formazione di complessi M + L ML M (nucleo centrale) è un acido di Lewis (accettore di coppie di elettroni) L (legante) è una base di Lewis (donatore di coppie di
Complessometria Analisi volumetrica per formazione di complessi M + L ML M (nucleo centrale) è un acido di Lewis (accettore di coppie di elettroni) L (legante) è una base di Lewis (donatore di coppie di
Bari,7 luglio 1999 Compito di Analisi dei Farmaci I
 Bari,7 luglio 1999 Compito di Analisi dei Farmaci I Quale quantità di potassio bromato dovrà essere pesata per liberare una quantità di iodio che reagisca con 30 ml di sodio tiosolfato, del quale 42.56
Bari,7 luglio 1999 Compito di Analisi dei Farmaci I Quale quantità di potassio bromato dovrà essere pesata per liberare una quantità di iodio che reagisca con 30 ml di sodio tiosolfato, del quale 42.56
Reazioni di ossido-riduzione (redox) - Come stabilire il verso di una redox? -
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
30 luglio 2010 Prova scritta di Chimica Analitica 1 con Laboratorio
 30 luglio 010 Prova scritta di Chimica Analitica 1 con Laboratorio 1. Considerate una soluzione satura del sale poco solubile MgNH 4 PO 4 la cui dissoluzione e rappresentata da: MgNH 4 PO 4 (s) = Mg +
30 luglio 010 Prova scritta di Chimica Analitica 1 con Laboratorio 1. Considerate una soluzione satura del sale poco solubile MgNH 4 PO 4 la cui dissoluzione e rappresentata da: MgNH 4 PO 4 (s) = Mg +
cognome e nome turno banco data Indicare i CALCOLI per ESTESO Nei RIQUADRI TRATTEGGIATI riportare i dati con le CIFRE SIGNIFICATIVE appropriate
 PREPARAZIONE e STANDARDIZZAZIONE di una SOLUZIONE di ACIDO CLORIDRICO densità HCl (aq) conc. (g/ml) % peso prelievo HCl (aq) conc. (ml) mmoli HCl = volume matraccio (ml) titolo previsto HCl (aq) diluito
PREPARAZIONE e STANDARDIZZAZIONE di una SOLUZIONE di ACIDO CLORIDRICO densità HCl (aq) conc. (g/ml) % peso prelievo HCl (aq) conc. (ml) mmoli HCl = volume matraccio (ml) titolo previsto HCl (aq) diluito
Esame (0) classei - Codice Prova:
 1) Il diossido di zolfo reagirà con l acqua secondo la reazione: SO 2 (g) + H 2 O (l) H 2 SO 3 (l) Quanto diossido di zolfo è necessario per preparare 27.86 g di H 2 SO 3 (l)? A. 27.86 g B. 0.3394 g C.
1) Il diossido di zolfo reagirà con l acqua secondo la reazione: SO 2 (g) + H 2 O (l) H 2 SO 3 (l) Quanto diossido di zolfo è necessario per preparare 27.86 g di H 2 SO 3 (l)? A. 27.86 g B. 0.3394 g C.
Prova in itinere di Chimica Generale 4 Giugno 2013
 Prova in itinere di Chimica Generale 4 Giugno 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Prova in itinere di Chimica Generale 4 Giugno 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Chimica Analitica con elementi di statistica Lezione n 5
 Chimica Analitica con elementi di statistica Lezione n 5 Christian Durante E-mail: christian.durante@unipd.it Tel. 049-8275112 Zona quadrilatero ufficio 00 215 02 142 (orario di ricevimento: tutti I giorni
Chimica Analitica con elementi di statistica Lezione n 5 Christian Durante E-mail: christian.durante@unipd.it Tel. 049-8275112 Zona quadrilatero ufficio 00 215 02 142 (orario di ricevimento: tutti I giorni
Chimica Analitica con elementi di statistica. Lezione n 9
 Chimica Analitica con elementi di statistica Lezione n 9 Christian Durante E mail: christian.durante@unipd.it Tel. 049 8275112 Zona quadrilatero ufficio 00 215 02 142 (orario di ricevimento: tutti I giorni
Chimica Analitica con elementi di statistica Lezione n 9 Christian Durante E mail: christian.durante@unipd.it Tel. 049 8275112 Zona quadrilatero ufficio 00 215 02 142 (orario di ricevimento: tutti I giorni
DETERMINAZIONE della MASSA di ACIDO ACETICO PRESENTE in un 1 L di ACETO
 DETERMINAZIONE della MASSA di ACIDO ACETICO PRESENTE in un 1 L di ACETO OBIETTIVO: determinare i grammi di acido acetico presenti in 1 litro di aceto comune (concentrazione in g/l). Approccio al problema:
DETERMINAZIONE della MASSA di ACIDO ACETICO PRESENTE in un 1 L di ACETO OBIETTIVO: determinare i grammi di acido acetico presenti in 1 litro di aceto comune (concentrazione in g/l). Approccio al problema:
Es: consideriamo una soluzione contenente acido K = 1, [CH 3 COOH]
![Es: consideriamo una soluzione contenente acido K = 1, [CH 3 COOH] Es: consideriamo una soluzione contenente acido K = 1, [CH 3 COOH]](/thumbs/103/157927484.jpg) SOLUZIONI TAMPONE Una soluzione tampone è una soluzione che contiene quantità paragonabili (dello stesso ordine di grandezza) di un acido debole e della sua base coniugata o di una base debole e del suo
SOLUZIONI TAMPONE Una soluzione tampone è una soluzione che contiene quantità paragonabili (dello stesso ordine di grandezza) di un acido debole e della sua base coniugata o di una base debole e del suo
dispersioni omogenee di due o più specie chimiche l una nell altra
 Soluzioni : dispersioni omogenee di due o più specie chimiche l una nell altra Solvente : componente che si trova nel medesimo stato fisico della soluzione componente che si trova in quantità maggiore
Soluzioni : dispersioni omogenee di due o più specie chimiche l una nell altra Solvente : componente che si trova nel medesimo stato fisico della soluzione componente che si trova in quantità maggiore
Solubilità dei sali Prodotto di solubilità
 Solubilità dei sali Prodotto di solubilità Aggiunta di una soluzione di NaCl ad una di AgNO 3 : formazione di un precipitato -AgCl- Solubilità Stabilite le condizioni di equilibrio di una soluzione satura
Solubilità dei sali Prodotto di solubilità Aggiunta di una soluzione di NaCl ad una di AgNO 3 : formazione di un precipitato -AgCl- Solubilità Stabilite le condizioni di equilibrio di una soluzione satura
Formazione di complessi
 Formazione di complessi Struttura degli ioni complessi Gli ioni complessi sono formati da un catione metallico legato ad anioni come OH -, Cl -, CN -, SCN -, o a molecole neutre come H 2 O, NH 3., detti
Formazione di complessi Struttura degli ioni complessi Gli ioni complessi sono formati da un catione metallico legato ad anioni come OH -, Cl -, CN -, SCN -, o a molecole neutre come H 2 O, NH 3., detti
COMPITO A. c) indicate lo ione monoatomico (carica e segno) formato da Mg : Mg 2+, Br : Br -
 CMPIT A 16) a) Scrivere il nome di KN 3 :nitrato di potassio. Cr 2 3 :ossido di cromo (III). b) scrivere la formula di solfato di ammonio: (NH 4 ) 2 S 4 ;..triossido di diazoto N 2 3 17) a) Elemento del
CMPIT A 16) a) Scrivere il nome di KN 3 :nitrato di potassio. Cr 2 3 :ossido di cromo (III). b) scrivere la formula di solfato di ammonio: (NH 4 ) 2 S 4 ;..triossido di diazoto N 2 3 17) a) Elemento del
ESERCIZI Tabella dei potenziali
 ESERCIZI 1) Una pila chimica è un dispositivo in cui si ha trasformazione di: a. energia elettrica in energia chimica b. energia chimica in energia elettrica c. entalpia in energia elettrica d. entropia
ESERCIZI 1) Una pila chimica è un dispositivo in cui si ha trasformazione di: a. energia elettrica in energia chimica b. energia chimica in energia elettrica c. entalpia in energia elettrica d. entropia
Solubilità dei sali Prodotto di solubilità
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
scrivere la reazione che avviene spontaneamente nella pila. Determinare inoltre la f.e.m. della pila a 25 C
 Una barra di Ni, immersa in una soluzione di Ni ++ a concentrazione 1x1-3 M viene accoppiata ad un secondo semielemento in cui una lamina di Ag è immersa in una soluzione di ioni Ag + a concentrazione
Una barra di Ni, immersa in una soluzione di Ni ++ a concentrazione 1x1-3 M viene accoppiata ad un secondo semielemento in cui una lamina di Ag è immersa in una soluzione di ioni Ag + a concentrazione
RNH 3 + OH - C 0 x x x
 Università degli Studi di Roma Tor Vergata, Facoltà di Scienze MFN Corso di Laurea Triennale in Chimica Applicata, Insegnamento di Chimica Generale Modulo di Stechiometria. AA 2009/2010. Soluzioni prima
Università degli Studi di Roma Tor Vergata, Facoltà di Scienze MFN Corso di Laurea Triennale in Chimica Applicata, Insegnamento di Chimica Generale Modulo di Stechiometria. AA 2009/2010. Soluzioni prima
EQUILIBRI ACIDO-BASE: ESERCIZI RISOLTI. Dott. Francesco Musiani
 EQUILIBRI ACIDO-BASE: ESERCIZI RISOLTI Dott. Francesco Musiani Versione aggiornata al 23.1.2017 1 - Calcolare il poh di soluzioni aventi le seguenti concentrazioni di H 3 O + : 1) 3,1 10-2 M; 2) 1,0 10-4
EQUILIBRI ACIDO-BASE: ESERCIZI RISOLTI Dott. Francesco Musiani Versione aggiornata al 23.1.2017 1 - Calcolare il poh di soluzioni aventi le seguenti concentrazioni di H 3 O + : 1) 3,1 10-2 M; 2) 1,0 10-4
SOLUZIONE DEL COMPITO A DI CHIMICA DEL
 SOLUZIONE DEL COMPITO A DI CHIMICA DEL 05-07-13 1A) 33.5 g di ioduro di sodio e 33.0 g di iodio vengono sciolti in acqua trattati con 17.9 L (a c.n.) di cloro; si formano iodato di sodio, acido iodico
SOLUZIONE DEL COMPITO A DI CHIMICA DEL 05-07-13 1A) 33.5 g di ioduro di sodio e 33.0 g di iodio vengono sciolti in acqua trattati con 17.9 L (a c.n.) di cloro; si formano iodato di sodio, acido iodico
I COMPOSTI DI COORDINAZIONE: sono molecole o ioni in cui un catione metallico è legato con un determinato numero di molecole o ioni negativi.
 I COMPOSTI DI COORDINAZIONE: sono molecole o ioni in cui un catione metallico è legato con un determinato numero di molecole o ioni negativi. [Fe(CN) 6 ] 3- Carica della molecola coordinatore legante Numero
I COMPOSTI DI COORDINAZIONE: sono molecole o ioni in cui un catione metallico è legato con un determinato numero di molecole o ioni negativi. [Fe(CN) 6 ] 3- Carica della molecola coordinatore legante Numero
II prova in itinere di Chimica Generale 7 Giugno 2016
 II prova in itinere di Chimica Generale 7 Giugno 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
II prova in itinere di Chimica Generale 7 Giugno 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di
soluzione standard o titolante
 ANALISI VOLUMETRICA 1 ACIDO-BASE PRECIPITAZIONE COMPLESSOMETRICA OSSIDO-RIDUZIONE In una titolazione l analita reagisce con un reagente addizionato sotto forma di una soluzione di concentrazione nota (soluzione
ANALISI VOLUMETRICA 1 ACIDO-BASE PRECIPITAZIONE COMPLESSOMETRICA OSSIDO-RIDUZIONE In una titolazione l analita reagisce con un reagente addizionato sotto forma di una soluzione di concentrazione nota (soluzione
Capitolo 22 L elettrochimica
 Capitolo 22 L elettrochimica Hai capito? pag. 572 Le osservazioni sarebbero le stesse. 2 + Cu 2 Cu 2+ ; la soluzione assume un colore azzurro per la presenza di ioni Cu 2+ e si forma un deposito grigio
Capitolo 22 L elettrochimica Hai capito? pag. 572 Le osservazioni sarebbero le stesse. 2 + Cu 2 Cu 2+ ; la soluzione assume un colore azzurro per la presenza di ioni Cu 2+ e si forma un deposito grigio
TRACCIA 1. Il candidato descriva in dettaglio la morfologia della cellula e le sue funzioni fisiologiche.
 TRACCIA 1 BIOLOGIA Il candidato descriva in dettaglio la morfologia della cellula e le sue funzioni fisiologiche. FISICA Problema n.1 Due condensatori di capacita 2µF e 4 µf sono collegati in serie con
TRACCIA 1 BIOLOGIA Il candidato descriva in dettaglio la morfologia della cellula e le sue funzioni fisiologiche. FISICA Problema n.1 Due condensatori di capacita 2µF e 4 µf sono collegati in serie con
STECHIOMETRIA. Scopo: prevedere la quantità di un certo prodotto che si forma a partire da determinate quantità di reagenti
 STECHIOMETRIA Punto di partenza: Una reazione chimica bilanciata. Scopo: prevedere la quantità di un certo prodotto che si forma a partire da determinate quantità di reagenti I coefficienti stechiometrici
STECHIOMETRIA Punto di partenza: Una reazione chimica bilanciata. Scopo: prevedere la quantità di un certo prodotto che si forma a partire da determinate quantità di reagenti I coefficienti stechiometrici
PRONTUARIO ESSENZIALE DI FORMULE PER IL LABORATORIO CHIMICO
 PRONTUARIO ESSENZIALE DI FORMULE PER IL LABORATORIO CHIMICO GIOVANNI BUTI LA MOLE MOLI Massa = P.A. MASSA = Moli * P. A. NUMERO DI PARTICELLE = Massa * N a P. A. 3 MOLARITA = Moli 4 V Massa = peso in grammi
PRONTUARIO ESSENZIALE DI FORMULE PER IL LABORATORIO CHIMICO GIOVANNI BUTI LA MOLE MOLI Massa = P.A. MASSA = Moli * P. A. NUMERO DI PARTICELLE = Massa * N a P. A. 3 MOLARITA = Moli 4 V Massa = peso in grammi
Esame di Chimica Generale 22 Febbraio 2011
 Esame di Chimica Generale 22 Febbraio 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 22 Febbraio 2011 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
OSSIDAZIONI CON PERMANGANATO DI POTASSIO
 OSSIDAZIONI CON PERMANGANATO DI POTASSIO Il permanganato di potassio è agente ossidante forte di colore viola intenso. In soluzioni fortemente acide (ph ~1) è ridotto a Mn 2+ incolore. MnO 4 + 8H + + 5e
OSSIDAZIONI CON PERMANGANATO DI POTASSIO Il permanganato di potassio è agente ossidante forte di colore viola intenso. In soluzioni fortemente acide (ph ~1) è ridotto a Mn 2+ incolore. MnO 4 + 8H + + 5e
Esame di Chimica Generale 15 Giugno 2016
 Esame di Chimica Generale 15 Giugno 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 15 Giugno 2016 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
12 luglio 2010 Prova scritta di Chimica Analitica 1 con Laboratorio
 2 luglio 200 Prova scritta di Chimica Analitica con Laboratorio. Scrivete le equazioni per il bilancio di carica e di massa per una soluzione satura del sale poco solubile Mg 3 PO ) 2 in cui si assume
2 luglio 200 Prova scritta di Chimica Analitica con Laboratorio. Scrivete le equazioni per il bilancio di carica e di massa per una soluzione satura del sale poco solubile Mg 3 PO ) 2 in cui si assume
Gli acidi (forti o deboli) si titolano con una base forte. Le basi (forti o deboli) si titolano con un acido forte.
 Gli acidi (forti o deboli) si titolano con una base forte. Le basi (forti o deboli) si titolano con un acido forte. D.C. Harris, Elementi di chimica analitica, Zanichelli Capitolo 11 1 e-mail: analitica.biotec@unife.it
Gli acidi (forti o deboli) si titolano con una base forte. Le basi (forti o deboli) si titolano con un acido forte. D.C. Harris, Elementi di chimica analitica, Zanichelli Capitolo 11 1 e-mail: analitica.biotec@unife.it
Esame di Chimica Generale 19 Febbraio 2013
 Esame di Chimica Generale 19 Febbraio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 19 Febbraio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
2.1 Iodimetria-iodometria
 .1 Iodimetria-iodometria Sono metodi analitici basati su reazioni di ossidoriduzione in cui una delle due coppie redox è I / I - Equazione della semireazione di riduzione dello iodio I + e - I - E = 0,535
.1 Iodimetria-iodometria Sono metodi analitici basati su reazioni di ossidoriduzione in cui una delle due coppie redox è I / I - Equazione della semireazione di riduzione dello iodio I + e - I - E = 0,535
Indirizzo: Chimica, materiali e biotecnologie -Articolazione Biotecnologie sanitarie CHIMICA ANALITICA E STRUMENTALE 3 anno
 Indirizzo: Chimica, materiali e biotecnologie -Articolazione Biotecnologie sanitarie CHIMICA ANALITICA E STRUMENTALE 3 anno UDA CONOSCENZE COMPETENZE ABILITA UDA N. 1 Gli acidi e le Ore: 11 Settembre-
Indirizzo: Chimica, materiali e biotecnologie -Articolazione Biotecnologie sanitarie CHIMICA ANALITICA E STRUMENTALE 3 anno UDA CONOSCENZE COMPETENZE ABILITA UDA N. 1 Gli acidi e le Ore: 11 Settembre-
27/04/2017 ELETTROCHIMICA REAZIONI REDOX SCHEMA REAZIONE REDOX
 ELETTROCHIMICA Tratta delle trasformazioni tra energia chimica ed energia elettrica Alla base ci sono reazioni di ossidoriduzione, cioè con scambio di elettroni tra reagenti e prodotti della reazione REAZIONI
ELETTROCHIMICA Tratta delle trasformazioni tra energia chimica ed energia elettrica Alla base ci sono reazioni di ossidoriduzione, cioè con scambio di elettroni tra reagenti e prodotti della reazione REAZIONI
Esame di Chimica Generale 16 Gennaio 2015
 Esame di Chimica Generale 16 Gennaio 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 16 Gennaio 2015 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Le Pile. Zn 2+ Ag + a=1 a=1
 Le Pile In questo capitolo sono illustrati alcuni problemi riguardanti pile con diversi tipi di elettrodi e nelle quali si realizzano processi di vario genere. Le pile sono utilizzate per ottenere informazioni
Le Pile In questo capitolo sono illustrati alcuni problemi riguardanti pile con diversi tipi di elettrodi e nelle quali si realizzano processi di vario genere. Le pile sono utilizzate per ottenere informazioni
12 febbraio 2009 Prova scritta di Chimica Analitica 1 con Laboratorio
 12 febbraio 2009 Prova scritta di Chimica Analitica 1 con Laboratorio 1. Calcolate pzn al punto di equivalenza della titolazione di una soluzione 0.02 mol/l di ZnCl 2 tamponata a ph 8.00 con una soluzione
12 febbraio 2009 Prova scritta di Chimica Analitica 1 con Laboratorio 1. Calcolate pzn al punto di equivalenza della titolazione di una soluzione 0.02 mol/l di ZnCl 2 tamponata a ph 8.00 con una soluzione
Studenti L-P(2017/18) L-O(2018/19) (Prof.Giuliano Moretti) Risultati della prova scritta del 15 febbraio 2019
 Studenti LP(2017/18) LO(2018/19) (Prof.Giuliano Moretti) Risultati della prova scritta del 15 febbraio 2019 La prova orale si svolgerà secondo il calendario riportato di seguito Presentarsi presso la stanza
Studenti LP(2017/18) LO(2018/19) (Prof.Giuliano Moretti) Risultati della prova scritta del 15 febbraio 2019 La prova orale si svolgerà secondo il calendario riportato di seguito Presentarsi presso la stanza
DIPARTIMENTO DI FARMACIA C.d.S. in Farmacia CHIMICA GENERALE ED INORGANICA Secondo Parziale - 19 Giugno 2015
 A DIPARTIMENTO DI FARMACIA C.d.S. in Farmacia CHIMICA GENERALE ED INORGANICA Secondo Parziale - 19 Giugno 2015 COGNOME NOME MATRICOLA Segnare con una crocetta la risposta (una sola) che si ritiene esatta.
A DIPARTIMENTO DI FARMACIA C.d.S. in Farmacia CHIMICA GENERALE ED INORGANICA Secondo Parziale - 19 Giugno 2015 COGNOME NOME MATRICOLA Segnare con una crocetta la risposta (una sola) che si ritiene esatta.
REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI. Dr. Francesco Musiani
 REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI Dr. Francesco Musiani Versione aggiornata al 20.12.2011 Zn (s) + NO 3 - Zn 2+ + NH 4 + Zn (s) Ý Zn 2+ (1) NO - + 3 Ý NH 4 (2) - Bilanciamento di (1): In questa
REAZIONI DI OSSIDO-RIDUZIONE: ESERCIZI RISOLTI Dr. Francesco Musiani Versione aggiornata al 20.12.2011 Zn (s) + NO 3 - Zn 2+ + NH 4 + Zn (s) Ý Zn 2+ (1) NO - + 3 Ý NH 4 (2) - Bilanciamento di (1): In questa
ANALISI VOLUMETRICA Metodo Volumetrico Titolazione volume di standard reagire completamente con l analita
 ANALISI VOLUMETRICA Metodo di analisi che si basa sulla titolazione. La concentrazione di un analita viene determinata misurando la sua capacità a combinarsi con un Reagente Standard (S.M.). (Esiste anche
ANALISI VOLUMETRICA Metodo di analisi che si basa sulla titolazione. La concentrazione di un analita viene determinata misurando la sua capacità a combinarsi con un Reagente Standard (S.M.). (Esiste anche
15 ottobre 2009 Prova scritta di Chimica Analitica 1 con Laboratorio
 15 ottobre 2009 Prova scritta di Chimica Analitica 1 con Laboratorio 1. Un campione di aria avente densita d 1.19 g/l contiene una concentrazione di SO 2 pari a 0.13 µg/l. Calcolate la concentrazione di
15 ottobre 2009 Prova scritta di Chimica Analitica 1 con Laboratorio 1. Un campione di aria avente densita d 1.19 g/l contiene una concentrazione di SO 2 pari a 0.13 µg/l. Calcolate la concentrazione di
Chimica Analitica con elementi di statistica Lezione n 4
 Chimica Analitica con elementi di statistica Lezione n 4 Christian Durante E-mail: christian.durante@unipd.it Tel. 049-8275112 Zona quadrilatero ufficio 00 215 02 142 (orario di ricevimento: tutti I giorni
Chimica Analitica con elementi di statistica Lezione n 4 Christian Durante E-mail: christian.durante@unipd.it Tel. 049-8275112 Zona quadrilatero ufficio 00 215 02 142 (orario di ricevimento: tutti I giorni
Appello Straordinario di Chimica Generale ed Inorganica (29 Aprile 2019) Canale M-Z. Testo A
 Appello Straordinario di Chimica Generale ed Inorganica (29 Aprile 2019) Canale M-Z Testo A 1) Una soluzione è ottenuta miscelando 15,00 ml di una soluzione di HCl (MM36,46) 0,360 M, 10,00 ml di una soluzione
Appello Straordinario di Chimica Generale ed Inorganica (29 Aprile 2019) Canale M-Z Testo A 1) Una soluzione è ottenuta miscelando 15,00 ml di una soluzione di HCl (MM36,46) 0,360 M, 10,00 ml di una soluzione
4. In un becker ci sono 50 ml di NaOH 0,10 M. Quale soluzione, se aggiunta alla soluzione nel becker, non provoca variazioni del ph?
 1. Quale tra i seguenti acidi è il più debole? a. CH 3 COOH K a = 1,8*10 5 c. HF K a = 3,5*10 4 b. HCN K a = 4,9*10 10 d. HCNO K a = 1,6*10 4 2. Nell equilibrio: Fe 3+ ( aq ) + SCN ( aq ) Fe(SCN) 2+ (
1. Quale tra i seguenti acidi è il più debole? a. CH 3 COOH K a = 1,8*10 5 c. HF K a = 3,5*10 4 b. HCN K a = 4,9*10 10 d. HCNO K a = 1,6*10 4 2. Nell equilibrio: Fe 3+ ( aq ) + SCN ( aq ) Fe(SCN) 2+ (
In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + +
 Ionizzazione dell Acqua e ph In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + + L acqua è una sostanza anfiprotica, cioè può sia donare che accettare protoni (ioni H + ). Costante
Ionizzazione dell Acqua e ph In acqua pura o in soluzione acquosa, si ha sempre il seguente equilibrio: + + L acqua è una sostanza anfiprotica, cioè può sia donare che accettare protoni (ioni H + ). Costante
CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq) + H 2 O (l)
 2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
TUTORAGGIO CHIMICA A.A. 2018/2019 Tutoraggio Chimica (Prof. L. Pilia) Nicola Melis
 TUTORAGGIO CHIMICA 18.12.2018 1 Es. 1: Il fluoruro di calcio si discioglie in piccole quantità in acqua. Calcolare il valore di K ps sapendo che [Ca 2+ ] = 2,3*10-4 CaF 2 (s) Ca 2+ (aq) + 2 F - (aq) Es.
TUTORAGGIO CHIMICA 18.12.2018 1 Es. 1: Il fluoruro di calcio si discioglie in piccole quantità in acqua. Calcolare il valore di K ps sapendo che [Ca 2+ ] = 2,3*10-4 CaF 2 (s) Ca 2+ (aq) + 2 F - (aq) Es.
La reazione da bilanciare è quindi: Cu + HNO 3 CuNO 3 + NO. Le due semireazioni da bilanciare saranno: HNO 3 NO (1) Cu CuNO 3 (2)
 Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Introducendo rame metallico (Cu) in acido nitrico diluito (HNO 3 ) si forma nitrato di rame (CuNO 3 ) e gas ossido nitrico (NO). Scrivere l equazione chimica bilanciata della reazione. La reazione da bilanciare
Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa
 Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa Esercizio: scrivere la reazione corrispondente ad ogni asterisco e bilanciare. PERMANGANATO Il permanganato di potassio K è un
Osservazioni su alcuni ossidanti comuni che agiscono in soluzione acquosa Esercizio: scrivere la reazione corrispondente ad ogni asterisco e bilanciare. PERMANGANATO Il permanganato di potassio K è un
Titolazioni Redox Dipenden0 dal ph
 Titolazioni Redox Dipenden0 dal ph Poiché molte reazioni redox dipendono fortemente dall ambiente acido o basico in cui sono condo8e, c è da a8endersi che il punto equivalente delle =tolazioni redox che
Titolazioni Redox Dipenden0 dal ph Poiché molte reazioni redox dipendono fortemente dall ambiente acido o basico in cui sono condo8e, c è da a8endersi che il punto equivalente delle =tolazioni redox che
LABORATORIO DI CHIMICA
 LABORATORIO DI CHIMICA Presentazione 3 a ESPERIENZA Titolazione Acido-Base ANALISI VOLUMETRICA Tipi di titolazioni Esistono diversi tipi di titolazione, classificati in funzione della reazione su cui si
LABORATORIO DI CHIMICA Presentazione 3 a ESPERIENZA Titolazione Acido-Base ANALISI VOLUMETRICA Tipi di titolazioni Esistono diversi tipi di titolazione, classificati in funzione della reazione su cui si
Rapporto tra soluto e solvente o soluzione
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Prova in itinere di Chimica Generale 7 Giugno 2012
 Prova in itinere di Chimica Generale 7 Giugno 2012 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Prova in itinere di Chimica Generale 7 Giugno 2012 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Titolazioni Redox. Analisi volumetrica basata su una reazione di ossido-riduzione. La somma delle due coppie coniugate ossido-riduttive
 Titolazioni Redox Analisi volumetrica basata su una reazione di ossido-riduzione Ossidante (accettore di elettroni si riduce) Riducente (donatore di elettroni si ossida) ox 1 + ne - rid 1 rid 2 ox 2 +
Titolazioni Redox Analisi volumetrica basata su una reazione di ossido-riduzione Ossidante (accettore di elettroni si riduce) Riducente (donatore di elettroni si ossida) ox 1 + ne - rid 1 rid 2 ox 2 +
Ossidazione. 4 Fe + 3 O 2 2 Fe 2 O 3
 Reazioni redox Ossidazione Nel linguaggio comune, con il termine di "ossidazione" si intende indicare le trasformazioni che subiscono i metalli (o anche altre sostanze) quando sono esposti all'aria per
Reazioni redox Ossidazione Nel linguaggio comune, con il termine di "ossidazione" si intende indicare le trasformazioni che subiscono i metalli (o anche altre sostanze) quando sono esposti all'aria per
-IDROLISI SALINA- composti ionici = elettroliti forti sono completamente dissociati in cationi e anioni
 SALI: composti ionici = elettroliti forti sono completamente dissociati in cationi e anioni Alcuni sali alterano il ph quando vengono sciolti in acqua. Ciò è dovuto al verificarsi dell idrolisi salina,
SALI: composti ionici = elettroliti forti sono completamente dissociati in cationi e anioni Alcuni sali alterano il ph quando vengono sciolti in acqua. Ciò è dovuto al verificarsi dell idrolisi salina,
Problema 1 Mg + 2HCl H 2 + MgCl 2. di Mg 1 Mg 1 H 2 quindi 0,823 moli di H 2 di H 2
 REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
REAZIONI CHIMICHE 1. Con riferimento alla seguente reazione (da bilanciare): Mg + HCl H 2 + MgCl 2 calcolare i grammi di H 2 che si ottengono facendo reagire completamente 20 g di magnesio. utilizzando
Esame di Chimica Generale 16 Luglio 2013
 Esame di Chimica Generale 16 Luglio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Esame di Chimica Generale 16 Luglio 2013 COGNOME NOME. MATRICOLA 1 2 3 4 5 6 7 8 9 10 Indicazioni per lo svolgimento del compito. Scrivete il vostro Nome e Cognome in STAMPATELLO su ciascuno di questi
Determinazione Complessometriche EDTA
 Determinazione Complessometriche EDTA Complessometria l La complessometria è l'analisi volumetrica che sfrutta le reazioni di formazione di complessi stabili e stechiometricamente definiti. l Un complesso
Determinazione Complessometriche EDTA Complessometria l La complessometria è l'analisi volumetrica che sfrutta le reazioni di formazione di complessi stabili e stechiometricamente definiti. l Un complesso
III verifica 2005/06 (A) Colonna.. Riga...
 Sono riportate le soluzioni commentate del compito A. Per gli altri compiti sono riportate (a volte in maniera succinta) le soluzioni dei quesiti, 2,4,6,8,9. Per gli altri quesiti, potete ricavare il procedimento
Sono riportate le soluzioni commentate del compito A. Per gli altri compiti sono riportate (a volte in maniera succinta) le soluzioni dei quesiti, 2,4,6,8,9. Per gli altri quesiti, potete ricavare il procedimento
CONCENTRAZIONE. Le proprietà delle soluzioni di pendono dalle quantità relative delle sostanze che le compongono.
 1 CONCENTRAZIONE Le proprietà delle soluzioni di pendono dalle quantità relative delle sostanze che le compongono. La concentrazione esprime la composizione quantitiva soluzione. di una Unità di concentrazione
1 CONCENTRAZIONE Le proprietà delle soluzioni di pendono dalle quantità relative delle sostanze che le compongono. La concentrazione esprime la composizione quantitiva soluzione. di una Unità di concentrazione
