Relazione finanziaria annuale al 31 dicembre Relazione finanziaria annuale. al 31 dicembre Pagina 1/106
|
|
|
- Marcello Murgia
- 8 anni fa
- Visualizzazioni
Transcript
1 Relazione finanziaria Pagina 1/106
2 MolMed S.p.A. è un azienda biotecnologica focalizzata su ricerca, sviluppo e validazione clinica di terapie innovative per la cura del cancro. Il portafoglio-prodotti di MolMed comprende due terapeutici antitumorali in sperimentazione clinica: TK, una terapia cellulare che consente il trapianto da donatori di midollo osseo parzialmente compatibili con il paziente, in Fase III per la cura delle leucemie ad alto rischio, e NGR-hTNF, un nuovo agente mirato ai vasi sanguigni tumorali, in Fase III nel mesotelioma pleurico maligno ed in Fase II per la terapia di altri sei diversi tipi di tumori solidi (colon-retto, fegato, polmone a piccole cellule, polmone non microcitico, ovaio e sarcomi dei tessuti molli). MolMed ha sede a Milano, presso il Parco Scientifico Biomedico San Raffaele. Le azioni di MolMed (MLM.MI) sono quotate al MTA gestito da Borsa Italiana (segmento Standard, classe I)
3 Sommario Dati sulla Società... 3 Organi societari in sintesi... 4 Lettera agli Azionisti... 6 Relazione sulla gestione Notizie sulla Società Combattere il cancro Una sfida globale Le terapie sviluppate da MolMed mirano alla cura di tumori gravi ad alto fabbisogno terapeutico Portafoglio-prodotti TK - terapia cellulare per la cura delle leucemie NGR-hTNF - Biofarmaco mirato ai vasi tumorali per la cura dei tumori solidi Attività di ricerca: programma biofarmaci mirati ai vasi o ai tessuti tumorali Attività di sviluppo e produzione GMP Sviluppo Produzione GMP Attività di tutela della proprietà intellettuale Attività di Business Development Attività di comunicazione ed Investor Relations Organizzazione e risorse umane Information technology Agevolazioni e incentivi alla ricerca e sviluppo Corporate Governance Attività di direzione e coordinamento Attuazione del Modello di Organizzazione, Gestione e Controllo (ex D.Lgs. n 231/2001) Operazioni con parti correlate Principali rischi ed incertezze a cui MolMed è esposta Rischi connessi a fattori esterni Rischi strategici e operativi Rischi finanziari Altre informazioni Azioni proprie Tutela delle informazioni e dei dati sensibili MolMed e i temi dell ambiente e della sicurezza sul lavoro Informazioni sulle partecipazioni degli Amministratori, dei direttori generali, sindaci e dirigenti con responsabilità strategiche (art. 79 Regolamento Consob delibera n del ) Principali risultati ottenuti nell esercizio Dati economici e finanziari Dati economici Dati patrimoniali e finanziari Outlook Fatti di rilievo intervenuti dopo la chiusura dell esercizio Evoluzione prevedibile della gestione Proposta di destinazione del risultato di esercizio Pagina 1
4 Prospetti di Bilancio Situazione patrimoniale-finanziaria Conto economico Conto economico complessivo Rendiconto finanziario Prospetto delle variazioni di patrimonio netto Situazione patrimoniale-finanziaria ai sensi della Delibera Consob n del 27 luglio Conto economico ai sensi della Delibera Consob n del 27 luglio Note Informazioni generali Principi contabili e criteri di valutazione Informativa di settore Note di stato patrimoniale Note di conto economico Altre note Attestazione del bilancio d esercizio ai sensi dell art.154-bis del D.lgs. 58/ Relazione della Società di Revisione Relazione del Collegio Sindacale Pagina 2
5 Dati sulla Società Sede legale: Via Olgettina, MILANO (MI) Codice Fiscale: Partita IVA: IT Registro Imprese di Milano: n REA: Capitale sociale: ,14 i.v. Simbolo Borsa Italiana: MLM ISIN: IT Ticker Reuters: MLMD.MI Ticker Bloomberg: MLM IM Azioni circolanti: (100% azioni ordinarie prive di valore nominale) Disclaimer Il presente documento può contenere dichiarazioni previsionali (forward-looking statements). Benché la Società ritenga che le proprie aspettative siano basate su assunti ragionevoli, le dichiarazioni previsionali sono soggette a diversi rischi ed incertezze, ivi inclusi fattori di natura scientifica, imprenditoriale, economica e finanziaria, che potrebbero causare differenze tangibili nei risultati rispetto a quelli anticipati nelle dichiarazioni previsionali. La Società non si assume responsabilità legate all aggiornamento delle dichiarazioni previsionali o al loro adattamento ad eventi o sviluppi futuri. Il presente documento non costituisce offerta o invito alla sottoscrizione oppure all acquisto di azioni di MolMed S.p.A.. Pagina 3
6 Organi societari in sintesi Consiglio di Amministrazione Presidente e Amministratore Delegato Consiglieri Claudio Bordignon Luigi Berlusconi Silvio Bianchi Martini (indipendente) Renato Botti Maurizio Carfagna Paolo M. Castelli Riccardo Cortese (indipendente) Marina Del Bue Alessandro De Nicola (indipendente) Massimiliano Frank Sabina Grossi Alfredo Messina Maurizio Tassi Il Consiglio di Amministrazione, nominato dall Assemblea tenutasi il 26 aprile 2010, rimarrà in carica fino alla data dell Assemblea convocata per l approvazione del bilancio al In data 26 aprile 2010, durante la sua prima riunione a seguito della chiusura dei lavori dell Assemblea, il Consiglio di Amministrazione ha confermato Claudio Bordignon nella carica di Amministratore Delegato. Silvio Bianchi Martini è stato confermato quale Lead Independent Director. Collegio Sindacale Presidente Sindaci effettivi Sindaci supplenti Fabio Scoyni Antonio Marchesi Enrico Scio Alberto Gallo Francesca Meneghel Il Collegio Sindacale, nominato dall Assemblea tenutasi il 26 aprile 2010, rimarrà in carica fino alla data dell Assemblea convocata per l approvazione del bilancio al Comitato per il Controllo Interno Presidente Membri Silvio Bianchi Martini (consigliere indipendente) Alessandro De Nicola (consigliere indipendente) Maurizio Tassi (consigliere) Comitato per la Remunerazione Presidente Membri Alessandro De Nicola (consigliere indipendente) Riccardo Cortese (consigliere indipendente) Sabina Grossi (consigliere) Società di revisione Deloitte & Touche S.p.A. Pagina 4
7 Consiglio Scientifico Il Consiglio Scientifico di MolMed, presieduto dal Professor Claudio Bordignon, è un organismo consultivo indipendente - caratteristico delle Società in cui la qualità dei progetti è determinata dal valore del loro contenuto scientifico - che svolge un importante ruolo di indirizzo in materia di ricerca e sviluppo di nuove strategie terapeutiche, e di verifica esterna oggettiva dei risultati ottenuti. Il Consiglio Scientifico di MolMed offre una combinazione unica di conoscenze ed esperienza di scienziati di livello internazionale, ed è così composto: Claudio Bordignon, Presidente - Membro del Consiglio Scientifico del Consiglio Europeo per la Ricerca (European Research Council), e Professore ordinario di Ematologia all Università Vita- Salute San Raffaele di Milano Carl-Henrik Heldin - Direttore della sede di Uppsala (Svezia) del Ludwig Institute for Cancer Research, e Professore di Biologia Cellulare e Molecolare all'università di Uppsala Robert Kerbel - Senior Scientist del Programma di Ricerca in Biologia Cellulare e Molecolare del Sunnybrook Health Sciences Centre di Toronto (Canada), Professore dei Dipartimenti di Biofisica Medica e di Medicina di Laboratorio e Patobiologia all Università di Toronto, e titolare della cattedra di ricerca nazionale canadese in Biologia dei Tumori, Angiogenesi e Terapia Antiangiogenica Alberto Sobrero - Direttore dell'unità di Oncologia Medica dell'ospedale San Martino di Genova, e membro del Comitato di Revisione dei Protocolli (Protocol Review Committee) dell Organizzazione Europea per la Ricerca e la Terapia del Cancro (EORTC, European Organisation for Research and Treatment of Cancer) Didier Trono - Direttore vicario del polo di competenze "Frontiere della genetica" della Fondazione Nazionale della Scienza svizzera, e decano della scuola di Scienze della vita alla Ecole Polytechnique Fédérale di Losanna (Svizzera) I curricula professionali dei membri del Consiglio Scientifico sono pubblicati sul sito web della Società ( Pagina 5
8 Lettera agli Azionisti Cari Azionisti, Per MolMed, il 2010 è stato un anno caratterizzato da molti risultati importanti. Permettetemi di ricordarne solamente quattro: 1. Per TK, il nostro prodotto di terapia cellulare in sperimentazione clinica di Fase III per le leucemie ad alto rischio, abbiamo ottenuto nuovi dati che dimostrano il ruolo diretto delle cellule TK nel combattere sia le infezioni, sia le ricadute della malattia in pazienti adulti affetti da leucemie ad alto rischio. Inoltre, abbiamo preparato l'espansione internazionale dello studio di Fase III in altri Paesi europei e negli Stati Uniti. 2. Abbiamo iniziato la sperimentazione di Fase III del nostro biofarmaco antitumorale sperimentale NGR-hTNF con uno studio clinico registrativo per il trattamento del mesotelioma pleurico maligno, una grave forma di cancro associata all esposizione all amianto attualmente priva di cure adeguate. Inoltre, abbiamo ottenuto dalla Food and Drug Administration il nulla-osta alla conduzione dello studio anche negli Stati Uniti. Si tratta di uno studio clinico randomizzato, in doppio cieco, placebo-controllato, che prevede l'arruolamento di 390 pazienti adulti e di cui ci attendiamo i risultati nel Abbiamo ottenuto risultati preliminari molto incoraggianti per NGR-hTNF in due ulteriori indicazioni, il carcinoma dell ovaio ed il carcinoma polmonare a piccole cellule, per le quali sono in corso studi clinici di Fase II in combinazione con la doxorubicina che hanno completato l arruolamento nel Oltre a rafforzare la dimostrazione del profilo di sicurezza molto favorevole del farmaco, i dati sono positivi anche in termini di attività clinica: nel carcinoma dell ovaio, l obiettivo primario dello studio è stato già raggiunto dopo la valutazione di meno della metà delle pazienti, mentre nel carcinoma polmonare a piccole cellule è stato ottenuto un tasso di controllo della malattia del 54%. Con questi nuovi dati, abbiamo ora la prova di attività clinica di NGR-hTNF in cinque diversi tipi di tumori solidi, tenendo conto dei risultati degli studi di Fase II già completati nel mesotelioma e nei carcinomi del colon retto e del fegato, che nel 2010 sono stati pubblicati su importanti riviste internazionali di oncologia. 4. In un momento di notevole contrazione dell accesso ai mercati finanziari per le aziende biotech, siamo riusciti a completare un aumento di capitale che ha portato all azienda nuove risorse lorde pari a 58 milioni di Euro. Questi fondi ci permetteranno di sostenere in maniera efficace lo sviluppo clinico ed industriale dei nostri progetti strategici. Con due terapeutici sperimentali altamente innovativi come TK e NGR-hTNF in portafoglio, due studi di Fase III e quattro studi di Fase II in corso in diverse indicazioni oncologiche, oltre a cinque studi clinici di Fase II già completati, MolMed sta confermando il proprio costante progresso verso l'obiettivo di diventare un attore di primo piano nell ambito della terapia del cancro. Oggi MolMed è un azienda consolidata in grado di coprire tutte le fasi di sviluppo, dalla ricerca all intero percorso di sviluppo clinico. I nostri obiettivi sono però più ambiziosi: portare TK sul mercato, presentando la domanda di registrazione già nel 2012 ed ottenere ulteriori dimostrazioni dell attività clinica di NGR-hTNF. Mentre ci avviciniamo a questi obiettivi intendiamo incrementare sostanzialmente il valore per gli azionisti dando maggior visibilità ai nostri progressi. Nel corso del 2010 il prezzo delle azioni di MolMed ha subito le difficili condizioni di mercato e le conseguenze dell aumento di capitale; tuttavia, si può evidenziare che, a fronte di un raddoppio delle azioni circolanti dopo l aumento di capitale, i volumi medi scambiati sono aumentati di circa venti volte, un elemento di maggiore attrattività del titolo per i grandi investitori internazionali. Ci aspettiamo che il 2011 sia un anno di svolta per iniziare a recuperare terreno sul fronte del valore del titolo. Abbiamo quindi individuato cinque priorità fondamentali per il 2011 al fine di incrementare il valore per gli azionisti. In primo luogo proseguire nell avanzamento dello sviluppo clinico di TK e di NGR-hTNF. A seguito del nulla-osta ottenuto nel gennaio 2011 dalla Food and Drug Administration, includeremo centri clinici negli Stati Uniti nello studio di Fase III di TK, oltre ad attivare altri centri clinici in Pagina 6
9 diversi Paesi europei. Proseguiremo anche l espansione internazionale dello studio di Fase III di NGR-hTNF per il mesotelioma, attualmente in corso in 11 centri in Italia ed in Polonia: intendiamo coinvolgere fino a 45 centri in Europa, Stati Uniti e Canada. Inoltre, ci aspettiamo che la presentazione dei risultati di uno studio randomizzato di Fase II di NGR-hTNF nel cancro del polmone, prevista in giugno nel corso del convegno dell American Society of Clinical Oncology (ASCO), costituirà una tappa importante per poter scegliere entro la fine dell anno la seconda indicazione per la sperimentazione clinica di Fase III. In secondo luogo prepararci per il futuro iter di registrazione dei farmaci. Mentre procedono gli studi clinici di Fase III, uno dei nostri obiettivi è di mantenere un dialogo costante con le autorità regolatorie europee e statunitensi al fine di ottemperare adeguatamente alle loro richieste. Stiamo procedendo a rafforzare e adeguare l organizzazione aziendale per garantire un percorso ottimale alla futura domanda di registrazione dei nostri farmaci sperimentali. Stiamo anche lavorando all automazione del processo di produzione di TK per incrementare la produttività del nostro sito di produzione. In terzo luogo intensificare le attività di Business Development. La disponibilità di ulteriori risultati clinici di NGR-hTNF, ed in particolare dei primi dati da studi randomizzati, dovrebbe aumentare l attrattività del prodotto nei confronti dell industria farmaceutica. In quarto luogo gestire con efficacia le risorse finanziarie. Resta di primaria importanza il mantenimento di un rigoroso controllo sui costi al fine di preservare la nostra indipendenza finanziaria anche in assenza di accordi di licenza. D altro canto, ci attendiamo di aumentare i ricavi da servizi, a cominciare dal recentissimo accordo appena sottoscritto con la Fondazione Telethon per lo sviluppo e la produzione di terapie geniche per malattie genetiche rare. In quinto luogo rafforzare le attività di Investor Relations. L incremento dei volumi azionari scambiati, il raddoppio del flottante del titolo, un programma di sviluppo clinico avanzato in costante progresso ed un flusso significativo di nuovi dati nel 2011 e nel 2012, costituiscono le basi per rafforzare le nostre attività di Investor Relations nel corso dei prossimi due anni. Queste attività saranno portate avanti in linea con l obiettivo di creare valore per gli azionisti. Cari Azionisti, crediamo che le aziende farmaceutiche siano alla ricerca - ed i pazienti in attesa - di nuove terapie in ambito oncologico, dato che le opzioni di trattamento attuali non sono ancora soddisfacenti, nonostante gli indubbi progressi compiuti dalla medicina negli ultimi anni. MolMed è sulla strada giusta per portare il suo contributo alla lotta contro il cancro, nonostante le normali incertezze insite nel percorso di sviluppo di nuovi prodotti terapeutici. Speriamo di riuscire, presto, a fornire terapie innovative in risposta alle urgenti esigenze terapeutiche dei pazienti. Permettetemi di concludere ringraziando in modo particolare tutti i nostri stakeholders. Con il loro contributo e sostegno hanno permesso a MolMed di conseguire i risultati significativi ottenuti nel 2010 e di portare avanti la nostra missione volta ad affrontare malattie oncologiche difficili, che costituiscono un pesante fardello per le persone e la società. Speriamo vivamente di continuare insieme lungo questo cammino verso il successo. Claudio Bordignon Presidente e Amministratore Delegato Pagina 7
10 Relazione sulla gestione 1. NOTIZIE SULLA SOCIETÀ MolMed è una società di biotecnologie mediche, nata nel 1996 e focalizzata su ricerca, sviluppo e validazione clinica di terapie innovative per la cura del cancro. Da marzo, MolMed è quotata sul segmento Standard, classe I, del Mercato Telematico Azionario (MTA) gestito da Borsa Italiana. MolMed è stata costituita come spin-off dell Istituto Scientifico San Raffaele nel campo della terapia genica e cellulare, applicata sia a malattie genetiche rare sia alle neoplasie ematologiche, con i primi studi clinici in pazienti affetti da leucemia. A partire dal 2000, si è evoluta da società di servizi ad azienda di prodotto, con una focalizzazione primaria su nuove terapie per la cura del cancro. Oggi, MolMed è un azienda consolidata, in grado di svolgere in proprio tutte le funzioni proprie di un azienda biotecnologica di prodotto, dalla ricerca di base, alla produzione, fino alla validazione clinica delle proprie terapie sperimentali. L approccio di MolMed alla terapia del cancro è basato su una strategia integrata, che mira, da un lato, all identificazione e allo sviluppo di farmaci in grado di ridurre la massa tumorale e di rallentarne la crescita e, dall altro, alla messa a punto di terapie altamente selettive per l eliminazione del tessuto tumorale residuo. MolMed ha un portafoglio-prodotti unico per innovatività, diversificazione degli approcci terapeutici e peculiarità tecnologiche. Le sue terapie sperimentali sono nuove, completamente originali, capostipiti di nuove classi di prodotti terapeutici. MolMed ha sede a Milano, all interno del parco scientifico biomedico San Raffaele. Questa sede offre vantaggi importanti, permettendo a MolMed di complementare le proprie risorse di ricerca e di sviluppo clinico con le eccellenti risorse e capacità scientifiche, tecnologiche e cliniche offerte dall istituzione che la ospita. In particolare, MolMed detiene un diritto di opzione su tutta la proprietà intellettuale generata dai progetti di ricerca condotti dall Istituto Scientifico San Raffaele nell ambito della terapia genica e molecolare in campo oncologico. A livello internazionale, la Società ha instaurato dal 2003 un alleanza strategica con Takara Bio Inc., importante azienda biotecnologica giapponese quotata sul mercato azionario di Tokio, attraverso accordi di co-sviluppo e di licenza dei prodotti di terapia cellulare di MolMed per i principali mercati asiatici. La mission di MolMed è principalmente quella di concentrare impegno e risorse nello sviluppo di nuove cure per il cancro, combinando l eccellenza scientifica e di ricerca con un alta efficienza nella gestione aziendale, focalizzata su un chiaro progetto industriale. Pagina 8
11 2. COMBATTERE IL CANCRO 2.1 Una sfida globale L attività di MolMed è focalizzata sull oncologia medica, l area terapeutica rivolta a combattere il cancro. Per cancro (o tumore maligno, o neoplasia), si intende qualsiasi tipo di crescita cellulare causata da un anormale ed incontrollata proliferazione locale, che può avere origine in tessuti diversi, e la sua disseminazione, attraverso il flusso sanguigno o il sistema linfatico, ad altri organi, dando origine al processo di metastatizzazione a distanza. Di fatto, il cancro è in realtà un ampio ed eterogeneo gruppo di malattie composto da oltre 200 tipi diversi di tumori, comunemente suddivisi in due grandi categorie: i tumori solidi e quelli del sangue (o neoplasie ematologiche). Le modalità di trattamento convenzionali disponibili per i tumori solidi sono la chirurgia, la radioterapia e la farmacoterapia (o chemioterapia). La resezione chirurgica precoce è potenzialmente curativa per alcuni tipi di tumore. Tuttavia, il ricorso alla chirurgia a volte non è risolutivo, o è addirittura impraticabile per pazienti affetti da malattia in stadio avanzato. In questo caso, le opzioni disponibili sono solamente radioterapia e farmacoterapia, spesso impiegate in combinazione sequenziale. Per i tumori del sangue (leucemie e linfomi), questi trattamenti sono spesso seguiti dal trapianto di cellule staminali emopoietiche. Nell ambito delle farmacoterapie, quelle oggi disponibili e più largamente diffuse sono basate su regimi che impiegano agenti citotossici, conosciuti come chemioterapie e caratterizzati da elevata tossicità, mancanza di specificità e benefici clinici spesso limitati nel tempo, che costringono i pazienti a passare da una linea di trattamento ad un altra (se disponibile) una volta divenuti refrattari al trattamento in corso, o quando sia stata raggiunta la massima tossicità cumulativa tollerata. Benefici clinici limitati nel tempo ed elevata tossicità degli attuali trattamenti consolidati determinano perciò un alto livello di fabbisogno terapeutico in oncologia, rendendola un area ad alta densità di investimenti in ricerca e sviluppo e a potenziale molto elevato per nuove terapie basate su una migliore comprensione dei meccanismi alla base della trasformazione e della crescita tumorale, in grado quindi di offrire una maggiore selettività, una riduzione della tossicità ed un incremento dell efficacia curativa e della sopravvivenza dei pazienti. Attualmente, l oncologia costituisce il segmento principale del mercato farmaceutico complessivo, ed anche quello in più rapida crescita 1. In Europa, Stati Uniti d America e Giappone il cancro è la seconda più diffusa causa di morte, ed in tempi recenti è stata osservata una crescita dell insorgenza di nuovi casi. Questo fenomeno è dovuto ad una combinazione di svariati fattori. In primo luogo, l invecchiamento della popolazione a livello mondiale. Questo comporta di per sé un incremento nell incidenza del cancro, considerato che il rischio d insorgenza per tutti i tipi di tumore aumenta con l età. Inoltre, man mano che le terapie antitumorali diventano più efficaci nel prolungare la sopravvivenza dei pazienti, aumenta il numero di pazienti che convivono con la malattia. E proprio il livello estremamente elevato del fabbisogno terapeutico in oncologia, in particolar modo per alcuni tipi di tumori, ad aver determinato in modo decisivo l avvento delle terapie innovative, basate su farmaci biologici o comunque derivate dall impiego delle biotecnologie. Le terapie innovative hanno in comune la caratteristica di essere specifiche e mirate, vale a dire dirette verso determinati bersagli molecolari coinvolti nella trasformazione tumorale o nella sua crescita, e grazie all azione mirata presentano una notevole riduzione della tossicità sistemica rispetto alle terapie convenzionali. I bersagli molecolari dei nuovi farmaci mirati possono essere specifici per un particolare tipo di tumore, oppure essere comuni a cellule di tumori diversi, o ancora essere caratteristici dei vasi sanguigni che alimentano la massa tumorale oppure dei fattori che ne alimentano la formazione e la 1 IMS Health Top 15 Global Therapeutic Classes, IMS Health, Pagina 9
12 crescita: nel secondo e terzo caso, offrono l opportunità di un espansione trasversale della terapia, con potenziale applicazione per diverse indicazioni oncologiche. Infine, le nuove terapie mirate spesso possono essere impiegate sia come nuove opzioni alternative ai regimi esistenti, sia come agenti potenziatori o in sinergia coi regimi esistenti stessi. La tendenza corrente nella ricerca sul cancro è l impiego di una combinazione di diverse classi di agenti terapeutici anziché di un unico approccio: in prospettiva, l introduzione sul mercato di terapie innovative di nuova generazione dovrebbe permettere un ulteriore incremento della sopravvivenza e della qualità della vita dei pazienti, avvicinando l obiettivo di ridurre le patologie tumorali oggi rapidamente progressive e con esito mortale a malattie croniche controllate. I prodotti e le strategie terapeutiche messe a punto da MolMed si inseriscono specificamente lungo questi filoni di identificazione e sviluppo di nuovi agenti biologici anti-tumorali. 2.2 Le terapie sviluppate da MolMed mirano alla cura di tumori gravi ad alto fabbisogno terapeutico Le attività di MolMed consistono principalmente nell identificazione, caratterizzazione e sviluppo pre-clinico, clinico e farmaceutico - di nuove terapie per indicazioni oncologiche molto diverse per tipologia e diffusione, ma accomunate dalla gravità e da un effettivo bisogno di nuove opzioni terapeutiche. Incidenza (Europa, Nordamerica, Giappone e Australia) Colon-retto Polmone Nessuna o scarsa (NSCLC) disponibilità di opzioni terapeutiche approvate o in sviluppo in: NGR-hTNF Prima/seconda linea Terza/quarta linea Polmone Designazione (SCLC) medicinale orfano in Leucemia Fegato UE & USA Ovaio Sarcomi 1 Mesotelioma 0 TK 1 0,00 0,33 0,67 1,00 Tasso di mortalità rispetto all incidenza Fabbisogno terapeutico Figura 1. Indicazioni delle terapie sperimentali di MolMed negli studi clinici in corso (linee piene) o in programma (linea tratteggiata) Fonti: Globocan Database ; 1 stima MolMed Da un lato, l attenzione della società è focalizzata su tumori considerati rari o comunque poco diffusi, sebbene in rapida crescita a causa di esposizione a condizioni ambientali che ne costituiscono concause di insorgenza, per i quali le opzioni terapeutiche attualmente disponibili sono scarsissime o addirittura mancanti, come nel caso delle leucemie acute ad alto rischio, del mesotelioma pleurico maligno, del carcinoma primario del fegato, del carcinoma polmonare a piccole cellule (SCLC) e dei sarcomi dei tessuti molli. D altro lato, la sperimentazione clinica delle terapie di MolMed è indirizzata a tumori molto più diffusi e quindi oggetto di maggiore attenzione dal punto di vista dello sviluppo o della disponibilità di opzioni terapeutiche - quali i carcinomi del colon-retto, dell ovaio e del polmone non microcitico (NSCLC) - ma per i quali molti dei pazienti sviluppano, nel corso del tempo, intolleranza per Pagina 10
13 raggiunta tossicità cumulativa, oppure refrattarietà per perdita di efficacia nel controllo della malattia. Per questi pazienti pesantemente pre-trattati, per i quali non vi sono più linee di trattamento efficaci, MolMed è impegnata nello sforzo di offrire una nuova opzione terapeutica. Per affrontare con successo la cura di ciascuno di questi tumori, MolMed sta sviluppando due terapie sperimentali, entrambe nuove, completamente originali e capostipiti di nuove classi terapeutiche, frutto di due differenti approcci tecnologici: TK, un prodotto di terapia cellulare per il trattamento dei tumori del sangue: si tratta di una terapia volta a rendere accessibile a tutti i pazienti le potenzialità curative del trapianto di cellule staminali del sangue derivate dal midollo osseo di un donatore sano, che oggi è praticabile in maniera sicura ed efficace solamente nel caso in cui il donatore sia pienamente compatibile con il paziente, condizione che si verifica solamente per il 50% dei pazienti candidati alla cura; NGR-hTNF, un biofarmaco mirato ai vasi tumorali per il trattamento dei tumori solidi: questo approccio si avvale di un particolare tipo di farmaco, un agente selettivo il cui bersaglio molecolare è una struttura presente unicamente sulle pareti dei vasi sanguigni che alimentano la massa tumorale. L azione antivascolare del farmaco taglia i rifornimenti di ossigeno e nutrienti al tumore, bloccandone la crescita. Pagina 11
14 3. PORTAFOGLIO-PRODOTTI Il portafoglio-prodotti di MolMed è capeggiato dai due antitumorali in sperimentazione clinica avanzata, TK e NGR-hTNF. Anche nell esercizio 2010, la maggior parte delle attività svolte dalle diverse funzioni aziendali è stata focalizzata in particolare sullo sviluppo clinico e farmaceutico di questi due prodotti sperimentali. Prodotto TK Indicazione (codice studio) Leucemie alto rischio (TK007, TK008) Leucemie/Giappone [Takara] NGR-hTNF Tumori solidi [ DMT] (EORTC 16041) Tumori solidi [bassa dose] (NGR002) Fase I randomizzato (2 studi) Fase II Fase III monoterapia Carcinoma colon-retto (NGR006) Carcinoma fegato (NGR008) Mesotelioma (NGR010, NGR015) Tumori solidi [alta dose] (NGR013) randomizzato + Xelox Carcinoma colon-retto (NGR005) + cisplatino Tumori solidi (NGR004) + cis/gem Carcinoma polmonare/nsclc (NGR014) cis/pem Tumori solidi (NGR003) + doxorubicina Carcinoma polmonare/sclc (NGR007) Carcinoma ovaio (NGR012) randomizzato Sarcomi dei tessuti molli (NGR016) randomizzato Legenda per gli studi clinici: in corso completato Figura 2. Il portafoglio-prodotti di MolMed 3.1 TK - terapia cellulare per la cura delle leucemie TK è un prodotto sperimentale di terapia cellulare basata su cellule ingegnerizzate, che rende praticabile in maniera più sicura ed efficace il trapianto di cellule staminali emopoietiche (HSCT) anche da donatori parzialmente compatibili con il paziente, aprendo a tutti la porta di questa pratica, che costituisce l unica terapia potenzialmente curativa disponibile, in particolare per le leucemie ad alto rischio. Il trapianto di cellule staminali permette di rigenerare il sistema emopoietico ed immunitario di un paziente leucemico, gravemente compromesso dalla malattia e dalle cure di radio e farmacoterapia cui deve sottoporsi prima del trapianto; il trapianto però ha bisogno di tempo - diversi mesi - per differenziarsi nelle cellule mature di un sistema immunitario pienamente funzionale. Nel frattempo, il paziente è privo di difese contro le infezioni e contro le ricadute leucemiche, ed è necessario che possa fruire di una protezione sostitutiva: in caso di piena compatibilità del donatore, questa viene fornita dai linfociti T del donatore stesso, in grado di combattere le infezioni, ed anche di riconoscere ed eliminare cellule tumorali residue. Tuttavia, i linfociti del donatore non possono venire impiegati come protezione sostitutiva se il donatore è solo parzialmente compatibile con il paziente, perché in tal caso si rivelano un arma a doppio taglio: da un lato forniscono un effetto immunoterapeutico efficace contro infezioni e ricadute leucemiche, dall altro però comportano un altissimo rischio di aggressione anche ai tessuti normali del paziente, noto come malattia del trapianto verso l ospite (GvHD), procurando danni gravissimi. Questo limite ne ha finora impedito l uso in tutti i casi di non perfetta compatibilità tra donatore e paziente, vanificando l opzione del trapianto per la metà dei pazienti leucemici. La terapia TK è stata progettata per permettere di beneficiare dell azione protettiva dei linfociti T del donatore, indispensabile per l effettivo successo del trapianto, anche in caso di compatibilità solamente parziale tra donatore e paziente. La terapia TK consiste nel modificare geneticamente i linfociti del donatore in modo da dotarli di un sistema di spegnimento mirato, che si attivi solamente per le cellule coinvolte nell innesco di GvHD. A tale scopo, i linfociti T del donatore vengono Pagina 12
15 trasdotti con un gene - TK, appunto - che li rende sensibili ad un semplice farmaco antivirale, il ganciclovir. In caso di insorgenza di GvHD, i linfociti coinvolti nell aggressione, e solo quelli, possono essere prontamente eliminati con la somministrazione del farmaco alla comparsa dei primi sintomi. TK permette quindi di mantenere tutti i benefici di presidio immunitario supplente svolto dai linfociti T del donatore, per il tempo necessario al trapianto di cellule staminali per generare un sistema immunitario nuovo, completo e duraturo, ed apre così la porta del trapianto a tutti, dato che un donatore familiare parzialmente compatibile è prontamente disponibile praticamente per ogni paziente candidato alla cura. TK ha ottenuto la designazione di Medicinale Orfano sia nell Unione Europea, sia negli Stati Uniti. Cellule staminali emopoietiche del donatore (HSC) Haemat. stem cells Trapianto HSC (giorno 0) Ospedale InfusioneTK (giorno +28) Cellule TK TK cells Protezione contro le infezioni (GvI), favorendo l attecchimento del trapianto Protezione contro le ricadute della leucemia (GvL) Donatore aploidentico T cells Paziente Officina GMP di MolMed Trasduzione, selezione ed espansione dei linfociti T del donatore Malattia del trapianto verso l ospite (GvHD) abrogazione mediante la somministrazione di ganciclovir Linfociti T del donatore HSV-TK Figura 3. Sintesi della procedura della terapia TK nel trapianto da donatore parzialmente compatibile E attualmente in corso in Italia la sperimentazione di Fase III (TK008) di TK in pazienti affetti da leucemie acute ad alto rischio sottoposti a trapianto da donatori parzialmente compatibili. Si tratta di uno studio clinico randomizzato su larga scala, volto alla dimostrazione dell efficacia terapeutica e della tolleranza del prodotto sperimentale nella sua formulazione finale, nei termini richiesti per i requisiti di mercato. Lo studio prevede l arruolamento di 152 pazienti, con un tasso di randomizzazione di 3:1 in favore della terapia TK. Gli obiettivi principali dello studio comprendono la riduzione del tasso di mortalità legata alla pratica del trapianto da donatore parzialmente compatibile e la sopravvivenza globale. Si tratta della prima sperimentazione di Fase III mai autorizzata in Italia per una terapia cellulare che comporti l uso di cellule ingegnerizzate. Per quanto riguarda l espansione internazionale dello studio di Fase III TK008, in programma per il 2011, nel corso del 2010 è stata depositata presso la Food and Drug Administration (FDA), l autorità federale statunitense per i farmaci, la richiesta relativa alla conduzione della sperimentazione clinica di Fase III di TK negli Stati Uniti. La richiesta ha ottenuto il nulla-osta della FDA il 5 gennaio 2011, e consente di includere nello studio TK008 pazienti arruolati in centri clinici degli Stati Uniti. La sperimentazione di Fase III è stata avviata a seguito dell esito molto positivo di uno studio di Fase II (TK007), pubblicato a maggio 2009 dalla prestigiosa rivista medica The Lancet Oncology 2, in cui è stato dimostrato che l introduzione della terapia TK permette di ottenere una rapida ed efficace immunoricostituzione, abbattendo la mortalità legata a questo tipo di trapianto e permettendo la sopravvivenza a lungo termine dei pazienti trattati. Nel corso del 2010, sono stati presentati ai convegni annuali della Società americana di oncologia clinica (ASCO) e della Società americana di ematologia (ASH) nuovi dati clinici ottenuti dal monitoraggio di lungo termine dello studio, che chiariscono le modalità con cui le cellule TK svolgono un ruolo diretto da un lato nel combattere le 2 Ciceri, Bonini et al, Infusion of suicide-gene-engineered donor lymphocytes after family haploidentical haemopoietic stemcell transplantation for leukaemia (the TK007 trial): a non-randomised phase I-II study, Lancet Oncol May 1;10: Pagina 13
16 ricadute leucemiche, e dall altro nel promuovere l immunoricostituzione in pazienti adulti: in particolare, la rigenerazione del sistema immunitario viene promossa dalle cellule TK attraverso la stimolazione della produzione di Interleuchina-7, una proteina che svolge un ruolo chiave nello sviluppo della risposta immune 3. Il poster presentato ad ASCO 2010 è consultabile sul sito web della Società ( nella sezione Prodotti/TK. Per quanto riguarda la produzione di TK, nel corso del 2010 è stato varato il progetto di sviluppo di un sistema automatizzato, che ha ottenuto un finanziamento a fondo perduto che ammonta complessivamente a Euro 1,4 milioni circa da parte della Regione Lombardia, di cui Euro 499 migliaia spettanti alla società, a parziale copertura delle spese di R&S sostenute per un periodo di 36 mesi. Il progetto viene svolto in collaborazione con Areta International S.r.l. e Datamed S.r.l.. Areta si occuperà della messa a punto di un processo ottimizzato di produzione e purificazione dell anticorpo monoclonale impiegato per la selezione delle cellule TK, e Datamed sarà responsabile di progettazione, ottimizzazione e collegamento dei moduli hardware e software del sistema. Gli abstracts delle principali pubblicazioni relative a TK sono consultabili sul sito web della Società ( nella sezione Prodotti/Principali Pubblicazioni. 3.2 NGR-hTNF - Biofarmaco mirato ai vasi tumorali per la cura dei tumori solidi NGR-hTNF è un agente selettivo mirato ai vasi tumorali con modalità d azione unica, primo nella classe dei complessi peptide/citochina in grado di mirare selettivamente ai vasi tumorali. E una proteina omotrimerica, in cui ciascuno dei tre monomeri è formato dalla combinazione della potente citochina antitumorale htnf con un peptide (NGR) che lega selettivamente [ un particolare complesso recettoriale, comprendente/il recettore] CD13, presente solamente sulla superficie delle cellule endoteliali che formano le pareti dei vasi sanguigni che alimentano il tumore. Peptide CNGRCG ciclico: Lega selettivamente il recettore CD13, espresso sulla superficie dei vasi tumorali neoformati TNF umano (htnf): Potente azione antitumorale Approvato solo per uso locoregionale; uso sistemico impedito dalla tossicità Distrugge la funzionalità dei vasi tumorali Figura 4. Struttura di un monomero della molecola di NGR-hTNF, e proprietà delle sue componenti. NGR-hTNF agisce in modo mirato sui vasi sanguigni che alimentano la massa tumorale, svolgendo un attività antivascolare che permette, tra l altro, di migliorare l accesso al tessuto tumorale dei farmaci somministrati in combinazione, incrementandone l efficacia. Per questo, può essere 3 ASCO 2010, poster 6534; ASH 2010, abstract 833 Pagina 14
17 impiegato sia come nuova opzione terapeutica a sé stante, sia in combinazione sinergica con la maggior parte dei regimi chemioterapici correnti. Rispetto a tutti gli altri farmaci comunemente classificati come agenti che distruggono i vasi tumorali, NGR-hTNF appare esercitare la propria attività antivascolare ed antitumorale senza provocare l innesco di meccanismi contro-regolatori dannosi: in particolare, non provoca né l incremento presso il sito tumorale di infiltrati di cellule provenienti dal midollo osseo, né l aumento di fattori di crescita in circolo, due fenomeni che stimolano la crescita di nuovi vasi tumorali, la ricrescita del tessuto tumorale dopo la terapia e la formazione di metastasi. Lo sviluppo clinico di NGR-hTNF comprende la sperimentazione sia come nuova opzione terapeutica a sé stante (monoterapia), sia in combinazione con diversi regimi chemioterapici, per un totale di sette indicazioni: carcinomi del colon-retto, del fegato, del polmone - a piccole cellule (SCLC) e non microcitico (NSCLC) - e dell ovaio, mesotelioma pleurico maligno e sarcomi dei tessuti molli. Per il mesotelioma maligno ed il carcinoma primario del fegato, NGR-hTNF è stato designato medicinale orfano sia negli Stati Uniti sia nell Unione Europea, dove è iscritto nel registro comunitario dei medicinali orfani ad uso umano con il codice EU/3/08/549 per il mesotelioma maligno, e con il codice EU/3/09/686 per il carcinoma primario del fegato. Ad aprile 2010, è iniziato in Italia uno studio clinico registrativo multicentro internazionale di Fase III (NGR015) per il trattamento del mesotelioma pleurico maligno. Lo studio, randomizzato in doppiocieco e placebo-controllato, prevede l arruolamento di 390 pazienti adulti affetti da mesotelioma pleurico maligno, in progressione di malattia dopo il trattamento con la chemioterapia standard a base di pemetrexed, l unico trattamento approvato oggi disponibile. La sperimentazione prevede la somministrazione di NGR-hTNF in aggiunta alla miglior scelta dello sperimentatore (MSS), confrontata con la somministrazione di un placebo in aggiunta alla MSS, dove la MSS consiste nella terapia di supporto da sola, oppure combinata con un agente chemioterapico scelto tra doxorubicina, gemcitabina o vinorelbina. La randomizzazione è di 1:1 tra NGR-hTNF e placebo. Lo sperimentatore stabilisce per ciascun paziente il trattamento più adatto tra terapia di supporto da sola, oppure combinata con chemioterapia; in seguito, i pazienti vengono randomizzati tra i due bracci di trattamento secondo alcuni specifici fattori di stratificazione. NGR-hTNF viene somministrato al dosaggio di 0,8 μg/m 2 una volta alla settimana fino a progressione della malattia, ed il placebo segue le stesse modalità di somministrazione nel braccio di controllo. Obiettivo principale dello studio è l incremento della sopravvivenza globale; gli obiettivi secondari includono incremento della sopravvivenza senza progressione di malattia, tasso e durata del controllo di malattia, profilo di sicurezza e qualità della vita dei pazienti. A maggio 2010, MolMed ha ottenuto dalla Food and Drug Administration (FDA), l autorità federale statunitense per i farmaci, il nulla osta alla richiesta relativa all avvio dello studio negli Stati Uniti. E inoltre prevista l attivazione di centri clinici in altri Paesi europei. Ad ottobre 2010, sono stati presentati al convegno della Società europea di oncologia medica (ESMO) i primi risultati di tre studi clinici: due studi di Fase II in combinazione con doxorubicina, in pazienti affetti da carcinoma dell ovaio (NGR012) e da carcinoma polmonare a piccole cellule (NGR007), ed uno studio di Fase I (NGR013) come monoterapia somministrata a dosi elevate crescenti a pazienti pesantemente pre-trattati, affetti da diversi tipi di tumori solidi. Tutti e tre gli studi clinici presentati ad ESMO vanno a rafforzare sempre di più la dimostrazione di un profilo di sicurezza estremamente favorevole di NGR-hTNF, senza alcun aggravio della tossicità in combinazione con doxorubicina, e senza alcuna tossicità limitante come monoterapia a dosi elevate. Inoltre, con i nuovi dati di Fase II nei carcinomi del polmone a piccole cellule e nell ovaio, è stata raggiunta l evidenza di attività clinica di NGR-hTNF in cinque diversi tipi di tumori solidi. I dati essenziali dei risultati presentati ad ESMO sono sintetizzati qui di seguito: Nello studio NGR012 per il trattamento del carcinoma dell ovaio ricorrente o in progressione, che ha arruolato 37 pazienti (arruolamento completato nel corso del 2010), l analisi preliminare delle prime 17 pazienti ha mostrato un tasso di controllo della malattia pari al 70%, con una durata mediana della sopravvivenza senza progressione pari a 5 mesi. In particolare, l obiettivo principale dello studio - almeno sei risposte su 37 pazienti - è stato raggiunto dopo l analisi di Pagina 15
18 meno della metà delle pazienti arruolate 4. MolMed intende ora proseguire la sperimentazione con uno studio randomizzato di Fase II che confronterà la combinazione di NGR-hTNF e doxorubicina con l attuale chemioterapia standard a base di doxorubicina. Nello studio NGR007 per il trattamento del carcinoma polmonare a piccole cellule in recidiva, che ha arruolato 28 pazienti (arruolamento completato nel corso del 2010), i primi risultati su 26 pazienti mostrano un tasso di controllo della malattia pari al 54%, mantenuto con una durata mediana della sopravvivenza senza progressione pari a 3,2 mesi 5. Nello studio NGR013, per sperimentazione di NGR-hTNF ad alte dosi in pazienti pesantemente pretrattati affetti da diversi tipi di tumori solidi, che finora ha arruolato 32 pazienti, viene valutata la somministrazione a dosi crescenti, più elevate rispetto a quella precedentemente identificata come dose limitante quando somministrata per infusione endovenosa della durata di un ora. I primi risultati presentati, riguardanti l esplorazione di otto livelli di dose fino a 200 μg/m 2, mostrano che NGR-hTNF può venire somministrato in sicurezza prolungando il tempo di infusione a due ore ed applicando una blanda pre-medicazione con paracetamolo 6. Attualmente, lo studio prosegue l arruolamento per l esplorazione di ulteriori livelli crescenti di dose, fino a 325 μg/m 2. Tra maggio e settembre 2010, i risultati clinici ottenuti in quattro studi di Fase II completati, tre come monoterapia - nel carcinoma del colon-retto (NGR006), nel carcinoma del fegato (NGR008), e nel mesotelioma pleurico maligno (NGR010) - ed uno nel carcinoma del colon-retto in combinazione con il regime Xelox (NGR005), sono stati oggetto di lavori pubblicati come full papers su primarie riviste internazionali di oncologia medica: Lo studio NGR010 nel mesotelioma pleurico maligno, il cui esito positivo ha fornito il razionale per il passaggio alla Fase III in questa indicazione, è stato pubblicato dal Journal of Clinical Oncology 7. L esito dello studio, condotto su 57 pazienti in stadio avanzato e pre-trattati con la chemioterapia standard, ha mostrato un tasso complessivo di controllo della malattia del 46%, con durata mediana di 4,7 mesi. Un chiaro vantaggio dell intensificazione della frequenza del trattamento, da trisettimanale a settimanale, è stato evidenziato in termini di durata del controllo della malattia (9,1 vs 4,4 mesi). Il beneficio clinico si è tradotto in un prolungamento della sopravvivenza globale, che nei pazienti con controllo iniziale della malattia risulta raddoppiata. Lo studio NGR006 nel carcinoma del colon-retto è stato pubblicato dallo European Journal of Cancer 8. L esito dello studio, condotto su 46 pazienti affetti da carcinoma del colon-retto avanzato e massicciamente pre-trattati, dimostra che la durata della sopravivenza globale mediana risulta raddoppiata rispetto ai controlli storici, un dato di particolare rilevanza clinica. Anche se il tasso di sopravvivenza libera da progressione di malattia non è stato raggiunto statisticamente, i dati complessivi mostrano un rallentamento della progressione tumorale indotta da NGR-hTNF, con un tasso di controllo della malattia pari al 39% per un tempo mediano di 3,8 mesi e una sopravvivenza globale mediana di oltre un anno (13,1 mesi), più che raddoppiata rispetto ai dati dei controlli storici sia per le terapie di supporto, sia per i farmaci biologici già registrati per il trattamento di questo tipo di tumore (farmaci anti-egfr, che inibiscono il recettore del fattore di crescita dell epidermide). Inoltre, nei pazienti trattati con NGR-hTNF, la durata della sopravvivenza mediana globale risulta ulteriormente raddoppiata nel gruppo di 4 ESMO 2010, poster ESMO 2010, poster ESMO 2010, poster Gregorc V, Zucali PA, Santoro A, Ceresoli G.L., Citterio G., De Pas TM, Zilenmbo N, De Vincenzo F, Simonelli M, Rossoni G, Spreafico A, Viganò MG, Fontana F, De Braud FG, Bajetta E., Caligaris-Cappio F, Bruzzi P, Lambiase A, Bordignon C., Phase II Study of Asparagine-Glycine-Arginine- Human Tumor Necrosis factor alpha, a selective vascular targeting agent, in priviously treated patients with malignant pleural mesothelioma, Journal of Clinical Oncology (2010), Vol 28, n. 15: Santoro A, Rimassa L, Sobrero A, Citterio G, Sclafani F, Carnaghi C, Pessino A, Caprioni F, Andretta V, Tronconi MC, Finocchiaro G, Rossoni G, Zanoni A, Miggiano C, Rizzardi GP, Traversari C, Caligaris-Cappio F, Lambiase A, Bordignon C, : Phase II study of NGR-hTNF, a selective vascular targeting agent, in patients with metastatic colorectal cancer after failure of standard therapy, European Journal of Cancer, 46 (15): , ottobre 2010 (pubblicazione anteprima online il 16 agosto 2010) Pagina 16
19 pazienti non precedentemente trattati con farmaci biologici (22,9 mesi) rispetto ai pazienti che sono stati pre-trattati con questa classe di farmaci (10,9 mesi). Lo studio NGR008 nel carcinoma del fegato è stato pubblicato dal British Journal of Cancer 9. L esito dello studio, condotto su 40 pazienti pre-trattati affetti da carcinoma primario del fegato in stadio avanzato e resistenti a trattamenti loco-regionali e/o sistemici, mostra una chiara evidenza di attività antitumorale di NGR-hTNF in questo tipo di tumore. I dati complessivi indicano un tasso di controllo della malattia pari al 30% mantenuto per una durata mediana di 4,3 mesi, ed una sopravvivenza globale mediana pari a quasi nove (8,9) mesi, rispetto a una sopravvivenza di sei mesi senza terapia. Di particolare rilevanza è stata l osservazione di un caso di eradicazione completa e duratura del tumore, ottenuta in un paziente refrattario al sorafenib, l unico farmaco a bersaglio molecolare registrato per il carcinoma del fegato. Questo risultato permane da maggio, mentre un altro paziente, non previamente trattato, ha raggiunto un importante regressione parziale del tumore, pari al 78%. Il tasso di risposta ottenuto nello studio, confermato al 7%, è incoraggiante e si confronta favorevolmente con i tassi di risposta osservati in studi di Fase II con terapie a bersaglio molecolare ed in studi di Fase III con sorafenib. Inoltre, NGR-hTNF è molto ben tollerato, senza alcuna tossicità da trattamento di grado elevato in una popolazione di pazienti per se difficilmente trattabile, a causa della frequente concomitanza con cirrosi epatica. Lo studio NGR005 nel carcinoma del colon-retto in combinazione con il regime Xelox è stato pubblicato da Annals of Oncology 10. Lo studio ha sperimentato, su 24 pazienti affetti da carcinoma del colon-retto in stadio avanzato, due differenti dosi di NGR-hTNF in combinazione con una dose fissa del trattamento standard Xelox, composto da capecitabina ed oxaliplatino. Una metà dei pazienti ha ricevuto la dose bassa di NGR-hTNF (0.8 μg/m 2 ), mentre l altra metà ha ricevuto la dose massima tollerata (45 μg/m 2 ). Obiettivi principali dello studio erano sicurezza ed attività antitumorale. I risultati forniscono un ulteriore conferma del profilo di sicurezza estremamente favorevole offerto da NGR-hTNF, come già verificato nei precedenti studi di Fase II in monoterapia, mostrando che la combinazione con il regime chemioterapico Xelox è ben tollerata, senza evidenze di incremento della tossicità associata allo Xelox. L attività antitumorale è stata riscontrata nella coorte trattata con la dose bassa, in cui metà dei pazienti ha raggiunto il controllo della malattia (compreso un caso di risposta parziale) con una durata mediana di 5 mesi ed un quarto dei pazienti ha raggiunto una maggior durata di soppravvivenza senza progressione della malattia rispetto a quella ottenuta con la terapia precedente, segno di un evidente effetto di NGR-hTNF sull evoluzione della storia naturale della malattia in questi pazienti. Nel corso del 2010, è proseguito l arruolamento in uno studio randomizzato di Fase II (NGR014) per il trattamento in prima linea del carcinoma polmonare non microcitico (NSCLC), in combinazione con uno tra due regimi a base di cisplatino - cisplatino/gemcitabina per tumori a cellule squamose, oppure cisplatino/pemetrexed per tumori non a cellule squamose versus i regimi chemioterapici da soli. L analisi primaria per la sopravvivenza senza progressione di malattia è prevista a metà I primi di dati di sicurezza relativi allo studio, che prevede l arruolamento di 102 pazienti, indicano un profilo molto favorevole. Di particolare interesse appare il fatto che nei pazienti con tumore a cellule squamose, trattati con la combinazione di NGR-hTNF con cisplatino e gemcitabina, non si sono manifestati fenomeni di sanguinamento, un grave effetto collaterale associato ai farmaci antiangiogenici attualmente disponibili, che ne impedise l impiego per il trattamento del cancro del polmone a cellule squamose. 9 Santoro A, Pressiani T, Citterio G, Rossoni G, Donadoni G, Pozzi F, Rimassa L, Peroneni N, Bozzarelli S, Rossoni G, Colombi S, De Braud FG, Caligaris-Cappio F, Lambiase A, Bordignon C, : Activity and safety of NGR-hTNF, a selective vascular-targeting agent, in previously treated patients with advanced hepatocellular carcinoma, British Journal of Cancer (2010) 103, doi: /sj.bjc (pubblicazione anteprima online il 17 agosto 2010) 10 Mammoliti S, Andretta V, Bennicelli E, Caprioni F, Comandini D, Fornarini G, Guglielmi A, Pessino A, Sciallero S, Sobrero AF, Mazzola G, Lambiase A, Bordignon C: Two doses of NGR-hTNF in combination with capecitabine plus oxaliplatin in colorectal cancer patients failing standard therapies, Annals of Oncology 2010; doi: /annonc/mdq436 (pubblicazione anteprima online il 20 settembre 2010) Pagina 17
20 Ad ottobre 2010, è iniziato uno studio randomizzato di Fase II (NGR016) di NGR-hTNF in una nuova indicazione, i sarcomi dei tessuti molli. Lo studio, che prevede l arruolamento di 96 pazienti, sperimenterà la somministrazione di NGR-hTNF come monoterapia oppure in combinazione con doxorubicina. Gli obiettivi dello studio sono la valutazione dell attività clinica in termini di sopravvivenza senza progressione di malattia, e la valutazione dell effetto biologico in termini di risposta metabolica del tumore. Nel corso del 2010, MolMed ha anche proseguito lo sviluppo farmaceutico di NGR-hTNF, volto all industrializzazione del processo di produzione del biofarmaco, al fine di disporre di un processo adeguato ai requisiti qualitativi e quantitativi richiesti per il mercato. in particolare, MolMed ha portato a termine la produzione per coprire il fabbisogno dell attuale e futura sperimentazione di Fase III, consistente in due lotti di principio attivo da cui sono stati prodotti due lotti GMP di prodotto medicinale finale. Infine, nel corso del 2010 NGR-hTNF è stato selezionato tra i Top 10 Most interesting Oncology Projects to Watch, i dieci progetti in ambito oncologico da tenere d occhio, da un comitato formato da Windhover Information, l editore delle pubblicazioni industriali di settore In Vivo e Start Up, e da consulenti di Campbell Alliance, un agenzia specializzata in consulenze gestionali per l industria farmaceutica e biotecnologica. I dieci antitumorali sperimentali selezionati rappresentano, secondo il comitato di selezione, le migliori opportunità in ambito oncologico che la bioindustria sia in grado di offrire oggi, in base alla soddisfazione dei seguenti criteri: fabbisogno terapeutico, potenziale di mercato, molteplicità delle indicazioni, solidità del razionale scientifico, opportunità di partnerships a diversi livelli, potenziale per ulteriori applicazioni oltre alle indicazioni attualmente sperimentate, e stabilità dell azienda che li sviluppa. 3.3 Attività di ricerca: programma biofarmaci mirati ai vasi o ai tessuti tumorali NGR-IFNγ NGR-hTNF è il capostipite di un programma volto allo sviluppo di biofarmaci mirati ai vasi oppure ad altri bersagli tumorali. Una seconda molecola scaturita da tale programma, costituita ancora dalla fusione del peptide NGR con una citochina, è NGR-IFNγ, che associa NGR all interferone-γ ed è attualmente in fase di sviluppo preclinico. Analogamente a quanto osservato nel caso di NGR-hTNF, anche NGR-IFNγ mostra una localizzazione mirata sui vasi tumorali di nuova formazione, mediata dalle interazioni tra le due componenti della molecola il peptide NGR ed IFNγ ed entrambi i rispettivi recettori, CD13 ed IFN-R, mentre non si osserva alcuna localizzazione sui tessuti sani. In modelli animali, è stata riscontrata un attività antitumorale in assenza di effetti tossici significativi, ed in particolare un attività tumorale a bassa dose in modelli murini di linfoma, carcinoma del colon e della prostata; in quest ultimo, è stato osservato un prolungamento della sopravvivenza a seguito di somministrazioni multiple di NGR-IFNγ. Nuove molecole In vista del futuro sviluppo della pipeline della Società, è proseguita l esplorazione di altre possibili molecole che mirino selettivamente ai vasi oppure ad altri bersagli tumorali, incluse le cellule neoplastiche stesse, e parallelamente di composti ad alta attività antitumorale. Il programma prevede l identificazione e la validazione da un lato di molecole di indirizzo mirato a determinati bersagli, e dall altro di molecole effettrici appropriate, da coniugare oppure da impiegare in combinazione. Allo stato attuale, sono state identificate tre nuovi peptidi ad indirizzo mirato (peptidi di targeting), con spiccata ed accresciuta specificità per bersagli vascolari o tumorali ed elevata stabilità; inoltre, sono state selezionate alcune molecole con proprietà antitumorali, tra cui una classe di inibitori delle chinasi. Pagina 18
SEBASTIANO FILETTI. Dipartimento di Medicina Interna e Specialità Mediche. Università di Roma Sapienza, Roma
 SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
SEBASTIANO FILETTI Dipartimento di Medicina Interna e Specialità Mediche Università di Roma Sapienza, Roma La malattia tiroidea è in aumento negli ultimi anni. Quali le ragioni? Dati epidemiologici provenienti
Il Consiglio di Amministrazione di MolMed approva il resoconto intermedio di gestione al 30 settembre 2014
 Il Consiglio di Amministrazione di MolMed approva il resoconto intermedio di gestione al 30 settembre 2014 Milano, 10 Novembre 2014 Il Consiglio di Amministrazione di MolMed S.p.A. (MLM.MI), riunitosi
Il Consiglio di Amministrazione di MolMed approva il resoconto intermedio di gestione al 30 settembre 2014 Milano, 10 Novembre 2014 Il Consiglio di Amministrazione di MolMed S.p.A. (MLM.MI), riunitosi
16th World Conference on Lung Cancer (WCLC): highlights
 16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
16th World Conference on Lung Cancer (WCLC): highlights RISULTATI PRELIMINARI STUDIO ITACA Lo studio Itaca è uno studio multicentrico italiano di Fase III che confronta un trattamento chemioterapico tailored
Relazione finanziaria semestrale al 30 giugno 2011. Relazione finanziaria semestrale. al 30 giugno 2011. Pagina 1/73
 Relazione finanziaria semestrale Relazione finanziaria semestrale Pagina 1/73 MolMed S.p.A. è un azienda biotecnologica focalizzata su ricerca, sviluppo e validazione clinica di terapie innovative per
Relazione finanziaria semestrale Relazione finanziaria semestrale Pagina 1/73 MolMed S.p.A. è un azienda biotecnologica focalizzata su ricerca, sviluppo e validazione clinica di terapie innovative per
Espressione di geni specifici per un determinato tumore
 Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
Espressione di geni specifici per un determinato tumore Paziente A: Non ha il cancro Espressione dei geni: Nessuna Biopsia Geni associati al cancro allo stomaco Paziente B: Ha un tumore allo stomaco Bassa
PASQUALE FREGA Assobiotec
 ITALIAN ORPHAN DRUGS DAY Venerdì 13 febbraio 2015 Sala conferenze Digital for Business - Sesto San Giovanni (MI) PASQUALE FREGA Assobiotec www.digitalforacademy.com Italian Orphan Drug Day Malattie Rare
ITALIAN ORPHAN DRUGS DAY Venerdì 13 febbraio 2015 Sala conferenze Digital for Business - Sesto San Giovanni (MI) PASQUALE FREGA Assobiotec www.digitalforacademy.com Italian Orphan Drug Day Malattie Rare
leaders in engineering excellence
 leaders in engineering excellence engineering excellence Il mondo di oggi, in rapida trasformazione, impone alle imprese di dotarsi di impianti e macchinari più affidabili e sicuri, e di più lunga durata.
leaders in engineering excellence engineering excellence Il mondo di oggi, in rapida trasformazione, impone alle imprese di dotarsi di impianti e macchinari più affidabili e sicuri, e di più lunga durata.
Bilancio di esercizio
 di esercizio Pagina 1/108 MolMed S.p.A. è un azienda biotecnologica focalizzata su ricerca, sviluppo e validazione clinica di terapie innovative per la cura del cancro. Il portafoglio-prodotti di MolMed
di esercizio Pagina 1/108 MolMed S.p.A. è un azienda biotecnologica focalizzata su ricerca, sviluppo e validazione clinica di terapie innovative per la cura del cancro. Il portafoglio-prodotti di MolMed
Perspectiva: previdenza professionale con lungimiranza. Fondazione collettiva per la previdenza professionale
 Perspectiva: previdenza professionale con lungimiranza Fondazione collettiva per la previdenza professionale Un futuro sereno grazie a Perspectiva Sfruttare completamente le opportunità di rendimento e
Perspectiva: previdenza professionale con lungimiranza Fondazione collettiva per la previdenza professionale Un futuro sereno grazie a Perspectiva Sfruttare completamente le opportunità di rendimento e
Perfare MASSIMIZZARE IL VALORE DELL ATTUALE GAMMA DI PRODOTTI
 Perfare Perfare Percorsi aziendali di formazione e assistenza operativa MASSIMIZZARE IL VALORE DELL ATTUALE GAMMA DI PRODOTTI Costruire un piano di azioni concrete per ottenere il massimo valore dall attuale
Perfare Perfare Percorsi aziendali di formazione e assistenza operativa MASSIMIZZARE IL VALORE DELL ATTUALE GAMMA DI PRODOTTI Costruire un piano di azioni concrete per ottenere il massimo valore dall attuale
QUALITÀ E SICUREZZA PER I NOSTRI PAZIENTI
 QUALITÀ E SICUREZZA PER I NOSTRI PAZIENTI L ACCREDITAMENTO INTERNAZIONALE ALL ECCELLENZA Fondazione Poliambulanza ha ricevuto nel dicembre 2013 l accreditamento internazionale all eccellenza da parte di
QUALITÀ E SICUREZZA PER I NOSTRI PAZIENTI L ACCREDITAMENTO INTERNAZIONALE ALL ECCELLENZA Fondazione Poliambulanza ha ricevuto nel dicembre 2013 l accreditamento internazionale all eccellenza da parte di
RELAZIONE DEL CONSIGLIO DI AMMINISTRAZIONE ALL ASSEMBLEA ORDINARIA DEGLI AZIONISTI
 RELAZIONE DEL CONSIGLIO DI AMMINISTRAZIONE ALL ASSEMBLEA ORDINARIA DEGLI AZIONISTI RELAZIONE DEL CONSIGLIO DI AMMINISTRAZIONE ALL ASSEMBLEA ORDINARIA DEGLI AZIONISTI Signori Azionisti, Vi abbiamo convocato
RELAZIONE DEL CONSIGLIO DI AMMINISTRAZIONE ALL ASSEMBLEA ORDINARIA DEGLI AZIONISTI RELAZIONE DEL CONSIGLIO DI AMMINISTRAZIONE ALL ASSEMBLEA ORDINARIA DEGLI AZIONISTI Signori Azionisti, Vi abbiamo convocato
Relazione finanziaria annuale al 31 dicembre 2012
 Relazione finanziaria annuale al 31 dicembre 2012 MOLMED S.p.A. Via Olgettina, 58-20132 Milano, Italia Tel. +39 0221277.1 - Fax +39 02 21277.325 info@molmed.com - www.molmed.com Capitale Sociale 27.070.992,30
Relazione finanziaria annuale al 31 dicembre 2012 MOLMED S.p.A. Via Olgettina, 58-20132 Milano, Italia Tel. +39 0221277.1 - Fax +39 02 21277.325 info@molmed.com - www.molmed.com Capitale Sociale 27.070.992,30
IL FONDO OGGI E DOMANI
 IL FONDO OGGI E DOMANI Lo schema di gestione che ha caratterizzato il Fondo fin dalla sua origine nel 1986 prevede un unico impiego delle risorse su una linea assicurativa gestita con contabilità a costi
IL FONDO OGGI E DOMANI Lo schema di gestione che ha caratterizzato il Fondo fin dalla sua origine nel 1986 prevede un unico impiego delle risorse su una linea assicurativa gestita con contabilità a costi
LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO
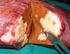 LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO Cetuximab può ridurre la massa tumorale per permettere la resezione delle metastasi, anche, in pazienti inizialmente non resecabili,
LA RESEZIONE DELLE METASTASI EPATICHE NEL TUMORE METASTATICO DEL COLON RETTO Cetuximab può ridurre la massa tumorale per permettere la resezione delle metastasi, anche, in pazienti inizialmente non resecabili,
Resoconto intermedio di gestione al 30 settembre 2012
 Resoconto intermedio di gestione al 30 settembre 2012 MOLMED S.p.A. Via Olgettina, 58-20132 Milano Tel. +39 0221277.1 - Fax +39 02 21277.325 info@molmed.com - www.molmed.com Capitale Sociale 43.609.036,42
Resoconto intermedio di gestione al 30 settembre 2012 MOLMED S.p.A. Via Olgettina, 58-20132 Milano Tel. +39 0221277.1 - Fax +39 02 21277.325 info@molmed.com - www.molmed.com Capitale Sociale 43.609.036,42
CONDIZIONI DEFINITIVE della NOTA INFORMATIVA BANCA DI CESENA OBBLIGAZIONI A TASSO FISSO. Isin IT0004233943
 BANCA DI CESENA CREDITO COOPERATIVO DI CESENA E RONTA SOCIETA COOPERATIVA CONDIZIONI DEFINITIVE della NOTA INFORMATIVA BANCA DI CESENA OBBLIGAZIONI A TASSO FISSO BANCA DI CESENA 01/06/07-01/06/10 - TF
BANCA DI CESENA CREDITO COOPERATIVO DI CESENA E RONTA SOCIETA COOPERATIVA CONDIZIONI DEFINITIVE della NOTA INFORMATIVA BANCA DI CESENA OBBLIGAZIONI A TASSO FISSO BANCA DI CESENA 01/06/07-01/06/10 - TF
l evoluzione del listino: societa e titoli quotati
 L Evoluzione del Listino: società e titoli quotati Nel biennio 1997-98 la Borsa italiana ha compiuto importanti progressi, in termini sia di dimensione complessiva che di livello qualitativo del listino.
L Evoluzione del Listino: società e titoli quotati Nel biennio 1997-98 la Borsa italiana ha compiuto importanti progressi, in termini sia di dimensione complessiva che di livello qualitativo del listino.
A.I.N.I. Associazione Imprenditoriale della Nazionalità Italiana Udruga Poduzetnika Talijanske Narodnosti
 L AINI ( ) è un Associazione di artigiani e di piccole e medie imprese appartenenti ai diversi settori merceologici i cui proprietari sono appartenenti alla Comunità Nazionale Italiana in Croazia (CNI),
L AINI ( ) è un Associazione di artigiani e di piccole e medie imprese appartenenti ai diversi settori merceologici i cui proprietari sono appartenenti alla Comunità Nazionale Italiana in Croazia (CNI),
LO STATO DELLA RICERCA SANITARIA IN ITALIA
 SAS Campus 2011 - Università di Milano-Bicocca, 22 novembre Business Intelligence e Analytics nell università, nel business e nel government per la crescita del Sistema Paese LO STATO DELLA RICERCA SANITARIA
SAS Campus 2011 - Università di Milano-Bicocca, 22 novembre Business Intelligence e Analytics nell università, nel business e nel government per la crescita del Sistema Paese LO STATO DELLA RICERCA SANITARIA
Nerviano Medical Sciences
 Nerviano Medical Sciences Sinergie ROL-NMS 28 gennaio 2011 1 Sinergie ROL/NMS 1. Apertura sistemica della ricerca di NMS da un lato verso il mondo accademico, regionale in primis ma nazionale e internazionale
Nerviano Medical Sciences Sinergie ROL-NMS 28 gennaio 2011 1 Sinergie ROL/NMS 1. Apertura sistemica della ricerca di NMS da un lato verso il mondo accademico, regionale in primis ma nazionale e internazionale
Lo sviluppo del cancro è un processo complesso che coinvolge parecchi cambiamenti nella stessa cellula staminale. Poiché tutte le cellule staminali
 Tumore Cos è il tumore? Il tumore o neoplasia (dal greco neo,, nuovo, e plasìa,, formazione), o cancro se è maligno, è una classe di malattie caratterizzate da una incontrollata riproduzione di alcune
Tumore Cos è il tumore? Il tumore o neoplasia (dal greco neo,, nuovo, e plasìa,, formazione), o cancro se è maligno, è una classe di malattie caratterizzate da una incontrollata riproduzione di alcune
REGOLAMENTO PER LA PROMOZIONE DELLA SOLIDARIETA INTERNAZIONALE E DEI DIRITTI UMANI. Art. 1 Finalità
 REGOLAMENTO PER LA PROMOZIONE DELLA SOLIDARIETA INTERNAZIONALE E DEI DIRITTI UMANI Art. 1 Finalità La Provincia di Genova, in attuazione di quanto previsto dal proprio Statuto, promuove la cultura della
REGOLAMENTO PER LA PROMOZIONE DELLA SOLIDARIETA INTERNAZIONALE E DEI DIRITTI UMANI Art. 1 Finalità La Provincia di Genova, in attuazione di quanto previsto dal proprio Statuto, promuove la cultura della
Resoconto intermedio di gestione al 31 marzo 2013
 Resoconto intermedio di gestione al 31 marzo 2013 MOLMED S.p.A. Via Olgettina, 58-20132 Milano, Italia Tel. +39 0221277.1 - Fax +39 02 21277.325 info@molmed.com - www.molmed.com Capitale Sociale 27.070.992,30
Resoconto intermedio di gestione al 31 marzo 2013 MOLMED S.p.A. Via Olgettina, 58-20132 Milano, Italia Tel. +39 0221277.1 - Fax +39 02 21277.325 info@molmed.com - www.molmed.com Capitale Sociale 27.070.992,30
Informazioni per potenziali partecipanti. Possiamo sciogliere l'amiloidosi AL?
 Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
Informazioni per potenziali partecipanti Possiamo sciogliere l'amiloidosi AL? È ora di affrontare diversamente l amiloidosi AL? L amiloidosi AL è una malattia rara e spesso fatale causata dall accumulo
PRYSMIAN S.P.A. COMITATO CONTROLLO E RISCHI. Regolamento. Regolamento del Comitato Controllo e Rischi
 PRYSMIAN S.P.A. COMITATO CONTROLLO E RISCHI Regolamento Regolamento del Comitato Controllo e Rischi Data approvazione: 16/01/2007 Ultima modifica: 08/11/2012 Regolamento del Comitato Controllo e Rischi
PRYSMIAN S.P.A. COMITATO CONTROLLO E RISCHI Regolamento Regolamento del Comitato Controllo e Rischi Data approvazione: 16/01/2007 Ultima modifica: 08/11/2012 Regolamento del Comitato Controllo e Rischi
CREDITO E SVILUPPO delle PMI nel Lazio: opportunità, vincoli e proposte per il sistema regionale
 CREDITO E SVILUPPO delle PMI nel Lazio: opportunità, vincoli e proposte per il sistema regionale Realizzato dall EURES Ricerche Economiche e Sociali in collaborazione con il Consiglio Regionale dell Economia
CREDITO E SVILUPPO delle PMI nel Lazio: opportunità, vincoli e proposte per il sistema regionale Realizzato dall EURES Ricerche Economiche e Sociali in collaborazione con il Consiglio Regionale dell Economia
Approvazione CDA del 25 giugno 2009. Limiti al cumulo di incarichi ricoperti dagli amministratori di Unipol Gruppo Finanziario S.p.A.
 Approvazione CDA del 25 giugno 2009 Limiti al cumulo di incarichi ricoperti dagli amministratori di Unipol Gruppo Finanziario S.p.A. Regolamento U n i p o l G r u p p o F i n a n z i a r i o S. p. A. Sede
Approvazione CDA del 25 giugno 2009 Limiti al cumulo di incarichi ricoperti dagli amministratori di Unipol Gruppo Finanziario S.p.A. Regolamento U n i p o l G r u p p o F i n a n z i a r i o S. p. A. Sede
Regolamento sui limiti al cumulo degli incarichi ricoperti dagli Amministratori del Gruppo Banco Popolare
 Regolamento sui limiti al cumulo degli incarichi ricoperti dagli Amministratori del Gruppo Banco Popolare febbraio 2013 1 1 PREMESSA... 3 1.1 Oggetto... 3 1.2 Perimetro di applicazione e modalità di recepimento...
Regolamento sui limiti al cumulo degli incarichi ricoperti dagli Amministratori del Gruppo Banco Popolare febbraio 2013 1 1 PREMESSA... 3 1.1 Oggetto... 3 1.2 Perimetro di applicazione e modalità di recepimento...
STUDI CLINICI 1. Che cosa è uno studio clinico e a cosa serve? 2. Come nasce la sperimentazione clinica e che tipi di studi esistono?
 STUDI CLINICI 1. Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica, o studio clinico controllato, (in inglese: clinical trial), un esperimento scientifico che genera dati
STUDI CLINICI 1. Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica, o studio clinico controllato, (in inglese: clinical trial), un esperimento scientifico che genera dati
STUDI SU MATERIALE GENETICO
 Istituto Oncologico Veneto Istituto di Ricovero e Cura a Carattere Scientifico Ospedale Busonera I.O.V. ISTITUTO ONCOLOGICO VENETO I.R.C.C.S. STUDI SU MATERIALE GENETICO Comitato Etico Istituto Oncologico
Istituto Oncologico Veneto Istituto di Ricovero e Cura a Carattere Scientifico Ospedale Busonera I.O.V. ISTITUTO ONCOLOGICO VENETO I.R.C.C.S. STUDI SU MATERIALE GENETICO Comitato Etico Istituto Oncologico
SCHEDA FARMACO. Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta
 Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Indicazione terapeutica Classificazione: Spesa per paziente trattato (euro, posologia/durata)
Principio attivo (nome commerciale) Forma farmaceutica e dosaggio, posologia, prezzo, regime di rimborsabilità, ditta Indicazione terapeutica Classificazione: Spesa per paziente trattato (euro, posologia/durata)
DOCUMENTO INFORMATIVO. PER L'OFFERTA DEL PRESTITO OBBLlGAZlONARlO BANCO DI LUCCA E DEL TIRRENO S.P.A. 20/05/2015 20/05/2021 TASSO FISSO 2.
 DOCUMENTO INFORMATIVO PER L'OFFERTA DEL PRESTITO OBBLlGAZlONARlO BANCO DI LUCCA E DEL TIRRENO S.P.A. 20/05/2015 20/05/2021 TASSO FISSO 2.00% EMISSIONE N. 27/2015 CODICE lsln IT0005108672 Il presente documento
DOCUMENTO INFORMATIVO PER L'OFFERTA DEL PRESTITO OBBLlGAZlONARlO BANCO DI LUCCA E DEL TIRRENO S.P.A. 20/05/2015 20/05/2021 TASSO FISSO 2.00% EMISSIONE N. 27/2015 CODICE lsln IT0005108672 Il presente documento
Relazione finanziaria semestrale al 30 giugno 2013
 Relazione finanziaria semestrale al 30 giugno 2013 MOLMED S.p.A. Via Olgettina, 58-20132 Milano, Italia Tel. +39 0221277.1 - Fax +39 02 21277.325 info@molmed.com - www.molmed.com Capitale Sociale 27.070.992,30
Relazione finanziaria semestrale al 30 giugno 2013 MOLMED S.p.A. Via Olgettina, 58-20132 Milano, Italia Tel. +39 0221277.1 - Fax +39 02 21277.325 info@molmed.com - www.molmed.com Capitale Sociale 27.070.992,30
UNIVERSITA DEGLI STUDI DI PERUGIA STATUTO DEL CENTRO UNIVERSITARIO DI RICERCA INTERDIPARTIMENTALE SULL ATTIVITÀ MOTORIA (C.U.R.I.A.MO.
 UNIVERSITA DEGLI STUDI DI PERUGIA STATUTO DEL CENTRO UNIVERSITARIO DI RICERCA INTERDIPARTIMENTALE SULL ATTIVITÀ MOTORIA (C.U.R.I.A.MO.) Art. 1 E costituito il Centro Universitario di Ricerca Interdipartimentale
UNIVERSITA DEGLI STUDI DI PERUGIA STATUTO DEL CENTRO UNIVERSITARIO DI RICERCA INTERDIPARTIMENTALE SULL ATTIVITÀ MOTORIA (C.U.R.I.A.MO.) Art. 1 E costituito il Centro Universitario di Ricerca Interdipartimentale
LA CASSETTA DEGLI ATTREZZI
 Aggiornamento del 29 maggio 2015 I CONTENUTI IL SISTEMA ECONOMICO LA FINANZA PUBBLICA LA SANITA IL SISTEMA ECONOMICO LA CASSETTA DEGLI ATTREZZI IL PIL PIL: DINAMICA E PREVISIONI NEI PRINCIPALI PAESI UE
Aggiornamento del 29 maggio 2015 I CONTENUTI IL SISTEMA ECONOMICO LA FINANZA PUBBLICA LA SANITA IL SISTEMA ECONOMICO LA CASSETTA DEGLI ATTREZZI IL PIL PIL: DINAMICA E PREVISIONI NEI PRINCIPALI PAESI UE
REGOLAMENTO PER LE EROGAZIONI EMBLEMATICHE DELLA FONDAZIONE CARIPLO
 REGOLAMENTO PER LE EROGAZIONI EMBLEMATICHE DELLA FONDAZIONE CARIPLO 1. Finalità degli interventi emblematici 2 2. Ammontare delle assegnazioni e soggetti destinatari 2 3. Aree filantropiche di pertinenza
REGOLAMENTO PER LE EROGAZIONI EMBLEMATICHE DELLA FONDAZIONE CARIPLO 1. Finalità degli interventi emblematici 2 2. Ammontare delle assegnazioni e soggetti destinatari 2 3. Aree filantropiche di pertinenza
811.112.243 Ordinanza del DFI
 Ordinanza del DFI concernente la sperimentazione di un modulo speciale d insegnamento e d esame per i primi quattro anni di studio presso la facoltà di medicina dell Università di Zurigo del 17 ottobre
Ordinanza del DFI concernente la sperimentazione di un modulo speciale d insegnamento e d esame per i primi quattro anni di studio presso la facoltà di medicina dell Università di Zurigo del 17 ottobre
Il mercato mobiliare
 Il mercato mobiliare E il luogo nel quale trovano esecuzione tutte le operazioni aventi per oggetto valori mobiliari, ossia strumenti finanziari così denominati per la loro attitudine a circolare facilmente
Il mercato mobiliare E il luogo nel quale trovano esecuzione tutte le operazioni aventi per oggetto valori mobiliari, ossia strumenti finanziari così denominati per la loro attitudine a circolare facilmente
Piano Economico Finanziario 2008. Consiglio Generale: seduta del 26 Ottobre 2007
 Piano Economico Finanziario 2008 e previsioni anni 2009 e 2010 Consiglio Generale: seduta del 26 Ottobre 2007 Indice Scenario & Previsioni PIANO ANNUALE 2008 1Fonti di finanziamento 2Impieghi 3Ricavi 4Costi
Piano Economico Finanziario 2008 e previsioni anni 2009 e 2010 Consiglio Generale: seduta del 26 Ottobre 2007 Indice Scenario & Previsioni PIANO ANNUALE 2008 1Fonti di finanziamento 2Impieghi 3Ricavi 4Costi
Avvio della programmazione 2007-13
 Avvio della programmazione 2007-13 Definizione dei criteri di selezione degli interventi per l attuazione delle strategie previste dal Programma Cagliari 9.11.2007 1 Le prossime scadenze Attività Definizione
Avvio della programmazione 2007-13 Definizione dei criteri di selezione degli interventi per l attuazione delle strategie previste dal Programma Cagliari 9.11.2007 1 Le prossime scadenze Attività Definizione
L ATI composta da Associazione Nuovi Lavori e BIC Puglia s.c.a.r.l., nell ambito del progetto URLO Una rete per le opportunità, PROMUOVE
 L ATI composta da Associazione Nuovi Lavori e BIC Puglia s.c.a.r.l., nell ambito del progetto URLO Una rete per le opportunità, PROMUOVE un PROTOCOLLO D INTESA tra CONSIGLIERA PARITÀ PROVINCIALE DONNE
L ATI composta da Associazione Nuovi Lavori e BIC Puglia s.c.a.r.l., nell ambito del progetto URLO Una rete per le opportunità, PROMUOVE un PROTOCOLLO D INTESA tra CONSIGLIERA PARITÀ PROVINCIALE DONNE
Il mieloma multiplo La terapia
 MIELOMA MULTIPLO Il mieloma multiplo è una malattia neoplastica caratterizzata dalla proliferazione e accumulo nel midollo osseo di linfociti e di plasmacellule che, direttamente o indirettamente, possono
MIELOMA MULTIPLO Il mieloma multiplo è una malattia neoplastica caratterizzata dalla proliferazione e accumulo nel midollo osseo di linfociti e di plasmacellule che, direttamente o indirettamente, possono
Accordo per l informazione e la consultazione a livello sovranazionale dei dipendenti
 Accordo per l informazione e la consultazione a livello sovranazionale dei dipendenti * del gruppo Deutsche Bank nell Unione Europea Commissione interna Euro Deutsche Bank Premessa In considerazione dello
Accordo per l informazione e la consultazione a livello sovranazionale dei dipendenti * del gruppo Deutsche Bank nell Unione Europea Commissione interna Euro Deutsche Bank Premessa In considerazione dello
Perchè fare ricerca in salute mentale? Più di un cittadino Europeo su tre
 Perchè fare ricerca in salute mentale? I disturbi mentali costituiscono un enorme carico per le persone che ne soffrono, per i loro familiari e per la società. Più di un cittadino Europeo su tre vive un
Perchè fare ricerca in salute mentale? I disturbi mentali costituiscono un enorme carico per le persone che ne soffrono, per i loro familiari e per la società. Più di un cittadino Europeo su tre vive un
BANCA ALETTI & C. S.p.A.
 BANCA ALETTI & C. S.p.A. in qualità di Emittente e responsabile del collocamento del Programma di offerta al pubblico e/o quotazione dei certificates BORSA PROTETTA e BORSA PROTETTA con CAP e BORSA PROTETTA
BANCA ALETTI & C. S.p.A. in qualità di Emittente e responsabile del collocamento del Programma di offerta al pubblico e/o quotazione dei certificates BORSA PROTETTA e BORSA PROTETTA con CAP e BORSA PROTETTA
Approvati dal Consiglio di Amministrazione i dati preliminari di vendita dell esercizio 2013
 Sant Elpidio a Mare, 29 gennaio 2014 TOD S S.p.A.: i ricavi del Gruppo, a cambi costanti, salgono a 979,2 milioni nell (+1,7%); crescita a doppia cifra in Greater China e nelle Americhe. Ottima performance
Sant Elpidio a Mare, 29 gennaio 2014 TOD S S.p.A.: i ricavi del Gruppo, a cambi costanti, salgono a 979,2 milioni nell (+1,7%); crescita a doppia cifra in Greater China e nelle Americhe. Ottima performance
CRITICITA, PRIORITA E PUNTI DI FORZA NELL AVVIO DELLA GESTIONE ASSOCIATA DEL PERSONALE a cura di Andrea Pellegrino
 CRITICITA, PRIORITA E PUNTI DI FORZA NELL AVVIO DELLA GESTIONE ASSOCIATA DEL PERSONALE a cura di Andrea Pellegrino In un contesto normativo e sociale caratterizzato da una costante evoluzione, al Comune,
CRITICITA, PRIORITA E PUNTI DI FORZA NELL AVVIO DELLA GESTIONE ASSOCIATA DEL PERSONALE a cura di Andrea Pellegrino In un contesto normativo e sociale caratterizzato da una costante evoluzione, al Comune,
Nomina membro del Consiglio di Amministrazione
 COMUNICATO STAMPA Nomina membro del Consiglio di Amministrazione Milano, 21 settembre 2012 - Il Consiglio di Amministrazione di MolMed S.p.A. (MLM.MI), in data odierna, ai sensi e per gli effetti dell
COMUNICATO STAMPA Nomina membro del Consiglio di Amministrazione Milano, 21 settembre 2012 - Il Consiglio di Amministrazione di MolMed S.p.A. (MLM.MI), in data odierna, ai sensi e per gli effetti dell
Management Game 2011
 Management Game 2011 La Mobilé Inc 1 Introduzione 1.1 La Mobilé Inc in breve Mobilé Inc è un azienda produttrice di telefonini che ha sede negli Stati Uniti che si è concentrata sulla produzione di telefonini
Management Game 2011 La Mobilé Inc 1 Introduzione 1.1 La Mobilé Inc in breve Mobilé Inc è un azienda produttrice di telefonini che ha sede negli Stati Uniti che si è concentrata sulla produzione di telefonini
Nascita, caratteristiche ed evoluzione dei sistemi di welfare. Prof. Carlo Borzaga
 Nascita, caratteristiche ed evoluzione dei sistemi di welfare Prof. Carlo Borzaga Sommario! alcune definizioni! perché servono politiche di welfare! i principali ambiti di intervento e i modelli di welfare!
Nascita, caratteristiche ed evoluzione dei sistemi di welfare Prof. Carlo Borzaga Sommario! alcune definizioni! perché servono politiche di welfare! i principali ambiti di intervento e i modelli di welfare!
Imprenditorialità e Innovazione per l Internazionalizzazione delle PMI
 Corso di Alta Formazione Imprenditorialità e Innovazione per l Internazionalizzazione delle PMI Evento Finale 25 marzo 2013 -Bergamo Palazzo dei Contratti e delle Manifestazioni BERGAMO SVILUPPO AZIENDA
Corso di Alta Formazione Imprenditorialità e Innovazione per l Internazionalizzazione delle PMI Evento Finale 25 marzo 2013 -Bergamo Palazzo dei Contratti e delle Manifestazioni BERGAMO SVILUPPO AZIENDA
STATUTO ASSOCIAZIONE DELLE SCUOLE AUTONOME DELLA PROVINCIA DI BOLOGNA ASA.BO
 STATUTO ASSOCIAZIONE DELLE SCUOLE AUTONOME DELLA PROVINCIA DI BOLOGNA ASA.BO FINALITÀ E SCOPI Art. 1 L Associazione è costituita al fine di sostenere le scuole aderenti nel raggiungimento dei fini istituzionali
STATUTO ASSOCIAZIONE DELLE SCUOLE AUTONOME DELLA PROVINCIA DI BOLOGNA ASA.BO FINALITÀ E SCOPI Art. 1 L Associazione è costituita al fine di sostenere le scuole aderenti nel raggiungimento dei fini istituzionali
IL diabetico. Gestione condivisa. Claudio Marengo Marco Comoglio Andrea Pizzini
 IL diabetico anziano Gestione condivisa Claudio Marengo Marco Comoglio Andrea Pizzini SEEd srl C.so Vigevano, 35-10152 Torino Tel. 011.566.02.58 - Fax 011.518.68.92 www.edizioniseed.it info@seed-online.it
IL diabetico anziano Gestione condivisa Claudio Marengo Marco Comoglio Andrea Pizzini SEEd srl C.so Vigevano, 35-10152 Torino Tel. 011.566.02.58 - Fax 011.518.68.92 www.edizioniseed.it info@seed-online.it
Pensione di vecchiaia: ecco i nuovi requisiti di età per ottenerla
 Pensione di vecchiaia: ecco i nuovi requisiti di età per ottenerla Maggio 2015 Più si va avanti e più si allontana l accesso alla pensione degli italiani. Col passare degli anni, infatti, aumenta l età
Pensione di vecchiaia: ecco i nuovi requisiti di età per ottenerla Maggio 2015 Più si va avanti e più si allontana l accesso alla pensione degli italiani. Col passare degli anni, infatti, aumenta l età
Relazione sulla gestione
 PIANORO CENTRO SPA SOCIETA' DI TRASFORMAZIONE URBANA Sede legale: PIAZZA DEI MARTIRI 1 PIANORO (BO) Iscritta al Registro Imprese di BOLOGNA C.F. e numero iscrizione: 02459911208 Iscritta al R.E.A. di BOLOGNA
PIANORO CENTRO SPA SOCIETA' DI TRASFORMAZIONE URBANA Sede legale: PIAZZA DEI MARTIRI 1 PIANORO (BO) Iscritta al Registro Imprese di BOLOGNA C.F. e numero iscrizione: 02459911208 Iscritta al R.E.A. di BOLOGNA
Casi concreti PREMESSA casi concreti completa e dettagliata documentazione nessun caso concreto riportato è descritto più di una volta
 Casi concreti La pubblicazione dei casi concreti ha, come scopo principale, quello di dare a tante persone la possibilità di essere informate della validità della consulenza individuale e indipendente
Casi concreti La pubblicazione dei casi concreti ha, come scopo principale, quello di dare a tante persone la possibilità di essere informate della validità della consulenza individuale e indipendente
Il ruolo di AIFA nella Ricerca Clinica. Luca Pani DG@aifa.gov.it
 Il ruolo di AIFA nella Ricerca Clinica Luca Pani DG@aifa.gov.it Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non possono essere considerate o citate
Il ruolo di AIFA nella Ricerca Clinica Luca Pani DG@aifa.gov.it Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non possono essere considerate o citate
REGIONE MARCHE GIUNTA REGIONALE
 DELIBERAZIONE DELLA 2 L. 196/97 Art. 17. Approvazione del Regolamento istitutivo del Dispositivo di accreditamento delle strutture formative della Regione Marche (DAFORM). LA VISTO il documento istruttorio
DELIBERAZIONE DELLA 2 L. 196/97 Art. 17. Approvazione del Regolamento istitutivo del Dispositivo di accreditamento delle strutture formative della Regione Marche (DAFORM). LA VISTO il documento istruttorio
REGOLAMENTO DI VALUTAZIONE DEL PERSONALE DIPENDENTE
 REGOLAMENTO DI VALUTAZIONE DEL PERSONALE DIPENDENTE Approvato con Determinazione del Direttore Generale n. 244 del 20/07/2010 L importanza di un sistema operativo di valutazione comune e riconoscibile
REGOLAMENTO DI VALUTAZIONE DEL PERSONALE DIPENDENTE Approvato con Determinazione del Direttore Generale n. 244 del 20/07/2010 L importanza di un sistema operativo di valutazione comune e riconoscibile
La rete per la promozione della salute in Lombardia
 La differenza che vale Gli ospedali di ANDREA: amici del bambino e della sua famiglia Bosisio Parini (LC) - 12-14 Novembre 2009 - IRCCS E. MEDEA La rete per la promozione della salute in Lombardia Giancarlo
La differenza che vale Gli ospedali di ANDREA: amici del bambino e della sua famiglia Bosisio Parini (LC) - 12-14 Novembre 2009 - IRCCS E. MEDEA La rete per la promozione della salute in Lombardia Giancarlo
* * * Questo comunicato stampa è disponibile anche sul sito internet della Società www.sesa.it
 COMUNICATO STAMPA APPROVAZIONE DEL RESOCONTO INTERMEDIO CONSOLIDATO DI GESTIONE PER IL PERIODO DI 9 MESI AL 31 GENNAIO 2014 Il Consiglio di Amministrazione di Sesa S.p.A. riunitosi in data odierna ha approvato
COMUNICATO STAMPA APPROVAZIONE DEL RESOCONTO INTERMEDIO CONSOLIDATO DI GESTIONE PER IL PERIODO DI 9 MESI AL 31 GENNAIO 2014 Il Consiglio di Amministrazione di Sesa S.p.A. riunitosi in data odierna ha approvato
Fondi Pensione Integrativi Territoriali:
 Le rôle croissant des régimes territoriaux et régionaux de protection sociale en Europe Fondi Pensione Integrativi Territoriali: Il Progetto della Regione Autonoma Valle d Aosta ed il Fondo Pensione regionale
Le rôle croissant des régimes territoriaux et régionaux de protection sociale en Europe Fondi Pensione Integrativi Territoriali: Il Progetto della Regione Autonoma Valle d Aosta ed il Fondo Pensione regionale
Progetto PI.20060128, passo A.1 versione del 14 febbraio 2007
 Università degli Studi di Roma La Sapienza Facoltà di Ingegneria Corso di Laurea in Ingegneria Gestionale Corso di Progettazione del Software Proff. Toni Mancini e Monica Scannapieco Progetto PI.20060128,
Università degli Studi di Roma La Sapienza Facoltà di Ingegneria Corso di Laurea in Ingegneria Gestionale Corso di Progettazione del Software Proff. Toni Mancini e Monica Scannapieco Progetto PI.20060128,
ATTIVAMENTE INSIEME BIOTECH NEL CUORE DELLE BIOTECNOLOGIE: CELLULE STAMINALI E FARMACI ORFANI
 ATTIVAMENTE INSIEME BIOTECH NEL CUORE DELLE BIOTECNOLOGIE: CELLULE STAMINALI E FARMACI ORFANI In occasione del 60 compleanno della scoperta del DNA che l Europa festeggia con la settimana europea biotech,
ATTIVAMENTE INSIEME BIOTECH NEL CUORE DELLE BIOTECNOLOGIE: CELLULE STAMINALI E FARMACI ORFANI In occasione del 60 compleanno della scoperta del DNA che l Europa festeggia con la settimana europea biotech,
Progetto IDENTITAS: Formazione agli operatori di Bilancio di Competenze
 Progetto IDENTITAS: Formazione agli operatori di Bilancio di Competenze Provincia di Roma Anno 2005 Indice Il problema affrontato...3 Obiettivi attesi/risultati raggiunti...3 Soggetti coinvolti...3 Il
Progetto IDENTITAS: Formazione agli operatori di Bilancio di Competenze Provincia di Roma Anno 2005 Indice Il problema affrontato...3 Obiettivi attesi/risultati raggiunti...3 Soggetti coinvolti...3 Il
1. Chi è il produttore secondo GSE? Vi sono delle conseguenze per me?
 1. Chi è il produttore secondo GSE? Vi sono delle conseguenze per me? Produttore nel campo di applicazione del GSE è la società che immette per la prima volta a titolo professionale, un pannello fotovoltaico
1. Chi è il produttore secondo GSE? Vi sono delle conseguenze per me? Produttore nel campo di applicazione del GSE è la società che immette per la prima volta a titolo professionale, un pannello fotovoltaico
MODELLO ORGANIZZATIVO REGIONALE PER LA GESTIONE DEL RISCHIO CLINICO.
 ALLEGATO A MODELLO ORGANIZZATIVO REGIONALE PER LA GESTIONE DEL RISCHIO CLINICO. il sistema organizzativo che governa le modalità di erogazione delle cure non è ancora rivolto al controllo in modo sistemico
ALLEGATO A MODELLO ORGANIZZATIVO REGIONALE PER LA GESTIONE DEL RISCHIO CLINICO. il sistema organizzativo che governa le modalità di erogazione delle cure non è ancora rivolto al controllo in modo sistemico
Banca Intermobiliare SpA Obbligazioni a tasso variabile
 Sede legale in Torino, Via Gramsci, n. 7 Capitale sociale: Euro 154.737.342,00 interamente versato Registro delle imprese di Torino e codice fiscale n. 02751170016 Iscritta all Albo Banche n. 5319 e Capogruppo
Sede legale in Torino, Via Gramsci, n. 7 Capitale sociale: Euro 154.737.342,00 interamente versato Registro delle imprese di Torino e codice fiscale n. 02751170016 Iscritta all Albo Banche n. 5319 e Capogruppo
16 Rapporto Nazionale sulla Formazione Indagine su Comuni e Province. Nicoletta Bevilacqua Responsabile Ufficio Monitoraggio e ricerca FormezPA
 16 Rapporto Nazionale sulla Formazione Indagine su Comuni e Province Nicoletta Bevilacqua Responsabile Ufficio Monitoraggio e ricerca FormezPA Obiettivi della presentazione Illustrare i principali risultati
16 Rapporto Nazionale sulla Formazione Indagine su Comuni e Province Nicoletta Bevilacqua Responsabile Ufficio Monitoraggio e ricerca FormezPA Obiettivi della presentazione Illustrare i principali risultati
della manutenzione, includa i requisiti relativi ai sottosistemi strutturali all interno del loro contesto operativo.
 L 320/8 Gazzetta ufficiale dell Unione europea IT 17.11.2012 REGOLAMENTO (UE) N. 1078/2012 DELLA COMMISSIONE del 16 novembre 2012 relativo a un metodo di sicurezza comune per il monitoraggio che devono
L 320/8 Gazzetta ufficiale dell Unione europea IT 17.11.2012 REGOLAMENTO (UE) N. 1078/2012 DELLA COMMISSIONE del 16 novembre 2012 relativo a un metodo di sicurezza comune per il monitoraggio che devono
La politica Nestlé per la Salute e la Sicurezza sul Lavoro
 La politica Nestlé per la Salute e la Sicurezza sul Lavoro La sicurezza non è negoziabile Nestlé è convinta che il successo a lungo termine possa essere raggiunto soltanto grazie alle sue persone. Nessun
La politica Nestlé per la Salute e la Sicurezza sul Lavoro La sicurezza non è negoziabile Nestlé è convinta che il successo a lungo termine possa essere raggiunto soltanto grazie alle sue persone. Nessun
MANUALE DELLA QUALITÀ Pag. 1 di 6
 MANUALE DELLA QUALITÀ Pag. 1 di 6 INDICE GESTIONE DELLE RISORSE Messa a disposizione delle risorse Competenza, consapevolezza, addestramento Infrastrutture Ambiente di lavoro MANUALE DELLA QUALITÀ Pag.
MANUALE DELLA QUALITÀ Pag. 1 di 6 INDICE GESTIONE DELLE RISORSE Messa a disposizione delle risorse Competenza, consapevolezza, addestramento Infrastrutture Ambiente di lavoro MANUALE DELLA QUALITÀ Pag.
CONSIGLIO NAZIONALE DELLE RICERCHE
 CONSIGLIO NAZIONALE DELLE RICERCHE REGOLAMENTO DI DISCIPLINA DELLE ATTIVITA' DI PROMOZIONE E SOSTEGNO DELLA RICERCA DEL CONSIGLIO NAZIONALE DELLE RICERCHE Approvato dal Consiglio direttivo nella seduta
CONSIGLIO NAZIONALE DELLE RICERCHE REGOLAMENTO DI DISCIPLINA DELLE ATTIVITA' DI PROMOZIONE E SOSTEGNO DELLA RICERCA DEL CONSIGLIO NAZIONALE DELLE RICERCHE Approvato dal Consiglio direttivo nella seduta
L asset più importante, l investimento più remunerativo? La governance, è tempo di investire nel «governance budget»
 Authorized and regulated by the Financial Services Authority L asset più importante, l investimento più remunerativo? La governance, è tempo di investire nel «governance budget» Il processo di investimento
Authorized and regulated by the Financial Services Authority L asset più importante, l investimento più remunerativo? La governance, è tempo di investire nel «governance budget» Il processo di investimento
REGOLAMENTO. (a completamento di quanto indicato nello statuto associativo) ITALA Motore di Impresa 1 - FINALITA DEL REGOLAMENTO
 REGOLAMENTO (a completamento di quanto indicato nello statuto associativo) 1 - FINALITA DEL REGOLAMENTO 1.1 Il presente regolamento si propone di organizzare l operatività di ITALA MOTORE D IMPRESA nell
REGOLAMENTO (a completamento di quanto indicato nello statuto associativo) 1 - FINALITA DEL REGOLAMENTO 1.1 Il presente regolamento si propone di organizzare l operatività di ITALA MOTORE D IMPRESA nell
Davide Campari-Milano S.p.A. Relazione del Consiglio di Amministrazione in ordine alle materie all Ordine del Giorno dell Assemblea degli azionisti
 Davide Campari-Milano S.p.A. Relazione del Consiglio di Amministrazione in ordine alle materie all Ordine del Giorno dell Assemblea degli azionisti del 30 aprile 2013, ai sensi dell articolo 125-ter del
Davide Campari-Milano S.p.A. Relazione del Consiglio di Amministrazione in ordine alle materie all Ordine del Giorno dell Assemblea degli azionisti del 30 aprile 2013, ai sensi dell articolo 125-ter del
Quando il dolore è ancora un problema. XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013
 Quando il dolore è ancora un problema XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013 Marta Gentili vivere senza dolore onlus In Italia, nel 2012, si stimano circa 364 mila nuove diagnosi per tumore
Quando il dolore è ancora un problema XVII CIPOMO Congresso Nazionale Roma, 20-22 giugno 2013 Marta Gentili vivere senza dolore onlus In Italia, nel 2012, si stimano circa 364 mila nuove diagnosi per tumore
I SISTEMI DI GESTIONE DELLA SALUTE E SICUREZZA SUL LAVORO: OHSAS 18001 AV2/07/11 ARTEMIDE.
 I SISTEMI DI GESTIONE DELLA SALUTE E SICUREZZA SUL LAVORO: OHSAS 18001 AV2/07/11 ARTEMIDE. 1 Nel panorama legislativo italiano la Salute e la Sicurezza sul Lavoro sono regolamentate da un gran numero di
I SISTEMI DI GESTIONE DELLA SALUTE E SICUREZZA SUL LAVORO: OHSAS 18001 AV2/07/11 ARTEMIDE. 1 Nel panorama legislativo italiano la Salute e la Sicurezza sul Lavoro sono regolamentate da un gran numero di
I fondi. Conoscerli di più per investire meglio. Ottobre 2008. Commissione Nazionale per le Società e la Borsa - Divisione Relazioni Esterne
 I fondi Conoscerli di più per investire meglio Ottobre 2008 Commissione Nazionale per le Società e la Borsa - Divisione Relazioni Esterne I FONDI: CONOSCERLI DI PIÙ PER INVESTIRE MEGLIO COSA SONO I fondi
I fondi Conoscerli di più per investire meglio Ottobre 2008 Commissione Nazionale per le Società e la Borsa - Divisione Relazioni Esterne I FONDI: CONOSCERLI DI PIÙ PER INVESTIRE MEGLIO COSA SONO I fondi
NOTA OPERATIVA N. 7/2015. OGGETTO: Crediti per imposte pagate all estero, aspetti fiscali e modalità di calcolo.
 NOTA OPERATIVA N. 7/2015 OGGETTO: Crediti per imposte pagate all estero, aspetti fiscali e modalità di calcolo. - Introduzione E sempre più frequente che le imprese italiane svolgano la propria attività
NOTA OPERATIVA N. 7/2015 OGGETTO: Crediti per imposte pagate all estero, aspetti fiscali e modalità di calcolo. - Introduzione E sempre più frequente che le imprese italiane svolgano la propria attività
RELAZIONE SANITARIA 2007
 RELAZIONE SANITARIA 2007 A CURA DELL OSSERVATORIO EPIDEMIOLOGICO PROVINCIALE Agosto 2008 1 Copie disponibili presso: Osservatorio Epidemiologico Provinciale Ripartizione Sanità Via Canonico M. Gamper 1
RELAZIONE SANITARIA 2007 A CURA DELL OSSERVATORIO EPIDEMIOLOGICO PROVINCIALE Agosto 2008 1 Copie disponibili presso: Osservatorio Epidemiologico Provinciale Ripartizione Sanità Via Canonico M. Gamper 1
UniCredit Banca a sostegno del fotovoltaico Stefano Rossetti Direttore Regionale Emilia Est e Romagna UniCredit Banca
 UniCredit Banca a sostegno del fotovoltaico Stefano Rossetti Direttore Regionale Emilia Est e Romagna UniCredit Banca 30 settembre 2007 Agenda La situazione della produzione di energia rinnovabile in Italia
UniCredit Banca a sostegno del fotovoltaico Stefano Rossetti Direttore Regionale Emilia Est e Romagna UniCredit Banca 30 settembre 2007 Agenda La situazione della produzione di energia rinnovabile in Italia
M U L T I F A M I L Y O F F I C E
 MULTI FAMILY OFFICE Un obiettivo senza pianificazione è solamente un desiderio (Antoine de Saint-Exupéry) CHI SIAMO MVC & Partners è una società che offre servizi di Multi Family Office a Clienti dalle
MULTI FAMILY OFFICE Un obiettivo senza pianificazione è solamente un desiderio (Antoine de Saint-Exupéry) CHI SIAMO MVC & Partners è una società che offre servizi di Multi Family Office a Clienti dalle
Progetto Nazionale di Cure Palliative Pediatriche
 Progetto Nazionale di Cure Palliative Pediatriche Ecco la proposta della Fondazione Maruzza Lefebvre D Ovidio, della fondazione Livia Benini, di altre Fondazioni ed Associazioni Italiane e successivamente
Progetto Nazionale di Cure Palliative Pediatriche Ecco la proposta della Fondazione Maruzza Lefebvre D Ovidio, della fondazione Livia Benini, di altre Fondazioni ed Associazioni Italiane e successivamente
Il Ministero dello Sviluppo Economico Il Ministro dello Sviluppo Economico
 Il Ministero dello Sviluppo Economico Il Ministro dello Sviluppo Economico L Associazione Bancaria Italiana (ABI) Il Presidente dell ABI La CONFINDUSTRIA Il Presidente di CONFINDUSTRIA La Conferenza dei
Il Ministero dello Sviluppo Economico Il Ministro dello Sviluppo Economico L Associazione Bancaria Italiana (ABI) Il Presidente dell ABI La CONFINDUSTRIA Il Presidente di CONFINDUSTRIA La Conferenza dei
SEDE DI CAGLIARI. Il credito all economia regionale: Il ruolo degli Intermediari e la nuova regolamentazione di settore
 FORUM PERMANENTE SUL CREDITO E LA FINANZA II^ CONFERENZA REGIONALE SUL CREDITO E LA FINANZA PER LO SVILUPPO Il credito all economia regionale: Il ruolo degli Intermediari e la nuova regolamentazione di
FORUM PERMANENTE SUL CREDITO E LA FINANZA II^ CONFERENZA REGIONALE SUL CREDITO E LA FINANZA PER LO SVILUPPO Il credito all economia regionale: Il ruolo degli Intermediari e la nuova regolamentazione di
D. LGS 81/2008. Rappresentante dei lavoratori per la sicurezza
 D. LGS 81/2008 I RAPPORTI CON I RAPPRESENTANTI DEI LAVORATORI Rappresentante dei lavoratori per la sicurezza 1. Il rappresentante dei lavoratori per la sicurezza è istituito a livello territoriale o di
D. LGS 81/2008 I RAPPORTI CON I RAPPRESENTANTI DEI LAVORATORI Rappresentante dei lavoratori per la sicurezza 1. Il rappresentante dei lavoratori per la sicurezza è istituito a livello territoriale o di
Relazione finanziaria annuale al 31 dicembre 2014
 Relazione finanziaria annuale al 31 dicembre 2014 MOLMED S.p.A. Via Olgettina, 58-20132 Milano Tel. +39 0221277.1 - Fax +39 02 21277.325 info@molmed.com - www.molmed.com Capitale Sociale 19.841.682,30
Relazione finanziaria annuale al 31 dicembre 2014 MOLMED S.p.A. Via Olgettina, 58-20132 Milano Tel. +39 0221277.1 - Fax +39 02 21277.325 info@molmed.com - www.molmed.com Capitale Sociale 19.841.682,30
Private Banking e Fondi Immobiliari
 0 Private Banking e Fondi Immobiliari Il mercato dei fondi immobiliari Il mercato dei fondi immobiliari nel mondo e in Europa Nel 2005 il portafoglio dei gestori professionali ha superato gli 800 mld di
0 Private Banking e Fondi Immobiliari Il mercato dei fondi immobiliari Il mercato dei fondi immobiliari nel mondo e in Europa Nel 2005 il portafoglio dei gestori professionali ha superato gli 800 mld di
Orientamenti sul sottomodulo del rischio di catastrofe per l assicurazione malattia
 EIOPA-BoS-14/176 IT Orientamenti sul sottomodulo del rischio di catastrofe per l assicurazione malattia EIOPA Westhafen Tower, Westhafenplatz 1-60327 Frankfurt Germany - Tel. + 49 69-951119-20; Fax. +
EIOPA-BoS-14/176 IT Orientamenti sul sottomodulo del rischio di catastrofe per l assicurazione malattia EIOPA Westhafen Tower, Westhafenplatz 1-60327 Frankfurt Germany - Tel. + 49 69-951119-20; Fax. +
in qualità di Emittente e Responsabile del Collocamento
 in qualità di Emittente e Responsabile del Collocamento Società per Azioni Via Lucrezia Romana, 41/47-00178 Roma P. IVA, Codice Fiscale e n. di Iscrizione al Registro delle Imprese di Roma n. 04774801007
in qualità di Emittente e Responsabile del Collocamento Società per Azioni Via Lucrezia Romana, 41/47-00178 Roma P. IVA, Codice Fiscale e n. di Iscrizione al Registro delle Imprese di Roma n. 04774801007
IL PRESENTE MODELLO RIPORTA LE CONDIZIONI DEFINITIVE DELLA NOTA INFORMATIVA SUL PROGRAMMA DI EMISSIONE DENOMINATO CASSA PADANA TASSO FISSO
 B.9 MODELLO DELLE CONDIZIONI DEFINITIVE CASSA PADANA Banca di Credito Cooperativo Società Cooperativa in qualità di Emittente IL PRESENTE MODELLO RIPORTA LE CONDIZIONI DEFINITIVE DELLA NOTA INFORMATIVA
B.9 MODELLO DELLE CONDIZIONI DEFINITIVE CASSA PADANA Banca di Credito Cooperativo Società Cooperativa in qualità di Emittente IL PRESENTE MODELLO RIPORTA LE CONDIZIONI DEFINITIVE DELLA NOTA INFORMATIVA
RENA. Rete per l Eccellenza Nazionale
 RENA Rete per l Eccellenza Nazionale Indice Il contesto e la nuova strategia. L obiettivo generale. Gli obiettivi strumentali. Le azioni specifiche. Gli obiettivi strumentali e le azioni specifiche. pag.
RENA Rete per l Eccellenza Nazionale Indice Il contesto e la nuova strategia. L obiettivo generale. Gli obiettivi strumentali. Le azioni specifiche. Gli obiettivi strumentali e le azioni specifiche. pag.
RISULTATI DELLA RILEVAZIONE SULLE COMMISSIONI APPLICATE DALLE BANCHE SU AFFIDAMENTI E SCOPERTI DI CONTO
 RISULTATI DELLA RILEVAZIONE SULLE COMMISSIONI APPLICATE DALLE BANCHE SU AFFIDAMENTI E SCOPERTI DI CONTO 1. Premessa La legge n. 2 del 28 gennaio 2009 ha vietato la commissione di massimo scoperto (CMS)
RISULTATI DELLA RILEVAZIONE SULLE COMMISSIONI APPLICATE DALLE BANCHE SU AFFIDAMENTI E SCOPERTI DI CONTO 1. Premessa La legge n. 2 del 28 gennaio 2009 ha vietato la commissione di massimo scoperto (CMS)
AMIANTO: quali effetti sulla salute ieri e oggi
 Aggiornamenti in Medicina del Lavoro AMIANTO: quali effetti sulla salute ieri e oggi Aldo Todaro U.O.C. Promozione e protezione salute lavoratori. Fondazione IRCCS CA Granda Ospedale Maggiore Policlinico
Aggiornamenti in Medicina del Lavoro AMIANTO: quali effetti sulla salute ieri e oggi Aldo Todaro U.O.C. Promozione e protezione salute lavoratori. Fondazione IRCCS CA Granda Ospedale Maggiore Policlinico
BANDO LAVORO & INCLUSIONE SOCIALE Favorire l inserimento lavorativo, in forma stabile e qualificata, di persone emarginate e svantaggiate
 BANDO LAVORO & INCLUSIONE SOCIALE Favorire l inserimento lavorativo, in forma stabile e qualificata, di persone emarginate e svantaggiate Il contesto L emarginazione sociale è un fenomeno che affligge
BANDO LAVORO & INCLUSIONE SOCIALE Favorire l inserimento lavorativo, in forma stabile e qualificata, di persone emarginate e svantaggiate Il contesto L emarginazione sociale è un fenomeno che affligge
Piaggio & C. S.p.A. Relazione Illustrativa
 Piaggio & C. S.p.A. Relazione Illustrativa Autorizzazione all acquisto e disposizione di azioni proprie, ai sensi del combinato disposto degli artt. 2357 e 2357-ter del codice civile, nonché dell art.
Piaggio & C. S.p.A. Relazione Illustrativa Autorizzazione all acquisto e disposizione di azioni proprie, ai sensi del combinato disposto degli artt. 2357 e 2357-ter del codice civile, nonché dell art.
Innovare in Filiere Tradizionali. Federchimica 19-05-2014
 Innovare in Filiere Tradizionali Federchimica 19-05-2014 Icap Leather chem L Azienda, fondata nel 1944, a seguito di espansione e di variazioni nell assetto societario acquisisce la denominazione di Icap
Innovare in Filiere Tradizionali Federchimica 19-05-2014 Icap Leather chem L Azienda, fondata nel 1944, a seguito di espansione e di variazioni nell assetto societario acquisisce la denominazione di Icap
PROVINCIA DI BERGAMO Bergamo, 22 ottobre 2012
 PROVINCIA DI BERGAMO Bergamo, 22 ottobre 2012 IL PATTO DEI SINDACI Raccogliere la sfida della riduzione del 20% delle emissioni di CO2 entro il 2020 sul proprio territorio: questo, in estrema sintesi,
PROVINCIA DI BERGAMO Bergamo, 22 ottobre 2012 IL PATTO DEI SINDACI Raccogliere la sfida della riduzione del 20% delle emissioni di CO2 entro il 2020 sul proprio territorio: questo, in estrema sintesi,
