EGFR pharmdx TM. Codice K test per il sistema Dako Autostainer Edizione 05/2015. Uso previsto Per uso diagnostico In Vitro.
|
|
|
- Carmelo Locatelli
- 6 anni fa
- Visualizzazioni
Transcript
1 EGFR pharmdx TM Codice K test per il sistema Dako Autostainer Edizione 05/2015 Uso previsto Per uso diagnostico In Vitro. Il saggio EGFR pharmdx TM è un sistema di analisi qualitativa immunoistochimica (IHC) che consente di identificare l'espressione del recettore del fattore di crescita epidermico (EGFR) in tessuti normali e neoplastici fissati secondo le procedure di routine per la valutazione istologica. L'analisi EGFR pharmdx individua in maniera specifica la proteina EGFR (HER1) nelle cellule che esprimono EGFR. L'analisi EGFR pharmdx è dunque valida per identificare i pazienti affetti da tumore colorettale che sono idonei ad una terapia a base di ERBITUX TM (Cetuximab) o Vectibix TM (Panitumumab). Cenni introduttivi Introduzione Il recettore del fattore di crescita epidemico (EGFR) è un recettore transmembrana 170 kd codificato dal gene HER1 umano. La proteina EGFR contiene un dominio extracellulare di legame al legante, una regione transmembrana e un dominio intracellulare con un'attività intrinseca di protein-tirosin-chinasi. Il recettore EGFR è omologo ad altri componenti della famiglia di recettorilerbb dell'egf, tra cui HER2IerbB2 o neu, HER3lerbB3 e ~~~41erbE34.'~~ La proteina EGFR è espressa da una vasta gamma di cellule nonali. tra cui molti tipi di cellule epiteliali e tumori da queste derivati.%' Tra le cellule non epiteliali che esprimono EGFR vanno citate la muscolatura liscia, i fibroblasti e i nervi.'' Specificità L'EGFR antiumano monoclonale murino, clone 2-18C9, viene fornito come supernatante per colture tissutali di un ibridoma. È prodotto da un topo immunizzato con EGFR immunoprecipitato proveniente da una linea cellulare A431 (carcinoma epidenoide umano). Gli studi di mappatura dell'epitopo indicano che I'anticorpo riconosce un epitopo nella regione extracellulare della molecola che è ricca di cisteina, la quale si estende dal sotto-dominio S2 ed è prossimale al dominio transmembrana. L'ulteriore mappatura degli aminoacidi di importanza critica indica che I'epitopo è conformazionale e dipendente dal ponte di bisolfuro nella molecola nativa." Questo anticorpo monoclonale non ha evidenziato reazioni crociate con HER2, HER3 o HER4 e con il tag vettore, myc. In genere si assiste alla colorazione del citoplasma, tuttavia il test deve essere ripetuto nel caso in cui la colorazione del citoplasma impedisca di distinguere la colorazione della membrana e complichi l'interpretazione dei risultati. Principio della procedura Il sistema di analisi IHC denominato EGFR pharmdx contiene tutti i reagenti necessari per portare a temine una procedura di colorazione IHC su campioni fissati secondo le procedure convenzionali e inclusi in paraffina. Dopo l'incubazione con I'anticorpo monoclonale primario anti-proteina EGFR umana, clone 2-18C9. il kit prevede l'impiego di un reagente di visualiuazione pronto all'uso. il quale sfrutta la tecnologia a base di destrano. Il reagente è composto da molecole di anticorpo secondario di capra anti-murino e da molecole di perossidasi di rafano, legate ad una comune catena principale di destrano. Questa tecnologia elimina la necessità di applicare in modo sequenziale un anticorpo di collegamento e un coniugato con perossidasi. La conversione enzimatica del cromogeno aggiunto successivamente porta alla formazione di un prodotto di reazione visibile nel sito antigenico. A questo punto è possibile applicare la colorazione di contrasto al campione e montare un vetrino coprioggetto. L'interpretazione dei risultati awiene per mezzo di un microscopio ottico. Per verificare il rendimento del reagente, nel kit vengono forniti dei vetrini di controllo contenenti due linee cellulari umane fissate in fonalina e incluse in paraffina. con valori di intensita di colorazione pari a 2+ e O. Reagenti Il codice K1494 si riferisce alla colorazione automatizzata con il sistema DAKO Autostainer. Il materiale elencato è sufficiente per effettuare 50 test (50 vetrini incubati con anticorpo primario anti-proteina EGFR e 50 vetrini incubati con il corrispondente reagente di controllo negativo). Il numero di test si basa sul protocollo EGFR pharmdx Autostainer con tutti i reagenti pronti all'uso. Il kit contiene materiale sufficiente per effettuare un massimo di 10 serie di colorazione singole.
2 Materiali forniti Quantità 2x1 1 rnl Descrizione Proteinase K READY-TO-USE I I Enzirna proteolitico Proteinase K diluito in tampone Tris-HCI, contenente sodio azide 0,015 rnolll. 2x1 1 rnl 1x12 rnl Blocco della perossidasi I PEROXIDASE BLOCK I Perossido di idrogeno al 3 %. Anticorpo monoclonale IgG, murino EGFR phanndx EGFR pharmdx MOUSE ANTI-HUMAN Anticor~o rnonoclonale lagi murino antiurnano EGFR Iclone 2-18C9). " in forma di supernatanteuper colture tissutali in tarnponè Tris-HCI. Contiene proteina stabilizzante e sodio azide 0,015 rnolll. 1x11 rnl Reagente di controllo negativo alle IgG, di topo EGFR phamdx NEGATIVE CONTROL Anticorpo rnonoclonale IgGi murino in forma di supernatante per colture tissutali in tampone Tris-HCI. contiene proteina stabilizzante e sodio azide 0,015 rnolll. 2x1 1 rnl Polimero marcato, HRP I LABELLED POLYMER-~q Destrano coniuaato con ~erossidasi di rafano e irnrnunoalobuline di cadra ' anti-irnrnunogl&uline di iopo isolate per affinità. ~ornitoin tampone Tris-HCI contenente proteina stabilizzante e un agente antirnicrobico. 10x11 rnl SUBSTRATE BUFFER Soluzione tampone substrato, a ph 7,5, contenente 0,l % di perossido di idrogeno, stabilizzanti, enhancer e un agente antirnicrobico. 2x3 rnl Cromogeno liquido DAB+ I DAB+ CHROMOGEN I I I Soluzione crornogeno contenente 3,3'-diarninobenzidina (5 %). Tampone di lavaggio 1Ox I WASH BUFFER (1 0x1 I I.. Soluzione salina tamponata con Tris, contenente Tween 20, a ph 7,6. 2x5 vetrini Vetrini di controllo EGFR phanndx TH Ogni vetrino contiene sezioni di due linee cellulari pellettizzate, fissate in formalina, incluse in paraffina, che rappresentano un livello moderato di espressione della proteina EGFR e assenza di espressione EGFR. I valori di intensità della colorazione IHC dei pellet cellulari sono pari a 2+ e O. i Linea cellulare: CAMA-1 + Livello di espressione: 0 Linea cellulare: HT-29 Livello di espressione: 2+
3 Materiali necessari ma non forniti Idrossido di ammonio, 15 molll, diluito a 0,037 moiil Colorazione di contrasto: ematossilina, a base di alcol o acqua, ad esempio Dako Hematoxylin (codice S3302) oppure Dako Automation Hematoxylin (codice ) Vetrini coprioggetto Acqua distillata o deioniuata (acqua grado reagente) Forno essiccante, in grado di mantenere una temperatura di C Etanolo, assoluto e al 95 % Microscopio ottico (ingrandimento dell'obiettivo 4x-40x) Mezzo di montaggio, ad esempio Dako Faramount (codice S3025), Dako Glycergel (codice C0563) o Dako Ultramount (codice S1964) Tessuti positivi e negativi da utilizzare come controlli di lavoro (vedere Controllo della qualità) Vetrini: vetrini Fisher SuperFrost Plus, vetrini polilisinati, vetlini a carica positiva o vetrini Dako Silanized Slides, codice S3003 (vedere Preparazione dei campioni) Vaschette o bagni per la colorazione Contaminuti (per intervalli di 2-30 minuti) Spruzzetta Xilene, toluene o derivati dello xilene Pipetta da 1 ml Dako Autostainer Universal Staining System (codice S3400) o Autostainer Plus (codice 53800) con il software Dako Autostainer versione o successiva (fare riferimento alla guida deli'utente di Dako Autostainer per conoscere i componenti necessari). Nota: tutti i reagenti inclusi o disponibili a parte, come Dako Wash Buffer (codice S3006), sono formulati in modo specifico per questo test. Affinché il test abbia il livello di rendimento specificato, evitare sostituzioni di qualsiasi genere. Preparazione dei campioni I campioni bioptici devono essere manipolati in modo da preseware il tessuto per la colorazione IHC. Adottare i metodi standard per il trattamento dei tessuti di tutti i ~ampioni.'~ I campioni consewati nei fissativi elencati di seguito sono idonei all'uso con l'analisi EGFR pharmdx. Formalina tamponata neutra al 10 % (vlv); formalina non tamponata al 10 % (vlv); formalina non tamponata al 25 % (vlv); alcol-formalina-acido acetico (AFA); Richard-Allen Scientific's Pen-fix; Bouin's Fixative. I tessuti fissati in Anatech's PreFer non sono idonei all'uso con l'analisi EGFR pharmdx. Se i tessuti fissati in PreFer vengono analizzati con il test EGFR pharmdx, la presewazione della morfologia è insoddisfacente e si possono ottenere risultati err~nei.'~ Sezioni incluse in paraffina Si possono utilizzare i tessuti trattati con i metodi convenzionali e inclusi in paraffina. I campioni bioptici devono essere bloccati in uno spessore di 3 o 4 mm e fissati per il periodo di tempo necessario, in base al tipo di fissativo utilizzato. In seguito i tessuti vengono disidratati e diafanizzati in una serie di alcoli e xilene. quindi infiltrati con paraffina fusa. La temperatura della paraffina non deve superare i 60 C. 1 blocchi di tessuto adeguatamente fissati e inclusi in paraffina che esprimono la proteina EGFR si conseweranno a tempo indeterminato prima del sezionamento e del montaggio sui vetrini, purché conservati in un luogo fresco (15-25 C). 13." I campioni di tessuto devono essere tagliati in sezioni di 3-5 pm. Dopo il sezionamento, i tessuti vengono montati sui vetrini e infine collocati sugli appositi rack per I'essiccamento. Si consiglia di utilizzare vetrini Fisher SuperFrost Plus, vetrini silanizzati Dako Silanized Slides (codice S3003), vetrini a carica positiva o vetrini polilisinati. Scuotere il rack porta-vetrini su una salviettina assorbente, in modo da eliminare l'acqua intrappolata sono la paraffina e sul vetro. Lasciare asciugare il rack porta-vetrini a temperatura ambiente per un'ora, quindi metterlo in un'incubatrice a C per un'altra ora. È necessario eliminare tutta l'eventuale acqua in eccesso trattenuta sui vetrini dopo il periodo in incubatrice. A questo scopo, scuotere i vetrini su salviettine assorbenti e lasciarli asciugare nell'incubatrice per un'altra ora. Dopo il periodo trascorso nell'incubatrice, i vetrini devono essere lasciati a temperatura ambiente finché non si raffreddano e finché la paraffina non si indurisce. Per preservare I'antigenicità, le sezioni di tessuto già montate sui vetrini (Fisher SuperFrost Plus, vetrini polilisinati, vetrini a carica positiva o Dako Silanized Slides - codice S3003) dovranno essere sottoposte alla colorazione entro 2 mesi dal sezionamento e conservate a temperatura ambiente (20-25 C). l4 Consultare il manuale Dako "lmmunochemical Staining ~ethods"'' o i riferimenti bibliografici 13 e 15 per ulteriori informazioni sulla preparazione dei campioni. L'uso di questo sistema di analisi con tessuti decaicificati non è stato approvato ed è fortemente sconsigliato. I vetrini da utilizzare per la valutazione EGFR e per la verifica della presenza di tumore devono essere preparati in contemporanea. Si consiglia di preparare almeno 5 vetrini: 1 per la presenza di tumore, 2 per la valutazione della proteina EGFR (uno per I'anticorpo primario e uno per il reagente di controllo negativo), 2 vetrini di riserva. Precauzioni 1. Per uso professionale. 2. Questo prodotto contiene sodio azide (NaN3), una sostanza chimica fortemente tossica in forma pura. Sebbene non sia classificato come prodotto a rischio, il contenuto di NaN3 alle concentrazioni indicate può reagire con il rame e il piombo delle tubature formando azidi metalliche fortemente esplosive. Durante lo smaltimento, sciacquare le tubature con abbondante acqua per prevenire l'eventuale accumulo di azide." 3. Sia per i campioni che per i reagenti, si consiglia di adottare le normali procedure previste per il trattamento dei prodotti di origine biologica. 4. Ridurre al minimo la contaminazione batterica dei reagenti, cosi da evitare una colorazione aspecifica. 5. Tempi, temperature e modalità di incubazione diversi da quelli specificati possono generare risultati erronei reagenti sono stati diluiti in modo ottimale. Ulteriori diluizioni potrebbero causare la perdita di colorazione antigenica. 7. Non sostituire gli anticorpi primari o i reagenti di controllo negativi con anticorpi primari e reagenti di controllo negativi appartenenti a lotti di produzione diversi (il numero di lotto è riportato sull'etichetta delle fiale) o con reagenti di altri produttori.
4 8. 11 polimero marcato, il cromogeno liquido DAB+ e la soluzione preparata cromogeno-substrato DAB+ possono subire alterazioni se esposti a livelli di luce eccessivi. Evitare di conservare i componenti del kit e di eseguire la colorazione in condizioni di luce intensa, ad esempio sotto la luce diretta del sole. 9. Indossare indumenti di protezione personale adeguati, così da evitare il contatto con gli occhi e la pelle.'8 Smaltire i reagenti inutilizzati nel rispetto delle disposizioni locali, regionali e nazionali previste in materia. 10. Su richiesta è disponibile una scheda di sicurezza per utenti professionisti. 11. In generale, l'utilizzo del prodotto da parte di soggetti di età infetiore a 18 anni non è consentito. Gli utenti devono essere accuratamente informati in merito alle corrette procedure operative, alle proprietà pericolose del prodotto e alle disposizioni di sicurezza necessarie. Per ulteriori informazioni, fare riferimento alla Scheda dati di sicurezza (SDS). DAB+ Chromogen: 1-5% biphenyl-3,3',4,4'-ietrayltetraammnium tetrachloride H350 Può provocare il cancro. H341 Sospettato di provocare alterazioni genetiche. P201 Procurarsi istruzioni specifiche prima dell'uso. P202 Non manipolare prima di avere letto e compreso tutte le avvertenze. P281 Utilizzare il dispositivo di protezione individuale richiesto. P308 + P313 IN CASO di esposizione o di possibile esposizione: Richiedere assistenza medica. P405 Conservare sotto chiave. P501 L Smaltire il prodotto e il recipiente in conformità a tutte le normative locali, regionali, nazionali e internazionali.....~. Wash Buffer (1OX): 5-10% Sodium chloride, 5-10% 2-Amino-2-(hydroxymethy1)propane-l,3-dio1 hydrochloride H31 9 Provoca grave irritazione oculare. P280 Indossare guanti protettivi. Fare uso di un dispositivo di protezione degli occhi o del viso. Indossare indumenti protettivi. P264 Lavare accuratamente le mani dopo I'uso. P305 + P351 + IN CASO DI CONTATTO CON GLI OCCHI: sciacquare accuratamente per parecchi minuti. Togliere le eventuali lenti a P338 contatto se è agevole farlo. Continuare a sciacquare. P337 + P313 Se l'irritazione degli occhi persiste, consultare un medico. Conservazione Conservare il kit per analisi EGFR pharmdx a 2-8 'C. Conservare anche i vetrini di controllo a 2-8 C. La soluzione preparata cromogeno-substrato (DAB) è stabile per 5 giorni circa. purche conservata a 2-8 C. Non utilizzare il kit dopo la data di scadenza stampata all'esterno della confezione del kit. Non sono stati osservati segni evidenti che suggeriscano l'instabilità di questi prodotti, pertanto è opportuno analizzare un controllo positivo e un controllo negativo contemporaneamente ai campioni dei pazienti. Se i prodotti sono conservati in condizioni difformi da quelle specificate nel relativo foglietto illustrativo, I'uso dei reagenti dovrà essere convalidato da~l'utente.'~ Istruzioni per l'uso Preparazlone dei reagenti Preparare i seguenti reagenti prima della colorazione. Soluzione tampone di lavaggio Preparare una quantità sufficiente di tampone per i cicli di lavaggio. A questo scopo, diluire il prodotto Wash Buffer 10x con rapporto?:l0 usando acqua distillata o deionizzata (acqua grado reagente). Eliminare la soluzione tampone se appare torbida. Soluzione cromogenosubstrato (DAB+) Miscelare accuratamente questa soluzione prima dell'uso. L'eventuale presenza di precipitato nella soluzione non altera la qualità della colorazione. Per preparare la soluzione cromogeno-substrato DAB+, aggiungere 11 gocce di cromogeno liquido DAB+ in un flacone di tampone substrato DAB+ e miscelare. Gettare via la soluzione che non viene utilizzata. Nota importante: il colore della soluzione cromogeno liquido DAB+ nel flacone pub variare da trasparente a violetto chiaro-marrone. Questa caratteristica non altera il rendimento del prodotto. Diluire in base alle istruzioni fornite sopra. L'aggiunta di una quantità eccessiva di soluzione crornogeno liquido DAB+ al tampone substrato DAB+ causa un deterioramento del segnale positivo. Colorazione di contrasto Preparare la soluzione ammoniacale per l'eventuale colorazione di contrasto blu richiesta. La soluzione ammoniacale (0,037 molll) viene preparata miscelando 2,5 (I0,5) rnl di idrossido di ammonio 15 mol/l (concentrato) in 1 litro di acqua grado reagente. La soluzione ammoniacale 0,037 molll inutilizzata può essere conservata in un flacone perfettamente sigillato a temperatura ambiente (20-25 C) per 12 mesi.
5 Meno di montaggio Per il montaggio acquoso si consiglia di utilizzare i mezzi Dako Faramount Aqueous Mounting Medium, Ready-to-use (codice S3025) o Dako Glycergel Mounting Medium (codice C0563). Liquefare Glycergel prima dell'uso riscaldando il mezzo tino a 40 C (15) circa. È possibile utilizzare anche un mezzo di montaggio permanente non acquoso, ad esempio Dako Ultramount (codice S1964). Procedura per la colorazione con il sistema Dako Autostainer Note sulla procedura Prima dell'uso, l'utente deve leggere attentamente le istruzioni fornite di seguito e studiare tutti i componenti (vedere Precauzioni). Fare riferimento alla pubblicazione "DAKO Autostainer, Universal Staining System, User Guide". Tutti i reagenti devono essere equilibrati a temperatura ambiente (20-25 C) prima dell'immunocolorazi one. Analogamente, tutte le fasi di incubazione devono svolgersi a temperatura ambiente. Evitare che le sezioni di tessuto si secchino durante la procedura di colorazione, altrimenti si potrebbe assistere ad un aumento del fenomeno di colorazione aspecifica. Deparaffinazione e reidratazione Prima della colorazione, i vetrini contenenti i tessuti devono essere deparaifinati per rimuovere il mezzo di inclusione e successivamente reidratati. Non rimuovere la paraffina solo parzialmente: la presenza di eventuali residui del mezzo di inclusione può provocare un aumento della colorazione aspecifica. FASE 1. Immergere i vetrini in un bagno di xilene e incubare per 5 (Il) minuti. Cambiare il bagno e ripetere la fase. FASE 2. Picchiettare i vetrini per eliminare il liquido in eccesso e immergerli in etanolo assoluto per 3 (11) minuti. Cambiare il bagno e ripetere una volta. FASE 3. Picchiettare i vetrini per eliminare il liquido in eccesso e immergerli in etanolo al 95 % per 3 (11) minuti. Cambiare il bagno e ripetere una volta. FASE 4. Picchiettare i vetrini per eliminare il liquido in eccesso e immergerli in acqua grado reagente per 5 (Il) minuti. FASE 5. Picchiettare i vetrini per eliminare il liquido in eccesso e immergerli nel tampone di lavaggio. Awiare la procedura di colorazione (vedere Protocollo di colorazione). Le soluzioni di xilene e di alcol devono essere sostituite dopo 40 vetrini. Al posto dello xilene è possibile utilizzare i derivati di toluene o xilene. ad esempio Histoclear. Il kit EGFR pharmdx include una fase di pretrattamento con digestione dell'enzima proteolitico. Talvolta è possibile che le sezioni di tessuto siano sovradigerite e questo causa la disgregazione delle membrane cellulan e della struttura generale del tessuto. Eseguire l'analisi prestando attenzione alla durata della fase di digestione proteolitica. Nota: se la sovradigestione è un problema frequente, i tessuti fissati in formalina tamponata neutra al 10 % possono essere sottoposti a post-fissazione in formalina tamponata neutra al 10 % per 10 minuti dopo la deparaffinazione. Vedere la procedura riportata di seguito. Procedura di post-fissazione 1. Deparaffinare le sezioni e immergerle in acqua grado reagente. 2. Immergere i vetrini in un bagno di formalina tamponata neutra al 10 % per 10 minuti. 3. Risciacquare i vetrini due volte in acqua deionizzata o distillata. 4. Proseguire con la procedura di colorazione EGFR pharmdx. Protocollo di colorazione automatiuata Fare riferimento alla pubblicazione "DAKO Autostainer, Universal Staining System, User Guide" FASE 1. Selezionare il protocollo e programmare il ciclo di colorazione. FASE 2. Utilizzare i programmi automatici (Auto) per impostare il programma e awiare l'analisi EGFR pharmdx. FASE 3. Collocare le fiale di reagente sul rack reagenti del sistema DAKO Autostainer secondo la mappa dei reagenti generata dal computer. FASE 4. Caricare i vetrini sul sistema DAKO Autostainer secondo la mappa dei vetrini generata dal computer. FASE 5. Awiare il ciclo. FASE 6. Rimuovere i vetrini dal sistema DAKO Autostainer. Proseguire con la colorazione di contrasto e il montaggio. Nota: sciacquare i vetrini in acqua grado reagente dopo la fase di immersione nella soluzione cromogeno-substrato DAB+. Sui dispositivi DAKO Autostainer versioni 02 e 03 viene eseguito un risciacquo dei vetrini in acqua grado reagente dopo la fase substrato-cromogeno, mentre sui dispositivi DAKO Autostainer versione 01 viene eseguito un risciacquo in soluzione tamponata. Questo significa che i vetrini colorati su un dispositivo della versione 01 devono essere necessariamente sciacquati con acqua grado reagente dopo la rimozione dal sistema Autostainer.
6 Figura l. Griglia di programmazione del sistema Autostainer Illustrazione del ciclo del programma sul sistema Dako Autostainer. La griglia di programmazione (Programming Grid) è un modello generico di protocollo (Master Protocol Template) contenente gli elementi del protocollo necessari per programmare tutti i sistemi di rivelazione con il kit EGFR pharmdx. In questa griglia di esempio sono visualizzati solo i reagenti EGFR. Colorazione di contrasto (istruzioni per ematossilina) Il prodotto finale della reazione di colorazione è insolubile in alcol e in acqua. È possibile utilizzare ematossilina a base di alcol o acqua, come Dako Hematoxylin (codice S3302) o Dako Automation Hematoxylin (codice S3301). Non utilizzare colorazioni di contrasto regressive. FASE 1. Rimuovere i vetrini dal sistema Dako Autostainer e applicare la colorazione di contrasto con ematossilina secondo la modalità descritta di seguito. FASE 2. Immergere i vetrini in un bagno di ematossilina. Incubare per 2-5 minuti, a seconda dell'intensità dell'ematossilina utilizzata. FASE 3. Sciacquare delicatamente in un bagno di acqua grado reagente. Verificare che tutta I'ematossilina residua venga lavata via. Facoltativo: immergere i vetrini 10 volte in un bagno di soluzione ammoniacale 0,037 molll (vedere Preparazione dei reagenti). Quando si utilizzano i prodotti Dako Hematoxylin (codice S3302) o Dako Automation Hematoxylin (codice S3301), la fase della soluzione ammoniacale non è necessaria. Nota: si consiglia vivamente di utilizzare Dako Automation Hematoxylin (codice S3301). Con un'incubazione di 5 minuti, questa colorazione di contrasto genera un prodotto finale viola chiarolblu che non oscura i'immunocolorazione specifica. Una colorazione di contrasto troppo forte potrebbe mascherare un'espressione EGFR debole. FASE 4. Sciacquare delicatamente in un bagno di acqua grado reagente per 2-5 minuti Montaggio Per il montaggio acquoso si consiglia di utilizzare i mezzi Dako Faramount Aqueous Mounting Medium, Ready-to-use (codice S3025) o Dako Glycergel Mounting Medium (codice C0563). Liquefare Glycergel prima dell'uso riscaldando il mezzo fino a 40 C (I5) circa. È possibile utilizzare anche un mezzo di montaggio permanente non acquoso. ad esempio Dako Ultramount (codice S1964). Nota: è possibile leggere i vetrini in qualunque momento. Tuttavia, se i vetrini vengono coperti con un mezzo di montaggio acquoso ed esposti alla luce intensa è possibile che si verifichi un certo grado di scolorimento. Per evitare che ciò accada, conservare i vetrini al buio a temperatura ambiente (20-25 C). Controllo della qualità Se le procedure consigliate per la fissazione, il trattamento e l'inclusione dei tessuti vengono modificate in laboratorio, è possibile che i risultati presentino variazioni significative. In tal caso, oltre ad utilizzare i vetrini di controllo forniti da Dako, occorre effettuare tutta una serie di controlli interni con regolarità. Negli USA, consultare le linee guida sul controllo della qualità stabilite nel "College of American Pathologists (CAP) Certification Program for Immunohistochemistry". Fare inoltre riferimento alle istruzioni "CLSI Quality Assurance for Immunocytochemistry Approved ~uideline"'~ e ai riferimenti bibliografici per ulteriori informazioni.
7 Vetrini di controllo EGFR pharmdx (forniti nel kit) Tutti i vetrini di controllo forniti nel kit contengono due linee cellulare umane pellettiuate, fissate in formalina e incluse in paraffina, con valori di intensità di colorazione pari a 2+ e O. È necessario utilizzare un vetrino in ogni procedura di colorazione. Valutando le linee cellulari sul vetrino di controllo fornito da Dako è possibile verificare la validità della procedura di colorazione. Non utilizzare i vetrini di controllo per I'interpretazione dei risultati dei campioni. Tessuto di controllo positivo I controlli dovrebbero essere costituiti da campioni freschi di autopsialbiopsialchinirgia che sono stati fissati, trattati e inclusi in paraffina nei tempi più brevi possibili, seguendo la medesima procedura utilizzata per i campioni dei pazienti da analizzare. I controlli positivi confermano se i tessuti sono stati preparati correttamente e se sono state adottate tecniche di colorazione corrette. È necessario includere un controllo positivo per ogni sei di condizioni di analisi previsto in ogni ciclo di colorazione. I controlli positivi devono produrre una colorazione positiva debole, cosl da evidenziare variazioni leggere nella sensibilità dell'anticorpo primario. I vetrini di controllo forniti nel kit o i campioni trattati diversamente dai campioni dei pazienti consentono di convalidare soltanto il rendimento del reagente, ma non verificano la preparazione del tessuto. I controlli positivi noti devono essere utilizzati esclusivamente per verificare il corretto rendimento dei tessuti trattati e dei reagenti per l'analisi, NON per formulare una diagnosi specifica dei campioni dei pazienti. Se i controlli positivi non presentano una colorazione positiva, significa che i risultati ottenuti con i campioni dei pazienti analizzati non sono validi. Tra i tipi di cellule normali che possono essere utilizzati come campioni EGFR positivi deboli vanno citate le cellule epiteliali ghiandolari della prostata e I'epitelio bronchiale del polmone. Poiché il pattern di colorazione EGFR è eterogeneo, anche gli elementi del tessuto normale che si colorano in modo debole possono risultare negativi. Un controllo interno positivo particolarmente forte è il perinevrio. Tra le cellule normali che presentano una colorazione EGFR positiva di moderata intensità vanno citate le cellule epiteliali della cervice e la pelle. Tessuto di controllo negativo In ogni ciclo di colorazione è necessario utilizzare un tessuto di controllo negativo (negativo alla proteina EGFR) che sia stato fissato, trattato e incluso in paraffina secondo la medesima procedura adottata per i campioni dei pazienti da analizzare. In questo modo è possibile verificare la specificità dell'anticorpo primario e fornire un'indicazione della colorazione di fondo specifica. Molteplici tipi di cellule presenti nella maggior parte delle sezioni tissutali offrono siti interni di controllo negativo (è necessaria una verifica dell'utente). Se si osserva una colorazione specifica nel tessuto di controllo negativo, significa che i risultati ottenuti con i campioni dei pazienti analizzati non sono validi. Tra gli elementi del tessuto che possono essere utilizzati come controlli negativi vanno citati i miociti cardiaci. Anche le cellule acinose pancreatiche sono negative all'egfr, mentre I'epitelio del dotto biliare pancreatico assume una colorazione positiva. L'analisi EGFR pharmdx non produce una colorazione dei linfociti, quando questi sono presenti, pertanto è possibile utilizzare i linfociti come controllo negativo interno. Reagente di controllo negativo aspecifico Al posto dell'anticorpo primario, è possibile utilizzare il reagente di controllo negativo (fornito nel kit) su una sezione di ogni campione con lo scopo di valutare la colorazione aspecifica e favorire I'interpretazione della colorazione specifica nel sito dell'antigene. Il periodo di incubazione del reagente di controllo negativo deve corrispondere a quello dell'anticorpo primario. Verifica del saggio Prima di utilizzare per la prima volta un sistema di colorazione in una procedura diagnostica, l'utente deve verificare la specificità del test applicandolo ad una serie di tessuti interni con caratteristiche note di rendimento IHC, che rappresentano tessuti positivi e negativi noti. Tali procedure di verifica devono essere ripetute per ogni nuovo lotto di test. A questo scopo, fare riferimento alle procedure per il controllo della qualità descritte in questa sezione del foglietto illustrativo del prodotto e ai requisiti di controllo della qualità espressi nel "CAP Certification Program for Immunohistochemistry" e10 alle istruzioni "CLSI Quality Assurance for Immunocytochemistry, Approved ~uideline"." Per la verifica del saggio è possibile utilizzare sia tessuti negativi, sia carcinomi per i quali siano noti i valori di intensità della colorazione EGFR.
8 Tabella 1. Finalità del controllo di qualità giornaliero Tessuto: fissato e trattato come il campione Anticotpo specifico e sistema di rivelazione Fondo: anticotpo aspecifico del paziente (reagente di controllo negativo, lagi murine) fornito Vetrino di controllo fornito da Dako. Controlla solo la procedura di colorazione. Valutando le linee cellulari sul vetrino di controllo fornito da Dako 6 possibile verificare la validità della procedura di colorazione. Controllo positivo: tessuti o cellule che Controlla tutte le fasi dell'analisi. Convalida le Rilevamento di una colorazione di contengono I'antigene bersaglio da individuare procedure e i reagenti utilizzati per la fondo aspecifica. (potrebbe essere presente nel tessuto del colorazione EGFR. paziente). Il controllo ideale è un tessuto con una colorazione positiva debole, in quanto è più sensibile all'anticorpo o alla degradazione dell'antigene. Controllo negativo: tessuti o cellule che si Rilevamento di una reattività crociata Rilevamento di una colorazione di presume negativi (potrebbero trovarsi nel indesiderata dell'anticorpo verso le cellule/i fondo aspecifica. tessuto del paziente o nel tessuto di controllo componenti cellulari. ~ositivo). Tessuto del paziente. Rilevamento della colorazione specifica. Rilevamento di una colorazione di fondo as~ecifica. Interpretazione della procedura di colorazione La valutazione dei vetrini deve essere effettuata da un patologo con un microscopio ottico. Tutte le valutazioni devono essere effettuate sulla regione tumorale del campione. Per la valutazione della colorazione immunocitochimica e la determinazione dell'intensità, serve un obiettivo con un ingrandimento 10x o 20x. Per I'interpretazione dei risultati della colorazione, prendere in considerazione le cellule intatte: spesso le cellule necrotiche o degradate assumono una colorazione aspecifica." In ogni kit EGFR pharmdx sono contenute linee cellulari positive e negative, che consentono di convalidare i cicli di colorazione ogni volta che viene eseguita l'analisi. Una colorazione adeguata delle linee cellulari di controllo indica che il kit EGFR pharmdx funziona correttamente. L'assenza di colorazione della membrana per la linea cellulare di controllo CAMA-1 (O) e una colorazione marrone chiaro o incompleta della membrana per la linea cellulare di controllo HT-29 (2+) indicano che il ciclo di colorazione è valido. Se l'intensità della colorazione della linea cellulare di controllo positiva e troppo debole o troppo forte, è possibile che vengano generati risultati falsi-negativi o falsi-positivi. In questo caso è necessario ripetere il test. Sono disponibili immagini di riferimento nella guida all'interpretazione del test EGFR pharmdx. Il kit EGFR pharmdx colora prevalentemente le membrane cellulari. rivelando sia una colorazione circonferenziale completa che incompleta. Il pattern di immunocolorazione è spesso eterogeneo e rivela varie intensità di colorazione all'interno di una singola neoplasia. È stata osservata anche la colorazione del citoplasma e degli spazi extracellulari. Spesso si assiste alla colorazione del citoplasma, tuttavia il test va ripetuto ne caso in cui una significativa colorazione del citoplasma complichi la distinzione della colorazione della membrana e l'interpretazione dei risultati. I tumori devono essere classificati positivi all'egfr o negativi alllegfr tramite la colorazione della membrana come struttura da valutare. Una cellula tumorale è positiva all'egfr se presenta una colorazione della membrana oltre il livello di fondo, sia essa completamente circonferenziale o meno. Un tumore senza colorazione della membrana oltre il livello di fondo in qualsiasi cellula tumorale è classificato come tumore negativo all'egfr. A seconda della durata dell'incubazione o della potenza dell'ematossilina impiegata, la colorazione di contrasto può produrre un blu più o meno scuro nel nucleo della cellula. Una colorazione di contrasto eccessiva o incompleta può compromettere la corretta interpretazione dei risultati. Tabella 2. Risultati della colorazione con EGFR phamdx Riferire al medico curante Tumore negativo all'egfr Tumore positivo all,egfr Definizione Assenza di colorazione della membrana oltre il livello di fondo in tutte le cellule tumorali La colorazione positiva alllegfr è definita come una qualsiasi colorazione IHC della membrana della cellula tumorale oltre il livello di fondo, sia essa completamente circonferenziale o meno. Intensità della colorazione l+, 2+ o 3+ Percentuale di colorazione delle cellule tumorali > 0 % Tali definizioni di risultati positivi e negativi rispettano le pubblicazioni su~l'argomento~~, ma possono necessitare di modifiche in contesti specifici. (Vedere la sezione sottostante Limiti specifici del prodotto)
9 Limiti Limiti generali L'IHC è una tecnica diagnostica multifase che richiede un addestramento specifico per quanto riguarda la scelta dei reagenti appropriati, la selezione, la fissazione e il trattamento dei tessuti, la preparazione del vetrino per IHC e I'interpretazione dei risultati della colorazione. La colorazione del tessuto dipende dal modo in cui tale tessuto viene trattato prima. Una fissazione eseguita in maniera scorretta, il congelamento, lo scongelamento, il lavaggio, I'essiccazione, il riscaldamento, il sezionamento o la contaminazione con altri tessuti o fluidi possono produrre artefatti, intrappolare I'anticorpo o generare risultati falsi-negativi. Risultati incoerenti possono essere provocati anche da inodifiche apportate ai metodi di fissazione e di inclusione o da irregolarità intrinseche del tessuto. Una colorazione di contrasto eccessiva o incompleta può compromettere I'interpretazione dei risultati L'interpretazione clinica di qualsiasi colorazione positiva o assenza di colorazione non può prescindere dal contesto della presentazione clinica, della morfologia e di altri criteri istopatologici e deve sempre essere accompagnata da studi morfologici e controlli adeguati, oltre che da altri test diagnostici. L'interpretazione della colorazione è di competenza di un patologo qualificato, che deve avere una profonda conoscenza degli anticorpi, dei reagenti e dei metodi impiegati. La colorazione deve essere eseguita in un laboratorio autorizzato certificato. sotto la supervisione di un patologo incaricato di esaminare i vetrini colorati e garantire l'adeguatezza dei controlli positivi e negativi. I tessuti delle persone infette dal virus dell'epatite B e contenenti I'antigene di superficie dell'epatite B (HBsAg) possono essere interessati da una colorazione aspecifica con la perossidasi di rafano.25 I reagenti potrebbero provocare reazioni impreviste in tessuti che non sono mai stati analizzati in passato. Inoltre non è possibile escludere la possibilità che si verifichino reazioni impreviste anche in gruppi di tessuti già analizzati in passato, vista l'elevata variabilità biologica dell'espressione antigenica nelle neoplasie o in altri tessuti pato~ogici.'~ Si prega di voler comunicare eventuali reazioni impreviste all'assistenza tecnica Dako, fornendo tutta la documentazione del caso. Eventuali risultati falsi-positivi potrebbero essere dovuti ad un legame non immunologico delle proteine o dei prodotti di reazione del substrato, oltre che dall'attività di pseudoperossidasi (eritrociti) e dall'attività di perossidasi endogena (citocromo c).~' Nota: i reagenti e le istruzioni fornite in questo sistema di analisi sono state studiate per assicurare una prestazione ottimale. L'ulteriore diluizione dei reagenti o una variazione dei tempi o delle temperature di incubazione potrebbero generare risultati erronei o discordanti. Limiti specifici del prodotto La percentuale di risposta al trattamento con cetuximab per i pazienti risultati negativi all'egfr e per quelli che hanno riscontrato una colorazione positiva ali'egfr in meno dell'l% delle cellule tumorali non è nota, poiché tali pazienti non erano presenti agli studi clinici sul farmaco. I tumori con colorazione positiva all'egfr in > 1% delle relative cellule esprimono I'EGFR rispettando le attuali istruzioni per I'uso del cetuximab. I pazienti che presentavano una colorazione EGFR della membrana con una quantità di cellule tumorali inferiore all'uno percento non sono stati inseriti nello studio per il controllo randomizzato di Panitumumab e, pertanto, l'attività del Panitumumab in questa popolazione di pazienti è sconosciuta. I tumori con colorazione positiva all'egfr in >l% delle cellule sono considerati come esprimenti EGFR rispetto alle attuali indicazioni per I'uso del Panitumumab. Eventuali risultati falsi-negativi potrebbero essere dovuti alla degradazione dell'antigene nei tessuti con il passare del tempo. I campioni devono essere sotioposti a colorazione entro due mesi dal montaggio dei tessuti sui vetrini, purché conservati a temperatura ambiente (20-25 C). Per garantire risultati ottimali e riproducibili, la proteina EGFR richiede una fase di digestione proteolitica quando i tessuti sono fissati e inclusi in paraffina secondo i metodi convenzionali. Caratteristiche prestazionali Specificita L'anticorpo anti-egfr, clone (2-18C9), è stato testato per studiare la reattività contro le linee cellulari che esprimono EGFR, HER2. HER3 ed HER4. Nel Western blotting dei lisati cellulari SKBR3 e A431, il clone 2-18C9 ha identificato una banda 170 kd che è coerente con il peso molecolare noto dell'egfr. Il clone 2-18C9 ha inoltre identificato la forma EGFRvIII (145 kd) del recettore nell'analisi immunoistochimica, nella citometria di flusso e nel Western blotting delle linee cellulari EGFRvIII transfettate. Negli esperimenti di Western blotting, il clone 2-18C9 non ha reagito con i lisati cellulari CAMA-1 positivi per HER2, gli estratti proteici BL-21 E. coli HER3-trasformati e i lisati cellulari CHO-HER4 transfettati. Inoltre, transfettanti di Chinese Hamster Ovary (CHO) che esprimevano myc (tag vettore), sia da solo sia coespresso con uno dei membri della famiglia HER. sono stati sottoposti a coltura su vetrini in camera fissati in formalina e inclusi in paraffina e colorati con anti-myc e 2-18C9. L'anticorpo anti-myc ha colorato tutti e cinque i transfettanti CHO, mentre il clone ha colorato solo le cellule CHO transfettate con HER1. Studi clinici Studi clinici Cetuximab Sono stati eseguiti tre studi (EMD , IMCL CP e IMCL CP ) sul farmaco Cetuximab, utilizzato nella cura del carcinoma colorettale. I risultati dei test che hanno espresso I'EGFR ad una colorazione immunoistochimica con Dako sono stati adottati come uno dei criteri per determinare se un campione fosse idoneo o meno a far parte dello studio. In 2 dei 3 studi che comprendevano lo studio pivotal (EMD ), la soglia per i tumori che esprimevano I'EGFR è stata fissata a l + (su un intervallo possibile da O a 3+) per quanto riguarda l'intensità della colorazione positiva all'egfr in > 1 % di tutte le cellule tumorali. È stata selezionata questa soglia perché un'analisi dei sottogruppi applicata a un'intera gamma di soglie differenti relative ai criteri di colorazione della membrana e ad altri criteri di differenziazione non aveva prodotto esiti significativi sul piano della differenziazione dei risultati clinici.
10 Studio pivotal Cetuxirnab Lo studio pivotal (EMD ) ha consentito il reclutamento dei pazienti affetti da tumori per i quali è stata rilevata qualche cellula positiva all'egfr tramite il test Dako EGFR pharmdx. Tutti questi tumori riscontrati nello studio mostravano almeno l'l% di cellule positive all'egfr e tali tumori esprimevano I'EGFR. I pazienti affetti da tumori che esprimevano I'EGFR sono stati curati con solo Cetuximab o con Cetuximab + Irinotecan. Sono stati analizzati 577 campioni di tumori. 474 dei 577 campioni di carcinoma colorettale analizzati (82 %, 95 % CI = 78,l %, 86,l %)esprimevano I'EGFR. 329 pazienti positivi all'egfr pharmdx sono risultati idonei alla randomizzazione 2:l nei due filoni dello studio pivotal sul farmaco. In questo studio, i pazienti trattati con Cetuximab + Irinotecan hanno ottenuto una percentuale di risposta pari a 50 su 21 8 (22,9 %, 95 % CI = 17,5 %, 29,l %). I pazienti trattati con solo Cetuximab hanno ottenuto una percentuale di risposta pari a 12 su 11 1 (10,8 %, 95 % CI = 5,7 %, 18,l %). Il Cetuximab è stato somministrato solo ai pazienti affetti da tumori che esprimevano I'EGFR Dako, come sopra descritto. La percentuale di risposta relativa ai tumori che non esprimevano I'EGFR non è nota, pertanto non può essere utilizzata per un eventuale confronto. Non c'è correlazione tra il grado di risposta del tumore e la percentuale di cellule positive all'egfr o l'intensità della colorazione EGFR (vedere Tabella 3). Tabella 3. Percentuali di risposta nello studio pivotal sul Cetuximab (EMD ) EGFR pharmdx + (21 %) EGFR pharmdx - Numero totale di pazienti analizzati 474' 103 Percentuale di risposta* dei casi trattati con Cetuximab + Irinotecan (22,9 %, 95 % CI = 17,5 %, 29,l %) Nessuno Percentuale di risposta' dei casi trattati con Cetuximab solo (10,8 %, 95 % CI = 5,7 %, 18,l %) Nessuno '329 pazienti positivi erano idonei alla randomizzazione 2:l nei due filoni dello studio pivotal sul farmaco # La percentuale di risposta si riferisce al numero di pazienti che, rispetto all'intera popolazione esaminata nello studio, ha conseguito una riduzione 2 50 % per quanto riguarda la somma del diametro perpendicolare di tutto il tumore misurabile (in altre parole, una riduzione della superficie del tumore pari almeno al 50 %), riduzione che è perdurata per almeno 28 giorni. Studi di supporto Cetuximab Il dosaggio EGFR pharmdx ha permesso di selezionare i pazienti ritenuti idonei a partecipare allo studio pivotal (EMD ) e ad uno studio di supporto (IMCL CP ) durante lo sviluppo del Cetuximab. Nello studio IMCL CP sono stati analizzati 140 campioni. Di questi, 105 campioni su 140 (75 %, 95 % CI = 66,9 %, 83,l %) presentavano tumori che esprimevano I'EGFR. Su 61 pazienti ammessi allo studio, solo 57 sono stati sottoposti alla terapia con Cetuximab. In un ulteriore studio di supporto (IMCL CP ), per la selezione dei pazienti è stato utilizzato un prototipo del kit EGFR pharmdx (costituito dallo stesso anticorpo primario e dallo stesso sistema di rivelazione descritti in precedenza). In totale sono stati analizzati 412 campioni provenienti da 401 pazienti. 292 pazienti su 401 (72,8 %, 95 % CI = 68,O %, 77.6 %) sono risultati positivi al test. Su 139 pazienti ammessi allo studio, 138 sono stati sottoposti alla terapia con Cetuximab + Irinotecan. Tabella 4. Riepilogo della percentuale che esprime I'EGFR nei pazienti affetti da tumore del colon ID studio Studio pivotal EMD Studio di supporto IMCL CP Studio con prototipo EGFR IMCL CP Rapporto che esprime I'EGR (n. che esprimeln. analizzati) O % che esprime I'EGFR 82,l % 75,O % 72,8 % Intervalli di confidenza 95 % 78,l - 86,l % 66, % 68,O % Studi clinici Panitumumab I dati sull'efficacia che supportano l'utilizzo del Panitumumab nella terapia dei pazienti affetti da tumore colorettale metastatico refrattario (mcrc) sono stati forniti da studi su pazienti i cui tumori risultavano positivi all'espressione di EGFR, come valutato dal saggio Dako EGFR pharmdxtm. Studio controllato randomizzato Panitumumab Questo studio multicentrico comparativo del Panitumumab, randomizzato, open-label ( , studio companion di estensione ) unito alla migliore terapia di supporto (BSC) in contrapposizione con la BSC da sola, ha arruolato pazienti affetti da mcrc che non sono riusciti a seguire i programmi di chemioterapia contenente oxaliplatina e irinotecan e i cui tumori esprimevano una colorazione EGFR della membrana in 2 1% delle cellule tumorali valutate. In entrambi i gruppi di terapia, la percentuale media delle cellule tumorali con colorazione EGFR positiva della membrana era 20% (intervallo: dall'l% al 100%). Nello studio è stato osservato un miglioramento statisticamente significativo nel punto finale primario della soprawivenza libera da progressione (PFS) per il Panitumumab associato al gruppo BSC confrontato con il gruppo di BSC da sola (p 0,0001, test log-rank stratificato). In questo studio controllato randomizzato, la percentuale di risposta era de11'8.3% (191229, 95% CI: 5,1%, 12,6%) e definita come risposta completa o parziale (criteri RECIST modificati), con una durata confermata di almeno 4 settimane. La percentuale di risposta corrispondente nei 174 pazienti che sono passati dalla BSC al Panitumumab nello studio companion di estensione era 9,8% (171174, 95% CI: 5,8%,15,2%). Non esisteva alcuna correlazione tra gli effetti della terapia su PFS e la percentuale di colorazione EGFR della membrana tumorale o di intensità di colorazione EGFR. (Vedere la Tabella 5 sotto riportata).
11 Tabella 5: Effetti della terapia su sopravvivenza libera da progressione con colorazione EGFR C Intervallo di confidenza N. pazienti1 95% per rapporto Studio eventi Rapporto pericolo a pericolo valore p Completamente randomiuato 463 l (0,44, 0,66) <0,0001 % di colorazione EGFR della membrana b 1-40% ,46 (0,30, 0,71) 0, % ,55 (0,40, 0,76) 0,0004 >35% (0,40, 0,78) 0,0007 Intensità massima della colorazione EGFR della membrana c ,61 (0,41, 0,90) 0, l 206 0,49 (0,37, 0,65) <0, l 80 0,61 (0,39, 0,97) 0,0379 I rapporti di pericolo per Panitumumab più la BSC rispetto alla BSC da sola sono stati valutati da un modello di Cox relativo ai pericoli proporzionali, regolato per il punteggio prestazionale ECOG e la regione geografica. Un valore < 1,O indica una percentuale media di evento inferiore e un tempo maggiore per l'evento per Panitumumab più BSC rispetto alla BSC da sola. esclusi 3 pazienti i cui tumori esprimevano una colorazione EGFR della membrana < 1 % (violazioni del protocollo) esclusi 2 pazienti i cui tumori esprimevano una colorazione EGFR della membrana < 1 % e una colorazione EGFR della membrana a intensità massima < l + (violazioni del protocollo) Tabella 6: Riepilogo della percentuale di espressione di EGFR nei pazienti affetti da tumore del colon ID studio Studio pivotal Rapporto espressione EGFR (n. con espressioneln. testati) "/o espressione EGFR 73,2% Intervalli di confidenza 95% 70,4-75,9% Riproducibilità Riproducibilita tra serie La riproducibilità tra serie è stata analizzata con una metodologia manuale presso due laboratori, in ognuno dei quali due tecnici hanno lavorato per 3 giorni su 5 campioni diversi (4 positivi, 1 negativo in ogni laboratorio), con valori di intensità della colorazione diversi, randomizzati e mascherati. La riproducibilità dei risultati positivi all'egfr rispetto a quelli negativi all'egfr è stata ottima (100 %): O rispetto a 1 +, 2+ e 3+. Per quanto concerne l'intensità della colorazione, è stata registrata una variazione di l + in due dei campioni positivi e di 2+ in uno dei campioni (in uno dei test, gran parte dell'elemento di tessuto positivo era stata lavata via dal vetrino). I due campioni negativi si sono confermati negativi. Riproducibilita della colorazione tra laboratori La riproducibilità tra laboratori è stata analizzata presso tre laboratori geograficamente distinti, con 30 campioni randomizzati e mascherati caratterizzati da valori di intensità della colorazione IHC diversi. I vetrini appena tagliati sono stati inviati a tutti i laboratori scelti per il test, affinché venissero sottoposti a colorazione manuale e automatizzata e valutati da un patologo. La percentuale di concordanza tra i laboratori è risultata del 100 % per una determinazione dicotoma positivalnegativa, dove O corrispondeva a un valore negativo, mentre l+, 2+ e 3+ corrispondevano a valori positivi relativamente all'espressione della proteina EGFR nelle procedure di analisi sia manuali sia automatiche. Immunoreattivita La Tabella 7 mostra un quadro riepilogativo dell'immunoreattività delltegfr pharmdx sul gruppo di tessuti normali consigliato. Tutti i tessuti erano stati fissati in formalina e inclusi in paraffina.
12 Tabella 7. Valutazione della colorazione del tessuto normale con EGFR pharmdx' Tipo di tessuto (campioni testati) Surrene (2) Midollo osseo (3) Mammella (2) Cervelletto, cerebellum (3) Cervello. cerebrum (3) Cervice (3) Colon (3) Esofago (2) Cuore (3) Rene (3) Fegato (3) Polmone (3) Cellule mesoteliali (3) Ovaio (3) Pancreas (3) Paratiroide (1 ) Nervo periferico (3) Colorazione positiva all'egfr dell'elemento tissutale e pattern di colorazione Cellule corticali (2+): citoplasma Cellule epiteliali lobulari (2+): membrana e citoplasma Strato molecolare (1 +): extracellulare Cellule dell'epitelio squamoso basale (2+): membrana " Cellule dell'epitelio squamoso basale (2+): membrana Tubuli (l+): colorazione cito~lasmatica (aranulare) Epatociti (sinusoidi) (3+); Dotti biliari (3+): membrana e citoplasma Cellule del rivestimento alveolarelcellule bronchiali basali (cellule mioepiteliali) (2+): membrana e citoplasma Cellule mesoteliali (2+): membrana e citoplasma Dotti (2+): membrana I~ofisi (3) Prostata (3) Ghiandola salivare (3) Muscolo scheletrico (3) Cute (3) Intestino tenue (3) Milza (3) Stomaco (3) Testicolo (3) Timo (3) Tiroide (3) Tonsilla (3) Utero (3) Processi cellulari nervosi (l+): fibroso Cellule dell'e~itelio ahiandolare (2+): membrana Elementi duttali (1 +): citoplasma Cellule sauamose. strutture deali annessi (2+): membrana e cito~lasma Epitelio squamoso (3+): membrana e citoplasma Epitelio delle ghiandole endometriali (2+): membrana e citoplasma Cellule stromali endometriali (2+): membrana e citoplasma Miometrio: nessuna 'La maggior parte dei tessuti analizzati ha prodotto una colorazione dei tibroblasti nel tessuto stromale (1 +, fibroso) nonché delle cellule perinevrali e mioepiteliali. In alcuni casi è stata osservata una colorazione endogena degli eosinofili indotta dalla perossidasi. "È stata osservata una irnmunocolorazione variabile dell'epitelio del colon normale.
DRUGFIT LEV1 LEV2 LEV3 REF KCQDRAB1 - KCQDRAB2 - KCQDRAB3
 DRUGFIT LEV1 LEV2 LEV3 REF KCQDRAB1 - KCQDRAB2 - KCQDRAB3 Per Uso Diagnostico In Vitro APPLICAZIONE D USO: Il DRUGFIT è destinato all uso come campione di controllo per monitorare le condizioni di dosaggio
DRUGFIT LEV1 LEV2 LEV3 REF KCQDRAB1 - KCQDRAB2 - KCQDRAB3 Per Uso Diagnostico In Vitro APPLICAZIONE D USO: Il DRUGFIT è destinato all uso come campione di controllo per monitorare le condizioni di dosaggio
HercepTest for Automated Link Platforms
 HercepTest for Automated Link Platforms Codice SK001 22 edizione (129284-001) P04456IT_01_SK00121-2/2016.05 p. 1/41 Sommario Pagina Finalità d uso...3 Cenni introduttivi - Mammella...4 Principio della
HercepTest for Automated Link Platforms Codice SK001 22 edizione (129284-001) P04456IT_01_SK00121-2/2016.05 p. 1/41 Sommario Pagina Finalità d uso...3 Cenni introduttivi - Mammella...4 Principio della
EnVision FLEX Mini Kit, High ph (Dako Omnis)
 EnVision FLEX Mini Kit, High ph (Dako Omnis) Code GV823 2 a edizione Il kit contiene i reagenti sufficienti per 150 test. Per strumenti Dako Omnis. Reagenti facoltativi: Codice Nome prodotto Test GV804
EnVision FLEX Mini Kit, High ph (Dako Omnis) Code GV823 2 a edizione Il kit contiene i reagenti sufficienti per 150 test. Per strumenti Dako Omnis. Reagenti facoltativi: Codice Nome prodotto Test GV804
EnVision FLEX+, Mouse, High ph, (Link)
 EnVision FLEX+, Mouse, High ph, (Link) Codice K8002 5 a edizione Il kit contiene reagenti sufficienti per 400 600 test. Per strumenti Autostainer Link. Reagenti facoltativi Codice Nome prodotto Test K8004
EnVision FLEX+, Mouse, High ph, (Link) Codice K8002 5 a edizione Il kit contiene reagenti sufficienti per 400 600 test. Per strumenti Autostainer Link. Reagenti facoltativi Codice Nome prodotto Test K8004
TEICOPLANINA QMS Saggio immunologico
 0155948-0 Gen. 2011 TEICOPLANINA QMS Saggio immunologico Prima dell'uso leggere attentamente il foglietto illustrativo del presente sistema quantitativo a microsfere (Quantitative Microsphere System -
0155948-0 Gen. 2011 TEICOPLANINA QMS Saggio immunologico Prima dell'uso leggere attentamente il foglietto illustrativo del presente sistema quantitativo a microsfere (Quantitative Microsphere System -
HercepTest Codice nr. K5204
 HercepTest Codice nr. K5204 21 a edizione Per colorazione immunocitochimica. Il kit contiene i reagenti sufficienti per 35 test (70 vetrini). (129258-001) P04454IT_01_K520421-2/2016.05 p.1/55 Sommario
HercepTest Codice nr. K5204 21 a edizione Per colorazione immunocitochimica. Il kit contiene i reagenti sufficienti per 35 test (70 vetrini). (129258-001) P04454IT_01_K520421-2/2016.05 p.1/55 Sommario
Sistema di rilevazione dei polimeri MultiVision: Polimeri Multivision anti-coniglio/ HRP + anti-topo/ AP
 Sistema di rilevazione dei polimeri MultiVision: Polimeri Multivision anti-coniglio/ HRP + anti-topo/ AP Pag. 1 di 5 USO PREVISTO: Per uso diagnostico in vitro. DISPONIBILITÀ: Codice catalogo Quantità
Sistema di rilevazione dei polimeri MultiVision: Polimeri Multivision anti-coniglio/ HRP + anti-topo/ AP Pag. 1 di 5 USO PREVISTO: Per uso diagnostico in vitro. DISPONIBILITÀ: Codice catalogo Quantità
diagnosi di GIST, né dovrebbe precludere il trattamento con Gleevec/Glivec.
 c-kit pharmdx Codice K1907 35 test per il sistema Dako Autostainer Uso previsto Per uso diagnostico in vitro. Il saggio c-kit pharmdx è un kit di analisi immunoistochimica (IHC) qualitativa che consente
c-kit pharmdx Codice K1907 35 test per il sistema Dako Autostainer Uso previsto Per uso diagnostico in vitro. Il saggio c-kit pharmdx è un kit di analisi immunoistochimica (IHC) qualitativa che consente
TEICOPLANINA QMS Saggio immunologico
 0155941-0 Gen., 2011 TEICOPLANINA QMS Saggio immunologico Prima dell'uso leggere attentamente il foglietto illustrativo del presente sistema quantitativo a microsfere (Quantitative Microsphere System -
0155941-0 Gen., 2011 TEICOPLANINA QMS Saggio immunologico Prima dell'uso leggere attentamente il foglietto illustrativo del presente sistema quantitativo a microsfere (Quantitative Microsphere System -
EGFR pharmdx. Codice K1494 50 test per il sistema Dako Autostainer Edizione 9/27/2006. Uso previsto Per uso diagnostico In Vitro.
 EGFR pharmdx Codice K1494 50 test per il sistema Dako Autostainer Edizione 9/27/2006 Uso previsto Per uso diagnostico In Vitro. Il saggio EGFR pharmdx è un sistema di analisi qualitativa immunoistochimica
EGFR pharmdx Codice K1494 50 test per il sistema Dako Autostainer Edizione 9/27/2006 Uso previsto Per uso diagnostico In Vitro. Il saggio EGFR pharmdx è un sistema di analisi qualitativa immunoistochimica
diagnosi di GIST, né dovrebbe precludere il trattamento con Gleevec/Glivec.
 c-kit pharmdx Codice K1906 25 test per uso manuale Uso previsto Per uso diagnostico In Vitro. Il saggio c-kit pharmdx è un kit di analisi immunoistochimica (IHC) qualitativa che consente di identificare
c-kit pharmdx Codice K1906 25 test per uso manuale Uso previsto Per uso diagnostico In Vitro. Il saggio c-kit pharmdx è un kit di analisi immunoistochimica (IHC) qualitativa che consente di identificare
URISTIKFIT LEV1 REF KCQURST1
 URISTIKFIT LEV1 REF KCQURST1 Per Uso Diagnostico In Vitro USO PREVISTO Il controllo URISTIKFIT è destinato all uso nel laboratorio clinico come materiale di controllo nelle procedure qualitative e semiquantitative
URISTIKFIT LEV1 REF KCQURST1 Per Uso Diagnostico In Vitro USO PREVISTO Il controllo URISTIKFIT è destinato all uso nel laboratorio clinico come materiale di controllo nelle procedure qualitative e semiquantitative
Caratteristiche prestazionali
 Caratteristiche prestazionali Kit RNeasy DSP FFPE, Versione 1 73604 Gestione della versione Il presente è il documento Caratteristiche prestazionali del kit RNeasy DSP FFPE, Versione 1, R1. Prima di eseguire
Caratteristiche prestazionali Kit RNeasy DSP FFPE, Versione 1 73604 Gestione della versione Il presente è il documento Caratteristiche prestazionali del kit RNeasy DSP FFPE, Versione 1, R1. Prima di eseguire
ADVANCE TM HRP. Codice K ml Codice K ml Codice K ml Prodotto pronto all'uso. Uso previsto. Per uso diagnostico In Vitro.
 ADVANCE TM HRP Codice K4067 500 ml Codice K4068 110 ml Codice K4069 11 ml Prodotto pronto all'uso Uso previsto Per uso diagnostico In Vitro. Questo sistema è destinato all'uso con anticorpi primari di
ADVANCE TM HRP Codice K4067 500 ml Codice K4068 110 ml Codice K4069 11 ml Prodotto pronto all'uso Uso previsto Per uso diagnostico In Vitro. Questo sistema è destinato all'uso con anticorpi primari di
Monoclonal Rabbit Anti-Human Cytokeratin 8/18 Clone EP17/EP30. Codice M3652. Uso previsto
 Monoclonal Rabbit Anti-Human Cytokeratin 8/18 Clone EP17/EP30 Codice M3652 Uso previsto Per uso diagnostico in vitro. Monoclonal Rabbit Anti-Human Cytokeratin 8/18, Clone EP17/EP30, è destinato all'utilizzo
Monoclonal Rabbit Anti-Human Cytokeratin 8/18 Clone EP17/EP30 Codice M3652 Uso previsto Per uso diagnostico in vitro. Monoclonal Rabbit Anti-Human Cytokeratin 8/18, Clone EP17/EP30, è destinato all'utilizzo
IMMUNOISTOCHIMICA ASPETTI BIOCHIMICI
 Università degli Studi di Ferrara Facoltà di Scienze MM.FF.NN. Laurea Triennale in Scienze Biologiche IMMUNOISTOCHIMICA ASPETTI BIOCHIMICI Guastella Giuseppe email giuseppe.guastella@unife.it telefono
Università degli Studi di Ferrara Facoltà di Scienze MM.FF.NN. Laurea Triennale in Scienze Biologiche IMMUNOISTOCHIMICA ASPETTI BIOCHIMICI Guastella Giuseppe email giuseppe.guastella@unife.it telefono
Laura Borghi Anatomia Patologica Azienda ULSS 18 Rovigo
 Laura Borghi Anatomia Patologica Azienda ULSS 18 Rovigo Anatomia Patologica Azienda ULSS 18 Rovigo MARKERS PROGNOSTICI p16 INK4a / Ki67 IN UNA POPOLAZIONE SELEZIONATA HPV DNA-HR POSITIVO: CORRELAZIONE
Laura Borghi Anatomia Patologica Azienda ULSS 18 Rovigo Anatomia Patologica Azienda ULSS 18 Rovigo MARKERS PROGNOSTICI p16 INK4a / Ki67 IN UNA POPOLAZIONE SELEZIONATA HPV DNA-HR POSITIVO: CORRELAZIONE
Le presenti istruzioni si applicano a Dako EnVision+, Peroxidase (Dako EnVision+, HRP).
 Dako EnVision+ System- HRP Labelled Polymer Anti-mouse Codice K4000 115 ml Codice K4001 110 ml Uso previsto Per uso diagnostico in vitro. Le presenti istruzioni si applicano a Dako EnVision+, Peroxidase
Dako EnVision+ System- HRP Labelled Polymer Anti-mouse Codice K4000 115 ml Codice K4001 110 ml Uso previsto Per uso diagnostico in vitro. Le presenti istruzioni si applicano a Dako EnVision+, Peroxidase
TECNICHE IMMUNOISTOCHIMICHE IN PATOLOGIA VETERINARIA: VANTAGGI E LIMITI. Pezzolato Marzia, DVM LAB Istopatologia - IZSTO
 TECNICHE IMMUNOISTOCHIMICHE IN PATOLOGIA VETERINARIA: VANTAGGI E LIMITI Pezzolato Marzia, DVM LAB Istopatologia - IZSTO L immunoistochimica (IHC) serve per individuare un determinato antigene mediante
TECNICHE IMMUNOISTOCHIMICHE IN PATOLOGIA VETERINARIA: VANTAGGI E LIMITI Pezzolato Marzia, DVM LAB Istopatologia - IZSTO L immunoistochimica (IHC) serve per individuare un determinato antigene mediante
PD-L1 IHC 22C3 pharmdx. SK test per l'utilizzo con Autostainer Link 48. Sommario
 PD-L1 IHC 22C3 pharmdx SK006 50 test per l'utilizzo con Autostainer Link 48 Sommario 1. Uso previsto... 2 2. Riepilogo e spiegazione... 2 2.1 NSCLC...2 2.2 Melanoma...2 3. Principio della procedura...
PD-L1 IHC 22C3 pharmdx SK006 50 test per l'utilizzo con Autostainer Link 48 Sommario 1. Uso previsto... 2 2. Riepilogo e spiegazione... 2 2.1 NSCLC...2 2.2 Melanoma...2 3. Principio della procedura...
Codice K4003: il prodotto seguente è sufficiente per 1100 sezioni di tessuto, sulla base di un utilizzo di 100 µl per sezione:
 Dako EnVision+ System- HRP Labelled Polymer Anti-Rabbit Codice K4002 15 ml Codice K4003 110 ml Uso previsto Per uso diagnostico in vitro. Queste istruzioni sono valide per il sistema Dako EnVision +, Peroxidase
Dako EnVision+ System- HRP Labelled Polymer Anti-Rabbit Codice K4002 15 ml Codice K4003 110 ml Uso previsto Per uso diagnostico in vitro. Queste istruzioni sono valide per il sistema Dako EnVision +, Peroxidase
Codice K4006 nel kit sono inclusi i seguenti materiali, sufficienti per 150 sezioni di tessuto, in base a un utilizzo di 100 µl per sezione:
 Dako EnVision+ System-HRP (DAB) For Use With Mouse Primary Antibodies Codice K4006 15 ml Codice K4007 110 ml Uso previsto Per uso diagnostico in vitro. Queste istruzioni sono valide per il sistema Dako
Dako EnVision+ System-HRP (DAB) For Use With Mouse Primary Antibodies Codice K4006 15 ml Codice K4007 110 ml Uso previsto Per uso diagnostico in vitro. Queste istruzioni sono valide per il sistema Dako
Heat Shock Protein 27 (G3.1)
 Identificazione Prodotto N Catalogo Descrizione 46946 HSP27 0,1 M (G3.1) 46947 HSP27 1 M (G3.1) 46945 HSP27 RTU M (G3.1) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Identificazione Prodotto N Catalogo Descrizione 46946 HSP27 0,1 M (G3.1) 46947 HSP27 1 M (G3.1) 46945 HSP27 RTU M (G3.1) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Streptavidina coniugata con perossidasi di rafano in PBS contenente una proteina stabilizzante e agenti antibatterici.
 Dako LSAB2 System-HRP Codice K0672 15 ml Codice K0673 15 ml Codice K0675 110 ml Uso previsto Per uso diagnostico In Vitro. Queste istruzioni si applicano al sistema universale Dako Labelled Streptavidin-Biotin2
Dako LSAB2 System-HRP Codice K0672 15 ml Codice K0673 15 ml Codice K0675 110 ml Uso previsto Per uso diagnostico In Vitro. Queste istruzioni si applicano al sistema universale Dako Labelled Streptavidin-Biotin2
Soluzione tamponata contenente perossido di idrogeno, detergente e sodio azide 0,015 mol/l.
 PD-L1 IHC 22C3 pharmdx SK006 50 test per l'utilizzo con Autostainer Link 48 Uso previsto Per uso diagnostico in vitro. PD-L1 IHC 22C3 pharmdx è un saggio immunoistochimico qualitativo che utilizza Monoclonal
PD-L1 IHC 22C3 pharmdx SK006 50 test per l'utilizzo con Autostainer Link 48 Uso previsto Per uso diagnostico in vitro. PD-L1 IHC 22C3 pharmdx è un saggio immunoistochimico qualitativo che utilizza Monoclonal
Monoclonal Mouse Anti-Human PD-L1 Clone 22C3. Codice M3653. Uso previsto
 Monoclonal Mouse Anti-Human PD-L1 Clone 22C3 Codice M3653 Uso previsto Sinonimo dell'antigene Riepilogo e spiegazione Per uso diagnostico in vitro. Monoclonal Mouse Anti-Human PD-L1, Clone 22C3, è destinato
Monoclonal Mouse Anti-Human PD-L1 Clone 22C3 Codice M3653 Uso previsto Sinonimo dell'antigene Riepilogo e spiegazione Per uso diagnostico in vitro. Monoclonal Mouse Anti-Human PD-L1, Clone 22C3, è destinato
PD-L1 IHC 28-8 pharmdx. SK test per l'utilizzo con Autostainer Link 48. Uso previsto Per uso diagnostico in vitro.
 PD-L1 IHC 28-8 pharmdx SK005 50 test per l'utilizzo con Autostainer Link 48 Uso previsto Per uso diagnostico in vitro. PD-L1 IHC 28-8 pharmdx è un saggio immunoistochimico qualitativo che utilizza Monoclonal
PD-L1 IHC 28-8 pharmdx SK005 50 test per l'utilizzo con Autostainer Link 48 Uso previsto Per uso diagnostico in vitro. PD-L1 IHC 28-8 pharmdx è un saggio immunoistochimico qualitativo che utilizza Monoclonal
EnVision G 2 Doublestain System, Rabbit/Mouse (DAB+/Permanent Red)
 EnVision G 2 Doublestain System, Rabbit/Mouse (DAB+/Permanent Red) Codice K5361 Seconda edizione Per l uso con anticorpi primari di coniglio e topo. Idoneo per 150 test. (114146-002) K5361/IT/SGA/13.10.06
EnVision G 2 Doublestain System, Rabbit/Mouse (DAB+/Permanent Red) Codice K5361 Seconda edizione Per l uso con anticorpi primari di coniglio e topo. Idoneo per 150 test. (114146-002) K5361/IT/SGA/13.10.06
LOCALIZZAZIONE in situ DI PROTEINE IN CELLULE E TESSUTI
 LOCALIZZAZIONE in situ DI PROTEINE IN CELLULE E TESSUTI 1 Che cosa sono le proteine? Indispensabili per il corretto funzionamento 2 Dove si trovano le proteine? Le proteine sono macromolecole ubiquitarie,
LOCALIZZAZIONE in situ DI PROTEINE IN CELLULE E TESSUTI 1 Che cosa sono le proteine? Indispensabili per il corretto funzionamento 2 Dove si trovano le proteine? Le proteine sono macromolecole ubiquitarie,
Progensa PCA3 Urine Specimen Transport Kit
 Istruzioni per i medici Progensa PCA3 Urine Specimen Transport Kit Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
Istruzioni per i medici Progensa PCA3 Urine Specimen Transport Kit Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
A-1-Antichymotrypsin (Polyclonal)
 Identificazione Prodotto N Catalogo Descrizione 44421 Alpha-1-Antichymotrypsin 0,1 R (Poly) 44422 Alpha-1-Antichymotrypsin 1 R (Poly) 44197 Alpha-1-Antichymotrypsin RTU R (Poly) Definizione Dei Simboli
Identificazione Prodotto N Catalogo Descrizione 44421 Alpha-1-Antichymotrypsin 0,1 R (Poly) 44422 Alpha-1-Antichymotrypsin 1 R (Poly) 44197 Alpha-1-Antichymotrypsin RTU R (Poly) Definizione Dei Simboli
Cytokeratin Cocktail (AE1 & AE3)
 Identificazione Prodotto N Catalogo Descrizione 44575 Cytokeratin Cocktail 0,1 M (AE1&AE3) 44576 Cytokeratin Cocktail 1 M (AE1&AE3) 44277 Cytokeratin Cocktail RTU M (AE1&AE3) Definizione Dei Simboli P
Identificazione Prodotto N Catalogo Descrizione 44575 Cytokeratin Cocktail 0,1 M (AE1&AE3) 44576 Cytokeratin Cocktail 1 M (AE1&AE3) 44277 Cytokeratin Cocktail RTU M (AE1&AE3) Definizione Dei Simboli P
INGEZIM Gluten Quanti Test Guida all utilizzo
 INGEZIM Gluten Quanti Test Guida all utilizzo 1 - INTRODUZIONE Il kit è basato su un saggio immunoenzimatico ELISA di tipo sandwich come dettato dal Codex Alimentarius. Ogni pozzetto è rivestito sul fondo
INGEZIM Gluten Quanti Test Guida all utilizzo 1 - INTRODUZIONE Il kit è basato su un saggio immunoenzimatico ELISA di tipo sandwich come dettato dal Codex Alimentarius. Ogni pozzetto è rivestito sul fondo
IMMUFIT LEV1 REF KCQIMMU1
 IMMUFIT LEV1 REF KCQIMMU1 Per Uso Diagnostico In Vitro APPLICAZIONE D USO: Questo prodotto è inteso per l uso diagnostico in vitro come controllo di qualità dell accuratezza degli immunodosaggi sui sistemi
IMMUFIT LEV1 REF KCQIMMU1 Per Uso Diagnostico In Vitro APPLICAZIONE D USO: Questo prodotto è inteso per l uso diagnostico in vitro come controllo di qualità dell accuratezza degli immunodosaggi sui sistemi
I prodotti prediluiti sono diluiti in modo ottimale per l uso con un ampia varietà di kit di rivelazione offerti da altri produttori.
 Identificazione Prodotto N Catalogo Descrizione 44819 TSH 0,1 R (Poly) 44820 TSH 1 R (Poly) 44400 TSH RTU R (Poly) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
Identificazione Prodotto N Catalogo Descrizione 44819 TSH 0,1 R (Poly) 44820 TSH 1 R (Poly) 44400 TSH RTU R (Poly) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
c-myc (EP121) Rabbit Monoclonal Antibody Identificazione Prodotto Definizione Dei Simboli Finalità D Uso Principi E Procedure Sommario E Spiegazione
 Identificazione Prodotto N Catalogo Descrizione 46928 c-myc 0,1 R (EP121) 46929 c-myc 1 R (EP121) 46927 c-myc RTU R (EP121) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 46928 c-myc 0,1 R (EP121) 46929 c-myc 1 R (EP121) 46927 c-myc RTU R (EP121) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Tecnica di preparazione di vetrini istologici. By A. Pirola
 Tecnica di preparazione di vetrini istologici By A. Pirola Preparazione del materiale istologico Problema 1 I tessuti vanno incontro a fenomeni di degradazione Problema 2 La luce può attraversare solo
Tecnica di preparazione di vetrini istologici By A. Pirola Preparazione del materiale istologico Problema 1 I tessuti vanno incontro a fenomeni di degradazione Problema 2 La luce può attraversare solo
ZytoDot SPEC HER2 Probe
 ZytoDot SPEC HER2 Probe C-3001-400 C-3001-100 40 (0.4 ml) 10 (0.1 ml) Per la rilevazione del gene umano HER2 mediante ibridazione in situ cromogenica (CISH).... Dispositivo per uso diagnostico in vitro
ZytoDot SPEC HER2 Probe C-3001-400 C-3001-100 40 (0.4 ml) 10 (0.1 ml) Per la rilevazione del gene umano HER2 mediante ibridazione in situ cromogenica (CISH).... Dispositivo per uso diagnostico in vitro
Anticorpo di topo monoclonale pronto all'uso, fornito in forma liquida in un tampone contenente la proteina stabilizzante e 0,015 mol/l NaN 3.
 FLEX Monoclonal Mouse Anti-Human Progesterone Receptor Ready-to-Use (Link) Codice IR068 Uso previsto Sinonimo dell'antigene Cenni introduttivi Reagente fornito Per uso diagnostico in vitro. FLEX Monoclonal
FLEX Monoclonal Mouse Anti-Human Progesterone Receptor Ready-to-Use (Link) Codice IR068 Uso previsto Sinonimo dell'antigene Cenni introduttivi Reagente fornito Per uso diagnostico in vitro. FLEX Monoclonal
Immunologia e Immunologia Diagnostica TECNICHE IMMUNOLOGICHE
 Immunologia e Immunologia Diagnostica TECNICHE IMMUNOLOGICHE Tecniche di laboratorio La maggior parte delle tecniche di laboratorio biomedico si basano sull utilizzo degli anticorpi. Gli anticorpi sono
Immunologia e Immunologia Diagnostica TECNICHE IMMUNOLOGICHE Tecniche di laboratorio La maggior parte delle tecniche di laboratorio biomedico si basano sull utilizzo degli anticorpi. Gli anticorpi sono
WITNESS GIARDIA INTRODUZIONE
 WITNESS GIARDIA WITNESS GIARDIA INTRODUZIONE Giardia intestinalis (sin. G. duodenalis o G. lamblia) è un protozoo parassita dell apparato gastrointestinale di numerose specie di animali (ad es. cane e
WITNESS GIARDIA WITNESS GIARDIA INTRODUZIONE Giardia intestinalis (sin. G. duodenalis o G. lamblia) è un protozoo parassita dell apparato gastrointestinale di numerose specie di animali (ad es. cane e
Cytokeratin 5 + Cytokeratin 14 (EP1601Y + LL002)
 Cytokeratin 5 + Cytokeratin 14 (EP1601Y Identificazione Prodotto N Catalogo Descrizione 45693 IMPATH CK5 + CK14 RTU M (EP1601Y & LL002) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero
Cytokeratin 5 + Cytokeratin 14 (EP1601Y Identificazione Prodotto N Catalogo Descrizione 45693 IMPATH CK5 + CK14 RTU M (EP1601Y & LL002) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44674 Lambda Light Chain 0,1 M (Lamb14) 44675 Lambda Light Chain 1 M (Lamb14) 44326 Lambda Light Chain RTU M (Lamb14) Definizione Dei Simboli P C A E S DIL
Identificazione Prodotto N Catalogo Descrizione 44674 Lambda Light Chain 0,1 M (Lamb14) 44675 Lambda Light Chain 1 M (Lamb14) 44326 Lambda Light Chain RTU M (Lamb14) Definizione Dei Simboli P C A E S DIL
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44827 Tryptase 0,1 M (G3) 44828 Tryptase 1 M (G3) 44404 Tryptase RTU M (G3) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 44827 Tryptase 0,1 M (G3) 44828 Tryptase 1 M (G3) 44404 Tryptase RTU M (G3) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Tessuto di controllo: sezione di arteria, appendice ed epidermide.
 Artisan Elastic Stain Kit Codice AR163 Uso previsto Per uso diagnostico in vitro. Il kit Elastic Stain Kit è destinato all'uso di laboratorio per l'identificazione con microscopia ottica di fibre ossitalane,
Artisan Elastic Stain Kit Codice AR163 Uso previsto Per uso diagnostico in vitro. Il kit Elastic Stain Kit è destinato all'uso di laboratorio per l'identificazione con microscopia ottica di fibre ossitalane,
Histology FISH Accessory Kit Codice K5799
 Histology FISH Accessory Kit Codice K5799 6 a edizione Per l ibridazione in situ con sonde fluorescenti (FISH) su sezioni di tessuto fissate in formalina e incluse in paraffina. Il kit contiene i reagenti
Histology FISH Accessory Kit Codice K5799 6 a edizione Per l ibridazione in situ con sonde fluorescenti (FISH) su sezioni di tessuto fissate in formalina e incluse in paraffina. Il kit contiene i reagenti
SAFE - Scuola di Scienze Agrarie, Forestali, Alimentari ed Ambientali. School of Agriculture, forest, Food and Environmental sciences
 Protocollo SAFE Determinazione dell attività antiossidante Valutazione della resistenza allo stress ossidativo in presenza di perossido d idrogeno Soluzione di perossido d idrogeno 1,6 M. Esporre i campioni
Protocollo SAFE Determinazione dell attività antiossidante Valutazione della resistenza allo stress ossidativo in presenza di perossido d idrogeno Soluzione di perossido d idrogeno 1,6 M. Esporre i campioni
ScanGel ScanSol ml ml
 ScanGel ScanSol 86448 100 ml 86449 500 ml MEZZO DI SOSPENSIONE DEI GLOBULI ROSSI IVD Tutti i prodotti fabbricati e commercializzati dalla società Bio-Rad sono sottoposti a un sistema di assicurazione qualità
ScanGel ScanSol 86448 100 ml 86449 500 ml MEZZO DI SOSPENSIONE DEI GLOBULI ROSSI IVD Tutti i prodotti fabbricati e commercializzati dalla società Bio-Rad sono sottoposti a un sistema di assicurazione qualità
ISTRUZIONI D USO IVD 0123 HLA CLASSE II REF 7029: HISTO TRAY DR 72 (10)
 ISTRUZIONI D USO IVD 0123 HISTO TRAY HLA CLASSE II PER USO DIAGNOSTICO IN VITRO REF 7029: HISTO TRAY DR 72 (10) 10 piastre Descrizione del prodotto La destinazione d uso dell HISTO TRAY è la tipizzazione
ISTRUZIONI D USO IVD 0123 HISTO TRAY HLA CLASSE II PER USO DIAGNOSTICO IN VITRO REF 7029: HISTO TRAY DR 72 (10) 10 piastre Descrizione del prodotto La destinazione d uso dell HISTO TRAY è la tipizzazione
15 Anti-D policlonale / incompleto
 Scheda Tecnica 0123 Technical File No.: Prodotto: 15 Anti-D policlonale / incompleto Categoria di prodotto secondo la classificazione CE: Allegato II Lista A Struttura della scheda tecnica Descrizione
Scheda Tecnica 0123 Technical File No.: Prodotto: 15 Anti-D policlonale / incompleto Categoria di prodotto secondo la classificazione CE: Allegato II Lista A Struttura della scheda tecnica Descrizione
Myelin Basic Protein (Polyclonal)
 Identificazione Prodotto N Catalogo Descrizione 45236 IMPATH Myelin Basic Protein RTU R (Poly) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito
Identificazione Prodotto N Catalogo Descrizione 45236 IMPATH Myelin Basic Protein RTU R (Poly) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito
la dimostrazione dei linfomi di tipo B è possibile con studi di riarrangiamento genico clonale. Principi E Procedure
 Identificazione Prodotto N Catalogo Descrizione 44660 IgM 0,1 R (Poly) 44661 IgM 1 R (Poly) 44319 IgM RTU R (Poly) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
Identificazione Prodotto N Catalogo Descrizione 44660 IgM 0,1 R (Poly) 44661 IgM 1 R (Poly) 44319 IgM RTU R (Poly) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44586 EMA 0,1 M (E29) 44587 EMA 1 M (E29) 44282 EMA RTU M (E29) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
Identificazione Prodotto N Catalogo Descrizione 44586 EMA 0,1 M (E29) 44587 EMA 1 M (E29) 44282 EMA RTU M (E29) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44435 BCL2 0,1 R (E17) 44436 BCL2 1 R (E17) 44205 BCL2 RTU R (E17) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
Identificazione Prodotto N Catalogo Descrizione 44435 BCL2 0,1 R (E17) 44436 BCL2 1 R (E17) 44205 BCL2 RTU R (E17) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
Lo scopo delle tecniche di colorazione immunoistochimica (IHC) è quello di consentire la visualizzazione degli antigeni tissutali (cellulari).
 Dako LSAB 2 System-AP Codice K0674 110 ml Codice K0676 15 ml Uso previsto Per uso diagnostico in vitro. Queste istruzioni si riferiscono a Universal Dako LSAB 2 System, Alkaline Phosphatase (LSAB2 System,
Dako LSAB 2 System-AP Codice K0674 110 ml Codice K0676 15 ml Uso previsto Per uso diagnostico in vitro. Queste istruzioni si riferiscono a Universal Dako LSAB 2 System, Alkaline Phosphatase (LSAB2 System,
Adenovirus (20/11 & 2/6)
 Identificazione Prodotto N Catalogo Descrizione 45606 Adenovirus 0,1 M (20/11 & 2/6) 45607 Adenovirus 1 M (20/11 & 2/6) 45631 Adenovirus RTU M (20/11 & 2/6) Definizione Dei Simboli P C A E S DIL DOC# DIS
Identificazione Prodotto N Catalogo Descrizione 45606 Adenovirus 0,1 M (20/11 & 2/6) 45607 Adenovirus 1 M (20/11 & 2/6) 45631 Adenovirus RTU M (20/11 & 2/6) Definizione Dei Simboli P C A E S DIL DOC# DIS
COLORAZIONE DELLE SEZIONI ISTOLOGICHE PER L OSSERVAZIONE OTTICA. COLORAZIONI TOPOGRAFICHE o ISTOMORFOLOGICHE COLORAZIONI IMMUNOISTOCHIMICHE
 COLORAZIONE DELLE SEZIONI ISTOLOGICHE PER L OSSERVAZIONE OTTICA Poiché la densità ottica delle diverse parti del campione biologico è pressoché identica, la colorazione interviene per aumentare il contrasto.
COLORAZIONE DELLE SEZIONI ISTOLOGICHE PER L OSSERVAZIONE OTTICA Poiché la densità ottica delle diverse parti del campione biologico è pressoché identica, la colorazione interviene per aumentare il contrasto.
I prodotti prediluiti sono diluiti in modo ottimale per l uso con un ampia varietà di kit di rivelazione offerti da altri produttori.
 Identificazione Prodotto N Catalogo Descrizione 45264 IMPATH TSH RTU R (Poly) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità D Uso
Identificazione Prodotto N Catalogo Descrizione 45264 IMPATH TSH RTU R (Poly) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità D Uso
Cytokeratin 7 (OV-TL 12/30)
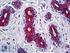 Identificazione Prodotto N Catalogo Descrizione 44565 Cytokeratin 7 0,1 M (OV-TL 12/30) 44566 Cytokeratin 7 1 M (OV-TL 12/30) 44272 Cytokeratin 7 RTU M (OV-TL 12/30) Definizione Dei Simboli P C A E S DIL
Identificazione Prodotto N Catalogo Descrizione 44565 Cytokeratin 7 0,1 M (OV-TL 12/30) 44566 Cytokeratin 7 1 M (OV-TL 12/30) 44272 Cytokeratin 7 RTU M (OV-TL 12/30) Definizione Dei Simboli P C A E S DIL
Aspetti metodologici della Citometria a Flusso: un esperienza pratica
 Aspetti metodologici della Citometria a Flusso: un esperienza pratica Moris Cadei Università degli Studi di Brescia Riccione, 22 Maggio 2009 Biopsie gastriche Nel nostro Servizio Diagnosi istopatologica
Aspetti metodologici della Citometria a Flusso: un esperienza pratica Moris Cadei Università degli Studi di Brescia Riccione, 22 Maggio 2009 Biopsie gastriche Nel nostro Servizio Diagnosi istopatologica
4F81BDSCHEDA TECNICA 4F81BD
 04011Pagina 1 di 5 pagine Codice prodotto: Nome prodotto: Consigliato per: Dimensioni disponibili: 120101 Gori Detergente concentrato rimuove alghe, muschio e strati verdi Tutti i legni per esterni 1 L
04011Pagina 1 di 5 pagine Codice prodotto: Nome prodotto: Consigliato per: Dimensioni disponibili: 120101 Gori Detergente concentrato rimuove alghe, muschio e strati verdi Tutti i legni per esterni 1 L
ZytoLight SPEC BCR/ABL Dual Color Dual Fusion Probe
 ZytoLight SPEC BCR/ABL Dual Color Dual Fusion Probe Z-2111-200 20 (0.2 ml) Per la rilevazione della translocazione t(9;22)(q34;q11)mediante ibridazione in situ fluorescente (FISH).... Dispositivo per uso
ZytoLight SPEC BCR/ABL Dual Color Dual Fusion Probe Z-2111-200 20 (0.2 ml) Per la rilevazione della translocazione t(9;22)(q34;q11)mediante ibridazione in situ fluorescente (FISH).... Dispositivo per uso
QUANTA Chek ANA Panel
 QUANTA Chek ANA Panel 708111 Finalità d uso Il Pannello ANA QUANTA Chek TM è utilizzato per il controllo della qualità delle procedure per la ricerca degli anticorpi antinucleo IFA ed ELISA. Ciascun siero
QUANTA Chek ANA Panel 708111 Finalità d uso Il Pannello ANA QUANTA Chek TM è utilizzato per il controllo della qualità delle procedure per la ricerca degli anticorpi antinucleo IFA ed ELISA. Ciascun siero
Artisan Reticulin-Nuclear Fast Red Stain Kit. Codice AR179. Uso previsto Per uso diagnostico in vitro.
 Artisan Reticulin-Nuclear Fast Red Stain Kit Codice AR179 Uso previsto Per uso diagnostico in vitro. Il Reticulin-Nuclear Fast Red Stain Kit è destinato all uso in laboratorio per l identificazione, al
Artisan Reticulin-Nuclear Fast Red Stain Kit Codice AR179 Uso previsto Per uso diagnostico in vitro. Il Reticulin-Nuclear Fast Red Stain Kit è destinato all uso in laboratorio per l identificazione, al
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44439 Beta-Catenin 0,1 M (14) 44440 Beta-Catenin 1 M (14) 44207 Beta-Catenin RTU M (14) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato
Identificazione Prodotto N Catalogo Descrizione 44439 Beta-Catenin 0,1 M (14) 44440 Beta-Catenin 1 M (14) 44207 Beta-Catenin RTU M (14) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato
Progesterone Receptor (Y85)
 Identificazione Prodotto N Catalogo Descrizione 44771 Progesterone Receptor 0,1 R (Y85) 44772 Progesterone Receptor 1 R (Y85) 44376 Progesterone Receptor RTU R (Y85) Definizione Dei Simboli P C A E S DIL
Identificazione Prodotto N Catalogo Descrizione 44771 Progesterone Receptor 0,1 R (Y85) 44772 Progesterone Receptor 1 R (Y85) 44376 Progesterone Receptor RTU R (Y85) Definizione Dei Simboli P C A E S DIL
04_biochimica. MFN0366-A1 (I. Perroteau) - Tecniche biochimiche-molecolari: Western blot
 1 2 1 - Gel di elettroforesi Trasferimento (blotting) + Membrana per western blot 3 4 2 Anticorpo primario ---> anticorpo secondario coniugato all enzima ---> reazione di biolimunescenza ---> luce che
1 2 1 - Gel di elettroforesi Trasferimento (blotting) + Membrana per western blot 3 4 2 Anticorpo primario ---> anticorpo secondario coniugato all enzima ---> reazione di biolimunescenza ---> luce che
GATA3 (L50-823) Mouse Monoclonal Antibody. Identificazione Prodotto. Definizione Dei Simboli. Principi E Procedure. Finalità D Uso
 Identificazione Prodotto N Catalogo Descrizione 45622 GATA3 0,1 M (L50-823) 45623 GATA3 1 M (L50-823) 45639 GATA3 RTU M (L50-823) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 45622 GATA3 0,1 M (L50-823) 45623 GATA3 1 M (L50-823) 45639 GATA3 RTU M (L50-823) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
metodi poco sensibili, laboriosi, costosi, e indaginosi
 dosaggi ormonali L ANALISI CHIMICA fasi di isolamento, purificazione e concentrazione elaborate non sufficientemente sensibile per il dosaggio di tutti gli ormoni nel sangue metodi poco sensibili, laboriosi,
dosaggi ormonali L ANALISI CHIMICA fasi di isolamento, purificazione e concentrazione elaborate non sufficientemente sensibile per il dosaggio di tutti gli ormoni nel sangue metodi poco sensibili, laboriosi,
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44458 CD10 0,1 M (56C6) 44459 CD10 1 M (56C6) 44217 CD10 RTU M (56C6) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Identificazione Prodotto N Catalogo Descrizione 44458 CD10 0,1 M (56C6) 44459 CD10 1 M (56C6) 44217 CD10 RTU M (56C6) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
HER2 e carcinoma gastrico
 Modulo 1 HER2 e carcinoma gastrico Cosa è HER2 Con l'acronimo HER2 viene identificato uno dei recettori per i fattori epidermici di crescita, codificato dal cromosoma 17; HER2 appartiene alla famiglia
Modulo 1 HER2 e carcinoma gastrico Cosa è HER2 Con l'acronimo HER2 viene identificato uno dei recettori per i fattori epidermici di crescita, codificato dal cromosoma 17; HER2 appartiene alla famiglia
PSA, sebbene con minore specificità. Pertanto, nell appropriato contesto clinico, la PSAP può essere complementare al PSA. Principi E Procedure
 Identificazione Prodotto N Catalogo Descrizione 44777 PSAP 0,1 M (PASE/4LJ) 44778 PSAP 1 M (PASE/4LJ) 44379 PSAP RTU M (PASE/4LJ) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 44777 PSAP 0,1 M (PASE/4LJ) 44778 PSAP 1 M (PASE/4LJ) 44379 PSAP RTU M (PASE/4LJ) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Il cancro del colon retto costituisce il terzo tumore più frequente in ambo i sessi
 Il cancro del colon retto costituisce il terzo tumore più frequente in ambo i sessi Il processo di cancerogenesi consta di più tappe, che prevedono da una parte la perdita di differenziazione delle cellule,
Il cancro del colon retto costituisce il terzo tumore più frequente in ambo i sessi Il processo di cancerogenesi consta di più tappe, che prevedono da una parte la perdita di differenziazione delle cellule,
PROGENSA PCA3 Urine Specimen Transport Kit
 PROGENSA PCA3 Urine Specimen Transport Kit Istruzioni per i medici Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
PROGENSA PCA3 Urine Specimen Transport Kit Istruzioni per i medici Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
Immunologia e Immunologia Diagnostica MATURAZIONE DEI LINFOCITI
 Immunologia e Immunologia Diagnostica MATURAZIONE DEI LINFOCITI Il percorso di maturazione dei linfociti Sviluppo della specicifità immunologica I linfociti B e T avviano le risposte immunitarie dopo il
Immunologia e Immunologia Diagnostica MATURAZIONE DEI LINFOCITI Il percorso di maturazione dei linfociti Sviluppo della specicifità immunologica I linfociti B e T avviano le risposte immunitarie dopo il
Striscia reattiva glicemia ematocrito emoglobina. N. modello: TD-4272 / GD40 DELTA
 Striscia reattiva glicemia ematocrito emoglobina AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori che eseguono
Striscia reattiva glicemia ematocrito emoglobina AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori che eseguono
Ruolo dell anatomo-patologo. Carcinoma del seno: esame morfologico ed immunologico ER/PR ER/PR. Her-2 (C-erbB-2) Her-2
 Ruolo dell anatomo-patologo Carcinoma del seno: esame morfologico ed immunologico L. Mazzucchelli Istituto cantonale di patologia, Locarno Fondazione Oncologia Lago Maggiore, 5 ottobre 2006 Diagnosi preoperatoria
Ruolo dell anatomo-patologo Carcinoma del seno: esame morfologico ed immunologico L. Mazzucchelli Istituto cantonale di patologia, Locarno Fondazione Oncologia Lago Maggiore, 5 ottobre 2006 Diagnosi preoperatoria
RAPPORTO SULLA VALUTAZIONE DELLA CITOTOSSICITÀ DI UN IMPIANTO TITANMED
 RAPPORTO SULLA VALUTAZIONE DELLA CITOTOSSICITÀ DI UN IMPIANTO TITANMED Riferimento: Ns. pratica 3000900357 Valutazioni eseguite da: Dr.ssa Clara CASSINELLI... n. copie distribuite: 1 Testo e immagini sono
RAPPORTO SULLA VALUTAZIONE DELLA CITOTOSSICITÀ DI UN IMPIANTO TITANMED Riferimento: Ns. pratica 3000900357 Valutazioni eseguite da: Dr.ssa Clara CASSINELLI... n. copie distribuite: 1 Testo e immagini sono
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44527 CD79a 0,1 M (JCB117) 44528 CD79a 1 M (JCB117) 44253 CD79a RTU M (JCB117) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 44527 CD79a 0,1 M (JCB117) 44528 CD79a 1 M (JCB117) 44253 CD79a RTU M (JCB117) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Androgen Receptor (SP107)
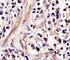 Identificazione Prodotto N Catalogo Descrizione 44425 Androgen Receptor 0,1 M (SP107) 44426 Androgen Receptor 1 M (SP107) 44199 Androgen Receptor RTU M (SP107) Definizione Dei Simboli P C A E S DIL DOC#
Identificazione Prodotto N Catalogo Descrizione 44425 Androgen Receptor 0,1 M (SP107) 44426 Androgen Receptor 1 M (SP107) 44199 Androgen Receptor RTU M (SP107) Definizione Dei Simboli P C A E S DIL DOC#
GATA3 (L50-823) Mouse Monoclonal Antibody. Identificazione Prodotto. Definizione Dei Simboli. Principi E Procedure. Finalità D Uso
 Identificazione Prodotto N Catalogo Descrizione 45652 IMPATH GATA3 RTU M (L50-823) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità
Identificazione Prodotto N Catalogo Descrizione 45652 IMPATH GATA3 RTU M (L50-823) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da Finalità
METODICHE DI IMMUNOCHIMICA
 METODICHE DI IMMUNOCHIMICA IMMUNOCHIMICA permette la determinazione quantitativa di proteine in tessuti e omogenati INTERAZIONI ANTIGENE-ANTICORPO L immunochimica si basa sulle interazioni antigene-anticorpo
METODICHE DI IMMUNOCHIMICA IMMUNOCHIMICA permette la determinazione quantitativa di proteine in tessuti e omogenati INTERAZIONI ANTIGENE-ANTICORPO L immunochimica si basa sulle interazioni antigene-anticorpo
GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA
 GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA Istruzioni Scrivere il proprio nome e cognome su questa pagina e sulla scheda delle risposte. Seguire le regole di sicurezza di laboratorio: se vengono
GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA Istruzioni Scrivere il proprio nome e cognome su questa pagina e sulla scheda delle risposte. Seguire le regole di sicurezza di laboratorio: se vengono
Striscia reattiva per β-chetone ematico
 FOGLIETTO ILLUSTRATIVO Striscia reattiva per β-chetone ematico AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori
FOGLIETTO ILLUSTRATIVO Striscia reattiva per β-chetone ematico AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori
Androgen Receptor (SP107)
 Identificazione Prodotto N Catalogo Descrizione 45164 IMPATH Androgen Receptor RTU M (SP107) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da
Identificazione Prodotto N Catalogo Descrizione 45164 IMPATH Androgen Receptor RTU M (SP107) Definizione Dei Simboli P A E S DOC# DIS pronto uso asciti siero supernatante numero documento distribuito da
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44761 PLAP 0,1 M (NB10) 44762 PLAP 1 M (NB10) 44371 PLAP RTU M (NB10) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Identificazione Prodotto N Catalogo Descrizione 44761 PLAP 0,1 M (NB10) 44762 PLAP 1 M (NB10) 44371 PLAP RTU M (NB10) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
ESAME MORFOLOGICO DEL SANGUE
 ESAME MORFOLOGICO DEL SANGUE Obiettivo Con l esame morfologico del sangue si intende differenziare gli elementi figurati del sangue, tramite la colorazione di May Grunwald-Giemsa, per poterli riconoscere
ESAME MORFOLOGICO DEL SANGUE Obiettivo Con l esame morfologico del sangue si intende differenziare gli elementi figurati del sangue, tramite la colorazione di May Grunwald-Giemsa, per poterli riconoscere
Sicurezza diagnostica. Efficienza del laboratorio.
 Sicurezza diagnostica. Efficienza del laboratorio. Leica Bond Oracle HER2 IHC System per carcinoma della mammella Sicurezza diagnostica Quando la decisione di un trattamento si basa su un vetrino colorato,
Sicurezza diagnostica. Efficienza del laboratorio. Leica Bond Oracle HER2 IHC System per carcinoma della mammella Sicurezza diagnostica Quando la decisione di un trattamento si basa su un vetrino colorato,
Collagen Type IV (CIV22)
 Identificazione Prodotto N Catalogo Descrizione 44543 Collagen Type IV 0,1 M (CIV22) 44544 Collagen Type IV 1 M (CIV22) 44261 Collagen Type IV RTU M (CIV22) Definizione Dei Simboli P C A E S DIL DOC# DIS
Identificazione Prodotto N Catalogo Descrizione 44543 Collagen Type IV 0,1 M (CIV22) 44544 Collagen Type IV 1 M (CIV22) 44261 Collagen Type IV RTU M (CIV22) Definizione Dei Simboli P C A E S DIL DOC# DIS
Allegato III Autocertificazione del produttore
 Scheda Tecnica 0123 Technical File No.: 24 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-Lua, Anti-Lub coombsreactive Allegato III Autocertificazione del produttore Struttura della
Scheda Tecnica 0123 Technical File No.: 24 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-Lua, Anti-Lub coombsreactive Allegato III Autocertificazione del produttore Struttura della
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44837 Vimentin 0,1 M (V9) 44838 Vimentin 1 M (V9) 44409 Vimentin RTU M (V9) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Identificazione Prodotto N Catalogo Descrizione 44837 Vimentin 0,1 M (V9) 44838 Vimentin 1 M (V9) 44409 Vimentin RTU M (V9) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti
Regolamento (CE) n. 1272/2008
 Regolamento (CE) n. 1272/2008 Consigli di prudenza Consigli di prudenza di carattere generale P101 In caso di consultazione di un medico, tenere a disposizione il contenitore o l'etichetta del prodotto.
Regolamento (CE) n. 1272/2008 Consigli di prudenza Consigli di prudenza di carattere generale P101 In caso di consultazione di un medico, tenere a disposizione il contenitore o l'etichetta del prodotto.
MECCANISMI D AZIONE DELLE ESPOSIZIONI AMBIENTALI ED OCCUPAZIONALI A CAMPI MAGNETICI ELF: VALUTAZIONE DELLE HSP IN PBL DI SOGGETTI ESPOSTI
 MECCANISMI D AZIONE DELLE ESPOSIZIONI AMBIENTALI ED OCCUPAZIONALI A CAMPI MAGNETICI ELF: VALUTAZIONE DELLE HSP IN PBL DI SOGGETTI ESPOSTI HEAT SHOCK PROTEINS (HSP70): SONO PROTEINE COINVOLTE NELLA RISPOSTA
MECCANISMI D AZIONE DELLE ESPOSIZIONI AMBIENTALI ED OCCUPAZIONALI A CAMPI MAGNETICI ELF: VALUTAZIONE DELLE HSP IN PBL DI SOGGETTI ESPOSTI HEAT SHOCK PROTEINS (HSP70): SONO PROTEINE COINVOLTE NELLA RISPOSTA
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44726 NSE 0,1 M (MRQ-55) 44727 NSE 1 M (MRQ-55) 44353 NSE RTU M (MRQ-55) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Identificazione Prodotto N Catalogo Descrizione 44726 NSE 0,1 M (MRQ-55) 44727 NSE 1 M (MRQ-55) 44353 NSE RTU M (MRQ-55) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Le seguenti istruzioni sono relative al sistema Dako EnVision+ System- HRP (AEC) (Dako EnVision+ System, HRP).
 Dako EnVision+ System-HRP (AEC) For Use with Mouse Primary Antibodies Codice n. K4004 115 ml Codice n. K4005 110 ml Uso previsto Per uso diagnostico in vitro. Le seguenti istruzioni sono relative al sistema
Dako EnVision+ System-HRP (AEC) For Use with Mouse Primary Antibodies Codice n. K4004 115 ml Codice n. K4005 110 ml Uso previsto Per uso diagnostico in vitro. Le seguenti istruzioni sono relative al sistema
IMPATH HER2 FISH. Identificazione del prodotto Cat. N. Descrizione ImPath HER2 FISH
 Identificazione del prodotto Cat. N. Descrizione 47862 ImPath HER2 FISH Uso previsto ImPath HER2 FISH (cat. n. 47862) è destinato all uso in combinazione con ImPath ISH Detection Kit (cat. n. 44996) per
Identificazione del prodotto Cat. N. Descrizione 47862 ImPath HER2 FISH Uso previsto ImPath HER2 FISH (cat. n. 47862) è destinato all uso in combinazione con ImPath ISH Detection Kit (cat. n. 44996) per
CLOSTRIDIUM DIFFICILE TOSSINE A e B
 MODALITA' DI RICHIESTA: Pazienti interni: tramite modulo interno prestampato. Pazienti esterni: tramite richiesta del medico curante. PREPARAZIONE DEL PAZIENTE ALL'ESAME: Nessuna. MODALITA' DI RACCOLTA
MODALITA' DI RICHIESTA: Pazienti interni: tramite modulo interno prestampato. Pazienti esterni: tramite richiesta del medico curante. PREPARAZIONE DEL PAZIENTE ALL'ESAME: Nessuna. MODALITA' DI RACCOLTA
WITNESS PARVO INTRODUZIONE
 WITNESS PARVO WITNESS PARVO INTRODUZIONE Il Parvovirus canino (CPV) appartiene ad un sottogruppo del parvovirus felino. È in stretto rapporto col virus della panleucopenia felina e col virus dell'enterite
WITNESS PARVO WITNESS PARVO INTRODUZIONE Il Parvovirus canino (CPV) appartiene ad un sottogruppo del parvovirus felino. È in stretto rapporto col virus della panleucopenia felina e col virus dell'enterite
Lavaggio degli eritrociti
 1 Lavaggio degli eritrociti Le attività emolitica ed emoagglutinante del virus Sendai richiedono una soluzione di eritrociti umani lavati in tampone PBS e diluiti al 2% (v/v). Reagenti Sangue umano fresco.
1 Lavaggio degli eritrociti Le attività emolitica ed emoagglutinante del virus Sendai richiedono una soluzione di eritrociti umani lavati in tampone PBS e diluiti al 2% (v/v). Reagenti Sangue umano fresco.
