Promotore: Prof. Alessandro Gringeri Fondazione I.R.C.C.S. Ospedale Maggiore Policlinico "Mangiagalli e Regina Elena" Bonomi" Via Pace, Milano
|
|
|
- Adelina Damiani
- 6 anni fa
- Visualizzazioni
Transcript
1 NOTA INFORMATIVA E CONSENSO INFORMATO PER LA PARTECIPAZIONE ALLO STUDIO RESIST- NAÏVE PER I TITOLARI DELLA POTESTÀ GENITORIALE SU UN MINORE (REScue Immunotolerance STudy in ITI-Naïve patients) Studio randomizzato di induzione della tolleranza immunologica per la prima volta in pazienti con severa emofilia di tipo A con inibitore ad alto rischio di fallimento: comparazione tra l induzione della immunotolleranza con concentrati di Fattore VIII (FVIII) con il Fattore di Von Willebrand (FVW)e quelli senza il fattore di Von Willebrand. Promotore: Prof. Alessandro Gringeri Fondazione I.R.C.C.S. Ospedale Maggiore Policlinico "Mangiagalli e Regina Elena" Centro Emofilia e Trombosi Bonomi" Via Pace, Milano "Angelo Bianchi Sperimentatore principale: Invitiamo Suo figlio a partecipare a una ricerca clinica organizzata, in qualità di Promotore, dal Centro Emofilia Angelo Bianchi Bonomi, Dipartimento di Medicina e Specialità Mediche, IRCCS Fondazione Ospedale Maggiore Policlinico Mangiagalli e Regina Elena, Via Pace, 9 Milano. Prima di decidere di dare il Suo consenso alla partecipazione allo studio di Suo figlio è molto importante che Lei capisca i motivi alla base della ricerca e le implicazioni future. Legga attentamente la seguente nota informativa e chieda informazioni sui punti che non le sono chiari. AMBITO DI INTERESSE DELLO STUDIO Il Suo medico Le propone di far partecipare Suo figlio al presente studio in quanto affetto da emofilia grave di tipo A con inibitore. Questo inibitore impedisce l efficacia dell infusione di fattore VIII (FVIII) rendendo quindi molto difficile il trattamento. La comparsa di questo inibitore è una complicanza seria e potenzialmente gravissima dell emofilia. Deve essere trattata appena possibile per ripristinare una condizione in cui il sistema immunitario accetta nuovamente i trattamenti con concentrati di FVIII. Si tratta della tolleranza immunologica. Sono invitati a partecipare allo studio i pazienti adulti e bambini con inibitori del fattore VIII di Paesi Europei ed Extraeuropei. Lo studio di induzione della tolleranza immunologica (RESIST- Naïve) è organizzato da sperimentatori internazionali come studio satellite dello Studio di tolleranza immunologica internazionale (ITI study). OBIETTIVO DELLO STUDIO Il trattamento convenzionale dei pazienti con inibitori del fattore VIII implica la cosiddetta induzione della tolleranza immunologica. Tolleranza immunologica significa che il sistema immunitario dell organismo accetta e tollera il fattore VIII somministrato in perfusione e che il paziente risponde di nuovo normalmente alle iniezioni di fattore VIII. La tolleranza immunologica si ottiene somministrando forti dosi di fattore VIII a scadenza regolare fino alla scomparsa dell inibitore. Questo trattamento non è sempre efficace e nel 10-20% dei pazienti l inibitore persiste nonostante il trattamento. 1
2 Esistono 2 tipi di concentrati di fattore VIII: i concentrati di fattore VIII di origine plasmatica umana che contengono il fattore Von Willebrand e i concentrati di fattore VIII ricombinante che non contengono quest altro fattore della coagulazione. Queste 2 famiglie di concentrati vengono comunemente utilizzate per le induzioni della tolleranza immunologica nei pazienti affetti da emofilia di tipo A. Si è ipotizzato che i concentrati derivanti dal plasma dei donatori e contenenti il fattore Von Willebrand potrebbero migliorare i risultati di tolleranza immunologica nell organismo. L obiettivo principale del presente studio è verificare, attraverso uno studio scientifico, la veridicità di tale ipotesi, allo scopo di migliorare la cura dei pazienti affetti da emofilia grave di tipo A con un inibitore al momento del trattamento di induzione della tolleranza immunologica. Per questo, i pazienti che partecipano al presente studio saranno suddivisi in 2 gruppi: uno utilizzerà concentrati di fattore VIII plasmatico, l altro concentrati di fattore VIII ricombinante. L assegnazione dei pazienti al tipo di trattamento avviene in modo casuale (assegnazione randomizzata) e centralizzato dopo il reclutamento nello studio. Ai pazienti dei 2 gruppi verranno somministrate le stesse dosi di trattamento e i soggetti verranno sottoposti allo stesso monitoraggio per tutta la durata dello studio. SVOLGIMENTO DELLO STUDIO Il presente studio osserverà l esistenza di una differenza nella capacità di induzione della tolleranza immunologica nei pazienti tra i concentrati di fattore VIII somministrati a una dose elevata (200 unità/kg/die). All interno di ciascun gruppo di trattamento, verranno somministrate diverse specialità commerciali di concentrati di fattore VIII. Sarà il Suo medico, in accordo con Lei, a decidere quella che verrà assegnata a Suo figlio per tutta la durata dello studio. La durata massima del trattamento di induzione della tolleranza immunologica nel presente studio è di 33 mesi. Dopo l ottenimento della tolleranza immunologica, Suo figlio verrà sottoposto a un follow-up nei 12 mesi successivi per monitorare il rischio di ricaduta. Suo figlio sarà seguito dal proprio medico presso il Centro di emofilia 1 volta al mese per tutta la durata dello studio; un campione di sangue (10 ml, circa 2 cucchiaino da te) sarà preso all inizio e alla fine dello studio, e un campione di 3.5 ml ogni mese. Inoltre, un prelievo di 5 ml sarà effettuato una volta durante il periodo di trattamento per i test genetici (per studiare i fattori che potenzialmente possono essere legati alla risposta di terapia di immunotolleranza). Alla scomparsa dell inibitore saranno effettuati esami del sangue più precisi: un test di recupero con un iniezione da 50 unità/kg e dosaggio del fattore VIII sanguigno a 15 e 30 minuti (5 ml ogni prelievo) dopo l iniezione e successivamente, se i risultati sono normali, un test di farmacocinetica con dosaggio del FVIII sanguigno fino a 48 ore (secondo le modalità convenzionali di farmacocinetica, 15 minuti dopo l iniezione e poi dopo 1h, 2h, 4h, 6h, 24h e 48h. Otto prelievi in totale, ovvero 40 ml di sangue). Questi stessi esami verranno ripetuti nell anno di monitoraggio di eventuali ricadute. RISCHI POTENZIALI Per poter effettuare quotidianamente l iniezione di fattore VIII per diversi mesi di seguito per una durata totale che può arrivare fino a 33 mesi, è probabile che il Suo medico le proponga l applicazione di un catetere venoso centrale. Anche l applicazione di questo dispositivo è una procedura abituale e dipende soprattutto dallo stato venoso periferico di Suo figlio. L inserimento di un catetere venoso centrale è una procedura chirurgica realizzata in anestesia generale ed essendo un intervento chirurgico comporta quindi qualche rischio. Il rischio principale è l eventuale infezione, che richiederebbe il trattamento con antibiotici o l asportazione e la conseguente necessità di reinserire un dispositivo nuovo. Infine, rare complicazioni tromboemboliche sono state osservate in pazienti a rischio di trombosi in presenza di alti livelli di fattore VIII nel sangue. Il medico ha stabilito che Suo figlio non è soggetto tale a rischio. TRATTAMENTO ALTERNATIVO L induzione della tolleranza immunologica è il trattamento convenzionale dei pazienti che hanno sviluppato 2
3 un inibitore del fattore VIII. Per il momento non esiste una procedura unica ma lo schema generale per l induzione della tolleranza immunologica e per il relativo follow-up è sempre lo stesso. Lo scopo di altri studi in corso (soprattutto l ITI Study) è quello di valutare se dosi diverse di prodotto e la cadenza delle iniezioni migliorano i risultati in termini di scomparsa dell inibitore. Nel caso in cui decidesse di non far partecipare Suo figlio allo studio, quest ultimo verrà sottoposto a un induzione della tolleranza immunologica nell ambito dei trattamenti abituali. Sia che Suo figlio partecipi o meno allo studio, in caso di emorragia attiva non controllata dal suo trattamento con concentrato di FVIII, verrà trattato con altri fattori di coagulazione aventi un attività bypassante l inibitore del FVIII. POSSIBILI BENEFICI DELLO STUDIO Non è possibile garantirle o prometterle un beneficio diretto derivante dalla partecipazione di Suo figlio al presente studio. Tuttavia Le informazioni che saranno fornite dallo studio consentiranno un progresso nelle modalità di trattamento dei pazienti che in futuro avranno bisogno di una tolleranza immunologica permettendo di sapere se una strategia terapeutica che si basa unicamente sulla famiglia di prodotti utilizzati è migliore dell altra. RAPPORTO RISCHI/BENEFICI Di conseguenza, il rapporto rischi/benefici del presente studio, che consente a Suo figlio di essere sottoposto a un induzione della tolleranza immunologica con i concentrati di FVIII plasmatico o con i concentrati di FVIII ricombinante, non comporta rischi particolari rispetto ai trattamenti convenzionali (prodotti utilizzati, catetere, metodo di conduzione dell induzione della tolleranza immunologica, durata del trattamento, monitoraggio clinico e biologico, criteri di successo) ma può migliorare le probabilità di scomparsa dell inibitore del fattore VIII. COMUNICAZIONE DI NUOVE INFORMAZIONI Lei sarà informato di qualsiasi nuova informazione relativa al presente studio che potrebbe influenzare la Sua decisione di proseguire o meno la partecipazione allo studio e dovrà firmare un nuovo modulo di consenso. Allo stesso modo, in ottemperanza alla legge del 4 marzo 2002 relativa ai diritti dei pazienti, sarà informato dei risultati globali dello studio, una volta terminato. PARTECIPAZIONE La partecipazione di Suo figlio al presente studio è completamente volontaria. Inoltre, ha il diritto di ritirare Suo figlio dallo studio in qualsiasi momento e senza dover fornire spiegazioni. Il rifiuto o l interruzione della partecipazione non pregiudicheranno i rapporti con il suo medico del Centro di emofilia. Anche le Autorità Sanitarie Europee (EMEA) e Nazionali, il Promotore del presente studio, con il gruppo di medici organizzatori dello studio e del comitato di controllo della sicurezza e il Suo medico del Centro di emofilia hanno il diritto di bloccare lo studio, senza richiedere il Suo consenso, nel caso lo reputassero necessario nell interesse dei pazienti oppure nel caso in cui la procedura dello studio non venisse rispettata. Se venisse presa una decisione di questo tipo, Lei ne sarà tempestivamente informato e Le sarà comunque fornito il trattamento adeguato. DISPOSIZIONI LEGALI Lo studio verrà condotto in conformità con le norme di Buona pratica clinica e con la Dichiarazione di Helsinki. A garanzia della sicurezza Suo figlio nel corso del presente studio viene adottata ogni ragionevole precauzione. In qualità di promotore del presente studio, tuttavia, il Centro Angeli Bianchi Bonomi di Milano ha stipulato ha appositamente stipulato la polizza assicurativa Fondazione I.R.C.C.S. Ospedale Maggiore Policlinico "Mangiagalli e Regina Elena", che garantisce la responsabilità civile e consente di coprire i partecipanti al presente studio clinico in caso di qualsiasi danno derivante dalla partecipazione ad n 3
4 esso. RISERVATEZZA DELLE INFORMAZIONI RACCOLTE Tutti i dati medici di Suo figlio raccolti nel corso del presente studio saranno conservati in forma strettamente riservata. Per garantire l anonimato, nei documenti relativi allo studio tali dati saranno identificati dal suo Centro di trattamento dell emofilia con un numero e con le sue iniziali. Questo vale anche per le informazioni trasmesse elettronicamente (attraverso Internet al centro di coordinamento dello studio): i dati saranno trasmessi in formato criptato attraverso una linea Internet dedicata, bloccata, che utilizza diversi codici cifrati e altri dispositivi di sicurezza specifici per la trasmissione dei dati medici. I dati dello studio così raccolti saranno affidati agli organizzatori per essere analizzati e soddisfare così l obiettivo dello studio. I rappresentanti dell Agenzia europea per la valutazione dei farmaci (EMEA), dell Agenzia Italiana del Farmaco, il Promotore dello studio o i suoi rappresentanti, potranno esaminare e copiare i dati medici necessari al presente studio. I risultati saranno oggetto di pubblicazione in relazione allo studio, ma l identità di Suo figlio non sarà rivelata in nessun caso. Lei dispone inoltre di un diritto di accesso, di verifica e di opposizione alla trasmissione dei dati coperti dal segreto professionale utilizzabili nell ambito del presente studio. Tali diritti possono essere esercitati presso il medico che segue Suo figlio nell ambito del presente studio e che è a conoscenza della Sua identità. CONTATTI Per eventuali domande in merito allo studio o ai Suoi diritti, o in caso di problemi legati allo studio, contatti i medici responsabili della sperimentazione del Suo Centro di trattamento dell emofilia: il Professor Alessandro Gringeri, al seguente n. di telefono: Eventuali commenti, domande e qualsiasi forma di richiesta sono ben accetti. Per maggiori informazioni, non esitare a contattare il personale del centro di emofilia o il Professor Gringeri 4
5 CONSENSO INFORMATO PER LA PARTECIPAZIONE ALLO STUDIO RESIST- NAÏVE PER I TITOLARI DELLA POTESTÀ GENITORIALE (REScue Immunotolerance STudy in ITI-Naïve patients) Studio randomizzato di induzione della tolleranza immunologica per la prima volta in pazienti con severa emofilia di tipo A con inibitore ad alto rischio di fallimento: comparazione tra l induzione della immunotolleranza con concentrati di Fattore VIII (FVIII) con il Fattore di Von Willebrand (FVW)e quelli senza il fattore di Von Willebrand. 1. Confermo di aver letto e compreso la nota informativa relativa allo studio sopra riportato e di aver avuto modo di porre domande al medico sperimentatore. 2. Ho capito che la partecipazione di mio figlio è volontaria e che sono libero di ritirare il mio consenso in qualsiasi momento presso il medico sperimentatore, per qualsivoglia ragione, senza che siano compromessi i trattamenti medici e i diritti legali di mio figlio. 3. Sono a conoscenza del fatto che i dati di carattere medico di mio figlio saranno trattati nel più totale anonimato sin dall inserimento nello studio. Autorizzo l accesso a tali dati a coloro che lavorano al presente studio. 4. Firmando il modulo di consenso, accetto di far partecipare mio figlio allo studio RESIST- Naïve. Questi documenti sono redatti in duplice copia, una per lo studio, l altra per il sottoscritto. 5. Sono d accordo/non sono d accordo (si prega di scegliere l opzione desiderata) che i campioni di sangue di mio figlio potranno essere conservati e utilizzati per ricerche future compresi eventuali test genetici. Sarò sempre contattato per ogni futura ricerca che possa implicare l uso di un campione di sangue di mio figlio al fine di approvare l utilizzo di tale campione con il consenso informato I TITOLARI DELLA POTESTÀ GENITORIALE: padre, madre, titolare della potestà genitoriale (cancellare i termini inutili) Io sottoscritto/a (COGNOME e NOME), dichiaro di accettare di far partecipare mio figlio liberamente e volontariamente allo studio denominato RESIST- Naïve. [Luogo] Data (gg/mm/aa): Firma: I TITOLARI DELLA POTESTÀ GENITORIALE: padre, madre, titolare della potestà genitoriale (cancellare i termini inutili) Io sottoscritto/a (COGNOME e NOME), dichiaro di accettare di far partecipare mio figlio liberamente e volontariamente allo studio denominato RESIST- Naïve 5
6 [Luogo] Data (gg/mm/aa): Firma: IL MEDICO SPERIMENTATORE: Io sottoscritto/a Dott/Dott.ssa (COGNOME e NOME), attesto di aver spiegato al/alla paziente firmatario/a lo scopo, le modalità e i potenziali rischi del presente studio e di aver risposto alle domande postemi. [Luogo] Data (gg/mm/aa): Firma del medico: 6
NOTA INFORMATIVA E CONSENSO INFORMATO PER LA PARTECIPAZIONE ALLO STUDIO RESIST- EXPERIENCED PER I TITOLARI DELLA POTESTÀ GENITORIALE SU UN MINORE
 NOTA INFORMATIVA E CONSENSO INFORMATO PER LA PARTECIPAZIONE ALLO STUDIO RESIST- EXPERIENCED PER I TITOLARI DELLA POTESTÀ GENITORIALE SU UN MINORE (REScue Immunotolerance STudy Experienced Patients) Studio
NOTA INFORMATIVA E CONSENSO INFORMATO PER LA PARTECIPAZIONE ALLO STUDIO RESIST- EXPERIENCED PER I TITOLARI DELLA POTESTÀ GENITORIALE SU UN MINORE (REScue Immunotolerance STudy Experienced Patients) Studio
Promotore: Prof. Alessandro Gringeri. Sperimentatore principale: Prof. Alessandro Gringeri
 NOTA INFORMATIVA E CONSENSO INFORMATO PERLA PARTECIPAZIONE ALLO STUDIO RESIST EXPERIENCED (REScue Immunotolerance STudy Experienced Patients) PAZIENTE ADULTO Studio di induzione della tolleranza immunologica
NOTA INFORMATIVA E CONSENSO INFORMATO PERLA PARTECIPAZIONE ALLO STUDIO RESIST EXPERIENCED (REScue Immunotolerance STudy Experienced Patients) PAZIENTE ADULTO Studio di induzione della tolleranza immunologica
Informazione e dichiarazione di consenso per i partecipanti allo Studio svizzero di coorte HIV. Riassunto
 Gentile paziente, Informazione e dichiarazione di consenso per i partecipanti allo Studio svizzero di coorte HIV La invitiamo a partecipare allo Studio svizzero di coorte HIV (SHCS). Lo scopo degli studi
Gentile paziente, Informazione e dichiarazione di consenso per i partecipanti allo Studio svizzero di coorte HIV La invitiamo a partecipare allo Studio svizzero di coorte HIV (SHCS). Lo scopo degli studi
Il processo del consenso informato
 Oncology Business Unit - GMO Il processo del consenso informato Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016 Definizione del consenso informato LINEE GUIDA PER LA BUONA PRATICA
Oncology Business Unit - GMO Il processo del consenso informato Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016 Definizione del consenso informato LINEE GUIDA PER LA BUONA PRATICA
La protezione dei soggetti ed il consenso informato
 La protezione dei soggetti ed il consenso informato Marco Ercolani, MD Trieste, 21 maggio 2008 Definizione di Consenso Informato (GCP) Procedura secondo la quale un soggetto accetta volontariamente di
La protezione dei soggetti ed il consenso informato Marco Ercolani, MD Trieste, 21 maggio 2008 Definizione di Consenso Informato (GCP) Procedura secondo la quale un soggetto accetta volontariamente di
Informazione per il paziente. Raccolta di dati clinici di pazienti con tumore cerebrale per il gruppo cooperativo svizzero per lo studio del glioma
 Informazione per il paziente Raccolta di dati clinici di pazienti con tumore cerebrale per il gruppo cooperativo svizzero per lo studio del glioma Gentile Signora, gentile Signore, prenda il tempo necessario
Informazione per il paziente Raccolta di dati clinici di pazienti con tumore cerebrale per il gruppo cooperativo svizzero per lo studio del glioma Gentile Signora, gentile Signore, prenda il tempo necessario
Guida per i parenti e le persone di supporto. Possiamo sciogliere l'amiloidosi AL?
 Guida per i parenti e le persone di supporto Possiamo sciogliere l'amiloidosi AL? Grazie per il Suo interesse Cosa sono gli studi di ricerca clinica? Le è stato fornito il presente opuscolo perché qualcuno
Guida per i parenti e le persone di supporto Possiamo sciogliere l'amiloidosi AL? Grazie per il Suo interesse Cosa sono gli studi di ricerca clinica? Le è stato fornito il presente opuscolo perché qualcuno
MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE DOMINANTI DI DEGENERAZIONE LOBARE FRONTOTEMPORALE
 Titolo del Progetto: NETWORK ITALIA PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER E DI DEGENERAZIONE LOBARE FRONTOTEMPORALE MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE
Titolo del Progetto: NETWORK ITALIA PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER E DI DEGENERAZIONE LOBARE FRONTOTEMPORALE MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE
FOGLIO INFORMATIVO E CONSENSO INFORMATO PER GASTROSCOPIA DIAGNOSTICA E TERAPEUTICA.
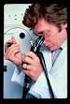 FOGLIO INFORMATIVO E CONSENSO INFORMATO PER GASTROSCOPIA DIAGNOSTICA E TERAPEUTICA. Gentile Paziente, La gastroscopia è un esame endoscopico che permette la visualizzazione della mucosa dell esofago, dello
FOGLIO INFORMATIVO E CONSENSO INFORMATO PER GASTROSCOPIA DIAGNOSTICA E TERAPEUTICA. Gentile Paziente, La gastroscopia è un esame endoscopico che permette la visualizzazione della mucosa dell esofago, dello
INFORMATIVA PER IL PAZIENTE
 INFORMATIVA PER IL PAZIENTE (Mod. Versione 4 del 27 maggio 2013) 1) Finalità del trattamento dei dati personali Diagnosi e cura dei tumori rari. Ricerca retrospettiva e/o traslazionale sui tumori rari.
INFORMATIVA PER IL PAZIENTE (Mod. Versione 4 del 27 maggio 2013) 1) Finalità del trattamento dei dati personali Diagnosi e cura dei tumori rari. Ricerca retrospettiva e/o traslazionale sui tumori rari.
DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE
 DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE Istruzioni per la compilazione Per la corretta esecuzione della manovra e per
DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE Istruzioni per la compilazione Per la corretta esecuzione della manovra e per
L IMMUNOTOLLERANZA RESCUE NEL BAMBINO CON EMOFILIA. Padova 13/14 maggio Chiara Biasoli Centro Emofilia Cesena
 L IMMUNOTOLLERANZA RESCUE NEL BAMBINO CON EMOFILIA Padova 13/14 maggio Chiara Biasoli Centro Emofilia Cesena Raccomandazioni AICE Obiettivo primario eradicazione Bambini principali candidati Intrapresa
L IMMUNOTOLLERANZA RESCUE NEL BAMBINO CON EMOFILIA Padova 13/14 maggio Chiara Biasoli Centro Emofilia Cesena Raccomandazioni AICE Obiettivo primario eradicazione Bambini principali candidati Intrapresa
N cartella N ricovero Cognome Nome Data di nascita DICHIARAZIONE DI AVVENUTA INFORMAZIONE ED ESPRESSIONE DEL CONSENSO A TRATTAMENTO CHEMIOTERAPICO
 Io sottoscritto/a, nato/a il a nel pieno possesso delle mie facoltà dichiaro di essere stato/a informato/a in modo dettagliato, chiaro e comprensibile, dal Dottor, sui seguenti punti: 1. diagnosi : La
Io sottoscritto/a, nato/a il a nel pieno possesso delle mie facoltà dichiaro di essere stato/a informato/a in modo dettagliato, chiaro e comprensibile, dal Dottor, sui seguenti punti: 1. diagnosi : La
INFORMATIVA AL PAZIENTE
 CEI FONDAZIONE PTV POLICLINICO TOR VERGATA SOP Procedure Operative Standard INFORMATIVA AL PAZIENTE Nessuna delle informazioni orali e scritte concernenti lo studio, compreso il modulo di consenso informato
CEI FONDAZIONE PTV POLICLINICO TOR VERGATA SOP Procedure Operative Standard INFORMATIVA AL PAZIENTE Nessuna delle informazioni orali e scritte concernenti lo studio, compreso il modulo di consenso informato
UNIVERSITÁ DEGLI STUDI MAGNA GRÆCIA DI CATANZARO
 SCHEDA INFORMATIVA E DICHIARAZIONE DI CONSENSO (per soggetti capace di fornire personalmente il consenso) SCHEDA INFORMATIVA Gentile Signora/e, In questa Azienda Ospedaliera è in programma una ricerca
SCHEDA INFORMATIVA E DICHIARAZIONE DI CONSENSO (per soggetti capace di fornire personalmente il consenso) SCHEDA INFORMATIVA Gentile Signora/e, In questa Azienda Ospedaliera è in programma una ricerca
Informazione per pazienti e familiari. La Ricerca e gli Studi Clinici
 Informazione per pazienti e familiari La Ricerca e gli Studi Clinici Introduzione L Azienda Ospedaliera di Reggio Emilia (ASMN) è un Istituto di Ricovero e Cura a Carattere Scientifico (IRCCS) nell ambito
Informazione per pazienti e familiari La Ricerca e gli Studi Clinici Introduzione L Azienda Ospedaliera di Reggio Emilia (ASMN) è un Istituto di Ricovero e Cura a Carattere Scientifico (IRCCS) nell ambito
INDICAZIONI CENTRO SPECIFICHE relative al CONSENSO INFORMATO in STUDI CLINICI
 COMITATO ETICO dell IDI-IRCCS INDICAZIONI CENTRO SPECIFICHE relative al CONSENSO INFORMATO in STUDI CLINICI 1/7 Indicazioni per l utilizzo di versioni modificate del modulo di consenso informato N.B.:
COMITATO ETICO dell IDI-IRCCS INDICAZIONI CENTRO SPECIFICHE relative al CONSENSO INFORMATO in STUDI CLINICI 1/7 Indicazioni per l utilizzo di versioni modificate del modulo di consenso informato N.B.:
Le informazioni contenute nei moduli suddetti devono essere complete, chiare e comprensibili.
 SEDE LEGALE: Udine - Via Pozzuolo 330 Centralino: +39 0432 554160 Fax: +39 0432 306241 C.F./P.IVA 02801630308 e mail: segreteria@egas.sanita.fvg.it - PEC:egas.protgen@certsanita.fvg.it COMITATO ETICO UNICO
SEDE LEGALE: Udine - Via Pozzuolo 330 Centralino: +39 0432 554160 Fax: +39 0432 306241 C.F./P.IVA 02801630308 e mail: segreteria@egas.sanita.fvg.it - PEC:egas.protgen@certsanita.fvg.it COMITATO ETICO UNICO
Pediatria Preventiva e Sociale
 Gli antibiotici sono farmaci molto potenti, ma possono non funzionare o diventare perfino dannosi qualora non vengano utilizzati in modo corretto. E quindi molto importante che vengano somministrati soltanto
Gli antibiotici sono farmaci molto potenti, ma possono non funzionare o diventare perfino dannosi qualora non vengano utilizzati in modo corretto. E quindi molto importante che vengano somministrati soltanto
Facsimile. prelievo di sangue (per analisi cliniche di laboratorio e per l estrazione di DNA)
 Consenso informato Dichiaro di aver preso visione del filmato informativo e di avere letto le informazioni inviatemi a casa. Mi è stato spiegato e mi è chiaro lo svolgimento, lo scopo e i rischi connessi
Consenso informato Dichiaro di aver preso visione del filmato informativo e di avere letto le informazioni inviatemi a casa. Mi è stato spiegato e mi è chiaro lo svolgimento, lo scopo e i rischi connessi
MODELLO INFORMATIVO. Informazioni relative all esame diagnostico HEAD-UP TILT TEST
 MODELLO INFORMATIVO Informazioni relative all esame diagnostico HEAD-UP TILT TEST Io sottoscritto/a nato/a. il. dichiaro di essere stato/a informato/a in data dal dr.. DI ESSERE AFFETTO DALLA SEGUENTE
MODELLO INFORMATIVO Informazioni relative all esame diagnostico HEAD-UP TILT TEST Io sottoscritto/a nato/a. il. dichiaro di essere stato/a informato/a in data dal dr.. DI ESSERE AFFETTO DALLA SEGUENTE
CONSENSO ALL ESECUZIONE DI TEST GENETICI
 CONSENSO ALL ESECUZIONE DI TEST GENETICI Io sottoscritto/a............................................................................ nato/a a.................................... (...... ) il....................................
CONSENSO ALL ESECUZIONE DI TEST GENETICI Io sottoscritto/a............................................................................ nato/a a.................................... (...... ) il....................................
CARTA INTESTATA DEL CENTRO
 CARTA INTESTATA DEL CENTRO Sede, Data Al Comitato Etico Unico Regionale Del Friuli Venezia Giulia c/o Direzione Scientifica CRO Aviano Alla Direzione Generale Azienda (DA COMPLETARE) OGGETTO: Dichiarazione
CARTA INTESTATA DEL CENTRO Sede, Data Al Comitato Etico Unico Regionale Del Friuli Venezia Giulia c/o Direzione Scientifica CRO Aviano Alla Direzione Generale Azienda (DA COMPLETARE) OGGETTO: Dichiarazione
Direttore Sanitario: Dr.ssa Silvia Campagnari MAMMOGRAFIA
 Direttore Sanitario: Dr.ssa Silvia Campagnari MAMMOGRAFIA INFORMAZIONI COS E E un indagine che utilizza radiazioni ionizzanti (Raggi X), a basso dosaggio, per la diagnosi della patologia mammaria. Poiché
Direttore Sanitario: Dr.ssa Silvia Campagnari MAMMOGRAFIA INFORMAZIONI COS E E un indagine che utilizza radiazioni ionizzanti (Raggi X), a basso dosaggio, per la diagnosi della patologia mammaria. Poiché
PROCEDURE PER IL PRELIEVO BIOLOGICO
 Istituto di Ricerche Farmacologiche Mario Negri Milano 13 Aprile 2010 SOTTOPROGETTO ANALISI GENOME-WIDE PROCEDURE PER IL PRELIEVO BIOLOGICO 1 ORA CHE MI SONO CHIARI GLI OBIETTIVI COSA E COME CHE COSA DEVO
Istituto di Ricerche Farmacologiche Mario Negri Milano 13 Aprile 2010 SOTTOPROGETTO ANALISI GENOME-WIDE PROCEDURE PER IL PRELIEVO BIOLOGICO 1 ORA CHE MI SONO CHIARI GLI OBIETTIVI COSA E COME CHE COSA DEVO
MODELLO DI COMUNICAZIONE AL RICHIEDENTE DELLA DECISIONE DEL COMITATO ETICO RELATIVA AL PARERE UNICO 1
 Appendice 6 MODELLO DI COMUNICAZIONE AL RICHIEDENTE DELLA DECISIONE DEL COMITATO ETICO RELATIVA AL PARERE UNICO 1 Il presente parere del comitato etico è stato compilato e stampato dal sito internet dell
Appendice 6 MODELLO DI COMUNICAZIONE AL RICHIEDENTE DELLA DECISIONE DEL COMITATO ETICO RELATIVA AL PARERE UNICO 1 Il presente parere del comitato etico è stato compilato e stampato dal sito internet dell
L EMOFILIA. Che cos è
 L EMOFILIA Che cos è L emofilia è una malattia rara di origine genetica che colpisce soprattutto i maschi. Se in un individuo sano la fuoriuscita di sangue dai vasi sanguigni si arresta rapidamente, chi
L EMOFILIA Che cos è L emofilia è una malattia rara di origine genetica che colpisce soprattutto i maschi. Se in un individuo sano la fuoriuscita di sangue dai vasi sanguigni si arresta rapidamente, chi
Responsabile Centro Emofilia Sapienza Università di Roma; Associazione Italiana Centri Emofilia, AICE EMOFILIA: PERCORSI INTEGRATI DI CURA
 PROF.SSA MARIA GABRIELLA MAZZUCCONI Responsabile Centro Emofilia Sapienza Università di Roma; Associazione Italiana Centri Emofilia, AICE EMOFILIA: PERCORSI INTEGRATI DI CURA L emofilia, come le altre
PROF.SSA MARIA GABRIELLA MAZZUCCONI Responsabile Centro Emofilia Sapienza Università di Roma; Associazione Italiana Centri Emofilia, AICE EMOFILIA: PERCORSI INTEGRATI DI CURA L emofilia, come le altre
E. O. Ospedali Galliera - Genova (L. 833/1978, art. 41; D. lgs n. 517/1993 art. 4 c. 12)
 E. O. Ospedali Galliera - Genova (L. 833/1978, art. 41; D. lgs n. 517/1993 art. 4 c. 12) Ospedale di rilievo nazionale e di alta specializzazione (D.P.C.M. 14 luglio 1995) Segreteria Amministrativa Comitato
E. O. Ospedali Galliera - Genova (L. 833/1978, art. 41; D. lgs n. 517/1993 art. 4 c. 12) Ospedale di rilievo nazionale e di alta specializzazione (D.P.C.M. 14 luglio 1995) Segreteria Amministrativa Comitato
SINOSSI. Titolo. Coordinatori e Promotori dello studio
 SINOSSI Titolo PLERIXAFOR (PLX) IN MODALITA ON DEMAND PER LA RACCOLTA DI CELLULE STAMINALI EMOPOIETICHE AUTOLOGHE IN PAZIENTI AFFETTI DA MIELOMA MULTIPLO DA LINFOMA CHE MOSTRINO POVERA MOBILIZZAZIONE DOPO
SINOSSI Titolo PLERIXAFOR (PLX) IN MODALITA ON DEMAND PER LA RACCOLTA DI CELLULE STAMINALI EMOPOIETICHE AUTOLOGHE IN PAZIENTI AFFETTI DA MIELOMA MULTIPLO DA LINFOMA CHE MOSTRINO POVERA MOBILIZZAZIONE DOPO
AULA ROSSA STUDI CLINICI IN CORSO
 Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche AULA ROSSA STUDI CLINICI IN CORSO Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica,
Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche AULA ROSSA STUDI CLINICI IN CORSO Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica,
Dipartimento del Farmaco
 Dipartimento del Farmaco U. O. C. di Farmaceutica Ospedaliera VERBALE DI VERIFICA DEGLI ARMADI DI REPARTO (in collaborazione con la Direzione Sanitaria di Presidio, per valutare la corretta tenuta dei
Dipartimento del Farmaco U. O. C. di Farmaceutica Ospedaliera VERBALE DI VERIFICA DEGLI ARMADI DI REPARTO (in collaborazione con la Direzione Sanitaria di Presidio, per valutare la corretta tenuta dei
RICERCA E SVILUPPO DI NUOVI FARMACI
 RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
Linee guida sulla gestione di terapie preoperatorie antiaggreganti ed anticoagulanti
 Linee guida sulla gestione di terapie preoperatorie antiaggreganti ed anticoagulanti Marco Moia Centro Emofilia e Trombosi A. Bianchi Bonomi Fondazione IRCCS Ca Granda Ospedale Maggiore Policlinico di
Linee guida sulla gestione di terapie preoperatorie antiaggreganti ed anticoagulanti Marco Moia Centro Emofilia e Trombosi A. Bianchi Bonomi Fondazione IRCCS Ca Granda Ospedale Maggiore Policlinico di
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante
 Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL)
 Azienda Ospedaliero- Universitaria Maggiore della Carità di Novara DIREZIONE SANITARIA S.C.D.O. FARMACIA DATA: 20.02.2008 REV. N 00 PAG. 1/8 UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL) REDATTO
Azienda Ospedaliero- Universitaria Maggiore della Carità di Novara DIREZIONE SANITARIA S.C.D.O. FARMACIA DATA: 20.02.2008 REV. N 00 PAG. 1/8 UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL) REDATTO
Nota Informativa Importante. Guida alla Terapia per i Paziente. Guida alla Contraccezione. Modulo d'informazione e Consenso Informato
 AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
MODULO DI CONSENSO INFORMATO PER IL PAZIENTE
 Pagina 1 di 9 MODULO DI CONSENSO INFORMATO PER IL PAZIENTE Istruzioni per la compilazione del modulo: Prima di firmare il presente modulo, il paziente - o i genitori/tutori in caso di pazienti minori o
Pagina 1 di 9 MODULO DI CONSENSO INFORMATO PER IL PAZIENTE Istruzioni per la compilazione del modulo: Prima di firmare il presente modulo, il paziente - o i genitori/tutori in caso di pazienti minori o
Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema. Dott.ssa Maria Susanna Rivetti
 Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema Dott.ssa Maria Susanna Rivetti 1 D.L.vo 219/2006 e s.m.i. Definizione Medicinali biologici Medicinali il cui principio attivo
Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema Dott.ssa Maria Susanna Rivetti 1 D.L.vo 219/2006 e s.m.i. Definizione Medicinali biologici Medicinali il cui principio attivo
Il Registro Nazionale per il Metilfenidato
 Il Registro Nazionale per il Metilfenidato Uno strumento di sanità pubblica Dante Besana Direttore di Struttura Complessa di Neuropsichiatria Infantile Milano 13 maggio 2005 Premesse giugno 2002 - CD SINPIA:
Il Registro Nazionale per il Metilfenidato Uno strumento di sanità pubblica Dante Besana Direttore di Struttura Complessa di Neuropsichiatria Infantile Milano 13 maggio 2005 Premesse giugno 2002 - CD SINPIA:
DENUNCIA DI SINISTRO INFORTUNI (DA INVIARE AL PIÙ PRESTO REDATTA IN MODO COMPLETO)
 ALL AGENZIA PRINCIPALE DI DENUNCIA DI SINISTRO INFORTUNI (DA INVIARE AL PIÙ PRESTO REDATTA IN MODO COMPLETO) RISERVATO AGENZIA RAMO N. DANNO ESERCIZIO CODICE AGENZIA DENUNCIA PERVENUTA IN AGENZIA IL 05
ALL AGENZIA PRINCIPALE DI DENUNCIA DI SINISTRO INFORTUNI (DA INVIARE AL PIÙ PRESTO REDATTA IN MODO COMPLETO) RISERVATO AGENZIA RAMO N. DANNO ESERCIZIO CODICE AGENZIA DENUNCIA PERVENUTA IN AGENZIA IL 05
Un esempio: CE Policlinico Gemelli
 Un esempio: CE Policlinico Gemelli Tipologia degli studi 32% 2% 3% 4% Farmacologici 41% 3% 9% 6% Diagnostici Chirurgici Anestesiologici Osservazionali Studi di laboratorio Dispositivi medici Radioterapia
Un esempio: CE Policlinico Gemelli Tipologia degli studi 32% 2% 3% 4% Farmacologici 41% 3% 9% 6% Diagnostici Chirurgici Anestesiologici Osservazionali Studi di laboratorio Dispositivi medici Radioterapia
Classificazione clinica dell emofilia A e B
 Classificazione clinica dell emofilia A e B Gravità Grave Moderata Lieve Livello di FVIII/ IX < 1 % 1-5 % > 5 % < 40 % Caratteristiche cliniche Emorragie spontanee dalla prima infanzia; frequenti emartri
Classificazione clinica dell emofilia A e B Gravità Grave Moderata Lieve Livello di FVIII/ IX < 1 % 1-5 % > 5 % < 40 % Caratteristiche cliniche Emorragie spontanee dalla prima infanzia; frequenti emartri
1. Vorresti condividere qualcosa di te? Nickname. Nazionalità. Età. Nazione in cui risiedi attualmente. Sei una studentessa?
 INTRODUZIONE Perchè una indagine riguardante delle informazioni relative alla tua diagnosi? Per progettare un domani migliore per le ragazze e le donne con problemi emorragici e per valutare le migliori
INTRODUZIONE Perchè una indagine riguardante delle informazioni relative alla tua diagnosi? Per progettare un domani migliore per le ragazze e le donne con problemi emorragici e per valutare le migliori
SCHEDA INFORMATIVA INTERVENTO DI ASPORTAZIONE DI CALAZIO APPROVATA DALLA SOCIETA OFTALMOLOGICA ITALIANA NELL ANNO 2003
 SCHEDA INFORMATIVA INTERVENTO DI ASPORTAZIONE DI CALAZIO APPROVATA DALLA SOCIETA OFTALMOLOGICA ITALIANA NELL ANNO 2003 Gentile Signora, Signore, Lei soffre di un calazio palpebrale. Questa scheda contiene
SCHEDA INFORMATIVA INTERVENTO DI ASPORTAZIONE DI CALAZIO APPROVATA DALLA SOCIETA OFTALMOLOGICA ITALIANA NELL ANNO 2003 Gentile Signora, Signore, Lei soffre di un calazio palpebrale. Questa scheda contiene
3 OSTELLI 3 CITTÀ CONCORSO DI PROGETTAZIONE
 3 OSTELLI 3 CITTÀ CONCORSO DI PROGETTAZIONE DOMANDA DI PARTECIPAZIONE E DICHIARAZIONI A CORREDO (nel caso di partecipazione in raggruppamento temporaneo costituito o da costituirsi l istanza dovrà essere
3 OSTELLI 3 CITTÀ CONCORSO DI PROGETTAZIONE DOMANDA DI PARTECIPAZIONE E DICHIARAZIONI A CORREDO (nel caso di partecipazione in raggruppamento temporaneo costituito o da costituirsi l istanza dovrà essere
DESTINATARI TEMA CATEGORIE E SEZIONI DEL CONCORSO
 La Sezione Italiana di Amnesty International, in collaborazione con EGA Editore in occasione del 60 anniversario della Dichiarazione universale dei diritti umani bandisce il DESTINATARI Il Concorso è riservato
La Sezione Italiana di Amnesty International, in collaborazione con EGA Editore in occasione del 60 anniversario della Dichiarazione universale dei diritti umani bandisce il DESTINATARI Il Concorso è riservato
FedEmo Progetto Sa.Me.Da. L.I.F.E.
 FedEmo Progetto Sa.Me.Da. L.I.F.E. (Safety Medical Database - Local Informed For Emergency) Emofilia: la patologia L emofilia è una malattia rara di origine genetica dovuta ad un difetto della coagulazione
FedEmo Progetto Sa.Me.Da. L.I.F.E. (Safety Medical Database - Local Informed For Emergency) Emofilia: la patologia L emofilia è una malattia rara di origine genetica dovuta ad un difetto della coagulazione
Federazione Italiana Giuoco Handball
 Federazione Italiana Giuoco Handball PALLAMANO DISCIPLINA OLIMPICA Segreteria Generale Circolare n. 14/2016 Roma, 25 marzo 2016 Alle Società Affiliate Agli atleti e tecnici Ai Signori Consiglieri Federali
Federazione Italiana Giuoco Handball PALLAMANO DISCIPLINA OLIMPICA Segreteria Generale Circolare n. 14/2016 Roma, 25 marzo 2016 Alle Società Affiliate Agli atleti e tecnici Ai Signori Consiglieri Federali
Allegato IV. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato IV Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio 277 Conclusioni scientifiche Il CHMP ha preso in esame la raccomandazione del
Allegato IV Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio 277 Conclusioni scientifiche Il CHMP ha preso in esame la raccomandazione del
SCHEDA DONATORE INFORMATIVA AI SENSI DEL CODICE PRIVACY AI FINI DELLA RACCOLTA DELLE DONAZIONI
 SCHEDA DONATORE INFORMATIVA AI SENSI DEL CODICE PRIVACY AI FINI DELLA RACCOLTA DELLE DONAZIONI Ai sensi dell'art. 13 del D.Lgs. 30 giugno 2003 n. 196 (di seguito, il Codice Privacy ), Veneranda Fabbrica
SCHEDA DONATORE INFORMATIVA AI SENSI DEL CODICE PRIVACY AI FINI DELLA RACCOLTA DELLE DONAZIONI Ai sensi dell'art. 13 del D.Lgs. 30 giugno 2003 n. 196 (di seguito, il Codice Privacy ), Veneranda Fabbrica
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante
 Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
FARMACOSORVEGLIANZA DEI PAZIENTI IN TERAPIA CON EVOLOCUMAB
 FARMACOSORVEGLIANZA DEI PAZIENTI IN TERAPIA CON EVOLOCUMAB Francesca Bambara IL RUOLO DELL INFERMIERE Le malattie cardiovascolari (CVD) hanno una mortalità pari a 4 milioni di persone ogni anno solo in
FARMACOSORVEGLIANZA DEI PAZIENTI IN TERAPIA CON EVOLOCUMAB Francesca Bambara IL RUOLO DELL INFERMIERE Le malattie cardiovascolari (CVD) hanno una mortalità pari a 4 milioni di persone ogni anno solo in
I CONVEGNO PER INFERMIERI IN ONCOLOGIA Ospedale di S. Polo Monfalcone 20 Novembre La ricerca: Come, dove, quando?
 I CONVEGNO PER INFERMIERI IN ONCOLOGIA Ospedale di S. Polo Monfalcone 20 Novembre 2004 La ricerca: Come, dove, quando? Daniela Grosso, UO di Oncologia Medica, Azienda Ospedaliera di Padova L ASSISTENZA
I CONVEGNO PER INFERMIERI IN ONCOLOGIA Ospedale di S. Polo Monfalcone 20 Novembre 2004 La ricerca: Come, dove, quando? Daniela Grosso, UO di Oncologia Medica, Azienda Ospedaliera di Padova L ASSISTENZA
Corso di Perfezionamento. Ricerca Clinica: l Infermiere di Ricerca nello Sviluppo di Nuovi Farmaci Antitumorali
 Corso di Perfezionamento Ricerca Clinica: l Infermiere di Ricerca nello Sviluppo di Nuovi Farmaci Antitumorali Coordinatore del Corso: Prof. Alessandro M. Gianni Segreteria organizzativa: Fondazione IRCCS
Corso di Perfezionamento Ricerca Clinica: l Infermiere di Ricerca nello Sviluppo di Nuovi Farmaci Antitumorali Coordinatore del Corso: Prof. Alessandro M. Gianni Segreteria organizzativa: Fondazione IRCCS
DOMANDA PER L'AUTORIZZAZIONE ALLA SPERIMENTAZIONE CLINICA
 Modello 1 DOMANDA PER L'AUTORIZZAZIONE ALLA SPERIMENTAZIONE CLINICA Al Presidente del Comitato Etico dell Azienda Sanitaria Locale Viterbo via S.Lorenzo,101 VITERBO Il sottoscritto Prof./Dr. Della Unità
Modello 1 DOMANDA PER L'AUTORIZZAZIONE ALLA SPERIMENTAZIONE CLINICA Al Presidente del Comitato Etico dell Azienda Sanitaria Locale Viterbo via S.Lorenzo,101 VITERBO Il sottoscritto Prof./Dr. Della Unità
AUTORIZZO DICHIARO. Croce Rossa Italiana Comitato Locale di Agro MODULO D ISCRIZIONE AL CAMPO SCUOLA 2017 ANCH IO SONO LA PROTEZIONE CIVILE
 MODULO D ISCRIZIONE AL CAMPO SCUOLA 2017 ANCH IO SONO LA PROTEZIONE CIVILE Croce Rossa Italiana Il/la sottoscritto/a 1 nato/a a PROV. il / / C.F. residente a PROV. CAP via/p.zza/c.so n tel. cell. cell2.
MODULO D ISCRIZIONE AL CAMPO SCUOLA 2017 ANCH IO SONO LA PROTEZIONE CIVILE Croce Rossa Italiana Il/la sottoscritto/a 1 nato/a a PROV. il / / C.F. residente a PROV. CAP via/p.zza/c.so n tel. cell. cell2.
PROGETTO FORMATIVO E DI ORIENTAMENTO (Rif.: Convenzione stipulata in data ) Cognome Nome. Codice Fiscale. Nato a il
 Allegato n. 2 PROGETTO FORMATIVO E DI ORIENTAMENTO (Rif.: Convenzione stipulata in data ) Tirocinante: Cognome Nome Codice Fiscale Nato a il Cittadinanza (se cittadino extracomunitario indicare il numero
Allegato n. 2 PROGETTO FORMATIVO E DI ORIENTAMENTO (Rif.: Convenzione stipulata in data ) Tirocinante: Cognome Nome Codice Fiscale Nato a il Cittadinanza (se cittadino extracomunitario indicare il numero
MODELLO DOMANDA DI CONTRIBUTO PER SOGGIORNI ESTIVI
 MODELLO 9012 2017 DOMANDA DI CONTRIBUTO PER SOGGIORNI ESTIVI -, Italia Contact Center 199.30.30.33 - www.enasarco.it INFORMAZIONI UTILI La domanda dovrà essere inviata entro e non oltre il 15/10/2017.
MODELLO 9012 2017 DOMANDA DI CONTRIBUTO PER SOGGIORNI ESTIVI -, Italia Contact Center 199.30.30.33 - www.enasarco.it INFORMAZIONI UTILI La domanda dovrà essere inviata entro e non oltre il 15/10/2017.
CONSENSO INFORMATO. Giornate ANMDO Caterina Mineccia. aterina Mineccia
 CONSENSO INFORMATO Giornate ANMDO 2006 Caterina Mineccia CONSENSO Espressione della volontà del Paziente: l obbligo è sancito dalla Costituzione, da norme, dal codice deontologico medico, dalla Carta dei
CONSENSO INFORMATO Giornate ANMDO 2006 Caterina Mineccia CONSENSO Espressione della volontà del Paziente: l obbligo è sancito dalla Costituzione, da norme, dal codice deontologico medico, dalla Carta dei
Art. 7 La notifica della valutazione della Commissione sarà comunicata ai vincitori entro il giorno 6 dicembre 2017.
 BANDO DI GARA PER L ASSEGNAZIONE DI 5 BORSE DI STUDIO A GIOVANI LAUREATI IN MEDICINA E CHIRURGIA O BIOLOGIA, PROMOSSO DA SOCIETÀ ITALIANA DI ALLERGOLOGIA, ASMA E IMMUNOLOGIA CLINICA (SIAAIC), SOCIETÀ ITALIANA
BANDO DI GARA PER L ASSEGNAZIONE DI 5 BORSE DI STUDIO A GIOVANI LAUREATI IN MEDICINA E CHIRURGIA O BIOLOGIA, PROMOSSO DA SOCIETÀ ITALIANA DI ALLERGOLOGIA, ASMA E IMMUNOLOGIA CLINICA (SIAAIC), SOCIETÀ ITALIANA
Ruolo dell Infermiere nella gestione di un Trial clinico
 Ricerca clinica Studi di fase I, II, III 3 Ruolo dell Infermiere nella gestione di un Trial clinico Processo Approvazione Attivazione Susanna Bassi Infermiera di ricerca, Ematologia Dh Ospedale di Circolo
Ricerca clinica Studi di fase I, II, III 3 Ruolo dell Infermiere nella gestione di un Trial clinico Processo Approvazione Attivazione Susanna Bassi Infermiera di ricerca, Ematologia Dh Ospedale di Circolo
COME FUNZIONANO GLI STUDI CLINICI
 COME FUNZIONANO GLI STUDI CLINICI Gli studi clinici rappresentano il modo migliore per verificare se un trattamento sia più efficace e sicuro di altri trattamenti già esistenti e approvati per l uso nella
COME FUNZIONANO GLI STUDI CLINICI Gli studi clinici rappresentano il modo migliore per verificare se un trattamento sia più efficace e sicuro di altri trattamenti già esistenti e approvati per l uso nella
FOGLIO INFORMATIVO E DICHIARAZIONE DI CONSENSO per un paziente adulto capace di dare personalmente il consenso
 FOGLIO INFORMATIVO E DICHIARAZIONE DI CONSENSO per un paziente adulto capace di dare personalmente il consenso Gentile Signora/e, Questo nostro Istituto, è stato invitato a partecipare ad uno studio osservazionale
FOGLIO INFORMATIVO E DICHIARAZIONE DI CONSENSO per un paziente adulto capace di dare personalmente il consenso Gentile Signora/e, Questo nostro Istituto, è stato invitato a partecipare ad uno studio osservazionale
Good Clinical Practice (ICH- GCP): principi generali. Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016
 Good Clinical Practice (ICH- GCP): principi generali Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016 Good Clinical Practice: cosa sono? Standard etico e di qualità internazionale
Good Clinical Practice (ICH- GCP): principi generali Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016 Good Clinical Practice: cosa sono? Standard etico e di qualità internazionale
ALLEGATO A IMPRESA RICHIEDENTE
 ALLEGATO A CAMERA DI COMMERCIO I.A.A. DI PISA Dipartimento Promozione Ufficio Brevetti, Marchi ed Innovazione tecnologica Bando per il sostegno ai processi di brevettazione/registrazione. Piazza V.Emanale
ALLEGATO A CAMERA DI COMMERCIO I.A.A. DI PISA Dipartimento Promozione Ufficio Brevetti, Marchi ed Innovazione tecnologica Bando per il sostegno ai processi di brevettazione/registrazione. Piazza V.Emanale
EMOFILIA A. Quale impatto e quali soluzioni terapeutiche
 EMOFILIA A Quale impatto e quali soluzioni terapeutiche BIBLIOTECA DEL SENATO GIOVANNI SPADOLINI SALA DEGLI ATTI PARLAMENTARI Piazza della Minerva, 38 - Roma Con il Patrocinio di ISTITUTO SUPERIORE DI
EMOFILIA A Quale impatto e quali soluzioni terapeutiche BIBLIOTECA DEL SENATO GIOVANNI SPADOLINI SALA DEGLI ATTI PARLAMENTARI Piazza della Minerva, 38 - Roma Con il Patrocinio di ISTITUTO SUPERIORE DI
Schema dello studio clinico di Fase 2b
 Sommario dei risultati dello studio clinico di Fase 2b di Ataluren presentato in occasione dell American Academy of Neurology Meeting il 16 Aprile 2010 Toronto, 16 Aprile 2010 - Un nuovo farmaco sperimentale
Sommario dei risultati dello studio clinico di Fase 2b di Ataluren presentato in occasione dell American Academy of Neurology Meeting il 16 Aprile 2010 Toronto, 16 Aprile 2010 - Un nuovo farmaco sperimentale
FAC SIMILE documento riepilogativo MODULO DI DOMANDA - SETTORE ESTRAZIONE E LAVORAZIONE DEI MATERIALI LAPIDEI
 CODICE DOMANDA BANDO PER IL SOSTEGNO AL MIGLIORAMENTO DELLE CONDIZIONI DI SALUTE E SICUREZZA SUL LAVORO, CON PARTICOLARE RIFERIMENTO ALL INNOVAZIONE TECNOLOGICA in attuazione dell articolo 11, comma 5,
CODICE DOMANDA BANDO PER IL SOSTEGNO AL MIGLIORAMENTO DELLE CONDIZIONI DI SALUTE E SICUREZZA SUL LAVORO, CON PARTICOLARE RIFERIMENTO ALL INNOVAZIONE TECNOLOGICA in attuazione dell articolo 11, comma 5,
interventi per l identificazione proattiva e la presa in carico del paziente complesso finalizzata alla prevenzione dei ricoveri ripetuti.
 Servizio del Personale Progetto Progetto CCM 2015 Malattie croniche: supporto e valutazione comparativa di interventi per l identificazione proattiva e la presa in carico del paziente complesso finalizzata
Servizio del Personale Progetto Progetto CCM 2015 Malattie croniche: supporto e valutazione comparativa di interventi per l identificazione proattiva e la presa in carico del paziente complesso finalizzata
Dal Big Bang al Big Ben SUMMER CAMP 2013
 MODULO DI ISCRIZIONE (da consegnare entro il 22 maggio 2013, vedi indicazioni a fondo pagina) Il sottoscritto: Codice Fiscale In qualità di: genitore chi ne fa le veci Tel. / Cell. E-mail: NOME E COGNOME
MODULO DI ISCRIZIONE (da consegnare entro il 22 maggio 2013, vedi indicazioni a fondo pagina) Il sottoscritto: Codice Fiscale In qualità di: genitore chi ne fa le veci Tel. / Cell. E-mail: NOME E COGNOME
Il protocollo di ricerca
 Infermiere di ricerca Il protocollo di ricerca Dr. Monica Turazza Negrar, 17 maggio 2017 Cosa rappresenta: percorso da seguire in qualsiasi forma di sperimentazione pianificata che riguardi prevenzione,
Infermiere di ricerca Il protocollo di ricerca Dr. Monica Turazza Negrar, 17 maggio 2017 Cosa rappresenta: percorso da seguire in qualsiasi forma di sperimentazione pianificata che riguardi prevenzione,
INFORMAZIONI SULLA VACCINAZIONE ANTI- PAPILLOMA VIRUS (HPV)
 INFORMAZIONI SULLA VACCINAZIONE ANTI- PAPILLOMA VIRUS (HPV) INFORMAZIONI SULLA VACCINAZIONE I papilloma virus umani sono virus la cui infezione è associata alla quasi totalità dei casi di tumore del collo
INFORMAZIONI SULLA VACCINAZIONE ANTI- PAPILLOMA VIRUS (HPV) INFORMAZIONI SULLA VACCINAZIONE I papilloma virus umani sono virus la cui infezione è associata alla quasi totalità dei casi di tumore del collo
Istituto Paritario Regina Sanguinis Christi Scuola dell Infanzia e Primaria Portici
 Istituto Paritario Regina Sanguinis Christi Scuola dell Infanzia e Primaria Portici PREMESSO CHE: Il Ministero dell Istruzione dell Università e della Ricerca e il Ministero della Salute hanno emanato
Istituto Paritario Regina Sanguinis Christi Scuola dell Infanzia e Primaria Portici PREMESSO CHE: Il Ministero dell Istruzione dell Università e della Ricerca e il Ministero della Salute hanno emanato
RICHIESTA DI PARERE SU SPERIMENTAZIONE CLINICA DI DISPOSITIVO MEDICO
 COMITATO ETICO INTERAZIENDALE (istituito con Delibera n. 236 del 10/09/13 e successiva Delibera n. 267 del 25/10/13 ed iscritto al Registro Regionale al n. 2) Sede: Via Venezia n.16, 15121 tel.0131206974-6651
COMITATO ETICO INTERAZIENDALE (istituito con Delibera n. 236 del 10/09/13 e successiva Delibera n. 267 del 25/10/13 ed iscritto al Registro Regionale al n. 2) Sede: Via Venezia n.16, 15121 tel.0131206974-6651
Studio SOUND. Sentinel node vs. Observation after axillary UltrasouND
 Studio SOUND Sentinel node vs. Observation after axillary UltrasouND Lo IEO pubblica una collana di Booklets al fine di aiutare il paziente a gestire eventuali problematiche (quali ad esempio le terapie
Studio SOUND Sentinel node vs. Observation after axillary UltrasouND Lo IEO pubblica una collana di Booklets al fine di aiutare il paziente a gestire eventuali problematiche (quali ad esempio le terapie
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
REGIONE DEL VENETO ISTITUTO ONCOLOGICO VENETO I.R.C.C.S. DELIBERAZIONE DEL DIRETTORE GENERALE N. 156 DEL 03/05/2013
 REGIONE DEL VENETO ISTITUTO ONCOLOGICO VENETO I.R.C.C.S. DELIBERAZIONE DEL DIRETTORE GENERALE N. 156 DEL 03/05/2013 OGGETTO: Approvazione del Contratto con Daiichi Sankyo Developmente Ltd per la realizzazione
REGIONE DEL VENETO ISTITUTO ONCOLOGICO VENETO I.R.C.C.S. DELIBERAZIONE DEL DIRETTORE GENERALE N. 156 DEL 03/05/2013 OGGETTO: Approvazione del Contratto con Daiichi Sankyo Developmente Ltd per la realizzazione
CONSIGLIO D EUROPA. Raccomanda ai Governi degli Stati membri :
 CONSIGLIO D EUROPA RACCOMANDAZIONE N. R (83) 10 DEL COMITATO DEI MINISTRI AGLI STATI MEMBRI RELATIVA ALLA PROTEZIONE DI DATI PERSONALI UTILIZZATI A FINI DI RICERCA SCIENTIFICA E DI STATISTICA (adottata
CONSIGLIO D EUROPA RACCOMANDAZIONE N. R (83) 10 DEL COMITATO DEI MINISTRI AGLI STATI MEMBRI RELATIVA ALLA PROTEZIONE DI DATI PERSONALI UTILIZZATI A FINI DI RICERCA SCIENTIFICA E DI STATISTICA (adottata
ESAMI DI CITOGENETICA ISTRUZIONI OPERATIVE PER ESECUZIONE PRELIEVI
 ESAMI DI CITOGENETICA ISTRUZIONI OPERATIVE PER ESECUZIONE PRELIEVI CENTRO PRELIEVI LABORATORIO CENTRALE- VIA SAN MASSIMO 10 AZIENDA OSPEDALIERA DI PADOVA ESAMI DI CITOGENETICA Esecuzione del Prelievo:
ESAMI DI CITOGENETICA ISTRUZIONI OPERATIVE PER ESECUZIONE PRELIEVI CENTRO PRELIEVI LABORATORIO CENTRALE- VIA SAN MASSIMO 10 AZIENDA OSPEDALIERA DI PADOVA ESAMI DI CITOGENETICA Esecuzione del Prelievo:
Il modulo integrativo sulla sicurezza del paziente
 Agenzia Nazionale per i Servizi Sanitari Regionali Ricerca Autofinanziata 2015 La valutazione partecipata del grado di umanizzazione delle strutture di ricovero Il modulo integrativo sulla sicurezza del
Agenzia Nazionale per i Servizi Sanitari Regionali Ricerca Autofinanziata 2015 La valutazione partecipata del grado di umanizzazione delle strutture di ricovero Il modulo integrativo sulla sicurezza del
Città di Bassano del Grappa. CONCORSO TRA I QUARTIERI 2017 È TEMPO DI METTERCI IL CUORE per la valorizzazione del territorio
 Città di Bassano del Grappa CONCORSO TRA I QUARTIERI 2017 È TEMPO DI METTERCI IL CUORE per la valorizzazione del territorio 1. Finalità e oggetto del concorso Il Comune di Bassano del Grappa, in collaborazione
Città di Bassano del Grappa CONCORSO TRA I QUARTIERI 2017 È TEMPO DI METTERCI IL CUORE per la valorizzazione del territorio 1. Finalità e oggetto del concorso Il Comune di Bassano del Grappa, in collaborazione
Allegato 1 al protocollo d intesa ANCI-Consulta nazionale dei CAF schema di convenzione Comune-CAF
 Allegato 1 al protocollo d intesa ANCI-Consulta nazionale dei CAF schema di convenzione Comune-CAF bonus tariffa sociale richiesta della tariffa sociale per la fornitura di energia elettrica e gas naturale
Allegato 1 al protocollo d intesa ANCI-Consulta nazionale dei CAF schema di convenzione Comune-CAF bonus tariffa sociale richiesta della tariffa sociale per la fornitura di energia elettrica e gas naturale
nato a (Prov )il nazione Residente in (Prov ) CAP Via/p.zza/loc n tel FAX CF via/p.zza/loc. n CAP COMUNICA (ai sensi della L.R. n.
 DENUNCIA DI INIZIO ATTIVITA per GUIDA AMBIENTALE 1 (PER I RESIDENTI O DOMICILIATI NEL NOSTRO COMUNE) n.2 copie in carta semplice entrambe con firma originale di cui una copia timbrata dovrà essere conservata
DENUNCIA DI INIZIO ATTIVITA per GUIDA AMBIENTALE 1 (PER I RESIDENTI O DOMICILIATI NEL NOSTRO COMUNE) n.2 copie in carta semplice entrambe con firma originale di cui una copia timbrata dovrà essere conservata
I cateteri SC sono compatibili con le pompe impiantabili Medtronic SynchroMed II e SynchroMed EL.
 Medtronic (Schweiz) AG Talstrasse 9 3053 Münchenbuchsee Tel. 031 868 01 00 Fax 031 868 01 99 swisscontact@medtronic.com www.medtronic.ch Agosto 2009 Ref: FA435 AVVISO DI SICUREZZA Cateteri intratecali
Medtronic (Schweiz) AG Talstrasse 9 3053 Münchenbuchsee Tel. 031 868 01 00 Fax 031 868 01 99 swisscontact@medtronic.com www.medtronic.ch Agosto 2009 Ref: FA435 AVVISO DI SICUREZZA Cateteri intratecali
Allegato 5 Definizione delle procedure operative in materia di accreditamento delle strutture formative della Regione Marche
 Allegato 5 Definizione delle procedure operative in materia di accreditamento delle strutture formative della Regione Marche Autocertificazione del mantenimento dei requisiti DAFORM Dispositivo di Accreditamento
Allegato 5 Definizione delle procedure operative in materia di accreditamento delle strutture formative della Regione Marche Autocertificazione del mantenimento dei requisiti DAFORM Dispositivo di Accreditamento
Criteri di partecipazione 5 Premi di categoria Premio per la Crescita del Profitto Premio per l Occupazione Premio per l Innovazione
 Criteri di partecipazione Il MoneyGram Award è dedicato agli Imprenditori Stranieri che dimostrano capacità di visione, coraggio e leadership nel fondare o condurre le proprie aziende in Italia. Inoltre,
Criteri di partecipazione Il MoneyGram Award è dedicato agli Imprenditori Stranieri che dimostrano capacità di visione, coraggio e leadership nel fondare o condurre le proprie aziende in Italia. Inoltre,
MODELLO DOMANDA DI CONTRIBUTO PER ASSISTENZA A FIGLI PORTATORI DI HANDICAP
 MODELLO 9004 2017 DOMANDA DI CONTRIBUTO PER ASSISTENZA A FIGLI PORTATORI DI HANDICAP -, Italia Contact Center 199.30.30.33 - www.enasarco.it INFORMAZIONI UTILI La domanda dovrà essere inviata entro e non
MODELLO 9004 2017 DOMANDA DI CONTRIBUTO PER ASSISTENZA A FIGLI PORTATORI DI HANDICAP -, Italia Contact Center 199.30.30.33 - www.enasarco.it INFORMAZIONI UTILI La domanda dovrà essere inviata entro e non
Fondazione Marzotto Via Petrarca, 1 Valdagno Tel. 0445/ del/della bambino/a CHIEDE
 Fondazione Marzotto Via Petrarca, 1 Valdagno Tel. 0445/423700 DOMANDA D ISCRIZIONE ALLA SCUOLA DELL INFANZIA (per facilitare l elaborazione dei dati e per evitare errori di comprensione si prega gentilmente
Fondazione Marzotto Via Petrarca, 1 Valdagno Tel. 0445/423700 DOMANDA D ISCRIZIONE ALLA SCUOLA DELL INFANZIA (per facilitare l elaborazione dei dati e per evitare errori di comprensione si prega gentilmente
Il Coordinamento della Ricerca 1 Corso ISG di Formazione per la Ricerca Clinica 28-Set-2015
 Qualità del dato e monitoraggio Il Coordinamento della Ricerca 1 Corso ISG di Formazione per la Ricerca Clinica 28-Set-2015 1 Qualità del dato 5.18.1b I dati riguardanti la sperimentazione debbono essere
Qualità del dato e monitoraggio Il Coordinamento della Ricerca 1 Corso ISG di Formazione per la Ricerca Clinica 28-Set-2015 1 Qualità del dato 5.18.1b I dati riguardanti la sperimentazione debbono essere
Dai colore alla vita Concorso di disegno per tutti i bambini delle scuole dell infanzia e primarie. Bando XIX edizione
 Dai colore alla vita Concorso di disegno per tutti i bambini delle scuole dell infanzia e primarie Bando XIX edizione La Fondazione Benedetta D Intino è lieta di dare vita alla XIX edizione del Concorso
Dai colore alla vita Concorso di disegno per tutti i bambini delle scuole dell infanzia e primarie Bando XIX edizione La Fondazione Benedetta D Intino è lieta di dare vita alla XIX edizione del Concorso
Agenzia Italiana del Farmaco
 Agenzia Italiana del Farmaco AREA PRODUZIONE E CONTROLLO Ufficio Autorizzazioni Officine IL DIRIGENTE VISTI gli articoli 8 e 9 del decreto legislativo 30 luglio 1999, n. 300 e s.m. i.; VISTO l articolo
Agenzia Italiana del Farmaco AREA PRODUZIONE E CONTROLLO Ufficio Autorizzazioni Officine IL DIRIGENTE VISTI gli articoli 8 e 9 del decreto legislativo 30 luglio 1999, n. 300 e s.m. i.; VISTO l articolo
Art. 1 Numero e tipologia delle borse
 Bando di concorso per il conferimento per l anno 2017 di una borsa di studio di 5.000,00 intitolata alla memoria del prof. FRANCESCO ILICETO, finanziata con i proventi derivanti dall Associazione Socio-Culturale
Bando di concorso per il conferimento per l anno 2017 di una borsa di studio di 5.000,00 intitolata alla memoria del prof. FRANCESCO ILICETO, finanziata con i proventi derivanti dall Associazione Socio-Culturale
Il/la sottoscritto/a nato/a a (Prov. ) il / / residente a Bonnanaro in via n. Codice fiscale tel In qualità di DESTINATARIO DEL BENEFICIO
 Al Comune di Bonnanaro Servizi Sociali Via Garibaldi N 6 07043 Bonnanaro Oggetto: DOMANDA DI PARTECIPAZIONE AL PROGRAMMA DI INTERVENTI DI CONTRASTO DELLE POVERTA ESTREME LINEA 2) Contributi relativi all
Al Comune di Bonnanaro Servizi Sociali Via Garibaldi N 6 07043 Bonnanaro Oggetto: DOMANDA DI PARTECIPAZIONE AL PROGRAMMA DI INTERVENTI DI CONTRASTO DELLE POVERTA ESTREME LINEA 2) Contributi relativi all
Il/La sottoscritto/a M/F Codice fiscale... nato/a il a... Dirigente/Amministratore della Società
 F.A.I.T. Fondo Assistenza Integrativa Torino Via Fanti 17 10128 Torino - Tel 011/57.18.435/397 E-Mail: fait@ui.torino.it Il/La sottoscritto/a... e-mail... nato/a il a... Dirigente/Amministratore della
F.A.I.T. Fondo Assistenza Integrativa Torino Via Fanti 17 10128 Torino - Tel 011/57.18.435/397 E-Mail: fait@ui.torino.it Il/La sottoscritto/a... e-mail... nato/a il a... Dirigente/Amministratore della
DOMANDA DI MEDIAZIONE (D.Lgs. 28/2010 e ss.mm.ii.)
 ASSOCIAZIONE NAZIONALE GEOMETRI CONSULENTI TECNICI, ARBITRI E MEDIATORI GEO-C.A.M. organismodimediazionegeocam@geo-cam.it - organismodimediazionegeocam@pec.it segreteria O.d.M. 393/8591921 SEZIONE DISTACCATA
ASSOCIAZIONE NAZIONALE GEOMETRI CONSULENTI TECNICI, ARBITRI E MEDIATORI GEO-C.A.M. organismodimediazionegeocam@geo-cam.it - organismodimediazionegeocam@pec.it segreteria O.d.M. 393/8591921 SEZIONE DISTACCATA
CONTENUTO DELLE INFORMAZIONI AI SOGGETTI ai sensi del D.M. 21 dicembre 2007 (G.U. n. 53 del 3 marzo 2008)
 CONTENUTO DELLE INFORMAZIONI AI SOGGETTI ai sensi del D.M. 21 dicembre 2007 (G.U. n. 53 del 3 marzo 2008) Tutte le informazioni relative alla sperimentazione devono essere fornite al soggetto e/o ai genitori/al
CONTENUTO DELLE INFORMAZIONI AI SOGGETTI ai sensi del D.M. 21 dicembre 2007 (G.U. n. 53 del 3 marzo 2008) Tutte le informazioni relative alla sperimentazione devono essere fornite al soggetto e/o ai genitori/al
CONVENZIONE PER LO SVOLGIMENTO DELLE ATTIVITÀ DI TIROCINIO PROFESSIONALIZZANTE TRA L
 CONVENZIONE PER LO SVOLGIMENTO DELLE ATTIVITÀ DI TIROCINIO PROFESSIONALIZZANTE TRA L Ordine degli psicologi della Regione Puglia, d ora in poi denominato soggetto promotore, rappresentato dal Presidente,
CONVENZIONE PER LO SVOLGIMENTO DELLE ATTIVITÀ DI TIROCINIO PROFESSIONALIZZANTE TRA L Ordine degli psicologi della Regione Puglia, d ora in poi denominato soggetto promotore, rappresentato dal Presidente,
FAC SIMILE documento riepilogativo MODULO DI DOMANDA - SETTORE AGRICOLTURA DATI IDENTIFICATIVI DELL IMPRESA RICHIEDENTE:
 CODICE DOMANDA BANDO PER IL SOSTEGNO AL MIGLIORAMENTO DELLE CONDIZIONI DI SALUTE E SICUREZZA SUL LAVORO, CON PARTICOLARE RIFERIMENTO ALL INNOVAZIONE TECNOLOGICA in attuazione dell articolo 11, comma 5,
CODICE DOMANDA BANDO PER IL SOSTEGNO AL MIGLIORAMENTO DELLE CONDIZIONI DI SALUTE E SICUREZZA SUL LAVORO, CON PARTICOLARE RIFERIMENTO ALL INNOVAZIONE TECNOLOGICA in attuazione dell articolo 11, comma 5,
Domanda di conciliazione in ambito di responsabilità professionale medica
 Domanda di conciliazione in ambito di responsabilità professionale medica ai sensi dell art. 4/bis della legge provinciale 5 marzo 2001, n. 7, e successive modifiche, e del decreto del Presidente della
Domanda di conciliazione in ambito di responsabilità professionale medica ai sensi dell art. 4/bis della legge provinciale 5 marzo 2001, n. 7, e successive modifiche, e del decreto del Presidente della
