Promotore: Prof. Alessandro Gringeri. Sperimentatore principale: Prof. Alessandro Gringeri
|
|
|
- Roberta Massa
- 6 anni fa
- Visualizzazioni
Transcript
1 NOTA INFORMATIVA E CONSENSO INFORMATO PERLA PARTECIPAZIONE ALLO STUDIO RESIST EXPERIENCED (REScue Immunotolerance STudy Experienced Patients) PAZIENTE ADULTO Studio di induzione della tolleranza immunologica nei pazienti affetti da emofilia grave di tipo A con inibitore in seguito all insuccesso di una precedente induzione della tolleranza immunologica con concentrati di FVIII senza fattore Von Willebrand. Promotore: Prof. Alessandro Gringeri Sperimentatore principale: Prof. Alessandro Gringeri La invitiamo a partecipare a una ricerca biomedica organizzata, in qualità di promotore, dal Centro Emofilia Angelo Bianchi Bonomi, Dipartimento di Medicina e Specialità Mediche, IRCCS Fondazione Ospedale Maggiore Policlinico Mangiagalli e Regina Elena, Via Pace, 9 Milano. Prima di decidere di dare il Suo consenso alla partecipazione allo studio è molto importante che Lei capisca i motivi alla base della ricerca e le implicazioni future. Legga attentamente la seguente nota informativa e chieda informazioni sui punti che non Le sono chiari. AMBITO DI INTERESSE DELLO STUDIO Il Suo medico Le propone di partecipare al presente studio in quanto Lei è affetto da emofilia grave di tipo A con inibitore. Questo inibitore impedisce l efficacia della perfusione di fattore VIII (FVIII) rendendo quindi molto difficile il trattamento. La comparsa di questo inibitore è una complicanza seria e potenzialmente gravissima dell Emofilia. Deve essere trattata appena possibile. Lei è già stato sottoposto a un trattamento di induzione della tolleranza immunologica a base di concentrati di fattore VIII non contenenti il fattore Von Willebrand, ma il suo inibitore del FVIII non è scomparso oppure è ricomparso dopo un po di tempo. È quindi necessario risottoporla a un trattamento per tentare di eliminarlo. Sono invitati a partecipare allo studio i pazienti adulti e bambini di Paesi Europei ed Extra-Europei. Lo studio di induzione della tolleranza immunologica (RESIST- Experienced) è organizzato da sperimentatori internazionali. OBIETTIVO DELLO STUDIO Esistono 2 tipi di concentrati di fattore VIII: i concentrati di fattore VIII di origine plasmatica umana che contengono il fattore Von Willebrand e i concentrati di fattore VIII ricombinante che non contengono quest altro fattore della coagulazione. Queste 2 famiglie di concentrati vengono comunemente utilizzate per le induzioni della tolleranza immunologica nei pazienti affetti da emofilia di tipo A. Si è ipotizzato che i concentrati derivanti dal plasma dei donatori e contenenti il fattore Von Willebrand potrebbero migliorare i risultati di tolleranza immunologica nell organismo. L obiettivo principale del presente studio è verificare, attraverso uno studio scientifico, la veridicità di tale ipotesi, allo scopo di migliorare la cura dei pazienti affetti da emofilia grave di tipo A con un inibitore al momento del trattamento di induzione della tolleranza immunologica. Per questo, a tutti i pazienti che partecipano al presente studio sarà somministrata la stessa dose di concentrati di fattore VIII plasmatico.
2 SVOLGIMENTO DELLO STUDIO Il presente studio osserverà la capacità dei concentrati di fattore VIII plasmatico somministrati a una dose elevata (200 unità/kg/die) di indurre una tolleranza immunologica nei pazienti a cui sono già stati somministrati in precedenza i concentrati di fattore VIII ricombinante. Esistono diverse specialità commerciali di questi concentrati. Sarà il Suo medico, in accordo con Lei, a decidere quella che Le verrà assegnata per tutta la durata dello studio. La durata massima del trattamento di induzione della tolleranza immunologica nel presente studio è di 33 mesi. Dopo l ottenimento della tolleranza immunologica, Lei verrà sottoposto a un follow-up nei 12 mesi successivi per monitorare il rischio di ricaduta. Lei sarà seguito dal proprio medico presso il Centro di emofilia 1 volta al mese per tutta la durata dello studio; un campione di sangue (10 ml, circa 2 cucchiaini da te) sarà preso all inizio e alla fine dello studio, e un campione di 3.5 ml ogni mese. Inoltre, un prelievo di 5 ml sarà effettuato una volta durante il periodo di trattamento per i test genetici (per studiare i fattori che potenzialmente possono essere legati alla risposta di terapia di immunotolleranza). Alla scomparsa dell inibitore saranno effettuati esami del sangue più precisi: un test di recupero con un iniezione da 50 unità/kg e dosaggio del fattore VIII sanguigno a 15 e 30 minuti (5 ml ogni prelievo) dopo l iniezione e successivamente, se i risultati sono normali, un test di farmacocinetica con dosaggio del FVIII sanguigno fino a 48 ore (secondo le modalità convenzionali di farmacocinetica, 15 minuti dopo l iniezione e poi dopo 1h, 2h, 4h, 6h, 24h e 48h. Otto prelievi in totale, ovvero 40 ml di sangue). Questi stessi esami verranno ripetuti nell anno di monitoraggio di eventuali ricadute. RISCHI POTENZIALI Per poter effettuare quotidianamente l iniezione di fattore VIII per diversi mesi di seguito per una durata totale che può arrivare fino a 33 mesi, è probabile che il Suo medico le proponga l applicazione di un catetere venoso centrale. Anche l applicazione di questo dispositivo è una procedura abituale e dipende soprattutto dalle condizioni delle Sue vene periferiche. L inserimento di un catetere venoso centrale è una procedura chirurgica realizzata in anestesia generale ed essendo un intervento chirurgico comporta quindi qualche rischio. Il rischio principale è l eventuale infezione, che richiederebbe il trattamento con antibiotici o l asportazione e la conseguente necessità di reinserire un dispositivo nuovo. Infine, rare complicazioni tromboemboliche sono state osservate in pazienti a rischio di trombosi in presenza di alti livelli di fattore VIII nel sangue. Il medico ha stabilito che Lei non è soggetto a tale rischio. TRATTAMENTO ALTERNATIVO L induzione della tolleranza immunologica è il trattamento convenzionale dei pazienti che hanno sviluppato un inibitore del fattore VIII. Per il momento non esiste una procedura unica ma lo schema generale per l induzione della tolleranza immunologica e per il relativo follow-up è sempre lo stesso. Lo scopo di altri studi in corso (soprattutto l ITI Study) è quello di valutare se dosi diverse di prodotto e la cadenza delle iniezioni migliorano i risultati in termini di scomparsa dell inibitore. Nel caso in cui decidesse di non partecipare allo studio, Lei verrà sottoposto a un induzione dell Immunotolleranza nell ambito dei trattamenti convenzionali. Sia che partecipiate o meno allo studio, in caso di emorragia attiva non controllata dal Suo trattamento con concentrato di FVIII, Lei verrà trattato con altri fattori di coagulazione aventi un attività bypassante l inibitore del FVIII. POSSIBILI BENEFICI DELLO STUDIO Non è possibile garantirle o prometterle un beneficio diretto derivante dalla partecipazione al presente studio. Tuttavia le informazioni che saranno fornite dallo studio consentiranno un progresso nelle modalità di
3 trattamento dei pazienti che in futuro avranno bisogno di una tolleranza immunologica permettendo di sapere se una strategia terapeutica che si basa unicamente sulla famiglia di prodotti utilizzati è migliore dell altra. RAPPORTO RISCHI/BENEFICI Di conseguenza, il rapporto rischi/benefici del presente studio, che Le consente di essere sottoposto a una nuova induzione della tolleranza immunologica con i prodotti plasmatici questa volta non comporta rischi particolari rispetto ai trattamenti convenzionali (prodotti utilizzati, catetere, metodo di conduzione dell induzione della tolleranza immunologica, durata del trattamento, monitoraggio clinico e biologico, criteri di successo) ma può migliorare le probabilità di scomparsa dell inibitore del fattore VIII. COMUNICAZIONE DI NUOVE INFORMAZIONI Lei sarà informato di qualsiasi nuova informazione relativa al presente studio che potrebbe influenzare la Sua decisione di proseguire o meno la partecipazione allo studio e dovrà firmare un nuovo modulo di consenso. Allo stesso modo, in ottemperanza alla legge del 4 marzo 2002 relativa ai diritti dei pazienti, sarà informato dei risultati globali dello studio, una volta terminato. PARTECIPAZIONE La Sua partecipazione al presente studio è completamente volontaria. Inoltre, ha il diritto di ritirarsi dallo studio in qualsiasi momento e senza dover fornire spiegazioni. Il rifiuto o l interruzione della partecipazione non pregiudicheranno i rapporti con il Suo medico del Centro di emofilia. Anche le Autorità Sanitarie Europee (EMEA) e Nazionali, il Promotore del presente studio (IRCCS Fondazione Ospedale Maggiore Policlinico Mangiagalli e Regina Elena, Via Pace, 9 MILANO), il gruppo di medici organizzatori dello studio e del comitato di controllo della sicurezza o il Suo medico del Centro di emofilia hanno il diritto di bloccare lo studio, senza richiedere il Suo consenso, nel caso lo reputassero necessario nell interesse dei pazienti oppure nel caso in cui la procedura dello studio non venisse rispettata. Se venisse presa una decisione di questo tipo, Lei ne sarà tempestivamente informato e Le sarà comunque fornito il trattamento adeguato. DISPOSIZIONI LEGALI Lo studio verrà condotto in conformità con le norme di Buona pratica clinica e con la Dichiarazione di Helsinki. A garanzia della sicurezza del presente studio viene adottata ogni ragionevole precauzione. In qualità di promotore del presente studio, il Centro Angeli Bianchi Bonomi di Milano ha stipulato ha appositamente stipulato la polizza assicurativa Fondazione I.R.C.C.S. Ospedale Maggiore Policlinico "Mangiagalli e Regina Elena", che garantisce la responsabilità civile e consente di coprire i partecipanti al presente studio clinico in caso di qualsiasi danno derivante dalla partecipazione ad n esso. RISERVATEZZA DELLE INFORMAZIONI RACCOLTE Tutti i Suoi dati medici raccolti nel corso del presente studio saranno conservati in forma strettamente riservata. Per garantire l anonimato, nei documenti relativi allo studio tali dati saranno identificati dal Suo Centro di trattamento dell emofilia con un numero e con le Sue iniziali. Questo vale anche per le informazioni trasmesse elettronicamente (attraverso Internet al centro di coordinamento dello studio): i dati saranno trasmessi in formato criptato attraverso una linea Internet dedicata, bloccata, che utilizza diversi codici cifrati e altri dispositivi di sicurezza specifici per la trasmissione dei dati medici. I dati dello studio così raccolti saranno affidati agli organizzatori per essere analizzati e soddisfare così l obiettivo dello studio. I rappresentanti dell Agenzia europea per la valutazione dei farmaci (EMEA), dell Agenzia Italiana del Farmaco o di altre autorità competenti, il Promotore dello studio o i suoi rappresentanti, potranno esaminare e copiare i dati medici qualora dovessero ritenerlo necessario. I risultati saranno oggetto di pubblicazione in relazione allo studio, ma la Sua identità non sarà rivelata in nessun caso.
4 Lei dispone inoltre di un diritto di accesso, di verifica e di opposizione alla trasmissione dei dati coperti dal segreto professionale utilizzabili nell ambito del presente studio. Tali diritti possono essere esercitati presso il medico che La segue nell ambito del presente studio e che è a conoscenza della Sua identità.
5 CONTATTI Per eventuali domande in merito allo studio o ai Suoi diritti, o in caso di problemi legati allo studio, contatti i medici responsabili della sperimentazione del Suo Centro di trattamento dell emofilia: il Professor Alessandro Gringeri, al seguente n. di telefono : , Eventuali commenti, domande e qualsiasi forma di richiesta sono ben accetti. Per maggiori informazioni, non esiti a contattare il personale del centro di emofilia o il Professor Gringeri.
6 CONSENSO INFORMATO PER LA PARTECIPAZIONE ALLO STUDIO RESIST-EXPERIENCED PAZIENTE ADULTO (REScue Immunotolerance STudy Experienced Patients ) Studio di induzione della tolleranza immunologica nei pazienti affetti da emofilia grave di tipo A con inibitore in seguito all insuccesso di una precedente induzione della tolleranza immunologica con concentrati di FVIII senza fattore Von Willebrand. 1. Confermo di aver letto e compreso la nota informativa relativa allo studio sopra riportato e di aver avuto modo di porre domande al medico sperimentatore. 2. Ho capito che la mia partecipazione è volontaria e che sono libero di ritirare il mio consenso in qualsiasi momento presso il medico sperimentatore, per qualsivoglia ragione, senza che siano compromessi i miei trattamenti medici e i miei diritti legali. 3. Sono a conoscenza del fatto che i dati di carattere medico saranno trattati nel più totale anonimato sin dall inserimento nello studio. Autorizzo l accesso a tali dati a coloro che lavorano al presente studio. 4. Firmando il modulo di consenso, accetto di partecipare allo studio RESIST- Experienced 5. Sono d accordo/non sono d accordo (si prega di scegliere l opzione desiderata) che i miei campioni di sangue potranno essere conservati e utilizzati per ricerche future compresi eventuali test genetici. Sarò sempre contattato per ogni futura ricerca che possa implicare l uso di un mio campione di sangue al fine di approvare l utilizzo di tale campione con il consenso informato CONSENSO INFORMATO PER LA PARTECIPAZIONE ALLO STUDIO RESIST-EXPERIENCED PAZIENTE ADULTO ILPAZIENTE : Io sottoscritto/a (COGNOME e NOME) partecipare volontariamente allo studio denominato RESIST- Experienced., dichiaro di accettare di [Luogo] Data (gg/mm/aa): Firma del paziente: IL MEDICO SPERIMENTATORE: Io sottoscritto/a Dott/Dott.ssa (COGNOME e NOME) attesto di aver spiegato al/alla paziente firmatario/a lo scopo, le modalità e i potenziali rischi del presente studio e di aver risposto alle domande postemi. [Luogo] Data (gg/mm/aa): Firma del medico:
NOTA INFORMATIVA E CONSENSO INFORMATO PER LA PARTECIPAZIONE ALLO STUDIO RESIST- EXPERIENCED PER I TITOLARI DELLA POTESTÀ GENITORIALE SU UN MINORE
 NOTA INFORMATIVA E CONSENSO INFORMATO PER LA PARTECIPAZIONE ALLO STUDIO RESIST- EXPERIENCED PER I TITOLARI DELLA POTESTÀ GENITORIALE SU UN MINORE (REScue Immunotolerance STudy Experienced Patients) Studio
NOTA INFORMATIVA E CONSENSO INFORMATO PER LA PARTECIPAZIONE ALLO STUDIO RESIST- EXPERIENCED PER I TITOLARI DELLA POTESTÀ GENITORIALE SU UN MINORE (REScue Immunotolerance STudy Experienced Patients) Studio
Promotore: Prof. Alessandro Gringeri Fondazione I.R.C.C.S. Ospedale Maggiore Policlinico "Mangiagalli e Regina Elena" Bonomi" Via Pace, Milano
 NOTA INFORMATIVA E CONSENSO INFORMATO PER LA PARTECIPAZIONE ALLO STUDIO RESIST- NAÏVE PER I TITOLARI DELLA POTESTÀ GENITORIALE SU UN MINORE (REScue Immunotolerance STudy in ITI-Naïve patients) Studio randomizzato
NOTA INFORMATIVA E CONSENSO INFORMATO PER LA PARTECIPAZIONE ALLO STUDIO RESIST- NAÏVE PER I TITOLARI DELLA POTESTÀ GENITORIALE SU UN MINORE (REScue Immunotolerance STudy in ITI-Naïve patients) Studio randomizzato
Informazione e dichiarazione di consenso per i partecipanti allo Studio svizzero di coorte HIV. Riassunto
 Gentile paziente, Informazione e dichiarazione di consenso per i partecipanti allo Studio svizzero di coorte HIV La invitiamo a partecipare allo Studio svizzero di coorte HIV (SHCS). Lo scopo degli studi
Gentile paziente, Informazione e dichiarazione di consenso per i partecipanti allo Studio svizzero di coorte HIV La invitiamo a partecipare allo Studio svizzero di coorte HIV (SHCS). Lo scopo degli studi
Informazione per il paziente. Raccolta di dati clinici di pazienti con tumore cerebrale per il gruppo cooperativo svizzero per lo studio del glioma
 Informazione per il paziente Raccolta di dati clinici di pazienti con tumore cerebrale per il gruppo cooperativo svizzero per lo studio del glioma Gentile Signora, gentile Signore, prenda il tempo necessario
Informazione per il paziente Raccolta di dati clinici di pazienti con tumore cerebrale per il gruppo cooperativo svizzero per lo studio del glioma Gentile Signora, gentile Signore, prenda il tempo necessario
La protezione dei soggetti ed il consenso informato
 La protezione dei soggetti ed il consenso informato Marco Ercolani, MD Trieste, 21 maggio 2008 Definizione di Consenso Informato (GCP) Procedura secondo la quale un soggetto accetta volontariamente di
La protezione dei soggetti ed il consenso informato Marco Ercolani, MD Trieste, 21 maggio 2008 Definizione di Consenso Informato (GCP) Procedura secondo la quale un soggetto accetta volontariamente di
Guida per i parenti e le persone di supporto. Possiamo sciogliere l'amiloidosi AL?
 Guida per i parenti e le persone di supporto Possiamo sciogliere l'amiloidosi AL? Grazie per il Suo interesse Cosa sono gli studi di ricerca clinica? Le è stato fornito il presente opuscolo perché qualcuno
Guida per i parenti e le persone di supporto Possiamo sciogliere l'amiloidosi AL? Grazie per il Suo interesse Cosa sono gli studi di ricerca clinica? Le è stato fornito il presente opuscolo perché qualcuno
FOGLIO INFORMATIVO E CONSENSO INFORMATO PER GASTROSCOPIA DIAGNOSTICA E TERAPEUTICA.
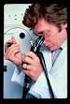 FOGLIO INFORMATIVO E CONSENSO INFORMATO PER GASTROSCOPIA DIAGNOSTICA E TERAPEUTICA. Gentile Paziente, La gastroscopia è un esame endoscopico che permette la visualizzazione della mucosa dell esofago, dello
FOGLIO INFORMATIVO E CONSENSO INFORMATO PER GASTROSCOPIA DIAGNOSTICA E TERAPEUTICA. Gentile Paziente, La gastroscopia è un esame endoscopico che permette la visualizzazione della mucosa dell esofago, dello
DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE
 DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE Istruzioni per la compilazione Per la corretta esecuzione della manovra e per
DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE Istruzioni per la compilazione Per la corretta esecuzione della manovra e per
MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE DOMINANTI DI DEGENERAZIONE LOBARE FRONTOTEMPORALE
 Titolo del Progetto: NETWORK ITALIA PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER E DI DEGENERAZIONE LOBARE FRONTOTEMPORALE MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE
Titolo del Progetto: NETWORK ITALIA PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER E DI DEGENERAZIONE LOBARE FRONTOTEMPORALE MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE
Il processo del consenso informato
 Oncology Business Unit - GMO Il processo del consenso informato Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016 Definizione del consenso informato LINEE GUIDA PER LA BUONA PRATICA
Oncology Business Unit - GMO Il processo del consenso informato Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016 Definizione del consenso informato LINEE GUIDA PER LA BUONA PRATICA
N cartella N ricovero Cognome Nome Data di nascita DICHIARAZIONE DI AVVENUTA INFORMAZIONE ED ESPRESSIONE DEL CONSENSO A TRATTAMENTO CHEMIOTERAPICO
 Io sottoscritto/a, nato/a il a nel pieno possesso delle mie facoltà dichiaro di essere stato/a informato/a in modo dettagliato, chiaro e comprensibile, dal Dottor, sui seguenti punti: 1. diagnosi : La
Io sottoscritto/a, nato/a il a nel pieno possesso delle mie facoltà dichiaro di essere stato/a informato/a in modo dettagliato, chiaro e comprensibile, dal Dottor, sui seguenti punti: 1. diagnosi : La
UNIVERSITÁ DEGLI STUDI MAGNA GRÆCIA DI CATANZARO
 SCHEDA INFORMATIVA E DICHIARAZIONE DI CONSENSO (per soggetti capace di fornire personalmente il consenso) SCHEDA INFORMATIVA Gentile Signora/e, In questa Azienda Ospedaliera è in programma una ricerca
SCHEDA INFORMATIVA E DICHIARAZIONE DI CONSENSO (per soggetti capace di fornire personalmente il consenso) SCHEDA INFORMATIVA Gentile Signora/e, In questa Azienda Ospedaliera è in programma una ricerca
INFORMATIVA AL PAZIENTE
 CEI FONDAZIONE PTV POLICLINICO TOR VERGATA SOP Procedure Operative Standard INFORMATIVA AL PAZIENTE Nessuna delle informazioni orali e scritte concernenti lo studio, compreso il modulo di consenso informato
CEI FONDAZIONE PTV POLICLINICO TOR VERGATA SOP Procedure Operative Standard INFORMATIVA AL PAZIENTE Nessuna delle informazioni orali e scritte concernenti lo studio, compreso il modulo di consenso informato
L IMMUNOTOLLERANZA RESCUE NEL BAMBINO CON EMOFILIA. Padova 13/14 maggio Chiara Biasoli Centro Emofilia Cesena
 L IMMUNOTOLLERANZA RESCUE NEL BAMBINO CON EMOFILIA Padova 13/14 maggio Chiara Biasoli Centro Emofilia Cesena Raccomandazioni AICE Obiettivo primario eradicazione Bambini principali candidati Intrapresa
L IMMUNOTOLLERANZA RESCUE NEL BAMBINO CON EMOFILIA Padova 13/14 maggio Chiara Biasoli Centro Emofilia Cesena Raccomandazioni AICE Obiettivo primario eradicazione Bambini principali candidati Intrapresa
INFORMATIVA PER IL PAZIENTE
 INFORMATIVA PER IL PAZIENTE (Mod. Versione 4 del 27 maggio 2013) 1) Finalità del trattamento dei dati personali Diagnosi e cura dei tumori rari. Ricerca retrospettiva e/o traslazionale sui tumori rari.
INFORMATIVA PER IL PAZIENTE (Mod. Versione 4 del 27 maggio 2013) 1) Finalità del trattamento dei dati personali Diagnosi e cura dei tumori rari. Ricerca retrospettiva e/o traslazionale sui tumori rari.
Pediatria Preventiva e Sociale
 Gli antibiotici sono farmaci molto potenti, ma possono non funzionare o diventare perfino dannosi qualora non vengano utilizzati in modo corretto. E quindi molto importante che vengano somministrati soltanto
Gli antibiotici sono farmaci molto potenti, ma possono non funzionare o diventare perfino dannosi qualora non vengano utilizzati in modo corretto. E quindi molto importante che vengano somministrati soltanto
Facsimile. prelievo di sangue (per analisi cliniche di laboratorio e per l estrazione di DNA)
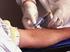 Consenso informato Dichiaro di aver preso visione del filmato informativo e di avere letto le informazioni inviatemi a casa. Mi è stato spiegato e mi è chiaro lo svolgimento, lo scopo e i rischi connessi
Consenso informato Dichiaro di aver preso visione del filmato informativo e di avere letto le informazioni inviatemi a casa. Mi è stato spiegato e mi è chiaro lo svolgimento, lo scopo e i rischi connessi
PROCEDURE PER IL PRELIEVO BIOLOGICO
 Istituto di Ricerche Farmacologiche Mario Negri Milano 13 Aprile 2010 SOTTOPROGETTO ANALISI GENOME-WIDE PROCEDURE PER IL PRELIEVO BIOLOGICO 1 ORA CHE MI SONO CHIARI GLI OBIETTIVI COSA E COME CHE COSA DEVO
Istituto di Ricerche Farmacologiche Mario Negri Milano 13 Aprile 2010 SOTTOPROGETTO ANALISI GENOME-WIDE PROCEDURE PER IL PRELIEVO BIOLOGICO 1 ORA CHE MI SONO CHIARI GLI OBIETTIVI COSA E COME CHE COSA DEVO
Informazione per pazienti e familiari. La Ricerca e gli Studi Clinici
 Informazione per pazienti e familiari La Ricerca e gli Studi Clinici Introduzione L Azienda Ospedaliera di Reggio Emilia (ASMN) è un Istituto di Ricovero e Cura a Carattere Scientifico (IRCCS) nell ambito
Informazione per pazienti e familiari La Ricerca e gli Studi Clinici Introduzione L Azienda Ospedaliera di Reggio Emilia (ASMN) è un Istituto di Ricovero e Cura a Carattere Scientifico (IRCCS) nell ambito
Responsabile Centro Emofilia Sapienza Università di Roma; Associazione Italiana Centri Emofilia, AICE EMOFILIA: PERCORSI INTEGRATI DI CURA
 PROF.SSA MARIA GABRIELLA MAZZUCCONI Responsabile Centro Emofilia Sapienza Università di Roma; Associazione Italiana Centri Emofilia, AICE EMOFILIA: PERCORSI INTEGRATI DI CURA L emofilia, come le altre
PROF.SSA MARIA GABRIELLA MAZZUCCONI Responsabile Centro Emofilia Sapienza Università di Roma; Associazione Italiana Centri Emofilia, AICE EMOFILIA: PERCORSI INTEGRATI DI CURA L emofilia, come le altre
Altre patologie di rilievo :
 In data da parte del personale della U.O.C. di Diagnostica per Immagini di qeusto Istituto, mi è stata consegnata copia del presente modulo al fine di consentire un attenta lettura e valutazione di quanto
In data da parte del personale della U.O.C. di Diagnostica per Immagini di qeusto Istituto, mi è stata consegnata copia del presente modulo al fine di consentire un attenta lettura e valutazione di quanto
Le informazioni contenute nei moduli suddetti devono essere complete, chiare e comprensibili.
 SEDE LEGALE: Udine - Via Pozzuolo 330 Centralino: +39 0432 554160 Fax: +39 0432 306241 C.F./P.IVA 02801630308 e mail: segreteria@egas.sanita.fvg.it - PEC:egas.protgen@certsanita.fvg.it COMITATO ETICO UNICO
SEDE LEGALE: Udine - Via Pozzuolo 330 Centralino: +39 0432 554160 Fax: +39 0432 306241 C.F./P.IVA 02801630308 e mail: segreteria@egas.sanita.fvg.it - PEC:egas.protgen@certsanita.fvg.it COMITATO ETICO UNICO
RICERCA E SVILUPPO DI NUOVI FARMACI
 RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
MODULO DI CONSENSO ALLA GASTROSCOPIA
 Ospedale San Donato - Arezzo Servizio di Endoscopia Digestiva MODULO DI CONSENSO ALLA GASTROSCOPIA Gentile Signore/a, attraverso l'opuscolo informativo che le è stato consegnato ha potuto conoscere le
Ospedale San Donato - Arezzo Servizio di Endoscopia Digestiva MODULO DI CONSENSO ALLA GASTROSCOPIA Gentile Signore/a, attraverso l'opuscolo informativo che le è stato consegnato ha potuto conoscere le
COMITATO ETICO PROVINCIALE DI BRESCIA ISTRUZIONI PER LA REDAZIONE DEI CONSENSI E DELLE INFORMATIVE OLTRE ALLE INDICAZIONI CONTENUTE NELLE GCP
 COMITATO ETICO PROVINCIALE DI BRESCIA ISTRUZIONI PER LA REDAZIONE DEI CONSENSI E DELLE INFORMATIVE OLTRE ALLE INDICAZIONI CONTENUTE NELLE GCP PER TUTTI GLI STUDI ISTRUZIONI PER LA FORMULAZIONE DEL CONSENSO
COMITATO ETICO PROVINCIALE DI BRESCIA ISTRUZIONI PER LA REDAZIONE DEI CONSENSI E DELLE INFORMATIVE OLTRE ALLE INDICAZIONI CONTENUTE NELLE GCP PER TUTTI GLI STUDI ISTRUZIONI PER LA FORMULAZIONE DEL CONSENSO
MODELLO DI COMUNICAZIONE AL RICHIEDENTE DELLA DECISIONE DEL COMITATO ETICO RELATIVA AL PARERE UNICO 1
 Appendice 6 MODELLO DI COMUNICAZIONE AL RICHIEDENTE DELLA DECISIONE DEL COMITATO ETICO RELATIVA AL PARERE UNICO 1 Il presente parere del comitato etico è stato compilato e stampato dal sito internet dell
Appendice 6 MODELLO DI COMUNICAZIONE AL RICHIEDENTE DELLA DECISIONE DEL COMITATO ETICO RELATIVA AL PARERE UNICO 1 Il presente parere del comitato etico è stato compilato e stampato dal sito internet dell
AULA GIALLA STUDI CLINICI IN CORSO
 Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche AULA GIALLA STUDI CLINICI IN CORSO Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica,
Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche AULA GIALLA STUDI CLINICI IN CORSO Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica,
L EMOFILIA. Che cos è
 L EMOFILIA Che cos è L emofilia è una malattia rara di origine genetica che colpisce soprattutto i maschi. Se in un individuo sano la fuoriuscita di sangue dai vasi sanguigni si arresta rapidamente, chi
L EMOFILIA Che cos è L emofilia è una malattia rara di origine genetica che colpisce soprattutto i maschi. Se in un individuo sano la fuoriuscita di sangue dai vasi sanguigni si arresta rapidamente, chi
CONSENSO ALL ESECUZIONE DI TEST GENETICI
 CONSENSO ALL ESECUZIONE DI TEST GENETICI Io sottoscritto/a............................................................................ nato/a a.................................... (...... ) il....................................
CONSENSO ALL ESECUZIONE DI TEST GENETICI Io sottoscritto/a............................................................................ nato/a a.................................... (...... ) il....................................
Direttore Sanitario: Dr.ssa Silvia Campagnari MAMMOGRAFIA
 Direttore Sanitario: Dr.ssa Silvia Campagnari MAMMOGRAFIA INFORMAZIONI COS E E un indagine che utilizza radiazioni ionizzanti (Raggi X), a basso dosaggio, per la diagnosi della patologia mammaria. Poiché
Direttore Sanitario: Dr.ssa Silvia Campagnari MAMMOGRAFIA INFORMAZIONI COS E E un indagine che utilizza radiazioni ionizzanti (Raggi X), a basso dosaggio, per la diagnosi della patologia mammaria. Poiché
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante
 Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
CARTA INTESTATA DEL CENTRO
 CARTA INTESTATA DEL CENTRO Sede, Data Al Comitato Etico Unico Regionale Del Friuli Venezia Giulia c/o Direzione Scientifica CRO Aviano Alla Direzione Generale Azienda (DA COMPLETARE) OGGETTO: Dichiarazione
CARTA INTESTATA DEL CENTRO Sede, Data Al Comitato Etico Unico Regionale Del Friuli Venezia Giulia c/o Direzione Scientifica CRO Aviano Alla Direzione Generale Azienda (DA COMPLETARE) OGGETTO: Dichiarazione
INDICAZIONI CENTRO SPECIFICHE relative al CONSENSO INFORMATO in STUDI CLINICI
 COMITATO ETICO dell IDI-IRCCS INDICAZIONI CENTRO SPECIFICHE relative al CONSENSO INFORMATO in STUDI CLINICI 1/7 Indicazioni per l utilizzo di versioni modificate del modulo di consenso informato N.B.:
COMITATO ETICO dell IDI-IRCCS INDICAZIONI CENTRO SPECIFICHE relative al CONSENSO INFORMATO in STUDI CLINICI 1/7 Indicazioni per l utilizzo di versioni modificate del modulo di consenso informato N.B.:
AULA ROSSA STUDI CLINICI IN CORSO
 Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche AULA ROSSA STUDI CLINICI IN CORSO Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica,
Terza Giornata Fiorentina dedicata ai pazienti con malattie mieloproliferative croniche AULA ROSSA STUDI CLINICI IN CORSO Che cosa è uno studio clinico e a cosa serve? Si definisce sperimentazione clinica,
EMOFILIA A. Quale impatto e quali soluzioni terapeutiche
 EMOFILIA A Quale impatto e quali soluzioni terapeutiche BIBLIOTECA DEL SENATO GIOVANNI SPADOLINI SALA DEGLI ATTI PARLAMENTARI Piazza della Minerva, 38 - Roma Con il Patrocinio di ISTITUTO SUPERIORE DI
EMOFILIA A Quale impatto e quali soluzioni terapeutiche BIBLIOTECA DEL SENATO GIOVANNI SPADOLINI SALA DEGLI ATTI PARLAMENTARI Piazza della Minerva, 38 - Roma Con il Patrocinio di ISTITUTO SUPERIORE DI
SINOSSI. Titolo. Coordinatori e Promotori dello studio
 SINOSSI Titolo PLERIXAFOR (PLX) IN MODALITA ON DEMAND PER LA RACCOLTA DI CELLULE STAMINALI EMOPOIETICHE AUTOLOGHE IN PAZIENTI AFFETTI DA MIELOMA MULTIPLO DA LINFOMA CHE MOSTRINO POVERA MOBILIZZAZIONE DOPO
SINOSSI Titolo PLERIXAFOR (PLX) IN MODALITA ON DEMAND PER LA RACCOLTA DI CELLULE STAMINALI EMOPOIETICHE AUTOLOGHE IN PAZIENTI AFFETTI DA MIELOMA MULTIPLO DA LINFOMA CHE MOSTRINO POVERA MOBILIZZAZIONE DOPO
E. O. Ospedali Galliera - Genova (L. 833/1978, art. 41; D. lgs n. 517/1993 art. 4 c. 12)
 E. O. Ospedali Galliera - Genova (L. 833/1978, art. 41; D. lgs n. 517/1993 art. 4 c. 12) Ospedale di rilievo nazionale e di alta specializzazione (D.P.C.M. 14 luglio 1995) Segreteria Amministrativa Comitato
E. O. Ospedali Galliera - Genova (L. 833/1978, art. 41; D. lgs n. 517/1993 art. 4 c. 12) Ospedale di rilievo nazionale e di alta specializzazione (D.P.C.M. 14 luglio 1995) Segreteria Amministrativa Comitato
PREMIO INNOVAZIONE TOSCANA 2017
 PREMIO INNOVAZIONE TOSCANA 2017 DOMANDA DI PARTECIPAZIONE IMPRESA Il/La sottoscritto/a nato/a a il e residente a nella sua qualità di dell Impresa avente sede legale in e sede operativa in Codice Fiscale/P.IVA
PREMIO INNOVAZIONE TOSCANA 2017 DOMANDA DI PARTECIPAZIONE IMPRESA Il/La sottoscritto/a nato/a a il e residente a nella sua qualità di dell Impresa avente sede legale in e sede operativa in Codice Fiscale/P.IVA
Dipartimento del Farmaco
 Dipartimento del Farmaco U. O. C. di Farmaceutica Ospedaliera VERBALE DI VERIFICA DEGLI ARMADI DI REPARTO (in collaborazione con la Direzione Sanitaria di Presidio, per valutare la corretta tenuta dei
Dipartimento del Farmaco U. O. C. di Farmaceutica Ospedaliera VERBALE DI VERIFICA DEGLI ARMADI DI REPARTO (in collaborazione con la Direzione Sanitaria di Presidio, per valutare la corretta tenuta dei
MODELLO INFORMATIVO. Informazioni relative all esame diagnostico HEAD-UP TILT TEST
 MODELLO INFORMATIVO Informazioni relative all esame diagnostico HEAD-UP TILT TEST Io sottoscritto/a nato/a. il. dichiaro di essere stato/a informato/a in data dal dr.. DI ESSERE AFFETTO DALLA SEGUENTE
MODELLO INFORMATIVO Informazioni relative all esame diagnostico HEAD-UP TILT TEST Io sottoscritto/a nato/a. il. dichiaro di essere stato/a informato/a in data dal dr.. DI ESSERE AFFETTO DALLA SEGUENTE
Il Registro Nazionale per il Metilfenidato
 Il Registro Nazionale per il Metilfenidato Uno strumento di sanità pubblica Dante Besana Direttore di Struttura Complessa di Neuropsichiatria Infantile Milano 13 maggio 2005 Premesse giugno 2002 - CD SINPIA:
Il Registro Nazionale per il Metilfenidato Uno strumento di sanità pubblica Dante Besana Direttore di Struttura Complessa di Neuropsichiatria Infantile Milano 13 maggio 2005 Premesse giugno 2002 - CD SINPIA:
Allegato IV. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato IV Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio 277 Conclusioni scientifiche Il CHMP ha preso in esame la raccomandazione del
Allegato IV Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio 277 Conclusioni scientifiche Il CHMP ha preso in esame la raccomandazione del
Classificazione clinica dell emofilia A e B
 Classificazione clinica dell emofilia A e B Gravità Grave Moderata Lieve Livello di FVIII/ IX < 1 % 1-5 % > 5 % < 40 % Caratteristiche cliniche Emorragie spontanee dalla prima infanzia; frequenti emartri
Classificazione clinica dell emofilia A e B Gravità Grave Moderata Lieve Livello di FVIII/ IX < 1 % 1-5 % > 5 % < 40 % Caratteristiche cliniche Emorragie spontanee dalla prima infanzia; frequenti emartri
FedEmo Progetto Sa.Me.Da. L.I.F.E.
 FedEmo Progetto Sa.Me.Da. L.I.F.E. (Safety Medical Database - Local Informed For Emergency) Emofilia: la patologia L emofilia è una malattia rara di origine genetica dovuta ad un difetto della coagulazione
FedEmo Progetto Sa.Me.Da. L.I.F.E. (Safety Medical Database - Local Informed For Emergency) Emofilia: la patologia L emofilia è una malattia rara di origine genetica dovuta ad un difetto della coagulazione
MODULO PER LA CANDIDATURA A PRESIDIO DELLA RETE REGIONALE PUGLIA PER LE MALATTIE RARE
 70126 Bari Via Gentile, 52 Partita IVA 05747190725 www.arespuglia.it COORDINAMENTO REGIONALE MALATTIE RARE (DGR 13 dicembre 2016, n. 2048 ed integrazione con DGR 29 maggio 2017, n. 794) Tel. 0809188139
70126 Bari Via Gentile, 52 Partita IVA 05747190725 www.arespuglia.it COORDINAMENTO REGIONALE MALATTIE RARE (DGR 13 dicembre 2016, n. 2048 ed integrazione con DGR 29 maggio 2017, n. 794) Tel. 0809188139
Nota Informativa Importante. Guida alla Terapia per i Paziente. Guida alla Contraccezione. Modulo d'informazione e Consenso Informato
 AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
Il modulo integrativo sulla sicurezza del paziente
 Agenzia Nazionale per i Servizi Sanitari Regionali Ricerca Autofinanziata 2015 La valutazione partecipata del grado di umanizzazione delle strutture di ricovero Il modulo integrativo sulla sicurezza del
Agenzia Nazionale per i Servizi Sanitari Regionali Ricerca Autofinanziata 2015 La valutazione partecipata del grado di umanizzazione delle strutture di ricovero Il modulo integrativo sulla sicurezza del
Ospedale di Treviso. Medicina di Laboratorio Guida ai Servizi
 Ospedale di Treviso Medicina di Laboratorio Guida ai Servizi L Unità Operativa Complessa Medicina di Laboratorio è un struttura del Dipartimento di Patologia Clinica dell Azienda ULSS 9 di Treviso. Essa
Ospedale di Treviso Medicina di Laboratorio Guida ai Servizi L Unità Operativa Complessa Medicina di Laboratorio è un struttura del Dipartimento di Patologia Clinica dell Azienda ULSS 9 di Treviso. Essa
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante
 Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
Corso di Perfezionamento. Ricerca Clinica: l Infermiere di Ricerca nello Sviluppo di Nuovi Farmaci Antitumorali
 Corso di Perfezionamento Ricerca Clinica: l Infermiere di Ricerca nello Sviluppo di Nuovi Farmaci Antitumorali Coordinatore del Corso: Prof. Alessandro M. Gianni Segreteria organizzativa: Fondazione IRCCS
Corso di Perfezionamento Ricerca Clinica: l Infermiere di Ricerca nello Sviluppo di Nuovi Farmaci Antitumorali Coordinatore del Corso: Prof. Alessandro M. Gianni Segreteria organizzativa: Fondazione IRCCS
FOGLIO INFORMATIVO E DICHIARAZIONE DI CONSENSO per un paziente adulto capace di dare personalmente il consenso
 FOGLIO INFORMATIVO E DICHIARAZIONE DI CONSENSO per un paziente adulto capace di dare personalmente il consenso Gentile Signora/e, Questo nostro Istituto, è stato invitato a partecipare ad uno studio osservazionale
FOGLIO INFORMATIVO E DICHIARAZIONE DI CONSENSO per un paziente adulto capace di dare personalmente il consenso Gentile Signora/e, Questo nostro Istituto, è stato invitato a partecipare ad uno studio osservazionale
Ruolo dell Infermiere nella gestione di un Trial clinico
 Ricerca clinica Studi di fase I, II, III 3 Ruolo dell Infermiere nella gestione di un Trial clinico Processo Approvazione Attivazione Susanna Bassi Infermiera di ricerca, Ematologia Dh Ospedale di Circolo
Ricerca clinica Studi di fase I, II, III 3 Ruolo dell Infermiere nella gestione di un Trial clinico Processo Approvazione Attivazione Susanna Bassi Infermiera di ricerca, Ematologia Dh Ospedale di Circolo
La scadenza ultima per la consegna del modulo di adesione è il 13 Aprile 2017, entro e non oltre le ore 12:00.
 Criteri di partecipazione Il MoneyGram Awards è dedicato agli Imprenditori Stranieri che dimostrano capacità di visione, coraggio e leadership nel fondare o condurre le proprie aziende in Italia. Inoltre,
Criteri di partecipazione Il MoneyGram Awards è dedicato agli Imprenditori Stranieri che dimostrano capacità di visione, coraggio e leadership nel fondare o condurre le proprie aziende in Italia. Inoltre,
Good Clinical Practice (ICH- GCP): principi generali. Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016
 Good Clinical Practice (ICH- GCP): principi generali Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016 Good Clinical Practice: cosa sono? Standard etico e di qualità internazionale
Good Clinical Practice (ICH- GCP): principi generali Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016 Good Clinical Practice: cosa sono? Standard etico e di qualità internazionale
FARMACOSORVEGLIANZA DEI PAZIENTI IN TERAPIA CON EVOLOCUMAB
 FARMACOSORVEGLIANZA DEI PAZIENTI IN TERAPIA CON EVOLOCUMAB Francesca Bambara IL RUOLO DELL INFERMIERE Le malattie cardiovascolari (CVD) hanno una mortalità pari a 4 milioni di persone ogni anno solo in
FARMACOSORVEGLIANZA DEI PAZIENTI IN TERAPIA CON EVOLOCUMAB Francesca Bambara IL RUOLO DELL INFERMIERE Le malattie cardiovascolari (CVD) hanno una mortalità pari a 4 milioni di persone ogni anno solo in
Modello di proposta di inserimento di nuovo farmaco in P.T.O.U.
 ALLEGAT0 1 Modello di proposta di inserimento di nuovo farmaco in P.T.O.U. Alla Commissione Terapeutica Ospedaliera Unica Oggetto: Proposta di introduzione farmaco in P.T.O.U. Il sottoscritto Dott. Dirigente
ALLEGAT0 1 Modello di proposta di inserimento di nuovo farmaco in P.T.O.U. Alla Commissione Terapeutica Ospedaliera Unica Oggetto: Proposta di introduzione farmaco in P.T.O.U. Il sottoscritto Dott. Dirigente
I CONVEGNO PER INFERMIERI IN ONCOLOGIA Ospedale di S. Polo Monfalcone 20 Novembre La ricerca: Come, dove, quando?
 I CONVEGNO PER INFERMIERI IN ONCOLOGIA Ospedale di S. Polo Monfalcone 20 Novembre 2004 La ricerca: Come, dove, quando? Daniela Grosso, UO di Oncologia Medica, Azienda Ospedaliera di Padova L ASSISTENZA
I CONVEGNO PER INFERMIERI IN ONCOLOGIA Ospedale di S. Polo Monfalcone 20 Novembre 2004 La ricerca: Come, dove, quando? Daniela Grosso, UO di Oncologia Medica, Azienda Ospedaliera di Padova L ASSISTENZA
HIGH RESEARCH. Decreto Legislativo 24 giugno 2003 n 211
 srl Decreto Legislativo 24 giugno 2003 n 211 Dr, President- General Manager HIGH RESERACH srl AriSla, Milano 18 gennaio 2016 Dlgs 211 Art 1 Decreto si applica a sperimentazioni condotte in GCP Non si applica
srl Decreto Legislativo 24 giugno 2003 n 211 Dr, President- General Manager HIGH RESERACH srl AriSla, Milano 18 gennaio 2016 Dlgs 211 Art 1 Decreto si applica a sperimentazioni condotte in GCP Non si applica
Linee guida sulla gestione di terapie preoperatorie antiaggreganti ed anticoagulanti
 Linee guida sulla gestione di terapie preoperatorie antiaggreganti ed anticoagulanti Marco Moia Centro Emofilia e Trombosi A. Bianchi Bonomi Fondazione IRCCS Ca Granda Ospedale Maggiore Policlinico di
Linee guida sulla gestione di terapie preoperatorie antiaggreganti ed anticoagulanti Marco Moia Centro Emofilia e Trombosi A. Bianchi Bonomi Fondazione IRCCS Ca Granda Ospedale Maggiore Policlinico di
MODULO DI CONSENSO INFORMATO PER IL PAZIENTE
 Pagina 1 di 9 MODULO DI CONSENSO INFORMATO PER IL PAZIENTE Istruzioni per la compilazione del modulo: Prima di firmare il presente modulo, il paziente - o i genitori/tutori in caso di pazienti minori o
Pagina 1 di 9 MODULO DI CONSENSO INFORMATO PER IL PAZIENTE Istruzioni per la compilazione del modulo: Prima di firmare il presente modulo, il paziente - o i genitori/tutori in caso di pazienti minori o
DOMANDA PER L'AUTORIZZAZIONE ALLA SPERIMENTAZIONE CLINICA
 Modello 1 DOMANDA PER L'AUTORIZZAZIONE ALLA SPERIMENTAZIONE CLINICA Al Presidente del Comitato Etico dell Azienda Sanitaria Locale Viterbo via S.Lorenzo,101 VITERBO Il sottoscritto Prof./Dr. Della Unità
Modello 1 DOMANDA PER L'AUTORIZZAZIONE ALLA SPERIMENTAZIONE CLINICA Al Presidente del Comitato Etico dell Azienda Sanitaria Locale Viterbo via S.Lorenzo,101 VITERBO Il sottoscritto Prof./Dr. Della Unità
Modello di Cura (MdC) per le persone affette da Artrite Reumatoide
 Translation into: Completed by: Email: MdC 1 MdC 2 MdC 3 MdC 4 MdC 5 Italian Modello di Cura (MdC) per le persone affette da Artrite Reumatoide Annamaria Iuliano annamariaiuliano@hotmail.it Le persone
Translation into: Completed by: Email: MdC 1 MdC 2 MdC 3 MdC 4 MdC 5 Italian Modello di Cura (MdC) per le persone affette da Artrite Reumatoide Annamaria Iuliano annamariaiuliano@hotmail.it Le persone
UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL)
 Azienda Ospedaliero- Universitaria Maggiore della Carità di Novara DIREZIONE SANITARIA S.C.D.O. FARMACIA DATA: 20.02.2008 REV. N 00 PAG. 1/8 UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL) REDATTO
Azienda Ospedaliero- Universitaria Maggiore della Carità di Novara DIREZIONE SANITARIA S.C.D.O. FARMACIA DATA: 20.02.2008 REV. N 00 PAG. 1/8 UTILIZZO DEI MEDICINALI FUORI INDICAZIONE (OFF-LABEL) REDATTO
Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema. Dott.ssa Maria Susanna Rivetti
 Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema Dott.ssa Maria Susanna Rivetti 1 D.L.vo 219/2006 e s.m.i. Definizione Medicinali biologici Medicinali il cui principio attivo
Utilizzo dei farmaci biologici in Regione Liguria: sostenibilità del sistema Dott.ssa Maria Susanna Rivetti 1 D.L.vo 219/2006 e s.m.i. Definizione Medicinali biologici Medicinali il cui principio attivo
Lo studio PARTNER. Le è stato chiesto di partecipare a questo studio perché ha un rapporto di coppia nel quale lei è il partner sieropositivo.
 Informazioni ai partecipanti e consenso per il partner sieropositivo Lo studio PARTNER Lo studio PARTNER è uno studio che viene eseguito sulle coppie in cui: (i) un partner è sieropositivo e l altro è
Informazioni ai partecipanti e consenso per il partner sieropositivo Lo studio PARTNER Lo studio PARTNER è uno studio che viene eseguito sulle coppie in cui: (i) un partner è sieropositivo e l altro è
ANNO ANNO
 ANNO 2000 500.000 ANNO 2010 900.000 8% 4% 5% 5% 5% 73 % FA p.v. biologica p.v. meccanica CIC Stabilire la corretta indicazione clinica all uso dei farmaci anticoagulanti Determinare i test di laboratorio
ANNO 2000 500.000 ANNO 2010 900.000 8% 4% 5% 5% 5% 73 % FA p.v. biologica p.v. meccanica CIC Stabilire la corretta indicazione clinica all uso dei farmaci anticoagulanti Determinare i test di laboratorio
I cateteri SC sono compatibili con le pompe impiantabili Medtronic SynchroMed II e SynchroMed EL.
 Medtronic (Schweiz) AG Talstrasse 9 3053 Münchenbuchsee Tel. 031 868 01 00 Fax 031 868 01 99 swisscontact@medtronic.com www.medtronic.ch Agosto 2009 Ref: FA435 AVVISO DI SICUREZZA Cateteri intratecali
Medtronic (Schweiz) AG Talstrasse 9 3053 Münchenbuchsee Tel. 031 868 01 00 Fax 031 868 01 99 swisscontact@medtronic.com www.medtronic.ch Agosto 2009 Ref: FA435 AVVISO DI SICUREZZA Cateteri intratecali
Modulo di Consenso Informato
 Clinica Medica 4 DIPARTIMENTO DI MEDICINA - DIMED Università di Padova Direttore: Prof. GianPaolo Rossi Prospective Appraisal of the Prevalence of Primary Aldosteronism in HYpertensive Patients presenting
Clinica Medica 4 DIPARTIMENTO DI MEDICINA - DIMED Università di Padova Direttore: Prof. GianPaolo Rossi Prospective Appraisal of the Prevalence of Primary Aldosteronism in HYpertensive Patients presenting
Gli studi clinici. Informazioni essenziali per una partecipazione consapevole. Iniziativa realizzata da
 Iniziativa realizzata da Con il network di Associazioni Pazienti che partecipano ad Gli studi clinici Con il patrocinio delle seguenti Società Scientifiche Società Italiana di Ematologia Associazione Italiana
Iniziativa realizzata da Con il network di Associazioni Pazienti che partecipano ad Gli studi clinici Con il patrocinio delle seguenti Società Scientifiche Società Italiana di Ematologia Associazione Italiana
SPINRAZA. NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione
 SPINRAZA NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione SSD Farmacia e Farmacologia Clinica IRCCS Burlo Garofolo Dott.ssa Alessandra Maestro Dott. Davide
SPINRAZA NUSINERSEN Terapia farmacologica: presupposti per il meccanismo d azione, vie di somministrazione SSD Farmacia e Farmacologia Clinica IRCCS Burlo Garofolo Dott.ssa Alessandra Maestro Dott. Davide
UNITÁ OPERATIVA DI PSICOLOGIA OSPEDALIERA DIPARTIMENTO ONCOLOGICO
 UNITÁ OPERATIVA DI PSICOLOGIA OSPEDALIERA DIPARTIMENTO ONCOLOGICO 1/9 Attività L unità operativa di Psicologia Ospedaliera assicura interventi psicologici per: 1. Garantire, quando richiesto, il supporto
UNITÁ OPERATIVA DI PSICOLOGIA OSPEDALIERA DIPARTIMENTO ONCOLOGICO 1/9 Attività L unità operativa di Psicologia Ospedaliera assicura interventi psicologici per: 1. Garantire, quando richiesto, il supporto
CENTRO DI COSMETOLOGIA UNIVERSITÀ DI FERRARA VALUTAZIONE D EFFICACIA DI UNA DOCCIA SOLARE CON PEDANA VIBRANTE
 CENTRO DI COSMETOLOGIA UNIVERSITÀ DI FERRARA VALUTAZIONE D EFFICACIA DI UNA DOCCIA SOLARE CON PEDANA VIBRANTE PRODOTTO DATA DITTA BODYWAVE HIGH PERFORMANCE 08.2007 QUADRA MEDICAL S.R.L. VIA NARDI 98 36060
CENTRO DI COSMETOLOGIA UNIVERSITÀ DI FERRARA VALUTAZIONE D EFFICACIA DI UNA DOCCIA SOLARE CON PEDANA VIBRANTE PRODOTTO DATA DITTA BODYWAVE HIGH PERFORMANCE 08.2007 QUADRA MEDICAL S.R.L. VIA NARDI 98 36060
1. Vorresti condividere qualcosa di te? Nickname. Nazionalità. Età. Nazione in cui risiedi attualmente. Sei una studentessa?
 INTRODUZIONE Perchè una indagine riguardante delle informazioni relative alla tua diagnosi? Per progettare un domani migliore per le ragazze e le donne con problemi emorragici e per valutare le migliori
INTRODUZIONE Perchè una indagine riguardante delle informazioni relative alla tua diagnosi? Per progettare un domani migliore per le ragazze e le donne con problemi emorragici e per valutare le migliori
CONVENZIONE PER LO SVOLGIMENTO DELLE ATTIVITÀ DI TIROCINIO PROFESSIONALIZZANTE TRA L
 CONVENZIONE PER LO SVOLGIMENTO DELLE ATTIVITÀ DI TIROCINIO PROFESSIONALIZZANTE TRA L Ordine degli psicologi della Regione Puglia, d ora in poi denominato soggetto promotore, rappresentato dal Presidente,
CONVENZIONE PER LO SVOLGIMENTO DELLE ATTIVITÀ DI TIROCINIO PROFESSIONALIZZANTE TRA L Ordine degli psicologi della Regione Puglia, d ora in poi denominato soggetto promotore, rappresentato dal Presidente,
I FARMACI SICURAMENTE ATTIVI DISPONIBILI IN TERAPIA ERANO POCHISSIMI
 I PROTOCOLLI CLINICI Sonia Ronconi i(meldola l FC) APPROCCIO EMPIRICO AI FARMACI Sino agli inizi degli anni 40 i farmaci venivano utilizzati grazie ad esperienze basate su tentativi ed errori che permettevano
I PROTOCOLLI CLINICI Sonia Ronconi i(meldola l FC) APPROCCIO EMPIRICO AI FARMACI Sino agli inizi degli anni 40 i farmaci venivano utilizzati grazie ad esperienze basate su tentativi ed errori che permettevano
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
CONTENUTO DELLE INFORMAZIONI AI SOGGETTI ai sensi del D.M. 21 dicembre 2007 (G.U. n. 53 del 3 marzo 2008)
 CONTENUTO DELLE INFORMAZIONI AI SOGGETTI ai sensi del D.M. 21 dicembre 2007 (G.U. n. 53 del 3 marzo 2008) Tutte le informazioni relative alla sperimentazione devono essere fornite al soggetto e/o ai genitori/al
CONTENUTO DELLE INFORMAZIONI AI SOGGETTI ai sensi del D.M. 21 dicembre 2007 (G.U. n. 53 del 3 marzo 2008) Tutte le informazioni relative alla sperimentazione devono essere fornite al soggetto e/o ai genitori/al
FOGLIO INFORMATIVO E MODULO DI CONSENSO INFORMATO ALLA PARTECIPAZIONE AL PROGETTO DI RICERCA SOGGETTI MINORI RAPPRESENTATI DA TERZI
 FOGLIO INFORMATIVO E MODULO DI CONSENSO INFORMATO ALLA PARTECIPAZIONE AL PROGETTO DI RICERCA SOGGETTI MINORI RAPPRESENTATI DA TERZI Titolo dello studio ASSET Valutazione individualizzata degli ausili e
FOGLIO INFORMATIVO E MODULO DI CONSENSO INFORMATO ALLA PARTECIPAZIONE AL PROGETTO DI RICERCA SOGGETTI MINORI RAPPRESENTATI DA TERZI Titolo dello studio ASSET Valutazione individualizzata degli ausili e
La clinica delle sindromi emofiliche
 La clinica delle sindromi emofiliche MARIA ELISA MANCUSO Centro Emofilia e Trombosi Angelo Bianchi Bonomi Fondazione IRCCS Ca Granda, Ospedale Maggiore Policlinico Milano Siset Training Center: Corso Malattie
La clinica delle sindromi emofiliche MARIA ELISA MANCUSO Centro Emofilia e Trombosi Angelo Bianchi Bonomi Fondazione IRCCS Ca Granda, Ospedale Maggiore Policlinico Milano Siset Training Center: Corso Malattie
Il Coordinamento della Ricerca 1 Corso ISG di Formazione per la Ricerca Clinica 28-Set-2015
 Qualità del dato e monitoraggio Il Coordinamento della Ricerca 1 Corso ISG di Formazione per la Ricerca Clinica 28-Set-2015 1 Qualità del dato 5.18.1b I dati riguardanti la sperimentazione debbono essere
Qualità del dato e monitoraggio Il Coordinamento della Ricerca 1 Corso ISG di Formazione per la Ricerca Clinica 28-Set-2015 1 Qualità del dato 5.18.1b I dati riguardanti la sperimentazione debbono essere
Criteri di partecipazione 5 Premi di categoria Premio per la Crescita del Profitto Premio per l Occupazione Premio per l Innovazione
 Criteri di partecipazione Il MoneyGram Award è dedicato agli Imprenditori Stranieri che dimostrano capacità di visione, coraggio e leadership nel fondare o condurre le proprie aziende in Italia. Inoltre,
Criteri di partecipazione Il MoneyGram Award è dedicato agli Imprenditori Stranieri che dimostrano capacità di visione, coraggio e leadership nel fondare o condurre le proprie aziende in Italia. Inoltre,
UNIVERSITÀ DEGLI STUDI DI TORINO Provider: Università degli Studi di Torino - (ID 173) DIREZIONE FUNZIONI ASSISTENZIALI Sezione Formazione ECM
 UNIVERSITÀ DEGLI STUDI DI TORINO Provider: Università degli Studi di Torino - (ID 173) DIREZIONE FUNZIONI ASSISTENZIALI Sezione Formazione ECM NOVITÀ SULL I.P.B. Obiettivo n 18 - Contenuti tecnico-professionali
UNIVERSITÀ DEGLI STUDI DI TORINO Provider: Università degli Studi di Torino - (ID 173) DIREZIONE FUNZIONI ASSISTENZIALI Sezione Formazione ECM NOVITÀ SULL I.P.B. Obiettivo n 18 - Contenuti tecnico-professionali
Schema dello studio clinico di Fase 2b
 Sommario dei risultati dello studio clinico di Fase 2b di Ataluren presentato in occasione dell American Academy of Neurology Meeting il 16 Aprile 2010 Toronto, 16 Aprile 2010 - Un nuovo farmaco sperimentale
Sommario dei risultati dello studio clinico di Fase 2b di Ataluren presentato in occasione dell American Academy of Neurology Meeting il 16 Aprile 2010 Toronto, 16 Aprile 2010 - Un nuovo farmaco sperimentale
L'UTILIZZO DEI MEDICINALI PLASMADERIVATI IN ITALIA
 Mod. S5 Rev. 6 del 12/10/2015, Pagina 1 di 5 L'UTILIZZO DEI MEDICINALI PLASMADERIVATI IN ITALIA 12 maggio 2016 organizzato da ISTITUTO SUPERIORE DI SANITÀ Centro nazionale sangue N ID: 109D16 Origine della
Mod. S5 Rev. 6 del 12/10/2015, Pagina 1 di 5 L'UTILIZZO DEI MEDICINALI PLASMADERIVATI IN ITALIA 12 maggio 2016 organizzato da ISTITUTO SUPERIORE DI SANITÀ Centro nazionale sangue N ID: 109D16 Origine della
LEGA NAVALE ITALIANA Sez. di OTRANTO. Trofeo 800 Martiri di Otranto Corfù Otranto. Elenco dei Documenti da Allegare in Copia
 Elenco dei Documenti da Allegare in Copia 1. Modulo di Iscrizione 2. Lista Completa Equipaggio 3. Mandato di Rappresentanza 4. Privacy 5. Dichiarazione di Responsabilità 6. Dichiarazione di Assunzione
Elenco dei Documenti da Allegare in Copia 1. Modulo di Iscrizione 2. Lista Completa Equipaggio 3. Mandato di Rappresentanza 4. Privacy 5. Dichiarazione di Responsabilità 6. Dichiarazione di Assunzione
PLACEBO Aspetti etici e scientifici
 Aspetti etici e scientifici Definizione Placebo (dal latino, letteralmente piacerò) può essere definito ogni trattamento, o parte di esso, che viene deliberatamente impiegato per determinare un effetto
Aspetti etici e scientifici Definizione Placebo (dal latino, letteralmente piacerò) può essere definito ogni trattamento, o parte di esso, che viene deliberatamente impiegato per determinare un effetto
Studio osservazionale prospettico: START2- POST VTE (nel contesto del Registro START2)
 Studio osservazionale prospettico: START2- POST VTE (nel contesto del Registro START2) Promosso da: Fondazione Arianna Anticoagulazione Centro Coordinatore: Angiologia, Bologna Fondazione senza fini di
Studio osservazionale prospettico: START2- POST VTE (nel contesto del Registro START2) Promosso da: Fondazione Arianna Anticoagulazione Centro Coordinatore: Angiologia, Bologna Fondazione senza fini di
ESAMI DI CITOGENETICA ISTRUZIONI OPERATIVE PER ESECUZIONE PRELIEVI
 ESAMI DI CITOGENETICA ISTRUZIONI OPERATIVE PER ESECUZIONE PRELIEVI CENTRO PRELIEVI LABORATORIO CENTRALE- VIA SAN MASSIMO 10 AZIENDA OSPEDALIERA DI PADOVA ESAMI DI CITOGENETICA Esecuzione del Prelievo:
ESAMI DI CITOGENETICA ISTRUZIONI OPERATIVE PER ESECUZIONE PRELIEVI CENTRO PRELIEVI LABORATORIO CENTRALE- VIA SAN MASSIMO 10 AZIENDA OSPEDALIERA DI PADOVA ESAMI DI CITOGENETICA Esecuzione del Prelievo:
COME FUNZIONANO GLI STUDI CLINICI
 COME FUNZIONANO GLI STUDI CLINICI Gli studi clinici rappresentano il modo migliore per verificare se un trattamento sia più efficace e sicuro di altri trattamenti già esistenti e approvati per l uso nella
COME FUNZIONANO GLI STUDI CLINICI Gli studi clinici rappresentano il modo migliore per verificare se un trattamento sia più efficace e sicuro di altri trattamenti già esistenti e approvati per l uso nella
Il rimedio migliore contro la tumore del sangue sei tu.
 Informazioni sulla donazione delle cellule staminali. Il rimedio migliore contro la tumore del sangue sei tu. Bastian, donatore di cellule staminali Salvare una vita umana è così semplice. Friederike,
Informazioni sulla donazione delle cellule staminali. Il rimedio migliore contro la tumore del sangue sei tu. Bastian, donatore di cellule staminali Salvare una vita umana è così semplice. Friederike,
Il ruolo del Responsabile aziendale di farmacovigilanza, i flussi, le DDL e il supporto nella segnalazione
 Il ruolo del Responsabile aziendale di farmacovigilanza, i flussi, le DDL e il supporto nella segnalazione La cultura della farmacovigilanza per la sicurezza del paziente Bologna 26 gennaio, 2, 9 e 16
Il ruolo del Responsabile aziendale di farmacovigilanza, i flussi, le DDL e il supporto nella segnalazione La cultura della farmacovigilanza per la sicurezza del paziente Bologna 26 gennaio, 2, 9 e 16
CATETERISMO CARDIACO, CORONAROGRAFIA, ANGIOGRAFIA PERIFERICA CONSENSO INFORMATO CARDIOLOGIA INTERVENTISTICA PER EMODINAMICA E
 Dipartimento Cardio-Toraco-Vascolare e Area Critica Cardiologia Interventistica Dott. Antonio Manari - Direttore CONSENSO INFORMATO PER EMODINAMICA E CARDIOLOGIA INTERVENTISTICA CATETERISMO CARDIACO, CORONAROGRAFIA,
Dipartimento Cardio-Toraco-Vascolare e Area Critica Cardiologia Interventistica Dott. Antonio Manari - Direttore CONSENSO INFORMATO PER EMODINAMICA E CARDIOLOGIA INTERVENTISTICA CATETERISMO CARDIACO, CORONAROGRAFIA,
REALTA E PROSPETTIVE DEL CENTRO F.C.S.A. N. 72
 D I S T R E T T O O S P E D A L I E R O T P 2 P. O. A. A J E L L O M A Z A R A D E L V A L L O U. O. DI P A T O L O G I A C L I N I C A D I R E T T O R E : F. C A L C A R A REALTA E PROSPETTIVE DEL CENTRO
D I S T R E T T O O S P E D A L I E R O T P 2 P. O. A. A J E L L O M A Z A R A D E L V A L L O U. O. DI P A T O L O G I A C L I N I C A D I R E T T O R E : F. C A L C A R A REALTA E PROSPETTIVE DEL CENTRO
ADEMPIMENTI PER L EROGAZIONE DELL ESAME CENED
 ADEMPIMENTI PER L EROGAZIONE DELL ESAME CENED Premessa L'Ente formatore, così come specificato dalle Condizioni d'uso e modalità di adesione ai servizi CENED, è tenuto ad osservare gli adempimenti riportati
ADEMPIMENTI PER L EROGAZIONE DELL ESAME CENED Premessa L'Ente formatore, così come specificato dalle Condizioni d'uso e modalità di adesione ai servizi CENED, è tenuto ad osservare gli adempimenti riportati
PROGETTO FORMATIVO E DI ORIENTAMENTO (Rif.: Convenzione stipulata in data ) Cognome Nome. Codice Fiscale. Nato a il
 Allegato n. 2 PROGETTO FORMATIVO E DI ORIENTAMENTO (Rif.: Convenzione stipulata in data ) Tirocinante: Cognome Nome Codice Fiscale Nato a il Cittadinanza (se cittadino extracomunitario indicare il numero
Allegato n. 2 PROGETTO FORMATIVO E DI ORIENTAMENTO (Rif.: Convenzione stipulata in data ) Tirocinante: Cognome Nome Codice Fiscale Nato a il Cittadinanza (se cittadino extracomunitario indicare il numero
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Degenza Breve Chirurgica
 Ospedale Ca Foncello di Treviso Degenza Breve Chirurgica Guida ai Servizi Gentile utente, questo opuscolo contiene alcune semplici informazioni che le potranno essere utili in vista dell intervento a cui
Ospedale Ca Foncello di Treviso Degenza Breve Chirurgica Guida ai Servizi Gentile utente, questo opuscolo contiene alcune semplici informazioni che le potranno essere utili in vista dell intervento a cui
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante
 Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
Indicazioni per la predisposizione del foglio informativo, del modulo di consenso informato e della lettera al medico curante Introduzione e premesse Sezione 1: Indicazioni per la redazione del foglio
REGIONE DEL VENETO ISTITUTO ONCOLOGICO VENETO I.R.C.C.S. DELIBERAZIONE DEL DIRETTORE GENERALE N. 156 DEL 03/05/2013
 REGIONE DEL VENETO ISTITUTO ONCOLOGICO VENETO I.R.C.C.S. DELIBERAZIONE DEL DIRETTORE GENERALE N. 156 DEL 03/05/2013 OGGETTO: Approvazione del Contratto con Daiichi Sankyo Developmente Ltd per la realizzazione
REGIONE DEL VENETO ISTITUTO ONCOLOGICO VENETO I.R.C.C.S. DELIBERAZIONE DEL DIRETTORE GENERALE N. 156 DEL 03/05/2013 OGGETTO: Approvazione del Contratto con Daiichi Sankyo Developmente Ltd per la realizzazione
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
