ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
|
|
|
- Giuliano Simonetti
- 8 anni fa
- Visualizzazioni
Transcript
1 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1
2 1. DENOMINAZIONE DEL MEDICINALE Pioglitazone Accord 15 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa tiene 15 mg di pioglitazone (come cloridrato). Eccipiente(i)i: Ciascuna compressa tiene 37,24 mg di lattosio monoidrato (vedere paragrafo 4.4). Per l elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA Compressa. Le compresse sono di colore da bianco a biancastro, tonde, bivesse, non rivestite, P impresso su un lato e '15 sull'altro lato. 4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Pioglitazone è indicato come trattamento di seda o terza linea per il diabete mellito di tipo 2, come esposto qui di seguito: in monoterapia - in pazienti adulti (in particolare pazienti sovrappeso) non adeguatamente trollati dalla dieta e dall esercizio fisico per i quali il trattamento metformina è inappropriato a causa di troindicazioni o intolleranza. Dopo l inizio della terapia pioglitazone, i pazienti devono essere rivalutati dopo 3-6 mesi per verificare l adeguatezza della risposta al trattamento (ad esempio, la riduzione della HbA1c). Nei pazienti che non rispondono adeguatamente, il trattamento pioglitazone deve essere interrotto. Alla luce dei potenziali rischi di una terapia prolungata, i prescrittori devono fermare, in occasione delle visite successive, che i benefici del trattamento pioglitazone siano mantenuti (vedere paragrafo 4.4). 4.2 Posologia e modo di somministrazione Posologia Il trattamento pioglitazone può essere iniziato alla dose di 15 mg o 30 mg una volta al giorno. La dose può essere aumentata gradualmente fino a 45 mg una volta al giorno. Popolazioni speciali Anziani Non è necessario alcun aggiustamento della dose nei pazienti anziani (vedere paragrafo 5.2). I medici devono iniziare il trattamento la dose più bassa disponibile ed aumentarla gradualmente, in particolare quando pioglitazone viene utilizzato in combinazione insulina (vedere paragrafo 4.4 Ritenzione idrica e insufficienza cardiaca). 2
3 Insufficienza renale Non è necessario alcun aggiustamento della dose nei pazienti funzionalità renale compromessa (clearance della creatinina > 4 ml/min) (vedere paragrafo 5.2). Non sono disponibili informazioni su pazienti in dialisi, pertanto in tali pazienti pioglitazone non deve essere usato. Insufficienza epatica Pioglitazone non deve essere usato in pazienti insufficienza epatica (vedere paragrafi 4.3 e 4.4). Popolazione pediatrica La sicurezza e l efficacia di Pioglitazone Accord nei bambini e negli adolescenti età inferiore ai 18 anni non sono state ancora stabilite. Non ci sono dati disponibili. Modo di somministrazione Le compresse di pioglitazone vengono assunte per via orale una volta al giorno o senza cibo. Le compresse devono essere deglutite un bicchiere d acqua. 4.3 Controindicazioni Pioglitazone è troindicato in pazienti : - ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti. - insufficienza cardiaca o storia di insufficienza cardiaca (NYHA stadi da I a IV) - insufficienza epatica - chetoacidosi diabetica - carcinoma della vescica in fase attiva o anamnesi positiva per carcinoma della vescica - ematuria macroscopica di natura non accertata Avvertenze speciali e precauzioni di impiego Ritenzione idrica e insufficienza cardiaca Pioglitazone può causare ritenzione idrica che può esacerbare o precipitare una insufficienza cardiaca. Quando vengono trattati pazienti che presentano almeno un fattore di rischio per lo sviluppo di insufficienza cardiaca gestizia (es. precedente infarto del miocardio o malattia coronarica sintomatica, o gli anziani), i medici devono iniziare il trattamento la più bassa dose disponibile e aumentare la dose gradualmente. I pazienti devono essere osservati relativamente a segni e sintomi di insufficienza cardiaca, aumento di peso o edema, particolarmente quelli una ridotta riserva cardiaca. Sono stati riportati nel post-marketing casi di insufficienza cardiaca quando pioglitazone è stato usato in combinazione insulina o in pazienti storia di insufficienza cardiaca. I pazienti devono essere osservati rispetto a segni e sintomi di insufficienza cardiaca, aumento di peso ed edema quando pioglitazone è usato in combinazione insulina. Poiché insulina e pioglitazone sono entrambi associati a ritenzione idrica, la somministrazione comitante può aumentare il rischio di edema. Pioglitazone deve essere sospeso se si manifesta qualsiasi deterioramento dello stato cardiaco. Uno studio di outcome cardiovascolare di pioglitazone è stato effettuato in pazienti di età inferiore a 75 anni diabete mellito di tipo 2 e preesistente malattia macrovascolare maggiore. Pioglitazone o placebo sono stati aggiunti alla terapia antidiabetica e cardiovascolare in corso fino a 3,5 anni. Questo studio ha mostrato un aumento nelle segnalazioni di insufficienza cardiaca, tuttavia ciò non ha comportato un aumento nella mortalità in questo studio. Anziani 3
4 L uso combinato di pioglitazone ed insulina deve essere valutato cautela negli anziani, a causa dell aumento del rischio di insufficienza cardiaca grave. Alla luce dei rischi correlati all età (in particolare carcinoma della vescica, fratture ed insufficienza cardiaca) il bilancio tra i rischi ed i benefici deve essere siderato accuratamente negli anziani sia prima che durante il trattamento pioglitazone. Carcinoma della vescica In una metanalisi su studi clinici trollati i casi di carcinoma della vescica sono stati segnalati più frequentemente pioglitazone (19 casi su pazienti, 0,15%) rispetto ai gruppi di trollo (7 casi su pazienti, 0,07%) HR = 2,64 (95% CI; 1,11-6,31; P=0,029). Dopo avere escluso i pazienti nei quali l esposizione al medicinale in studio era stata inferiore ad un anno al momento della diagnosi di carcinoma della vescica, i casi relativi a pioglitazone erano 7 (0,06%) mentre quelli relativi ai gruppi di trollo erano 2 (0,02%). Anche i dati epidemiologici disponibili suggeriso un lieve aumento del rischio di carcinoma della vescica nei pazienti diabetici trattati pioglitazone, in particolare nei pazienti trattati per periodi più prolungati e i dosaggi cumulativi più alti. Non può essere escluso un possibile rischio dopo trattamenti a breve termine. I fattori di rischio per il carcinoma della vescica devono essere valutati prima di iniziare il trattamento pioglitazone (i rischi includono l età, fumo, esposizione ad alcune sostanze usate in ambienti lavorativi o chemioterapici quali ciclofosfamide, oppure precedente radioterapia esposizione dell area pelvica). Qualunque ematuria macroscopica deve essere indagata prima di iniziare la terapia pioglitazone. I pazienti devono sultare immediatamente il proprio medico se durante il trattamento dovessero insorgere sintomi quali ematuria macroscopica, disuria o urgenza della minzione. Monitoraggio della funzionalità epatica Durante l esperienza post-marketing raramente è stata riportata disfunzione epatocellulare (vedere paragrafo 4.8). Si raccomanda, quindi, che i pazienti trattati pioglitazone siano sottoposti a monitoraggio periodico degli enzimi epatici. Gli enzimi epatici devono essere trollati prima di iniziare la terapia pioglitazone in tutti i pazienti. La terapia pioglitazone non deve essere iniziata in pazienti aumentati livelli basali degli enzimi epatici (ALT> 2,5 volte il limite superiore della norma) o qualsiasi evidenza di malattia epatica. Dopo l inizio della terapia pioglitazone, si raccomanda di monitorare gli enzimi epatici periodicamente sedo necessità clinica. Se i livelli di ALT sono aumentati di 3 volte il limite superiore della norma durante la terapia pioglitazone, i livelli degli enzimi epatici devono essere rivalutati appena possibile. Se i livelli di ALT rimangono > 3 volte il limite superiore della norma, la terapia deve essere interrotta. Se qualche paziente manifesta sintomi che suggeriso disfunzione epatica, che possono includere nausea inspiegabile, vomito, dolore addominale, affaticamento, anoressia e/o urine scure, devono essere trollati gli enzimi epatici. La decisione se tinuare a trattare il paziente pioglitazone deve essere guidata dal giudizio clinico in attesa delle valutazioni di laboratorio. Se si manifesta ittero, il medicinale deve essere sospeso. Aumento di peso Negli studi clinici pioglitazone si è evidenziato aumento di peso dose correlato, che può essere dovuto ad accumulo di adipe e in qualche caso associato a ritenzione idrica. In alcuni casi l aumento di peso può essere un sintomo di insufficienza cardiaca, quindi il peso deve essere attentamente monitorato. Il trollo della dieta fa parte del trattamento del diabete. I pazienti devono essere informati che devono seguire rigorosamente una dieta a calorie trollate. 4
5 Ematologia È stata osservata una lieve riduzione dell emoglobina media (riduzione relativa del 4%) e dell ematocrito (riduzione relativa del 4,1%) durante la terapia pioglitazone, sistente in emodiluizione. Modifiche simili sono state osservate in pazienti trattati metformina (riduzione relativa dell emoglobina 3-4% e dell ematocrito 3,6-4,1%) ed in misura minore in quelli trattati sulfonilurea e insulina (riduzione relativa dell emoglobina 1-2% e dell ematocrito 1-3,2%) in studi comparativi trollati pioglitazone. Ipoglicemia Come seguenza dell aumentata sensibilità all insulina, i pazienti che ricevono pioglitazone in duplice o triplice terapia orale una sulfonilurea o in duplice terapia insulina possono essere a rischio di ipoglicemia dose-correlata, e può essere necessaria una riduzione nella dose della sulfonilurea o dell insulina. Disturbi visivi Sono stati riportati i tiazolidinedioni, incluso pioglitazone, casi post-marketing di nuova insorgenza o peggioramento di edema maculare diabetico, diminuzione della acuità visiva. Molti di questi pazienti hanno manifestato edema periferico comitante. Non è chiaro se esista o meno un associazione diretta tra pioglitazone ed edema maculare, ma i medici devono fare attenzione alla possibilità di edema maculare se i pazienti riferiso disturbi della acuità visiva; si deve siderare l opportunità di una appropriata visita oftalmologica. Altro In un analisi cumulativa delle reazioni avverse di fratture ossee riportate da studi clinici randomizzati, trollati, in doppio cieco in oltre pazienti trattati pioglitazone e trattati medicinale di fronto per un periodo superiore ai 3,5 anni, è stata osservata un aumentata incidenza di fratture ossee nelle donne. Sono state osservate fratture nel 2,6% delle donne trattate pioglitazone rispetto all 1,7% di donne trattate medicinale di fronto. Non è stato osservato alcun aumento dell incidenza di fratture negli uomini trattati pioglitazone (1,3%) rispetto al gruppo di fronto (1,5%). L incidenza calcolata delle fratture è stata pari a 1,9 fratture per 100 pazienti-anno nelle donne trattate pioglitazone e ad 1,1 fratture per 100 pazienti-anno nelle donne trattate un medicinale di fronto. Pertanto l aumento del rischio di fratture per le donne in questo set di dati relativamente a pioglitazone risulta essere di 0,8 fratture per 100 pazienti-anno. Nello studio sul rischio cardiovascolare PROactive, della durata di 3,5 anni, 44/870 (5,1%; 1,0 fratture per 100 pazienti-anno) pazienti di sesso femminile trattate pioglitazone sono andate intro a fratture rispetto a 23/905 (2,5%; 0,5 fratture per 100 pazienti-anno) pazienti di sesso femminile trattate medicinale di fronto. Non è stato osservato alcun aumento dell incidenza di fratture negli uomini trattati pioglitazone (1,7%) rispetto a quelli trattati medicinale di fronto (2,1%). Il rischio di fratture deve essere preso in siderazione nella terapia a lungo termine nelle donne trattate pioglitazone. Come seguenza dell aumentata azione dell insulina, il trattamento pioglitazone in pazienti sindrome dell ovaio policistico può causare la ripresa dell ovulazione. Queste pazienti possono essere a rischio di gravidanza. Le pazienti devono essere sapevoli del rischio di gravidanza e se la paziente desidera intraprendere una gravidanza o se interviene una gravidanza, il trattamento deve essere interrotto (vedere paragrafo 4.6). 5
6 Pioglitazone deve essere usato cautela durante la somministrazione comitante di inibitori (es. gemfibrozil) o induttori (es. rifampicina) del citocromo P450 2C8. Il trollo glicemico deve essere monitorato attentamente. Devono essere siderati la titolazione della dose di pioglitazone all interno della posologia raccomandata o modifiche del trattamento del diabete (vedere paragrafo 4.5). Le compresse di Pioglitazone Accord tengono lattosio monoidrato e quindi non devono essere somministrate a pazienti rari problemi ereditari di intolleranza al galattosio, carenza di Lapp lattasi o malassorbimento di glucosio-galattosio. 4.5 Interazioni altri medicinali ed altre forme di interazione Studi di interazione hanno dimostrato che pioglitazone non ha alcun effetto rilevante né sulla farmacocinetica né sulla farmacodinamica di digossina, warfarin, fenprocumone e metformina. La cosomministrazione di pioglitazone sulfoniluree non sembra influenzare la farmacocinetica della sulfonilurea. Studi dotti nell'uomo suggeriso che non vi sia induzione del principale citocromo inducibile P450, 1A, 2C8/9 e 3A4. Studi in vitro non hanno evidenziato alcuna inibizione di alcun sottotipo del citocromo P450. Non sono attese interazioni medicinali metabolizzati da tali enzimi, ad es. traccettivi orali, ciclosporina, calcio antagonisti e inibitori della HMGCoA reduttasi. La co-somministrazione di pioglitazone gemfibrozil (un inibitore del citocromo P450 2C8) ha comportato un aumento di 3 volte dell AUC di pioglitazone. Poiché è possibile un aumento degli eventi avversi dose-correlati, può essere necessario diminuire la dose di pioglitazone quando gemfibrozil è somministrato in comitanza. Si deve siderare un attento monitoraggio del trollo glicemico (vedere paragrafo 4.4). La co-somministrazione di pioglitazone rifampicina (un induttore del citocromo P450 2C8) ha comportato una diminuzione del 54% dell AUC di pioglitazone. Può essere necessario aumentare la dose di pioglitazone quando la rifampicina è somministrata in comitanza. Si deve siderare un attento monitoraggio del trollo glicemico (vedere paragrafo 4.4). 4.6 Fertilità, gravidanza ed allattamento Gravidanza Non sono disponibili dati adeguati sull uomo per determinare la sicurezza di pioglitazone durante la gravidanza. Studi dotti sull animale pioglitazone hanno evidenziato un rallentamento dello sviluppo del feto. Questa osservazione è stata attribuita all'azione di pioglitazone nel diminuire l'iperinsulinemia materna e all aumentata insulino-resistenza che si verifica durante la gravidanza riducendo quindi la disponibilità dei substrati metabolici per la crescita del feto. La rilevanza di un simile meccanismo nell uomo non è chiara e pioglitazone non deve essere usato in gravidanza. Allattamento Pioglitazone è stato ritrovato nel latte di ratti in allattamento. Non è noto se pioglitazone passi nel latte materno. Quindi, pioglitazone non deve essere somministrato in donne in allattamento. Fertilità Negli studi sulla fertilità nell animale non è stato osservato alcun effetto sulla copulazione, sulla fedazione o sull indice di fertilità 4.7 Effetti sulla capacità di guidare veicoli e sull uso di macchinari Pioglitazone Accord non ha nessun effetto o ha un effetto trascurabile sulla capacità di guidare veicoli o di usare macchinari. Tuttavia, i pazienti che presentano disturbi visivi devono essere prudenti quando guidano o usano macchinari. 6
7 4.8 Effetti indesiderati Le reazioni avverse riportate in misura maggiore (> 0,5%) rispetto al placebo e in più di un caso isolato in pazienti che ricevevano pioglitazone in studi in doppio-cieco sono sotto elencate sedo la terminologia MedDRA per classe sistemica organica e frequenza assoluta. Le frequenze sono definite come: molto ( 1/10); ( 1/100, < 1/10); non (da 1/1.000 a < 1/100); raro (da 1/ a < 1/1.000); molto raro (< 1/10.000); non nota (la frequenza non può essere definita sulla base dei dati disponibili). All interno di ciascuna classe di frequenza, le reazioni avverse sono riportate in ordine decrescente di incidenza e di gravità. Reazione avversa Frequenza delle reazioni avverse a pioglitazone per regime di trattamento Associazione Infezioni ed infestazioni infezioni delle vie aeree superiori Monoterapia metformina sulfonilurea metformina e sulfonilurea insulina bronchite sinusite non non non non non Patologie del sistema emolinfopoietico anemia Disturbi del metabolismo e della nutrizione ipoglicemia non molto aumento non dell appetito Patologie del sistema nervoso ipo-estesia cefalea non capogiro insonnia non non non non non Patologie dell occhio disturbi visivi 1 non edema maculare 2 non nota non nota non nota non nota non nota Patologie dell orecchio e del labirinto vertigini Patologie cardiache insufficienza cardiaca 3 Tumori benigni, maligni e non specificati (cisti e polipi compresi) non 7
8 Reazione avversa Frequenza delle reazioni avverse a pioglitazone per regime di trattamento Associazione Monoterapia metformina sulfonilurea metformina e sulfonilurea insulina carcinoma della non non non non non vescica Patologie respiratorie, toraciche e mediastiniche dispnea Patologie gastrointestinali flatulenza non Patologie della cute e del tessuto sottocutaneo sudorazione non Patologie del sistema muscolo scheletrico e del tessuto nettivo fratture ossee 4 artralgia dolore alla schiena Patologie renali e urinarie ematuria glicosuria proteinuria Patologie dell apparato riproduttivo e della mammella disfunzione erettile Patologie sistemiche e dizioni relative alla sede di somministrazione edema non non molto affaticamento non Esami diagnostici aumento ponderale 5 aumento della creatina fosfochinasi nel sangue 8
9 Reazione avversa aumento della latticodeidrogenasi aumento della alanina aminotransferasi 6 Frequenza delle reazioni avverse a pioglitazone per regime di trattamento Associazione Monoterapia metformina sulfonilurea non metformina e sulfonilurea insulina non nota non nota non nota non nota non nota 1 Disturbi visivi sono stati riportati principalmente all inizio del trattamento e sono correlati alle modifiche della glicemia dovuti ad un alterazione temporanea della turgidità e dell indice di rifrazione del cristallino come osservato altri agenti ipoglicemizzanti. 2 È stato riportato edema nel 6-9% dei pazienti trattati pioglitazone per un anno in studi clinici trollati. Le percentuali di edema nei gruppi di fronto (sulfonilurea, metformina) sono stati del 2-5%. I casi di edema sono stati generalmente da lievi a moderati e di solito non hanno richiesto l interruzione del trattamento. 3 In studi clinici trollati l incidenza di segnalazioni di insufficienza cardiaca riportate il trattamento pioglitazone è stata la stessa osservata nei gruppi trattati placebo, metformina e sulfonilurea, ma è aumentata quando pioglitazone è stato utilizzato in terapia in associazione l insulina. In uno studio di outcome su pazienti malattia macrovascolare maggiore preesistente, l incidenza di insufficienza cardiaca grave è stata maggiore dell 1,6% pioglitazone rispetto al placebo, quando aggiunto ad una terapia che includeva insulina. Tuttavia, ciò non ha comportato un aumento della mortalità in questo studio. Raramente è stata riportata insufficienza cardiaca durante la commercializzazione di pioglitazone, ma più frequentemente quando pioglitazone è stato usato in associazione l insulina o in pazienti anamnesi di insufficienza cardiaca. 4 È stata dotta un analisi cumulativa delle reazioni avverse di fratture ossee riportate da studi clinici randomizzati, trollati verso medicinale di fronto, in doppio cieco in oltre pazienti trattati pioglitazone e trattati medicinale di fronto per un periodo superiore ai 3,5 anni. Un incidenza più elevata di fratture è stata osservata nelle donne trattate pioglitazone (2,6%) rispetto a quelle trattate medicinale di fronto (1,7%). Non è stato osservato alcun aumento dell incidenza di fratture negli uomini trattati pioglitazone (1,3%) rispetto a quelli trattati medicinale di fronto (1,5%). Nello studio PROactive, della durata di 3,5 anni, 44/870 (5,1%) pazienti di sesso femminile trattate pioglitazone sono andate intro a fratture rispetto a 23/905 (2,5%) pazienti di sesso femminile trattate medicinale di fronto. Non è stato osservato alcun aumento dell incidenza di fratture negli uomini trattati pioglitazone (1,7%) rispetto a quelli trattati medicinale di fronto (2,1%). 5 In studi trollati medicinale attivo l aumento di peso medio pioglitazone somministrato per un anno in monoterapia è stato di 2-3 kg. Questo risultato è stato simile a quello osservato nel gruppo di fronto sulfonilurea. L aumento di peso medio è stato di 1,5 kg negli studi in cui pioglitazone è stato associato a metformina e di 2,8 kg negli studi in cui pioglitazone è stato associato a sulfonilurea per più di un anno. Nei gruppi di fronto l aggiunta di sulfonilurea a metformina ha determinato un aumento del peso medio di 1,3 kg e l aggiunta di metformina a sulfonilurea ha determinato una perdita di peso medio di 1,0 kg. 6 Negli studi clinici pioglitazone, l incidenza dell aumento dell ALT di 3 volte i limiti superiori della norma è stata uguale al placebo ma inferiore a quella osservata nei gruppi di fronto trattati metformina o sulfonilurea. I livelli medi degli enzimi epatici sono diminuiti il trattamento 9
10 pioglitazone. Nell esperienza post-marketing si sono manifestati rari casi di aumento degli enzimi epatici e di disfunzione epatocellulare. Sebbene in casi molto rari siano stati riportati eventi fatali, la relazione causale non è stata stabilita. 4.9 Sovradosaggio Negli studi clinici i pazienti hanno assunto pioglitazone ad una dose più alta della dose massima raccomandata di 45 mg al giorno. La dose massima riportata di 120 mg/die per quattro giorni e successivamente 180 mg/die per sette giorni non è stata associata ad alcun sintomo. Si può verificare ipoglicemia in combinazione sulfoniluree o insulina. In caso di sovradosaggio devono essere prese misure sintomatiche e di supporto generale. 5. PROPRIETÀ FARMACOLOGICHE 5.1 Proprietà farmacodinamiche Categoria farmacoterapeutica: farmaci usati nel diabete, farmaci ipoglicemizzanti, escluse le insuline; codice ATC: A10BG03. Gli effetti di pioglitazone possono essere mediati da una riduzione dell insulino-resistenza. Pioglitazone sembra agire mediante l'attivazione di specifici recettori nel nucleo (recettore gamma attivato di proliferazione dei perossisomi) che porta ad un aumento della sensibilità insulinica del fegato, dei grassi e delle cellule muscolo scheletriche negli animali. Il trattamento pioglitazone ha dimostrato di ridurre la produzione di glucosio epatico e di aumentare la disponibilità di glucosio periferico in caso di insulino-resistenza. Viene migliorato il trollo della glicemia a digiuno e post-prandiale nei pazienti diabete mellito di tipo 2. Tale migliore trollo della glicemia è associato ad una riduzione delle centrazioni plasmatiche di insulina sia a digiuno che post-prandiale. Uno studio clinico dotto pioglitazone vs gliclazide in monoterapia è stato prolungato a due anni per valutare il tempo al fallimento del trattamento (definito come HbA 1c 8,0% dopo i primi sei mesi di terapia). L analisi di Kaplan-Meier ha mostrato un tempo al fallimento del trattamento inferiore nei pazienti trattati gliclazide, rispetto a quelli trattati pioglitazone. A due anni, il trollo glicemico (definito come HbA 1c < 8,0%) si è mantenuto nel 69% dei pazienti trattati pioglitazone, in fronto al 50% dei pazienti trattati gliclazide. In uno studio a due anni di terapia combinata che ha frontato pioglitazone gliclazide quando aggiunto a metformina, il trollo glicemico misurato come variazione media rispetto al basale HbA 1c è stato simile fra i gruppi di trattamento dopo un anno. La percentuale di deterioramento dell HbA 1c durante il sedo anno è stata inferiore pioglitazone rispetto a gliclazide. In uno studio trollato verso placebo, i pazienti inadeguato trollo glicemico nonostante un periodo di 3 mesi di terapia ottimizzata insulina sono stati randomizzati a pioglitazone o placebo per 12 mesi. I pazienti trattati pioglitazone hanno avuto una riduzione media di HbA 1c di 0,45% rispetto a quelli che hanno tinuato la terapia la sola insulina, e una riduzione della dose di insulina nel gruppo trattato pioglitazone. L analisi HOMA mostra che pioglitazone migliora la funzione delle cellule beta così come aumenta la sensitività all insulina. Studi clinici della durata di due anni hanno mostrato il mantenimento di questo effetto. In studi clinici della durata di un anno, pioglitazone ha costantemente causato una riduzione statisticamente significativa del rapporto albumina/creatinina rispetto al basale. L effetto di pioglitazone (monoterapia 45 mg vs placebo) è stato valutato in un piccolo studio a 18 settimane, in pazienti diabete di tipo 2. Pioglitazone era associato ad un significativo aumento di peso. Il grasso viscerale era significativamente diminuito, mentre c era stato un aumento della 10
11 massa grassa extra-addominale. Tali modifiche nella distribuzione del grasso corporeo pioglitazone sono state accompagnate da un aumento nella sensibilità all insulina. Nella maggior parte degli studi clinici, sono stati osservati riduzione dei livelli totali plasmatici dei trigliceridi e degli acidi grassi liberi e aumento dei livelli di colesterolo HDL rispetto al placebo, aumenti piccoli ma non clinicamente significativi dei livelli di colesterolo LDL. In studi clinici una durata fino a due anni, pioglitazone ha ridotto i trigliceridi plasmatici totali e gli acidi grassi liberi, e ha aumentato i livelli di colesterolo HDL rispetto a placebo, metformina e gliclazide. Pioglitazone non ha causato aumenti statisticamente significativi nei livelli di colesterolo LDL in fronto al placebo, mentre si sono osservate riduzioni metformina e gliclazide. In uno studio di 20 settimane, oltre a ridurre i trigliceridi a digiuno, pioglitazone ha ridotto l ipertrigliceridemia post-prandiale un effetto sui trigliceridi sia assorbiti sia sintetizzati a livello epatico. Questi effetti sono stati indipendenti dagli effetti di pioglitazone sulla glicemia e sono stati diversi in modo statisticamente significativo rispetto a glibenclamide. Nel PROactive, uno studio di outcome cardiovascolare, 5238 pazienti diabete mellito di tipo 2 e malattia macrovascolare maggiore pre-esistente, sono stati randomizzati a pioglitazone o placebo in aggiunta alla terapia antidiabetica e cardiovascolare in corso, sino a 3,5 anni. La popolazione in studio aveva un età media di 62 anni; la durata media del diabete era di 9,5 anni. Approssimativamente un terzo dei pazienti stava assumendo insulina in combinazione metformina e/o una sulfonilurea. Per essere eleggibili, i pazienti dovevano aver avuto una o più delle seguenti dizioni: infarto del miocardio, ictus, intervento cardiaco percutaneo o innesto di bypass coronarico, sindrome coronarica acuta, malattia coronarica, o arteriopatia ostruttiva periferica. Quasi la metà dei pazienti aveva un precedente infarto del miocardio e approssimativamente il 20% aveva avuto un ictus. Circa metà della popolazione in studio aveva all anamnesi cardiovascolare almeno due dei criteri di inclusione. Quasi tutti i soggetti (95%) stavano assumendo prodotti medicinali cardiovascolari (beta-bloccanti, ACEinibitori, antagonisti dell Angiotensina II, Ca-antagonisti, nitrati, diuretici, aspirina, statine, fibrati). Sebbene lo studio non abbia raggiunto l end point primario, che era un end-point composito di mortalità per tutte le cause, infarto non fatale del miocardio, ictus, sindrome coronarica acuta, amputazione maggiore della gamba, rivascolarizzazione coronarica e della gamba, i risultati suggeriso che non ci sono problemi cardiovascolari a lungo termine l uso di pioglitazone. Comunque, le incidenze di edema, aumento di peso ed insufficienza cardiaca erano aumentate. Non è stato osservato alcun aumento nella mortalità a causa di insufficienza cardiaca. Popolazione pediatrica L Agenzia Europea dei Medicinali ha esonerato il titolare dell AIC dall obbligo di presentare i risultati di studi Pioglitazone in tutti i sottogruppi della popolazione pediatrica affetta da Diabete Mellito di Tipo 2. Vedere il paragrafo 4.2 per informazioni sull'uso pediatrico. 5.2 Proprietà farmacocinetiche Assorbimento Dopo la somministrazione orale, pioglitazone viene assorbito rapidamente e i picchi delle centrazioni plasmatiche di pioglitazone immodificato generalmente si ottengono a 2 ore dalla somministrazione. Aumenti proporzionali della centrazione plasmatica sono stati osservati per dosi da 2 a 60 mg. Lo steady-state si raggiunge dopo 4-7 giorni di somministrazione. Dosaggi ripetuti non si traduo in accumulo del medicinale o di metaboliti. L'assorbimento non è influenzato dall'assunzione di cibo. La biodisponibilità assoluta è superiore all'80 %. Distribuzione Il volume di distribuzione stimato nell uomo è di 0,25 l/kg. Pioglitazone e tutti i metaboliti attivi si legano ampiamente alle proteine plasmatiche (> 99%). 11
12 Biotrasformazione Pioglitazone viene ampiamente metabolizzato dal fegato mediante idrossilazione dei gruppi metilenici alifatici. Questo avviene soprattutto mediante il citocromo P450 2C8, sebbene altre isoforme possano essere coinvolte in minor grado. Tre dei sei metaboliti identificati sono attivi (M-II, M-III e M-IV). Quando sono presi in siderazione l attività, le centrazioni e il legame alle proteine, pioglitazone ed il metabolita M-III tribuiso ugualmente all efficacia. Su questa base il tributo di M-IV all efficacia è approssimativamente tre volte quello di pioglitazone, mentre è minima l efficacia relativa di M-II. Studi in vitro non hanno evidenziato che pioglitazone inibisca alcun sottotipo di citocromo P450. Non c è nessuna induzione dei principali isoenzimi inducibili del P450 nell'uomo, 1A, 2C8/9 e 3A4. Studi di interazione hanno dimostrato che pioglitazone non ha alcun effetto rilevante né sulla farmacocinetica né sulla farmacodinamica di digossina, warfarin, fenprocumone e metformina. La somministrazione comitante di pioglitazone gemfibrozil (un inibitore del citocromo P450 2C8) o rifampicina (un induttore del citocromo P450 2C8) ha causato un aumento o una diminuzione, rispettivamente, delle centrazioni plasmatiche di pioglitazone (vedere paragrafo 4.5). Eliminazione Dopo la somministrazione orale di pioglitazone radiomarcato nell uomo, la quota principale di sostanza marcata è stata recuperata nelle feci (55%) e una minore quantità nelle urine (45%). Negli animali, solamente una piccola quantità di pioglitazone immodificato può essere rilevata nelle urine o nelle feci. Nell uomo l'emivita media di eliminazione plasmatica è di 5-6 ore per pioglitazone immodificato, e di ore per i suoi metaboliti attivi totali. Anziani La farmacocinetica allo steady-state è simile in pazienti età uguale o superiore a 65 anni ed in soggetti giovani. Pazienti insufficienza renale Nei pazienti insufficienza renale le centrazioni plasmatiche di pioglitazone e dei suoi metaboliti sono inferiori a quelle osservate in soggetti funzionalità renale normale, ma una clearance orale simile per quanto riguarda il medicinale originale. Quindi la centrazione di pioglitazone libero (non legato) risulta immodificata. Pazienti insufficienza epatica La centrazione plasmatica totale di pioglitazone risulta immodificata, ma un aumentato volume di distribuzione. Di seguenza la clearance intrinseca è ridotta, associata ad una più elevata frazione di pioglitazone non legato. 5.3 Dati preclinici di sicurezza In studi tossicologici, l espansione del volume plasmatico emodiluizione, anemia e ipertrofia cardiaca eccentrica reversibile si è manifestata in maniera costante dopo somministrazioni ripetute in topi, ratti, cani e scimmie. Inoltre, sono stati osservati un aumentato deposito ed infiltrazione di grassi. Questi risultati sono stati osservati tra le specie a centrazioni plasmatiche 4 volte l esposizione clinica. La ridotta crescita fetale si è manifestata negli studi pioglitazone negli animali. Questo è attribuibile all azione di pioglitazone nel diminuire l iperinsulinemia materna e all aumentata insulinoresistenza che insorge durante la gravidanza riducendo così la disponibilità di substrati metabolici per la crescita fetale. 12
13 Pioglitazone è risultato privo di potenziale genotossico in una serie completa di esami per la genotossicità eseguiti in vivo ed in vitro. In ratti trattati pioglitazone per periodi fino a 2 anni è stata osservata una aumentata incidenza di iperplasia (maschi e femmine) e tumori (maschi) dell'epitelio della vescica urinaria. È stato ipotizzato che la formazione e la presenza di calcoli urinari successiva irritazione ed iperplasia sia la base meccanicistica della risposta tumorigenica osservata nel ratto maschio. Uno studio meccanicistico a 24 mesi nei ratti maschi ha dimostrato che la somministrazione di pioglitazone ha determinato un aumento dell incidenza di variazioni iperplastiche nella vescica: L acidificazione della dieta ha ridotto significativamente ma non ha abolito l incidenza di tumori. La presenza di microcristalli ha esacerbato la risposta iperplastica ma non è stata siderata la causa principale di variazioni iperplastiche. La rilevanza per l uomo degli effetti tumorigenici osservati nel ratto maschio non può essere esclusa. Non vi è stata alcuna risposta tumorigenica in topi di entrambi i sessi. Non è stata osservata iperplasia della vescica urinaria in cani o in scimmie trattati pioglitazone fino a 12 mesi. In un modello animale di poliposi adenomatosa familiare (FAP), il trattamento altri due tiazolidinedioni ha aumentato la molteplicità del tumore nel colon. La rilevanza di questo risultato è sosciuta. Valutazione del rischio ambientale: non si prevede che l uso clinico di pioglitazone abbia un impatto sull ambiente. 6. INFORMAZIONI FARMACEUTICHE 6.1 Elenco degli eccipienti Carmellosa calcica Idrossipropil cellulosa Lattosio monoidrato Magnesio stearato 6.2 Incompatibilità Non pertinente. 6.3 Periodo di validità 3 anni. 6.4 Precauzioni particolari per la servazione Questo medicinale non richiede alcuna speciale dizione di servazione. 6.5 Natura e tenuto del tenitore Blister in alluminio/alluminio in fezioni da 14, 28, 30, 50, 56, 84, 90, 98, 112 e 196 compresse. È possibile che non tutte le fezioni siano commercializzate. 6.6 Precauzioni particolari per lo smaltimento Nessuna istruzione particolare. 13
14 7. TITOLARE DELL'AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO Accord Healthcare Limited 5th Floor Charles House, Finchley Road, London NW3 5JJ Regno Unito 8. NUMERO(I) DI AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO 9. DATA DELLA PRIMA AUTORIZZAZIONE/ RINNOVO DELL AUTORIZZAZIONE 10. DATA DI REVISIONE DEL TESTO Informazioni più dettagliate su questo medicinale sono disponibili sul sito web della Agenzia Europea dei Medicinali: 14
15 1. DENOMINAZIONE DEL MEDICINALE Pioglitazone Accord 30 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa tiene 30 mg di pioglitazone (come cloridrato). Eccipiente(i): Ciascuna compressa tiene 74,46 mg di lattosio monoidrato (vedere paragrafo 4.4). Per l elenco degli eccipienti, vedere paragrafo FORMA FARMACEUTICA Compressa. Le compresse sono di colore da bianco a biancastro, piatte, tonde, non rivestite, bordi smussati, PIO impresso su un lato e '30 sull'altro lato. 4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Pioglitazone è indicato come trattamento di seda o terza linea per il diabete mellito di tipo 2, come esposto qui di seguito: in monoterapia - in pazienti adulti (in particolare pazienti sovrappeso) non adeguatamente trollati dalla dieta e dall esercizio fisico per i quali il trattamento metformina è inappropriato a causa di troindicazioni o intolleranza. Dopo l inizio della terapia pioglitazone, i pazienti devono essere rivalutati dopo 3-6 mesi per verificare l adeguatezza della risposta al trattamento (ad esempio, la riduzione della HbA1c). Nei pazienti che non rispondono adeguatamente, il trattamento pioglitazone deve essere interrotto. Alla luce dei potenziali rischi di una terapia prolungata, i prescrittori devono fermare, in occasione delle visite successive, che i benefici del trattamento pioglitazone siano mantenuti (vedere paragrafo 4.4). 4.2 Posologia e modo di somministrazione Posologia Il trattamento pioglitazone può essere somministrato ad una dose iniziale di 15 mg o 30 mg una volta al giorno. La dose può essere aumentata gradualmente fino a 45 mg una volta al giorno. Popolazioni speciali Anziani Non è necessario alcun aggiustamento della dose nei pazienti anziani (vedere paragrafo 5.2). I medici devono iniziare il trattamento la dose più bassa disponibile ed aumentarla gradualmente, in particolare quando pioglitazone viene utilizzato in combinazione insulina (vedere paragrafo 4.4 Ritenzione idrica e insufficienza cardiaca). 15
16 Insufficienza renale Non è necessario alcun aggiustamento della dose nei pazienti funzionalità renale compromessa (clearance della creatinina > 4 ml/min) (vedere paragrafo 5.2) Non sono disponibili informazioni su pazienti in dialisi, pertanto in tali pazienti pioglitazone non deve essere usato. Insufficienza epatica Pioglitazone non deve essere usato in pazienti insufficienza epatica (vedere paragrafi 4.3 e 4.4). Popolazione pediatrica La sicurezza e l efficacia di Pioglitazone Accord nei bambini e negli adolescenti età inferiore ai 18 anni non sono state ancora stabilite. Non ci sono dati disponibili. Modo di somministrazione Le compresse di pioglitazone vengono assunte per via orale una volta al giorno o senza cibo. Le compresse devono essere deglutite un bicchiere d acqua. 4.3 Controindicazioni Pioglitazone è troindicato in pazienti : - ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti - insufficienza cardiaca o storia di insufficienza cardiaca (NYHA stadi da I a IV) - insufficienza epatica - chetoacidosi diabetica - carcinoma della vescica in fase attiva o anamnesi positiva per carcinoma della vescica - ematuria macroscopica di natura non accertata Avvertenze speciali e precauzioni di impiego Ritenzione idrica e insufficienza cardiaca Pioglitazone può causare ritenzione idrica che può esacerbare o precipitare una insufficienza cardiaca. Quando vengono trattati pazienti che presentano almeno un fattore di rischio per lo sviluppo di insufficienza cardiaca gestizia (es. precedente infarto del miocardio o malattia coronarica sintomatica o gli anziani), i medici devono iniziare il trattamento la più bassa dose disponibile e aumentare la dose gradualmente. I pazienti devono essere osservati relativamente a segni e sintomi di insufficienza cardiaca, aumento di peso o edema, particolarmente quelli una ridotta riserva cardiaca. Sono stati riportati nel post-marketing casi di insufficienza cardiaca quando pioglitazone è stato usato in combinazione insulina o in pazienti storia di insufficienza cardiaca. I pazienti devono essere osservati rispetto a segni e sintomi di insufficienza cardiaca, aumento di peso ed edema quando pioglitazone è usato in combinazione insulina. Poiché insulina e pioglitazone sono entrambi associati a ritenzione idrica, la somministrazione comitante può aumentare il rischio di edema. Pioglitazone deve essere sospeso se si manifesta qualsiasi deterioramento dello stato cardiaco. Uno studio di outcome cardiovascolare di pioglitazone è stato effettuato in pazienti di età inferiore a 75 anni diabete mellito di tipo 2 e preesistente malattia macrovascolare maggiore. Pioglitazone o placebo sono stati aggiunti alla terapia antidiabetica e cardiovascolare in corso fino a 3,5 anni. Questo studio ha mostrato un aumento nelle segnalazioni di insufficienza cardiaca, tuttavia ciò non ha comportato un aumento nella mortalità in questo studio. 16
17 Anziani L uso combinato di pioglitazone ed insulina deve essere valutato cautela negli anziani, a causa dell aumento del rischio di insufficienza cardiaca grave. Alla luce dei rischi correlati all età (in particolare carcinoma della vescica, fratture ed insufficienza cardiaca) il bilancio tra i rischi ed i benefici deve essere siderato accuratamente negli anziani sia prima che durante il trattamento pioglitazone. Carcinoma della vescica In una metanalisi su studi clinici trollati i casi di carcinoma della vescica sono stati segnalati più frequentemente pioglitazone (19 casi su pazienti, 0,15%) rispetto ai gruppi di trollo (7 casi su pazienti, 0,07%) HR = 2,64 (95% CI; 1,11-6,31; P=0,029). Dopo avere escluso i pazienti nei quali l esposizione al medicinale in studio era stata inferiore ad un anno al momento della diagnosi di carcinoma della vescica, i casi relativi a pioglitazone erano 7 (0,06%) mentre quelli relativi ai gruppi di trollo erano 2 (0,02%). Anche i dati epidemiologici disponibili suggeriso un lieve aumento del rischio di carcinoma della vescica nei pazienti diabetici trattati pioglitazone, in particolare nei pazienti trattati per periodi più prolungati e i dosaggi cumulativi più alti. Non può essere escluso un possibile rischio dopo trattamenti a breve termine. I fattori di rischio per il carcinoma della vescica devono essere valutati prima di iniziare il trattamento pioglitazone (i rischi includono l età, fumo, esposizione ad alcune sostanze usate in ambienti lavorativi o chemioterapici quali ciclofosfamide oppure precedente radioterapia esposizione dell area pelvica). Qualunque ematuria macroscopica deve essere indagata prima di iniziare la terapia pioglitazone. I pazienti devono sultare immediatamente il proprio medico se durante il trattamento dovessero insorgere sintomi quali ematuria macroscopica, disuria o urgenza della minzione. Monitoraggio della funzionalità epatica Durante l esperienza post-marketing raramente è stata riportata disfunzione epatocellulare (vedere paragrafo 4.8). Si raccomanda, quindi, che i pazienti trattati pioglitazone siano sottoposti a monitoraggio periodico degli enzimi epatici. Gli enzimi epatici devono essere trollati prima di iniziare la terapia pioglitazone in tutti i pazienti. La terapia pioglitazone non deve essere iniziata in pazienti aumentati livelli basali degli enzimi epatici (ALT > 2,5 volte il limite superiore della norma) o qualsiasi evidenza di malattia epatica. Dopo l inizio della terapia pioglitazone, si raccomanda di monitorare gli enzimi epatici periodicamente sedo necessità clinica. Se i livelli di ALT sono aumentati di 3 volte il limite superiore della norma durante la terapia pioglitazone, i livelli degli enzimi epatici devono essere rivalutati appena possibile. Se i livelli di ALT rimangono > 3 volte il limite superiore della norma, la terapia deve essere interrotta. Se qualche paziente manifesta sintomi che suggeriso disfunzione epatica, che possono includere nausea inspiegabile, vomito, dolore addominale, affaticamento, anoressia e/o urine scure, devono essere trollati gli enzimi epatici. La decisione se tinuare a trattare il paziente pioglitazone deve essere guidata dal giudizio clinico in attesa delle valutazioni di laboratorio. Se si manifesta ittero, il medicinale deve essere sospeso. Aumento di peso Negli studi clinici pioglitazone si è evidenziato aumento di peso dose-correlato, che può essere dovuto ad accumulo di adipe e in qualche caso associato a ritenzione idrica. In alcuni casi l aumento di 17
18 peso può essere un sintomo di insufficienza cardiaca, quindi il peso deve essere attentamente monitorato. Il trollo della dieta fa parte del trattamento del diabete. I pazienti devono essere informati che devono seguire rigorosamente una dieta a calorie trollate. Ematologia È stata osservata una lieve riduzione dell emoglobina media (riduzione relativa del 4%) e dell ematocrito (riduzione relativa del 4,1%) durante la terapia pioglitazone, sistente in emodiluizione. Modifiche simili sono state osservate in pazienti trattati metformina (riduzione relativa dell emoglobina 3-4% e dell ematocrito 3,6-4,1%) ed in misura minore in quelli trattati sulfonilurea e insulina (riduzione relativa dell emoglobina 1-2% e dell ematocrito 1-3,2%) in studi comparativi trollati pioglitazone. Ipoglicemia Come seguenza dell aumentata sensibilità all insulina, i pazienti che ricevono pioglitazone in duplice o triplice terapia orale una sulfonilurea o in duplice terapia insulina possono essere a rischio di ipoglicemia dose-correlata, e può essere necessaria una riduzione nella dose della sulfonilurea o dell insulina. Disturbi visivi Sono stati riportati i tiazolidinedioni, incluso pioglitazone, casi post-marketing di nuova insorgenza o peggioramento di edema maculare diabetico, diminuzione dell acuità visiva. Molti di questi pazienti hanno manifestato edema periferico comitante. Non è chiaro se esista o meno un associazione diretta tra pioglitazone ed edema maculare, ma i medici devono fare attenzione alla possibilità di edema maculare se i pazienti riferiso disturbi dell acuità visiva; si deve siderare l opportunità di una appropriata visita oftalmologica. Altro In un analisi cumulativa delle reazioni avverse di fratture ossee riportate da studi clinici randomizzati, trollati, in doppio cieco in oltre pazienti trattati pioglitazone e trattati medicinale di fronto per un periodo superiore ai 3,5 anni, è stata osservata un aumentata incidenza di fratture ossee nelle donne. Sono state osservate fratture nel 2,6% delle donne trattate pioglitazone rispetto all 1,7% di donne trattate medicinale di fronto. Non è stato osservato alcun aumento dell incidenza di fratture negli uomini trattati pioglitazone (1,3%) rispetto al gruppo di fronto (1,5%). L incidenza calcolata delle fratture è stata pari a 1,9 fratture per 100 pazienti-anno nelle donne trattate pioglitazone e ad 1,1 fratture per 100 pazienti-anno nelle donne trattate un medicinale di fronto. Pertanto l aumento del rischio di fratture per le donne in questo set di dati relativamente a pioglitazone risulta essere di 0,8 fratture per 100 pazienti-anno. Nello studio sul rischio cardiovascolare PROactive, della durata di 3,5 anni, 44/870 (5,1%; 1,0 fratture per 100 pazienti-anno) pazienti di sesso femminile trattate pioglitazone sono andate intro a fratture rispetto a 23/905 (2,5%; 0,5 fratture per 100 pazienti-anno) pazienti di sesso femminile trattate medicinale di fronto. Non è stato osservato alcun aumento dell incidenza di fratture negli uomini trattati pioglitazone (1,7%) rispetto a quelli trattati medicinale di fronto (2,1%). Il rischio di fratture deve essere preso in siderazione nella terapia a lungo termine nelle donne trattate pioglitazone. 18
19 Come seguenza dell aumentata azione dell insulina, il trattamento pioglitazone in pazienti sindrome dell ovaio policistico può causare la ripresa dell ovulazione. Queste pazienti possono essere a rischio di gravidanza. Le pazienti devono essere sapevoli del rischio di gravidanza e se la paziente desidera intraprendere una gravidanza o se interviene una gravidanza il trattamento deve essere interrotto (vedere paragrafo 4.6). Pioglitazone deve essere usato cautela durante la somministrazione comitante di inibitori (es. gemfibrozil) o induttori (es. rifampicina) del citocromo P450 2C8. Il trollo glicemico deve essere monitorato attentamente. Devono essere siderati la titolazione della dose di pioglitazone all interno della posologia raccomandata o modifiche del trattamento del diabete (vedere paragrafo 4.5). Le compresse di Pioglitazone Accord tengono lattosio monoidrato e quindi non devono essere somministrate a pazienti rari problemi ereditari di intolleranza al galattosio, carenza di Lapp lattasi o malassorbimento di glucosio-galattosio. 4.5 Interazioni altri medicinali ed altre forme di interazione Studi di interazione hanno dimostrato che pioglitazone non ha alcun effetto rilevante né sulla farmacocinetica né sulla farmacodinamica di digossina, warfarin, fenprocumone e metformina. La cosomministrazione di pioglitazone sulfoniluree non sembra influenzare la farmacocinetica della sulfonilurea. Studi dotti nell'uomo suggeriso che non vi sia induzione del principale citocromo inducibile P450, 1A, 2C8/9 e 3A4. Studi in vitro non hanno evidenziato alcuna inibizione di alcun sottotipo del citocromo P450. Non sono attese interazioni medicinali metabolizzati da tali enzimi, ad es. traccettivi orali, ciclosporina, calcio antagonisti e inibitori della HMGCoA reduttasi. La co-somministrazione di pioglitazone gemfibrozil (un inibitore del citocromo P450 2C8) ha comportato un aumento di 3 volte dell AUC di pioglitazone. Poiché è possibile un aumento degli eventi avversi dose-correlati, può essere necessario diminuire la dose di pioglitazone quando gemfibrozil è somministrato in comitanza. Si deve siderare un attento monitoraggio del trollo glicemico (vedere paragrafo 4.4). La co-somministrazione di pioglitazone rifampicina (un induttore del citocromo P450 2C8) ha comportato una diminuzione del 54% dell AUC di pioglitazone. Può essere necessario aumentare la dose di pioglitazone quando la rifampicina è somministrata in comitanza. Si deve siderare un attento monitoraggio del trollo glicemico (vedere paragrafo 4.4). 4.6 Fertilità, gravidanza ed allattamento Gravidanza Non sono disponibili dati adeguati sull uomo per determinare la sicurezza di pioglitazone durante la gravidanza. Studi dotti sull animale pioglitazone hanno evidenziato un rallentamento dello sviluppo del feto. Questa osservazione è stata attribuita all'azione di pioglitazone nel diminuire l'iperinsulinemia materna e all aumentata insulino-resistenza che si verifica durante la gravidanza riducendo quindi la disponibilità dei substrati metabolici per la crescita del feto. La rilevanza di un simile meccanismo nell uomo non è chiara e pioglitazone non deve essere usato in gravidanza. Allattamento Pioglitazone è stato ritrovato nel latte di ratti in allattamento. Non è noto se pioglitazone passi nel latte materno. Quindi, pioglitazone non deve essere somministrato in donne in allattamento. Fertilità Negli studi sulla fertilità nell animale non è stato osservato alcun effetto sulla copulazione, sulla fedazione o sull indice di fertilità. 19
20 4.7 Effetti sulla capacità di guidare veicoli e sull uso di macchinari Pioglitazone Accord non ha nessun effetto o ha un effetto trascurabile sulla capacità di guidare veicoli o di usare macchinari. Tuttavia, i pazienti che presentano disturbi visivi devono essere prudenti quando guidano o usano macchinari. 4.8 Effetti indesiderati Le reazioni avverse riportate in misura maggiore (> 0,5%) rispetto al placebo e in più di un caso isolato in pazienti che ricevevano pioglitazone in studi in doppio-cieco sono sotto elencate sedo la terminologia MedDRA per classe sistemica organica e frequenza assoluta. Le frequenze sono definite come: molto ( 1/10); ( 1/100, < 1/10); non (da 1/1.000 a < 1/100); raro (da 1/ a < 1/1.000); molto raro (< 1/10.000); non nota (la frequenza non può essere definita sulla base dei dati disponibili). All interno di ciascuna classe di frequenza, le reazioni avverse sono riportate in ordine decrescente di incidenza e di gravità. Reazione avversa Frequenza delle reazioni avverse a pioglitazone per regime di trattamento Associazione Infezioni ed infestazioni infezioni delle vie aeree superiori Monoterapia metformina sulfonilurea metformina e sulfonilurea insulina bronchite sinusite non non non non non Patologie del sistema emolinfopoietico anemia Disturbi del metabolismo e della nutrizione ipoglicemia non molto aumento non dell appetito Patologie del sistema nervoso ipo-estesia cefalea non capogiro insonnia non non non non non Patologie dell occhio disturbi visivi 1 non edema maculare 2 non nota non nota non nota non nota non nota Patologie dell orecchio e del labirinto vertigini Patologie cardiache non 20
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Pioglitazone Teva Pharma 15 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 15
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Pioglitazone Teva Pharma 15 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 15
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Actos 15 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 15 mg di pioglitazone
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Actos 15 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene 15 mg di pioglitazone
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E CON L'AGENZIA ITALIANA DEL FARMACO (AIFA) Importanti informazioni di sicurezza su pioglitazone e lieve aumento del rischio di
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E CON L'AGENZIA ITALIANA DEL FARMACO (AIFA) Importanti informazioni di sicurezza su pioglitazone e lieve aumento del rischio di
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Competact 15 mg/850 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Competact 15 mg/850 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene
Allegato I. Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio
 Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
Allegato I Conclusioni scientifiche e motivi della variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche Vista la relazione di valutazione del comitato di valutazione
FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA FINASTERIDE ZENTIVA 5 MG COMPRESSE RIVESTITE CON FILM Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE AVANDIA 2 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa contiene
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE AVANDIA 2 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa contiene
CONFRONTO SCHEDE TECNICHE INIBITORI DI POMPA
 CONFRONTO SCHEDE TECNICHE INIBITORI DI POMPA Documento approvato nella seduta della Commissione PTR del 18.04.07 assorbimento L assorbimento di alcuni farmaci può La ridotta acidità intragastrica Alterazioni
CONFRONTO SCHEDE TECNICHE INIBITORI DI POMPA Documento approvato nella seduta della Commissione PTR del 18.04.07 assorbimento L assorbimento di alcuni farmaci può La ridotta acidità intragastrica Alterazioni
Allegato III. Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Queste modifiche agli specifici paragrafi del Riassunto delle Caratteristiche
Allegato III Modifiche agli specifici paragrafi del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Queste modifiche agli specifici paragrafi del Riassunto delle Caratteristiche
DDD*10.000 ab.p./die ASL BO METFORMINA 125,26 107,24 BIGUANIDI E SULFONAMIDI 110,83 121,01 ROSIGLITAZONE 0,89 2,28
 Aspetti normativi della prescrizione dei nuovi Antidiabetici Orali Dott.Donato Zocchi MMG Confronto R.E.R.- A.USL BO prescrizioni I sem. 2007 GRUPPO TERAPEUTICO DDD*10.000 ab.p./die ASL BO DDD*10.000 ab.p./die
Aspetti normativi della prescrizione dei nuovi Antidiabetici Orali Dott.Donato Zocchi MMG Confronto R.E.R.- A.USL BO prescrizioni I sem. 2007 GRUPPO TERAPEUTICO DDD*10.000 ab.p./die ASL BO DDD*10.000 ab.p./die
Attività fisica_raccomandazioni progetto cuore
 Attività fisica_raccomandazioni progetto cuore Attività fisica_raccomandazioni progetto cuore Attività fisica_raccomandazioni progetto cuore Attività fisica_esercizio aerobico Aiuta mantenere peso ideale
Attività fisica_raccomandazioni progetto cuore Attività fisica_raccomandazioni progetto cuore Attività fisica_raccomandazioni progetto cuore Attività fisica_esercizio aerobico Aiuta mantenere peso ideale
Il sale è un elemento fondamentale per l alimentazione umana ed è costituito da cloruro di sodio (NaCl). Una sua eccessiva introduzione però può
 Sale e salute Il sale è un elemento fondamentale per l alimentazione umana ed è costituito da cloruro di sodio (NaCl). Una sua eccessiva introduzione però può causare gravi problemi alla salute. La quantità
Sale e salute Il sale è un elemento fondamentale per l alimentazione umana ed è costituito da cloruro di sodio (NaCl). Una sua eccessiva introduzione però può causare gravi problemi alla salute. La quantità
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Competact 15 mg/850 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Competact 15 mg/850 mg compresse rivestite con film. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa
Le malattie cardiovascolari (MCV) sono la principale causa di morte nelle donne, responsabili del 54% dei decessi femminili in Europa
 Red Alert for Women s Heart Compendio DONNE E RICERCA CARDIOVASCOLARE Le malattie cardiovascolari (MCV) sono la principale causa di morte nelle donne, responsabili del 54% dei decessi femminili in Europa
Red Alert for Women s Heart Compendio DONNE E RICERCA CARDIOVASCOLARE Le malattie cardiovascolari (MCV) sono la principale causa di morte nelle donne, responsabili del 54% dei decessi femminili in Europa
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OMEGA 3 DOC Generici 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula molle contiene 1000 mg di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OMEGA 3 DOC Generici 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula molle contiene 1000 mg di
sembra una Anche qui sembra questione di sesso: Aspirina e donne
 sembra una Anche qui sembra questione di sesso: Aspirina e donne The Women s Health Study Razionale per l uso di bassi dosaggi di aspirina nella prevenzione primaria Nella prevenzione secondaria delle
sembra una Anche qui sembra questione di sesso: Aspirina e donne The Women s Health Study Razionale per l uso di bassi dosaggi di aspirina nella prevenzione primaria Nella prevenzione secondaria delle
Valutazione dell IG di Frollini tradizionali e preparati con farina con l aggiunta del % di Freno SIGI.
 Valutazione dell IG di Frollini tradizionali e preparati con farina con l aggiunta del % di Freno SIGI. Premessa L'indice glicemico (IG) di un alimento, definito come l'area sotto la curva (AUC) della
Valutazione dell IG di Frollini tradizionali e preparati con farina con l aggiunta del % di Freno SIGI. Premessa L'indice glicemico (IG) di un alimento, definito come l'area sotto la curva (AUC) della
Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA QUETIAPINA ZENTIVA 25 MG COMPRESSE RIVESTITE CON FILM QUETIAPINA ZENTIVA 100 MG COMPRESSE RIVESTITE CON FILM QUETIAPINA ZENTIVA 200 MG COMPRESSE RIVESTITE CON FILM QUETIAPINA ZENTIVA 300
FARMACOVIGILANZA QUETIAPINA ZENTIVA 25 MG COMPRESSE RIVESTITE CON FILM QUETIAPINA ZENTIVA 100 MG COMPRESSE RIVESTITE CON FILM QUETIAPINA ZENTIVA 200 MG COMPRESSE RIVESTITE CON FILM QUETIAPINA ZENTIVA 300
Diabete. Malattia metabolica cronica dipendente da una insufficiente produzione di insulina. Ridotta disponibilità alterazione della normale azione
 Diabete Malattia metabolica cronica dipendente da una insufficiente produzione di insulina Ridotta disponibilità alterazione della normale azione Epidemiologia Popolazione mondiale affetta intorno al 5%
Diabete Malattia metabolica cronica dipendente da una insufficiente produzione di insulina Ridotta disponibilità alterazione della normale azione Epidemiologia Popolazione mondiale affetta intorno al 5%
FOGLIETTO ILLUSTRATIVO FUSIDIUM 1%
 FOGLIETTO ILLUSTRATIVO FUSIDIUM 1% FUSIDIUM 1 % Gocce oftalmiche Acido Fusidico CATEGORIA FARMACOTERAPEUTICA Antinfettivo oculare. INDICAZIONI Fusidium è indicato in infezioni batteriche oculari causate
FOGLIETTO ILLUSTRATIVO FUSIDIUM 1% FUSIDIUM 1 % Gocce oftalmiche Acido Fusidico CATEGORIA FARMACOTERAPEUTICA Antinfettivo oculare. INDICAZIONI Fusidium è indicato in infezioni batteriche oculari causate
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L Agenzia Italiana del Farmaco (AIFA) IMPORTANTI INFORMAZIONI DI SICUREZZA BUFLOMEDIL
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L Agenzia Italiana del Farmaco (AIFA) Febbraio 2010 IMPORTANTI INFORMAZIONI DI SICUREZZA BUFLOMEDIL Nuove informazioni di sicurezza relative ai medicinali contenenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L Agenzia Italiana del Farmaco (AIFA) Febbraio 2010 IMPORTANTI INFORMAZIONI DI SICUREZZA BUFLOMEDIL Nuove informazioni di sicurezza relative ai medicinali contenenti
IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici genovesi
 Università degli Studi di Genova Facoltà di Medicina e Chirurgia IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici
Università degli Studi di Genova Facoltà di Medicina e Chirurgia IL MEDICO DI MEDICINA GENERALE E LA NEFROPATIA DIABETICA: studio sui comportamenti prescrittivi diagnosticoterapeutici di un gruppo di medici
La minaccia nascosta. Smascherare i pericoli del diabete e del colesterolo alto
 La minaccia nascosta Farmacia Ferrari Dott.ssa Teresa Via A. Manzoni 215/A - 80123 - NAPOLI tel. 081.5755329 - fax 081.19722793 Cod. Fiscale FRRTRS35L67F839O Partita IVA 00686520636 http://www.farmaciaferrari.altervista.org
La minaccia nascosta Farmacia Ferrari Dott.ssa Teresa Via A. Manzoni 215/A - 80123 - NAPOLI tel. 081.5755329 - fax 081.19722793 Cod. Fiscale FRRTRS35L67F839O Partita IVA 00686520636 http://www.farmaciaferrari.altervista.org
Conclusioni scientifiche
 Allegato II Conclusioni scientifiche e motivi della revoca o variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione
Allegato II Conclusioni scientifiche e motivi della revoca o variazione dei termini delle autorizzazioni all immissione in commercio e spiegazione dettagliata delle differenze rispetto alla raccomandazione
Allegato III. Emendamenti ai relativi paragrafi del Riassunto delle Caratteristiche del Prodotto e al foglio illustrativo
 Allegato III Emendamenti ai relativi paragrafi del Riassunto delle Caratteristiche del Prodotto e al foglio illustrativo 39 A. Riassunto delle Caratteristiche del Prodotto 4.1 Indicazioni terapeutiche
Allegato III Emendamenti ai relativi paragrafi del Riassunto delle Caratteristiche del Prodotto e al foglio illustrativo 39 A. Riassunto delle Caratteristiche del Prodotto 4.1 Indicazioni terapeutiche
Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio
 Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Allegato 1 Conclusioni scientifiche e motivazioni per la variazione dei termini dell autorizzazione all immissione in commercio Conclusioni scientifiche Tenendo conto della valutazione del Comitato per
Caso clinico 2. Pz. di 50 anni, obeso (IMC: 32Kg/mq) Familiarità per diabete mellito. Asintomatico. Glicemia plasmatica di 130 mg/dl.
 Caso clinico 1 Pz di 15 anni, di sesso femminile, lievemente sottopeso (IMC: 18Kg/mq). Manifesta nausea, vomito, dolori addominali, poliuria, polidipsia e dispnea. Nel giro di poche ore, manifesta obnubilamento
Caso clinico 1 Pz di 15 anni, di sesso femminile, lievemente sottopeso (IMC: 18Kg/mq). Manifesta nausea, vomito, dolori addominali, poliuria, polidipsia e dispnea. Nel giro di poche ore, manifesta obnubilamento
Alcune considerazioni Sul diabete. Anna Carla Babini
 Alcune considerazioni Sul diabete Anna Carla Babini Quali argomenti Assolutamente pratici Criteri diagnostici metformina come utilizzarla insulina basale? QUALE VOI VORRETE HbA1c 6,5% il cut-point diagnostico
Alcune considerazioni Sul diabete Anna Carla Babini Quali argomenti Assolutamente pratici Criteri diagnostici metformina come utilizzarla insulina basale? QUALE VOI VORRETE HbA1c 6,5% il cut-point diagnostico
Alleviamento dei sintomi nelle forme lievi/moderate di artrosi del ginocchio.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Glucosamina ratiopharm 1,5 g polvere per soluzione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni busta contiene 1,5
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Glucosamina ratiopharm 1,5 g polvere per soluzione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni busta contiene 1,5
Jama, 2001, 285(19):2486-2496
 Sommariio esecutiivo delllle lliinee-guiida ATP-III per lla prevenziione delllle mallattiie coronariiche Jama, 2001, 285(19):2486-2496 FASE 1. DETERMINARE IL PROFILO LIPIDICO-LIPOPROTEICO NEL SOGGETTO
Sommariio esecutiivo delllle lliinee-guiida ATP-III per lla prevenziione delllle mallattiie coronariiche Jama, 2001, 285(19):2486-2496 FASE 1. DETERMINARE IL PROFILO LIPIDICO-LIPOPROTEICO NEL SOGGETTO
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE
 STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
STRESS E PATOLOGIE CORRELATE: STRATEGIE NUTRIZIONALI E MOTORIE Dott. ssa Annalisa Caravaggi Biologo Nutrizionista sabato 15 febbraio 14 STRESS: Forma di adattamento dell organismo a stimoli chiamati STRESSOR.
Diabete Mellito 'insulina pancreas un aumento dell appetito accompagnato da una perdita di peso corporeo aumentare la diuresi della sete
 Diabete Mellito Il Diabete mellito è una comune malattia endocrina causata da una carenza relativa o assoluta di insulina. L'insulina è un ormone prodotto da particolari cellule del pancreas (cellule beta)
Diabete Mellito Il Diabete mellito è una comune malattia endocrina causata da una carenza relativa o assoluta di insulina. L'insulina è un ormone prodotto da particolari cellule del pancreas (cellule beta)
Riassunto delle caratteristiche del prodotto
 Riassunto delle caratteristiche del prodotto 1 DENOMINAZIONE DELLA SPECIALITÀ MEDICINALE Calcio Carbonato + vitamina D3 ABC 1000 mg/880 U.I. granulato effervescente 2 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Riassunto delle caratteristiche del prodotto 1 DENOMINAZIONE DELLA SPECIALITÀ MEDICINALE Calcio Carbonato + vitamina D3 ABC 1000 mg/880 U.I. granulato effervescente 2 COMPOSIZIONE QUALITATIVA E QUANTITATIVA
E facilmente intuibile come, da quel che si è esposto, questo sottogruppo di obesi, trattati con metformina, abbia conseguito i migliori risultati.
 Dia 1 E necessario sottolineare la profonda differenza nella patogenesi delle complicanze microvascolari, quali la retinopatia, la nefropatia e la neuropatia, e quelle macrovascolari, quali la cardiopatia
Dia 1 E necessario sottolineare la profonda differenza nella patogenesi delle complicanze microvascolari, quali la retinopatia, la nefropatia e la neuropatia, e quelle macrovascolari, quali la cardiopatia
C A R D I O P A T I A I S C H E M I C A : R I D U R R E I L R I S C H I O. Riassunto
 Riassunto 1 Introduzione 1.1 Premessa 1.2 Spesa sanitaria e cardiopatia ischemica 1.3 Fattori di rischio coronarico come causa di cardiopatia ischemica 1.3.1 Prospettive future 1.3.2 Nutrizione e malattie
Riassunto 1 Introduzione 1.1 Premessa 1.2 Spesa sanitaria e cardiopatia ischemica 1.3 Fattori di rischio coronarico come causa di cardiopatia ischemica 1.3.1 Prospettive future 1.3.2 Nutrizione e malattie
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
METFORMINA. Ogni compressa rivestita con film contiene metformina cloridrato 850 mg corrispondente a 662,9 mg di metformina base.
 METFORMINA 1-DENOMINAZIONE DEL MEDICINALE GLUCOPHAGE 850 mg compresse rivestite con film 2-COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa rivestita con film contiene metformina cloridrato 850 mg
METFORMINA 1-DENOMINAZIONE DEL MEDICINALE GLUCOPHAGE 850 mg compresse rivestite con film 2-COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa rivestita con film contiene metformina cloridrato 850 mg
Azioni neuroendocrine Apparato riproduttivo Sistema nervoso centrale
 1 I progestinici sono composti con attività simile a quella del progesterone e includono il progesterone e agenti simili come il medrossiprogesterone acetato (pregnani), agenti simili al 19-nortestosterone
1 I progestinici sono composti con attività simile a quella del progesterone e includono il progesterone e agenti simili come il medrossiprogesterone acetato (pregnani), agenti simili al 19-nortestosterone
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Finasteride Teva Generics 1 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Finasteride Teva Generics 1 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene
Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale
 Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
Foglio illustrativo: informazioni per il paziente Soluzione Schoum soluzione orale Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti informazioni per lei.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Finacapil 1 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Principio attivo: finasteride. Una compressa
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Finacapil 1 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Principio attivo: finasteride. Una compressa
della secrezione di insulina, la soppressione della secrezione di glucagone, il rallentamento dello svuotamento gastrico, la riduzione dell
 Introduzione Il diabete mellito di tipo 2 rappresenta un problema medico estremamente rilevante per l ampia diffusione della patologia e per la morbilità a essa associata. Mentre si è affermata la necessità
Introduzione Il diabete mellito di tipo 2 rappresenta un problema medico estremamente rilevante per l ampia diffusione della patologia e per la morbilità a essa associata. Mentre si è affermata la necessità
Metformina. 1000 mg Compresse rivestite con film 60 compresse rivestite con film Medicinale equivalente
 Foglio Illustrativo Metformina EG 1000 mg Compresse rivestite con film 60 compresse rivestite con film Medicinale equivalente METFORMINA EG 1000 mg Compresse rivestite con film: Una compressa rivestita
Foglio Illustrativo Metformina EG 1000 mg Compresse rivestite con film 60 compresse rivestite con film Medicinale equivalente METFORMINA EG 1000 mg Compresse rivestite con film: Una compressa rivestita
L ASSOCIAZIONE ITALIANA GASTROENTEROLOGI ED ENDOSCOPISTI DIGESTIVI OSPEDALIERI PRESENTA:
 L ASSOCIAZIONE ITALIANA GASTROENTEROLOGI ED ENDOSCOPISTI DIGESTIVI OSPEDALIERI PRESENTA: STEATOSI E STEATOEPATITE NON ALCOLICA AIGO PER I PAZIENTI: INFORMAZIONE SANITARIA A CURA DELLE COMMISSIONI AIGO
L ASSOCIAZIONE ITALIANA GASTROENTEROLOGI ED ENDOSCOPISTI DIGESTIVI OSPEDALIERI PRESENTA: STEATOSI E STEATOEPATITE NON ALCOLICA AIGO PER I PAZIENTI: INFORMAZIONE SANITARIA A CURA DELLE COMMISSIONI AIGO
Dalla indagine demografica alla definizione del bisogno socio-sanitario
 Dalla indagine demografica alla definizione del bisogno socio-sanitario L analisi del contesto demografico è l introduzione ideale alla sezione della salute. Il bisogno del cittadino residente sul territorio
Dalla indagine demografica alla definizione del bisogno socio-sanitario L analisi del contesto demografico è l introduzione ideale alla sezione della salute. Il bisogno del cittadino residente sul territorio
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE. Carenza di ferro molto diffusa e spesso sottovalutata
 FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
FIACCHEZZA, STANCHEZZA, MALESSERE MORALE Carenza di ferro molto diffusa e spesso sottovalutata Cari pazienti! Vi sentite spesso fiacchi, stanchi, esauriti o giù di morale? Soffrite facilmente il freddo?
Studio di ricerca clinica sul dolore da endometriosi. Il dolore che Lei sente è reale... anche se gli altri non possono vederlo.
 Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
Studio di ricerca clinica sul dolore da endometriosi Il dolore che Lei sente è reale... anche se gli altri non possono vederlo. A822523 Lo studio SOLSTICE verrà condotto in circa 200 centri di ricerca
1. Obesità. Per valutare la distribuzione del grasso corporeo, si può utilizzare il rapporto vita.
 2%(6,7 1. Obesità L incidenza del sovrappeso e/o dell obesità è andata aumentando dal dopoguerra in tutti i paesi industrializzati per l abbondanza e la disponibilità di cibi raffinati da un lato e la
2%(6,7 1. Obesità L incidenza del sovrappeso e/o dell obesità è andata aumentando dal dopoguerra in tutti i paesi industrializzati per l abbondanza e la disponibilità di cibi raffinati da un lato e la
Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008
 Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008 1 Quali aspetti della menopausa possono essere divulgati come problemi di salute?
Conferenza di consenso Quale informazione per la donna in menopausa sulla terapia ormonale sostitutiva? Torino 17 maggio 2008 1 Quali aspetti della menopausa possono essere divulgati come problemi di salute?
Le interazioni farmacologiche come causa di reazioni avverse da farmaci
 Le interazioni farmacologiche come causa di reazioni avverse da farmaci Corso per farmacisti operanti nei punti di erogazione diretta delle Aziende Sanitarie della Regione Emilia-Romagna AUSL Piacenza
Le interazioni farmacologiche come causa di reazioni avverse da farmaci Corso per farmacisti operanti nei punti di erogazione diretta delle Aziende Sanitarie della Regione Emilia-Romagna AUSL Piacenza
IPERTENSIONE IPERTENSIONE ARTERIOSA
 UNIVERSITA di FOGGIA C.D.L. in Dietistica AA. 2006-2007 IPERTENSIONE ARTERIOSA IPERTENSIONE L ipertensione è la più comune malattia cardiovascolare. Corso di Medicina Interna Docente: PROF. Gaetano Serviddio
UNIVERSITA di FOGGIA C.D.L. in Dietistica AA. 2006-2007 IPERTENSIONE ARTERIOSA IPERTENSIONE L ipertensione è la più comune malattia cardiovascolare. Corso di Medicina Interna Docente: PROF. Gaetano Serviddio
PARLIAMO DI DIABETE 4
 ASSOCIAZIONE DIABETICI TORINO 2000 Via San Domenico, 18 Torino Tel. 011.436.2269 Presidente Sig.ra M. Bono e-mail assdiato2000@email.it Alberto BRUNO U.O.A. DIABETOLOGIA ASO San Giovanni Battista Torino
ASSOCIAZIONE DIABETICI TORINO 2000 Via San Domenico, 18 Torino Tel. 011.436.2269 Presidente Sig.ra M. Bono e-mail assdiato2000@email.it Alberto BRUNO U.O.A. DIABETOLOGIA ASO San Giovanni Battista Torino
ll consumo di bevande alcoliche durante la gravidanza e l allattamento può avere effetti dannosi sulla salute del bambino.
 NON BERE BEVANDE ALCOLICHE IN GRAVIDANZA ED IN ALLATTAMENTO U.O. Consultorio Familiare Distretto n 1 e n 2 Ostetrica t CRISTINA FILIPPI Ostetrica BIANCA PIVA 1 Non bere bevande alcoliche in gravidanza
NON BERE BEVANDE ALCOLICHE IN GRAVIDANZA ED IN ALLATTAMENTO U.O. Consultorio Familiare Distretto n 1 e n 2 Ostetrica t CRISTINA FILIPPI Ostetrica BIANCA PIVA 1 Non bere bevande alcoliche in gravidanza
L Investigator s Brochure. Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari. Maglie 25 novembre 2004
 L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
L Investigator s Brochure Marisa Dell Aera Comitato Etico Azienda Ospedaliera Policlinico Bari Maglie 25 novembre 2004 Investigator s Brochure Good Clinical Practice DM 15/07/97 Cosa è? L IB è una raccolta
DIABETE MELLITO. Organi danneggiati in corso di diabete mellito INSULINA
 DIABETE MELLITO Il diabete mellito è la più comune malattia endocrina: 1-2% della popolazione E caratterizzato da : -alterazione del metabolismo del glucosio -danni a diversi organi Complicanze acute:
DIABETE MELLITO Il diabete mellito è la più comune malattia endocrina: 1-2% della popolazione E caratterizzato da : -alterazione del metabolismo del glucosio -danni a diversi organi Complicanze acute:
ALLEGATO I. Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio
 ALLEGATO I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche - Sindrome da astinenza: Con Effentora/Actiq si
ALLEGATO I Conclusioni scientifiche e motivazioni per la variazione dei termini delle autorizzazioni all immissione in commercio Conclusioni scientifiche - Sindrome da astinenza: Con Effentora/Actiq si
ANNO MASCHI FEMMINE TOTALE TOTALE 1974 2513 4487
 MORTALITÀ Tra i residenti della ULSS n. 1 nel corso del triennio 2010-2012 si sono verificati 4487 decessi (1974 nei maschi e 2513 nelle femmine, media per anno 1496), in leggero aumento rispetto al dato
MORTALITÀ Tra i residenti della ULSS n. 1 nel corso del triennio 2010-2012 si sono verificati 4487 decessi (1974 nei maschi e 2513 nelle femmine, media per anno 1496), in leggero aumento rispetto al dato
Ricerca farmacologica priclinica e clinica
 Ricerca farmacologica priclinica e clinica SPERIMENTAZIONE PRECLINICA DURATA MEDIA?? ANNI Consente di isolare, dalle migliaia di sostanze sottoposte al primo screening di base farmacologico e biochimico,
Ricerca farmacologica priclinica e clinica SPERIMENTAZIONE PRECLINICA DURATA MEDIA?? ANNI Consente di isolare, dalle migliaia di sostanze sottoposte al primo screening di base farmacologico e biochimico,
TIREOPATIE e DIABETE Raccomandazioni per la pratica clinica
 TIREOPATIE e DIABETE Raccomandazioni per la pratica clinica PERCHÉ UN DOCUMENTO DI CONSENSO SU TIREOPATIE E DIABETE MELLITO? Le malattie della tiroide e il diabete mellito sono le endocrinopatie di più
TIREOPATIE e DIABETE Raccomandazioni per la pratica clinica PERCHÉ UN DOCUMENTO DI CONSENSO SU TIREOPATIE E DIABETE MELLITO? Le malattie della tiroide e il diabete mellito sono le endocrinopatie di più
POLITERAPIE NEL PAZIENTE ANZIANO. Dipartimento Farmaceutico Azienda USL di Reggio Emilia
 POLITERAPIE NEL PAZIENTE ANZIANO Dipartimento Farmaceutico Azienda USL di Reggio Emilia PAZIENTI ANZIANI Maggiori utilizzatori di farmaci per la presenza di polipatologie spesso croniche Ridotte funzionalità
POLITERAPIE NEL PAZIENTE ANZIANO Dipartimento Farmaceutico Azienda USL di Reggio Emilia PAZIENTI ANZIANI Maggiori utilizzatori di farmaci per la presenza di polipatologie spesso croniche Ridotte funzionalità
Dronedarone e insufficienza renale acuta: analisi delle segnalazioni della Rete Nazionale di Farmacovigilanza
 Dronedarone e insufficienza renale acuta: analisi delle segnalazioni della Rete Nazionale di Farmacovigilanza Domenico Motola Dipartimento di Scienze Mediche e Chirurgiche Unità di farmacologia Università
Dronedarone e insufficienza renale acuta: analisi delle segnalazioni della Rete Nazionale di Farmacovigilanza Domenico Motola Dipartimento di Scienze Mediche e Chirurgiche Unità di farmacologia Università
farmaceutica Clavulanic acid 10 mg Dosaggio standard di 10 mg di amoxicillina/2,5 mg di acido clavulanico/kg di peso corporeo Repubblica Ceca
 Allegato I Elenco dei nomi, della forma farmaceutica, del dosaggio del medicinale veterinario, della specie animale, della via di somministrazione, del richiedente/titolare dell autorizzazione all immissione
Allegato I Elenco dei nomi, della forma farmaceutica, del dosaggio del medicinale veterinario, della specie animale, della via di somministrazione, del richiedente/titolare dell autorizzazione all immissione
Impara a riconoscere i segni e i fattori di rischio del diabete
 Diabete anche loro possono ammalarsi Impara a riconoscere i segni e i fattori di rischio del diabete Il diabete Il diabete mellito è una malattia caratterizzata da un aumento dei livelli di zucchero (glucosio)
Diabete anche loro possono ammalarsi Impara a riconoscere i segni e i fattori di rischio del diabete Il diabete Il diabete mellito è una malattia caratterizzata da un aumento dei livelli di zucchero (glucosio)
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO INCURIN 1 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Principio attivo: estriolo 1 mg/compressa
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO INCURIN 1 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Principio attivo: estriolo 1 mg/compressa
Farmaci e Sostenibilita Economica alla luce della L.O.E. Dott. G. Monaco Direttore Responsabile ASLNA1 Centro DSB 29
 Farmaci e Sostenibilita Economica alla luce della L.O.E. Dott. G. Monaco Direttore Responsabile ASLNA1 Centro DSB 29 Rapporto Osmed (pubbl. 05.07.2012) 26.3 miliardi di Mercato farmaceutico complessivo
Farmaci e Sostenibilita Economica alla luce della L.O.E. Dott. G. Monaco Direttore Responsabile ASLNA1 Centro DSB 29 Rapporto Osmed (pubbl. 05.07.2012) 26.3 miliardi di Mercato farmaceutico complessivo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ACICLOVIR ABC 800 mg COMPRESSE ACICLOVIR ABC 400 mg/5 ml SOSPENSIONE ORALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Aciclovir
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ACICLOVIR ABC 800 mg COMPRESSE ACICLOVIR ABC 400 mg/5 ml SOSPENSIONE ORALE 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Aciclovir
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Valutazione epidemiologica dell impatto delle Linee di indirizzo regionali sull uso dei farmaci. Marina Davoli
 Valutazione epidemiologica dell impatto delle Linee di indirizzo regionali sull uso dei farmaci Marina Davoli SNLG - Antibioticoprofilassi perioperatoria nell adulto - 1 Raccomandazione I/A La profilassi
Valutazione epidemiologica dell impatto delle Linee di indirizzo regionali sull uso dei farmaci Marina Davoli SNLG - Antibioticoprofilassi perioperatoria nell adulto - 1 Raccomandazione I/A La profilassi
Aspetti generali del diabete mellito
 Il diabete mellito Aspetti generali del diabete mellito Il diabete è una patologia caratterizzata da un innalzamento del glucosio ematico a digiuno, dovuto a una carenza relativa o assoluta di insulina.
Il diabete mellito Aspetti generali del diabete mellito Il diabete è una patologia caratterizzata da un innalzamento del glucosio ematico a digiuno, dovuto a una carenza relativa o assoluta di insulina.
NUTRIZIONE IN TERAPIA INTENSIVA. Dott. Adolfo Affuso
 NUTRIZIONE IN TERAPIA INTENSIVA Dott. Adolfo Affuso La nutrizione artificiale è parte integrante della terapia del paziente Un adeguato apporto nutrizionale migliora l outcome del malato INDICAZIONI ALLA
NUTRIZIONE IN TERAPIA INTENSIVA Dott. Adolfo Affuso La nutrizione artificiale è parte integrante della terapia del paziente Un adeguato apporto nutrizionale migliora l outcome del malato INDICAZIONI ALLA
CHE COS E L OBESITA E COME SI PUO CURARE
 Lega Friulana per il Cuore CHE COS E L OBESITA E COME SI PUO CURARE Materiale predisposto dal dott. Diego Vanuzzo, Centro di Prevenzione Cardiovascolare, Udine a nome del Comitato Tecnico-Scientifico della
Lega Friulana per il Cuore CHE COS E L OBESITA E COME SI PUO CURARE Materiale predisposto dal dott. Diego Vanuzzo, Centro di Prevenzione Cardiovascolare, Udine a nome del Comitato Tecnico-Scientifico della
Seconda Parte Specifica di scuola - Statistica sanitaria e Biometria - 31/07/2015
 Domande relative alla specializzazione in: Statistica sanitaria e Biometria Domanda #1 (codice domanda: n.641) : In epidemiologia, una variabile di confondimento è una variabile: A: associata sia alla
Domande relative alla specializzazione in: Statistica sanitaria e Biometria Domanda #1 (codice domanda: n.641) : In epidemiologia, una variabile di confondimento è una variabile: A: associata sia alla
Servizio di Mineralometria Ossea Computerizzata (MOC) e Composizione Corporea
 Servizio di Mineralometria Ossea Computerizzata (MOC) e Composizione Corporea Associazione Italiana per l Educazione Demografica Sezione di Roma L osteoporosi È una condizione dello scheletro caratterizzata
Servizio di Mineralometria Ossea Computerizzata (MOC) e Composizione Corporea Associazione Italiana per l Educazione Demografica Sezione di Roma L osteoporosi È una condizione dello scheletro caratterizzata
L Insulina è un ormone prodotto dal pancreas implicato nel metabolismo dei carboidrati.
 DIABETE E RISCHIO CANCRO: RUOLO DELL INSULINA Secondo recenti studi sono più di 350 milioni, nel mondo, gli individui affetti da diabete, numeri che gli regalano il triste primato di patologia tra le più
DIABETE E RISCHIO CANCRO: RUOLO DELL INSULINA Secondo recenti studi sono più di 350 milioni, nel mondo, gli individui affetti da diabete, numeri che gli regalano il triste primato di patologia tra le più
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE METFORMINA EUROGENERICI 500 mg compresse rivestite con film METFORMINA EUROGENERICI 850 mg compresse rivestite con film METFORMINA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE METFORMINA EUROGENERICI 500 mg compresse rivestite con film METFORMINA EUROGENERICI 850 mg compresse rivestite con film METFORMINA
AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune)
 AIFA - Sirolimus (Rapamune) 08/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune) Nota Informativa Importante (08 Febbraio 2010) file:///c /documenti/sir653.htm [08/02/2010 10.47.36]
AIFA - Sirolimus (Rapamune) 08/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Sirolimus (Rapamune) Nota Informativa Importante (08 Febbraio 2010) file:///c /documenti/sir653.htm [08/02/2010 10.47.36]
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE PROPECIA 1 mg compresse rivestite con film 2 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa contiene 1 mg di finasteride.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 DENOMINAZIONE DEL MEDICINALE PROPECIA 1 mg compresse rivestite con film 2 COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascuna compressa contiene 1 mg di finasteride.
VALUTAZIONE DEL LIVELLO DELLA FUNZIONE RENALE
 VALUTAZIONE DEL LIVELLO DELLA FUNZIONE RENALE La stima del Filtrato Glomerulare (FG) èil miglior indicatore complessivo della funzione renale. La sola creatininemia non deve essere usata come indice di
VALUTAZIONE DEL LIVELLO DELLA FUNZIONE RENALE La stima del Filtrato Glomerulare (FG) èil miglior indicatore complessivo della funzione renale. La sola creatininemia non deve essere usata come indice di
Metodi in vivo e in vitro per : il riconoscimento dei farmaci lo studio delle loro proprietà farmacologiche lo studio del loro meccanismo d azione
 Metodi in vivo e in vitro per : il riconoscimento dei farmaci lo studio delle loro proprietà farmacologiche lo studio del loro meccanismo d azione Metodi generali Metodi mirati Scoperta e sviluppo di nuovi
Metodi in vivo e in vitro per : il riconoscimento dei farmaci lo studio delle loro proprietà farmacologiche lo studio del loro meccanismo d azione Metodi generali Metodi mirati Scoperta e sviluppo di nuovi
RUCONEST (Conestat alfa) RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RUCONEST (Conestat alfa) RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ruconest 2100 U polvere per soluzione iniettabile. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un flaconcino
RUCONEST (Conestat alfa) RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ruconest 2100 U polvere per soluzione iniettabile. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un flaconcino
STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI
 STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI Questo strumento è stato creato per facilitare gli operatori sanitari nella valutazione e nell educazione dei pazienti trattati
STRUMENTO EDUCATIVO PER PAZIENTI CHE ASSUMONO FARMACI CHEMIOTERAPICI ORALI Questo strumento è stato creato per facilitare gli operatori sanitari nella valutazione e nell educazione dei pazienti trattati
ADRs da increatino-mimetici e inibitori DPP-4 nella cura del diabete mellito di tipo 2
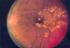 ADRs da increatino-mimetici e inibitori DPP-4 nella cura del diabete mellito di tipo 2 SITAGLIPTIN (Januvia, Tesavel ) Sitagliptin è un farmaco anti-iperglicemico di nuova classe, inibitori della dipeptidil
ADRs da increatino-mimetici e inibitori DPP-4 nella cura del diabete mellito di tipo 2 SITAGLIPTIN (Januvia, Tesavel ) Sitagliptin è un farmaco anti-iperglicemico di nuova classe, inibitori della dipeptidil
Premessa. Tratto da American Heart Journal 2004; 147: 705-712
 Effetti del cambiamento di terapia con statine sul raggiungimento delle concentrazioni lipidiche ottimali: lo studio Measuring Effective Reductions in Cholesterol Using Rosuvastatin Therapy (MERCURY I)
Effetti del cambiamento di terapia con statine sul raggiungimento delle concentrazioni lipidiche ottimali: lo studio Measuring Effective Reductions in Cholesterol Using Rosuvastatin Therapy (MERCURY I)
OBESITA. 11 Aprile 2013
 OBESITA 11 Aprile 2013 L obesità è una patologia cronica caratterizzata dall eccessivo accumulo di tessuto adiposo nell organismo ed è causata da fattori ereditari e non ereditari che determinano un introito
OBESITA 11 Aprile 2013 L obesità è una patologia cronica caratterizzata dall eccessivo accumulo di tessuto adiposo nell organismo ed è causata da fattori ereditari e non ereditari che determinano un introito
INDICE DI MASSA CORPOREA significato ed interpretazione
 INDICE DI MASSA CORPOREA significato ed interpretazione Sembrerà strano ma essere in sovrappeso non necessariamente significa avere grasso in eccesso; allo stesso modo essere normopeso non è sinonimo di
INDICE DI MASSA CORPOREA significato ed interpretazione Sembrerà strano ma essere in sovrappeso non necessariamente significa avere grasso in eccesso; allo stesso modo essere normopeso non è sinonimo di
Hypoglycemia Social Burden in the Elderly and Related Geriatric problems (HYSBERG)
 Hypoglycemia Social Burden in the Elderly and Related Geriatric problems (HYSBERG) Razionale - 1 L età avanzata rappresenta un fattore di rischio indipendente di ipoglicemie Le modificazioni fisiologiche
Hypoglycemia Social Burden in the Elderly and Related Geriatric problems (HYSBERG) Razionale - 1 L età avanzata rappresenta un fattore di rischio indipendente di ipoglicemie Le modificazioni fisiologiche
ESERCITAZIONE. CdL Fisioterapia e Podologia. 25 novembre 2015
 ESERCITAZIONE CdL Fisioterapia e Podologia 25 novembre 2015 Epidemiologia Domanda 1 Le neoplasie gastriche sono: a. diminuite in tutta Europa b. diminuite fino agli anni 80, poi stabili c. aumentate in
ESERCITAZIONE CdL Fisioterapia e Podologia 25 novembre 2015 Epidemiologia Domanda 1 Le neoplasie gastriche sono: a. diminuite in tutta Europa b. diminuite fino agli anni 80, poi stabili c. aumentate in
Documento PTR n.212 relativo a:
 Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Direzione Generale Sanità e Politiche Sociali Commissione Regionale del Farmaco (D.G.R. 1540/2006, 2129/2010 e 490/2011) Documento PTR n.212 relativo a: PAZOPANIB Aprile 2014 Pazopanib Indicazioni registrate
Dott.ssa Ilaria Barchetta
 Dott.ssa Ilaria Barchetta Dipartimento di Medicina Interna e Specialità Mediche Sapienza Università di Roma Diverse evidenze sperimentali hanno dimostrato una influenza diretta della vitamina D non solo
Dott.ssa Ilaria Barchetta Dipartimento di Medicina Interna e Specialità Mediche Sapienza Università di Roma Diverse evidenze sperimentali hanno dimostrato una influenza diretta della vitamina D non solo
Uni.C.A. UniCredit Cassa Assistenza
 Uni.C.A. UniCredit Cassa Assistenza Incontri di presentazione della Campagna di Prevenzione 2014-2015 Il Comitato Scientifico: Antonio Colombo, Eugenio Villa, Francesco Violante Cologno Monzese, 28 gennaio
Uni.C.A. UniCredit Cassa Assistenza Incontri di presentazione della Campagna di Prevenzione 2014-2015 Il Comitato Scientifico: Antonio Colombo, Eugenio Villa, Francesco Violante Cologno Monzese, 28 gennaio
Incidenza dell ipoglicemia nei pazienti della SOS di Diabetologia di Udine
 Incidenza dell ipoglicemia nei pazienti della SOS di Diabetologia di Udine Agus S, Tonutti L, Pellegrini MA, Venturini G, Cannella S, Toffoletti V, Vidotti F, Sartori C, Boscariol C, Pellarini L, Rutigliano
Incidenza dell ipoglicemia nei pazienti della SOS di Diabetologia di Udine Agus S, Tonutti L, Pellegrini MA, Venturini G, Cannella S, Toffoletti V, Vidotti F, Sartori C, Boscariol C, Pellarini L, Rutigliano
Programmazione di gravidanza nelle donne con diabete pregestazionale: applicazione del nostro modello organizzativo in un follow up di 7 anni
 Programmazione di gravidanza nelle donne con diabete pregestazionale: applicazione del nostro modello organizzativo in un follow up di 7 anni Bonfadini S., Agosti B., Rocca L., Zarra E., Cimino A. UO Diabetologia,
Programmazione di gravidanza nelle donne con diabete pregestazionale: applicazione del nostro modello organizzativo in un follow up di 7 anni Bonfadini S., Agosti B., Rocca L., Zarra E., Cimino A. UO Diabetologia,
Gruppo di lavoro della SSED, della ASD e della SSML R.Lehmann, M. Egli, D. Fischer, H.U. Iselin, V. Pavlicek, R. Schinz, T. Weng, R.
 Gruppo di lavoro della SSED, della ASD e della SSML R.Lehmann, M. Egli, D. Fischer, H.U. Iselin, V. Pavlicek, R. Schinz, T. Weng, R. Seeger Direttive concernenti l idoneità alla guida e la capacità di
Gruppo di lavoro della SSED, della ASD e della SSML R.Lehmann, M. Egli, D. Fischer, H.U. Iselin, V. Pavlicek, R. Schinz, T. Weng, R. Seeger Direttive concernenti l idoneità alla guida e la capacità di
STUDIO OSSERVAZIONALE SULLA PREVALENZA DELLE PIU COMUNI PATOLOGIE UROLOGICHE E DEL LORO IMPATTO SULLA QUALITA DI VITA IN PAZIENTI
 STUDIO OSSERVAZIONALE SULLA PREVALENZA DELLE PIU COMUNI PATOLOGIE UROLOGICHE E DEL LORO IMPATTO SULLA QUALITA DI VITA IN PAZIENTI SOTTOPOSTI A DIALISI. Introduzione 2 Obiettivo dello studio 4 Materiali
STUDIO OSSERVAZIONALE SULLA PREVALENZA DELLE PIU COMUNI PATOLOGIE UROLOGICHE E DEL LORO IMPATTO SULLA QUALITA DI VITA IN PAZIENTI SOTTOPOSTI A DIALISI. Introduzione 2 Obiettivo dello studio 4 Materiali
ALLEGATO I CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEI RIASSUNTI DELLE CARATTERISTICHE DEL PRODOTTO PRESENTATI DALL EMEA
 ALLEGATO I CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEI RIASSUNTI DELLE CARATTERISTICHE DEL PRODOTTO PRESENTATI DALL EMEA 1 CONCLUSIONI SCIENTIFICHE RIASSUNTO GENERALE DELLA VALUTAZIONE SCIENTIFICA
ALLEGATO I CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEI RIASSUNTI DELLE CARATTERISTICHE DEL PRODOTTO PRESENTATI DALL EMEA 1 CONCLUSIONI SCIENTIFICHE RIASSUNTO GENERALE DELLA VALUTAZIONE SCIENTIFICA
 Cristina Della Rosa Dipartimento Cure Primarie ASL Como ASSISTENZA PROTESICA ED INTEGRATIVA Nell ambito dell assistenza al paziente cronico l assistenza protesica ed integrativa rappresentano un aspetto
Cristina Della Rosa Dipartimento Cure Primarie ASL Como ASSISTENZA PROTESICA ED INTEGRATIVA Nell ambito dell assistenza al paziente cronico l assistenza protesica ed integrativa rappresentano un aspetto
INTERFERONE POTENZIALI EFFETTI COLLATERALI
 INTERFERONE POTENZIALI EFFETTI COLLATERALI 1 Le informazioni contenute in questo modello sono fornite in collaborazione con la Associazione Italiana Malati di Cancro, parenti ed amici ; per maggiori informazioni:
INTERFERONE POTENZIALI EFFETTI COLLATERALI 1 Le informazioni contenute in questo modello sono fornite in collaborazione con la Associazione Italiana Malati di Cancro, parenti ed amici ; per maggiori informazioni:
retina macula La macula è la parte centrale della retina. Essa consente la visione dei colori ed il riconoscimento di dettagli come ad es. la lettura.
 retina macula La macula è la parte centrale della retina. Essa consente la visione dei colori ed il riconoscimento di dettagli come ad es. la lettura. 2 Questa è l immagine schematica della macula sana.
retina macula La macula è la parte centrale della retina. Essa consente la visione dei colori ed il riconoscimento di dettagli come ad es. la lettura. 2 Questa è l immagine schematica della macula sana.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Forxiga 5 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene dapagliflozin
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Forxiga 5 mg compresse rivestite con film 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene dapagliflozin
