Proprietà dei gas (Cap. 13)
|
|
|
- Ottavio Natali
- 5 anni fa
- Visualizzazioni
Transcript
1 Proprietà dei gas (Cap. 13) I gas Misura della pressione Leggi di Boyle, di Charles e di Gay-Lussac Ipotesi di Avogadro Legge del gas ideale Determinazione della massa molecolare dei gas Legge di Dalton delle pressioni parziali Distribuzione di Maxwell-Boltzmann Teoria cinetica e velocità quadratica media (par ) Legge di Graham (par lettura) Cammino libero medio (par lettura) Equazione di van der Waals
2 Stati fisici della materia Rappresentazione molecolare delle particelle in un solido, un liquido e un gas. I tre stati fisici della materia sono solido, liquido e gassoso. Un solido ha volume e forma propri; un liquido ha volume proprio ma assume la forma del recipiente in cui è contenuto. Il gas non ha né volume né forma propri e si espande occupando l intero volume del recipiente nel quale è introdotto.
3 Il quadro molecolare di un solido cristallino è quello di un insieme ordinato (reticolo) di particelle (atomi, molecole o ioni). Le singole particelle vibrano intorno alle poszioni fisse del reticolo, ma non sono libere di muoversi. Gli impedimenti al moto delle particelle di un solido si riflettono nel volume e forma fissi che caratterizzano il solido. La descrizione molecolare di un liquido è di particelle sempre a contatto tra di loro, ma libere di muoversi. Nel liquido non c è una disposizione ordinata e fissa delle particelle come in un solido. Quando un solido fonde diventando liquido, il reticolo si rompe e le particelle costituenti non sono più mantenute in posizioni fisse. Il fatto che le densità tra la fase solida e liquida di una qualunque sostanza, non differiscano molto tra di loro, indica che la distanza tra le particelle è simile nelle due fasi.
4 La fase liquida e solida di una sostanza hanno compressibilità (o comprimibilità) simili e piccole, il che significa che il loro volume non cambia apprezzabilmente all aumento della pressione. Le compressìbilità simili delle fasi solida e liquida di una sostanza sono un ulteriore indicazione che le particelle nelle due fasi hanno distanze simili. Quando una certa massa di liquido evapora trasformandosi in gas, c è un enorme aumento di volume. Una mole di acqua liquida a 100 C occupa un volume di 18,8 ml, mentre una mole di vapor d acqua occupa un volume di più di ml.
5 Nell evaporazione le molecole di una sostanza si separano a grandi distanze; questo spiega la facilità con cui i gas possono essere compressi. Le particelle riempiono solo una piccola frazione dello spazio totale occupato dal gas; la maggior parte del volume del gas è spazio vuoto e di conseguenza i gas hanno grandi compressibilità. Il volume di un gas diminuisce notevolmente quando la pressione aumenta)
6 La pressione del gas Le molecole di un gas sono in costante movimento ad alte velocità ed urtano le altre molecole e le pareti del recipiente. La forza di queste collisioni contro le pareti del recipiente è responsabile della pressione esercitata dal gas. Uno strumento usato per misurare la pressione è il manometro, che è un tubo di vetro a forma di U parzialmente riempito con un liquido. Il liquido usato di solito è il mercurio data la sua elevata densità e la sua scarsa reattività.
7 La pressione del gas Manometro a mercurio a) Entrambi i rubinetti sono aperti verso l atmosfera per cui tutte e due le colonne sono esposte alla pressione atmosferica ed hanno la stessa altezza perché la pressione è la stessa sulle due superfici. b) I due rubinetti sono chiusi, l aria nella colonna di destra è stata evacuata, per cui la pressione sopra la colonna di mercurio di destra è praticamente zero. L altezza delle colonne non è più la stessa. La differenza di altezza, h, è una misura diretta della pressione del gas nel pallone. L altezza h si misura in mm e la pressione si esprime in millimetri di mercurio (mmhg). L unità di pressione mmhg è detta torr (il suo simbolo è Torr ). L altezza della colonna liquida che può essere sostenuta da un gas è inversamente proporzionale alla densità del liquido; meno denso è il liquido, più alta sarà la colonna.
8 La pressione del gas Barometro a mercurio inventato da Evangelista Torricelli nel 1643 per misurare la pressione atmosferica. La pressione esercitata dall atmosfera può sostenere una colonna alta 760 mm (a livello del mare in una giornata serena) Unità di misura della pressione: atmosfera (atm) 1 atm = 760 Torr = 760 mmhg
9 La pressione del gas Torricelli prese un lungo tubo di vetro, chiuso ad una estremità, lo riempì di mercurio e lo capovolse. A livello del mare, il livello del mercurio nel tubo si abbassava ad un altezza di 760 mm. Il livello raggiunto dal mercurio fornisce la misura della pressione atmosferica esercitata sulla superficie del mercurio nella bacinella, espressa in millimetri di mercurio (mmhg).
10 La pressione del gas A B C D Dispositivi per misurare la pressione A) Dispositivo utilizzato per misurare la pressione dei pneumatici (sopra 760 Torr) B) Misuratore meccanico di pressione, usa un materiale compressibile per misurare pressioni fino a ca Torr C) Termocoppia: strumento elettronico che sfrutta la relazione tra temperatura e pressione di un gas per misurare pressioni tra 1 Torr e 10-3 Torr D) Dispositivo ionico che usa la corrente di ioni creata da un filamento per misurare pressioni del vuoto inferiori a 10-4 Torr.
11 La pressione del gas La pressione è una grandezza intensiva. In generale, la pressione P è data dal rapporto tra la forza F, che agisce perpendicolarmente a una superficie, e l area A della superficie stessa. P = F/A L'unità di misura della pressione nel Sistema Internazionale (SI) è il pascal (Pa), pari a un newton (N) per metro quadrato (m 2 ). 1 Pa = 1N / m 2
12 Unità di misura della pressione Unità SI Unità tradizionali 1 Pascal (Pa) = 1 kg m -1 s -2 = 1 J m -3 (pressione standard 100 kpa o 1 bar) 1 atmosfera (atm) = 760 Torr 100 kpa = 1x10 5 Pa 1 atm = 1,01325x10 5 Pa 1 N = 1 kg m s -2 1 J = 1 kg m2 s-2 = 1 bar = 1,01325 bar = 0,9869 atm = 101,325 kpa = 750,1 Torr = 760 Torr = 750,1 mmhg
13 La legge di Boyle Il primo studio sistematico del comportamento dei gas quando vengono applicate pressioni diverse fu condotto da Robert Boyle. Sperimentalmente Boyle dimostrò che, a temperatura costante, il volume di una data quantità di gas è inversamente proporzionale alla pressione: V = c/p P V = c con T costante; c dipende da quantità e temperatura del gas Legge di Boyle (1660)
14 Legge di Boyle La legge di Boyle afferma che il volume di un gas a temperatura costante è inversamente proporzionale alla sua pressione.
15 Legge di Boyle Interpretazione molecolare delle legge di Boyle: quando il volume di un gas diminuisce le molecole del gas urtano le pareti più frequentemente producendo un aumento della pressione. La lunghezza totale del cammino percorso dalle particelle di gas è identica in a) e b) ma le particelle del gas nel volume più piccolo subiscono più collisioni con le pareti del recipiente di quelle nel volume più grande.
16 La legge di Boyle
17 La legge di Charles Charles dimostrò sperimentalmente che, a pressione costante, il volume di una data quantità di gas è direttamente proporzionale alla sua temperatura assoluta (relazione lineare tra V e T) V = c T V/T = c con T temperatura assoluta e P costante c dipende da quantità e pressione del gas Questa è la legge di Charles.
18 Interpretazione molecolare delle legge di Charles Quando aumenta la temperatura le velocità delle molecole aumentano e quindi aumentano le collisioni con la parete del recipiente: ciò corrisponde ad un aumento di pressione. Se il recipiente non è rigido, questo porta a sua volta ad un aumento del volume del gas. Vediamo quindi che un aumento della temperatura porta ad un aumento del volume in accordo con la legge di Charles.
19 La legge di Charles Tutte e tre le rette estrapolano a V = 0 e T = -273,15 C. Se aggiungiamo 273,15 alle temperature espresse nella scala Celsius, le tre rette passano per l origine.
20 La legge di Charles
21 La legge di Charles Aggiungendo 273,15 alla temperatura Celsius otteniamo una nuova scala di temperature, che è la scala assoluta delle temperature o scala Kelvin. L unità di misura è il kelvin (simbolo K) T(K) = t ( C) + 273,15 Lo zero assoluto (0 K = -273,15 C), rappresenta la più bassa temperatura possibile.
22 Verifica della legge di Charles Uso della legge di Charles per calcolare come cambia il volume di un gas se cambiamo la sua temperatura, mantenendo fissa la quantità di gas e la sua pressione. a b c d a) Si versa azoto liquido su un pallone gonfiato con elio b) e c) Man mano che T diminuisce il volume del gas nel pallone diminuisce c) Quando il gas nel pallone si scalda di nuovo il suo volume aumenta rigonfiando il pallone.
23 Termometro a gas: a) Un campione di aria è intrappolato con una goccia di mercurio in un tubo capillare chiuso in basso. Secondo la legge di Charles V è direttamente proporzionale a T. L aria esterna mantiene una pressione costante sull aria intrappolata sotto il mercurio. b) quando la temperatura aumenta la goccia di mercurio sale perché il volume dell aria intrappolata aumenta.
24 Legge dei volumi di combinazione di Gay-Lussac Gli esperimenti sui gas portarono alla scoperta di una proprietà importante delle reazioni tra gas. Agli inizi del XIX secolo il chimico francese Joseph Louis Gay-Lussac osservò che: Se tutti i volumi sono misurati alla stessa pressione e temperatura, i volumi con cui i gas si combinano nelle reazioni chimiche stanno tra di loro in rapporti di numeri interi e piccoli. Questa osservazione è nota come legge dei volumi di combinazione di Gay-Lussac e fu uno dei primi indizi dell esistenza degli atomi e delle molecole
25 Legge dei volumi di combinazione di Gay-Lussac
26 Ipotesi di Avogadro L interpretazione della legge di Gay-Lussac da parte del chimico italiano Amedeo Avogadro, portò a comprendere che molti degli elementi gassosi, come idrogeno, ossigeno, azoto e cloro, si trovano normalmente come molecole biatomiche e non come atomi isolati. Partendo dalle osservazioni di Gay-Lussac Avogadro postulò che: Volumi uguali di gas diversi, alla stessa pressione e temperatura, contengono lo stesso numero di molecole (Ipotesi di Avogadro, 1811).
27 Ipotesi di Avogadro Consideriamo la reazione tra idrogeno e cloro per formare cloruro di idrogeno. Si osserva sperimentalmente che un volume di idrogeno reagisce con un volume di cloro per produrre due volumi di cloruro di idrogeno. Secondo l ipotesi di Avogadro questo significa che una molecola di idrogeno reagisce con una molecola di cloro per formare due molecole di cloruro di idrogeno. Se una molecola di idrogeno può formare due molecole di cloruro di idrogeno, significa che la molecola di idrogeno deve consistere di almeno due atomi di idrogeno. Avogadro immaginò che sia l idrogeno che il cloro fossero molecole biatomiche. Se l idrogeno esistesse come atomi non ci sarebbe modo di spiegare la legge dei volumi di combinazione di Gay-Lussac.
28 Ipotesi di Avogadro
29 Legge del gas ideale o equazione di stato del gas ideale L ipotesi di Avogadro implica che volumi uguali di gas differenti alla stessa pressione e temperatura contengano un ugual numero di moli, n: La legge di Avogadro può essere scritta come: V n ( a P e T costanti) Dalla combinazione delle tre leggi di Avogadro, di Boyle e di Charles si ottiene la legge del gas ideale o equazione di stato del gas ideale.
30 Legge del gas ideale V n (a P e T costanti) legge di Avogadro V 1/P (a T e n costanti) legge di Boyle V T (a P e n costanti) legge di Charles V nt/p PV nt
31 Equazione di stato del gas ideale P V = n R T P = pressione (in atm) V = volume (in L) n = numero di moli T = temperatura assoluta (in K) R = costante (universale) dei gas
32 Equazione di stato del gas ideale L equazione di stato del gas ideale è valida solo a basse pressioni (alcuni bar o atm; è comunque valida fino ad alcune decine di bar o atm). I gas che rispettano questa equazione si dice che hanno un comportamento ideale, o che sono gas ideali. L equazione del gas ideale è un esempio di equazione di stato. Lo stato di un gas è definito dalla sua pressione, volume, temperatura e numero di moli; un equazione che mette queste grandezze in relazione tra di loro è detta equazione di stato.
33 Il volume molare dei gas E stato determinato sperimentalmente che una mole di un gas ideale a 0 C e 1 atm ( condizioni normali, c.n.) occupa un volume 0, m 3 o 22,4141 L. (1 m 3 = 10 3 dm 3 = 10 3 L) Questo volume è il volume molare di un gas ideale a 0 C e 1 atm. R = PV/nT = 0,08206 (L atm mol -1 K -1 ) = 8,3145 (J mol -1 K -1 ) = 8,3145 (Pa m 3 mol -1 K -1 ) (1 Pa = 1 J m -3 )
34 Il volume molare dei gas Il volume di una mole di gas a 0 C e 1 atm. Il volu me di 22,4141 L è rappresentato dal cubo, i cui spigoli misurano 28,2 cm.
35 Uso della legge del gas ideale per calcolare la massa molecolare dei gas. P V = n R T n = m/pm PV = (m/pm)rt PM = (mrt)/pv
36 La legge del gas ideale può essere usata per calcolare la densità dei gas in grammi per litro. P V = n R T d = m/v densità (g/l) P = (n/v)rt n = m/pm P = (m/v PM)RT d = (m/v) = PM (P/RT) (g L -1 ) PM = massa molecolare (g mol -1 ) La densità di un gas è direttamente proporzionale alla pressione e inversamente proporzionale alla temperatura. La densità di un gas aumenta quando aumenta la pressione e quando diminuisce la temperatura.
37 Mentre la legge del gas ideale è indipendente dall identità del gas, la densità di un gas dipende dalla natura del gas e permette la determinazione diretta della massa molare. Nel 1860 Stanislao Cannizzaro usò la misura delle densità dei gas insieme alla legge di Avogadro, per compilare la prima tabella sperimentale delle masse atomiche
38 Densità relativa Se si hanno due gas diversi nelle stesse condizioni di pressione e temperatura si dimostra che : d 1 /d 2 = M 1 /M 2 Il rapporto d 1 /d 2 = densità relativa Massa molare media Nel caso di una miscela di gas, si definisce massa molare media M il rapporto tra la massa in grammi del gas e la quantità in moli complessiva: M = m(g) del gas n(mol) di sostanza complessiva
39 I gas possono essere versati da un recipiente all altro se sono più densi dell aria. Nella foto NO 2 (gas) viene versato in un beker.
40 Miscele di gas e pressioni parziali STP = temperatura e pressione standard 0 C, 1 atm (in passato) 0 C, 1 bar (IUPAC)
41 Legge di Dalton delle pressioni parziali In una miscela di gas ideali ciascun gas esercita una pressione come se fosse presente da solo nel recipiente: questa pressione è detta pressione parziale. La pressione totale esercitata da una miscela di gas è uguale alla somma delle pressioni parziali dei singoli componenti della miscela. Questa osservazione è nota come legge di Dalton delle pressioni parziali. P totale = p 1 + p 2 + p 3 + p i con p i = x i P tot La pressione parziale di ogni specie è uguale al prodotto della sua frazione molare per la pressione totale.
42 Legge di Dalton delle pressioni parziali Interpretazione molecolare della legge di Dalton La pressione esercitata da un gas o da una miscela di gas è dovuta alle continue collisioni delle molecole del gas con le pareti del recipiente. Secondo la legge del gas ideale, a T e P fisse, la pressione esercitata da un gas è proporzionale solo al numero di molecole. Quindi in una miscela di gas, la pressione parziale di ogni gas è la pressione totale moltiplicata per la frazione di molecole di quel gas. Data una miscela di gas in un recipiente, le molecole di ciascun gas urtano le pareti e producono una pressione identica a quella che generano quando si trovano da sole nel medesimo recipiente.
43 Applicazione pratica della legge di Dalton delle pressioni parziali Metodo usato per determinare la quantità di un gas insolubile in acqua, sviluppato in una reazione chimica: a) Raccolta di un gas su acqua: il gas sposta l acqua da un recipiente capovolto inizialmente pieno d acqua. b) Quando la reazione è completata si alza o si abbassa il recipiente finché il livello dell acqua dentro e fuori è lo stesso. Quando i due livelli sono uguali la pressione all interno del recipiente è uguale alla pressione atmosferica. La pressione all interno del recipiente non è dovuta solo al gas raccolto ma anche al vapor d acqua presente: P tot = P gas + P H2O = P atm
44 La pressione all interno del recipiente non è dovuta solo al gas raccolto ma anche al vapor d acqua presente: Ptot = P gas + P H2O = P atm La pressione del vapore di H 2 O(l), P H2O dalla temperatura. dipende solo
45 Esercizio 13.12
46 Teoria cinetica dei gas Le molecole di gas sono separate e in moto continuo ed esercitano una pressione urtando le pareti del recipiente. Applicando le leggi della fisica al moto delle molecole, è possibile calcolare la pressione esercitata dalle molecole a seguito delle loro collisioni con le pareti. Questo trattamento, basato sul moto delle molecole, è chiamato teoria cinetica dei gas. L energia associata al moto di un corpo (energia cinetica, E c ) è data da: E c = ½ m v 2 m = massa del corpo (kg) v = velocità (m s -1 ) E c (J; 1 J = 1 kg m 2 s -2 ) L energia cinetica per mole di molecole è: E c = ½ M kg v 2 M kg = massa molare in kilogrammi (kg mol -1 )
47 Teoria cinetica dei gas Es. calcolo dell energia cinetica di una mole di molecole di azoto se ogni molecola ha una velocità di 500 m s -1 a 20 C L energia cinetica per mole di molecole è: E c = ½ M kg v 2 M kg = massa molare in kilogrammi Finora abbiamo supposto che tutte molecole di un gas viaggino alla stessa velocità ma in realtà non è così.
48 Misura della distribuzione delle velocità molecole di un gas delle Un raggio di atomi o molecole gassose ad alta temperatura fuoriesce da un piccolo foro in una fornace e passa per una serie di fessure di collimazione. Il raggio passa poi in un selettore di velocità che consiste in una serie di dischi ruotanti con piccole fessure poste ad angoli fissi l una dall altra. Solo le particelle che viaggiano alla giusta velocità per passare attraverso tutte le fessure successive possono uscire dal selettore. Variando la velocità di rotazione dei dischi, si possono selezionare particelle che si muovono a velocità diverse. Un rivelatore conta il numero di particelle che escono dall apparecchiatura ad una data velocità.
49 Distribuzione delle velocità molecolari di Maxwell- Boltzmann Riportando in un grafico la frazione delle molecole che hanno velocità v in funzione di v a diverse temperature si ottengono curve che partono dall origine, salgono fino ad un massimo e poi scendono a zero all aumentare della velocità. A temperature più alte un maggior numero di molecole viaggia a velocità più alte. La distribuzione delle velocità molecolari in un gas è chiamata distribuzione di Maxwell-Boltzmann. Dato che le molecole di un gas viaggiano a velocità diverse hanno anche energie cinetiche diverse, pertanto in un gas c è una distribuzione di energie cinetiche molecolari. Riportando in grafico la frazione di molecole con energia cinetica E c in funzione di E c si ottiene un andamento simile a quello delle velocità molecolari.
50 Distribuzione delle velocità molecolari di Maxwell-Boltzmann Distribuzione delle velocità di molecole di azoto a 300 K e 1000 K. Per es. la frazione di molecole con velocità 1000 m/s, è maggiore a 1000 K che a 300 K.
51
52 Distribuzione delle energie cinetiche Distribuzione delle energie cinetiche di molecole di azoto a 300 K e 1000 K. La distribuzione è rappresentata dalla frazione di molecole di azoto che hanno energia cinetica E c in funzione di E c.
53 La teoria cinetica molecolare dei gas I gas dal punto di vista macroscopico hanno tutti lo stesso comportamento, che tuttavia risulta sensibile alle variazioni di temperatura e pressione. La teoria cinetica dei gas ne spiega la natura sulla base del modello dei gas ideali o perfetti.
54 La teoria cinetica molecolare dei gas I postulati della teoria sono i seguenti: 1. Le molecole di un gas sono in moto incessante. Si urtano a caso tra di loro e con le pareti del recipiente. 2. Tutte le collisioni sono elastiche, cioè durante le collisioni non si perde energia a causa di calore o attrito. 3. La distanza media tra le molecole di un gas è molto più grande delle dimensioni delle molecole. Il gas consiste per la maggior parte di spazio vuoto. 4. Qualsiasi interazione tra le molecole è trascurabile. Le molecole non si attraggono né si respingono. 5. L energia cinetica media delle molecole di un gas è proporzionale alla temperatura assoluta del gas. Tutti i gas, indipendentemente dalla loro massa molecolare, alla stessa temperatura possiedono la stessa energia cinetica media.
55 La teoria cinetica dei gas Dal postulato 5 si arriva a definire la velocità quadratica media (v rms ), che è uguale alla radice quadrata della media dei quadrati delle velocità molecolari. La velocità quadratica media è una buona misura della velocità media molecolare di un gas.
56 Gas Massa molare (Kg mol -1 ) v rms (m s -1 ) 20 C 1000 C H N O CO Valori di v rms per diversi gas. Alla stessa temperatura, v rms diminuisce all aumentare della massa molare. (rms = root-mean-square)
57
58 Legge dell effusione di Graham (lettura) Il mescolamento di molecole di due o più gas dovuto ai movimenti molecolari viene chiamato diffusione gassosa. Strettamente collegata alla diffusione è l effusione, che è il movimento di un gas attraverso una sottile apertura da un recipiente ad un altro in cui la pressione è molto bassa. Thomas Graham trovò sperimentalmente che la velocità di effusione di un gas - la quantità di gas che si muove da un posto ad un altro in un dato tempo - è inversamente proporzionale alla radice quadrata della sua massa molare (legge di Graham). La legge di Graham può essere utilizzata per determinare la massa molecolare di un gas.
59 Perché la legge di Graham sia valida, le molecole di gas devono attraversare direttamente i fori del recipiente senza urtare altre molecole. Affinché questo avvenga, il diametro dei fori deve essere sufficientemente piccolo e la pressione del gas sufficientemente bassa perché le molecole attraversino i fori una alla volta, senza urtare altre molecole di gas.
60 Legge dell effusione di Graham (lettura) La velocità con cui un gas effonde attraverso un piccolo foro in un recipiente è direttamente proporzionale alla velocità quadratica media delle molecole del gas.
61 Cammino libero medio (lettura) Le molecole di un gas subiscono molte collisioni (a 20 C e 1 bar, una molecola subisce ca collisioni al secondo), per cui il loro cammino effettivo è caotico e a zig-zag. Tra una collisione e l altra le molecole di gas si muovono con velocità di centinaia di metri al secondo, ma il loro avanzamento netto è piuttosto lento. La distanza percorsa tra una collisione e l altra è definita cammino libero medio (l). Il cammino libero medio è inversamente proporzionale alla densità numerica di molecole (N/V) e al quadrato del diametro della molecola. Frequenza di collisione (z) di una molecola = numero di collisioni che una molecola subisce per secondo.
62 Equazione di van der Waals per i gas reali T = 300 K Le deviazioni dall equazione del gas ideale possono essere mostrate graficamente riportando PV/RT in funzione di P (n = 1). La grandezza della deviazione dal comportamento ideale ad una data pressione dipende dalla temperatura e dalla natura del gas. Più vicino è il gas al punto a cui può essere liquefatto, maggiore sarà la deviazione dal comportamento ideale.
63 Equazione di van der Waals per i gas reali L equazione del gas ideale è basata sulle ipotesi fisiche che: 1) le dimensioni delle molecole del gas siano trascurabili; 2) esse non si attraggano tra di loro. Correzione per il volume: V-nb Ad alte pressioni il volume delle molecole del gas non è più trascurabile rispetto al volume del recipiente. b è una costante il cui valore dipende dal gas ed è una misura delle dimensioni delle molecole.
64 Equazione di van der Waals per i gas reali Correzione per la pressione: P + a(n 2 /V 2 ) Una molecola di gas vicina ad una parete del suo recipiente sperimenta una spinta netta verso l interno dovuta all attrazione delle altre molecole. Di conseguenza colpisce la parete con meno forza che se il gas fosse ideale. La pressione effettiva del gas è minore di quella calcolata dalla legge del gas ideale. Poiché l attrazione si esercita tra coppie di molecole, questo fattore è proporzionale al quadrato della densità del gas (n/v) 2. a = costante di proporzionalità.
65 Equazione di van der Waals per i gas reali Tenendo conto di queste due correzioni si ottiene l equazione di van der Waals per i gas reali, dal nome del fisico che per primo riconobbe l importanza delle dimensioni molecolari e delle attrazioni tra le molecole del gas. (P + a(n 2 /V 2 ) )(V-nb) = nrt Le costanti a e b i cui valori dipendono dal particolare gas, sono dette costanti di van der Waals.
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 6 Le leggi dei gas 1. I gas ideali e la teoria cinetico-molecolare 2. La pressione dei gas 3.
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Lo stato gassoso. L atmosfera terrestre è il sistema gassoso in cui siamo immersi
 Lo stato gassoso L atmosfera terrestre è il sistema gassoso in cui siamo immersi I gas sono comprimibili (ampi spazi vuoti tra le particelle?) I gas si espandono facilmente riempiendo rapidamente lo spazio
Lo stato gassoso L atmosfera terrestre è il sistema gassoso in cui siamo immersi I gas sono comprimibili (ampi spazi vuoti tra le particelle?) I gas si espandono facilmente riempiendo rapidamente lo spazio
LA MATERIA ED I SUOI STATI
 LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
LA MATERIA ED I SUOI STATI GAS COMPOSIZIONE DELL ARIA 1. I gas ideali e la teoria cineticomolecolare Nel modello del gas ideale le particelle 1. l energia cinetica media delle particelle è proporzionale
Lo stato gassoso e le sue proprietà
 Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Lo stato gassoso e le sue proprietà Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental Sciences University of Camerino, ITALY 1
Stati di aggregazione della materia. dal microscopico al macroscopico: struttura. interazioni GASSOSO. proprietà SOLIDO LIQUIDO
 Stati di aggregazione della materia GASSOSO dal microscopico al macroscopico: struttura interazioni proprietà SOLIDO LIQUIDO Lo stato gassoso È uno dei tre stati di aggregazione della materia, caratterizzato
Stati di aggregazione della materia GASSOSO dal microscopico al macroscopico: struttura interazioni proprietà SOLIDO LIQUIDO Lo stato gassoso È uno dei tre stati di aggregazione della materia, caratterizzato
I gas. ChimicaGenerale_lezione10
 I gas Nel 1630 fu usato per la prima volta il termine gas: Van Helmont che lo inventò, pensava però che non fosse possibile contenere un gas in un recipiente, perché aveva una natura e una composizione
I gas Nel 1630 fu usato per la prima volta il termine gas: Van Helmont che lo inventò, pensava però che non fosse possibile contenere un gas in un recipiente, perché aveva una natura e una composizione
Lo stato gassoso. Particelle con volume proprio trascurabile puntiformi
 Lo stato gassoso Gas ideale (o perfetto) Particelle in movimento (casuale) Particelle con volume proprio trascurabile puntiformi Assenza di interazioni tra le particelle trasformazioni fisiche e non chimiche
Lo stato gassoso Gas ideale (o perfetto) Particelle in movimento (casuale) Particelle con volume proprio trascurabile puntiformi Assenza di interazioni tra le particelle trasformazioni fisiche e non chimiche
Un modello per il gas ideale
 Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione
Il Gas Ideale. Il gas ideale é un'astrazione
 Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
Il Gas Ideale a) le particelle sono animate da moto perenne, ed occupano omogeneamente tutto lo spazio a loro disposizione b) il movimento delle particelle è casuale c) le particelle hanno volume proprio
GAS. Forze di legame intermolecolari ridotte Stato altamente disordinato
 I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
GAS IDEALI (o gas perfetti )
 GAS IDEALI (o gas perfetti ) TEORIA CINETICA DEI GAS (modello di gas ideale ) molecole puntiformi moto rettilineo ed urti elastici forze attrattive - repulsive intermolecolari nulle PARAMETRI DELLO STATO
GAS IDEALI (o gas perfetti ) TEORIA CINETICA DEI GAS (modello di gas ideale ) molecole puntiformi moto rettilineo ed urti elastici forze attrattive - repulsive intermolecolari nulle PARAMETRI DELLO STATO
I gas. Le caratteristiche dei gas. La legge di Boyle
 I gas Le caratteristiche dei gas Lo stato aeriforme è definito come uno dei tre stati della materia. Lo stato aeriforme può essere costituito da vapore o da gas. Un vapore è diverso da un gas in quanto
I gas Le caratteristiche dei gas Lo stato aeriforme è definito come uno dei tre stati della materia. Lo stato aeriforme può essere costituito da vapore o da gas. Un vapore è diverso da un gas in quanto
Stati di aggregazione della materia. GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti
 9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
9. I Gas Farmacia Stati di aggregazione della materia GAS Volume e forma indefiniti LIQUIDO Volume definito, forma indefinita SOLIDO Volume e forma definiti Stato solido Nello stato solido l energia di
Lo stato gassoso gas. Caratteristiche dello stato gassoso. liquido. solido. assenza di volume proprio forma fluida
 Lo stato gassoso gas liquido solido assenza di volume proprio forma fluida Caratteristiche dello stato gassoso Capacità di occupare tutto lo spazio a disposizione Distanze molto grandi tra le particelle
Lo stato gassoso gas liquido solido assenza di volume proprio forma fluida Caratteristiche dello stato gassoso Capacità di occupare tutto lo spazio a disposizione Distanze molto grandi tra le particelle
Diagramma di stato di H 2 O
 Lezione 13 1. Pressione e temperatura 2. Leggi dei gas 3. Teoria cinetica ei gas 4. Gas ideali e gas reali 5. Miscele gassose: legge di Dalton 6. Frazioni molari Diagramma di stato di H 2 O Diagrammi di
Lezione 13 1. Pressione e temperatura 2. Leggi dei gas 3. Teoria cinetica ei gas 4. Gas ideali e gas reali 5. Miscele gassose: legge di Dalton 6. Frazioni molari Diagramma di stato di H 2 O Diagrammi di
Leggi ricavate da osservazioni sperimentali : mantenendo costante due dei 4 parametri, come variano gli altri due?
 Le leggi dei gas Lo stato gassoso è caratterizzato da mancanza di forma e volume propri, e dalla tendenza a occupare tutto il volume disponibile. Lo stato di un gas dipende da 4 parametri: Volume (V) Pressione
Le leggi dei gas Lo stato gassoso è caratterizzato da mancanza di forma e volume propri, e dalla tendenza a occupare tutto il volume disponibile. Lo stato di un gas dipende da 4 parametri: Volume (V) Pressione
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
Il prodotto della pressione per il volume di una determinata massa gassosa è direttamente proporzionale alla temperatura assoluta: PV = KT
 ESERCITAZIONE 5 LEGGI DEI GAS Le leggi che governano i rapporti che si stabiliscono tra massa, volume, temperatura e pressione di un gas, sono leggi limite, riferite cioè ad un comportamento ideale, cui
ESERCITAZIONE 5 LEGGI DEI GAS Le leggi che governano i rapporti che si stabiliscono tra massa, volume, temperatura e pressione di un gas, sono leggi limite, riferite cioè ad un comportamento ideale, cui
Elementi che esistono come gas a 25 0 C and 1 atmosfera 5.1
 I gas Capitolo 5 Elementi che esistono come gas a 25 0 C and 1 atmosfera 5.1 Tabella 5.1 Alcune sostanze che si trovano allo stato gassoso a 1 atm e 25 C Elementi H 2 (idrogeno molecolare) N 2 (azoto molecolare)
I gas Capitolo 5 Elementi che esistono come gas a 25 0 C and 1 atmosfera 5.1 Tabella 5.1 Alcune sostanze che si trovano allo stato gassoso a 1 atm e 25 C Elementi H 2 (idrogeno molecolare) N 2 (azoto molecolare)
Queste proprietà derivano dalla grande distanza che separa le molecole che compongono un gas.
 Stato Gassoso Lo stato gassoso I gas hanno tre proprietà caratteristiche: 1.sono facilmente comprimibili 2. si espandono per riempire il loro contenitore 3. occupano molto più spazio dei solidi e liquidi
Stato Gassoso Lo stato gassoso I gas hanno tre proprietà caratteristiche: 1.sono facilmente comprimibili 2. si espandono per riempire il loro contenitore 3. occupano molto più spazio dei solidi e liquidi
I gas e loro proprietà Cap , 9-12, 15-24, 27-28, 31-33, 37-40, 52, 93-96
 2016 2017 CCS - Biologia CCS Scienze Geologiche 1 I gas e loro proprietà Cap 11. 1-7, 9-12, 15-24, 27-28, 31-33, 37-40, 52, 93-96 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito.
2016 2017 CCS - Biologia CCS Scienze Geologiche 1 I gas e loro proprietà Cap 11. 1-7, 9-12, 15-24, 27-28, 31-33, 37-40, 52, 93-96 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito.
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Legge di stato dei gas ideali
 Legge di stato dei gas ideali Le leggi di Boyle e Charles/Gay Lussac possono essere riunite, insieme al principio di Avogadro, in un'unica equazione che correla fra loro P, V, T e numero di moli di un
Legge di stato dei gas ideali Le leggi di Boyle e Charles/Gay Lussac possono essere riunite, insieme al principio di Avogadro, in un'unica equazione che correla fra loro P, V, T e numero di moli di un
STATO GASSOSO. nel 1766 nel 1772 nel 1774
 STATO GASSOSO 1 STATO GASSOSO I gas furono le ultime sostanze ad essere identificate dal punto di vista chimico; infatti l idea dell esistenza di diversi tipi di gas si affermò solo lentamente. Scoperta
STATO GASSOSO 1 STATO GASSOSO I gas furono le ultime sostanze ad essere identificate dal punto di vista chimico; infatti l idea dell esistenza di diversi tipi di gas si affermò solo lentamente. Scoperta
CO 2 NO 2 SO 2 CH 4. He Ne Ar H 2 N 2 O 2 Cl 2
 Lo stato gassoso I gas sono materiali caratterizzati dalla mancanza di forma e volume propri. Assumono la forma ed il volume del recipiente che li contiene e sono facilmente comprimibili. Le sostanze gassose
Lo stato gassoso I gas sono materiali caratterizzati dalla mancanza di forma e volume propri. Assumono la forma ed il volume del recipiente che li contiene e sono facilmente comprimibili. Le sostanze gassose
GAS. Forze di legame intermolecolari ridotte Stato altamente disordinato
 I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
I GAS PERFETTI GAS Forze di legame intermolecolari ridotte Stato altamente disordinato Principali caratteristiche: Bassa viscosità Assenza di volume e forma propri Comprimibilità Miscibilità Pressione:
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3 1 GLI STATI DI AGGREGAZIONE DELLA MATERIA 2 I composti chimici
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologia agroalimentare PARTE 3 1 GLI STATI DI AGGREGAZIONE DELLA MATERIA 2 I composti chimici
Il gas perfetto è costituito da particelle
 Stato aeriforme E costituito da gas o vapori; un sistema gassoso è formato da un grande numero di particelle a distanze grandi tra loro, in movimento caotico (la densità di un gas è inferiore a quella
Stato aeriforme E costituito da gas o vapori; un sistema gassoso è formato da un grande numero di particelle a distanze grandi tra loro, in movimento caotico (la densità di un gas è inferiore a quella
Stati di aggregazione della materia
 Stati di aggregazione della materia A seconda della natura dei legami tra gli atomi o delle forze tra le molecole si possono avere diversi stati di aggregazione della materia SOLIDO LIQUIDO GAS PLASMA
Stati di aggregazione della materia A seconda della natura dei legami tra gli atomi o delle forze tra le molecole si possono avere diversi stati di aggregazione della materia SOLIDO LIQUIDO GAS PLASMA
= cost a p costante V 1 /T 1 =V 2 /T 2 LEGGE DI GAY-LUSSAC: Un sistema allo stato gassoso è definito da 4. mmhg (torr), bar.
 GAS IDEALI Un sistema allo stato gassoso è definito da 4 parametri: OLUME () l, m 3 PRESSIONE (p) Pa, atm, mmhg (torr), bar QUANTITA DI SOSTANZA (n) mol TEMPERATURA (T) K Sperimentalmente sono state determinate
GAS IDEALI Un sistema allo stato gassoso è definito da 4 parametri: OLUME () l, m 3 PRESSIONE (p) Pa, atm, mmhg (torr), bar QUANTITA DI SOSTANZA (n) mol TEMPERATURA (T) K Sperimentalmente sono state determinate
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 2. La carta d identità delle sostanze SEGUI LA MAPPA descrivere atomica 1 descrivere
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 2. La carta d identità delle sostanze SEGUI LA MAPPA descrivere atomica 1 descrivere
-GAS IDEALI- Le particelle che costituiscono un gas ideale:
 -GAS IDEALI- Le particelle che costituiscono un gas ideale: sono in movimento continuo e casuale hanno un volume trascurabile rispetto al volume totale a disposizione del gas non interagiscono fra loro
-GAS IDEALI- Le particelle che costituiscono un gas ideale: sono in movimento continuo e casuale hanno un volume trascurabile rispetto al volume totale a disposizione del gas non interagiscono fra loro
Sistemi Gassosi. GAS = specie che occupa tutto lo spazio disponibile. VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 )
 Sistemi Gassosi GAS = specie che occupa tutto lo spazio disponibile VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 ) PRESSIONE = forza per unità di superficie Unità di misura: Forza Newton (N)
Sistemi Gassosi GAS = specie che occupa tutto lo spazio disponibile VOLUME = spazio occupato si misura in: m 3, L (1L = 1dm 3 ) PRESSIONE = forza per unità di superficie Unità di misura: Forza Newton (N)
Leggi dei gas Equazione di stato dei gas perfetti
 Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
Le leggi dei gas Quale descrizione fisico-matematica si può usare per i diversi stati di aggregazione della materia? Essa è tanto più semplice (equazioni) quanto meno interagenti sono fra loro le particelle
TEORIA CINETICA DEI GAS IDEALI
 TEORIA CINETICA DEI GAS IDEALI T R AT TO DA: I P ro b l e m i D e l l a F i s i c a - C u t n e l l, J o h n s o n, Yo u n g, S t a d l e r Z a n i c h e l l i e d i t o r e La F i s i c a di A m a l d
TEORIA CINETICA DEI GAS IDEALI T R AT TO DA: I P ro b l e m i D e l l a F i s i c a - C u t n e l l, J o h n s o n, Yo u n g, S t a d l e r Z a n i c h e l l i e d i t o r e La F i s i c a di A m a l d
ATOMI E MOLECOLE. ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche.
 1 ATOMI E MOLECOLE ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche. SIMBOLO ATOMICO= 1 o 2 lettere che identificano elemento A= numero di massa (protoni+neutroni) Z=
1 ATOMI E MOLECOLE ATOMO= unità più piccola di un elemento che ne mantiene le caratteristiche chimiche. SIMBOLO ATOMICO= 1 o 2 lettere che identificano elemento A= numero di massa (protoni+neutroni) Z=
Stati d aggregazione della materia
 Stati d aggregazione della materia SOLIDO: Forma e volume propri. GASSOSO: Forma e volume del recipiente in cui è contenuto. LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. Parametri
Stati d aggregazione della materia SOLIDO: Forma e volume propri. GASSOSO: Forma e volume del recipiente in cui è contenuto. LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. Parametri
Termodinamica (2) gas ideali Lezione 13, 19/11/2018, JW
 Termodinamica (2) gas ideali Lezione 13, 19/11/2018, JW 16.1-16.2 1 1. Gas ideali In un gas ideale l interazione tra le molecole può essere trascurata. Cerchiamo l'equazione di stato dei gas ideali, cioè
Termodinamica (2) gas ideali Lezione 13, 19/11/2018, JW 16.1-16.2 1 1. Gas ideali In un gas ideale l interazione tra le molecole può essere trascurata. Cerchiamo l'equazione di stato dei gas ideali, cioè
approfondimento Fasi e cambiamenti di fase
 approfondimento Fasi e cambiamenti di fase Gas ideali e gas reali Teoria cinetica dei gas e conseguenze Cambiamenti di fase e conservazione della energia Gas ideali e gas reali In un gas ideale: l interazione
approfondimento Fasi e cambiamenti di fase Gas ideali e gas reali Teoria cinetica dei gas e conseguenze Cambiamenti di fase e conservazione della energia Gas ideali e gas reali In un gas ideale: l interazione
Termodinamica Chimica
 Universita degli Studi dell Insubria Termodinamica Chimica I Gas Ideali dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini Proprietà di un Gas Può essere compresso facilmente Esercita
Universita degli Studi dell Insubria Termodinamica Chimica I Gas Ideali dario.bressanini@uninsubria.it http://scienze-como.uninsubria.it/bressanini Proprietà di un Gas Può essere compresso facilmente Esercita
Capitolo 5 La quantità chimica: la mole
 Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
Capitolo 5 La quantità chimica: la mole 1. La massa di atomi e molecole: un po di storia 2. Le reazioni tra i gas e il principio di Avogadro 3. Quanto pesano un atomo o una molecola? 4. La massa atomica
. Proprietà degli stati della materia Aeriforme Liquido Solido
 . Proprietà degli stati della materia Aeriforme Liquido Solido Volume variabile in funzione del recipiente Volume definito Volume definito Forma del recipiente Forma del recipiente Forma propria Miscibili
. Proprietà degli stati della materia Aeriforme Liquido Solido Volume variabile in funzione del recipiente Volume definito Volume definito Forma del recipiente Forma del recipiente Forma propria Miscibili
STATI DI AGGREGAZIONE
 STATI DI AGGREGAZIONE SOLIDO HA FORMA E VOLUME PROPRIO LIQUIDI NON HA FORMA PROPRIA HA VOLUME PROPRIO GAS NON HA NE FORMA NE VOLUME PROPRI FORZE INTERMOLECOLARI Solidi > liquidi >> gas 0 Gas reali> gas
STATI DI AGGREGAZIONE SOLIDO HA FORMA E VOLUME PROPRIO LIQUIDI NON HA FORMA PROPRIA HA VOLUME PROPRIO GAS NON HA NE FORMA NE VOLUME PROPRI FORZE INTERMOLECOLARI Solidi > liquidi >> gas 0 Gas reali> gas
STATI DI AGGREGAZIONE
 STATI DI AGGREGAZIONE SOLIDO HA FORMA E VOLUME PROPRIO LIQUIDO NON HA FORMA PROPRIA HA VOLUME PROPRIO GAS NON HA NE FORMA NE VOLUME PROPRI FORZE INTERMOLECOLARI Solidi > liquidi >> gas 0 Gas reali> gas
STATI DI AGGREGAZIONE SOLIDO HA FORMA E VOLUME PROPRIO LIQUIDO NON HA FORMA PROPRIA HA VOLUME PROPRIO GAS NON HA NE FORMA NE VOLUME PROPRI FORZE INTERMOLECOLARI Solidi > liquidi >> gas 0 Gas reali> gas
LEGGI DEI GAS. Gas sono sostanze sprovviste di forma e volume proprio
 LEGGI DEI GAS Gas sono sostanze sprovviste di forma e volume proprio Una grandezza molto significativa per descrivere un gas è la pressione, conseguenza delle collisioni del gas sulla superficie del contenitore.
LEGGI DEI GAS Gas sono sostanze sprovviste di forma e volume proprio Una grandezza molto significativa per descrivere un gas è la pressione, conseguenza delle collisioni del gas sulla superficie del contenitore.
Corso di Chimica Generale CL Biotecnologie
 Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Corso di Chimica Generale CL Biotecnologie STATI DELLA MATERIA Prof. Manuel Sergi MATERIA ALLO STATO GASSOSO MOLECOLE AD ALTA ENERGIA CINETICA GRANDE DISTANZA TRA LE MOLECOLE LEGAMI INTERMOLECOLARI DEBOLI
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 5 La quantità chimica: la mole 3 Sommario 1. La massa di atomi e molecole: cenni storici 2. Quanto pesa un atomo o una molecola
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 5 La quantità chimica: la mole 3 Sommario 1. La massa di atomi e molecole: cenni storici 2. Quanto pesa un atomo o una molecola
I Gas. Farmacia. Lezione
 I Gas Farmacia Lezione 2016-2017 GAS Importanza dei gas L airbag si riempie di N2 gas in seguito ad un urto. Il gas viene generato dalla decomposizione della sodio azide NaN3. 2 NaN3 ---> 2 Na + 3 N2 Stati
I Gas Farmacia Lezione 2016-2017 GAS Importanza dei gas L airbag si riempie di N2 gas in seguito ad un urto. Il gas viene generato dalla decomposizione della sodio azide NaN3. 2 NaN3 ---> 2 Na + 3 N2 Stati
1.Pressione di un Gas
 1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 19 Temperatura e principio zero della termodinamica I nostri sensi non sono affidabili per definire lo stato termico dei corpi. Ocorre un metodo
UNITA DI MISURA. Le unità di misura sono molto importanti
 Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
Le unità di misura sono molto importanti UNITA DI MISURA 1000 è solo un numero 1000 LIRE unità di misura monetaria 1000 EURO unità di misura monetaria ma il valore di acquisto è molto diverso! 1000 Euro/mese
Lezione 2. Leggi ponderali
 Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Lezione 2 Leggi ponderali I miscugli eterogenei presentano i componenti distinguibili in due o più fasi, in rapporti di massa altamente variabili e che mantengono le caratteristiche originarie. I miscugli
Stati della materia. Esempio. Fusione e solidificazione. Esempio. Stati di aggregazione della materia
 Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Stati della materia STATI DI AGGREGAZIONE DELLA MATERIA E GAS PERFETTI Cosa sono gli stati della materia? Gli stati della materia sono come si presenta la materia nell universo fisico e dipendono dalla
Introduzione alla Chimica. Paolo Mazza
 Introduzione alla Chimica Paolo Mazza 2 aprile 2013 Indice 1 Introduzione 2 2 Le teorie della materia 4 2.1 Teoria atomica.................................... 4 2.2 Teoria cinetica.....................................
Introduzione alla Chimica Paolo Mazza 2 aprile 2013 Indice 1 Introduzione 2 2 Le teorie della materia 4 2.1 Teoria atomica.................................... 4 2.2 Teoria cinetica.....................................
Dipartimento di Scienze Chimiche. Ambiente. Sistema
 Descrizione macroscopica dei sistemi materiali Sistema: materia compresa entro una superficie chiusa (ad esempio la superficie interna di un contenitore, ma può essere anche una superficie matematica,
Descrizione macroscopica dei sistemi materiali Sistema: materia compresa entro una superficie chiusa (ad esempio la superficie interna di un contenitore, ma può essere anche una superficie matematica,
INTRODUZIONE ALLA TERMODINAMICA. Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta
 INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
Densita. FLUIDI : liquidi o gas. macroscop.:
 6-SBAC Fisica 1/10 FLUIDI : liquidi o gas macroscop.: microscop.: sostanza che prende la forma del contenitore che la occupa insieme di molecole tenute insieme da deboli forze di coesione (primi vicini)
6-SBAC Fisica 1/10 FLUIDI : liquidi o gas macroscop.: microscop.: sostanza che prende la forma del contenitore che la occupa insieme di molecole tenute insieme da deboli forze di coesione (primi vicini)
Stati di aggregazione della materia
 SOLIDO: Forma e volume propri. Stati di aggregazione della materia LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. GASSOSO: Forma e volume del recipiente in cui è contenuto. Parametri
SOLIDO: Forma e volume propri. Stati di aggregazione della materia LIQUIDO: Forma del recipiente in cui è contenuto, ma volume proprio. GASSOSO: Forma e volume del recipiente in cui è contenuto. Parametri
2 HCl. H 2 + Cl 2 ATOMI E MOLECOLE. Ipotesi di Dalton
 Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Ipotesi di Dalton ATOMI E MOLECOLE 1.! Un elemento è formato da particelle indivisibili chiamate atomi. 2.! Gli atomi di uno specifico elemento hanno proprietà identiche. 3.! Gli atomi si combinano secondo
Esercizi sui Gas. Insegnamento di Chimica Generale CCS CHI e MAT
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/ Esercizio 1 Un
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/ Esercizio 1 Un
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
LA TEORIA CINETICA DEI GAS.
 LA TEORIA CINETICA DEI GAS. Il comportamento dei gas,contrariamente a quanto accade per i liquidi e per i solidi appare indipendente dalla specie chimica: la bassissima densità,la capacità di espandersi
LA TEORIA CINETICA DEI GAS. Il comportamento dei gas,contrariamente a quanto accade per i liquidi e per i solidi appare indipendente dalla specie chimica: la bassissima densità,la capacità di espandersi
Teoria Cinetica Molecolare dei Gas Ideali
 Teoria Cinetica Molecolare dei Gas Ideali Un gas è composto da molecole molto lontane tra di loro in confronto alle loro dimensioni e possono essere considerate puntiformi, quindi prive di volume. Le molecole
Teoria Cinetica Molecolare dei Gas Ideali Un gas è composto da molecole molto lontane tra di loro in confronto alle loro dimensioni e possono essere considerate puntiformi, quindi prive di volume. Le molecole
L equilibrio dei gas
 L equilibrio dei gas Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura 1 L equilibrio dei gas Un gas esercita una pressione sul recipiente che
L equilibrio dei gas Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura 1 L equilibrio dei gas Un gas esercita una pressione sul recipiente che
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà. I liquidi e loro proprietà
 2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
2014 2015 CCS - Biologia CCS - Fisica I gas e loro proprietà 1 I liquidi e loro proprietà 2 Proprietà Generali dei Gas I gas possono essere espansi all infinito. I gas occupano i loro contenitori uniformemente
1) Che cos é la pressione? Qual è la sua unità di misura nel S.I.?
 1) Che cos é la pressione? Qual è la sua unità di misura nel S.I.? 2) Da che cosa dipende la pressione esercitata da un oggetto di massa m poggiato su di una superficie? 3) Che cos è un fluido? 4) Come
1) Che cos é la pressione? Qual è la sua unità di misura nel S.I.? 2) Da che cosa dipende la pressione esercitata da un oggetto di massa m poggiato su di una superficie? 3) Che cos è un fluido? 4) Come
Le grandezze. grandezza. Grandezze estensive e intensive 03/03/2019. Qualunque proprietà della materia che è soggetta ad essere misurata si definisce
 Le grandezze Le grandezze Qualunque proprietà della materia che è soggetta ad essere misurata si definisce grandezza Grandezze estensive e intensive Le grandezze estensive dipendono dalle dimensioni del
Le grandezze Le grandezze Qualunque proprietà della materia che è soggetta ad essere misurata si definisce grandezza Grandezze estensive e intensive Le grandezze estensive dipendono dalle dimensioni del
LEGGI PONDERALI DELLA CHIMICA
 LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
LEGGI PONDERALI DELLA CHIMICA LEGGE DI LAVOISIER (1743-1794) In ogni reazione la massa totale dei reagenti è uguale alla massa totale dei prodotti. Massa Totale R = Massa Totale P Esempio rame + zolfo
Gradi di libertà negli sta/ di aggregazione della materia
 Gradi di libertà negli sta/ di aggregazione della materia I solidi cristallini sono cara-erizza0 da un ordine nelle posizioni e nelle orientazioni. Gradi di libertà negli sta/ di aggregazione della materia
Gradi di libertà negli sta/ di aggregazione della materia I solidi cristallini sono cara-erizza0 da un ordine nelle posizioni e nelle orientazioni. Gradi di libertà negli sta/ di aggregazione della materia
Modulo B Unità 3 Equilibrio dei fluidi Pagina 1. Solidi, liquidi, aeriformi
 Modulo B Unità 3 Equilibrio dei fluidi Pagina Solidi, liquidi, aeriformi I solidi hanno forma e volume propri, i liquidi hanno volume proprio e forma del recipiente che li contiene, gli aeriformi hanno
Modulo B Unità 3 Equilibrio dei fluidi Pagina Solidi, liquidi, aeriformi I solidi hanno forma e volume propri, i liquidi hanno volume proprio e forma del recipiente che li contiene, gli aeriformi hanno
Aria e pressione. Enrico Degiuli Classe prima
 Aria e pressione Enrico Degiuli Classe prima Le proprietà dell aria L aria è un miscuglio di gas, è composta da 78% di azoto 21% di ossigeno 1% altri gas (argon, CO2, neon, elio, ) Il nostro pianeta è
Aria e pressione Enrico Degiuli Classe prima Le proprietà dell aria L aria è un miscuglio di gas, è composta da 78% di azoto 21% di ossigeno 1% altri gas (argon, CO2, neon, elio, ) Il nostro pianeta è
Termodinamica. Marcello Borromeo corso di Fisica per Farmacia - Anno Accademico
 Termodinamica Studia sistemi estesi caratterizzati da pressione, volume e temperatura Si basa sulla definizione della temperatura e su tre principi Il primo principio riguarda la conservazione dell energia
Termodinamica Studia sistemi estesi caratterizzati da pressione, volume e temperatura Si basa sulla definizione della temperatura e su tre principi Il primo principio riguarda la conservazione dell energia
Massa degli atomi e delle molecole
 Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
Dallo studio dei volumi di gas nelle reazioni chimiche alle masse degli atomi e delle molecole Lo stato fisico di di un gas è descritto da tre grandezze fisiche: PRESSIONE (p) VOLUME (V) TEMPERATURA (T)
Lez 14 16/11/2016. Lezioni in didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617
 Lez 14 16/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Esperienza di Joule E. Fiandrini Fis. Sper. e 2 Esperienza di Joule
Lez 14 16/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Esperienza di Joule E. Fiandrini Fis. Sper. e 2 Esperienza di Joule
Gas. Chimica generale ed Inorganica: Chimica Generale. I palloni ad aria calda
 Gas I palloni ad aria calda Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-2 Illustrando la pressione esercitata da un
Gas I palloni ad aria calda Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-1 Lo stato gassoso di tre alogeni (Gruppo 17) Gas FIGURA 6-2 Illustrando la pressione esercitata da un
ESERCIZI ESERCIZI. 1) L equazione di stato valida per i gas perfetti è: a. PV = costante b. PV = nrt c. PV = znrt d. RT = npv Soluzione
 ESERCIZI 1) L equazione di stato valida per i gas perfetti è: a. PV = costante b. PV = nrt c. PV = znrt d. RT = npv 2) In genere, un gas si comporta idealmente: a. ad elevate pressioni e temperature b.
ESERCIZI 1) L equazione di stato valida per i gas perfetti è: a. PV = costante b. PV = nrt c. PV = znrt d. RT = npv 2) In genere, un gas si comporta idealmente: a. ad elevate pressioni e temperature b.
GLI STATI DELLA MATERIA
 GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
GLI STATI DELLA MATERIA E LE SOLUZIONI Stati di aggregazione della materia Cambiamenti di stato La temperatura del cubetto di ghiaccio aumenta fino a raggiungere un valore detto PUNTO (O TEMPERATURA) DI
LEGAMI INTERMOLECOLARI LEGAMI INTERMOLECOLARI
 I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
I legami (o forze) intermolecolari sono le forze attrattive tra particelle: molecola - molecola, molecola - ione, ione - ione In assenza di queste interazioni tutti i composti sarebbero gassosi NB: attenzione
STATO GASSOSO. parte I a. - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio
 STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
Lezione 20: Atomi e molecole
 Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
Lezione 20 - pag.1 Lezione 20: Atomi e molecole 20.1. Il punto della situazione Abbiamo visto, nella lezione precedente, come il modello atomico sia in grado di spiegare la grande varietà di sostanze che
Esercizi sui Gas. Insegnamento di Chimica Generale CCS CHI e MAT. A.A. 2015/2016 (I Semestre)
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio 1 Un campione
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT A.A. 2015/2016 (I Semestre) Esercizi sui Gas Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio Esercizio 1 Un campione
Forze Intermolecolari. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Forze Intermolecolari Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Forze Intermolecolari Le Forze Intermolecolari sono forze attrattive fra molecole. Le
Forze Intermolecolari Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Forze Intermolecolari Le Forze Intermolecolari sono forze attrattive fra molecole. Le
LO STATO GASSOSO. S: Forma e volume propri L: Volume proprio forma del contenitore G: Volume e forma del contenitore
 LO STATO GASSOSO Le diverse proprietà di massa degli stati di aggregazione della materia sono dovute all arrangiamento delle molecole (o atomi o ioni). Tutti gli stati rispondono ad una perturbazione (ad
LO STATO GASSOSO Le diverse proprietà di massa degli stati di aggregazione della materia sono dovute all arrangiamento delle molecole (o atomi o ioni). Tutti gli stati rispondono ad una perturbazione (ad
Temperatura. Il legame con le grandezze microscopiche è di tipo statistico. Pressione Volume Temperatura
 Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
Temperatura La materia è un sistema fisico a molti corpi Gran numero di molecole (N A =6,02 10 23 ) interagenti tra loro Descrizione mediante grandezze macroscopiche (valori medi su un gran numero di particelle):
LE LEGGI DEI GAS. Prof. Michele Barcellona
 LE LEGGI DEI GAS Prof. Michele Barcellona STATO DI UN GAS Lo stato di un gas dipende dalle seguenti grandezze: Massa (in moli) Volume V Pressione P Temperatura T LE TRASFORMAZIONI DI UN GAS La modifica
LE LEGGI DEI GAS Prof. Michele Barcellona STATO DI UN GAS Lo stato di un gas dipende dalle seguenti grandezze: Massa (in moli) Volume V Pressione P Temperatura T LE TRASFORMAZIONI DI UN GAS La modifica
STATO GASSOSO. parte I a. - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio
 STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
STATO GASSOSO parte I a - GAS PERFETTI - GAS REALI Lucidi del Prof. D. Scannicchio GAS PERFETTI molecole puntiformi (volume proprio nullo) urti elastici (stesse particelle prima e dopo l'urto) parametri
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
I Gas e Loro Proprietà (II)
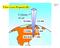 I Gas e Loro Proprietà (II) 2017 10 miles 0.2 atm 4 miles 0.5 atm Sea level 1 atm Dario Bressanini Gas e reazioni chimiche Determinare il volume di CO 2 prodotto a 37 0 C e 1.0 atm quando 5.6 g di glucosio
I Gas e Loro Proprietà (II) 2017 10 miles 0.2 atm 4 miles 0.5 atm Sea level 1 atm Dario Bressanini Gas e reazioni chimiche Determinare il volume di CO 2 prodotto a 37 0 C e 1.0 atm quando 5.6 g di glucosio
Lezione 25: Un approccio macroscopico all equazione dei gas
 Lezione 25 - pag.1 Lezione 25: Un approccio macroscopico all equazione dei gas 25.1. Dal micro al macro Nella lezione 22 abbiamo costruito un modello microscopico che spiega bene alcune caratteristiche
Lezione 25 - pag.1 Lezione 25: Un approccio macroscopico all equazione dei gas 25.1. Dal micro al macro Nella lezione 22 abbiamo costruito un modello microscopico che spiega bene alcune caratteristiche
Calcolo di Integrali
 Calcolo di Integrali 28 aprile 2013 Indice 1 Teoria cinetica dei gas: la distribuzione delle velocità di Maxwell 2 2 Lavoro associato a una trasformazione isoterma 4 1 1 Teoria cinetica dei gas: la distribuzione
Calcolo di Integrali 28 aprile 2013 Indice 1 Teoria cinetica dei gas: la distribuzione delle velocità di Maxwell 2 2 Lavoro associato a una trasformazione isoterma 4 1 1 Teoria cinetica dei gas: la distribuzione
Capitolo 1 Misure e grandezze
 Capitolo 1 Misure e grandezze 1. Il Sistema Internazionale di Unità di misura 2. Grandezze estensive e grandezze intensive 3. Energia, lavoro e calore 4. Temperatura e calore 5. Misure precise e misure
Capitolo 1 Misure e grandezze 1. Il Sistema Internazionale di Unità di misura 2. Grandezze estensive e grandezze intensive 3. Energia, lavoro e calore 4. Temperatura e calore 5. Misure precise e misure
Capitolo 1 Misure e grandezze
 Capitolo 1 Misure e grandezze 1. Il Sistema Internazionale di Unità di misura 2. Grandezze estensive e grandezze intensive 3. Energia, lavoro e calore 4. Temperatura e calore 5. Misure precise e misure
Capitolo 1 Misure e grandezze 1. Il Sistema Internazionale di Unità di misura 2. Grandezze estensive e grandezze intensive 3. Energia, lavoro e calore 4. Temperatura e calore 5. Misure precise e misure
Gas. Vapore. Forma e volume del recipiente in cui è contenuto. un gas liquido a temperatura e pressione ambiente. microscopico MACROSCOPICO
 Lo Stato Gassoso Gas Vapore Forma e volume del recipiente in cui è contenuto. un gas liquido a temperatura e pressione ambiente MACROSCOPICO microscopico bassa densità molto comprimibile distribuzione
Lo Stato Gassoso Gas Vapore Forma e volume del recipiente in cui è contenuto. un gas liquido a temperatura e pressione ambiente MACROSCOPICO microscopico bassa densità molto comprimibile distribuzione
Le dimensioni rappresentano il concetto di misura fondamentali: lunghezza, tempo, massa, temperatura,
 Dimensioni e unità Le dimensioni rappresentano il concetto di misura fondamentali: lunghezza, tempo, massa, temperatura, derivate: energia, forza, velocità, pressione, Le unità sono i mezzi utilizzati
Dimensioni e unità Le dimensioni rappresentano il concetto di misura fondamentali: lunghezza, tempo, massa, temperatura, derivate: energia, forza, velocità, pressione, Le unità sono i mezzi utilizzati
Liceo Scientifico Statale Severi Salerno
 Liceo Scientifico Statale Severi Salerno VERIFICA SCRITTA DI FISICA Docente: Pappalardo Vincenzo Data: 08/11/2018 Classe: 4D 1. Esercizio Una massa di ghiaccio di 50g e alla temperatura di 0 C viene posta
Liceo Scientifico Statale Severi Salerno VERIFICA SCRITTA DI FISICA Docente: Pappalardo Vincenzo Data: 08/11/2018 Classe: 4D 1. Esercizio Una massa di ghiaccio di 50g e alla temperatura di 0 C viene posta
Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più
 I Fluidi Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più comunemente forze di coesione) che caratterizzano
I Fluidi Ogni sostanza è composta da un grandissimo numero di molecole soggette a forze di attrazione reciproche più o meno intense (coesione molecolare o più comunemente forze di coesione) che caratterizzano
UNIVERSITÀ DEGLI STUDI DI TERAMO
 UNIVERSITÀ DEGLI STUDI DI TERAMO FACOLTÀ DI MEDICINA VETERINARIA CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di FISICA MEDICA A.A. 2015 /2016 Docente: Chiucchi Riccardo mail:rchiucchi@unite.it
UNIVERSITÀ DEGLI STUDI DI TERAMO FACOLTÀ DI MEDICINA VETERINARIA CORSO DI LAUREA IN TUTELA E BENESSERE ANIMALE Corso di FISICA MEDICA A.A. 2015 /2016 Docente: Chiucchi Riccardo mail:rchiucchi@unite.it
