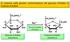
L ossidazione completa del glucosio da parte dell O 2. può essere suddivisa in due semi-reazioni
|
|
|
- Evangelista Colella
- 5 anni fa
- Visualizzazioni
Transcript
1 L ossidazione completa del glucosio da parte dell O 2 C 6 H 12 O O 2 6 CO H 2 O può essere suddivisa in due semi-reazioni C 6 H 12 O O 2 6 CO H e - (si ossidano gli atomi di carbonio) e 6 O H e - 12 H 2 O (riduzione dell O 2 ) NON diretta, ma mediata dai coenzimi NAD + e FAD
2 La conservazione dell energia durante l ossidazione di substrati può avvenire anche mediante trasporto di elettroni scambiati in reazioni di ossido-riduzione accoppiate. Nella fosforilazione ossidativa il trasporto di elettroni e la formazione di un gradiente di protoni transmembrana promuove la formazione di ATP.
3 MITOCONDRIO = CENTRALE ENERGETICA Trasformazione del piruvato ad acetil Coa; Ciclo degli acidi tricarbossilici; Fosforilazione ossidativa; Catabolismo acidi grassi; Ciclo dell urea (in parte); Serbatoio di Ca 2+
4
5 Mitochondrial network
6
7 Gli elettroni vengono trasportati da centri redox Fe 2+ Fe 3+ Cu + Cu 2+
8
9 CITOCROMI: David Keilin, 1925 Fe 2+ Fe 3+
10 CENTRI FERRO-ZOLFO: ferro non eme [2Fe-2S] [4Fe-4S] Fe e S sono uniti a Cys con legami di coordinazione con simmetria tetraedrica Possono subire reazioni redox (Fe 2+ Fe 3+ )
11 CoenzimaQ
12 FLAVINE e CoQ Hanno 3 stati di ossidazione possibili perché possono accettare o donare o uno o due elettroni
13 Potenziali di riduzione standard di alcuni componenti della catena di trasporto degli elettroni
14 CATENA DI TRASPORTO DEGLI ELETTRONI Gli elettroni trasportati dai 10 NADH e 2 FADH 2 prodotti da Glicolisi e ciclo di Krebs passano nella catena di trasporto di elettroni in cui: 4 complessi enzimatici contenenti circa 10 centri redox assemblati sulla membrana interna del mitocondrio; 1. NADH e FADH 2 vengono riossidati a NAD + e FAD; 2. Gli elettroni vengono trasferiti secondo una sequenza dettata dal potenziale ossidoriduttivo dei trasportatori (verso potenziali redox via via crescenti), fino ad arrivare all ossigeno; 3. Durante il trasferimento (che è un processo ESOERGONICO ) vengono espulsi protoni nello spazio intermembrana; 4. L energia conservata in questo gradiente protonico permette la sintesi di ATP (FOSFORILAZIONE OSSIDATIVA), nel momento in cui i protoni tornano nella matrice.
15
16 Complesso I 43 catene polipeptidiche 850 kd 1 FMN (= FAD-AMP) che partecipa alle reazioni redox 6 o 7 centri ferro-zolfo che partecipano al trasporto di e - Durante il trasporto di e -, 4 protoni vengono trasferiti fuori dalla matrice nello spazio intra-membrana
17 Complesso I
18 Complesso II 1. Contiene la succinato deidrogenasi (ciclo di Krebs) che contiene FAD 2. Passa gli elettroni dal succinato al CoQ 3. Contiene centri Fe-S 4. Contiene citocromo b NON opera dopo il Complesso I, ma fornisce un altro ingresso alla catena
19
20 Complesso III 1. Contiene 2 x 11 subunità (PM : 2 x 248 kd) 2. Contiene 2 citocromi b, 1 citocromo c 1, 1 centro [2Fe-2S] 3. Consente al trasportatore a 2 e - (CoQH2) di ridurre due molecole di citocromo c (trasportatore a un e - ) mediante il Ciclo Q
21 Complesso III
22
23 2 e - CICLO Q
24 Complesso IV (citocromo ossidasi) Catalizza le ossidazioni (con acquisto di 1 e - ) di 4 molecole consecutive di citocromo c ridotto e la contemporanea riduzione di una molecola di O 2 4 cit.c(fe 2+ ) + 4 H + + O 2 4 cit.c(fe 3+ ) + 2 H 2 O E un dimero 2 x 200 kd, 2 x 13 subunità Lega 4 centri redox : 1. cit.a 2. cit a x Cu B 4. centro 2 x Cu A
25 Citocromo c E un trasportatore di e - solubile Complesso IV
26 MECCANISMO DI REAZIONE DELLA CITOCROMO C OSSIDASI 4 cit c Fe H + + O 2 4 cit c Fe H 2 O Oltre ai 4 H + utilizzati per ridurre l O 2, 4 H + vengono traslocati nello spazio intermembrane. O 2
27
28
29
30
31 Modello del trasporto di elettroni legato alla pompa protonica
32 Z = carica del protone F = costante di Faraday = quantità di carica elettrica di una mole di elettroni = ,3399 C/mol
33 TEORIA CHEMIOSMOTICA: Peter Mitchell, 1961 (Nobel nel 1978) Gradiente elettrochimico di H +
34 La variazione di energia libera che serve a traslocare un protone verso lo spazio intermembrana è formata da due componenti: G = 2,3 RT [ph dentro ph fuori] + ZF Ψ [1] [2] Poiché il ph fuori è minore del ph dentro la matrice, [1] è positivo. Poiché Ψ è positivo quando un protone viene trasportato da un potenziale negativo ad uno positivo, anche [2] è positivo G è positivo L intero processo di formazione del gradiente protonico è un processo endoergonico Quindi Lo scaricamento del gradiente protonico è un processo esoergonico accoppiato a sintesi di ATP
35 PROVE SPERIMENTALI DELLA TEORIA CHEMIOSMOTICA DELLA FOSFORILAZIONE OSSIDATIVA 1. è necessaria una membrana interna intatta 2. le proteine del trasporto sono proteine transmembrana 3. uso di agenti che dissipano il gradiente: disaccoppianti (2, 4 dinitrofenolo) ionofori (valinomicina) 4. inibitori della pompa protonica (oligomicina B)
36 F0 F1 ATPasi ( complesso V) Boyer e Walker, Nobel 1997 F1 α 3 β 3 γδε β catalizza la formazione di ATP α lega ATP Dallo studio della struttura ai raggi X si osserva che l interno del cilindro e la porzione di gamma al suo interno sono privi di carica.
37
38 La rotazione della parte catalitica α 3 β 3 viene indotta dal trasferimento di protoni e consente la sintesi di ATP
39 Complesso dell ATP sintasi mitocondriale in toto Vista laterale Ogni subunità C di F 0 ha un residuo di Asp che subisce protonazione/deprotonazione durante il ciclo catalitico
40 Come avviene la rotazione La subunità a ha due semicanali per i protoni I protoni che entrano nel mezzo canale di entrata della subunità a vengono trasferiti sull Asp di una subunità c L Arg sulla subunità a che era ad esso legata si sposta verso l Asp protonato sulla subunità c adiacente scacciando il protone dal mezzo canale di uscita La subunità c con la coppia Asp- Arg si muove verso il semicanale di entrata e ricomincia un nuovo ciclo
41 La forza motrice provoca una rotazione dell asse centrale la subunità γ (mostrata come freccia verde)
42 RAPPORTO FOSFORO / OSSIGENO (quantità di ATP sintetizzato / O 2 ridotto) Il passaggio di circa un H + a livello della subunità F 0 produce un solo cambiamento conformazionale (rotazione di 120 ). Quindi per sintetizzare 1 ATP occorrono circa 3 H +
43 Traslocatore ADP/ATP
44 Traslocatore ADP/ATP Sp. intermem. matrice Cambia conformazione solo se legato. Ad ogni esportazione di ATP (-4) ed importazione di ADP (-3) corrisponde il trasferimento di una carica, che è guidato dalla differenza di potenziale Ψ attraverso la membrana mitocondriale interna (+ all esterno), che guida anche l entrata di Ca 2+
45 Il Pi entra nella matrice per simporto con H + e in parte dissipa il gradiente protonico Quindi per formare un ATP servono in totale 4 protoni
46 Sommario del flusso di elettroni, del numero di protoni traslocati, dell ATP prodotto se e - provengono dal NADH (sito di ingresso complesso I) = 10 protoni traslocati = 2,5 ATP prodotti se e - provengono da FADH2 (sito di ingresso Q, ubichinone) = 6 protoni traslocati = 1,5 ATP prodotti Il rapporto tra ATP sintetizzato e ½ O 2 ridotto (rapporto P/O) è 2,5 per il NADH 1,5 per il FADH 2
47 Gli equivalenti riducenti vengono trasportati all interno dei mitocondri attraverso dei sistemi navetta (Shuttle)
48 Shuttle del malato-aspartato
49 Shuttle del Glicerolo 3-fosfato (cervello e tessuto muscolare) Non utilizza trasportatori di membrana Meno efficiente dello shuttle malatoaspartato per resa di ATP
50 Assumendo che 1 NADH 2,5 ATP e 1 FADH 2 1,5 ATP
51 GLICOLISI RESA ENERGETICA DAL METABOLISMO AEROBIO DEL GLUCOSIO Glucosio 2 NADH + 2 ATP + 2 Piruvato 2 x 2,5 ATP + 2 ATP = 7 ATP PIRUVATO DEIDROGENASI CICLO DI KREBS 2 Piruvato 2 NADH + 2 Acetil CoA 2 x 2,5 ATP = 5 ATP 2 Acetil CoA 4 CO ATP + 6 NADH + 2 FADH 2 2 ATP + 6 x 2,5 ATP + 2 x 1,5 ATP = 20 ATP TOTALE 32 ATP (se si utilizza il malato/aspartato)
52 Regolazione della respirazione
53 Glicolisi Ciclo di Krebs Fosforil. Ox.
54 Nel tessuto adiposo bruno (nei neonati e negli animali in letargo), anche in presenza di alte concentrazioni di ATP la respirazione continua, ma l energia prodotta viene utilizzata per produrre calore anziché ATP attraverso la termogenina, una proteina disaccoppiante.
L ossidazione completa del glucosio da parte dell O 2. può essere suddivisa in due semi-reazioni
 L ossidazione completa del glucosio da parte dell O 2 C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O può essere suddivisa in due semi-reazioni C 6 H 12 O 6 + 6 O 2 6 CO 2 + 24 H + + 24 e - (si ossidano gli atomi
L ossidazione completa del glucosio da parte dell O 2 C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O può essere suddivisa in due semi-reazioni C 6 H 12 O 6 + 6 O 2 6 CO 2 + 24 H + + 24 e - (si ossidano gli atomi
L ossidazione completa del glucosio da parte dell O 2. può essere suddivisa in due semi-reazioni
 L ossidazione completa del glucosio da parte dell O 2 C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O può essere suddivisa in due semi-reazioni C 6 H 12 O 6 + 6 O 2 6 CO 2 + 24 H + + 24 e - (si ossidano gli atomi
L ossidazione completa del glucosio da parte dell O 2 C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O può essere suddivisa in due semi-reazioni C 6 H 12 O 6 + 6 O 2 6 CO 2 + 24 H + + 24 e - (si ossidano gli atomi
FADH ADP + Pi ATP...29 AG ' = -30,5 kj/mol...29 Resa di ATP per l ossidazione completa del glucosio...31
 FOSFORILAZIONE OSSIDATIVA FOSFORILAZIONE OSSIDATIVA...1 Glicolisi e ciclo di Krebs...3 il NADH il NADPH e il FADH2 sono traportatori solubili di elettroni...4 LA FOSFORILAZIONE OSSIDATIVA...5 Il mitocondrio...5
FOSFORILAZIONE OSSIDATIVA FOSFORILAZIONE OSSIDATIVA...1 Glicolisi e ciclo di Krebs...3 il NADH il NADPH e il FADH2 sono traportatori solubili di elettroni...4 LA FOSFORILAZIONE OSSIDATIVA...5 Il mitocondrio...5
Come le cellule traggono energia dal cibo: produzione di ATP
 Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Fosforilazione ossidativa
 Fosforilazione ossidativa FOSFORILAZIONE OSSIDATIVA La fosforilazione ossidativa è la via finale del metabolismo energetico, in cui gli elettroni (NADH e FADH 2 ) provenienti dalle molecole energetiche
Fosforilazione ossidativa FOSFORILAZIONE OSSIDATIVA La fosforilazione ossidativa è la via finale del metabolismo energetico, in cui gli elettroni (NADH e FADH 2 ) provenienti dalle molecole energetiche
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Corso di Laurea in Scienze Biologiche. Insegnamento di. Anno Accademico
 Seconda Università degli Studi di Napoli DiSTABiF Prof. Antimo Di Maro Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Anno Accademico 2015-16 Lezione 15 Catena di trasporto degli
Seconda Università degli Studi di Napoli DiSTABiF Prof. Antimo Di Maro Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Anno Accademico 2015-16 Lezione 15 Catena di trasporto degli
Modulo 16: La fosforilazione ossidativa
 1 Modulo 16: La fosforilazione ossidativa La fosforilazione ossidativa NADH e FADH 2 trasferiscono e - ad alto potenziale di trasferimento all O 2 liberando una quantità di energia sufficiente per generare
1 Modulo 16: La fosforilazione ossidativa La fosforilazione ossidativa NADH e FADH 2 trasferiscono e - ad alto potenziale di trasferimento all O 2 liberando una quantità di energia sufficiente per generare
matrice Sp. Interm. Il gambo (γε) cilindro C10 ruota con esso H + H+ H + H + H + H H + H H + H + H + H +
 I protoni si muovono secondo gradiente attraverso un canale d ingresso creato dalla subunità a e raggiungono il cilindro c 10. Quando una subunità c lega 1 un altro è rilasciato nella matrice lasciando
I protoni si muovono secondo gradiente attraverso un canale d ingresso creato dalla subunità a e raggiungono il cilindro c 10. Quando una subunità c lega 1 un altro è rilasciato nella matrice lasciando
Nicotinamide adenin dinucleotide (NAD + ) H - NMN R AMP. Nel NADP + questo gruppo ossidrilico è esterificato con un gruppo fosforico
 Nicotinamide adenin dinucleotide (NAD + ) H - NMN R AMP Nel NADP + questo gruppo ossidrilico è esterificato con un gruppo fosforico FMN riboflavina. FADH. (FMNH. ) (semichinone) AMP Flavin adenin dinucleotide
Nicotinamide adenin dinucleotide (NAD + ) H - NMN R AMP Nel NADP + questo gruppo ossidrilico è esterificato con un gruppo fosforico FMN riboflavina. FADH. (FMNH. ) (semichinone) AMP Flavin adenin dinucleotide
NADH FADH 2 (trasportatori ridotti di elettroni) Catena respiratoria (trasferimento degli
 NADH FADH 2 (trasportatori ridotti di elettroni) Fase 3 Trasferimento degli elettroni e fosforilazione ossidativa Catena respiratoria (trasferimento degli elettroni) Nicotinamide adenin dinucleotide (NAD
NADH FADH 2 (trasportatori ridotti di elettroni) Fase 3 Trasferimento degli elettroni e fosforilazione ossidativa Catena respiratoria (trasferimento degli elettroni) Nicotinamide adenin dinucleotide (NAD
CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO)
 CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO) - Decarb. ossid. piruvato - -Ossidazione acidi grassi - Vie ossidative aa -Ciclo di Krebs avvengono tutte nella matrice mitocondriale In tutte queste
CATENA RESPIRATORIA (CR) FOSFORILAZIONE OSSIDATIVA (FO) - Decarb. ossid. piruvato - -Ossidazione acidi grassi - Vie ossidative aa -Ciclo di Krebs avvengono tutte nella matrice mitocondriale In tutte queste
Catena di trasporto degli elettroni (catena respiratoria) e Fosforilazione ossidativa
 Catena di trasporto degli elettroni (catena respiratoria) e Fosforilazione ossidativa NADH e FADH2 (accettori universali di e-) formati nella glicolisi e nel ciclo di Krebs (e nell ossidazione degli acidi
Catena di trasporto degli elettroni (catena respiratoria) e Fosforilazione ossidativa NADH e FADH2 (accettori universali di e-) formati nella glicolisi e nel ciclo di Krebs (e nell ossidazione degli acidi
COMPLESSO V o ATP-SINTASI o F 1 F O -ATPasi
 COMPLESSO V o ATP-SINTASI o F 1 F O -ATPasi Componente F 1 (costituita dalle subunità α 3 β 3 γδε) Componente F o (subunità a 1 b 2 c 10 ) Matrice Contiene le subunità catalitiche (α e β) collegate alla
COMPLESSO V o ATP-SINTASI o F 1 F O -ATPasi Componente F 1 (costituita dalle subunità α 3 β 3 γδε) Componente F o (subunità a 1 b 2 c 10 ) Matrice Contiene le subunità catalitiche (α e β) collegate alla
COMPLESSO IV: CENTRI REDOX
 COMPLESSO IV: CENTRI REDOX Subunità II = 1 centro redox: Cu A (centro binucleare a 2 atomi di rame legati a due residui di cisteina, formano una struttura geometrica simile a quella di un centro FeS) riceve
COMPLESSO IV: CENTRI REDOX Subunità II = 1 centro redox: Cu A (centro binucleare a 2 atomi di rame legati a due residui di cisteina, formano una struttura geometrica simile a quella di un centro FeS) riceve
FOSFORILAZIONE OSSIDATIVA
 FOSFORILAZIONE OSSIDATIVA Lo scopo ultimo dei processi metabolici ossidativi è quello di canalizzare l energia contenuta nello scheletro carbonioso di zuccheri, ac. grassi e amminoacidi nella sintesi di
FOSFORILAZIONE OSSIDATIVA Lo scopo ultimo dei processi metabolici ossidativi è quello di canalizzare l energia contenuta nello scheletro carbonioso di zuccheri, ac. grassi e amminoacidi nella sintesi di
I Mitocondri Centrale elettrica cellulare
 I Mitocondri Centrale elettrica cellulare Potenziale redox standard Fe 2+ D Fe 3+ + e - Fe 2+ + Cu 2+ D Fe 3+ + Cu + Cu 2+ + e - D Cu + Ε = E + RT nf ln [accettore elettroni] [donatore elettroni] n = n
I Mitocondri Centrale elettrica cellulare Potenziale redox standard Fe 2+ D Fe 3+ + e - Fe 2+ + Cu 2+ D Fe 3+ + Cu + Cu 2+ + e - D Cu + Ε = E + RT nf ln [accettore elettroni] [donatore elettroni] n = n
trasferimento degli elettroni dal donatore di elettroni di una
 Una reazione di ossidoriduzione può essere realizzata per via chimica o per via elettrochimica Gli ioni Cu + si ossidano a Cu 2+ mentre gli ioni Fe 3+ si riducono a Fe 2+. Nel primo caso la reazione di
Una reazione di ossidoriduzione può essere realizzata per via chimica o per via elettrochimica Gli ioni Cu + si ossidano a Cu 2+ mentre gli ioni Fe 3+ si riducono a Fe 2+. Nel primo caso la reazione di
Fosforilazione ossidativa
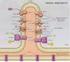 Chimica Biologica A.A. 2010-2011 Fosforilazione ossidativa Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Teoria Chemiosmotica ΔG = 2.3 RT (ph (matrice) -ph (spazio
Chimica Biologica A.A. 2010-2011 Fosforilazione ossidativa Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Teoria Chemiosmotica ΔG = 2.3 RT (ph (matrice) -ph (spazio
Anatomia biochimica di un mitocondrio
 Anatomia biochimica di un mitocondrio Le involuzioni(creste)aumentano considerevolmente l area della superficie della membrana interna. La membrana interna di un singolo mitocondrio può avere anche più
Anatomia biochimica di un mitocondrio Le involuzioni(creste)aumentano considerevolmente l area della superficie della membrana interna. La membrana interna di un singolo mitocondrio può avere anche più
Attività cellulare altamente coordinata svolta da sistemi multienzimatici, con i seguenti scopi: ottenere energia chimica dall ambiente attraverso la
 Metabolismo Attività cellulare altamente coordinata svolta da sistemi multienzimatici, con i seguenti scopi: ottenere energia chimica dall ambiente attraverso la degradazione di nutrienti operare la sintesi
Metabolismo Attività cellulare altamente coordinata svolta da sistemi multienzimatici, con i seguenti scopi: ottenere energia chimica dall ambiente attraverso la degradazione di nutrienti operare la sintesi
COME VIENE METABOLIZZATA QUESTA MASSICCIA QUANTITA DI ENERGIA? Trasformazione di energia potenziale di riduzione. energia libera di fosforilazione
 Trasformazione di energia potenziale di riduzione in energia libera di fosforilazione Un uomo adulto produce in media abbastanza energia da sintetizzare ogni giorno una quantità di ATP pari al suo peso
Trasformazione di energia potenziale di riduzione in energia libera di fosforilazione Un uomo adulto produce in media abbastanza energia da sintetizzare ogni giorno una quantità di ATP pari al suo peso
Respirazione cellullare
 Respirazione cellullare 1 luce La respirazione è un processo complementare alla fotosintesi e permette di completare il ciclo del Carbonio. fotosintesi CO 2 H 2 O O 2 Carboidrati respirazione Energia utile
Respirazione cellullare 1 luce La respirazione è un processo complementare alla fotosintesi e permette di completare il ciclo del Carbonio. fotosintesi CO 2 H 2 O O 2 Carboidrati respirazione Energia utile
Fosforilazione ossidativa
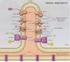 Fosforilazione ossidativa H 2 2H + + 2e - NADH+H + NAD + + 2H + +2e - FADH 2 FAD + 2H + + 2e - ½O 2 + 2H + + 2e - H 2 O + Calore ½ O 2 + 2H + + 2e - H 2 O + ATP 1 La fosforilazione ossidativa avviene nella
Fosforilazione ossidativa H 2 2H + + 2e - NADH+H + NAD + + 2H + +2e - FADH 2 FAD + 2H + + 2e - ½O 2 + 2H + + 2e - H 2 O + Calore ½ O 2 + 2H + + 2e - H 2 O + ATP 1 La fosforilazione ossidativa avviene nella
Il ciclo di Krebs e la fosforilazione ossidativa
 Il ciclo di Krebs e la fosforilazione ossidativa La respirazione cellulare Sono i processi molecolari in cui è coinvolto il consumo di O 2 e la formazione di CO 2 e H 2 O da parte della cellula. E suddivisa
Il ciclo di Krebs e la fosforilazione ossidativa La respirazione cellulare Sono i processi molecolari in cui è coinvolto il consumo di O 2 e la formazione di CO 2 e H 2 O da parte della cellula. E suddivisa
I MITOCONDRI: LE CENTRALI ENERGETICHE DELLA CELLULA
 I MITOCONDRI: LE CENTRALI ENERGETICHE DELLA CELLULA MITOCONDRIO OSSERVATO AL SEM Localizzazione dei mitocondri SONO IN GENERE PIÙ ABBONDANTI DELLE ZONE DELLA CELLULA CHE RICHIEDONO MAGGIORI QUANTITA DI
I MITOCONDRI: LE CENTRALI ENERGETICHE DELLA CELLULA MITOCONDRIO OSSERVATO AL SEM Localizzazione dei mitocondri SONO IN GENERE PIÙ ABBONDANTI DELLE ZONE DELLA CELLULA CHE RICHIEDONO MAGGIORI QUANTITA DI
Cap.19. Ciclo di Krebs. o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico
 Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
Una panoramica del ciclo dell acido ciclico
 Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
Ciclo di Krebs Una panoramica del ciclo dell acido ciclico Concetti chiave Il ciclo dell acido citrico, o ciclo di Krebs, o ciclo degli acidi tricarbossilici (TCA), è un processo catalitico a 8 tappe che
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
La degradazione ossidativa di zuccheri, ac. grassi, e amminoacidi. livello del substrato) Equivalenti riducenti di NADH e FADH 2
 La degradazione ossidativa di zuccheri, ac. grassi, e amminoacidi produce energia: ATP (fosforilazioni a livello del substrato) Equivalenti riducenti di NADH e FADH 2 Dalla loro ri-ossidazione si può ottenere
La degradazione ossidativa di zuccheri, ac. grassi, e amminoacidi produce energia: ATP (fosforilazioni a livello del substrato) Equivalenti riducenti di NADH e FADH 2 Dalla loro ri-ossidazione si può ottenere
Prof. Maria Nicola GADALETA FOSFORILAZIONE OSSIDATIVA 4
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche FOSFORILAZIONE
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche FOSFORILAZIONE
IL METABOLISMO CELLULARE GLICOLISI E RESPIRAZIONE CELLULARE
 IL METABOLISMO CELLULARE GLICOLISI E RESPIRAZIONE CELLULARE LE REAZIONI REDOX Sono reazioni chimiche in cui i reagenti si scambiano elettroni L acquisto di uno o più elettroni viene detto RIDUZIONE La
IL METABOLISMO CELLULARE GLICOLISI E RESPIRAZIONE CELLULARE LE REAZIONI REDOX Sono reazioni chimiche in cui i reagenti si scambiano elettroni L acquisto di uno o più elettroni viene detto RIDUZIONE La
Respirazione cellulare e fosforilazione ossidativa
 Respirazione cellulare e fosforilazione ossidativa La respirazione cellulare Il ciclo dell acido citrico ha un ruolo centrale nel catabolismo. Gli aminoacidi, gli acidi grassi e gli zuccheri come il glucosio
Respirazione cellulare e fosforilazione ossidativa La respirazione cellulare Il ciclo dell acido citrico ha un ruolo centrale nel catabolismo. Gli aminoacidi, gli acidi grassi e gli zuccheri come il glucosio
Modulo 16: La fosforilazione ossidativa
 1 Modulo 16: La fosforilazione ossidativa 2 E.Kennedy, A.Lehningher (1948): nelle cellule eucariotiche la fosforilazione avviene nei mitocondri. Questa scoperta rappresenta storicamente l inizio degli
1 Modulo 16: La fosforilazione ossidativa 2 E.Kennedy, A.Lehningher (1948): nelle cellule eucariotiche la fosforilazione avviene nei mitocondri. Questa scoperta rappresenta storicamente l inizio degli
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
I Lincei per una nuova didattica nella Scuola: una rete nazionale Polo di Brescia
 I Lincei per una nuova didattica nella Scuola: una rete nazionale Polo di Brescia Edizione 2016-2017 Metabolismo: equilibrio e omeostasi dei processi cellulari Lezione: Le principali vie metaboliche, il
I Lincei per una nuova didattica nella Scuola: una rete nazionale Polo di Brescia Edizione 2016-2017 Metabolismo: equilibrio e omeostasi dei processi cellulari Lezione: Le principali vie metaboliche, il
Modulo 14 Il ciclo di Krebs
 Modulo 14 Il ciclo di Krebs Il destino ossidativo del piruvato In condizioni aerobie il piruvato viene decarbossilato ad acetato. L acetato è ossidato ulteriormente nel ciclo dell acido citrico. Una serie
Modulo 14 Il ciclo di Krebs Il destino ossidativo del piruvato In condizioni aerobie il piruvato viene decarbossilato ad acetato. L acetato è ossidato ulteriormente nel ciclo dell acido citrico. Una serie
Capitolo 6 La respirazione cellulare
 Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
Seminario. Ciclo di Krebs 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A
 Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
Seminario PASSO PER PASSO 1. La citrato sintasi forma citrato a partire dall ossaloacetato e dall acetilcoenzima A Il ciclo dell acido citrico inizia con la reazione di condensazione di un unità con 4
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
ADP + HPO 3, NAD +, NADP +, FAD ATP, NADH, NADPH, FADH 2 ENERGIA CHIMICA
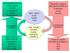 MACROMOLECOLE CELLULARI Proteine Polisaccaridi Lipidi Acidi nucleici ADP + HPO 3 2-, NAD +, NADP +, FAD Metaboliti complessi RICCHI DI ENERGIA Carboidrati Lipidi Proteine ANABOLISMO (biosintesi) MOLECOLE
MACROMOLECOLE CELLULARI Proteine Polisaccaridi Lipidi Acidi nucleici ADP + HPO 3 2-, NAD +, NADP +, FAD Metaboliti complessi RICCHI DI ENERGIA Carboidrati Lipidi Proteine ANABOLISMO (biosintesi) MOLECOLE
Il metabolismo microbico
 Corso di Microbiologia Generale. A.A. 2015-2016 Il metabolismo microbico Dott.ssa Annalisa Serio Il metabolismo Insieme di reazioni chimiche che avvengono all interno di un organismo vivente: Le reazioni
Corso di Microbiologia Generale. A.A. 2015-2016 Il metabolismo microbico Dott.ssa Annalisa Serio Il metabolismo Insieme di reazioni chimiche che avvengono all interno di un organismo vivente: Le reazioni
il valore 3 o 5 dipende dal meccanismo usato per trasportare gli elettroni del NADH dal citosol alla matrice mitocondriale
 = 976 kj/mole il valore 3 o 5 dipende dal meccanismo usato per trasportare gli elettroni del NADH dal citosol alla matrice mitocondriale Energia contenuta nel glucosio = 2840 kj/mole Recupero = 32 x 30,5
= 976 kj/mole il valore 3 o 5 dipende dal meccanismo usato per trasportare gli elettroni del NADH dal citosol alla matrice mitocondriale Energia contenuta nel glucosio = 2840 kj/mole Recupero = 32 x 30,5
Cap.21 CATABOLISMO DEI LIPIDI
 Cap.21 CATABOLISMO DEI LIPIDI Glucosio= forma di energia immediatamente disponibile LIPIDI= Deposito energetico utilizzabile da tutti i tessuti, tranne cervello e globuli rossi Rispetto ai carboidrati,
Cap.21 CATABOLISMO DEI LIPIDI Glucosio= forma di energia immediatamente disponibile LIPIDI= Deposito energetico utilizzabile da tutti i tessuti, tranne cervello e globuli rossi Rispetto ai carboidrati,
FOSFORILAZIONE OSSIDATIVA
 FOSFORILAZIONE OSSIDATIVA Lo scopo ultimo dei processi metabolici ossidativi è quello di canalizzare l energia contenuta nello scheletro carbonioso di zuccheri, ac. grassi e amminoacidi nella sintesi di
FOSFORILAZIONE OSSIDATIVA Lo scopo ultimo dei processi metabolici ossidativi è quello di canalizzare l energia contenuta nello scheletro carbonioso di zuccheri, ac. grassi e amminoacidi nella sintesi di
Energia e metabolismi energetici
 Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
MANTENIMENTO DELLA STRUTTURA CRESCITA SVILUPPO RIPRODUZIONE
 BIOENERGETICA MANTENIMENTO DELLA STRUTTURA CRESCITA SVILUPPO RIPRODUZIONE GLI ORGANISMI VIVENTI POSSONO UTILIZZARE SOLO DUE FORME DI ENERGIA: LUMINOSA (radiazioni di determinate lunghezze d onda) (ORGANISMI
BIOENERGETICA MANTENIMENTO DELLA STRUTTURA CRESCITA SVILUPPO RIPRODUZIONE GLI ORGANISMI VIVENTI POSSONO UTILIZZARE SOLO DUE FORME DI ENERGIA: LUMINOSA (radiazioni di determinate lunghezze d onda) (ORGANISMI
Capitolo B2 Il metabolismo energetico: dal glucosio all ATP
 Capitolo B2 Il metabolismo energetico: dal glucosio all ATP Quesiti e problemi 1 Le funzioni del metabolismo cellulare sono: ricavare energia utile per la cellula attraverso la degradazione di sostanze
Capitolo B2 Il metabolismo energetico: dal glucosio all ATP Quesiti e problemi 1 Le funzioni del metabolismo cellulare sono: ricavare energia utile per la cellula attraverso la degradazione di sostanze
Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA
 Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O Processi molecolari in cui è coinvolto il consumo
Via finale comune per l ossidazione di tutti i combustibili metabolici che entrano nella via come molecola di acetil CoA C 6 H 12 O 6 + 6O 2 6CO 2 + 6H 2 O Processi molecolari in cui è coinvolto il consumo
1. Quale dei seguenti componenti della catena mitocondriale di trasporto degli elettroni non è parte di un complesso lipoproteico di membrana?
 1. Quale dei seguenti componenti della catena mitocondriale di trasporto degli elettroni non è parte di un complesso lipoproteico di membrana? a) ubichinone e citrocromo c b) citocromo a e a3 c) citocromo
1. Quale dei seguenti componenti della catena mitocondriale di trasporto degli elettroni non è parte di un complesso lipoproteico di membrana? a) ubichinone e citrocromo c b) citocromo a e a3 c) citocromo
La materia vivente è costituita da molecole, che costruiscono strutture ordinate partendo da materiali disordinati, tramite una spesa energetica
 LA LOGICA DELLA VITA La materia vivente è costituita da molecole, che costruiscono strutture ordinate partendo da materiali disordinati, tramite una spesa energetica G = H - T S Le reazioni dei processi
LA LOGICA DELLA VITA La materia vivente è costituita da molecole, che costruiscono strutture ordinate partendo da materiali disordinati, tramite una spesa energetica G = H - T S Le reazioni dei processi
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
Lezione 7. Il metabolismo terminale e la produzione di ATP
 Lezione 7 Il metabolismo terminale e la produzione di ATP 1 Il metabolismo terminale Catabolismo Lipidi Amminoacidi Carboidrati convergono sul metabolismo terminale, e producono una stessa molecola: l
Lezione 7 Il metabolismo terminale e la produzione di ATP 1 Il metabolismo terminale Catabolismo Lipidi Amminoacidi Carboidrati convergono sul metabolismo terminale, e producono una stessa molecola: l
Catena Respiratoria e Fosforilazione Ossidativa. glucosio. piruvato H + Ac-CoA O 2. e - NADH. ADP P i H 2 O H + H + ATP NADH
 Catena Respiratoria e Fosforilazione Ossidativa glucosio piruvato H + H + Ac-CoA O 2 H 2 O H + e - NADH ATP ADP P i NADH Catena di Trasporto degli Elettroni glicolisi / ciclo di Krebs / -ox acidi grassi:
Catena Respiratoria e Fosforilazione Ossidativa glucosio piruvato H + H + Ac-CoA O 2 H 2 O H + e - NADH ATP ADP P i NADH Catena di Trasporto degli Elettroni glicolisi / ciclo di Krebs / -ox acidi grassi:
Energia e metabolismo.
 a.a. 2016-2017 CORSO DI LAUREA IN INFERMIERISTICA Dott.ssa Marilena Greco Biologia applicata Energia e metabolismo. Energia solare O2 CO2 Autotrofi ATP GLUCOSIO Fotosintesi calore calore Respirazione CO2
a.a. 2016-2017 CORSO DI LAUREA IN INFERMIERISTICA Dott.ssa Marilena Greco Biologia applicata Energia e metabolismo. Energia solare O2 CO2 Autotrofi ATP GLUCOSIO Fotosintesi calore calore Respirazione CO2
Catabolismo degli acidi grassi e chetogenesi
 Catabolismo degli acidi grassi e chetogenesi Metabolismo dei lipidi Adipociti del grasso bianco Tappa di preparazione all ossidazione degli acidi grassi La membrana mitocondriale interna è impermeabile
Catabolismo degli acidi grassi e chetogenesi Metabolismo dei lipidi Adipociti del grasso bianco Tappa di preparazione all ossidazione degli acidi grassi La membrana mitocondriale interna è impermeabile
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
I processi mediante i quali le molecole biologiche vengono scisse e risintetizzate costituiscono una rete di reazioni enzimatiche, complessa e
 I processi mediante i quali le molecole biologiche vengono scisse e risintetizzate costituiscono una rete di reazioni enzimatiche, complessa e finemente regolata, detta metabolismo dell organismo. Questa
I processi mediante i quali le molecole biologiche vengono scisse e risintetizzate costituiscono una rete di reazioni enzimatiche, complessa e finemente regolata, detta metabolismo dell organismo. Questa
CICLO DI KREBS (o DELL ACIDO CITRICO)
 CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
I processi metabolici cellulari
 I processi metabolici cellulari 1 Metabolismo E l insieme delle reazioni chimiche che avvengono in una cellula o, più in generale, in qualsiasi organismo. Le sostanze coinvolte in tali reazioni sono dette
I processi metabolici cellulari 1 Metabolismo E l insieme delle reazioni chimiche che avvengono in una cellula o, più in generale, in qualsiasi organismo. Le sostanze coinvolte in tali reazioni sono dette
6 H 2. con G=-686 kcal/mole di H 12 O 6 O + 6 CO O 2. glucosio La respirazione avviene in tre stadi principali; ognuno di questi
 La respirazione La respirazione è un processo di ossidoriduzione nel quale i riducenti sono molecole organiche altamente ridotte e ricche di energia e gli ossidanti sono molecole inorganiche come O 2 Il
La respirazione La respirazione è un processo di ossidoriduzione nel quale i riducenti sono molecole organiche altamente ridotte e ricche di energia e gli ossidanti sono molecole inorganiche come O 2 Il
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
Lezione 7. Il metabolismo terminale e la produzione di ATP
 Lezione 7 Il metabolismo terminale e la produzione di ATP 1 Il metabolismo terminale Catabolismo Lipidi Amminoacidi Carboidrati convergono sul metabolismo terminale, e producono una stessa molecola: l
Lezione 7 Il metabolismo terminale e la produzione di ATP 1 Il metabolismo terminale Catabolismo Lipidi Amminoacidi Carboidrati convergono sul metabolismo terminale, e producono una stessa molecola: l
Mitocondri. -sono visibili al MO (Ø 0,5 µ e lunghezza da 1 a 6 µ) -assenti nei batteri e presenti in tutte le cellule eucariotiche
 Mitocondri sono organelli deputati alla produzione dell energia, capaci di ossidare i prodotti dell assorbimento intestinale degradandoli e di convertire l energia liberata in ATP processo chiamato respirazione
Mitocondri sono organelli deputati alla produzione dell energia, capaci di ossidare i prodotti dell assorbimento intestinale degradandoli e di convertire l energia liberata in ATP processo chiamato respirazione
RESPIRAZIONE CELLULARE (METABOLISMO DEL GLUCOSIO)
 RESPIRAZIONE CELLULARE (METABOLISMO DEL GLUCOSIO) LA GLICOLISI: dopo il ciclo di Calvin, che avviene nelle cellule autotrofe delle piante, il glucosio prodotto va a demolirsi per produrre energia nelle
RESPIRAZIONE CELLULARE (METABOLISMO DEL GLUCOSIO) LA GLICOLISI: dopo il ciclo di Calvin, che avviene nelle cellule autotrofe delle piante, il glucosio prodotto va a demolirsi per produrre energia nelle
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia.
 La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
Ossidazione dell α-chetoglutarato: questa reazione porta alla formazione di un legame TIOESTERE ad alta energia e alla produzione di NADH
 Ossidazione dell α-chetoglutarato: questa reazione porta alla formazione di un legame TIOESTERE ad alta energia e alla produzione di NADH TPP Lipoammide FAD α-chetoglutarato Complesso dell αchetoglutarato
Ossidazione dell α-chetoglutarato: questa reazione porta alla formazione di un legame TIOESTERE ad alta energia e alla produzione di NADH TPP Lipoammide FAD α-chetoglutarato Complesso dell αchetoglutarato
Regolazione del Ciclo di Krebs 8 reazioni
 Regolazione del Ciclo di Krebs 8 reazioni Stechiometria del Ciclo Acetil-CoA + 3NAD + + FAD + GDP + Pi + 2H 2 O 2 CO 2 + HS-CoA + 3NADH + 2H + + FADH2 + GTP (GTP ATP) 1 NADH 2,5 ATP 1 FADH 2 1,5 ATP Per
Regolazione del Ciclo di Krebs 8 reazioni Stechiometria del Ciclo Acetil-CoA + 3NAD + + FAD + GDP + Pi + 2H 2 O 2 CO 2 + HS-CoA + 3NADH + 2H + + FADH2 + GTP (GTP ATP) 1 NADH 2,5 ATP 1 FADH 2 1,5 ATP Per
Aerobiosi C A T A B O L I S M O. Lez 4A. Schema generale del metabolismo dei glucidi
 Schema generale del metabolismo dei glucidi -1- Aerobiosi In condizioni aerobiche il piruvato prodotto dalla glicolisi e dalla degradazione di alcuni aminoacidi è ossidato a H 2 O e CO 2 nella respirazione
Schema generale del metabolismo dei glucidi -1- Aerobiosi In condizioni aerobiche il piruvato prodotto dalla glicolisi e dalla degradazione di alcuni aminoacidi è ossidato a H 2 O e CO 2 nella respirazione
scaricato da
 ACIL CoA DEIDROGENASI La membrana mitocondriale non è permeabile al NADH citosolico. Speciali sistemi navetta (shuttle) trasportano gli equivalenti riducenti dal NADH citosolico all interno dei mitocondri
ACIL CoA DEIDROGENASI La membrana mitocondriale non è permeabile al NADH citosolico. Speciali sistemi navetta (shuttle) trasportano gli equivalenti riducenti dal NADH citosolico all interno dei mitocondri
COMBUSTIONE = OSSIDAZIONE SOSTANZA ORGANICA. Legno + O2 -> CO2 + H2O + calore
 Respirazione COMBUSTIONE = OSSIDAZIONE SOSTANZA ORGANICA Legno + O2 -> CO2 + H2O + calore O2 ---> CO2 + H2O + calore Cumultive C-CO 2 (% of initial C) Weight remaining (%) Decomposition as mass loss 100
Respirazione COMBUSTIONE = OSSIDAZIONE SOSTANZA ORGANICA Legno + O2 -> CO2 + H2O + calore O2 ---> CO2 + H2O + calore Cumultive C-CO 2 (% of initial C) Weight remaining (%) Decomposition as mass loss 100
CICLO DI KREBS (o DELL ACIDO CITRICO)
 CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA
 Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
Cap.15 BIOENERGETICA IL METABOLISMO RISULTA DALL INSIEME DELLE REAZIONI CHIMICHE CHE PERMETTONO AI SISTEMI VIVENTI DI UTILIZZARE ENERGIA E MATERIA I Legge della Termodinamica: Il contenuto energetico dell
MODULO 6 FOSFORILAZIONE OSSIDATIVA REAZIONI DI OSSIDORIDUZIONE
 MODULO 6 FOSFORILAZIONE OSSIDATIVA REAZIONI DI OSSIDORIDUZIONE Introduzione I sistemi viventi possono essere distinti, in base al consumo d ossigeno, in organismi aerobi ed organismi anaerobi. I primi
MODULO 6 FOSFORILAZIONE OSSIDATIVA REAZIONI DI OSSIDORIDUZIONE Introduzione I sistemi viventi possono essere distinti, in base al consumo d ossigeno, in organismi aerobi ed organismi anaerobi. I primi
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Corso di Laurea in Scienze Biologiche. Insegnamento di. Anno Accademico
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in Scienze Biologiche Insegnamento di CHIMICA BIOLOGICA Prof. Antimo Di Maro Anno Accademico 2016-17 Lezione 14 Ciclo di Krebs L ossidazione
Il metabolismo cellulare
 Il metabolismo cellulare L obesità è problema sanitario e sociale Tessuto adiposo bianco e bruno È tutta una questione di energia: Se si assumono più molecole energetiche di quelle che ci servono per costruire
Il metabolismo cellulare L obesità è problema sanitario e sociale Tessuto adiposo bianco e bruno È tutta una questione di energia: Se si assumono più molecole energetiche di quelle che ci servono per costruire
2 INCONTRO: LA PRODUZIONE DI ENERGIA NELLA CELLULA
 INCONTRO: LA PRODUZIONE DI ENERGIA NELLA CELLULA 1 INTRODUZIONE 1 L energia chimica Esistono diversi tipi di energia e una tra queste è l energia chimica: un tipo di energia che possiedono tutte le molecole
INCONTRO: LA PRODUZIONE DI ENERGIA NELLA CELLULA 1 INTRODUZIONE 1 L energia chimica Esistono diversi tipi di energia e una tra queste è l energia chimica: un tipo di energia che possiedono tutte le molecole
La respirazione cellulare
 La respirazione cellulare Lo zucchero ("alimento") prodotto nella fase oscura della fotosintesi viene ossidato nel mitocondrio e qui si libera energia metabolica sotto forma di ATP. ANABOLISMO e CATABOLISMO
La respirazione cellulare Lo zucchero ("alimento") prodotto nella fase oscura della fotosintesi viene ossidato nel mitocondrio e qui si libera energia metabolica sotto forma di ATP. ANABOLISMO e CATABOLISMO
CATENA DI TRASPORTO DEGLI ELETTRONI
 2 Parte, Mitocondri CATENA DI TRASPORTO DEGLI ELETTRONI http://www.personal.kent.edu/~cearley/pchem/krebs/etc.png http://lh3.ggpht.com/ TXGk 7CtnfE/Us6AfOto9fI/AAAAAAAAA38/TCEjo91 _B8/citric_acid_cycle%25255B12%25255D.jpg?imgmax=800
2 Parte, Mitocondri CATENA DI TRASPORTO DEGLI ELETTRONI http://www.personal.kent.edu/~cearley/pchem/krebs/etc.png http://lh3.ggpht.com/ TXGk 7CtnfE/Us6AfOto9fI/AAAAAAAAA38/TCEjo91 _B8/citric_acid_cycle%25255B12%25255D.jpg?imgmax=800
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
REGOLAZIONE DEL CICLO TCA
 REGOLAZIONE DEL CICLO TCA Respirazione cellulare Fase 1 1) Catabolismo di acidi grassi 2) Glucosio 3) Amminoacidi Acetil-CoA Fase2 Ciclo dell acido citrico: ossidazione dell acetil CoA con produzione di
REGOLAZIONE DEL CICLO TCA Respirazione cellulare Fase 1 1) Catabolismo di acidi grassi 2) Glucosio 3) Amminoacidi Acetil-CoA Fase2 Ciclo dell acido citrico: ossidazione dell acetil CoA con produzione di
Digestione e assorbimento dei lipidi. β-ossidazione degli acidi grassi
 Digestione e assorbimento dei lipidi β-ossidazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500
Digestione e assorbimento dei lipidi β-ossidazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500
GLUCOSIO. Vena porta DIGESTIONE DEI DISACCARIDI. Enzimi parete intestinale
 DIGESTIONE DELL AMIDO AMIDO Amilasi salivare DESTRINE Amilasi pancreatica MALTOSIO Enzimi parete intestinale GLUCOSIO Vena porta DIGESTIONE DEI DISACCARIDI DISACCARIDI Enzimi parete intestinale MONOSACCARIDI
DIGESTIONE DELL AMIDO AMIDO Amilasi salivare DESTRINE Amilasi pancreatica MALTOSIO Enzimi parete intestinale GLUCOSIO Vena porta DIGESTIONE DEI DISACCARIDI DISACCARIDI Enzimi parete intestinale MONOSACCARIDI
Fonte diretta di Energia è l ATP.
 Una cellula compie tre tipi di lavoro: -Lavoro meccanico: movimenti muscolari.. -Lavoro di trasporto: trasporto contro gradiente -Lavoro chimico: assemblaggio di polimeri da monomeri Fonte diretta di Energia
Una cellula compie tre tipi di lavoro: -Lavoro meccanico: movimenti muscolari.. -Lavoro di trasporto: trasporto contro gradiente -Lavoro chimico: assemblaggio di polimeri da monomeri Fonte diretta di Energia
Catabolismo = degradazione di composti per recuperare i loro componenti e/o produrre energia
 Il METABOLISMO comprende la totalità dei processi attraverso i quali gli esseri viventi ricavano e utilizzano energia secondo i limiti imposti dalle leggi della termodinamica : Catabolismo = degradazione
Il METABOLISMO comprende la totalità dei processi attraverso i quali gli esseri viventi ricavano e utilizzano energia secondo i limiti imposti dalle leggi della termodinamica : Catabolismo = degradazione
IL METABOLISMO ENERGETICO BIOCHIMICA. GLICOLISI, FERMENTAZIONE E RESPIRAZIONE CELLULARE GSCATULLO
 IL METABOLISMO ENERGETICO BIOCHIMICA. GLICOLISI, FERMENTAZIONE E RESPIRAZIONE CELLULARE GSCATULLO ( Introduzione Metabolismo energetico Funzione Il metabolismo energetico è un attività coordinata cui partecipano
IL METABOLISMO ENERGETICO BIOCHIMICA. GLICOLISI, FERMENTAZIONE E RESPIRAZIONE CELLULARE GSCATULLO ( Introduzione Metabolismo energetico Funzione Il metabolismo energetico è un attività coordinata cui partecipano
Respirazione cellulare
 Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Trasporto degli elettroni e fosforilazione ossidativa
 Trasporto degli elettroni e fosforilazione ossidativa La fosforilazione ossidativa rappresenta il culmine del metabolismo energetico negli organismi aerobici Tutte le tappe enzimatiche della degradazione
Trasporto degli elettroni e fosforilazione ossidativa La fosforilazione ossidativa rappresenta il culmine del metabolismo energetico negli organismi aerobici Tutte le tappe enzimatiche della degradazione
Catabolismo = degradazione di composti per recuperare i loro. Anabolismo = Le vie anaboliche e cataboliche sono in relazione fra loro
 Il METABOLISMO comprende la totalità dei processi attraverso i quali gli esseri viventi ricavano e utilizzano energia secondo i limiti imposti dalle leggi della termodinamica : Catabolismo = degradazione
Il METABOLISMO comprende la totalità dei processi attraverso i quali gli esseri viventi ricavano e utilizzano energia secondo i limiti imposti dalle leggi della termodinamica : Catabolismo = degradazione
BIOCHIMICA e BIOTECNOLOGIE degli ALIMENTI
 Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
Seconda Università degli Studi di Napoli DiSTABiF Anno Accademico 2016-17 Corso di Laurea Magistrale in SCIENZE DEGLI ALIMENTI E DELLA NUTRIZIONE UMANA Insegnamento di BIOCHIMICA e BIOTECNOLOGIE degli
IL METABOLISMO. Dal carbonio agli OGM Capitolo 2
 IL METABOLISMO Dal carbonio agli OGM Capitolo 2 IL METABOLISMO L'insieme delle trasformazioni chimiche ed energetiche che si verificano nelle cellule di un organismo vivente e ne garantiscono la conservazione,
IL METABOLISMO Dal carbonio agli OGM Capitolo 2 IL METABOLISMO L'insieme delle trasformazioni chimiche ed energetiche che si verificano nelle cellule di un organismo vivente e ne garantiscono la conservazione,
Gluconeogenesi. Sintesi de-novo di glucosio
 Gluconeogenesi Sintesi de-novo di glucosio La gluconeogenesi garantisce il mantenimento dei livelli di glucosio nel sangue anche per molto tempo dopo l assorbimento e la completa ossidazione del glucosio
Gluconeogenesi Sintesi de-novo di glucosio La gluconeogenesi garantisce il mantenimento dei livelli di glucosio nel sangue anche per molto tempo dopo l assorbimento e la completa ossidazione del glucosio
Utilizzo del glucosio: la glicolisi
 Utilizzo del glucosio: la glicolisi GLUCOSIO Sistema rapido, reversibile, GLICOLISI avviene anche in assenza di ossigeno. Produce poca energia OSSIDAZIONE PIRUVATO Fermentazione LATTATO ACETATO CICLO DI
Utilizzo del glucosio: la glicolisi GLUCOSIO Sistema rapido, reversibile, GLICOLISI avviene anche in assenza di ossigeno. Produce poca energia OSSIDAZIONE PIRUVATO Fermentazione LATTATO ACETATO CICLO DI
4. MED Nella respirazione aerobica si ha ossidazione delle molecole di: A) glucosio B) ossigeno C) biossido di carbonio D) acqua E) NAD +
 1. MED 1997 - La tappa di passaggio dalla glicolisi al ciclo di Krebs e' la trasformazione: A) del glucosio in piruvato B) del piruvato in glucosio C) del piruvato in acetil-coa D) del glucosio in acetil-coa
1. MED 1997 - La tappa di passaggio dalla glicolisi al ciclo di Krebs e' la trasformazione: A) del glucosio in piruvato B) del piruvato in glucosio C) del piruvato in acetil-coa D) del glucosio in acetil-coa
2 a reazione della glicolisi: isomerizzazione del glucosio 6-fosfato in fruttosio 6-fosfato
 2 a reazione della glicolisi: isomerizzazione del glucosio 6-fosfato in fruttosio 6-fosfato Glucosio 6-fosfato isomerasi Glucosio 6-fosfato anomero α Fruttosio 6-fosfato anomero α Glucosio 6-fosfato Fruttosio
2 a reazione della glicolisi: isomerizzazione del glucosio 6-fosfato in fruttosio 6-fosfato Glucosio 6-fosfato isomerasi Glucosio 6-fosfato anomero α Fruttosio 6-fosfato anomero α Glucosio 6-fosfato Fruttosio
Prima di essere ossidati. gli ACIDI GRASSI devono essere attivati. (cioè legati al CoA) e poi entrare nel mitocondrio
 Prima di essere ossidati gli ACIDI GRASSI devono essere attivati (cioè legati al CoA) e poi entrare nel mitocondrio L enzima acil CoA sintetasi (= acido grasso tiokinasi) sta sulla membrana mitocondriale
Prima di essere ossidati gli ACIDI GRASSI devono essere attivati (cioè legati al CoA) e poi entrare nel mitocondrio L enzima acil CoA sintetasi (= acido grasso tiokinasi) sta sulla membrana mitocondriale
Metabolismo: Introduzione
 Metabolismo: Introduzione METABOLISMO Insieme delle reazioni chimiche coordinate e integrate che hanno luogo in tutte le cellule C A T A B O L I S M O Ossidazioni esoergoniche Alimenti: Carboidrati Lipidi
Metabolismo: Introduzione METABOLISMO Insieme delle reazioni chimiche coordinate e integrate che hanno luogo in tutte le cellule C A T A B O L I S M O Ossidazioni esoergoniche Alimenti: Carboidrati Lipidi
