Monolisa HCV Ag-Ab ULTRA V2
|
|
|
- Lorenzo Moro
- 7 anni fa
- Visualizzazioni
Transcript
1 Monolisa HCV Ag-Ab ULTRA V2 1 piastra piastre KIT DI SCREENING COMBINATO PER ANTICORPI ANTI-HCV E ANTIGENE VIRALE DEL VIRUS DELL'EPATITE C IN SIERO O PLASMA UMANO UTILIZZANDO UNA TECNICA DI IMMUNODOSAGGIO ENZIMATICO /09 1 [IT]
2 INDICE 1. USO PREVISTO RIEPILOGO E ILLUSTRAZIONE DEL TEST PRINCIPI DELLA PROCEDURA REAGENTI AVVERTIMENTI E PRECAUZIONI CAMPIONI PROCEDURA LIMITAZIONE DEL TEST CARATTERISTICHE DELLE PRESTAZIONI RIFERIMENTI BIBLIOGRAFICI [IT]
3 1. USO PREVISTO Monolisa HCV Ag-Ab ULTRA V2 è un immunodosaggio enzimatico qualitativo per la determinazione dell'infezione da virus dell'epatite C (HCV) basato sulla rilevazione di anticorpi anti-hcv e antigene del capside nel siero o nel plasma umano. Il test di screening dell'epatite C può essere impiegato da laboratori diagnostici e banche del sangue. 2. RIEPILOGO E ILLUSTRAZIONE DEL TEST Il virus dell'epatite C (HCV) è un virus a senso positivo con involucro dell'rna (9,5 kb) appartenente alla famiglia delle Flaviviridae, di cui sono stati identificati i sei principali genotipi. L'HCV è riconosciuto come causa principale dell'epatite virale non A e non B. L'infezione da HCV è caratterizzata da forma acuta e cronica che può condurre a cirrosi e carcinoma epatocellulare. Le evidenze sierologiche dell'infezione da HCV sono ottenibili tramite esami del sangue per eseguire lo screening di antigeni dell'hcv e/o anticorpi e/o RNA. Rispetto al test per lo screening dei soli anticorpi anti- HCV, l'impiego del test per lo screening combinato di anticorpi anti-hcv e antigene del capside dell'hcv può ridurre il periodo della finestra sierologica e migliorare la determinazione dell'infezione. 3. PRINCIPI DELLA PROCEDURA Monolisa HCV Ag-Ab ULTRA V2 si basa sull'impiego di una fase solida preparata con antigeni purificati: due proteine ricombinanti della regione non strutturale (NS3 e NS4) e un peptide della regione strutturale (capside) del virus dell'epatite C, e un anticorpo monoclonale contro il capside dell'epatite C. La fase liquida comprende due coniugati. Il primo coniugato (R6) consiste in un anticorpo monoclonale biotinilato di topo contro il capside dell'epatite C. Tale anticorpo monoclonale non reagisce con il peptide del capside impiegato nella fase solida. Il secondo coniugato (R7) è una miscela di anticorpi IgG anti-umani marcati con perossidasi di topo e streptavidina marcata con perossidasi. La procedura di dosaggio comprende le seguenti fasi della reazione: 1) Il coniugato 1, i campioni da testare e i sieri di controllo sono distribuiti nei pozzetti della micropiastra. Gli eventuali anticorpi per HVC saranno legati agli antigeni fissati nella fase solida. In presenza di antigene del capside dell'epatite C, tale antigene sarà legato dagli anticorpi monoclonali rivestiti nella fase solida e dagli anticorpi monoclonali biotinilati contro l'antigene del capside dell'epatite C (coniugato 1). 2) Dopo l'incubazione a 37 C per 90 minuti e la fase di lavaggio, si aggiungono il coniugato 2 contenente anticorpi IgG anti-umani marcati con perossidasi e la streptavidina marcata con perossidasi a ogni pozzetto della micropiastra. In presenza di IgG umana che abbia reagito con la fase solida, il coniugato IgG anti-umano si lega con gli anticorpi umani Il coniugato di perossidasi/streptavidina si lega alla biotina del coniugato 1, se nel campione è presente un antigene del capside dell'hcv. 3) Dopo 30 minuti di incubazione a 37 C, viene rimosso il coniugato enzimatico non legato tramite la fase di lavaggio e la presenza dei complessi di perossidasi dell'anticorpo dell'antigene viene individuata con l'aggiunta del substrato. 4) Dopo 30 minuti di incubazione a temperatura di laboratorio (18-30 C), all'interruzione della reazione, si rileva la lettura dello spettrometro a 450/ nm. L'assorbanza misurata per un campione consente di rilevare la presenza o l'assenza di anticorpi HCV e/o di antigeni del capside dell'epatite C nel campione. L'intensità cromatica è proporzionata alla quantità di anticorpi HCV e/o antigene del capside dell'epatite C nella fase solida. 3 [IT]
4 4. REAGENTI 4.1. Descrizione Identificazione sull'etichetta Descrizione Presentazione Preparazione Presentazione Preparazione R1 Microplate Micropiastra 12 strip da 8 pozzetti ciascuna, rivestite da anticorpo monoclonale anti-capside del VHC, antigeni purificati ricombinanti dell'epatite C (NS3, NS4) e un peptide del capside dell'hcv. Numero ID specifico = 93 1 piastra 5 piastre R2 Concentrated washing solution (20X) Soluzione di lavaggio concentrata (20x) Tampone Tris NaCl ph 7,4 Conservante: ProClin 300 (0,04%) 70 ml Da diluire 235 ml Da diluire R3 Negative control Controllo negativo Tampone Tris HCI, contenente BSA (Siero di albumina bovina); Conservante: ProClin 300 (0,1%) 1 ml 1 ml R4 Positive control Controllo positivo Siero umano contenente anticorpi dell'hcv, negativo all'antigene dell'hb e per anticorpi anti HIV-1 e anti HIV-2 diluiti in un tampone Tris HCI contenente BSA, e attivato fotochimicamente. Conservante: ProClin 300 (0,1%) 1,5 ml 3 ml R5a Antigen positive control Controllo positivo antigene Controllo positivo antigene sintetico contenente un peptide del capside liofilizzato. q.s. ad 1 ml Da ricostituire q.s. ad 1 ml Da ricostituire R5b Antigen diluent Diluente di R5a Acqua distillata contenente conservante: ProClin 300 (0,5 %) 1 ml Da ricostituire 1 ml Da ricostituire R6 Conjugate 1 Coniugato 1 Anticorpi monoclonali biotinilati di topo contro antigene del capside dell'hcv. Colore porpora Conservante: Azoturo di sodio (< 0,1%), Cosmocil CQ (0,025%) 15 ml 2 fiale 2 x 30 ml R7 Conjugate 2 Coniugato 2 Anticorpi di topo diretti contro IgG umana/perossidasi e streptavidina/perossidasi. Colore verde. Conservante: ProClin 300 (0,5 %) 15 ml 2 fiale 2 x 30 ml R8 Substrate buffer Substrato Soluzione di acido citrico e acetato di sodio, ph 4,0, contenente H 2 O 2 (0,015%) e dimetilsolfossido (DMSO) 4% 60 ml Da ricostituire 2 fiale 2 x 60 ml Da ricostituire 4 [IT]
5 R9 Chromogen: TMB solution (11X) Cromogeno: Soluzione TMB Soluzione contenente 3,3, 5,5 tetrametilbenzidina (TMB) 5 ml Da diluire 2 fiale 2 x 5 ml Da diluire R10 Stopping solution Soluzione bloccante Soluzione di acido solforico (H 2 SO 4 1N) 28 ml 3 fiale 3 x 28 ml 4.2. Condizioni di conservazione e manipolazione Conservare il kit a +2-8 C. Ogni articolo del kit conservato a +2-8 C può essere utilizzato fino dalla data di scadenza riportata sulla confezione (fatto salvo laddove diversamente indicato). Dopo l'apertura e in assenza di contaminazione, i reagenti R2, R3, R4, R6, R7, R8, R9 e R10 conservati a 2-8 C possono essere utilizzati fino alla data di scadenza riportata sulla confezione. Identificazione R1 R2 R5a + R5b R8 + R9 Conservazione Dopo l'apertura del sacchetto sotto-vuoto, le strip del micropozzetto conservate a +2-8 C possono essere utilizzate per 1 mese nella confezione originale accuratamente risigillata con del nastro adesivo. La soluzione di lavaggio distillata può essere conservata a C per 2 settimane. La soluzione di lavaggio concentrata (R2) può essere conservata a C. Dopo la ricostituzione, la soluzione di lavoro di controllo positivo antigene (R5) può essere conservata per 1 mese a +2-8 C e 2 mesi a -20 C (fino a 5 cicli di congelamento/scongelamento dopo il congelamento a -20 C). Dopo la ricostituzione, i reagenti conservati al buio possono essere utilizzati per 6 ore a temperatura ambiente (18-30 C). 5. AVVERTIMENTI E PRECAUZIONI Per diagnostico in vitro da parte di un operatore sanitario Precauzioni per la salute e la sicurezza Questo kit di test deve essere maneggiato esclusivamente da personale adeguatamente addestrato e qualificato nelle procedure di laboratorio e cosciente dei potenziali rischi connessi. Indossare abbigliamento protettivo, guanti, protezioni per occhi/viso adeguati e manipolare gli oggetti in maniera appropriata nel rispetto della buona pratica di laboratorio. Il kit contiene componenti ematici umani. Il materiale di origine umana nella preparazione di reagente R4 (controllo positivo) è stato testato e risultato non reattivo all'antigene di superficie dell'epatite B (HBs Ag) e agli anticorpi dei virus dell'immunodeficienza umana (HIV-1 e HIV-2 Ab) e positivo agli anticorpi anti-hcv. Il controllo positivo R4 è inattivato tramite riscaldamento. Nessun metodo di test conosciuto è in grado di garantire con assoluta certezza l'assenza di agenti infettivi. Tutti gli emoderivati umani, i reagenti e i campioni umani, pertanto, devono essere manipolati con la consapevolezza che si tratta di sostanze in grado di trasmettere malattie infettive ed è necessario seguire le precauzioni generali per gli agenti patogeni ematici raccomandate nel rispetto di tutte le normative locali, regionali e nazionali. Versamenti biologici: I versamenti di materiale di origine umana devono essere trattati come sostanze potenzialmente infettive. I versamenti non contenenti sostanze acide devono essere immediatamente decontaminati e asciugati. A questo scopo, disinfettare l'area in cui è avvenuto il versamento, i materiali ed eventuali superfici o apparecchiature contaminate utilizzando un disinfettante chimico appropriato efficace per i materiali a potenziale rischio biologico relativi ai campioni coinvolti (generalmente, una diluizione 1:10 di candeggina per uso domestico, 70-80% di etanolo o isopropanolo, uno iodoforo allo 0,5% quale Wescodyne Plus, ecc.). I versamenti contenenti sostanze acide devono essere adeguatamente assorbiti (asciugati con un panno) o neutralizzati, l'area deve essere lavata con acqua e asciugata; il materiale utilizzato per 5 [IT]
6 assorbire il versamento può richiedere lo smaltimento come rifiuto a rischio biologico. L'area deve essere quindi decontaminata con un disinfettante chimico. NOTA: Non collocare le soluzioni contenenti candeggina in autoclave. Procedere allo smaltimento di tutti i campioni e i materiali utilizzati per l'esecuzione del test come potenzialmente infetti. I rifiuti di laboratorio, chimici o a rischio biologico devono essere manipolati e smaltiti nel rispetto di tutte le normative locali, regionali e nazionali. Per le raccomandazioni su precauzioni e rischi correlati ad alcuni componenti chimici del presente kit, consultare i simboli riportati sulle etichette e le informazioni fornite alla fine delle istruzioni per. La scheda di sicurezza è disponibile all'indirizzo Precauzioni relative al protocollo Preparazione L'affidabilità dei risultati dipende dalla corretta implementazione delle seguenti pratiche di laboratorio corrette. Non utilizzare reagenti scaduti. Non mescolare, né unire reagenti appartenenti a numeri di lotto differenti all'interno di un unico ciclo. Prima del attendere 30 minuti che i reagenti si stabilizzino a temperatura ambiente (18-30 C). La denominazione del test e il numero di identificazione specifico del test stesso sono riportati sul telaio di ogni micropiastra. Questo numero di identificazione specifico è indicato anche su ogni strip. Monolisa HCV Ag-Ab ULTRA V2: Numero ID specifico = 93 Verificare il numero di identificazione specifico prima del. Qualora il numero di identificazione risulti mancante o diverso dal numero indicato corrispondente al dosaggio da testare, la strip non dovrà essere utilizzata. NOTA: Per la soluzione di lavaggio (R2, identificazione etichetta: colore verde 20X), tampone di substrato di perossidasi (R8, identificazione etichetta: tampone TMB, colore blu), cromogeno (R9, identificazione etichetta: TMB 11X, color porpora) e soluzione bloccante (R10, identificazione etichetta: 1N colore rosso), è possibile utilizzare lotti diversi da quelli contenuti nel kit, fermo restando che venga utilizzato lo stesso lotto all'interno di un determinato ciclo di test. Tali reagenti possono essere utilizzati con altre procedure della nostra azienda. Contattare l'assistenza tecnica per informazioni dettagliate. Ricostituire con cura i reagenti evitando eventuali contaminazioni. Utilizzare preferibilmente materiale monouso oppure vetreria perfettamente lavata e asciugata con acqua deionizzata. Non far asciugare la micropiastra nell'intervallo compreso fra la fine dell'operazione di lavaggio e la distribuzione del reagente. La reazione enzimatica è particolarmente sensibile agli ioni metallici. Di conseguenza, evitare che eventuali elementi di metallo entrino a contatto con le varie soluzioni contenenti coniugato o substrato. La soluzione di sviluppo (tampone substrato + cromogeno) deve essere di colore rosa. La variazione del colore rosa entro pochi minuti dalla ricostituzione indica che il reagente non può essere utilizzato e deve essere sostituito. La soluzione di sviluppo può essere preparata in un contenitore di vetro o in un vassoio di plastica monouso pre-lavato con 1N HCl, risciacquato accuratamente con acqua distillata e asciugato. Il reagente deve essere conservato al buio. Non utilizzare mai lo stesso contenitore per distribuire il coniugato e la soluzione di sviluppo Elaborazione Non modificare la procedura di dosaggio. Non eseguire il test in presenza di vapori reattivi (vapori acidi, alcalini e di aldeide) o polvere potenzialmente in grado di alterare l'attività enzimatica del coniugato. Utilizzare una nuova distribuzione per ciascun campione. Il lavaggio del pozzetto è una fase essenziale della procedura: attenersi al numero di cicli di lavaggio raccomandato e assicurarsi che tutti i pozzetti, una volta riempiti, vengano completamente svuotati. Un lavaggio inadeguato può condurre a risultati inesatti. Seguire attentamente le procedure di lavaggio descritte per ottimizzare le prestazioni del test. Con alcuni strumenti, potrebbe essere necessario ottimizzare la procedura di lavaggio (aumento del 6 [IT]
7 numero di cicli della fase di lavaggio e/o del volume di tamponi di lavaggio per ogni ciclo) per ottenere un livello accettabile di sfondo OD per il campione negativo. Per gli adattamenti e le procedure speciali contattare l'azienda. 6. CAMPIONI Prelevare un campione di sangue secondo le pratiche correnti. Il test dovrà essere eseguito su plasma o siero non diluito (prelevato da EDTA, citrato di sodio o ACD). Si sconsiglia di utilizzare un campione prelevato dalle provette contenenti eparinato di litio. È stato riscontrato un segnale inferiore sui campioni risultati positivi al test per l'antigene HCV. I campioni contenenti aggregati devono essere chiarificati tramite centrifugazione prima del test. Aggregati o particelle di fibrina sospese possono produrre falsi positivi. Il campione sarà conservato a +2-8 C se il test viene eseguito entro 7 giorni oppure può essere surgelato a - 20 C. Non ripetere più di 3 cicli di congelamento/scongelamento. I campioni devono essere scongelati a temperatura ambiente (18-30 C). Si consiglia di omogeneizzarli capovolgendoli prima del. I campioni contenenti fino a 120 g/l di albumina, 50 µg/l di biotina e 200 mg/l di bilirubina, i campioni contenenti fino a 33 g/l di trioleina e i campioni contenenti fino a 2 g/l di emoglobina non compromettono i risultati. Si sconsiglia tuttavia di utilizzare campioni iperemolizzati e iperlipemici contaminati. Si raccomanda di non riscaldare i campioni in quanto ciò potrebbe ridurre in modo significativo la rilevazione dell'antigene HCV. Per essere spediti, i campioni devono essere confezionati in conformità con le disposizioni vigenti in materia di trasporto di agenti eziologici e trasportati preferibilmente congelati. 7. PROCEDURA 7.1. Materiali necessari ma non forniti Acqua distillata. Ipocloruro di sodio (candeggina per uso domestico) e bicarbonato di sodio. Carta assorbente. Pellicole adesive. Guanti monouso. Occhiali di sicurezza. Provette monouso. Pipette o multipipette automatiche o semi-automatiche, regolabili o preimpostate per misurare e dispensare 50 μl, 80 μl, 100 μl, 200 μl e 1 ml. Cilindri graduati da 10 ml, 200 ml e ml. Miscelatore vortex. Sistema di lavaggio automatico, semi-automatico o manuale per micropiastre. Bagno d'acqua o incubatore per micropiastre equivalente, dotato di termostato impostato a 37 C ± 1 C (*). Contenitore per rifiuti biologici potenzialmente pericolosi.. Lettore di micropiastre dotato di filtri 450, 490 nm e nm (*). (*) Per informazioni dettagliate sull'apparecchiatura raccomandata, consultare il nostro reparto tecnico Preparazione dei reagenti Reagenti pronti al Reagente 1 (R1): Micropiastra Ogni supporto del telaio contenente 12 strip è avvolto in un sacchetto di alluminio laminato sigillato. Tagliare il sacchetto con le forbici o un bisturi da 0,5 a 1 cm sopra la sigillatura. Aprire il sacchetto ed estrarre il telaio. Riporre le strip inutilizzate nel sacchetto. Chiudere con cura il sacchetto e conservarlo a +2-8 C con del nastro adesivo. Reagente 6 (R6): Coniugato 1 Omogeneizzare capovolgendo prima del. Reagente 7 (R7): Coniugato 2 Omogeneizzare capovolgendo prima del. 7 [IT]
8 Reagenti per ricostituire Reagente 2 (R2): Soluzione di lavaggio concentrata (20x) Diluire 1:20 in acqua distillata per ottenere una soluzione di lavaggio pronta al. Preparare 800 ml per una piastra di 12 strip. Reagente 8 (R8) + Reagente 9 (R9): Soluzione di sviluppo dell'enzima Diluire 1:11 il cromogeno (R9) nel tampone di substrato (per es. 1 ml di reagente R ml di reagente R8) poiché 10 ml sono necessari e sufficienti a trattare 12 strip. Omogeneizzare. Reagente 5a (R5a) + Reagente 5b (R5b): Soluzione di lavoro (R5). Versare il contenuto di diluente R5b nella fiala di Ag R5 liofilizzato. Richiudere la fiala e lasciare decantare per 10 minuti a temperatura ambiente (18-30 C) agitando e capovolgendo la fiala periodicamente per favorire lo scioglimento Procedura di dosaggio Attenersi rigorosamente alla procedura. Utilizzare sieri di controllo negativo e positivo per ogni test al fine di confermarne la qualità. Attenersi alle pratiche di laboratorio corrette di seguito riportate: 1) Determinare attentamente il piano di identificazione e distribuzione del campione. 2) Preparare la soluzione di lavaggio diluita R2 e la soluzione di lavoro di controllo positivo dell'antigene (R5a + R5b). (fare riferimento al 7.2) 3) Estrarre il telaio di supporto e il numero di strip necessarie (R1) dalla confezione protettiva. Riporre le strip inutilizzate nella confezione. Chiudere la confezione e riporla a +2-8 C. 4) Distribuire nel pozzetto nel seguente ordine (distribuzione consigliabile sulla piastra): 100 μl di coniugato 1 (R6) in ogni pozzetto, quindi 50 μl di controllo negativo (R3) nel pozzetto A1, 50 μl di controllo positivo (R4) nei pozzetti B1, C1, D1, 50 μl di soluzione di lavoro di controllo positivo dell'antigene (R5a + R5b) nel pozzetto E1, 50 μl del primo campione nel pozzetto F1, 50 μl del secondo campione in G1, ecc. Omogeneizzare la miscela con almeno 3 aspirazioni o con un agitatore per micropiastre per 5 secondi. Se la distribuzione dei campioni richiede più di 10 minuti, si consiglia di distribuire i controlli positivi e negativi dopo i campioni da testare. A seconda del sistema impiegato, non è possibile modificare la posizione dei controlli o l'ordine di distribuzione. NOTA: dopo la distribuzione, il pozzetto contenente il campione (o i controlli) passa da porpora a blu. È possibile verificare la presenza del (campione + coniugato 1) nei pozzetti tramite lettura spettrometrica a 620 nm (fare riferimento al 7.7). 5) Se possibile, coprire la piastra con una nuova pellicola adesiva. 6) Incubare la micropiastra per 90 minuti (± 5 min.) a 37 C ± 1 C. 7) Se necessario, rimuovere la pellicola adesiva. Aspirare il contenuto dei pozzetti in un contenitore per rifiuti liquidi e aggiungere almeno 370 µl di soluzione di lavaggio in ogni pozzetto. Aspirare nuovamente e ripetere il lavaggio almeno 5 volte. Il volume residuo deve essere inferiore a 10 μl (se necessario, asciugare le strip capovolgendole su carta assorbente). Se si dispone di un sistema di lavaggio automatico, seguire lo stesso ciclo operativo. 8) Distribuire rapidamente 100 μl di soluzione di coniugato 2 (R7) in ogni pozzetto nella piastra. Il coniugato deve essere agitato con delicatezza prima del. Coprire, se possibile, con una nuova pellicola adesiva e incubare per 30 minuti (± 5 min.) a 37 C ± 1 C. NOTA: il coniugato è di colore verde. È possibile verificare la presenza del coniugato nei pozzetti tramite lettura spettrometrica a 620 nm (fare riferimento al 7.7). 9) Rimuovere la pellicola adesiva, svuotare tutti i pozzetti tramite aspirazione e lavare almeno 5 volte come descritto sopra. 10) Preparare una soluzione di sviluppo dell'enzima (reagente R8 + R9). 11) Distribuire rapidamente 80 μl di soluzione di sviluppo dell'enzima preparato (R8 + R9) in tutti i pozzetti. Far sviluppare la reazione al buio per 30 minuti (± 5 minuti) a temperatura ambiente (18-30 C). Non utilizzare pellicole adesive durante questo periodo di incubazione. 8 [IT]
9 NOTA: in questa fase della manipolazione si può controllare visivamente la distribuzione della soluzione di sviluppo, di colore rosa. Vi è una netta differenza di colorazione tra un pozzetto vuoto e un pozzetto contenente la soluzione di substrato rosa. (Fare riferimento al 7.7) 12) Aggiungere 100 μl della soluzione bloccante (R10) utilizzando la stessa sequenza e la stessa percentuale di distribuzione della soluzione di sviluppo. NOTA: in questa fase di manipolazione si può controllare visivamente la distribuzione della soluzione bloccante incolore. Il colore del substrato, rosa (per i campioni negativi) o blu (per quelli positivi), sbiadisce dai pozzetti che diventano incolori (per i campioni negativi) o gialli (per quelli positivi) dopo l'aggiunta della soluzione bloccante. 13) Asciugare accuratamente il fondo di ogni piastra. Attendere almeno 4 minuti dopo l'aggiunta della soluzione bloccante ed entro 30 minuti dal blocco della reazione, leggere la densità ottica a 450/ nm con un lettore per piastre. 14) Verificare la corrispondenza tra lettura spettrofotometrica e visiva e rispetto al piano di identificazione e distribuzione di piastra e campione Controllo qualità Utilizzare i controlli positivi (R4 e R5) e il controllo negativo (R3) a ogni esecuzione del test per confermare il dosaggio. (Fare riferimento a 7.5) 7.5. Criteri di validazione del test Il test è confermato se le condizioni seguenti sono rispettate: 1) Per il controllo negativo R3: Il valore di assorbanza misurata deve essere inferiore al 60% del cut-off: O.D. < cut-off x 0,6 2) Per il controllo positivo degli anticorpi R4: 0,800 O.D. medio R Se uno dei singoli valori del controllo positivo R4 differisce di oltre il 30% dal valore medio, ignorare il valore e ripetere il calcolo con i due valori di controllo positivi restanti. 3) Per la soluzione di lavoro R5: O.D. > 0, Calcolo/Interpretazione dei risultati Il cut-off si determina con il controllo positivo R4: Calcolare il valore dell'assorbanza media misurata per il controllo positivo R4. Calcolare il valore di cut-off: OD medio R4 CO = La presenza o l'assenza di anticorpi anti-hcv e/o di antigene del capside si determina confrontando l'assorbanza registrata con il valore di cut-off calcolato per ogni campione. Per ogni campione si calcola il seguente rapporto: Rapporto = OD del campione/valore CO I campioni con densità ottica inferiore al valore di cut-off sono ritenuti negativi (rapporto < 1) da Monolisa HCV Ag-Ab ULTRA V2. I risultati immediatamente inferiori al valore di cut-off (CO-10 % < O.D. < CO, rapporto tra 0,9 e 1) dovranno tuttavia essere interpretati con cautela. È consigliabile ritestare in duplicato i campioni corrispondenti quando consentito da sistemi e procedure di laboratorio. 9 [IT]
10 I campioni con densità ottica maggiore o uguale al cut-off (rapporto 1) sono considerati inizialmente positivi da Monolisa HCV Ag-Ab ULTRA V2. Dovranno essere ritestati in duplicato prima dell'interpretazione finale. Se, dopo la ripetizione del test, il valore del rapporto di almeno uno dei 2 duplicati risulta maggiore o uguale a 1, il risultato iniziale è ripetibile e il campione è dichiarato positivo con Monolisa HCV Ag-Ab ULTRA V2. I valori del rapporto dei 2 duplicati sono inferiori a 1, il risultato iniziale non è ripetibile e il campione è dichiarato negativo. I campioni ritestati due volte e risultati negativi con Monolisa HCV Ag-Ab ULTRA V2, ma con un valore prossimo al valore di cut-off (rapporto tra 0,9 e 1) dovranno essere considerati con cautela. È consigliabile ritestare il paziente con un altro metodo o un altro campione. In caso di densità ottica molto bassa dei campioni testati (OD negativo) e quando si controlla la presenza di campioni e reagente, i risultati possono essere interpretati come negativi. Si consiglia di confermare i campioni positivi seguendo le attuali raccomandazioni nazionali e gli algoritmi Verifica spettrometrica del pipettaggio di campione e coniugato (facoltativa) Verifica del pipettaggio di campione e coniugato 1 (R6) È possibile verificare la presenza di coniugato 1 (R6) + campione nel pozzetto tramite lettura automatica a 620 nm. Ogni pozzetto contenente campione e coniugato 1 (R6) deve avere OD maggiore di 0,800. NOTA: dopo l'aggiunta del campione, il coniugato 1 (R6) passa da porpora a blu. Verifica del pipettaggio di coniugato 2 (R7) Il coniugato 2 (R7) è di colore verde. È possibile verificare la presenza di coniugato 2 (R7) nei pozzetti tramite lettura automatica a 620 nm: Il valore OD di ogni pozzetto deve essere superiore a 0,300 (un valore inferiore a questo indica normalmente una scarsa dispensazione del coniugato). Verifica del pipettaggio di soluzione di sviluppo È possibile verificare la presenza di soluzione di sviluppo rosa nel pozzetto tramite lettura automatica a 490 nm. Un pozzetto con soluzione di sviluppo deve avere una densità ottica superiore a 0,100 (un OD inferiore indica una scarsa dispensazione della soluzione di sviluppo). Si verifica una variazione cromatica significativa dei pozzetti vuoti da incolore a rosa dopo l'aggiunta della soluzione di cromogeno del substrato preparata. 8. LIMITAZIONE DEL TEST Date le diverse risposte immunologiche dei pazienti affetti dal virus dell'epatite C (soprattutto durante le sieroconversioni), si possono osservare alcune differenze di rilevazione tra test in base al tipo di proteine antigeniche impiegate. Un risultato negativo durante un test di screening non esclude quindi la possibilità di esposizione o infezione da virus dell'epatite C. Secondo la letteratura, i portatori di HCV sottoposti a trattamento di immunosoppressione o con coinfezione da HIV-HCV possono presentare livelli di anticorpi particolarmente bassi, sotto il limite di rilevazione dei test HCV. Qualsiasi tecnica ELISA può produrre reazioni con falsi positivi. Si consiglia di verificare la specificità della reazione di qualsiasi campione risultato positivo ripetibile, secondo i criteri di interpretazione del kit Monolisa HCV Ag-Ab ULTRA V2 kit, applicando un metodo idoneo: impiegare separatamente un test di screening degli anticorpi anti-hcv ELISA con test di rilevazione degli anticorpi anti-hcv immunoblot per dimostrare la presenza di anticorpi anti-hcv. Se necessario, utilizzare un test di biologia molecolare per lo screening del genoma HCV. Il metodo colorimetrico di verifica della deposizione di campioni e/o coniugati e/o soluzione di sviluppo non consente un controllo preciso dei volumi distribuiti e rivela soltanto la presenza del campione e/o dei coniugati e/o della soluzione di sviluppo. La percentuale di risposte errate con questo metodo è strettamente associata alla precisione del sistema utilizzato (coefficiente cumulativo di variazione di distribuzione e lettura superiore al 10% riducono notevolmente la qualità della verifica). L'impiego del test Monolisa HCV Ag-Ab ULTRA V2 non è approvato per gruppi di campioni o campioni diluiti. Eccezionalmente, si possono rilevare particelle fini nel Coniugato 1 (R6), la cui presenza non altera comunque la qualità del reagente. 10 [IT]
11 9. CARATTERISTICHE DELLE PRESTAZIONI 9.1. Misurazione di precisione La riproducibilità e la precisione intermedia sono state determinate utilizzando campioni con diverse concentrazioni di anticorpi anti-hcv e antigeni HCV. I campioni sono stati testati 30 volte durante la stessa serie di test per determinare la ripetibilità. La precisione intermedia è stata valutata testando i campioni in duplicato ogni 20 giorni in 2 cicli indipendenti ogni giorno. Sono stati calcolati medie dei rapporti, deviazioni standard e coefficienti di variazione (CV) Ripetibilità Campioni N Media dei rapporti Deviazione standard CV % Negativo S1 30 0,23 0,024 10,4 Positivo antigene HCV Positivo anticorpi anti-hcv I CV ottenuti su 6 campioni positivi sono <10% Precisione intermedia S2 30 1,21 0,048 4,0 S3 30 1,43 0,053 3,7 S6 30 7,18 0,166 2,3 S4 30 1,42 0,046 3,2 S5 30 1,35 0,083 6,1 S7 30 6,73 0,153 2,3 Intradosaggidosaggio/operatore totale Inter- Riproducibilità Media In giornata Campioni N dei rapporti CV CV DS DS CV % DS DS CV % % % Negativo S1 80 0,22 0,017 7,5 0,028 12,5 0,029 12,7 0,043 19,4 Positivo antigene HCV Positivo anticorpi anti-hcv S2bis 80 2,80 0,143 5,1 0,277 9,9 0,283 10,1 0,421 15,0 S3 80 1,56 0,124 7,9 0,129 8,2 0, ,197 12,6 S6 68 6,69 0,500 7,5 0,621 9,3 0,557 8,3 0,973 14,5 S4 80 1,57 0,062 3,9 0,125 8,0 0* N/A 0,140 8,9 S5 80 1,75 0,075 4,3 0,164 9,3 0* N/A 0,181 10,3 S7 80 7,69 0,285 3,7 0,531 6,9 0* N/A 0,603 7,8 *: Il valore negativo della varianza è stato stimato a 0. I CV ottenuti su 6 campioni positivi non sono superiori al 15% Prestazioni cliniche Le prestazioni di Monolisa HCV Ag-Ab ULTRA V2 sono state determinate testando i campioni di donatori di sangue casuali, pazienti ricoverati, pazienti con infezioni acute e croniche da virus dell'epatite C e pazienti con sintomi non associati all'infezione da virus dell'epatite C. Gli studi si sono svolti presso 2 sedi di donatori di sangue, un nosocomio e un sito Bio-Rad Specificità diagnostica Lo studio è stato svolto su campioni di siero e plasma EDTA prelevati presso 2 centri di donazione su donatori casuali. È stato inoltre eseguito uno studio di specificità sui campioni dei pazienti ricoverati. Tutti i campioni sono stati sottoposti a test anti-hcv con marcatura CE. 11 [IT]
12 Popolazione Donatori di sangue Struttura #1 Tipo di campione Numero Campioni reattivi ripetuti (RR) Specificità (%) siero /537 plasma /2002 #2 siero /2638 Intervallo di confidenza 95% #1 + # ,94% 5174/ ,83% 99,99% Pazienti ricoverati #3 siero ,80% 501/502 98,92% 100,00% *: 3 donatori risultati indeterminati con il test di riferimento sono stati esclusi dai calcoli Sensibilità diagnostica La sensibilità diagnostica è stata studiata su 575 campioni di pazienti affetti da virus dell'epatite C. Tra questi campioni, 25 provenivano da pazienti campionati nelle 24 ore precedenti all'analisi. Sono stati testati 481 diversi campioni genotipizzati (1; 2; 3; 4; 5; 6). Tabella 1: Genotipi testati Genotipi Total (2 2a/c, 2a, (4, 4a, 4a/c, 4a/c/d, (1, 1a, 1b, 1a/b) (3, 3a, 3b, 3c) (5, 5a) (6, 6a, 6a/b, 6n) e 2b, 2b/3 4c, 4e, 4h, 4n, 4r) N La sensibilità diagnostica di tutti i campioni testati è pari al 100% (575/575) con un intervallo di confidenza del 95% di [99,4-100,0]. Campioni di pazienti con infezione acuta: 39 gruppi di sieroconversione (10 profili di capside, 10 profili NS3 e 19 profili multipli) sono stati testati con dosaggio Monolisa HCV Ag-Ab ULTRA V2 e confrontati con un dosaggio combinato di antigeni/anticorpi e con un dosaggio di anticorpi anti-hcv entrambi con marcatura CE. In tutti i gruppi si è ottenuta una rilevazione precoce. Di questi 39 gruppi, uno non è stato rilevato da Monolisa HCV Ag-Ab ULTRA V2 e tre non sono stati rilevati dal dosaggio combinato Ag-Ab assunto come confronto. Dei 38 gruppi rilevati da Monolisa HCV Ag-Ab ULTRA V2, 5 hanno registrato una rilevazione precoce, 27 una rilevazione equivalente e 6 una rilevazione tardiva rispetto al dosaggio combinato Ag-Ab. Rispetto a un test con anticorpi anti-hcv, 28 gruppi hanno registrato una rilevazione precoce, 9 una rilevazione equivalente e 1 una rilevazione tardiva. Monolisa HCV Ag-Ab ULTRA V2 contro dosaggio combinato Ag-Ab HCV Monolisa HCV Ag-Ab ULTRA V2 contro dosaggio Anti-HCV Numero di gruppi Rilevazione precoce 5 28 Rilevazione equivalente 27 9 Rilevazione tardiva Specificità analitica / studio di reattività incrociata 365 campioni potenzialmente interferenti contenenti anticorpi contro patogeni che potrebbero provocare patologie infettive (Citomegalovirus, virus di Epstein Barr, VZV, virus del morbillo, virus della rosolia, virus della parotite, virus dell'herpes, virus dell'influenza, virus dell'epatite A, virus dell'epatite B, HIV 1/2, HTLV 1/2, sifilide, Toxoplasma gondii, Dengue, Chagas), campioni del gruppo a rischio (pazienti dializzati, affetti da cirrosi non epatica, donne in gravidanza, donne pluripare) o campioni di pazienti con disturbi del sistema immunitario (autoanticorpi, fattori reumatoidi, anticorpi anti-topo e mielomi) sono stati testati con Monolisa HCV Ag-Ab ULTRA V2 test. 12 [IT]
13 Due campioni sono risultati ripetutamente positivi con il test Monolisa HCV Ag-Ab ULTRA V2. La specificità osservata in questa popolazione target pari al 99,45% (363/365) era simile alla specificità dei campioni clinici Effetto gancio È stata studiata l'esistenza di un possibile effetto gancio testando 5 campioni con titoli alti a varie diluizioni. L'equivalenza di risultati osservati tra i campioni diluiti e non diluiti mostra l'assenza dell'effetto gancio. 10. RIFERIMENTI BIBLIOGRAFICI Bhartia A.R., Letendrea S.L., Wolfsona T. Clinical variables identify seronegative HCV co-infection in HIV-infected individuals. J. of Clin. Virol. 2011, 52 : Bouvier-Alias M, Patel K, Dahari H, Beaucourt S, Larderie P, Blatt L, Hezode C, Picchio G et al. Clinical utility of total HCV core antigen quantification: a new indirect marker of HCV replication. Hepatology. 2002, 36 : Choo Q.L., Richman K.H., Han J.H., Berger K., Lee C., Dong C., Gallegos C., Coit D., Medina-Selby A., Barp P.J., Weiner A.J., Bradley D.W., Kuo G. and Houghton M. Genetic organization and diversity of the hepatitis C virus. Proc. Natl. Acad. Sci. U.S.A. 1991, 88: EASL EASL Clinical Practice Guidelines: Management of hepatitis C virus infection. Journal of Hepatology. 2011, 55(2): Jackson BR, Busch MP, Stramer SL, AuBuchon JP. The cost-effectiveness of NAT for HIV, HCV and HBV in whole blood donations. Transfusion. 2003, 43: Lambert N. Value of HCV Antigen-Antibody Combined HCV Assay in Hepatitis C Diagnosis. Dev. Biol. (Basel), 2007, 127: Laperche S., Le Marrec N., Girault A., Bouchardeau F., Servant-Delmas A., Maniez-Montreuil M., Gallian P., Levayer T., Morel P., Simon N. Simultaneous detection of hepatitis C virus (HCV) core antigen and anti-hcv antibodies improves the early detection of HCV infection. J. Clin. Microbiol. 2005, 43(8): Nübling CM, Unger G, Chudy M, Raia S, Löwer J. Sensitivity of HCV core antigen and HCV RNA detection in the early infection phase. Transfusion : Rider P.J. and Liu F. Crosstalk between HIV and hepatitis C virus during co-infection. BMC Medicine. 2012, 10: 32. Schnuriger A., Dominguez S., Valantin M.A., Tubiana R., Duvivier C., Ghosn J., Simon A., Katlama C. and Thibault V. Early Detection of Hepatitis C Virus Infection by Use of a New Combined Antigen-Antibody Detection Assay : Potential Use for High-Risk Individuals. J. Clin. Microbiol. 2006, Strader DB, Wright T, Thomas DL, Seeff LB. Diagnosis, management and treatment of Hepatitis C. AASLD Practice Guideline. Hepatology. 2004, 39 : Widell A., Busch M. Exposed or not exposed - that is the question: evidence for resolving and abortive hepatitis C virus infections in blood donors. Transfusion. 2009, 49: [IT]
14 14 [IT]
15 15 [IT]
16 16 [IT]
17 17 [IT]
18 Bio-Rad 3, boulevard Raymond Poincare Marnes-la-Coquette - Francia Tel.: +33 (0) /09 Fax: +33 (0) [IT]
Monolisa HCV Ag-Ab ULTRA V2. 1 piastra- 96 72561 5 piastre - 480 72562
 Monolisa HCV Ag-Ab ULTRA V2 1 piastra- 96 72561 5 piastre - 480 72562 1 2 Monolisa HCV Ag-Ab ULTRA V2 1 piastra- 96 72561 5 piastre - 480 72562 KIT DI SCREENING COMBINATO PER ANTICORPI ANTI-HCV E ANTIGENE
Monolisa HCV Ag-Ab ULTRA V2 1 piastra- 96 72561 5 piastre - 480 72562 1 2 Monolisa HCV Ag-Ab ULTRA V2 1 piastra- 96 72561 5 piastre - 480 72562 KIT DI SCREENING COMBINATO PER ANTICORPI ANTI-HCV E ANTIGENE
MONOLISA HBs Ag ULTRA 1 Piastra - 96 tests Piastra tests 72348
 MONOLISA HBs Ag ULTRA 1 Piastra - 96 tests 72346 5 Piastra - 480 tests 72348 KIT PER LA RIVELAZIONE DELL'ANTIGENE DI SUPERFICIE DEL VIRUS DELL'EPATITE B MEDIANTE TECNICA DI IMMUNODOSAGGIO ENZIMATICO NEL
MONOLISA HBs Ag ULTRA 1 Piastra - 96 tests 72346 5 Piastra - 480 tests 72348 KIT PER LA RIVELAZIONE DELL'ANTIGENE DI SUPERFICIE DEL VIRUS DELL'EPATITE B MEDIANTE TECNICA DI IMMUNODOSAGGIO ENZIMATICO NEL
INGEZIM Gluten Quanti Test Guida all utilizzo
 INGEZIM Gluten Quanti Test Guida all utilizzo 1 - INTRODUZIONE Il kit è basato su un saggio immunoenzimatico ELISA di tipo sandwich come dettato dal Codex Alimentarius. Ogni pozzetto è rivestito sul fondo
INGEZIM Gluten Quanti Test Guida all utilizzo 1 - INTRODUZIONE Il kit è basato su un saggio immunoenzimatico ELISA di tipo sandwich come dettato dal Codex Alimentarius. Ogni pozzetto è rivestito sul fondo
ScanGel ScanSol ml ml
 ScanGel ScanSol 86448 100 ml 86449 500 ml MEZZO DI SOSPENSIONE DEI GLOBULI ROSSI IVD Tutti i prodotti fabbricati e commercializzati dalla società Bio-Rad sono sottoposti a un sistema di assicurazione qualità
ScanGel ScanSol 86448 100 ml 86449 500 ml MEZZO DI SOSPENSIONE DEI GLOBULI ROSSI IVD Tutti i prodotti fabbricati e commercializzati dalla società Bio-Rad sono sottoposti a un sistema di assicurazione qualità
PLATELIA ASPERGILLUS IgG Negative and Positive Controls
 PLATELIA ASPERGILLUS IgG Negative and Positive Controls 48 62786 Sieri Umani per il Controllo di Qualità 881090-2012/06 sommario 1. USO PREVISTO...27 2. INDICAZIONI PER L USO...27 3. REAGENTI...27 4. AVVERTENZE
PLATELIA ASPERGILLUS IgG Negative and Positive Controls 48 62786 Sieri Umani per il Controllo di Qualità 881090-2012/06 sommario 1. USO PREVISTO...27 2. INDICAZIONI PER L USO...27 3. REAGENTI...27 4. AVVERTENZE
IMMUFIT LEV1 REF KCQIMMU1
 IMMUFIT LEV1 REF KCQIMMU1 Per Uso Diagnostico In Vitro APPLICAZIONE D USO: Questo prodotto è inteso per l uso diagnostico in vitro come controllo di qualità dell accuratezza degli immunodosaggi sui sistemi
IMMUFIT LEV1 REF KCQIMMU1 Per Uso Diagnostico In Vitro APPLICAZIONE D USO: Questo prodotto è inteso per l uso diagnostico in vitro come controllo di qualità dell accuratezza degli immunodosaggi sui sistemi
DRUGFIT LEV1 LEV2 LEV3 REF KCQDRAB1 - KCQDRAB2 - KCQDRAB3
 DRUGFIT LEV1 LEV2 LEV3 REF KCQDRAB1 - KCQDRAB2 - KCQDRAB3 Per Uso Diagnostico In Vitro APPLICAZIONE D USO: Il DRUGFIT è destinato all uso come campione di controllo per monitorare le condizioni di dosaggio
DRUGFIT LEV1 LEV2 LEV3 REF KCQDRAB1 - KCQDRAB2 - KCQDRAB3 Per Uso Diagnostico In Vitro APPLICAZIONE D USO: Il DRUGFIT è destinato all uso come campione di controllo per monitorare le condizioni di dosaggio
ALLwell Ingenasa Ingezim Gluten Quick
 ALLwell Ingenasa Ingezim Gluten Quick ELISA kit Cat. N. LFD030-Q TEST immunoenzimatico per la rivelazione quantitativa del glutine in campioni alimentari ed ambientali Manuale d uso Leggere attentamente
ALLwell Ingenasa Ingezim Gluten Quick ELISA kit Cat. N. LFD030-Q TEST immunoenzimatico per la rivelazione quantitativa del glutine in campioni alimentari ed ambientali Manuale d uso Leggere attentamente
HCV Ab V3 Calibrators
 ACCESS Immunoassay System HCV Ab V3 2 x 50 B33458 Individuazione qualitativa degli anticorpi anti-hcv nel siero e nel plasma umano mediante Access Immunoassay Systems. ACCESS Immunoassay System HCV Ab
ACCESS Immunoassay System HCV Ab V3 2 x 50 B33458 Individuazione qualitativa degli anticorpi anti-hcv nel siero e nel plasma umano mediante Access Immunoassay Systems. ACCESS Immunoassay System HCV Ab
Platelia Measles IgG. 1 piastra /12
 Platelia Measles IgG 1 piastra - 48 72686 METODO IMMUNOENZIMATICO PER LA DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgG ANTI VIRUS DEL MORBILLO NEL SIERO UMANO 2014/12 SOMMARIO 1. UTILIZZAZIONE 2. INTRODUZIONE
Platelia Measles IgG 1 piastra - 48 72686 METODO IMMUNOENZIMATICO PER LA DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgG ANTI VIRUS DEL MORBILLO NEL SIERO UMANO 2014/12 SOMMARIO 1. UTILIZZAZIONE 2. INTRODUZIONE
TEICOPLANINA QMS Saggio immunologico
 0155941-0 Gen., 2011 TEICOPLANINA QMS Saggio immunologico Prima dell'uso leggere attentamente il foglietto illustrativo del presente sistema quantitativo a microsfere (Quantitative Microsphere System -
0155941-0 Gen., 2011 TEICOPLANINA QMS Saggio immunologico Prima dell'uso leggere attentamente il foglietto illustrativo del presente sistema quantitativo a microsfere (Quantitative Microsphere System -
Striscia reattiva glicemia ematocrito emoglobina. N. modello: TD-4272 / GD40 DELTA
 Striscia reattiva glicemia ematocrito emoglobina AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori che eseguono
Striscia reattiva glicemia ematocrito emoglobina AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori che eseguono
BORRELIA BURGDORFERI SENSU LATO NEL SIERO, PLASMA O LIQUIDO CEREBROSPINALE UMANO MEDIANTE IMMUNODOSAGGIO ENZIMATICO
 PLATELIA LYME IgG 96 72952 DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgG ANTI-BORRELIA BURGDORFERI SENSU LATO NEL SIERO, PLASMA O LIQUIDO CEREBROSPINALE UMANO MEDIANTE IMMUNODOSAGGIO ENZIMATICO 1- USO
PLATELIA LYME IgG 96 72952 DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgG ANTI-BORRELIA BURGDORFERI SENSU LATO NEL SIERO, PLASMA O LIQUIDO CEREBROSPINALE UMANO MEDIANTE IMMUNODOSAGGIO ENZIMATICO 1- USO
TEICOPLANINA QMS Saggio immunologico
 0155948-0 Gen. 2011 TEICOPLANINA QMS Saggio immunologico Prima dell'uso leggere attentamente il foglietto illustrativo del presente sistema quantitativo a microsfere (Quantitative Microsphere System -
0155948-0 Gen. 2011 TEICOPLANINA QMS Saggio immunologico Prima dell'uso leggere attentamente il foglietto illustrativo del presente sistema quantitativo a microsfere (Quantitative Microsphere System -
PLATELIA CMV IgM TEST
 PLATELIA CMV IgM 72811 96 TEST DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgM ANTI-CYTOMEGALOVIRUS NEL SIERO O NEL PLASMA UMANO MEDIANTE DOSAGGIO IMMUNOENZIMATICO 1. USO PREVISTO Platelia CMV IgM è un
PLATELIA CMV IgM 72811 96 TEST DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgM ANTI-CYTOMEGALOVIRUS NEL SIERO O NEL PLASMA UMANO MEDIANTE DOSAGGIO IMMUNOENZIMATICO 1. USO PREVISTO Platelia CMV IgM è un
URISTIKFIT LEV1 REF KCQURST1
 URISTIKFIT LEV1 REF KCQURST1 Per Uso Diagnostico In Vitro USO PREVISTO Il controllo URISTIKFIT è destinato all uso nel laboratorio clinico come materiale di controllo nelle procedure qualitative e semiquantitative
URISTIKFIT LEV1 REF KCQURST1 Per Uso Diagnostico In Vitro USO PREVISTO Il controllo URISTIKFIT è destinato all uso nel laboratorio clinico come materiale di controllo nelle procedure qualitative e semiquantitative
Valutazione del test rapido Geenius HIV1/2 per la conferma degli anticorpi anti HIV1-2. Gianna Mazzarelli
 Valutazione del test rapido Geenius HIV1/2 per la conferma degli anticorpi anti HIV1-2 Gianna Mazzarelli 14/09/2015 Tempi di rilevazione di specifici markers di infezione HIV Test combinati Ag/Ab Ag ricombinanti
Valutazione del test rapido Geenius HIV1/2 per la conferma degli anticorpi anti HIV1-2 Gianna Mazzarelli 14/09/2015 Tempi di rilevazione di specifici markers di infezione HIV Test combinati Ag/Ab Ag ricombinanti
Analisi Immunoenzimatiche
 Analisi Immunoenzimatiche Mara Stefanelli INAIL Dipartimento Innovazioni Tecnologiche e Sicurezza degli Impianti, Prodotti e Insediamenti antropici Istituto Superiore di Sanità Dipartimento Ambiente e
Analisi Immunoenzimatiche Mara Stefanelli INAIL Dipartimento Innovazioni Tecnologiche e Sicurezza degli Impianti, Prodotti e Insediamenti antropici Istituto Superiore di Sanità Dipartimento Ambiente e
ISTRUZIONI D USO IVD 0123 HLA CLASSE II REF 7029: HISTO TRAY DR 72 (10)
 ISTRUZIONI D USO IVD 0123 HISTO TRAY HLA CLASSE II PER USO DIAGNOSTICO IN VITRO REF 7029: HISTO TRAY DR 72 (10) 10 piastre Descrizione del prodotto La destinazione d uso dell HISTO TRAY è la tipizzazione
ISTRUZIONI D USO IVD 0123 HISTO TRAY HLA CLASSE II PER USO DIAGNOSTICO IN VITRO REF 7029: HISTO TRAY DR 72 (10) 10 piastre Descrizione del prodotto La destinazione d uso dell HISTO TRAY è la tipizzazione
WITNESS GIARDIA INTRODUZIONE
 WITNESS GIARDIA WITNESS GIARDIA INTRODUZIONE Giardia intestinalis (sin. G. duodenalis o G. lamblia) è un protozoo parassita dell apparato gastrointestinale di numerose specie di animali (ad es. cane e
WITNESS GIARDIA WITNESS GIARDIA INTRODUZIONE Giardia intestinalis (sin. G. duodenalis o G. lamblia) è un protozoo parassita dell apparato gastrointestinale di numerose specie di animali (ad es. cane e
Allegato III Autocertificazione del produttore
 Scheda Tecnica 0123 Technical File No.: 24 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-Lua, Anti-Lub coombsreactive Allegato III Autocertificazione del produttore Struttura della
Scheda Tecnica 0123 Technical File No.: 24 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-Lua, Anti-Lub coombsreactive Allegato III Autocertificazione del produttore Struttura della
Syphilis Total Ab 1 piastra - 96 72530 5 piastre - 480 72531
 Syphilis Total Ab 1 piastra - 96 72530 5 piastre - 480 72531 KIT PER LA RILEVAZIONE QUALITATIVA DI ANTICORPI ANTI TREPONEMA PALLIDUM IN SIERO O PLASMA UMANO CON UNA TECNICA DI IMMUNODOSAGGIO ENZIMATICO
Syphilis Total Ab 1 piastra - 96 72530 5 piastre - 480 72531 KIT PER LA RILEVAZIONE QUALITATIVA DI ANTICORPI ANTI TREPONEMA PALLIDUM IN SIERO O PLASMA UMANO CON UNA TECNICA DI IMMUNODOSAGGIO ENZIMATICO
ALLwell Elution Technologies Bovine Casein Protein
 ALLwell Elution Technologies Bovine Casein Protein Elisa kit Cat. N. ETE-75CAS Kit per la rilevazione della caseina bovina in campioni alimentari Manuale d uso Leggere attentamente il manuale prima di
ALLwell Elution Technologies Bovine Casein Protein Elisa kit Cat. N. ETE-75CAS Kit per la rilevazione della caseina bovina in campioni alimentari Manuale d uso Leggere attentamente il manuale prima di
ScanGel NEUTRAL Schede Schede
 ScanGel NEUTRAL 86429 48 Schede 86430 1080 Schede GEL NEUTRO Gruppo indiretto, ricerca di Ac irregolari, compatibilità IVD Tutti i prodotti fabbricati e commercializzati dalla società Bio-Rad sono sottoposti
ScanGel NEUTRAL 86429 48 Schede 86430 1080 Schede GEL NEUTRO Gruppo indiretto, ricerca di Ac irregolari, compatibilità IVD Tutti i prodotti fabbricati e commercializzati dalla società Bio-Rad sono sottoposti
PLATELIA H. PYLORI IgG 72778
 PLATELIA H. PYLORI IgG 72778 96 TEST RIVELAZIONE DEGLI ANTICORPI IgG ANTI- HELICOBACTER PYLORI NEL SIERO UMANO MEDIANTE TECNICA IMMUNOENZIMATICA 1- INTERESSE CLINICO Identificato nel 1983 da Warren et
PLATELIA H. PYLORI IgG 72778 96 TEST RIVELAZIONE DEGLI ANTICORPI IgG ANTI- HELICOBACTER PYLORI NEL SIERO UMANO MEDIANTE TECNICA IMMUNOENZIMATICA 1- INTERESSE CLINICO Identificato nel 1983 da Warren et
HBCon. ISTRUZIONI PER L USO VITROS Immunodiagnostic Products Kit di conferma dell HBsAg
 ISTRUZIONI PER L USO VITROS Immunodiagnostic Products Kit di conferma dell HBsAg HBCon 822 8595 Impiego Uso in vitro per la conferma della presenza dell antigene di superficie dell epatite B (HBsAg) in
ISTRUZIONI PER L USO VITROS Immunodiagnostic Products Kit di conferma dell HBsAg HBCon 822 8595 Impiego Uso in vitro per la conferma della presenza dell antigene di superficie dell epatite B (HBsAg) in
bioelisa VEDI CAMBI RISALTATI
 VEDI CAMBI RISALTATI bioelisa RUBELLA IgG colour 3000-1219 480 tests Test ELISA per la determinazione qualitativa e quantitativa di anticorpi IgG anti-rosolia in siero umano. Sommario La rosolia, o morbillo
VEDI CAMBI RISALTATI bioelisa RUBELLA IgG colour 3000-1219 480 tests Test ELISA per la determinazione qualitativa e quantitativa di anticorpi IgG anti-rosolia in siero umano. Sommario La rosolia, o morbillo
WITNESS FeLV-FIV CARATTERISTICHE GENERALI INDICAZIONI DEL TEST PRINCIPIO DEL TEST
 WITNESS FeLV-FIV WITNESS FeLV-FIV CARATTERISTICHE GENERALI Il virus della leucemia felina (FeLV) è un retrovirus del gruppo Mammalian tipo C, diffuso in tutto il mondo e particolarmente endemico nelle
WITNESS FeLV-FIV WITNESS FeLV-FIV CARATTERISTICHE GENERALI Il virus della leucemia felina (FeLV) è un retrovirus del gruppo Mammalian tipo C, diffuso in tutto il mondo e particolarmente endemico nelle
15 Anti-D policlonale / incompleto
 Scheda Tecnica 0123 Technical File No.: Prodotto: 15 Anti-D policlonale / incompleto Categoria di prodotto secondo la classificazione CE: Allegato II Lista A Struttura della scheda tecnica Descrizione
Scheda Tecnica 0123 Technical File No.: Prodotto: 15 Anti-D policlonale / incompleto Categoria di prodotto secondo la classificazione CE: Allegato II Lista A Struttura della scheda tecnica Descrizione
bioelisa VEDI CAMBI RISALTATI
 VEDI CAMBI RISALTATI bioelisa RUBELLA IgM (Immunocapture) 3000-1231 96 tests Test ELISA per la determinazione degli anticorpi IgM anti-rosolia nel siero o nel plasma umano. Sommario La rosolia, o morbillo
VEDI CAMBI RISALTATI bioelisa RUBELLA IgM (Immunocapture) 3000-1231 96 tests Test ELISA per la determinazione degli anticorpi IgM anti-rosolia nel siero o nel plasma umano. Sommario La rosolia, o morbillo
VEDI CAMBI RISALTATI. Componenti 1. MCPL MICROPIASTRA: 12 x 8 pozzetti ricoperti di antigene T. gondii inattivato. Pozzetti separabili singolarmente.
 VEDI CAMBI RISALTATI bioelisa TOXO IgG 3000-1214 96 tests Test ELISA per la determinazione qualitativa e quantitativa degli anticorpi IgG anti-toxoplasma gondii nel siero o nel plasma umano. Sommario La
VEDI CAMBI RISALTATI bioelisa TOXO IgG 3000-1214 96 tests Test ELISA per la determinazione qualitativa e quantitativa degli anticorpi IgG anti-toxoplasma gondii nel siero o nel plasma umano. Sommario La
WITNESS RELAXIN GENERALITÀ
 WITNESS RELAXIN WITNESS RELAXIN GENERALITÀ Il kit WITNESS RELAXIN è utilizzato nella diagnosi di gravidanza della cagna e della gatta e permette la distinzione tra gravidanza vera e pseudogravidanza nella
WITNESS RELAXIN WITNESS RELAXIN GENERALITÀ Il kit WITNESS RELAXIN è utilizzato nella diagnosi di gravidanza della cagna e della gatta e permette la distinzione tra gravidanza vera e pseudogravidanza nella
ScanGel Monoclonal ABO/RH1/K Schede Schede
 ScanGel Monoclonal ABO/RH1/K 86495 48 Schede 86485 288 Schede GEL FORMULATI CON REAGENTI MONOCLONALI DI ORIGINE MURINA O UMANA Determinazione degli Ag ABO1, ABO2, RH1, KEL1 IVD Tutti i prodotti fabbricati
ScanGel Monoclonal ABO/RH1/K 86495 48 Schede 86485 288 Schede GEL FORMULATI CON REAGENTI MONOCLONALI DI ORIGINE MURINA O UMANA Determinazione degli Ag ABO1, ABO2, RH1, KEL1 IVD Tutti i prodotti fabbricati
Caratteristiche prestazionali
 Caratteristiche prestazionali Kit RNeasy DSP FFPE, Versione 1 73604 Gestione della versione Il presente è il documento Caratteristiche prestazionali del kit RNeasy DSP FFPE, Versione 1, R1. Prima di eseguire
Caratteristiche prestazionali Kit RNeasy DSP FFPE, Versione 1 73604 Gestione della versione Il presente è il documento Caratteristiche prestazionali del kit RNeasy DSP FFPE, Versione 1, R1. Prima di eseguire
Per la conservazione viene aggiunta sodio azide a una concentrazione finale inferiore allo 0,1 %.
 Scheda Tecnica 0123 Technical File No.: 38 Prodotto: Categoria di prodotto secondo la classificazione CE: Albumina Bovina 22% 30% Allegato III Autocertificazione del produttore Struttura della scheda tecnica
Scheda Tecnica 0123 Technical File No.: 38 Prodotto: Categoria di prodotto secondo la classificazione CE: Albumina Bovina 22% 30% Allegato III Autocertificazione del produttore Struttura della scheda tecnica
QuickTox TM Kit for QuickScan Ochratoxin-A in Wine. Manuale d uso. Cat. # OTA-WINE
 QuickTox TM Kit for QuickScan Ochratoxin-A in Wine Cat. # OTA-WINE Manuale d uso Via San Geminiano, 4 41030 San Prospero (MO)- Italy : +39 059 8637161 : +39 059 7353024 : immunolab@generon.it : www.generon.it
QuickTox TM Kit for QuickScan Ochratoxin-A in Wine Cat. # OTA-WINE Manuale d uso Via San Geminiano, 4 41030 San Prospero (MO)- Italy : +39 059 8637161 : +39 059 7353024 : immunolab@generon.it : www.generon.it
EXTRA-GENE I Kit per l estrazione del DNA genomico 50 Estrazioni
 IT Istruzioni d uso EXTRA-GENE I Kit per l estrazione del DNA genomico 50 Estrazioni REF 7059 1. Descrizione del prodotto EXTRA-GENE è un kit per l estrazione veloce del DNA genomico senza l utilizzo di
IT Istruzioni d uso EXTRA-GENE I Kit per l estrazione del DNA genomico 50 Estrazioni REF 7059 1. Descrizione del prodotto EXTRA-GENE è un kit per l estrazione veloce del DNA genomico senza l utilizzo di
PLATELIA CANDIDA Ab PLUS Negative and Positive Controls. Sieri Umani per il Controllo di Qualità
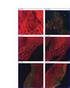 PLATELIA CANDIDA Ab PLUS Negative and Positive Controls 48 62787 Sieri Umani per il Controllo di Qualità sommario 1. USO PREVISTO...27 2. INDICAZIONI PER L USO...27 3. REAGENTI...27 4. AVVERTENZE PER GLI
PLATELIA CANDIDA Ab PLUS Negative and Positive Controls 48 62787 Sieri Umani per il Controllo di Qualità sommario 1. USO PREVISTO...27 2. INDICAZIONI PER L USO...27 3. REAGENTI...27 4. AVVERTENZE PER GLI
Progensa PCA3 Urine Specimen Transport Kit
 Istruzioni per i medici Progensa PCA3 Urine Specimen Transport Kit Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
Istruzioni per i medici Progensa PCA3 Urine Specimen Transport Kit Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
Speed Duo Leish K/Ehrli
 Speed Duo Leish K/Ehrli TM IT Speed Duo Leish K/Ehrli TM Kit di diagnosi veterinaria Solo per uso in vitro INTERESSE CLINICO La leishmaniosi canina è una malattia dovuta alla proliferazione nei macrofagi
Speed Duo Leish K/Ehrli TM IT Speed Duo Leish K/Ehrli TM Kit di diagnosi veterinaria Solo per uso in vitro INTERESSE CLINICO La leishmaniosi canina è una malattia dovuta alla proliferazione nei macrofagi
bioelisa VEDI CAMBI RISALTATI
 VEDI CAMBI RISALTATI bioelisa HIV-1+2 3.0 3000-1168 96 tests 3000-1169 480 tests Test ELISA per la determinazione degli anticorpi contro i virus dell immunodeficienza umana (HIV) tipo 1 (gruppo M-O) o
VEDI CAMBI RISALTATI bioelisa HIV-1+2 3.0 3000-1168 96 tests 3000-1169 480 tests Test ELISA per la determinazione degli anticorpi contro i virus dell immunodeficienza umana (HIV) tipo 1 (gruppo M-O) o
VEDI CAMBI RISALTATI. Ac a-igm a-hav IgM HAV a-hav perossidasi
 VEDI CAMBI RISALTATI bioelisa HAV IgM 3000-1098 96 tests Test ELISA per la determinazione degli anticorpi IgM contro il virus dell'epatite A (HAV) nel siero o nel plasma umano. Sommario Il virus dell'epatite
VEDI CAMBI RISALTATI bioelisa HAV IgM 3000-1098 96 tests Test ELISA per la determinazione degli anticorpi IgM contro il virus dell'epatite A (HAV) nel siero o nel plasma umano. Sommario Il virus dell'epatite
QUANTA Chek ANA Panel
 QUANTA Chek ANA Panel 708111 Finalità d uso Il Pannello ANA QUANTA Chek TM è utilizzato per il controllo della qualità delle procedure per la ricerca degli anticorpi antinucleo IFA ed ELISA. Ciascun siero
QUANTA Chek ANA Panel 708111 Finalità d uso Il Pannello ANA QUANTA Chek TM è utilizzato per il controllo della qualità delle procedure per la ricerca degli anticorpi antinucleo IFA ed ELISA. Ciascun siero
AlereTM. HIV Combo TOCCARE QUI PER VEDERE IL PRODOTTO
 AlereTM HIV Combo TOCCARE QUI PER VEDERE IL PRODOTTO Cogli qualunque opportunità di fare il test. I casi di infezione acuta sono compresi fra il 5 e il 20% rispetto al totale dei casi di infezione da HIV
AlereTM HIV Combo TOCCARE QUI PER VEDERE IL PRODOTTO Cogli qualunque opportunità di fare il test. I casi di infezione acuta sono compresi fra il 5 e il 20% rispetto al totale dei casi di infezione da HIV
PROGENSA PCA3 Urine Specimen Transport Kit
 PROGENSA PCA3 Urine Specimen Transport Kit Istruzioni per i medici Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
PROGENSA PCA3 Urine Specimen Transport Kit Istruzioni per i medici Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
Kit per la determinazione immuno-turbidimetrica quantitativa delle sieroproteine umane su sistemi automatici.
 1 1. IMMUNOTURBIDIMETRIA METODI IMMUNO-TURBIDIMETRICI PER AUTOMAZIONE 2. LATTICI METODI IN AGGLUTINAZIONE AL LATTICE SU VETRINO 3. LATTICI PER AUTOMAZIONE METODI TURBIDIMETRICI AL LATTICE 2012 1 2 METODI
1 1. IMMUNOTURBIDIMETRIA METODI IMMUNO-TURBIDIMETRICI PER AUTOMAZIONE 2. LATTICI METODI IN AGGLUTINAZIONE AL LATTICE SU VETRINO 3. LATTICI PER AUTOMAZIONE METODI TURBIDIMETRICI AL LATTICE 2012 1 2 METODI
bioelisa VEDI CAMBI RISALTATI
 VEDI CAMBI RISALTATI bioelisa anti-hbs 3000-1101 96 tests Test ELISA per la determinazione e quantificazione degli anticorpi contro l antigene di superficie dell Epatite B (anti-hbs) nel siero umano. Sommario
VEDI CAMBI RISALTATI bioelisa anti-hbs 3000-1101 96 tests Test ELISA per la determinazione e quantificazione degli anticorpi contro l antigene di superficie dell Epatite B (anti-hbs) nel siero umano. Sommario
ScanGel Monoclonal ABO/RH1/RH Schede Schede
 ScanGel Monoclonal ABO/RH1/RH1 86494 48 Schede 86444 288 Schede GEL FORMULATI CON REAGENTI MONOCLONALI DI ORIGINE MURINA O UMANA Prova diretta ABO. Determinazione del Ag RH1 IVD Tutti i prodotti fabbricati
ScanGel Monoclonal ABO/RH1/RH1 86494 48 Schede 86444 288 Schede GEL FORMULATI CON REAGENTI MONOCLONALI DI ORIGINE MURINA O UMANA Prova diretta ABO. Determinazione del Ag RH1 IVD Tutti i prodotti fabbricati
ALLflow Elution Technologies Egg Proteins Rapid Test
 ALLflow Elution Technologies Egg Proteins Rapid Test Lateral Flow kit Cat. # ETBEGG-1003 Kit per la rilevazione rapida delle proteine dell uovo in campioni alimentari ed ambientali Manuale d uso Leggere
ALLflow Elution Technologies Egg Proteins Rapid Test Lateral Flow kit Cat. # ETBEGG-1003 Kit per la rilevazione rapida delle proteine dell uovo in campioni alimentari ed ambientali Manuale d uso Leggere
ADA infliximab. ADA IFX BUF CONJ HRP Anticorpi anti-farmaco Infliximab Tampone Coniugato HRP
 Sanquin Division Reagents Plesmanlaan 125 NL 1066CX Amsterdam ADA infliximab Telephone: +31 20 5123599 Fax: +31 20 5123570 E-mail: reagents@sanquin.nl www.sanquin.nl/reagents M2960 M2960_v01 48 ELISA per
Sanquin Division Reagents Plesmanlaan 125 NL 1066CX Amsterdam ADA infliximab Telephone: +31 20 5123599 Fax: +31 20 5123570 E-mail: reagents@sanquin.nl www.sanquin.nl/reagents M2960 M2960_v01 48 ELISA per
ScanGel ABO Complete/RH/K Duo x 24 schede x 144 schede Schede ScanGel ABO Complete/RH1 Duo e ScanGel Monoclonal RH/K Phenotypes Duo
 ScanGel ABO Complete/RH/K Duo 86719 2 x 24 schede 86709 2 x 144 schede Schede ScanGel ABO Complete/RH1 Duo e ScanGel Monoclonal RH/K Phenotypes Duo GEL FORMULATI CON REAGENTI MONOCLONALI DI ORIGINE MURINA
ScanGel ABO Complete/RH/K Duo 86719 2 x 24 schede 86709 2 x 144 schede Schede ScanGel ABO Complete/RH1 Duo e ScanGel Monoclonal RH/K Phenotypes Duo GEL FORMULATI CON REAGENTI MONOCLONALI DI ORIGINE MURINA
QUANTA Chek Celiac Panel 708113
 QUANTA Chek Celiac Panel 708113 Finalità d uso Il Pannello Celiac QUANTA Chek TM è utilizzato per il controllo della qualità delle procedure per la ricerca degli autoanticorpi IFA ed ELISA. Ciascun siero
QUANTA Chek Celiac Panel 708113 Finalità d uso Il Pannello Celiac QUANTA Chek TM è utilizzato per il controllo della qualità delle procedure per la ricerca degli autoanticorpi IFA ed ELISA. Ciascun siero
bioelisa HAV tests Test ELISA per la determinazione degli anticorpi contro il virus dell'epatite A (HAV) nel siero o nel plasma umano.
 bioelisa HAV 3000-1097 96 tests Test ELISA per la determinazione degli anticorpi contro il virus dell'epatite A (HAV) nel siero o nel plasma umano. Sommario Il virus dell'epatite A (HAV) è un virus con
bioelisa HAV 3000-1097 96 tests Test ELISA per la determinazione degli anticorpi contro il virus dell'epatite A (HAV) nel siero o nel plasma umano. Sommario Il virus dell'epatite A (HAV) è un virus con
Scheda del protocollo QIAsymphony SP
 Scheda del protocollo QIAsymphony SP Protocollo DNA_Blood_400_V6_DSP Informazioni generali Per uso diagnostico in vitro. Questo protocollo è previsto per la purificazione del DNA genomico totale e mitocondriale
Scheda del protocollo QIAsymphony SP Protocollo DNA_Blood_400_V6_DSP Informazioni generali Per uso diagnostico in vitro. Questo protocollo è previsto per la purificazione del DNA genomico totale e mitocondriale
Striscia reattiva per β-chetone ematico
 FOGLIETTO ILLUSTRATIVO Striscia reattiva per β-chetone ematico AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori
FOGLIETTO ILLUSTRATIVO Striscia reattiva per β-chetone ematico AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori
HCV Ab PLUS x 50. HCV Ab PLUS CALIBRATORS HCV Ab PLUS QC 34339
 ACCESS Immunoassay System HCV Ab PLUS 34330 2 x 50 Individuazione qualitativa degli anticorpi anti-hcv nel siero e nel plasma umano mediante Access Immunoassay Systems. ACCESS Immunoassay System HCV Ab
ACCESS Immunoassay System HCV Ab PLUS 34330 2 x 50 Individuazione qualitativa degli anticorpi anti-hcv nel siero e nel plasma umano mediante Access Immunoassay Systems. ACCESS Immunoassay System HCV Ab
ISTRUZIONE DI LAVORO IL CAMPIONAMENTO ACQUE AD USO POTABILE
 ISTRUZIONE DI LAVORO IL 5.7.01 CAMPIONAMENTO ACQUE AD USO POTABILE Redatto da: RSQ Firma Verificato e Approvato da: RD Firma RSQ/RD Ed 04 del 24/03/2015 Pag 1/5 OGGETTO La presente Istruzione di Lavoro
ISTRUZIONE DI LAVORO IL 5.7.01 CAMPIONAMENTO ACQUE AD USO POTABILE Redatto da: RSQ Firma Verificato e Approvato da: RD Firma RSQ/RD Ed 04 del 24/03/2015 Pag 1/5 OGGETTO La presente Istruzione di Lavoro
VEDI CAMBI RISALTATI. Componenti 1. MCPL MICROPIASTRA: 12 x 8 pozzetti ricoperti con antigene di CMV inattivato. Pozzetti separabili singolarmente.
 VEDI CAMBI RISALTATI bioelisa CMV colour 2.0 3000-1249 96 tests 3000-1250 480 tests Test ELISA per la determinazione di anticorpi contro il Citomegalovirus in siero o plasma umano. Sommario Il Citomegalovirus
VEDI CAMBI RISALTATI bioelisa CMV colour 2.0 3000-1249 96 tests 3000-1250 480 tests Test ELISA per la determinazione di anticorpi contro il Citomegalovirus in siero o plasma umano. Sommario Il Citomegalovirus
Immunologia e Immunologia Diagnostica TECNICHE IMMUNOLOGICHE
 Immunologia e Immunologia Diagnostica TECNICHE IMMUNOLOGICHE Tecniche di laboratorio La maggior parte delle tecniche di laboratorio biomedico si basano sull utilizzo degli anticorpi. Gli anticorpi sono
Immunologia e Immunologia Diagnostica TECNICHE IMMUNOLOGICHE Tecniche di laboratorio La maggior parte delle tecniche di laboratorio biomedico si basano sull utilizzo degli anticorpi. Gli anticorpi sono
Anti-Jka, Anti-Jkb coombs
 Scheda Tecnica 0123 Technical File No.: 3 Prodotto: Anti-Jka, Anti-Jkb coombs Categoria di prodotto secondo la classificazione CE: Allegato II Lista B Struttura della scheda tecnica Descrizione del prodotto:
Scheda Tecnica 0123 Technical File No.: 3 Prodotto: Anti-Jka, Anti-Jkb coombs Categoria di prodotto secondo la classificazione CE: Allegato II Lista B Struttura della scheda tecnica Descrizione del prodotto:
ALLflow Elution Technologies Milk Proteins Rapid Test
 ALLflow Elution Technologies Milk Proteins Rapid Test Lateral Flow kit Cat. N. ETMILK-1004 Kit per la rilevazione rapida delle proteine del latte in campioni alimentari ed ambientali Manuale d uso Leggere
ALLflow Elution Technologies Milk Proteins Rapid Test Lateral Flow kit Cat. N. ETMILK-1004 Kit per la rilevazione rapida delle proteine del latte in campioni alimentari ed ambientali Manuale d uso Leggere
Allegato 7 FT /7 Rev Pagina 1/5
 Allegato 7 FT 244012/7 Rev. 0 2003.03 Pagina 1/5 Data di compilazione: 2003-MAR 01 1 IDENTIFICAZIONE DELLA SOSTANZA/PREPARATO E DELLE SOCIETA Identificazione della sostanza o del preparato Nome commerciale
Allegato 7 FT 244012/7 Rev. 0 2003.03 Pagina 1/5 Data di compilazione: 2003-MAR 01 1 IDENTIFICAZIONE DELLA SOSTANZA/PREPARATO E DELLE SOCIETA Identificazione della sostanza o del preparato Nome commerciale
RIDASCREEN. Aflatoxin Total. Test immunoenzimatico per il dosaggio quantitativo di aflatossine. Art. No.: R4701. Test in vitro Conservare a 2-8 C
 RIDASCREEN Aflatoxin Total Test immunoenzimatico per il dosaggio quantitativo di aflatossine Art. No.: R4701 Test in vitro Conservare a 2-8 C R-Biopharm AG, Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0
RIDASCREEN Aflatoxin Total Test immunoenzimatico per il dosaggio quantitativo di aflatossine Art. No.: R4701 Test in vitro Conservare a 2-8 C R-Biopharm AG, Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0
Kit ELISA per IgG / IgM anti-cmv
 Kit ELISA per IgG / IgM anti-cmv N articolo: EC113.00 N articolo: EC113L60 (standard IgG per liquor) Codice colore: giallo / trasparente SOLO PER USO DIAGNOSTICO IN VITRO Sekisui Virotech GmbH Löwenplatz
Kit ELISA per IgG / IgM anti-cmv N articolo: EC113.00 N articolo: EC113L60 (standard IgG per liquor) Codice colore: giallo / trasparente SOLO PER USO DIAGNOSTICO IN VITRO Sekisui Virotech GmbH Löwenplatz
IO-TR-010 Determinazione Manuale degli antigeni AB0 fenotipo Rh antigene Kell
 Unità emittente SGQ Unità destinataria DIR TAL IMM Udr CQB SGQ BSCS SGA LAB CRIO CAR CR X X X X X X X X X X X X REDATTO Dott.ssa M. Ferraro 12/06/2014 REVISIONATO Dott. F. Buscemi APPROVATO Dott. F. Buscemi
Unità emittente SGQ Unità destinataria DIR TAL IMM Udr CQB SGQ BSCS SGA LAB CRIO CAR CR X X X X X X X X X X X X REDATTO Dott.ssa M. Ferraro 12/06/2014 REVISIONATO Dott. F. Buscemi APPROVATO Dott. F. Buscemi
Per la conservazione viene aggiunta sodio azide a una concentrazione finale inferiore allo 0,1 %.
 Scheda Tecnica 0123 Technical File No.: 20 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-Cw monoclonale umano IgM Allegato III Autocertificazione del produttore Struttura della scheda
Scheda Tecnica 0123 Technical File No.: 20 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-Cw monoclonale umano IgM Allegato III Autocertificazione del produttore Struttura della scheda
Istruzioni per l uso di BVPro
 Numero di catalogo: MBVP15 per confezione da 5 e MBVP125 per confezione da 25 Istruzioni per l uso di BVPro BVPro Test diagnostico rapido per la determinazione di vaginosi batterica (VB). Per uso professionale.
Numero di catalogo: MBVP15 per confezione da 5 e MBVP125 per confezione da 25 Istruzioni per l uso di BVPro BVPro Test diagnostico rapido per la determinazione di vaginosi batterica (VB). Per uso professionale.
PLATELIA Aspergillus IgG TESTS
 PLATELIA Aspergillus IgG 62783 96 TESTS DETERMINAZIONE DEGLI ANTICORPI IgG ANTI- ASPERGILLUS NEL SIERO O NEL PLASMA UMANO MEDIANTE METODO IMMUNOENZIMATICO 1- SCOPO DEL TEST Platelia Aspergillus IgG è test
PLATELIA Aspergillus IgG 62783 96 TESTS DETERMINAZIONE DEGLI ANTICORPI IgG ANTI- ASPERGILLUS NEL SIERO O NEL PLASMA UMANO MEDIANTE METODO IMMUNOENZIMATICO 1- SCOPO DEL TEST Platelia Aspergillus IgG è test
WITNESS PARVO INTRODUZIONE
 WITNESS PARVO WITNESS PARVO INTRODUZIONE Il Parvovirus canino (CPV) appartiene ad un sottogruppo del parvovirus felino. È in stretto rapporto col virus della panleucopenia felina e col virus dell'enterite
WITNESS PARVO WITNESS PARVO INTRODUZIONE Il Parvovirus canino (CPV) appartiene ad un sottogruppo del parvovirus felino. È in stretto rapporto col virus della panleucopenia felina e col virus dell'enterite
Allegato C al Decreto n. 108 del pag. 1/7
 giunta regionale Allegato C al Decreto n. 108 del 23.12.2015 pag. 1/7 R E G I O N E V E N E T O Segreteria Regionale per la Sanità Coordinamento Regionale Acquisti per la Sanità LOTTO N. 1 FORNITURA DI
giunta regionale Allegato C al Decreto n. 108 del 23.12.2015 pag. 1/7 R E G I O N E V E N E T O Segreteria Regionale per la Sanità Coordinamento Regionale Acquisti per la Sanità LOTTO N. 1 FORNITURA DI
RIDASCREEN. Nitrofuran (AHD) Test immunoenzimatico per l analisi quantitativa di AHD. Art. No.: R3713. Test in vitro Conservare a 2-8 C
 RIDASCREEN Nitrofuran (AHD) Test immunoenzimatico per l analisi quantitativa di AHD Art. No.: R3713 Test in vitro Conservare a 2-8 C R-Biopharm AG, Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0 / Telefax:
RIDASCREEN Nitrofuran (AHD) Test immunoenzimatico per l analisi quantitativa di AHD Art. No.: R3713 Test in vitro Conservare a 2-8 C R-Biopharm AG, Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0 / Telefax:
PLATELIA HSV 2 IgG 96 TEST 72821
 PLATELIA HSV 2 IgG 96 TEST 72821 DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgG ANTI-HSV 2 NEL SIERO O NEL PLASMA UMANO MEDIANTE IMMUNODOSAGGIO ENZIMATICO 1. USO PREVISTO Platelia HSV 2 IgG è un immunodosaggio
PLATELIA HSV 2 IgG 96 TEST 72821 DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgG ANTI-HSV 2 NEL SIERO O NEL PLASMA UMANO MEDIANTE IMMUNODOSAGGIO ENZIMATICO 1. USO PREVISTO Platelia HSV 2 IgG è un immunodosaggio
 ACIDITA su burro, margarine, panna e grassi semilavorati PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA PREPARAZIONE DEL CAMPIONE CONDIZIONI DI REAZIONE (Edit) Gli acidi grassi del campione, in
ACIDITA su burro, margarine, panna e grassi semilavorati PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA PREPARAZIONE DEL CAMPIONE CONDIZIONI DI REAZIONE (Edit) Gli acidi grassi del campione, in
il laboratorio in una provetta
 MANUALE D USO REV 03/12/2008 MBS--HACCP&ACQUE EASY TEST METODO COLORIIMETRIICO RAPIIDO PER ANALIISII MIICROBIIOLOGIICHE MANUALE D USO MBS-HACCP&ACQUE Easy test: il laboratorio in una provetta 1.1 Caratteristiche
MANUALE D USO REV 03/12/2008 MBS--HACCP&ACQUE EASY TEST METODO COLORIIMETRIICO RAPIIDO PER ANALIISII MIICROBIIOLOGIICHE MANUALE D USO MBS-HACCP&ACQUE Easy test: il laboratorio in una provetta 1.1 Caratteristiche
TROPONINA (compreso tra gli esami urgenti)
 MODALITA' DI RICHIESTA: Pazienti interni: tramite modulo interno prestampato. Pazienti esterni: tramite richiesta del medico curante. TROPONINA (compreso tra gli esami urgenti) PREPARAZIONE DEL PAZIENTE
MODALITA' DI RICHIESTA: Pazienti interni: tramite modulo interno prestampato. Pazienti esterni: tramite richiesta del medico curante. TROPONINA (compreso tra gli esami urgenti) PREPARAZIONE DEL PAZIENTE
RISOLUZIONE ENO 25/2004
 DICARBONATO DI DIMETILE (DMDC) L'ASSEMBLEA GENERALE, Visto l'articolo 2 paragrafo 2 iv dell'accordo del 3 aprile 2001 che istituisce l'organizzazione internazionale della vigna e del vino Su proposta della
DICARBONATO DI DIMETILE (DMDC) L'ASSEMBLEA GENERALE, Visto l'articolo 2 paragrafo 2 iv dell'accordo del 3 aprile 2001 che istituisce l'organizzazione internazionale della vigna e del vino Su proposta della
Kit artus HBV QS-RGQ. Caratteristiche delle prestazioni. Maggio Sample & Assay Technologies. Sensibilità analitica plasma
 Kit artus HBV QS-RGQ Caratteristiche delle prestazioni Kit artus HBV QS-RGQ, versione 1, 4506363, 4506366 Prima di eseguire il test, verificare la disponibilità delle nuove revisioni delle etichette elettroniche
Kit artus HBV QS-RGQ Caratteristiche delle prestazioni Kit artus HBV QS-RGQ, versione 1, 4506363, 4506366 Prima di eseguire il test, verificare la disponibilità delle nuove revisioni delle etichette elettroniche
OSSIDAZIONI CON PERMANGANATO DI POTASSIO
 OSSIDAZIONI CON PERMANGANATO DI POTASSIO Il permanganato di potassio è agente ossidante forte di colore viola intenso. In soluzioni fortemente acide (ph ~1) è ridotto a Mn 2+ incolore. MnO 4 + 8H + + 5e
OSSIDAZIONI CON PERMANGANATO DI POTASSIO Il permanganato di potassio è agente ossidante forte di colore viola intenso. In soluzioni fortemente acide (ph ~1) è ridotto a Mn 2+ incolore. MnO 4 + 8H + + 5e
MONOLISA Anti-HCV PLUS Version 2
 MONOLISA Anti-HCV PLUS Version 2 1 piastra - 96 tests 72317 5 piastre - 480 tests 72318 KIT PER IL MONITORAGGIO DEGLI ANTICORPI ANTI-HCV (VIRUS DELL'EPATITE C) NEL NEL SIERO O NEL PLASMA UMANO MEDIANTE
MONOLISA Anti-HCV PLUS Version 2 1 piastra - 96 tests 72317 5 piastre - 480 tests 72318 KIT PER IL MONITORAGGIO DEGLI ANTICORPI ANTI-HCV (VIRUS DELL'EPATITE C) NEL NEL SIERO O NEL PLASMA UMANO MEDIANTE
Petrifilm Piastre per il conteggio di Enterobacteriaceae
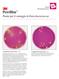 Guida all'interpretazione Petrifilm Piastre per il conteggio di Enterobacteriaceae 1 2 1 2 Conteggio di Enterobacteriaceae = 1 Il conteggio di Enterobacteriaceae è facile utilizzando le piastre Petrifilm
Guida all'interpretazione Petrifilm Piastre per il conteggio di Enterobacteriaceae 1 2 1 2 Conteggio di Enterobacteriaceae = 1 Il conteggio di Enterobacteriaceae è facile utilizzando le piastre Petrifilm
PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA TRATTAMENTO DEL CAMPIONE
 PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA TRATTAMENTO DEL CAMPIONE ACIDO L-LATTICO su uova L acido L-lattico reagisce, per via enzimatica, con un derivato fenolico e induce la formazione di
PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA TRATTAMENTO DEL CAMPIONE ACIDO L-LATTICO su uova L acido L-lattico reagisce, per via enzimatica, con un derivato fenolico e induce la formazione di
Test ELISA per IgG/IgM - set IgA anti Candida albicans
 Test ELISA per IgG/IgM set IgA anti Candida albicans N articolo: EC111.00 (kit test IgG/IgM) EC111.08 (set IgA) Codice colore: marrone scuro SOLO PER USO DIAGNOSTICO IN VITRO Sekisui Virotech GmbH Löwenplatz
Test ELISA per IgG/IgM set IgA anti Candida albicans N articolo: EC111.00 (kit test IgG/IgM) EC111.08 (set IgA) Codice colore: marrone scuro SOLO PER USO DIAGNOSTICO IN VITRO Sekisui Virotech GmbH Löwenplatz
RIDASCREEN FAST DON SC Art. Nr. R5905
 RIDASCREEN FAST DON SC Art. Nr. R5905 Test immunoenzimatico per il dosaggio quantitativo di deossinivalenolo Federal Grain Inspection Services CERTIFICATE NO. FGIS 2014-052 Test in vitro Conservare a 2-8
RIDASCREEN FAST DON SC Art. Nr. R5905 Test immunoenzimatico per il dosaggio quantitativo di deossinivalenolo Federal Grain Inspection Services CERTIFICATE NO. FGIS 2014-052 Test in vitro Conservare a 2-8
LIFECODES Quik-ID Class II test
 ISTRUZIONI PER L USO LIFECODES Quik-ID Class II test REF C2ID IVD INDICE USO... 2 RIASSUNTO E SPIEGAZIONE... 2 PRINCIPIO... 2 REAGENTI... 2 AVVERTENZE... 3 PRECAUZIONI... 3 RACCOLTA CAMPIONI... 3 PROCEDURA...
ISTRUZIONI PER L USO LIFECODES Quik-ID Class II test REF C2ID IVD INDICE USO... 2 RIASSUNTO E SPIEGAZIONE... 2 PRINCIPIO... 2 REAGENTI... 2 AVVERTENZE... 3 PRECAUZIONI... 3 RACCOLTA CAMPIONI... 3 PROCEDURA...
BENZILPENICILLINA BENZATINICA PREPARAZIONE INIETTABILI. Benzilpenicillina Benzatinica polvere sterile per preparazioni iniettabili
 1 1 1 1 1 1 1 1 0 1 0 1 0 1 1 01/FU Maggio 00 Commenti entro il 0 Settembre 00 NOTA: Corretta in seguito ai commenti della Dott.ssa Mozzetti La monografia è stata revisionata per armonizzarla con le altre
1 1 1 1 1 1 1 1 0 1 0 1 0 1 1 01/FU Maggio 00 Commenti entro il 0 Settembre 00 NOTA: Corretta in seguito ai commenti della Dott.ssa Mozzetti La monografia è stata revisionata per armonizzarla con le altre
Istruzioni per la raccolta dei campioni per la conferma della diagnosi di morbillo, rosolia e parotite, e per la genotipizzazione virale
 ALLEGATO 4 Istruzioni per la raccolta dei campioni per la conferma della diagnosi di morbillo, rosolia e parotite, e per la genotipizzazione virale Per la conferma di laboratorio dei casi sospetti di morbillo
ALLEGATO 4 Istruzioni per la raccolta dei campioni per la conferma della diagnosi di morbillo, rosolia e parotite, e per la genotipizzazione virale Per la conferma di laboratorio dei casi sospetti di morbillo
Acido 3,5-dinitrosalicilico Glucosio Acido 3-amino-5-nitrosalicilico Acido gluconico (Incolore-giallo leggero)
 1 Determinazione di zuccheri riducenti e di amido in banana in relazione alle condizioni di conservazione (Corso di Fisiologia della produzione e della post-raccolta) In banana durante il processo di maturazione
1 Determinazione di zuccheri riducenti e di amido in banana in relazione alle condizioni di conservazione (Corso di Fisiologia della produzione e della post-raccolta) In banana durante il processo di maturazione
student_view0/chapter33/animation_quiz_1.html
 http://highered.mheducation.com/sites/0072556781/ student_view0/chapter33/animation_quiz_1.html Metti in ordine le reazioni per i due tipi di test ELISA Indirect ELISA Sandwich ELISA Ricostruisci il test
http://highered.mheducation.com/sites/0072556781/ student_view0/chapter33/animation_quiz_1.html Metti in ordine le reazioni per i due tipi di test ELISA Indirect ELISA Sandwich ELISA Ricostruisci il test
Dispositivo di prelievo Aptima Multitest Swab
 Uso previsto Il dispositivo di prelievo Aptima Multitest Swab è previsto per l uso con i test Aptima. Il dispositivo di prelievo Aptima Multitest Swab è previsto per l uso per la raccolta di campioni vaginali
Uso previsto Il dispositivo di prelievo Aptima Multitest Swab è previsto per l uso con i test Aptima. Il dispositivo di prelievo Aptima Multitest Swab è previsto per l uso per la raccolta di campioni vaginali
Determinazione di zuccheri riducenti e di amido in banana in relazione alle condizioni di conservazione
 1 Determinazione di zuccheri riducenti e di amido in banana in relazione alle condizioni di conservazione In banana durante il processo di maturazione avviene la trasformazione di amido in zuccheri riducenti
1 Determinazione di zuccheri riducenti e di amido in banana in relazione alle condizioni di conservazione In banana durante il processo di maturazione avviene la trasformazione di amido in zuccheri riducenti
Annexe III Autocertificazione del produttore
 Scheda Tecnica 0123 Technical File No.: 27 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-k (cellano) coombsreactive policlonale, umano IgG Annexe III Autocertificazione del produttore
Scheda Tecnica 0123 Technical File No.: 27 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-k (cellano) coombsreactive policlonale, umano IgG Annexe III Autocertificazione del produttore
Scheda del protocollo QIAsymphony SP
 Scheda del protocollo QIAsymphony SP Protocollo PC_AXpH_HC2_V1_DSP Uso previsto Per uso diagnostico in vitro. Questo protocollo è stato sviluppato per l uso con campioni cervicali conservati nella soluzione
Scheda del protocollo QIAsymphony SP Protocollo PC_AXpH_HC2_V1_DSP Uso previsto Per uso diagnostico in vitro. Questo protocollo è stato sviluppato per l uso con campioni cervicali conservati nella soluzione
AMPICILLINA SODICA PREPARAZIONE INIETTABILE. Ampicillina sodica polvere sterile per preparazioni iniettabili
 1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
Per la conservazione viene aggiunta sodio azide a una concentrazione finale inferiore allo 0,1%.
 Scheda Tecnica 0123 Technical File No.: 21 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-S monoclonale (Sistema MNSs) Allegato III Autocertificazione del produttore Struttura della
Scheda Tecnica 0123 Technical File No.: 21 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-S monoclonale (Sistema MNSs) Allegato III Autocertificazione del produttore Struttura della
Lavaggio degli eritrociti
 1 Lavaggio degli eritrociti Le attività emolitica ed emoagglutinante del virus Sendai richiedono una soluzione di eritrociti umani lavati in tampone PBS e diluiti al 2% (v/v). Reagenti Sangue umano fresco.
1 Lavaggio degli eritrociti Le attività emolitica ed emoagglutinante del virus Sendai richiedono una soluzione di eritrociti umani lavati in tampone PBS e diluiti al 2% (v/v). Reagenti Sangue umano fresco.
Tecniche diagnostiche
 TEST DIAGNOSTICI Tecniche diagnostiche Infezione corrente Isolamento dell agente eziologico Identificazione del materiale genetico dell agente eziologico Segni clinici Alterazioni patognomoniche Alterazioni
TEST DIAGNOSTICI Tecniche diagnostiche Infezione corrente Isolamento dell agente eziologico Identificazione del materiale genetico dell agente eziologico Segni clinici Alterazioni patognomoniche Alterazioni
GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA
 GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA Istruzioni Scrivere il proprio nome e cognome su questa pagina e sulla scheda delle risposte. Seguire le regole di sicurezza di laboratorio: se vengono
GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA Istruzioni Scrivere il proprio nome e cognome su questa pagina e sulla scheda delle risposte. Seguire le regole di sicurezza di laboratorio: se vengono
DETERMINAZIONE IMMUNOENZIMATICA DIRETTA DELL ANTIGENE CARCINOEMBRIONICO (CEA) NEL SIERO O PLASMA UMANO
 DETERMINAZIONE IMMUNOENZIMATICA DIRETTA DELL ANTIGENE CARCINOEMBRIONICO (CEA) NEL SIERO O PLASMA UMANO IE207 96 DET. USO DEL KIT Metodo immunoenzimatico per la determinazione quantitativa dell antgene
DETERMINAZIONE IMMUNOENZIMATICA DIRETTA DELL ANTIGENE CARCINOEMBRIONICO (CEA) NEL SIERO O PLASMA UMANO IE207 96 DET. USO DEL KIT Metodo immunoenzimatico per la determinazione quantitativa dell antgene
Manuale cattletype BHV1 ge Ab
 Luglio 2014 Manuale cattletype BHV1 ge Ab 5 (n di catalogo 270203) 20 (n di catalogo 270205) Per la rilevazione degli anticorpi anti-glicoproteina E dell'herpes virus bovino 1 Registrazione in conformità
Luglio 2014 Manuale cattletype BHV1 ge Ab 5 (n di catalogo 270203) 20 (n di catalogo 270205) Per la rilevazione degli anticorpi anti-glicoproteina E dell'herpes virus bovino 1 Registrazione in conformità
RING TEST NAZIONALE LEUCOSI BOVINA ENZOOTICA PER LA RICERCA DI ANTICORPI NEI CONFRONTI DEL VIRUS DELLA
 Istituto Zooprofilattico Sperimentale dell Umbria e delle Marche Centro di Referenza Nazionale per lo studio dei Retrovirus correlati alle patologie infettive dei Ruminanti RING TEST NAZIONALE PER LA RICERCA
Istituto Zooprofilattico Sperimentale dell Umbria e delle Marche Centro di Referenza Nazionale per lo studio dei Retrovirus correlati alle patologie infettive dei Ruminanti RING TEST NAZIONALE PER LA RICERCA
