MONOLISA HBs Ag ULTRA 1 Piastra - 96 tests Piastra tests 72348
|
|
|
- Mirella Bonelli
- 7 anni fa
- Visualizzazioni
Transcript
1 MONOLISA HBs Ag ULTRA 1 Piastra - 96 tests Piastra tests KIT PER LA RIVELAZIONE DELL'ANTIGENE DI SUPERFICIE DEL VIRUS DELL'EPATITE B MEDIANTE TECNICA DI IMMUNODOSAGGIO ENZIMATICO NEL SIERO O NEL PLASMA UMANO NUOVA VERSIONE DEL FOGLIETTO ILLUSTRATIVO! I cambiamenti di testo sono sottolineati in Grigio IVD Controllo di qualità del produttore Tutti i prodotti fabbricati e commercializzati dalla società Bio-Rad sono sottoposti ad un sistema di assicurazione di qualità dal ricevimento delle materie prime fino alla commercializzazione dei prodotti finiti. Ciascun lotto di prodotto finito è soggetto a un controllo di qualità e viene messo in commercio soltanto se risulta conforme ai criteri di approvazione. La documentazione relativa alla produzione e al controllo di ciascun lotto è conservata negli archivi della nostra società. 49
2 SOMMARIO 1 - SCOPO DEL DOSAGGIO 2 - INTERESSE CLINICO 3 - PRINCIPIO DEL TEST MONOLISA HBs Ag ULTRA 4 - COMPOSIZIONE DEL KIT MONOLISA HBs Ag ULTRA 5 - PRECAUZIONI 6 - ISTRUZIONI PER L'IGIENE E LA SICUREZZA 7 - MATERIALE NECESSARIO, MA NON FORNITO 8 - PREPARAZIONE DEI REAGENTI 9 - CONSERVAZIONE - VALIDITÀ 10 - CAMPIONI 11 - PROCEDURA OPERATIVA 12 - ADATTAMENTO 13 - CALCOLO ED INTERPRETAZIONE DEI RISULTATI 14 - VERIFICA SPETTROFOTOMETRICA DEL DEPOSITO DEI CAMPIONI E DEL CONIUGATO 15 - PERFORMANCE 16 - LIMITI DEL TEST 17 - BIBLIOGRAFIA 50
3 1 - SCOPO DEL DOSAGGIO MONOLISA HBs Ag ULTRA è una tecnica di immunodosaggio enzimatico di tipo "sandwich" in 1 passaggio, per la rivelazione dell'antigene di superficie del virus dell'epatite B (Ag HBs) nel siero o nel plasma umano. 2 - INTERESSE CLINICO La presenza dell'ag HBs nel siero è sintomatica di un'infezione da virus dell'epatite B. Questo antigene è il primo marker a manifestarsi e può precedere di 2-3 settimane i segni clinici e biologici della malattia. La sua presenza può essere di breve (qualche giorno) o di lunga durata (diversi anni). Superati i 6 mesi di persistenza dell'ag HBs, l'epatite è classificata come "cronica". Il numero elevato di portatori cronici asintomatici fa sì che l'epatite B rappresenti un rischio trasfusionale di notevole importanza. La prevenzione della trasmissione si basa sull'individuazione dell'ag HBs ad ogni donazione di sangue. 3 - PRINCIPIO DEL TEST MONOLISA HBs Ag ULTRA MONOLISA HBs Ag ULTRA è una tecnica di immunodosaggio enzimatico di tipo "sandwich" a 1 passaggio, che utilizza anticorpi monoclonali e anticorpi policlonali selezionati per la loro capacità di legarsi ai diversi sotto-tipi dell'ag HBs, attualmente riconosciuti dall'oms, e alla maggior parte dei ceppi variant dell'epatite B. La fase solida del test MONOLISA HBs Ag ULTRA è sensibilizzata con anticorpi monoclonali. I coniugati del MONOLISA HBs Ag ULTRA si basano sull'impiego degli anticorpi monoclonali di topo e degli anticorpi policlonali di capra contro l'ag HBs. Detti anticorpi sono legati alla perossidasi. Il dosaggio comprende le seguenti fasi : 1) Distribuzione dei campioni e dei sieri di controllo nei pozzetti della micropiastra. Detta distribuzione può essere controllata visivamente : infatti vi è una differenza evidente tra la colorazione di un pozzetto vuoto e quella di un pozzetto contenente un campione. È altresì possibile verificarla mediante lettura spettrofotometrica a 490/ nm (facoltativo). 2) Distribuzione del coniugato Anche questa distribuzione può essere controllata visivamente : infatti, dopo aver aggiunto il coniugato inizialmente rosso, il pozzetto assume una colorazione rossa. È possibile verificarla mediante lettura spettrofotometrica a 490/ nm (facoltativo); a questo stadio della manipolazione è possibile controllare anche la distribuzione dei campioni mediante lettura spettrofotometrica a 490/ nm. 3) Al termine dell'incubazione di un'ora e mezza a 37 C, il coniugato non legato viene eliminato mediante lavaggio. 4) Distribuzione della soluzione di rivelazione dell'attività enzimatica. Anche questa distribuzione può essere controllata visivamente : vi è una differenza evidente tra la colorazione di un pozzetto vuoto e quella di un pozzetto contenente il substrato di colore rosa. È altresì possibile verificarla mediante lettura spettrofotometrica a 490 nm (facoltativo). 5) Dopo un'incubazione di 30 minuti in presenza del substrato, al riparo dalla luce e a temperatura ambiente (18-30 C), la presenza del coniugato viene rivelata da un cambiamento di colore. 6) Distribuzione della soluzione di arresto. Anche questa distribuzione può essere controllata visivamente: La colorazione del substrato, rosa (per i campioni negativi) o blu (per i campioni positivi), scompare dai pozzetti che diventano incolori (per i campioni negativi) o gialli (per i campioni positivi) in seguito ad addizione della soluzione di arresto. 7) Lettura delle densità ottiche a 450/ nm e interpretazione dei risultati. 51
4 4 - COMPOSIZIONE DEL KIT MONOLISA HBs Ag ULTRA Tutti i reagenti sono destinati esclusivamente all'uso diagnostico in vitro. ETICHETTATURA NATURA DEI REAGENTI PRESENTAZIONE R1 MICROPIASTRA : 12 strip da 8 pozzetti sensibilizzati 1 piastra 5 piastre con anticorpi monoclonali anti-hbs (topo). R2 SOLUZIONE DI LAVAGGIO concentrata (10 volte) 1 flacon 2 flaconi Tampone tris NaCl, ph = 7,4 100 ml 2 x 250 ml Conservante : Sodio mertiolato 0,01 % R3 CONTROLLO NEGATIVO 2 flaconi 2 flaconi Tampone Tris HCl, contenente BSA. 2 x 2,5 ml 2 x 2,5 ml Conservante : ProClin TM 300 (0,1 %) R4 CONTROLLO POSITIVO (Umano) 1 flacone 1 flaconi Tampone Tris HCl, contenente BSA, addizionato di 2.5 ml 2,5 ml una miscela di Ag HBs purificati da sotto-tipi ad e ay (umani). Conservante : ProClin TM 300 (0,1 %) R6 DILUENTE CONIUGATO : Tampone Tris HCl ph 7,4 1 flacon 2 flaconi addizionato con BSA, Tween 20, immunoglobuline di 8 ml 2 x 18 ml bovino e topo e con un indicatore colorato di controllo del deposito Conservante : Ciprofloxacina (10 µg/ml), ProClin TM 300 (0,1 %) R7 CONIUGATO 1 flacone 2 flaconi Anticorpi monoclonali anti-hbs di topo e anticorpi qsp 8 ml qsp 2 x 18 ml policlonali anti-hbs di capra legati allaperossidasi. Liofilizzat R8 TAMPONE SUBSTRATO DELLA PEROSSIDASI 1 flacone 2 flaconi Soluzione di acido citrico e acetato di sodio ph 4,0 60 ml 2 x 60 ml contenente lo 0,015% di H 2 O 2 e il 4% di dimetilsolfossido (DMSO). R9 CROMOGENO di colore rosa 1 flacone 2 flaconi Soluzione contenente tetrametil benzidina (TMB) 5 ml 2 x 5 ml R10 SOLUZIONE DI ARRESTO 1 flacone 3 flaconi Soluzione di acido solforico 1N 28 ml 3 x 28 ml ALTRO FOGLI ADESIVI x 4 x PRECAUZIONI La qualità dei risultati dipende dal rispetto delle buone pratiche di laboratorio di seguito riportate : Sul telaio di ciascuna micropiastra sono riportati sia il nome del test sia un numero di identificazione specifico del test. Tale numero di identificazione specifico si trova anche su ciascuna strip. MONOLISA HBs Ag ULTRA : Numero specifico di identificazione = 51. Questo numero di identificazione deve essere controllato prima di ciascun utilizzo. Qualunque strip priva del numero di test o in cui il numero è diverso da quello sopra indicato, non deve essere utilizzata. Non utilizzare reagenti scaduti. Non mescolare reagenti di lotti diversi durante uno stesso test. NOTA : È possibile utilizzare altri lotti di soluzione di lavaggio (R2, indicata con 10 x in blu sull etichetta), di tampone substrato (R8, indicato con TMB buf. in blu), di cromogeno (R9, indicato con TMB 11 x in viola) e di soluzione di arresto (R10, indicata con 1N in rosso) diversi da quelli inclusi nel kit con riserva di utilizzare un solo e unico lotto nel corso dello stesso test. Detti reattivi possono essere altresì utilizzati con altri prodotti BIO-RAD. Contattare il nostro servizio tecnico per informazioni dettagliate. Prima dell'utilizzo, attendere 30 minuti affinché i reagenti si riportino alla temperatura ambiente (18-30 C) e un'ora per la soluzione di lavaggio diluita (R2). Ricostituire con cura i reagenti evitando qualunque contaminazione. 52
5 Non eseguire il test in presenza di vapori reattivi (acidi, alcalini, aldeidi) o di polveri che potrebbero alterare l'attività enzimatica del coniugato. Utilizzare recipienti di vetro perfettamente lavati e risciacquati con acqua distillata o preferire materiale mono-uso. Non lasciare che la micropiastra si asciughi tra la fine del lavaggio e la distribuzione dei reagenti. La reazione enzimatica è molto sensibile a tutti i metalli o ioni metallici. Di conseguenza, nessun elemento metallico deve venire a contatto con le diverse soluzioni contenenti il coniugato o la soluzione substrato. La soluzione di rivelazione (tampone substrato + cromogeno) deve essere di colore rosa. La presenza di una colorazione diversa nei minuti successivi alla ricostituzione indica che il reagente è inutilizzabile e deve essere sostituito. Per questa preparazione utilizzare preferibilmente recipienti e materiale in plastica mono-uso distribuiti in commercio o recipienti in vetro precedentemente lavati con acido cloridrico 1N, risciacquati con acqua distillata e asciugati. Conservare la soluzione al riparo dalla luce. Utilizzare un puntale di distribuzione nuovo per ciascun siero. Il lavaggio dei pozzetti costituisce una fase essenziale della manipolazione: rispettare il numero di cicli di lavaggio prescritti e assicurarsi che tutti i pozzetti siano completamente riempiti, poi svuotarli del tutto. Un lavaggio eseguito male può produrre risultati errati. Non utilizzare mai lo stesso recipiente per distribuire il coniugato e la soluzione di rivelazione. Verificare l'esattezza e la precisione delle pipette e il buon funzionamento degli strumenti utilizzati. Non modificare il protocollo operativo. 6 - ISTRUZIONI PER L'IGIENE E LA SICUREZZA Tutti i reagenti del kit sono destinati all'uso diagnostico "in vitro". Indossare guanti mono-uso per maneggiare i reagenti e i campioni e lavarsi le mani con cura dopo la manipolazione. Non "pipettare" con la bocca Il controllo positivo (R4) contiene l'ag HBs di sotto-tipo ad e ay purificati a partire da plasma umani negativi agli anticorpi anti-hiv1 e 2 e agli anticorpi anti-hcv, e inattivati dal calore. Poiché nessun metodo può dare la certezza assoluta dell assenza dei virus HIV, HBV, HCV o di altri agenti infettivi, considerare sia i reagenti di origine umana sia i campioni prelevati dai pazienti come potenzialmente infettivi e maneggiarli con le precauzioni d uso. Considerare sia il materiale a diretto contatto con i campioni sia i reagenti di origine umana sia le soluzioni di lavaggio come prodotti contaminati. Evitare schizzi di campioni o di soluzioni che li contengono. Le superfici sporche devono essere pulite con candeggina diluita al 10%. Se il liquido contaminante è un acido, le superfici sporche devono essere neutralizzate preventivamente con bicarbonato di sodio, poi lavate con candeggina e asciugate con carta assorbente. Il materiale utilizzato per pulire dovrà essere gettato in un contenitore speciale per residui contaminati. I campioni, i reagenti di origine umana come pure il materiale e i prodotti contaminati devono essere eliminati dopo essere stati decontaminati : -- o immergendoli in candeggina a concentrazione finale del 5% di ipoclorito di sodio (1 volume di candeggina per 10 volumi di liquido contaminato o acqua) per 30 minuti, -- oppure mediante autoclavaggio a 121 C per almeno 2 ore. L'autoclave è il metodo migliore per inattivare i virus HIV e HBV. ATTENZIONE: NON INTRODURRE NELL'AUTOCLAVE SOLUZIONI CONTENENTI IPOCLORITO DI SODIO. Non dimenticare di neutralizzare e/o autoclavare le soluzioni o i residui di lavaggio o qualunque liquido contenente campioni biologici prima di eliminarli nel lavello. La scheda con i dati relativi alla sicurezza è disponibile su richiesta. La manipolazione e l eliminazione dei prodotti chimici devono essere effettuate attenendosi alle buone pratiche di laboratorio. Evitare qualunque contatto del tampone substrato, del cromogeno e della soluzione di arresto con la pelle e le mucose (tossicità, irritazioni e bruciature). Certi reattivi contengono ProClin 300 (0,1%) Xi Irritante R43 : può comportare una sensibilizzazione per contatto con la pelle S28-37: Dopo contatto con la pelle, lavare abbondantemente con sapone ed acqua. Utilizzare appositi guanti 53
6 7 - MATERIALE NECESSARIO, MA NON FORNITO Acqua distillata. Ipoclorito di sodio (candeggina) e bicarbonato di sodio. Pipette automatiche o semi-automatiche regolabili o fisse atte a distribuire 50 µl, 100 µl, 1000 µl e 10 ml. Provette graduate da 100 ml e 1000 ml. Contenitore per rifiuti contaminati. Bagnomaria o incubatore a secco*, eventualmente dotato di termostato a 37 C ± 1 C*. Sistema di lavaggio automatico*, semi-automatico* o manuale per micropiastre. Apparecchio per la lettura* di micropiastre dotato di filtri da 450, 490 e nm. Carta assorbente (*) Consultateci per informazioni precise riguardo agli apparecchi approvati dai nostri servizi tecnici 8 - PREPARAZIONE DEI REAGENTI Lasciare che i reagenti del kit MONOLISA Ag HBs ULTRA si riportino a temperatura ambiente (18-30 C) prima dell'utilizzo. 1) Reagenti pronti per l'uso Reagente 1 (R1) : Micropiastra Ciascun telaio supporto contenente 12 strip è confezionato in una bustina ZIP. Tagliare la bustina con le forbici o un taglierino ad una distanza di 0,5-1 cm sotto la ZIP. Aprire la bustina ed estrarre il telaio. Riporre nella bustina le strip inutilizzate. Richiudere la bustina con cura e riporla a +2-8 C. Reagente 3 (R3) : Controllo Negativo Reagente 4 (R4) : Controllo Positivo Reagente 10 (R10) : Soluzione di arresto 2) Reagenti da ricostituire Soluzione di lavaggio (concentrata 10x) : Reagente 2 (R2) Diluire a 1/10 la soluzione di lavaggio R2 in acqua distillata. Preparare 80 ml per una micropiastra da 12 strip. Coniugato (R6 + R7) Picchiettare leggermente il flacone di coniugato liofilizzato (R7) sul gocciolatoio per staccare eventuali sostanze rimaste attaccate al tappo di gomma. Aprire il flacone di coniugato liofilizzato (R7) e travasarvi il contenuto di un flacone di diluente per coniugato (R6). Richiudere il flacone e lasciar riposare per 10 minuti mescolando di tanto in tanto per agevolare la dissoluzione. Soluzione di rivelazione enzimatica (R8 + R9) Diluire il reagente R9 nel reagente R8 in proporzioni pari a 1/11 (esempio : 1 ml di reagente R9 in 10 ml di reagente R8) sapendo che per l'analisi di 12 strip sono necessari e sufficienti 10 ml. Questa soluzione rimane stabile per 6 ore al riparo dalla luce. Omogeneizzare. 9 - CONSERVAZIONE - VALIDITÀ Prima dell'utilizzo il kit deve essere conservato a C. Una volta aperto, ciascun componente del kit MONOLISA HBs Ag ULTRA conservato a +2-8 C può essere utilizzato fino alla data di scadenza indicata sulla confezione, salvo diversa indicazione specifica : R1 : Una volta aperta la bustina, le strip conservate a +2-8 C nella loro bustina originaria ben chiusa rimangono stabili per 1 mese. R2 : Dopo la diluizione, la soluzione di lavaggio si conserva per 2 settimane a +2-8 C. La soluzione di lavaggio concentrata può essere conservata a C fino alla data di scadenza. R6 + R7 : La soluzione di coniugato può essere conservata a C per 1 mese e rimane stabile a temperatura ambiente (18-30 C) per 8 ore. R8 + R9 : Una volta ricostituita, la soluzione di rivelazione può essere conservata per 6 ore al riparo dalla luce e a temperatura ambiente ( C) CAMPIONI Prelevare un campione di sangue secondo le pratiche d'uso. I test vengono eseguiti su campioni non diluiti di siero o di plasma (prelevati con anticoagulanti come EDTA, eparina, citrato, ACD). Estrarre il siero o il plasma dal coagulo o dai globuli rossi non appena possibile per evitare emolisi. Un emolisi molto evidente può avere ripercussioni sulle prestazioni del test. I campioni che presentano grumi devono essere chiarificati prima del test mediante centrifugazione. Le particelle o aggregati di fibrina in sospensione possono produrre risultati falsi positivi. 54
7 Se il monitoraggio è eseguito entro 7 giorni i campioni vanno conservati a C oppure possono essere congelati a - 20 C. Evitare cicli ripetuti di congelamento/scongelamento. Si raccomanda di non utilizzare i campioni sottoposti a più di tre cicli di congelamento/scongelamento. Se i campioni devono essere trasportati, imballarli secondo le normative vigenti in materia di trasporto di agenti eziologici e trasportarli preferibilmente congelati. NON UTILIZZARE SIERI CONTAMINATI, IPERLIPEMICI O IPEREMOLIZZATI. NOTA : Non sono state messe in evidenza interferenze nei campioni contenenti fino a 90 g/l di albumina, 100 mg/l di bilirubina, come pure nei campioni lipemici contenenti fino a 36 g/l di trioleina e nei campioni emolizzati contenenti fino a 1 g/l di emoglobina PROCEDURA OPERATIVA Attenersi rigorosamente al protocollo proposto. Utilizzare i controlli positivo (R4) e negativo (R3) per ciascuna serie di determinazioni per convalidare i risultati del test. Applicare le buone pratiche di laboratorio. 1) Stabilire accuratamente il piano di distribuzione e identificazione dei campioni. 2) Preparare la soluzione di lavaggio R2 (cfr. capitolo 8). 3) Preparare la soluzione di coniugato (R6 + R7) (cfr. capitolo 8). 4) Estrarre dall imballaggio di protezione il telaio supporto e il numero di strip (R1) necessarie. Rimettere le strip non utilizzate nell imballo e richiuderlo. 5) Dispensare nei pozzetti nell'ordine seguente (piano consigliato per le piastre): Pozzetti A1, B1, C1 e D1 : 100 µl di controllo negativo (R3) Pozzetto E1: 100 µl di controllo positivo (R4) Pozzetto F1: 100 µl del primo campione da testare se detto pozzetto non è utilizzato come pozzetto di controllo per la validazione del deposito dei campioni e del coniugato (facoltativo) Pozzetti G1, H1, ecc.: 100 µl di campioni da testare. In funzione del sistema utilizzato, è possibile modificare la posizione dei oppure l ordine di distribuzione dei controlli. NB : A questo stadio della manipolazione è possibile controllare la distribuzione dei campioni, infatti vi è una differenza evidente tra la colorazione di un pozzetto vuoto e quella di un pozzetto contenente un campione. (cfr. paragrafo 14 per il controllo automatico - VALIDAZIONE SPETTROFOTOMETRICA DEL DEPOSITO DEI CAMPIONI E DEL CONIUGATO) 6) Agitare la soluzione di coniugato prima dell'uso. Amalgamare. Distribuire rapidamente 50 µl della soluzione ricostituita di coniugato (R6 + R7) in tutti i pozzetti. Omogeneizzare la miscela di reazione. NB : A questo stadio della manipolazione è possibile controllare la distribuzione dei campioni nonché la distribuzione del coniugato anche visivamente: una volta aggiunto il coniugato, i pozzetti che contengono i campioni assumono una colorazione rossa. (cfr. paragrafo 14 per il controllo automatico - VALIDAZIONE SPETTROFOTOMETRICA DEL DEPOSITO DEI CAMPIONI E DEL CONIUGATO). 7) Se possibile, coprire con un film adesivo e incubare per 1 ora e 30 ± 5 minuti a 37 ± 1 C. 8) Staccare la pellicola adesiva, aspirare il contenuto di ciascun pozzetto e lavare almeno 5 volte. Accertarsi che il volume residuo non superi i 10 µl (eventualmente, asciugare la piastra capovolgendola su un foglio di carta assorbente). 9) Dispensare rapidamente in tutti i pozzetti 100 µl della soluzione di rivelazione dell'attività enzimatica (R8 + R9) preparata in precedenza. Lasciare che la reazione si sviluppi al buio per 30 ± 5 minuti a temperatura ambiente (18-30 C). Per questa incubazione, non utilizzare alcun film adesivo. N.B.: A questo stadio della manipolazione è possibile controllare visivamente la distribuzione della soluzione di rivelazione, che presenta una colorazione rosa. Vi è una differenza evidente tra la colorazione di un pozzetto vuoto e quella di un pozzetto contenente la soluzione di rivelazione rosa. (fare riferimento al paragrafo 14 per la verifica automatica VERIFICA SPETTROFOTOMETRICA DEL DEPOSITO DEI CAMPIONI E DEI REAGENTI). 10) Aggiungere 100 µl della soluzione di arresto (R10) seguendo la stessa sequenza e lo stesso ritmo di distribuzione come per la soluzione di rivelazione. Omogeneizzare la miscela di reazione. N.B.: A questo stadio della manipolazione è possibile controllare visivamente la distribuzione della soluzione di arresto, che è incolore. La colorazione del substrato, rosa (per i campioni negativi) o blu (per i campioni positivi), scompare dai pozzetti che diventano incolori (per i campioni negativi) o gialli (per i campioni positivi) in seguito ad addizione della soluzione di arresto. 55
8 11) Asciugare accuratamente la parte inferiore delle piastre. Attendere almeno 4 minuti dopo la distribuzione della soluzione di arresto prima della lettura e leggere la densità ottica a 450/620 nm per mezzo di un lettore di piastre, entro i 30 minuti successivi all arresto della reazione. 12) Verificare, prima della trascrizione dei risultati, la concordanza tra la lettura ed il piano di distribuzione e di identificazione delle piastre e dei campioni ADATTAMENTO LAVAGGIO : È indispensabile attenersi alle procedure di lavaggio al fine di ottenere dal test prestazioni ottimali. Per alcuni lavatori può essere necessario ottimizzare la procedura di lavaggio (aumento del numero di cicli di lavaggio e/o del volume di tampone di lavaggio per ogni ciclo, tempo di immersione) al fine di ottenere un livello accettabile di rumori di fondo (DO) per i campioni negativi. Consultateci per le procedure specifiche e gli adattamenti CALCOLO E INTERPRETAZIONE DEI RISULTATI 1) Calcolo della densità ottica media del controllo negativo : DO R3 Esempio Controllo negativo R3 DO 1 0, , , ,027 Totale DO R3 = 0,120 Totale DO R3 /4 = = media DO R3 2) Calcolo del valore-soglia Per ciascuna piastra, il valore-soglia è uguale a : DO R3 + 0,050 Esempio DO R3 = 0,030 Valore-soglia (VS) = 0, ,050 = 0,080 3) Condizioni per la validazione del test Tutti i valori del controllo negativo devono risultare inferiori o uguali a 0,080 unità di densità ottica. Il valore del controllo positivo (DO R4) deve essere superiore o uguale a 1,000. Se il valore del controllo negativo non rientra nella norma o risulta superiore di oltre il 40% rispetto alla media dei controlli negativi (DO R3), eliminarlo e ripetere il calcolo della media del controllo negativo sugli altri 3 valori. È possibile eliminare un solo valore. In caso di rumore di fondo molto basso per il controllo negativo R3 (media dei valori negativi R3 inferiori a 0.010) non utilizzare il criterio di rigetto per il controllo negativo R3. Se tutti i controlli risultano al di fuori dell'intervallo dei valori sopra riportati, il test deve essere rieseguito. 4) Calcolo dei rapporti Per ciascun campione calcolare il rapporto : DO campione Rapporto = VS 5) Interpretazione dei risultati I campioni che presentano un rapporto inferiore a 1 sono considerati negativi secondo il test MONOLISA Ag HBs ULTRA. I campioni che presentano un rapporto compreso tra 0,9 e 1 devono essere interpretati con prudenza. Si consiglia di ritestare in doppio i campioni corrispondenti qualora i sistemi utilizzati e le procedure di laboratorio lo consentano. I campioni che presentano un rapporto pari o superiore a 1 sono considerati inizialmente positivi e devono essere ritestati in doppio prima dell'interpretazione definitiva. Se, una volta ripetuto il dosaggio, per un campione il rapporto dei 2 doppietti risulta inferiore a 1, il risultato iniziale è non riproducibile e il campione viene dichiarato negativo in base al test MONOLISA HBs Ag ULTRA. Per i campioni iniziali reattivi oppure dubbi (0.9< indice<1), se, in seguito alla ripetizione del dosaggio, almeno un rapporto dei due doppietti risulta uguale o superiore a 1, il risultato iniziale è riproducibile e il campione viene dichiarato positivo secondo il test MONOLISA HBs Ag ULTRA, conformemente ai limiti descritti di seguito. I campioni ritestati in doppio e risultati negativi in base al test MONOLISA HBs Ag ULTRA, ma per i quali uno dei valori è prossimo al valore soglia (rapporto compreso tra 0,9 e 1) dovrebbero essere considerati con prudenza. Si consiglia di rieseguire il test per questi pazienti con un altro metodo o mediante un nuovo prelievo. In caso di DO molto basse per i campioni testati (DO negativa) e quando la presenza dei campioni nonchè dei 56
9 reattivi è controllata, i risultati possono essere interpretati come negativi. Al fine di verificare la specificità della reazione, qualunque campione risultato positivo secondo i criteri di interpretazione del test MONOLISA HBs Ag ULTRA dovrebbe essere confermato da una tecnica di neutralizzazione degli Ag HBs. Le reazioni non ripetibili sono spesso dovute a : Lavaggio inadeguato delle micropiastre. Contaminazione dei campioni negativi del siero o del plasma con un'alta concentrazione di Ag HBs. Contaminazione della soluzione di rivelazione da parte di agenti ossidanti (candeggina, ioni metallici, ecc.). Contaminazione della soluzione di arresto VERIFICA SPETTROFOTOMETRICA DEL DEPOSITO DEI CAMPIONI E DEL CONIUGATO Verifica del deposito dei campioni e del coniugato 1) Verifica del deposito dei campioni È possibile verificare la presenza dei campioni nei pozzetti prima della distribuzione del coniugato mediante lettura spettrofotometrica a 490/ nm : un pozzetto contenente un campione presenta una DO compresa tra 0,050 e 0,900. NOTA : vi è una differenza evidente tra la colorazione di un pozzetto vuoto trasparente e quella di un pozzetto contenente un campione. 2) Verifica del deposito del coniugato Qualora la presenza dei campioni sia stata verificata mediante esame spettrofotometrico come descritto in precedenza, l'aggiunta di coniugato può essere controllata mediante lettura spettrofotometrica a /700 nm : un pozzetto contenente coniugato presenta una DO superiore a 1,100. NOTA : I pozzetti contenti i campioni sono giallastri e diventano rossi in seguito ad addizione del coniugato colorato. 3) Verifica contemporanea del deposito dei campioni e del coniugato (soltanto mediante tecnica spettrofotometrica). Qualora la presenza dei campioni non sia stata verificata mediante lettura automatica, come descritto in precedenza, la presenza contemporanea dei campioni e del coniugato nei pozzetti può essere verificata mediante lettura automatica a 490/ nm, sempre che si disponga di un pozzetto con il solo coniugato. Il delta delle loro DO deve risultare superiore a 0,35 come specificato di seguito: [DO (campione + coniugato) - DO solo coniugato] 0,35 Verifica del deposito della soluzione di rivelazione È possibile verificare la presenza della soluzione di rivelazione rosa mediante lettura automatica a 490 nm : un pozzetto contenente la soluzione di rivelazione deve avere una densità ottica superiore a 0,100 (una DO inferiore indica una cattiva distribuzione della soluzione di rivelazione) PRESTAZIONI Le prestazioni del test MONOLISA HBs Ag ULTRA sono state determinate a partire da test eseguiti su campioni di donatori di sangue non selezionati, su campioni di pazienti ospedalizzati affetti da epatite B acuta ed epatite B cronica, su campioni di pazienti che presentano patologie senza alcuna relazione con il virus dell'epatite B, su campioni in commercio e panel di sieroconversione. La soglia di sensibilità è stata valutata a partire da un panel francese della SFTS e dallo standard dell'oms. Specificità La specificità in 9894 donatori di sangue non selezionati provenienti da 3 siti diversi è stata stimata pari al 99,94% (9887/9893). La reazione ripetuta di un campione è stata confermata positiva per l'ag HBs. Lo studio di specificità clinica è stato eseguito in un laboratorio ospedaliero (Centro di Epatologia). Su 200 campioni ospedalieri sottoposti a test, 2 campioni sono risultati ripetutamente reattivi (uno è risultato dubbio in prima intenzione (rapporto = 0,97) e positivo con un rapporto di 1,87 dopo ripetizione, l'altro con rapporti pari a 2,29 e 1,99). 289 pazienti che presentavano patologie o stati senza alcuna relazione con l'epatite B (donne in gravidanza, fattore reumatoide, Ig anti-nucleari, Ig topo o altre infezioni virali o batteriche) sono stati testati con MONOLISA HBs Ag ULTRA. 11 campioni risultati ripetutamente positivi sono stati controllati con un test EIA in commercio oltre che mediante un test di neutralizzazione. 10 degli 11 campioni ripetutamente positivi con MONOLISA HBs Ag ULTRA sono risultati positivi con il suddetto test Ag HBs EIA in commercio. Un campione è risultato non interpretabile con il test di neutralizzazione ed è stato eliminato dal calcolo finale; 2 campioni non sono stati neutralizzati : uno proveniente da un campione positivo all IgG HSV, l altro da un campione di mieloma anch esso risultato positivo con il test EIA in commercio impiegato per confronto portando ad una specificità pari al 99,28% (276/278). Gli altri 9 campioni positivi all IgG HSV e i 9 campioni di mieloma sono risultati negativi con il test MONOLISA HBs Ag ULTRA. 57
10 Sensibilità Analitica La soglia di sensibilità del test è stata stimata inferiore a 0,06 ng/ml di Ag HBs a partire dal panel francese SFTS 2001 e inferiore a 0,050 IU/ml per lo standard dell'oms. I seguenti sotto-tipi del panel SFTS 2001: adw2, adw4, adr, ayw1, ayw2, ayw3, ayw4, ayw5 e ayr sono risultati tutti positivi con un rapporto superiore a 5 con il test MONOLISA HBs Ag ULTRA. Sensibilità Gli studi di sensibilità realizzati su 428 campioni positivi provenienti dal follow-up di pazienti affetti da epatite B cronica e da epatite B acuta, hanno dimostrato una sensibilità pari al 100%. Un panel di 15 proteine ricombinanti che imitano le più importanti mutazioni nelle sequenze degli aminoacidi dell'ag HBs è stato testato ed individuato completamente con il test MONOLISA HBs Ag ULTRA. Un totale di 60 panel di sieroconversione di epatite B (293 campioni) in commercio è stato testato e paragonato a test di immunodosaggio enzimatico disponibili sul mercato. In 29 casi di sieroconversione MONOLISA HBs Ag ULTRA he dato risultati equivalenti al Monolisa HBs Ag Plus. In 28 casi di sieroconversione MONOLISA HBs Ag ULTRA ha rivelato le sieroconversioni con 1 prelievo di anticipo, in 2 casi con 2 prelievi di anticipo e in un caso con 5 prelievi di anticipo. Precisione La precisione del test MONOLISA HBs Ag ULTRA è stata determinata mediante l'analisi di 4 campioni : 1 campione negativo, 2 campioni positivi all'ag HBs (camp. 2 e 3) e 1 campione positivo alto all'ag HBs. La ripetibilità (intra-dosaggio) è stata valutata analizzando questi 4 campioni testati 30 volte nel corso della stessa manipolazione. La riproducibilità (inter-dosaggio) è stata valutata analizzando gli stessi 4 campioni testati in doppio per 20 giorni in ragione di 2 dosaggi indipendenti al giorno. I risultati sono riassunti nelle tabelle seguenti : Tabella 1 : Ripetibilità intra - dosaggio n = 30 camp 1 camp 2 camp 3 camp 4 media dei rapporti deviazione standard (SD) CV (%) rapporti % 3.83 % 3.77 % 6.19 % Tabella 2 : Riproducibilità inter - dosaggio n = 40 camp 1 camp 2 camp 3 camp 4 media dei rapporti deviazione standard (SD) CV (%) rapporti 18.1 % 8.2 % 9.36 % % 16 - LIMITI DEL TEST Un risultato negativo indica che il campione controllato non contiene Ag HBs individuabili tramite il test MONOLISA HBs Ag ULTRA. Tuttavia, nella misura in cui tassi notevolmente ridotti di Ag HBs possono non essere rivelati, un risultato simile non esclude la possibilità di infezione da virus dell'epatite B. Al fine di verificare la specificità della reazione, qualunque campione risultato positivo (secondo i criteri di interpretazione del test MONOLISA HBs Ag ULTRA) dovrebbe essere confermato da una tecnica di neutralizzazione degli Ag HBs eventualmente presenti nel campione (test Monolisa Ag HBs confirmation, codice 72208) Il metodo colorimetrico di verifica del deposito dei campioni e/o dei coniugati e/o della soluzione di rivelazione non consente di verificare l'esattezza dei volumi distribuiti ma soltanto di evidenziare la presenza di campioni e/o di coniugato. Il tasso di risposte errate ottenute con tale metodo è collegato alla precisione del sistema utilizzato (dei CV con cumuli di pipettaggio e di lettura superiori al 10% possono deteriorare significativamente la qualità di detta verifica). Nel caso di lavaggio inefficace in seguito alla fase di incubazione del coniugato, la verifica automatica della distribuzione della soluzione di rivelazione (mediante lettura a 490 nm delle densità ottiche dei pozzetti) può dare risultati errati con densità ottiche superiori a 0,100 in assenza di soluzione di rivelazione. Tuttavia questo fenomeno non è stato osservato nel corso delle valutazioni condotte su 939 campioni testati BIBLIOGRAFIA Vedere versione francese 58
MONOLISA Anti-HCV PLUS Version 2
 MONOLISA Anti-HCV PLUS Version 2 1 piastra - 96 tests 72317 5 piastre - 480 tests 72318 KIT PER IL MONITORAGGIO DEGLI ANTICORPI ANTI-HCV (VIRUS DELL'EPATITE C) NEL NEL SIERO O NEL PLASMA UMANO MEDIANTE
MONOLISA Anti-HCV PLUS Version 2 1 piastra - 96 tests 72317 5 piastre - 480 tests 72318 KIT PER IL MONITORAGGIO DEGLI ANTICORPI ANTI-HCV (VIRUS DELL'EPATITE C) NEL NEL SIERO O NEL PLASMA UMANO MEDIANTE
INGEZIM Gluten Quanti Test Guida all utilizzo
 INGEZIM Gluten Quanti Test Guida all utilizzo 1 - INTRODUZIONE Il kit è basato su un saggio immunoenzimatico ELISA di tipo sandwich come dettato dal Codex Alimentarius. Ogni pozzetto è rivestito sul fondo
INGEZIM Gluten Quanti Test Guida all utilizzo 1 - INTRODUZIONE Il kit è basato su un saggio immunoenzimatico ELISA di tipo sandwich come dettato dal Codex Alimentarius. Ogni pozzetto è rivestito sul fondo
ScanGel ABO Complete/RH/K Duo x 24 schede x 144 schede Schede ScanGel ABO Complete/RH1 Duo e ScanGel Monoclonal RH/K Phenotypes Duo
 ScanGel ABO Complete/RH/K Duo 86719 2 x 24 schede 86709 2 x 144 schede Schede ScanGel ABO Complete/RH1 Duo e ScanGel Monoclonal RH/K Phenotypes Duo GEL FORMULATI CON REAGENTI MONOCLONALI DI ORIGINE MURINA
ScanGel ABO Complete/RH/K Duo 86719 2 x 24 schede 86709 2 x 144 schede Schede ScanGel ABO Complete/RH1 Duo e ScanGel Monoclonal RH/K Phenotypes Duo GEL FORMULATI CON REAGENTI MONOCLONALI DI ORIGINE MURINA
URISTIKFIT LEV1 REF KCQURST1
 URISTIKFIT LEV1 REF KCQURST1 Per Uso Diagnostico In Vitro USO PREVISTO Il controllo URISTIKFIT è destinato all uso nel laboratorio clinico come materiale di controllo nelle procedure qualitative e semiquantitative
URISTIKFIT LEV1 REF KCQURST1 Per Uso Diagnostico In Vitro USO PREVISTO Il controllo URISTIKFIT è destinato all uso nel laboratorio clinico come materiale di controllo nelle procedure qualitative e semiquantitative
PLATELIA ASPERGILLUS IgG Negative and Positive Controls
 PLATELIA ASPERGILLUS IgG Negative and Positive Controls 48 62786 Sieri Umani per il Controllo di Qualità 881090-2012/06 sommario 1. USO PREVISTO...27 2. INDICAZIONI PER L USO...27 3. REAGENTI...27 4. AVVERTENZE
PLATELIA ASPERGILLUS IgG Negative and Positive Controls 48 62786 Sieri Umani per il Controllo di Qualità 881090-2012/06 sommario 1. USO PREVISTO...27 2. INDICAZIONI PER L USO...27 3. REAGENTI...27 4. AVVERTENZE
15 Anti-D policlonale / incompleto
 Scheda Tecnica 0123 Technical File No.: Prodotto: 15 Anti-D policlonale / incompleto Categoria di prodotto secondo la classificazione CE: Allegato II Lista A Struttura della scheda tecnica Descrizione
Scheda Tecnica 0123 Technical File No.: Prodotto: 15 Anti-D policlonale / incompleto Categoria di prodotto secondo la classificazione CE: Allegato II Lista A Struttura della scheda tecnica Descrizione
ISTRUZIONI D USO IVD 0123 HLA CLASSE II REF 7029: HISTO TRAY DR 72 (10)
 ISTRUZIONI D USO IVD 0123 HISTO TRAY HLA CLASSE II PER USO DIAGNOSTICO IN VITRO REF 7029: HISTO TRAY DR 72 (10) 10 piastre Descrizione del prodotto La destinazione d uso dell HISTO TRAY è la tipizzazione
ISTRUZIONI D USO IVD 0123 HISTO TRAY HLA CLASSE II PER USO DIAGNOSTICO IN VITRO REF 7029: HISTO TRAY DR 72 (10) 10 piastre Descrizione del prodotto La destinazione d uso dell HISTO TRAY è la tipizzazione
bioelisa VEDI CAMBI RISALTATI
 VEDI CAMBI RISALTATI bioelisa RUBELLA IgM (Immunocapture) 3000-1231 96 tests Test ELISA per la determinazione degli anticorpi IgM anti-rosolia nel siero o nel plasma umano. Sommario La rosolia, o morbillo
VEDI CAMBI RISALTATI bioelisa RUBELLA IgM (Immunocapture) 3000-1231 96 tests Test ELISA per la determinazione degli anticorpi IgM anti-rosolia nel siero o nel plasma umano. Sommario La rosolia, o morbillo
GENSCREEN HIV1/2 version 2
 GENSCREEN HIV1/2 version 2 1 micropiastra - 96 test 72278 5 micropiastre - 480 test 72279 PER LA RILEVAZIONE DEGLI ANTICORPI ANTI-HIV1 E ANTI-HIV2 NEL SIERO/PLASMA PER TECNICA IMMUNOENZIMATICA IVD Controllo
GENSCREEN HIV1/2 version 2 1 micropiastra - 96 test 72278 5 micropiastre - 480 test 72279 PER LA RILEVAZIONE DEGLI ANTICORPI ANTI-HIV1 E ANTI-HIV2 NEL SIERO/PLASMA PER TECNICA IMMUNOENZIMATICA IVD Controllo
HBCon. ISTRUZIONI PER L USO VITROS Immunodiagnostic Products Kit di conferma dell HBsAg
 ISTRUZIONI PER L USO VITROS Immunodiagnostic Products Kit di conferma dell HBsAg HBCon 822 8595 Impiego Uso in vitro per la conferma della presenza dell antigene di superficie dell epatite B (HBsAg) in
ISTRUZIONI PER L USO VITROS Immunodiagnostic Products Kit di conferma dell HBsAg HBCon 822 8595 Impiego Uso in vitro per la conferma della presenza dell antigene di superficie dell epatite B (HBsAg) in
WITNESS RELAXIN GENERALITÀ
 WITNESS RELAXIN WITNESS RELAXIN GENERALITÀ Il kit WITNESS RELAXIN è utilizzato nella diagnosi di gravidanza della cagna e della gatta e permette la distinzione tra gravidanza vera e pseudogravidanza nella
WITNESS RELAXIN WITNESS RELAXIN GENERALITÀ Il kit WITNESS RELAXIN è utilizzato nella diagnosi di gravidanza della cagna e della gatta e permette la distinzione tra gravidanza vera e pseudogravidanza nella
VEDI CAMBI RISALTATI. Ac a-igm a-hav IgM HAV a-hav perossidasi
 VEDI CAMBI RISALTATI bioelisa HAV IgM 3000-1098 96 tests Test ELISA per la determinazione degli anticorpi IgM contro il virus dell'epatite A (HAV) nel siero o nel plasma umano. Sommario Il virus dell'epatite
VEDI CAMBI RISALTATI bioelisa HAV IgM 3000-1098 96 tests Test ELISA per la determinazione degli anticorpi IgM contro il virus dell'epatite A (HAV) nel siero o nel plasma umano. Sommario Il virus dell'epatite
Per la conservazione viene aggiunta sodio azide a una concentrazione finale inferiore allo 0,1 %.
 Scheda Tecnica 0123 Technical File No.: 38 Prodotto: Categoria di prodotto secondo la classificazione CE: Albumina Bovina 22% 30% Allegato III Autocertificazione del produttore Struttura della scheda tecnica
Scheda Tecnica 0123 Technical File No.: 38 Prodotto: Categoria di prodotto secondo la classificazione CE: Albumina Bovina 22% 30% Allegato III Autocertificazione del produttore Struttura della scheda tecnica
Per la conservazione viene aggiunta sodio azide a una concentrazione finale inferiore allo 0,1%.
 Scheda Tecnica 0123 Technical File No.: 21 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-S monoclonale (Sistema MNSs) Allegato III Autocertificazione del produttore Struttura della
Scheda Tecnica 0123 Technical File No.: 21 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-S monoclonale (Sistema MNSs) Allegato III Autocertificazione del produttore Struttura della
Striscia reattiva glicemia ematocrito emoglobina. N. modello: TD-4272 / GD40 DELTA
 Striscia reattiva glicemia ematocrito emoglobina AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori che eseguono
Striscia reattiva glicemia ematocrito emoglobina AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori che eseguono
CLOSTRIDIUM DIFFICILE TOSSINE A e B
 MODALITA' DI RICHIESTA: Pazienti interni: tramite modulo interno prestampato. Pazienti esterni: tramite richiesta del medico curante. PREPARAZIONE DEL PAZIENTE ALL'ESAME: Nessuna. MODALITA' DI RACCOLTA
MODALITA' DI RICHIESTA: Pazienti interni: tramite modulo interno prestampato. Pazienti esterni: tramite richiesta del medico curante. PREPARAZIONE DEL PAZIENTE ALL'ESAME: Nessuna. MODALITA' DI RACCOLTA
PLATELIA CMV IgM TEST
 PLATELIA CMV IgM 72811 96 TEST DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgM ANTI-CYTOMEGALOVIRUS NEL SIERO O NEL PLASMA UMANO MEDIANTE DOSAGGIO IMMUNOENZIMATICO 1. USO PREVISTO Platelia CMV IgM è un
PLATELIA CMV IgM 72811 96 TEST DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgM ANTI-CYTOMEGALOVIRUS NEL SIERO O NEL PLASMA UMANO MEDIANTE DOSAGGIO IMMUNOENZIMATICO 1. USO PREVISTO Platelia CMV IgM è un
RIDASCREEN. Aflatoxin Total. Test immunoenzimatico per il dosaggio quantitativo di aflatossine. Art. No.: R4701. Test in vitro Conservare a 2-8 C
 RIDASCREEN Aflatoxin Total Test immunoenzimatico per il dosaggio quantitativo di aflatossine Art. No.: R4701 Test in vitro Conservare a 2-8 C R-Biopharm AG, Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0
RIDASCREEN Aflatoxin Total Test immunoenzimatico per il dosaggio quantitativo di aflatossine Art. No.: R4701 Test in vitro Conservare a 2-8 C R-Biopharm AG, Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0
Annexe III Autocertificazione del produttore
 Scheda Tecnica 0123 Technical File No.: 27 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-k (cellano) coombsreactive policlonale, umano IgG Annexe III Autocertificazione del produttore
Scheda Tecnica 0123 Technical File No.: 27 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-k (cellano) coombsreactive policlonale, umano IgG Annexe III Autocertificazione del produttore
ISTRUZIONE OPERATIVA CAMPIONAMENTO ACQUA
 Pagina 1 di 5 ISTRUZIONE OPERATIVA REVISIONE NUMERO DATA REDATTA DA DIR VERIFICATA DA RAQ APPROVATA DA AMM PARAGRAFO REVISIONATO NUMERO MOTIVO 00 15-01-09 Prima emissione 01 22-04-13 4.1.2 01 22-04-13
Pagina 1 di 5 ISTRUZIONE OPERATIVA REVISIONE NUMERO DATA REDATTA DA DIR VERIFICATA DA RAQ APPROVATA DA AMM PARAGRAFO REVISIONATO NUMERO MOTIVO 00 15-01-09 Prima emissione 01 22-04-13 4.1.2 01 22-04-13
 ACIDITA su burro, margarine, panna e grassi semilavorati PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA PREPARAZIONE DEL CAMPIONE CONDIZIONI DI REAZIONE (Edit) Gli acidi grassi del campione, in
ACIDITA su burro, margarine, panna e grassi semilavorati PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA PREPARAZIONE DEL CAMPIONE CONDIZIONI DI REAZIONE (Edit) Gli acidi grassi del campione, in
Valutazione del test rapido Geenius HIV1/2 per la conferma degli anticorpi anti HIV1-2. Gianna Mazzarelli
 Valutazione del test rapido Geenius HIV1/2 per la conferma degli anticorpi anti HIV1-2 Gianna Mazzarelli 14/09/2015 Tempi di rilevazione di specifici markers di infezione HIV Test combinati Ag/Ab Ag ricombinanti
Valutazione del test rapido Geenius HIV1/2 per la conferma degli anticorpi anti HIV1-2 Gianna Mazzarelli 14/09/2015 Tempi di rilevazione di specifici markers di infezione HIV Test combinati Ag/Ab Ag ricombinanti
QUANTA Chek Celiac Panel 708113
 QUANTA Chek Celiac Panel 708113 Finalità d uso Il Pannello Celiac QUANTA Chek TM è utilizzato per il controllo della qualità delle procedure per la ricerca degli autoanticorpi IFA ed ELISA. Ciascun siero
QUANTA Chek Celiac Panel 708113 Finalità d uso Il Pannello Celiac QUANTA Chek TM è utilizzato per il controllo della qualità delle procedure per la ricerca degli autoanticorpi IFA ed ELISA. Ciascun siero
ELENCO PRESIDI SANITARI PER LA CASSETTA DI PRONTO SOCCORSO E SEGNALETICA
 ELENCO PRESIDI SANITARI PER LA CASSETTA DI PRONTO SOCCORSO E SEGNALETICA L elenco dei presidi è quello previsto dall allegato 1 del D.Lgs. 388/2003, "REGOLAMENTO RECANTE DISPOSIZIONI SUL PRONTO SOCCORSO
ELENCO PRESIDI SANITARI PER LA CASSETTA DI PRONTO SOCCORSO E SEGNALETICA L elenco dei presidi è quello previsto dall allegato 1 del D.Lgs. 388/2003, "REGOLAMENTO RECANTE DISPOSIZIONI SUL PRONTO SOCCORSO
Scheda del protocollo QIAsymphony SP
 Scheda del protocollo QIAsymphony SP Protocollo DNA_Blood_400_V6_DSP Informazioni generali Per uso diagnostico in vitro. Questo protocollo è previsto per la purificazione del DNA genomico totale e mitocondriale
Scheda del protocollo QIAsymphony SP Protocollo DNA_Blood_400_V6_DSP Informazioni generali Per uso diagnostico in vitro. Questo protocollo è previsto per la purificazione del DNA genomico totale e mitocondriale
PROGENSA PCA3 Urine Specimen Transport Kit
 PROGENSA PCA3 Urine Specimen Transport Kit Istruzioni per i medici Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
PROGENSA PCA3 Urine Specimen Transport Kit Istruzioni per i medici Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
ACIDO IPPURICO e ACIDI o-m-p-metilippurici URINARI in UV Codice Z06010
 ACIDO IPPURICO e ACIDI o-m-p-metilippurici URINARI in UV Codice Z06010 BIOCHIMICA La determinazione dell Acido Ippurico urinario viene impiegata per il monitoraggio biologico dei soggetti esposti a Toluene.
ACIDO IPPURICO e ACIDI o-m-p-metilippurici URINARI in UV Codice Z06010 BIOCHIMICA La determinazione dell Acido Ippurico urinario viene impiegata per il monitoraggio biologico dei soggetti esposti a Toluene.
4F81BDSCHEDA TECNICA 4F81BD
 04011Pagina 1 di 5 pagine Codice prodotto: Nome prodotto: Consigliato per: Dimensioni disponibili: 120101 Gori Detergente concentrato rimuove alghe, muschio e strati verdi Tutti i legni per esterni 1 L
04011Pagina 1 di 5 pagine Codice prodotto: Nome prodotto: Consigliato per: Dimensioni disponibili: 120101 Gori Detergente concentrato rimuove alghe, muschio e strati verdi Tutti i legni per esterni 1 L
Test autodiagnostico per l HIV. Guida a Come eseguire il test
 Test autodiagnostico per l HIV Guida a Come eseguire il test Cosa aspettarsi... Test autodiagnostico per l HIV Il test autodiagnostico BioSURE per l HIV è facile ed estremamente preciso. Tuttavia, funziona
Test autodiagnostico per l HIV Guida a Come eseguire il test Cosa aspettarsi... Test autodiagnostico per l HIV Il test autodiagnostico BioSURE per l HIV è facile ed estremamente preciso. Tuttavia, funziona
PROTOCOLLO RACCOLTA SANGUE PER ANALISI OMICHE
 PROTOCOLLO RACCOLTA SANGUE PER ANALISI OMICHE 00028 Autori Vittorio Sirolli Gianluigi Zaza Contenuti Premesse - Introduzione separazione del plasma Premesse - Introduzione separazione del plasma release
PROTOCOLLO RACCOLTA SANGUE PER ANALISI OMICHE 00028 Autori Vittorio Sirolli Gianluigi Zaza Contenuti Premesse - Introduzione separazione del plasma Premesse - Introduzione separazione del plasma release
AMPICILLINA SODICA PREPARAZIONE INIETTABILE. Ampicillina sodica polvere sterile per preparazioni iniettabili
 1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
PLATELIA CANDIDA Ab PLUS Negative and Positive Controls. Sieri Umani per il Controllo di Qualità
 PLATELIA CANDIDA Ab PLUS Negative and Positive Controls 48 62787 Sieri Umani per il Controllo di Qualità sommario 1. USO PREVISTO...27 2. INDICAZIONI PER L USO...27 3. REAGENTI...27 4. AVVERTENZE PER GLI
PLATELIA CANDIDA Ab PLUS Negative and Positive Controls 48 62787 Sieri Umani per il Controllo di Qualità sommario 1. USO PREVISTO...27 2. INDICAZIONI PER L USO...27 3. REAGENTI...27 4. AVVERTENZE PER GLI
PLATELIA HSV 2 IgG 96 TEST 72821
 PLATELIA HSV 2 IgG 96 TEST 72821 DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgG ANTI-HSV 2 NEL SIERO O NEL PLASMA UMANO MEDIANTE IMMUNODOSAGGIO ENZIMATICO 1. USO PREVISTO Platelia HSV 2 IgG è un immunodosaggio
PLATELIA HSV 2 IgG 96 TEST 72821 DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgG ANTI-HSV 2 NEL SIERO O NEL PLASMA UMANO MEDIANTE IMMUNODOSAGGIO ENZIMATICO 1. USO PREVISTO Platelia HSV 2 IgG è un immunodosaggio
Scheda dei Dati di Sicurezza Secondo le Direttive 91/155/CEE
 1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Sodio Silicato neutro, soluzione 1.2 Nome della societá o ditta: PANREAC
1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Sodio Silicato neutro, soluzione 1.2 Nome della societá o ditta: PANREAC
Lavaggio degli eritrociti
 1 Lavaggio degli eritrociti Le attività emolitica ed emoagglutinante del virus Sendai richiedono una soluzione di eritrociti umani lavati in tampone PBS e diluiti al 2% (v/v). Reagenti Sangue umano fresco.
1 Lavaggio degli eritrociti Le attività emolitica ed emoagglutinante del virus Sendai richiedono una soluzione di eritrociti umani lavati in tampone PBS e diluiti al 2% (v/v). Reagenti Sangue umano fresco.
Molti anticorpi gruppo-ematici reagiscono con i corrispondenti antigeni sui globuli rossi in vitro senza determinare alcun effetto visibile.
 Molti anticorpi gruppo-ematici reagiscono con i corrispondenti antigeni sui globuli rossi in vitro senza determinare alcun effetto visibile. Questi anticorpi sono delle molecole IgG che attaccano un solo
Molti anticorpi gruppo-ematici reagiscono con i corrispondenti antigeni sui globuli rossi in vitro senza determinare alcun effetto visibile. Questi anticorpi sono delle molecole IgG che attaccano un solo
Protocollo di predisinfezione/pulizia manuale e sterilizzazione degli inserti e delle lime SATELEC
 Protocollo di predisinfezione/pulizia manuale e sterilizzazione degli inserti e delle lime SATELEC Avvertenze: Non utilizzare lana d acciaio o prodotti di pulizia abrasivi. Evitare le soluzioni contenenti
Protocollo di predisinfezione/pulizia manuale e sterilizzazione degli inserti e delle lime SATELEC Avvertenze: Non utilizzare lana d acciaio o prodotti di pulizia abrasivi. Evitare le soluzioni contenenti
Kit per la determinazione immuno-turbidimetrica quantitativa delle sieroproteine umane su sistemi automatici.
 1 1. IMMUNOTURBIDIMETRIA METODI IMMUNO-TURBIDIMETRICI PER AUTOMAZIONE 2. LATTICI METODI IN AGGLUTINAZIONE AL LATTICE SU VETRINO 3. LATTICI PER AUTOMAZIONE METODI TURBIDIMETRICI AL LATTICE 2012 1 2 METODI
1 1. IMMUNOTURBIDIMETRIA METODI IMMUNO-TURBIDIMETRICI PER AUTOMAZIONE 2. LATTICI METODI IN AGGLUTINAZIONE AL LATTICE SU VETRINO 3. LATTICI PER AUTOMAZIONE METODI TURBIDIMETRICI AL LATTICE 2012 1 2 METODI
MODALITA DI ID DIPARTIMENTO DI PREVENZIONE MEDICA LABORATORIO di PREVENZIONE ISTRUZIONE OPERATIVA
 ISTRUZIONE OPERATIVA MODALITA DI CAMPIONAMENTO DI VAR IE MATRICI PER ANALISI MICROBIOLOGICHE -UTENTI ESTERNI ID 02521 rev data di approvazione Descrizione delle modifiche FIRMA DI REDAZIONE NOMINATIVO
ISTRUZIONE OPERATIVA MODALITA DI CAMPIONAMENTO DI VAR IE MATRICI PER ANALISI MICROBIOLOGICHE -UTENTI ESTERNI ID 02521 rev data di approvazione Descrizione delle modifiche FIRMA DI REDAZIONE NOMINATIVO
Scheda dei Dati di Sicurezza Secondo le Direttive 91/155/CEE
 1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione secondo l allegato I: Sodio Carbonato anhidro 1.2 Nome della societá
1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione secondo l allegato I: Sodio Carbonato anhidro 1.2 Nome della societá
Sostanze inorganiche: determinazioni qualitative
 Carbonati e Bicarbonati Indicare il tipo di sostanza basandosi sulle caratteristiche alla calcinazione e le prove di solubilità e il ph. Sodio carbonato anidro Na 2 CO 3 (F.U. X Edizione, European Pharmacopeia
Carbonati e Bicarbonati Indicare il tipo di sostanza basandosi sulle caratteristiche alla calcinazione e le prove di solubilità e il ph. Sodio carbonato anidro Na 2 CO 3 (F.U. X Edizione, European Pharmacopeia
PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA TRATTAMENTO DEL CAMPIONE
 PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA TRATTAMENTO DEL CAMPIONE ACIDO L-LATTICO su uova L acido L-lattico reagisce, per via enzimatica, con un derivato fenolico e induce la formazione di
PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA TRATTAMENTO DEL CAMPIONE ACIDO L-LATTICO su uova L acido L-lattico reagisce, per via enzimatica, con un derivato fenolico e induce la formazione di
VALUTAZIONE DEL POTERE BATTERICIDA (SANIFICANTE 10)
 VALUTAZIONE DEL POTERE BATTERICIDA (SANIFICANTE 10) 1. SCOPO Testare le capacità battericida del SANIFICANTE 10, detergente igienizzante a base di sali quaternari di ammonio, nelle condizioni di sporco
VALUTAZIONE DEL POTERE BATTERICIDA (SANIFICANTE 10) 1. SCOPO Testare le capacità battericida del SANIFICANTE 10, detergente igienizzante a base di sali quaternari di ammonio, nelle condizioni di sporco
EXTRA-GENE I Kit per l estrazione del DNA genomico 50 Estrazioni
 IT Istruzioni d uso EXTRA-GENE I Kit per l estrazione del DNA genomico 50 Estrazioni REF 7059 1. Descrizione del prodotto EXTRA-GENE è un kit per l estrazione veloce del DNA genomico senza l utilizzo di
IT Istruzioni d uso EXTRA-GENE I Kit per l estrazione del DNA genomico 50 Estrazioni REF 7059 1. Descrizione del prodotto EXTRA-GENE è un kit per l estrazione veloce del DNA genomico senza l utilizzo di
RIDASCREEN. Nitrofuran (AHD) Test immunoenzimatico per l analisi quantitativa di AHD. Art. No.: R3713. Test in vitro Conservare a 2-8 C
 RIDASCREEN Nitrofuran (AHD) Test immunoenzimatico per l analisi quantitativa di AHD Art. No.: R3713 Test in vitro Conservare a 2-8 C R-Biopharm AG, Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0 / Telefax:
RIDASCREEN Nitrofuran (AHD) Test immunoenzimatico per l analisi quantitativa di AHD Art. No.: R3713 Test in vitro Conservare a 2-8 C R-Biopharm AG, Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0 / Telefax:
ASSEGNAZIONE E DISTRIBUZIONE EMOCOMPONENTI ALLOGENICI
 ASSEGNAZIONE E DISTRIBUZIONE EMOCOMPONENTI ALLOGENICI Gli antigeni gruppo-ematici più importanti da un punto di vista immunologico e trasfusionale sono quelli AB0 ed Rh Test pre-trasfusionali Type: determinazione
ASSEGNAZIONE E DISTRIBUZIONE EMOCOMPONENTI ALLOGENICI Gli antigeni gruppo-ematici più importanti da un punto di vista immunologico e trasfusionale sono quelli AB0 ed Rh Test pre-trasfusionali Type: determinazione
BENZILPENICILLINA BENZATINICA PREPARAZIONE INIETTABILI. Benzilpenicillina Benzatinica polvere sterile per preparazioni iniettabili
 1 1 1 1 1 1 1 1 0 1 0 1 0 1 1 01/FU Maggio 00 Commenti entro il 0 Settembre 00 NOTA: Corretta in seguito ai commenti della Dott.ssa Mozzetti La monografia è stata revisionata per armonizzarla con le altre
1 1 1 1 1 1 1 1 0 1 0 1 0 1 1 01/FU Maggio 00 Commenti entro il 0 Settembre 00 NOTA: Corretta in seguito ai commenti della Dott.ssa Mozzetti La monografia è stata revisionata per armonizzarla con le altre
Acido Citrico Monoidrato
 Acido Citrico Monoidrato 1. IDENTIFICAZIONE DELLA SOSTANZA/PREPARATO E DELLA SOCIETÀ/IMPRESA Nome prodotto: Acido Citrico Monoidrato Nome chimico: Acidoβ idrossi 1,2,3 propantricarbossilico monoidrato
Acido Citrico Monoidrato 1. IDENTIFICAZIONE DELLA SOSTANZA/PREPARATO E DELLA SOCIETÀ/IMPRESA Nome prodotto: Acido Citrico Monoidrato Nome chimico: Acidoβ idrossi 1,2,3 propantricarbossilico monoidrato
ALLwell Elution Technologies Bovine Casein Protein
 ALLwell Elution Technologies Bovine Casein Protein Elisa kit Cat. N. ETE-75CAS Kit per la rilevazione della caseina bovina in campioni alimentari Manuale d uso Leggere attentamente il manuale prima di
ALLwell Elution Technologies Bovine Casein Protein Elisa kit Cat. N. ETE-75CAS Kit per la rilevazione della caseina bovina in campioni alimentari Manuale d uso Leggere attentamente il manuale prima di
DETERMINAZIONE DUREZZA ACQUA
 DETERMINAZIONE DUREZZA ACQUA Le acque contengono disciolti un gran numero di sali e quindi sono presenti molti cationi metallici, tra cui quelli polivalenti che sono i responsabili della durezza. Contribuiscono
DETERMINAZIONE DUREZZA ACQUA Le acque contengono disciolti un gran numero di sali e quindi sono presenti molti cationi metallici, tra cui quelli polivalenti che sono i responsabili della durezza. Contribuiscono
ISTRUZIONE OPERATIVA CAMPIONAMENTO ACQUA
 Pagina 1 di 6 ISTRUZIONE OPERATIVA REVISIONE NUMERO DATA REDATTA DA DIR (firma) VERIFICATA DA RAQ (firma) APPROVATA DA AMM (firma) PARAGRAFO REVISIONATO NUMERO MOTIVO 00 15-01-09 Prima emissione 01 22-04-13
Pagina 1 di 6 ISTRUZIONE OPERATIVA REVISIONE NUMERO DATA REDATTA DA DIR (firma) VERIFICATA DA RAQ (firma) APPROVATA DA AMM (firma) PARAGRAFO REVISIONATO NUMERO MOTIVO 00 15-01-09 Prima emissione 01 22-04-13
CH50 Eq SOMMARIO E SPIEGAZIONE PRINCIPIO DELLA PROCEDURA FINALITÀ D USO
 CH50 Eq Saggio immunoenzimatico per la misurazione dell attività totale del percorso classico del complemento nel siero umano MicroVue CH50 Eq EIA Sommario Preparato di il Campione ed il reagente Diluire
CH50 Eq Saggio immunoenzimatico per la misurazione dell attività totale del percorso classico del complemento nel siero umano MicroVue CH50 Eq EIA Sommario Preparato di il Campione ed il reagente Diluire
RIDASCREEN ß-Agonists
 RIDASCREEN ß-Agonists Saggio immunoenzimatico per l analisi quantitativa dei β-agonisti Art. No.: R1704 Test in vitro Conservare a 2-8 C R-Biopharm AG, Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0 /
RIDASCREEN ß-Agonists Saggio immunoenzimatico per l analisi quantitativa dei β-agonisti Art. No.: R1704 Test in vitro Conservare a 2-8 C R-Biopharm AG, Darmstadt, Germany Tel.: +49 (0) 61 51 81 02-0 /
Utilizzeremo un kit analitico per valutare la qualità dell acqua potabile delle nostre case, scuole e fontanelle cittadine.
 Acqua in brocca Ciao! Io sono LABBY e vi farò da guida per l analisi dell acqua del vostro rubinetto! Utilizzeremo un kit analitico per valutare la qualità dell acqua potabile delle nostre case, scuole
Acqua in brocca Ciao! Io sono LABBY e vi farò da guida per l analisi dell acqua del vostro rubinetto! Utilizzeremo un kit analitico per valutare la qualità dell acqua potabile delle nostre case, scuole
GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA
 GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA Istruzioni Scrivere il proprio nome e cognome su questa pagina e sulla scheda delle risposte. Seguire le regole di sicurezza di laboratorio: se vengono
GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA Istruzioni Scrivere il proprio nome e cognome su questa pagina e sulla scheda delle risposte. Seguire le regole di sicurezza di laboratorio: se vengono
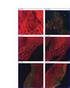
TECNICHE IMMUNOISTOCHIMICHE IN PATOLOGIA VETERINARIA: VANTAGGI E LIMITI. Pezzolato Marzia, DVM LAB Istopatologia - IZSTO
 TECNICHE IMMUNOISTOCHIMICHE IN PATOLOGIA VETERINARIA: VANTAGGI E LIMITI Pezzolato Marzia, DVM LAB Istopatologia - IZSTO L immunoistochimica (IHC) serve per individuare un determinato antigene mediante
TECNICHE IMMUNOISTOCHIMICHE IN PATOLOGIA VETERINARIA: VANTAGGI E LIMITI Pezzolato Marzia, DVM LAB Istopatologia - IZSTO L immunoistochimica (IHC) serve per individuare un determinato antigene mediante
WITNESS PARVO INTRODUZIONE
 WITNESS PARVO WITNESS PARVO INTRODUZIONE Il Parvovirus canino (CPV) appartiene ad un sottogruppo del parvovirus felino. È in stretto rapporto col virus della panleucopenia felina e col virus dell'enterite
WITNESS PARVO WITNESS PARVO INTRODUZIONE Il Parvovirus canino (CPV) appartiene ad un sottogruppo del parvovirus felino. È in stretto rapporto col virus della panleucopenia felina e col virus dell'enterite
Esperienza 14: il test ELISA
 Esperienza 14: il test ELISA La tecnica di dosaggio immuno-assorbente legato a un enzima (in inglese Enzyme-Linked Immuno Assay) o ELISA è principalmente utilizzato in immunologia al fine di rilevare e/o
Esperienza 14: il test ELISA La tecnica di dosaggio immuno-assorbente legato a un enzima (in inglese Enzyme-Linked Immuno Assay) o ELISA è principalmente utilizzato in immunologia al fine di rilevare e/o
Saggio immunoenzimatico per la misurazione dell attività totale del percorso classic del complement nel siero umano
 Saggio immunoenzimatico per la misurazione dell attività totale del percorso classic del complement nel siero umano Per uso diagnostico In Vitro SOMMARIO MicroVue CH50 Eq EIA Pagina 1 di 11 FINALITÀ D
Saggio immunoenzimatico per la misurazione dell attività totale del percorso classic del complement nel siero umano Per uso diagnostico In Vitro SOMMARIO MicroVue CH50 Eq EIA Pagina 1 di 11 FINALITÀ D
REGIONE VENETO / Segreteria regionale Sanità e Sociale- ARSS Agenzia Regionale Sanitaria e Sociosanitaria
 Lista di verifica REQUITI MINIMI SPECIFICI E DI QUALITA' PER L'AUTORIZZAZIONE 1 - REQUITI STRUTTURALI LABPAT.AU.1.1 I locali e gli spazi sono dimensionati in funzione della tipologia e del volume dell'attività
Lista di verifica REQUITI MINIMI SPECIFICI E DI QUALITA' PER L'AUTORIZZAZIONE 1 - REQUITI STRUTTURALI LABPAT.AU.1.1 I locali e gli spazi sono dimensionati in funzione della tipologia e del volume dell'attività
AlereTM. HIV Combo TOCCARE QUI PER VEDERE IL PRODOTTO
 AlereTM HIV Combo TOCCARE QUI PER VEDERE IL PRODOTTO Cogli qualunque opportunità di fare il test. I casi di infezione acuta sono compresi fra il 5 e il 20% rispetto al totale dei casi di infezione da HIV
AlereTM HIV Combo TOCCARE QUI PER VEDERE IL PRODOTTO Cogli qualunque opportunità di fare il test. I casi di infezione acuta sono compresi fra il 5 e il 20% rispetto al totale dei casi di infezione da HIV
Informazioni generali
 Un ausilio per la preparazione e l'isolamento di linfociti purificati direttamente dal sangue intero FOGLIO ILLUSTRATIVO Per uso diagnostico In Vitro PI-TT.610-IT-V5 Informazioni generali Uso previsto
Un ausilio per la preparazione e l'isolamento di linfociti purificati direttamente dal sangue intero FOGLIO ILLUSTRATIVO Per uso diagnostico In Vitro PI-TT.610-IT-V5 Informazioni generali Uso previsto
WINEMATIC V PROCEDURE ANALITICHE PROCEDURE ANALITICHE PROCEDURE ANALITICHE PROCEDURE ANALITICHE PROCEDURE ANALITICHE
 60.50.796 - Ed. 2 03/2010 WINEMATIC V. 3.00 Nonostante questo manuale sia stato prodotto con la massima cura, non si può escludere che possa contenere errori. La GIBERTINI ELETTRONICA Srl non si assume
60.50.796 - Ed. 2 03/2010 WINEMATIC V. 3.00 Nonostante questo manuale sia stato prodotto con la massima cura, non si può escludere che possa contenere errori. La GIBERTINI ELETTRONICA Srl non si assume
SCHEDA DI SICUREZZA. Direttiva CEE 91/155
 SCHEDA DI SICUREZZA Direttiva CEE 91/155 1.0 IDENTIFICAZIONE PRODOTTO E SOCIETA' 1.1 Nome commerciale ALG 5-MB 1.2 Impieghi Addensante per stampa. 1.3 Produttore ed assistenza DATT CHIMICA SRL Via Clerici,
SCHEDA DI SICUREZZA Direttiva CEE 91/155 1.0 IDENTIFICAZIONE PRODOTTO E SOCIETA' 1.1 Nome commerciale ALG 5-MB 1.2 Impieghi Addensante per stampa. 1.3 Produttore ed assistenza DATT CHIMICA SRL Via Clerici,
Tra nm Nucleotidi mono-fosfato
 Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Convegno Qualità Microbiologica dei Cosmetici: Aspetti Tecnici e Normativi Milano, 15 maggio Lucia Bonadonna Istituto Superiore di Sanità
 Convegno Qualità Microbiologica dei Cosmetici: Aspetti Tecnici e Normativi Milano, 15 maggio 2015 Lucia Bonadonna Istituto Superiore di Sanità Regolamento 1223/2009 art. 19, Capo VI, stabilisce che il
Convegno Qualità Microbiologica dei Cosmetici: Aspetti Tecnici e Normativi Milano, 15 maggio 2015 Lucia Bonadonna Istituto Superiore di Sanità Regolamento 1223/2009 art. 19, Capo VI, stabilisce che il
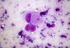
ESAME MORFOLOGICO DEL SANGUE
 ESAME MORFOLOGICO DEL SANGUE Obiettivo Con l esame morfologico del sangue si intende differenziare gli elementi figurati del sangue, tramite la colorazione di May Grunwald-Giemsa, per poterli riconoscere
ESAME MORFOLOGICO DEL SANGUE Obiettivo Con l esame morfologico del sangue si intende differenziare gli elementi figurati del sangue, tramite la colorazione di May Grunwald-Giemsa, per poterli riconoscere
METANOLO (ALCOOL METILICO) URINARIO in UV Codice Z05610
 METANOLO (ALCOOL METILICO) URINARIO in UV Codice Z05610 METABOLISMO Il Metanolo è un alcool alifatico di PM=32,0. La principale via di assorbimento è quella gastrointestinale; dopo un breve periodo dall
METANOLO (ALCOOL METILICO) URINARIO in UV Codice Z05610 METABOLISMO Il Metanolo è un alcool alifatico di PM=32,0. La principale via di assorbimento è quella gastrointestinale; dopo un breve periodo dall
Schema a blocchi di uno spettrofluorimetro
 MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
ALOGENURI (Cl -, Br -, I - ) 1
 ALOGENURI (Cl -, Br -, I - ) 1 Cloruri, bromuri e ioduri di tutti i metalli, eccetto quelli di Pb +,Ag + e Hg + (I), sono solubili in H O. Cloruri, bromuri e ioduri di Pb +,Ag + e Hg + (I) sono inoltre
ALOGENURI (Cl -, Br -, I - ) 1 Cloruri, bromuri e ioduri di tutti i metalli, eccetto quelli di Pb +,Ag + e Hg + (I), sono solubili in H O. Cloruri, bromuri e ioduri di Pb +,Ag + e Hg + (I) sono inoltre
Studio per valutazione dell efficacia di prodotto disinfettante secondo l utilizzo dichiarato dal. Committente:
 Studio per valutazione dell efficacia di prodotto disinfettante secondo l utilizzo dichiarato dal committente Programma di studio n.: 12/046 Committente: Euroslate Srl Via Pian dei Ratti, 38/A 16040 ORERO
Studio per valutazione dell efficacia di prodotto disinfettante secondo l utilizzo dichiarato dal committente Programma di studio n.: 12/046 Committente: Euroslate Srl Via Pian dei Ratti, 38/A 16040 ORERO
Test tecnico per culture starter di batteri lattici 2012
 Test tecnico per culture starter di batteri lattici 2012 Il presente rapporto contiene l esame tecnico per culture STARTER di batteri lattici per la fermentazione malolattica. Lo scopo non è quello di
Test tecnico per culture starter di batteri lattici 2012 Il presente rapporto contiene l esame tecnico per culture STARTER di batteri lattici per la fermentazione malolattica. Lo scopo non è quello di
CITRATI URINARI in UV Codice Z32210
 CITRATI URINARI in UV Codice Z32210 BIOCHIMICA L acido citrico è un acido organico. Tra gli inibitori urinari è ritenuto di particolare interesse in quanto la sua somministrazione induce un aumento del
CITRATI URINARI in UV Codice Z32210 BIOCHIMICA L acido citrico è un acido organico. Tra gli inibitori urinari è ritenuto di particolare interesse in quanto la sua somministrazione induce un aumento del
DOSAGGIO DELLA CARBOSSIMETILCELLULOSA (GOMMA DI CELLULOSA, CMC) NEI VINI BIANCHI
 RISOLUZIONE OIV/ENO 404/2010 DOSAGGIO DELLA CARBOSSIMETILCELLULOSA (GOMMA DI CELLULOSA, CMC) NEI VINI BIANCHI L ASSEMBLEA GENERALE Visto l'articolo 2 paragrafo 2 iv dell'accordo del 3 aprile 2001 che istituisce
RISOLUZIONE OIV/ENO 404/2010 DOSAGGIO DELLA CARBOSSIMETILCELLULOSA (GOMMA DI CELLULOSA, CMC) NEI VINI BIANCHI L ASSEMBLEA GENERALE Visto l'articolo 2 paragrafo 2 iv dell'accordo del 3 aprile 2001 che istituisce
Scheda di dati di sicurezza ai sensi del regolamento 1907/2006/CE, Articolo 31
 Pagina: 1/4 Stampato il: 06.03.2013 Numero versione 5 1 Identificazione della sostanza o della miscela e della società/impresa Identificatore del prodotto Denominazione commerciale: Meron AC polvere Usi
Pagina: 1/4 Stampato il: 06.03.2013 Numero versione 5 1 Identificazione della sostanza o della miscela e della società/impresa Identificatore del prodotto Denominazione commerciale: Meron AC polvere Usi
PROTOCOLLO DI DECONTAMINAZIONE DEGLI STRUMENTI DA ESEGUIRE PRIMA DI QUALSIASI INTERVENTO DA PARTE DI UN OPERATORE
 Pagina : 1/5 I - PREMESSA Le istruzioni descritte in questo protocollo sono delle raccomandazioni: qualsiasi altra disposizione è sotto diretta responsabilità dell esecutore. Queste istruzioni sono applicabili
Pagina : 1/5 I - PREMESSA Le istruzioni descritte in questo protocollo sono delle raccomandazioni: qualsiasi altra disposizione è sotto diretta responsabilità dell esecutore. Queste istruzioni sono applicabili
SAFE - Scuola di Scienze Agrarie, Forestali, Alimentari ed Ambientali. School of Agriculture, forest, Food and Environmental sciences
 Protocollo SAFE Determinazione dell attività antiossidante Valutazione della resistenza allo stress ossidativo in presenza di perossido d idrogeno Soluzione di perossido d idrogeno 1,6 M. Esporre i campioni
Protocollo SAFE Determinazione dell attività antiossidante Valutazione della resistenza allo stress ossidativo in presenza di perossido d idrogeno Soluzione di perossido d idrogeno 1,6 M. Esporre i campioni
Argomento Titolazione volumetrica acido-base. Target
 Argomento Titolazione volumetrica acido-base Target Università- Corso di Chimica Analitica Quantitativa Obiettivi: Applicazione del concetto di equilibrio acido-base all analisi quantitativa; Acquisizione
Argomento Titolazione volumetrica acido-base Target Università- Corso di Chimica Analitica Quantitativa Obiettivi: Applicazione del concetto di equilibrio acido-base all analisi quantitativa; Acquisizione
Disinfezione e Sterilizzazione
 Disinfezione e Sterilizzazione T. d. P. Rampini Maurizio Servizio Igiene Pubblica Reggio Centro La valutazione dei rischi biologici presenti nella struttura Individuazione di ambienti a basso, medio ed
Disinfezione e Sterilizzazione T. d. P. Rampini Maurizio Servizio Igiene Pubblica Reggio Centro La valutazione dei rischi biologici presenti nella struttura Individuazione di ambienti a basso, medio ed
SINH 2 OX PEAR. Istruzioni per l uso made in Italy for sinh2ox health & care srl Torino, Italy
 SINH 2 OX PEAR Istruzioni per l uso made in Italy for sinh2ox health & care srl Torino, Italy SINH2OXHEALTHANDCARE srl via ferdinando bocca 11, 10132 torino, italy p. iva 10867140013 capitale sociale 40.000
SINH 2 OX PEAR Istruzioni per l uso made in Italy for sinh2ox health & care srl Torino, Italy SINH2OXHEALTHANDCARE srl via ferdinando bocca 11, 10132 torino, italy p. iva 10867140013 capitale sociale 40.000
Concetti generali PRELIEVO DI SANGUE PER EMOCOLTURA. In condizioni fisiologiche il sangue è STERILE
 Concetti generali In condizioni fisiologiche il sangue è STERILE Batteriemia: presenza di batteri nel sangue Fungemia: presenza di funghi nel sangue PRELIEVO DI SANGUE PER EMOCOLTURA L emocoltura è definita
Concetti generali In condizioni fisiologiche il sangue è STERILE Batteriemia: presenza di batteri nel sangue Fungemia: presenza di funghi nel sangue PRELIEVO DI SANGUE PER EMOCOLTURA L emocoltura è definita
Per la conservazione viene aggiunta sodio azide a una concentrazione finale inferiore allo 0,1 %.
 Scheda Tecnica 0123 Technical File No.: 22 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-M / Anti-N monoclonale (MNSs-System) Allegato III Autocertificazione del produttore Struttura
Scheda Tecnica 0123 Technical File No.: 22 Prodotto: Categoria di prodotto secondo la classificazione CE: Anti-M / Anti-N monoclonale (MNSs-System) Allegato III Autocertificazione del produttore Struttura
Sistema di rilevazione dei polimeri MultiVision: Polimeri Multivision anti-coniglio/ HRP + anti-topo/ AP
 Sistema di rilevazione dei polimeri MultiVision: Polimeri Multivision anti-coniglio/ HRP + anti-topo/ AP Pag. 1 di 5 USO PREVISTO: Per uso diagnostico in vitro. DISPONIBILITÀ: Codice catalogo Quantità
Sistema di rilevazione dei polimeri MultiVision: Polimeri Multivision anti-coniglio/ HRP + anti-topo/ AP Pag. 1 di 5 USO PREVISTO: Per uso diagnostico in vitro. DISPONIBILITÀ: Codice catalogo Quantità
Un anticorpo è una proteina prodotta dai linfociti B in risposta all ingresso nell organismo di un antigene.
 Un antigene è una molecola (proteica o polisaccaridica), o una sua parte, che è in grado di stimolare una risposta specifica del sistema immunitario. Affinché una molecola funga da antigene è necessario
Un antigene è una molecola (proteica o polisaccaridica), o una sua parte, che è in grado di stimolare una risposta specifica del sistema immunitario. Affinché una molecola funga da antigene è necessario
DETERMINAZIONE della MASSA di ACIDO ACETICO PRESENTE in un 1 L di ACETO
 DETERMINAZIONE della MASSA di ACIDO ACETICO PRESENTE in un 1 L di ACETO OBIETTIVO: determinare i grammi di acido acetico presenti in 1 litro di aceto comune (concentrazione in g/l). Approccio al problema:
DETERMINAZIONE della MASSA di ACIDO ACETICO PRESENTE in un 1 L di ACETO OBIETTIVO: determinare i grammi di acido acetico presenti in 1 litro di aceto comune (concentrazione in g/l). Approccio al problema:
Distribuita in esclusiva da: Versione 13/4
 Distribuita in esclusiva da: Versione 13/4 EFFECT PRIMER Primer ATTIVATORE Rust Activator PITTURA Iron Paint PROTEZIONE Sealer LA RUGGINE DIRETTAMENTE SUL FERRO: LE FASI APPLICAZIONE DEL RUST ACTIVATOR
Distribuita in esclusiva da: Versione 13/4 EFFECT PRIMER Primer ATTIVATORE Rust Activator PITTURA Iron Paint PROTEZIONE Sealer LA RUGGINE DIRETTAMENTE SUL FERRO: LE FASI APPLICAZIONE DEL RUST ACTIVATOR
Esame svizzero di maturità Sessione gennaio 2011 ESAME DI MATURITÀ. Opzione specifica biologia e chimica. gennaio 2011 CORRELAZIONI
 ESAME DI MATURITÀ Opzione specifica biologia e chimica gennaio 2011 CORRELAZIONI Cognome:.......... Nome:.......... Gruppo:.......... Numero:.......... Tempo a disposizione: 60 minuti Punteggio correlazioni:
ESAME DI MATURITÀ Opzione specifica biologia e chimica gennaio 2011 CORRELAZIONI Cognome:.......... Nome:.......... Gruppo:.......... Numero:.......... Tempo a disposizione: 60 minuti Punteggio correlazioni:
SCHEDA TECNICA PLACCA PAZIENTE ADESIVE BIPARTITE CON ADESIVO CONDUTTORE
 SCHEDA TECNICA PLACCA PAZIENTE ADESIVE BIPARTITE CON ADESIVO CONDUTTORE MARCHIO COMMERCIALE MARCHIO CE CLASSE DI APPARTENENZA NORME RIFERIMENTO DESTINAZIONE D USO HOSPITAL' S PLATE Prodotti conformi art.
SCHEDA TECNICA PLACCA PAZIENTE ADESIVE BIPARTITE CON ADESIVO CONDUTTORE MARCHIO COMMERCIALE MARCHIO CE CLASSE DI APPARTENENZA NORME RIFERIMENTO DESTINAZIONE D USO HOSPITAL' S PLATE Prodotti conformi art.
Contiene il virus vivo attenuato ceppo Oka/Merck Contiene il virus vivo attenuato ceppo Oka Tra +2 e +8 Tra +2 e +8
 Varivax Varilrix Ditta Sanofi Pasteur MSD GlaxoSmithKline Ceppo virus varicella Temperatura di conservazione Immunogenicità Inizio della risposta immunitaria Durata della risposta immunitaria Efficacia
Varivax Varilrix Ditta Sanofi Pasteur MSD GlaxoSmithKline Ceppo virus varicella Temperatura di conservazione Immunogenicità Inizio della risposta immunitaria Durata della risposta immunitaria Efficacia
Scheda dei Dati di Sicurezza Secondo le Direttive 91/155/CEE. 2. Composizione/Informazione dei componenti
 1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Alluminio soluzione modello Al=1,000±0,002 g/l 1.2 Nome della societá
1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Alluminio soluzione modello Al=1,000±0,002 g/l 1.2 Nome della societá
Estrazione di pigmenti vegetali da sostanze naturali
 Estrazione di pigmenti vegetali da sostanze naturali Il cavolo rosso deve il suo colore agli antociani o antocianine, che sono una classe di pigmenti idrosolubili appartenente alla famiglia dei flavonoidi.
Estrazione di pigmenti vegetali da sostanze naturali Il cavolo rosso deve il suo colore agli antociani o antocianine, che sono una classe di pigmenti idrosolubili appartenente alla famiglia dei flavonoidi.
XVII ZOLFO. Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE. Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI
 XVII ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI XVII - ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE 1. Principio Il campione viene
XVII ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE Metodo XVII.2 DETERMINAZIONE DELLO ZOLFO DA SOLFATI XVII - ZOLFO Metodo XVII.1 DETERMINAZIONE DELLO ZOLFO TOTALE 1. Principio Il campione viene
Dipartimento di Chimica, Materiali e Ingegneria Chimica "Giulio Natta" Servizio Prevenzione e Protezione Dipartimentale
 Dipartimento di Chimica, Materiali e Ingegneria Chimica "Giulio Natta" Servizio Prevenzione e Protezione Dipartimentale DCMIC/SIC/IOP.13.041 27.06.2014 - agg. 1 Procedura di sicurezza per l uso dei guanti
Dipartimento di Chimica, Materiali e Ingegneria Chimica "Giulio Natta" Servizio Prevenzione e Protezione Dipartimentale DCMIC/SIC/IOP.13.041 27.06.2014 - agg. 1 Procedura di sicurezza per l uso dei guanti
Scheda dei Dati di Sicurezza Secondo le Direttive 91/155/CEE
 1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Stagno II Cloruro 2-idrato 1.2 Nome della societá o ditta: PANREAC
1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Stagno II Cloruro 2-idrato 1.2 Nome della societá o ditta: PANREAC
PLATELIA RUBELLA IgM 96 TEST 72851
 PLATELIA RUBELLA IgM 96 TEST 72851 DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgM ANTI-VIRUS DELLA ROSOLIA NEL SIERO O NEL PLASMA UMANO MEDIANTE DOSAGGIO IMMUNOENZIMATICO 1. USO PREVISTO Platelia Rubella
PLATELIA RUBELLA IgM 96 TEST 72851 DETERMINAZIONE QUALITATIVA DEGLI ANTICORPI IgM ANTI-VIRUS DELLA ROSOLIA NEL SIERO O NEL PLASMA UMANO MEDIANTE DOSAGGIO IMMUNOENZIMATICO 1. USO PREVISTO Platelia Rubella
CITRATI URINARI e SIERICI DUAL KIT in UV Codice Z32410
 CITRATI URINARI e SIERICI DUAL KIT in UV Codice Z32410 BIOCHIMICA L acido citrico è un acido organico. Tra gli inibitori urinari è ritenuto di particolare interesse in quanto la sua somministrazione induce
CITRATI URINARI e SIERICI DUAL KIT in UV Codice Z32410 BIOCHIMICA L acido citrico è un acido organico. Tra gli inibitori urinari è ritenuto di particolare interesse in quanto la sua somministrazione induce
PIERREL FARMACEUTICI S.P.A. SCHEDA DI SICUREZZA: ALFA PIERREL
 PIERREL FARMACEUTICI S.P.A. SCHEDA DI SICUREZZA: ALFA PIERREL ISTRUZIONE OPERATIVA SICUREZZA DATA DI EMISSIONE: NOVEMBRE 2001 1. ELEMENTI IDENTIFICATIVI DEL PREPARATO E DELLA SOCIETÀ 1.1 ELEMENTI IDENTIFICATIVI
PIERREL FARMACEUTICI S.P.A. SCHEDA DI SICUREZZA: ALFA PIERREL ISTRUZIONE OPERATIVA SICUREZZA DATA DI EMISSIONE: NOVEMBRE 2001 1. ELEMENTI IDENTIFICATIVI DEL PREPARATO E DELLA SOCIETÀ 1.1 ELEMENTI IDENTIFICATIVI
SCHEDA PRODOTTO GUANTI BIOSAFE HIGH RISK BIOSAFE HIGH RISK
 Documento SP-DAR HR Data: Maggio 2013 Edizione2, Revisione 0 Pag. 1 di 7 GUANTO DA ESAMINAZIONE IN LATTICE SENZA POLVERE NON STERILE Nome commerciale: Tipologia: Fabbricante: Codice prodotto: Marcatura
Documento SP-DAR HR Data: Maggio 2013 Edizione2, Revisione 0 Pag. 1 di 7 GUANTO DA ESAMINAZIONE IN LATTICE SENZA POLVERE NON STERILE Nome commerciale: Tipologia: Fabbricante: Codice prodotto: Marcatura
Scheda di sicurezza materiale
 Pag. 1/5 1. Identificazione prodotto e nome della società Nome commerciale: Fabbricante: STONE P STONE P FREE SWEDEN & MARTINA SPA Via Veneto 10 35020 DUE CARRARE (pd9 Informazioni d emergenza: 049 9124300
Pag. 1/5 1. Identificazione prodotto e nome della società Nome commerciale: Fabbricante: STONE P STONE P FREE SWEDEN & MARTINA SPA Via Veneto 10 35020 DUE CARRARE (pd9 Informazioni d emergenza: 049 9124300
Associazione Italiana Allevatori Laboratorio Standard Latte GRASSO, PROTEINE, CASEINE, LATTOSIO, UREA LATTE VACCINO
 GRASSO, PROTEINE, CASEINE, LATTOSIO, UREA LATTE VACCINO FT 001 (set da 10 campioni) FT 002 (set da 5 campioni) Descrizione del campione: campione da 80 ml di latte crudo, contenuto in provette di plastica
GRASSO, PROTEINE, CASEINE, LATTOSIO, UREA LATTE VACCINO FT 001 (set da 10 campioni) FT 002 (set da 5 campioni) Descrizione del campione: campione da 80 ml di latte crudo, contenuto in provette di plastica
