FOGLIO INFORMATIVO PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER
|
|
|
- Letizia Rocco
- 6 anni fa
- Visualizzazioni
Transcript
1 Titolo del Progetto: NETWORK ITALIANO PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER E DI DEGENERAZIONE LOBARE FRONTOTEMPORALE FOGLIO INFORMATIVO PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER
2 Informazioni generali Medico responsabile dello studio Nome dell istituto in cui verrà realizzato lo studio Indirizzo dell Istituto Numero di telefono Numero di identificazione del paziente Egregio Signore/Gentile Signora, attraverso questo foglio informativo Le chiediamo la Sua disponibilità a prendere parte ad uno studio, di seguito descritto, realizzato a scopo di ricerca che si svolgerà presso l IRCCS Centro San Giovanni di Dio Fatebenefratelli di Brescia. Lei potrà scegliere liberamente di prenderne parte o meno. Alla fine di questo documento troverà un modulo attraverso il quale potrà esprimere il Suo consenso a partecipare o meno allo studio. Dovrà firmare questo modulo, solo nel caso in cui Lei decidesse di partecipare. Ciò vorrà dire che avrà fornito il Suo consenso. Cos è il consenso? Il consenso rappresenta la Sua manifestazione di volontà al prendere parte a questo studio. Ciò significa che spetta soltanto a Lei decidere se vuole sottoporsi agli esami ed alle valutazioni incluse nello studio stesso, dopo che Le siano state fornite delle spiegazioni esaurienti da almeno un componente del gruppo di ricerca. Questo modulo per il Consenso Informato contiene tutte le informazioni richieste dalla legge. Lei potrà decidere di prendere parte allo studio dopo che: 1. Una persona tra il personale Le avrà spiegato in cosa consiste lo studio 2. Avrà compreso lo scopo dello studio 3. Avrà compreso cosa dovrà fare durante lo studio 4. Avrà compreso i rischi dello studio 5. Sarà disposto a fare ciò che è richiesto dallo studio Potrà rivolgersi alla Sua famiglia ed al Suo medico per farsi aiutare nel prendere una decisione. Potrà prendersi tutto il tempo che Lei riterrà necessario per decidere. Potrà cambiare idea in qualsiasi momento dello studio. Potrà lasciare lo studio in qualsiasi momento, anche dopo aver firmato questo modulo. Non sarà necessaria alcuna giustificazione. Decidere di non partecipare o di lasciare lo studio non comporterà alcuna conseguenza sulle eventuali cure di cui potrà necessitare in futuro. Quali sono l argomento e lo scopo della ricerca? Il progetto di ricerca, al quale deciderà di prendere parte o meno, è finanziato dal Ministero della Salute. Si tratta di un progetto nazionale che coinvolge diversi centri italiani. Questo studio prende in considerazione due tra le maggiori demenze neurodegenerative primarie, la malattia di Alzheimer e la degenerazione frontotemporale lobare. Si tratta di forme di demenza diffuse nell'età senile e destinate a coinvolgere un numero sempre più elevato di soggetti per il progressivo invecchiamento della popolazione dei paesi occidentali avanzati e di quelli in via di sviluppo. La malattia di Alzheimer e la degenerazione frontotemporale lobare sono caratterizzate da un deterioramento progressivo delle funzioni cognitive cerebrali che si manifestano solitamente in modo sporadico. Tuttavia ne esistono alcune forme, denominate familiari, in cui i segni ed i sintomi della patologia si manifestano in più persone appartenenti allo stesso nucleo familiare. In quest ultimo caso è presente sin dalla nascita un alterazione in un gene, ma i segni ed i sintomi clinici ad essa associati insorgono nell età adulta. Si tratta, in generale, di forme trasmesse con modalità definita di tipo autosomico dominante. La presenza di un singolo gene mutato è considerata responsabile di una eventuale insorgenza della malattia, tuttavia la comparsa della demenza è influenzata anche da fattori ambientali e/o biologici ancora in gran parte da determinare. Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 2
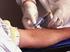
3 L obiettivo di questo progetto di ricerca è quello di acquisire informazioni cliniche, biologiche, genetiche, neurofisiologiche e di neuroimmagine da persone appartenenti a famiglie in cui è già stata identificata la mutazione genetica causativa della degenerazione frontotemporale lobare o della malattia di Alzheimer. Le forme di demenza familiare sono di grande rilevanza per la comprensione dei meccanismi della malattia, per l identificazione di marcatori precoci e per l attuazione di interventi terapeutici tempestivi. Dal momento che le forme di demenza a trasmissione genetica sono rare, è importante riuscire a raccogliere e condividere una grande mole di dati in maniera coerente, in modo da poterle comprendere ed affrontare meglio. Le chiediamo di partecipare a questo studio perché, come Lei sa, nella Sua famiglia è stata identificata una mutazione genetica causativa della malattia di Alzheimer. Lei ha già partecipato ad un percorso di consulenza genetica per le malattie degenerative a trasmissione familiare che ha previsto l effettuazione del test genetico. Ora, entrando a far parte di questo studio, Le verrà chiesto di effettuare gli esami e le visite descritti di seguito. Chi è il Personale Medico che segue lo studio? Lo studio coinvolge più figure professionali e, nello specifico, Medici/Neurologi, Radiologi, Genetisti, Psicologi/Psichiatri. Durante tutte le fasi dello studio queste figure saranno a Sua disposizione per fornirle eventuali informazioni e/o chiarimenti e per darle tutto il supporto di cui dovesse avere bisogno. A chi dovrò rivolgermi se avrò delle domande? Lei potrà rivolgersi al medico responsabile dello studio per qualsiasi domanda o chiarimento. Può contattare il dott. Giovanni B. Frisoni al numero oppure all indirizzo di posta elettronica gfrisoni@fatebenefratelli.eu Saranno sufficienti le informazioni che fornirò io? Oltre a Lei ci avvarremo di almeno un altra persona per ottenere specifiche informazioni che la riguardano. Le verrà chiesto di indicare 2 persone che la conoscono bene, ma che non siano Suoi consanguinei. Esse rappresenteranno una fonte di informazione collaterale, ovvero ci permetteranno di raccogliere ulteriori informazioni sulla Sua persona. Lei dovrà presentarsi di persona presso il Centro per affrontare le visite ed effettuare gli esami, mentre la Sua fonte collaterale, nel caso in cui non sia disponibile, potrà anche essere contattata telefonicamente. Cosa mi verrà chiesto di fare durante lo studio? Durante lo studio verranno effettuate visite mediche e alcune indagini strumentali. Queste sono descritte sotto in modo che Lei possa comprenderne meglio la procedura. Nel riquadro successivo invece vengono descritti i relativi possibili effetti collaterali. PRELIEVO DI SANGUE: Le verrà prelevato un campione di sangue, da una vena del Suo braccio (75 ml). Ciò al fine di eseguire test di laboratorio per identificare eventuali marcatori precoci di malattia. Nel caso Lei fornisca il Suo consenso, in un secondo momento Le verrà prelevata un ulteriore quota di sangue (40 ml) per il Centro DIAN Americano (US-DIAN), promotore dello studio sulle forme autosomiche dominanti di malattia di Alzheimer ed i cui scopi sono riportati nel riquadro che segue Centro DIAN Americano, per scopi di ricerca strettamente connessi all ambito scientifico di indagine qui illustrato. Da ogni campione di sangue verranno estratti siero, globuli rossi, plasma, DNA e linfociti. Parte del campione verrà analizzato per fini diagnostici e parte verrà preparato per la crioconservazione (ibernazione in azoto liquido). PRELIEVO DI LIQUIDO CEREBROSPINALE (PUNTURA LOMBARE): Verrà prelevata, nella parte inferiore della sua schiena, del liquido spinale (16 ml) il quale si trova attorno al cervello ed al midollo spinale, al fine di analizzarne i livelli di alcune proteine, tra le quali la beta-amiloide e la tau, coinvolte Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 3
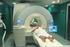
4 nell insorgenza di diverse malattie neurodegenerative. Tale procedura va effettuata a digiuno, per cui non dovrà né mangiare né bere niente (ad eccezione dell acqua, che è permessa) dalla mezzanotte antecedente il prelievo. I Suoi segni vitali (temperatura corporea, pulsazioni, pressione sanguigna, respirazione) saranno misurati sia prima di eseguire la puntura lombare che dopo, in modo da tenere sotto controllo le Sue condizioni fisiche. Lei verrà fatto sdraiare, in posizione rannicchiata, o rimarrà seduto, leggermente piegato in avanti. Dopo aver disinfettato la zona di interesse con un antisettico, verrà eseguita un anestesia locale. Quando la zona sarà insensibile, verrà effettuata la puntura lombare (nota anche come puntura spinale) utilizzando un ago molto sottile, che sarà inserito nel canale spinale dell area lombare, ben al di sotto del livello in cui termina il midollo spinale. La quantità di liquido spinale prelevata verrà immagazzinata e poi analizzata. Dopo aver effettuato la puntura lombare dovrà rimanere in clinica per circa 2 ore, durante le quali il personale dello studio monitorerà le Sue condizioni. Le verrà dato qualcosa da bere prima di andarsene. Nelle successive 24 ore, non dovrà praticare attività fisica intensa. Non potrà quindi sollevare pesi, fare piegamenti, fare i lavori di casa o di giardinaggio, correre o andare in bicicletta. Il giorno dopo l esame verrà contattato da una persona del gruppo di ricerca che Le chiederà informazioni sulle Sue condizioni di salute. Nel caso Lei fornisca il Suo consenso, nella stessa seduta Le verrà prelevata una quota aggiuntiva di liquido spinale (7 ml) per il Centro DIAN Americano (US-DIAN), promotore dello studio sulle forme autosomico dominanti di malattia di Alzheimer ed i cui scopi sono riportati nel riquadro che segue Centro DIAN Americano, per scopi di ricerca strettamente connessi all ambito scientifico di indagine qui illustrato. VALUTAZIONE CLINICA: Durante questa visita sarete presenti sia Lei che la fonte collaterale che Lei ha indicato. Le verranno chieste informazioni demografiche e riguardanti la Sua storia medica generale, i farmaci che attualmente sta assumendo e la Sua storia familiare. Le verranno poste domande su questioni riguardanti la Sua vita quotidiana (per esempio, le attività che svolge, i Suoi hobby, le Sue relazioni sociali), sul Suo umore oltre che sull eventuale presenza di qualche difficoltà/disfunzione che Lei riscontra (per esempio a livello cognitivo, come attenzione o memoria, e/o comportamentale, come agitazione o irascibilità). La raccolta di queste informazioni avverrà attraverso l utilizzo di specifici questionari ed interviste. Verrà infine effettuato un esame medico obiettivo, attraverso il quale si osserveranno le Sue condizioni fisiche generali e si valuterà la Sua funzionalità motoria (per esempio, la coordinazione e l equilibrio). Tale visita durerà approssimativamente 1 ora. VALUTAZIONE NEUROPSICOLOGICA: Durante questa valutazione, sarà sottoposto a test che valutano il Suo funzionamento cognitivo generale. Saranno valutate le Sue capacità di: orientamento spaziale e temporale, attenzione e concentrazione, memoria, linguaggio, coordinazione dei gesti, abilità visuo-spaziali, di pianificazione e di giudizio. Alcune di queste prove Le saranno somministrate in modalità cartacea, altre attraverso l utilizzo di un computer. Le sarà inoltre chiesto di compilare un Questionario in cui le si presenteranno domande generali rispetto ad alcuni comportamenti. Tale valutazione durerà approssimativamente 2 ore e mezza e non coinvolgerà la fonte collaterale. ELETTROENCEFALOGRAMMA (EEG): Le verrà chiesto di sottoporsi ad un elettroencefalogramma, al fine di raccogliere informazioni utili circa l attività elettrica generale delle Sue cellule cerebrali (i neuroni) a riposo, con occhi chiusi e aperti. Verranno posizionati sulla Sua testa degli elettrodi (piccoli dischi di metallo), con l aiuto di una pasta o di un gel conduttore, dopo aver sgrassato la zona di interesse, in modo da permettere una migliore registrazione del segnale. RISONANZA MAGNETICA CEREBRALE (RMN): Le verrà chiesto di sottoporsi ad una risonanza magnetica del cervello. Una RM è una fotografia elettronica del Suo cervello creata attraverso l uso di un potente magnete, ma senza l utilizzo di raggi X. Tale esame permette di visualizzare nel dettaglio le strutture anatomiche del Suo cervello, le maggiori connessioni anatomiche e l attività funzionale a riposo. Sarà fatto sdraiare sulla schiena all interno di un grossa apertura cilindrica, in cui è posizionato lo scanner, e durante l esame sentirà come un rumore di colpi. Le saranno fornite delle cuffie in modo da attenuare il rumore ed in modo che il medico possa comunicare con Lei durante l esame. L esame durerà circa 1 ora. Prima di entrare nello scanner Le sarà chiesto di togliere, nel caso ne sia provvisto/a, orecchini, fermagli per i capelli, dentiera, collane ed ogni oggetto, metallico e non, che potrebbe interferire con l esame. In ogni caso, il medico che effettuerà l esame si accerterà dell eseguibilità dello stesso. La RM non può essere Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 4
5 inoltre eseguita su persone che hanno installato un pacemaker, clip chirurgiche o altri impianti metallici. Nel caso Lei avesse installato qualcuno di questi impianti avverta il medico responsabile dello studio. In ogni caso, alla fine di questo foglio informativo troverà un questionario relativo alla RM che ci permetterà di definire, in base alle risposte che Lei fornirà, se può sottoporsi a questo esame. IMAGING CEREBRALE FUNZIONALE CON RADIOTRACCIANTE: Le verrà chiesto di sottoporsi ai due seguenti esami: (1) un esame di PET CON DESOSSIGLUCOSIO (FDG-PET) per lo studio della funzione cerebrale nelle diverse aree coinvolte nella genesi dei disturbi cognitivi. L intero esame richiederà circa 90 minuti. Le verrà chiesto di presentarsi a digiuno. Le verrà iniettato il radiotracciante ( MBq di Fluoro DesossiGlucosio, F18-FDG) nella vena del braccio, e dopo circa minuti Le sarà chiesto di posizionarsi all interno di un grossa apertura cilindrica, in cui è posizionato lo scanner, per 40 minuti. Durante questo periodo lo scanner acquisirà delle immagini del metabolismo del glucosio nel Suo cervello. (2) un esame PET CON TRACCIANTE PER L AMILOIDE (Amyloid-PET) * per l individuazione dei depositi nel cervello di proteina beta amiloide, proteina anomala che si deposita tra i neuroni portandoli a sofferenza, oltre ad essere implicata in diverse malattie neurodegenerative. L intero esame richiederà circa 2 ore. Le verrà iniettato una piccola quantità ( MBq) del radiotracciante (Florbetapir) in una vena del braccio e dopo circa minuti Le sarà chiesto di posizionarsi all interno di un grossa apertura cilindrica, in cui è posizionato lo scanner PET. Durante l esame PET Lei starà disteso/a e immobile nel lettino dello scanner mentre verranno acquisite le immagini del Suo cervello, in minuti circa. Un membro del nostro staff sarà presente mentre viene eseguita la procedura e La terrà sotto osservazione. Qualora manifestasse qualsiasi reazione avversa, non sarà dimesso/a fino a quando l evento non si sarà risolto o stabilizzato. È possibile che, se le immagini della prima scansione non saranno utilizzabili, Lei sia ricollocato/a nello scanner PET per una seconda scansione PET (anche questa della durata di minuti). Troverà un questionario relativo alle indagini con radiotracciante alla fine di questo foglio informativo. Tale questionario verrà utilizzato per determinare se è possibile sottoporla a queste indagini. * Per questo esame strumentale verranno definiti un foglio informativo e un consenso informato specifici a parte. PRELIEVO URINA: Le verrà chiesto di acquisire un campione di urina (20 ml) BIOPSIA CUTANEA: Verrà eseguito il prelievo di un piccolo frammento di cute (2 flask da 75 cm 2 con punch da 3 mm), al fine di valutare la presenza di alterazioni biochimiche in cellule denominate fibroblasti. Il prelievo viene eseguito in anestesia locale a livello della spalla. Non è previsto che Lei riceva l esito degli esami sopraelencati che effettuerà. Qualora lo desiderasse, potrà richiedere la refertazione di uno o più degli esami effettuati, contattando il medico responsabile dello studio [nome cognome]. L Allegato 1 specifica le sedi in cui recarsi per effettuare gli esami previsti dallo studio e sopra elencati. Centro DIAN Americano (US-DIAN) US-DIAN è stato istituito a Washington (USA) nel 2008 dal National Institute on Aging (NIA) e si propone di studiare le rare forme ereditarie di malattia di Alzheimer causate dalla mutazione di un gene. Comprendere le suddette forme di Alzheimer può permettere di ottenere anche delle informazioni rilevanti su altre forme di demenza e di sviluppare trattamenti specifici per curarle. Lo studio americano è coordinato dal Dott. John Carl Morris, presso l Università di Washington. L obiettivo dello US-DIAN è quello di raccogliere longitudinalmente dati cognitivi, clinici, biologici e di neuroimmagine nei portatori della mutazione genetica - sintomatici e asintomatici - e sui loro familiari non portatori della mutazione. Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 5
6 Attualmente il DIAN americano coinvolge 13 Istituti di ricerca negli Stati Uniti, in Gran Bretagna, in Germania ed in Australia. Tutte le informazioni relative allo US-DIAN possono essere ricavate dal sito dedicato reperibile attraverso il seguente link: Quali effetti avversi o rischi mi posso aspettare da questo studio? PRELIEVO DEL SANGUE. Il prelievo di sangue attraverso un ago e una siringa può occasionalmente essere doloroso o produrre un livido nella sede della puntura, ma ciò è temporaneo. Alcune persone possono provare affaticamento o vertigini e c è anche una piccola possibilità di avere infezione nella sede della puntura. Per minimizzare questa possibilità, tutti i prelievi del sangue verranno effettuati da personale medico o infermieristico esperto e verranno mantenute condizioni di sterilità. PUNTURA LOMBARE. La raccolta di liquido cerebrospinale non comporta alcun rischio significativo. Durante questa procedura, Lei potrebbe provare un temporaneo dolore e disagio alla schiena. La puntura causa cefalea in meno del 4% dei casi e questa cefalea passa al massimo dopo pochi giorni. Effetti avversi possibili ma estremamente rari sono l infezione, il danno alle radici nervose e il sanguinamento. Per minimizzare questi eventi avversi, la puntura lombare verrà effettuata da un medico specificamente qualificato per questa procedura. PRELIEVO URINA. Nessuna controindicazione. BIOPSIA CUTANEA. Il prelievo di un frammento di cute non è doloroso, in quanto viene effettuato in anestesia locale e, in genere, non lascia cicatrici e non comporta alcun tipo di disturbo. I pazienti in genere riportano soltanto un senso di tensione della pelle nell'area interessata dall'indagine. Il fastidio che si potrebbe riscontrare nei due giorni successivi all'esame, si allevia facilmente con la semplice applicazione di ghiaccio. VALUTAZIONE CLINICA E NEUROPSICOLOGICA. Non comportano alcuna alterazione né sul piano fisico, né su quello comportamentale. Potrà tuttavia percepire alcuni compiti stancanti o alcune domande noiose o imbarazzanti. Lei potrà decidere di non rispondere alle domande che dovesse giudicare non opportune. EEG. L elettroencefalogramma è un esame molto sicuro. Viene registrata l attività elettrica del cervello, ma in nessun momento vi è passaggio di corrente attraverso il Suo corpo. Potrebbe residuare sui capelli il gel utilizzato per migliorare la registrazione EEG, ma verrà lavato via con uno shampoo. RMN. La RMN non è considerata pericolosa a meno che Lei non abbia pacemakers o impianti metallici ferromagnetici di diversa natura (incluse protesi) nel corpo. Se si trova in uno di questi casi, NON POTRA ESSERE SOTTOPOSTO ad esame di RM. Inoltre, NON POSSONO ESSERE SOTTOPOSTI all esame di RM le persone che soffrono di claustrofobia e le donne in stato di gravidanza. Sulla base del questionario collocato alla fine di questo foglio informativo, potremmo decidere se nel Suo caso sarà possibile effettuare una RM. TECNICHE DI IMAGING CEREBRALE CON RADIOTRACCIANTE: Sulla base del questionario collocato alla fine di questo foglio informativo, potremmo decidere se nel Suo caso sia possibile effettuare un indagine cerebrale con radiotracciante. Poiché prima dell esecuzione dell esame Le verrà iniettata nella vena del braccio una piccola quantità di radiotracciante, l inserimento dell ago può occasionalmente esser doloroso o produrre un livido nella sede della puntura, ma ciò è temporaneo. In rare occasioni l inserimento di un ago può provocare sanguinamento, formazione di un coagulo ematico, gonfiore o infezione nella sede di iniezione. Nel caso sperimentasse reazioni avverse al radiotracciante nel corso dello studio, Le chiediamo di contattare immediatamente il medico che La ha in cura. NON POSSONO ESSERE SOTTOPOSTE agli esami di imaging cerebrale con radiotracciante le persone che soffrono di claustrofobia e le donne in stato di gravidanza e allattamento. Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 6
7 PET CEREBRALE CON RADIO TRACCIANTE PER L AMILOIDE: è necessario non intraprendere una gravidanza nei 10 giorni precedenti all esame e durante le 24 ore successive allo stesso/non far intraprendere una gravidanza alla partner durante le 24 ore successive all esame. L esame PET con il tracciante per l amiloide comporta il ricevere una piccola dose di radioattività dovuta all iniezione del radio tracciante. Il tracciante per l amiloide è utilizzato in dosi molto basse, indicate da studi precedenti come ben al di sotto dei livelli noti per avere effetti misurabili sul corpo. Benchè l esposizione a radiazioni aumenti il rischio di sviluppare tumori, la quantità totale di radiazione proveniente dall esame PET con il tracciante per l amiloide (3.5-7 msv) e dall associata tomografia computerizzata (TC) a bassa dose (1 msv), eseguita come parte dell esame PET, è circa equivalente alla dose media di radioattività naturale cui è esposta una persona che abita in Grecia o in Finlandia per un anno ("Natural Radiation Atlas of Europe". National Radiological Protection Board for the Commission of the European Communities, 1992). Chieda al medico responsabile dello studio [dott. Giovanni B. Frisoni] se ha qualsiasi domanda riguardo gli eventi avversi. Cosa succede se dovessi riscontrare dei danni a causa dello studio? I ricercatori dell IRCCS Centro San Giovanni di Dio Fatebenefratelli di Brescia e gli altri professionisti cercheranno di ridurre, controllare e curare ogni complicazione che dovesse emergere in questo studio. Se Lei sviluppasse qualche malattia o si facesse male mentre sta partecipando allo studio dovrà ricorrere immediatamente alle cure mediche di cui ha bisogno. Per quanto riguarda gli eventi avversi legati all esame PET per l amiloide, verrà stipulata una polizza ad hoc che sarà operativa per le lesioni che si verifichino entro 10 (dieci) anni (e 1 anno aggiuntivo per la presentazione di richieste di risarcimento) dalla data di conclusione dello studio e per le quali sia richiesto il risarcimento entro 36 (trentasei) mesi dalla data di conclusione dello studio. Che benefici mi posso aspettare da questo studio? In termini immediati, lo studio non apporterà alcun vantaggio alla Sua persona. Tuttavia, i risultati e le conclusioni tratte da tale studio permetteranno di migliorare le conoscenze relative alle forme familiari di demenza ed ai meccanismi sottostanti. Inoltre i risultati dello studio potrebbero, in futuro, aiutare a sviluppare terapie efficaci per i pazienti affetti da malattia di Alzheimer e degenerazione frontotemporale lobare. Nel caso in cui in futuro fossero disponibili dei farmaci sperimentali (farmaci ancora in fase di studio), che potrebbero apportarle un qualche beneficio, se lo desidera sarà contattato dal medico responsabile dello studio, il quale Le chiederà se Lei voglia provare ad assumere il nuovo farmaco. Devo pagare qualcosa per la partecipazione allo studio? Essendo parte integrante dello studio, tutti i test e le procedure che Lei riceverà non avranno un costo per Lei. Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 7
8 Sono obbligato a rimanere nello studio? Lei può decidere di interrompere la Sua partecipazione allo studio in qualsiasi momento, senza dover dare alcuna spiegazione. La Sua decisione non influenzerà le eventuali cure di cui dovesse necessitare in futuro. Chiami il medico responsabile dello studio se deciderà di non voler più farne parte. Condivideremo con Lei ogni nuova informazione che potrebbe influire sulla Sua scelta di rimanere nello studio. Voi potete decidere di escludermi dallo studio a cui io ho fornito il Consenso? Noi potremmo chiederle di lasciare lo studio se: non fosse in grado di eseguire le istruzioni richieste dalle procedure dello studio manifestasse nuovi problemi di salute durante lo studio il medico responsabile dello studio riterrà, alla luce della situazione clinica, che sia nel Suo migliore interesse interrompere lo studio. Come verranno trattati i miei dati personali? Il trattamento delle Sue informazioni personali avverrà nel rispetto della vigente normativa sulla privacy (Decreto Legislativo 30 giugno 2003 n.196 Codice in materia di protezione dei dati personali GU n.174 del 29 luglio 2003). Tutti i dati acquisiti saranno trattati in forma anonima, secondo le procedure descritte nell Allegato 2. Alla Sua identità potrà risalire soltanto il ricercatore che eseguirà lo specifico esame o la specifica visita. Nessun altra persona potrà risalire al Suo nome, al Suo indirizzo, alla Sua data di nascita completa o ad altre informazioni sensibili che potrebbero condurre a Lei. Ciò al fine di garantire la Sua privacy. Come verranno gestiti i dati raccolti durante lo studio e gli esiti delle mie valutazioni? Le informazioni che Lei fornirà e gli esami che effettuerà saranno tutti provvisti di un Codice univoco, che identificherà solo la Sua persona. I Suoi esami e le Sue valutazioni saranno conservati presso l IRCCS Fatebenefratelli di Brescia. Nessuno, al di fuori del ricercatore che eseguirà lo specifico esame o la specifica visita, potrà risalire alla Sua persona basandosi sui dati contrassegnati con il Codice univoco. Tutti i Suoi dati digitalizzati saranno inoltre anonimizzati ed archiviati su una piattaforma centralizzata e sicura gestita dall IRCCS Fatebenefratelli di Brescia, coordinatore del progetto (Responsabile della piattaforma: Dr. Giovanni B. Frisoni), secondo le procedure descritte nell Allegato 2. Nello specifico, i dati clinici, neurofisiologici, di neuroimmagine e le informazioni biologiche che La riguardano saranno contrassegnati con un codice numerico e non riporteranno il Suo nome o altre informazioni in grado di identificarla direttamente. Alcune informazioni riguardo le Sue condizioni cliniche, sempre in forma anonima, verranno utilizzate per costruire un Registro Epidemiologico Nazionale delle forme genetiche di demenza. Per maggiori dettagli sul registro faccia riferimento al riquadro Registro Epidemiologico che segue. Una parte dei campioni biologici (18 ml di sangue, 9ml di CSF), sarà conservata nella Banca di Materiale Biologico ( Biobanca ) dall IRCCS Fatebenefratelli di Brescia e utilizzata conformemente alle regole previste nel Codice Etico per l utilizzazione del materiale biologico, a fini di ricerca o sperimentazione elaborato dal Comitato Etico dell IRCCS Centro San Giovanni di Dio Fatebenefratelli di Brescia (Allegato 4). Una parte dei campioni biologici (57 ml di sangue, 7ml di CSF, 20 ml di urina, fibroblasti in 2 flask da 75 cm 2 ), anonimizzati, sarà spedita e conservata nella Biobanca dell IRCCS Fondazione Istituto Neurologico Carlo Besta di Milano (Responsabile: dott. Tagliavini), secondo le procedure descritte nell Allegato 3. Previo Suo consenso, un ulteriore quota di materiale biologico (40ml di sangue, 7ml di CSF) sarà inviata, anonimizzata, al Centro DIAN americano (Responsabile: dott. Morris) e trattata secondo la regolamentazione locale ( Le informazioni raccolte che La riguardano saranno combinate, in forma anonima, con le informazioni di Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 8
9 altre persone partecipanti allo studio, al solo scopo di ricerca. Se Lei fornirà il Suo consenso, ci consentirà di utilizzare e di condividere con i partners del progetto DIAfN le Sue informazioni in forma anonima anche oltre il termine dello studio. Se Lei fornirà il Suo consenso, al termine dello studio i Suoi dati in forma anonima verranno condivisi ed utilizzati dalla comunità scientifica per scopi di ricerca strettamente connessi all ambito scientifico di indagine indicato in questo modulo informativo, al solo fine di arricchire le attuali conoscenze sulla demenza frontotemporale e sulla malattia di Alzheimer in modo da poter migliorare ed accrescere le nostre capacità di curarle. I risultati dello studio verranno pubblicati su riviste mediche e presentati a convegni. Registro Epidemiologico Lo studio si propone di costituire, sul territorio nazionale, un Registro Epidemiologico (Responsabile: Dr. Fabrizio Tagliavini) per le forme familiari di demenza. Tale registro includerà in forma anonima una serie di informazioni sulle famiglie con storia positiva per forme autosomiche dominati di AD o FTLD. Nello specifico, il Registro Epidemiologico raccoglierà informazioni relative al sesso, all età, alle indagini genetiche effettuate, alle condizioni cliniche, al tipo di malattia neurodegenerativa riscontrata nella famiglia, all età d insorgenza della malattia nella famiglia, all evoluzione della malattia. Non verranno invece inseriti i dati sensibili, in modo da garantire il rispetto della privacy. Queste informazioni sono fondamentali per la ricerca sulla cause della malattia, per la valutazione dei trattamenti più efficaci e per la progettazione di interventi di prevenzione. Posso conoscere i risultati dello studio? Se Lei lo desidera e lo richiederà, alla fine dello studio potranno esserle comunicati i risultati emersi dalla ricerca in generale. Se lascio lo studio come verranno trattati le informazioni precedentemente acquisite e gli esiti degli esami effettuati? Se Lei decide di abbandonare lo studio, non verranno più raccolti campioni biologici o informazioni che La riguardano. Firmando questo consenso, Lei ci darà il permesso di utilizzare le informazioni che ci ha fornito prima di lasciare lo studio per scopi di ricerca strettamente connessi all ambito scientifico di indagine indicato in questo foglio informativo. Tali informazioni saranno conservate anche al termine dello studio. Qualora ne faccia esplicita richiesta, provvederemo alla distruzione dei campioni biologici e alla rimozione di tutte le informazioni che La riguardano dalla piattaforma centralizzata. Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 9
10 QUESTIONARIO PER LA RISONANZA MAGNETICA (RMN) Si prega di rispondere alle seguenti domande segnando Sì o No. Queste domande riguardano condizioni che possono influire sulla sua salute e sicurezza e/o alterare la qualità dell esame di RM. Se Lei non comprende qualcuna di queste domande, chieda chiarimenti al medico responsabile dello studio. 1. Lei è portatore di pacemaker o di valvola cardiaca artificiale SÌ / NO 2. Lei ha mai avuto un intervento chirurgico? SÌ / NO Se sì, che tipo di operazione ha subìto? 3. Lei è portatore di qualche protesi artificiale o di impianti metallici? SÌ / NO 4. Lei ha qualche frammento metallico nel Suo corpo, per esempio da una ferita di guerra o da un incidente sul lavoro? SÌ / NO 5. Lei è portatore di protesi o di impianti (per esempio ai denti, o protesi d anca)? SÌ / NO 6. Lei è portatore di un apparecchio acustico? SÌ / NO 7. Lei soffre di claustrofobia? SÌ / NO 8. (Solo per donne in età fertile): Lei è in stato di gravidanza? SÌ / NO Io confermo di avere letto le precedenti domande e che le mie risposte sono corrette per quanto meglio conosco e credo. SÌ /NO QUESTIONARIO PER LE INDAGINI CON RADIOTRACCIANTE: Si prega di rispondere alle seguenti domande segnando Sì o No. Queste domande riguardano condizioni che possono influire sulla sua salute e sicurezza e/o alterare la qualità dell esame con radiotracciante. Se Lei non comprende qualcuna di queste domande, chieda chiarimenti al medico responsabile dello studio. 1. Lei soffre di claustrofobia? SÌ / NO 2. (Solo per donne in età fertile): Lei è in stato di gravidanza? SÌ / NO 3. (Solo per donne in età fertile): Lei sta allattando? SÌ / NO Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 10
11 ALLEGATO 1. SEDE IN CUI RECARSI PER EFFETTUARE GLI ESAMI I partecipanti al progetto di ricerca Italian Network for autosomal dominant Alzheimer s disease and frontotemporal lobar degeneration dovranno recarsi presso le seguenti sedi per poter effettuare gli esami previsti dal protocollo di ricerca. RISONANZA MAGNETICA (RMN) Servizio di Neuroradiologia - Azienda Ospedaliera Universitaria Integrata di Verona P.le Stefani 1, A VERONA Responsabile: Dott. Alberto Beltramello TOMOGRAFIA AD EMISSIONE DI POSITRONI (PET con Desossiglucosio) U.O Medicina Nucleare Dipartimento di Radiologia e Diagnostica per Immagini Fondazione Poliambulanza Istituto Ospedaliero via Bissolati, 57, BRESCIA Responsabile: Dott. Ugo Paolo Guerra EEG; Prelievo di Sangue; Prelievo di Urina; Biopsia Cutanea; Puntura Lombare; Valutazione Clinica, Neurologica e Neuropsicologica IRCCS Centro San Giovanni di Dio Fatebenefratelli Via Pilastroni, BRESCIA Responsabile: Dott. Giovanni B. Frisoni Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 11
12 ALLEGATO 2. PROTOCOLLO PER LA PROTEZIONE E LA SICUREZZA DEI DATI Tutti i dati che saranno condivisi sulla piattaforma centralizzata saranno anonimizzati secondo le procedure descritte nel paragrafo del documento Protocol for ensuring data protection/safety in neugrid elaborato dall Istituto Centro San Giovanni di Dio Fatebenefratelli di Brescia nell ambito del progetto Europeo neugrid ( Tali procedure prevedono che il centro che ha raccolto i dati provveda, prima della condivisione dei dati: 1) alla rimozione di tutti i campi identificativi (vedere elenco sotto) dai dati clinici 2) alla rimozione di tutti i campi identificativi (vedere elenco sotto) dai dati di risonanza magnetica (DICOM headers) 3) alla rimozione delle informazioni biometriche (de-facing) dai dati di risonanza magnetica strutturale, per evitare l identificazione del volto 4) all assegnazione di un codice numerico identificativo 5) alla trasmissione dei dati clinici e di risonanza magnetica al centro coordinatore attraverso una connessione web sicura Elenco dei campi identificativi che saranno rimossi: (A) Nomi; (B) Indicazioni geografiche locali (città, indirizzi, vie, CAP, coordinate geografiche); (C) Tutte le informazioni relative a date (ad eccezione dell anno) per le date direttamente associate ad un soggetto, ad esclusione di: - data di nascita (mese e anno ammessi); - data della visita/esame (giorno, mese ed anno ammessi); - data della morte (mese ed anno ammessi); (D) Numeri telefonici; (E) Numeri di fax; (F) Indirizzi di posta elettronica; (G) Codice fiscale; (H) Numero di tessera sanitaria; (I) Numero dell assicurazione sanitaria; (J) Numeri di conto (bollette, conto corrente, carte di credito, etc ); (K) Numeri di certificati/licenze; (L) Identificativi di veicoli e numeri seriali, incluso il numero di targa; (M) Identificativi di apparecchiature e numeri seriali; (N) Indirizzi Web (URLs); (O) Indirizzi di Internet Protocol (IP); (P) Dati biometrici, incluse impronte digitali e registrazioni vocali; (Q) Fotografie del volto e qualsiasi immagine simile; (R) Qualsiasi altro numero identificativo, caratteristica, o codice univoci. Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 12
13 ALLEGATO 3. BANCA DI MATERIALE BIOLOGICO (IRCCS ISTITUTO NEUROLOGICO CARLO BESTA). La Biobanca è un unità di servizio, senza scopo di lucro diretto, finalizzata alla raccolta e alla conservazione di materiale biologico umano utilizzato per diagnosi, per studi sulla biodiversità e per ricerca. La Biobanca nasce nell ambito del progetto Italian Diafn (Network Italiano per le forme autosomiche dominanti di malattia di Alzheimer e di Degenerazione Frontotemporale Lobare) in risposta all esigenza di avere un sistema affidabile e valido per la collezione e la conservazione di campioni biologici di varia natura provenienti da pazienti affetti da patologie neurodegenerative a base genetica. La Biobanca è localizzata presso l IRCSS Fondazione Istituto Neurologico Carlo Besta di Milano, via Celoria 11, Milano. Struttura La Biobanca è installata presso la Criobanca, operativa presso l Istituto Neurologico C. Besta dal 2005 e gestita dal servizio CryoManagement di SOL SpA che, con l ausilio di strumentazioni e software dedicati, garantisce la massima sicurezza sia per i campioni biologici sia per gli operatori in conformità della normativa vigente (2004/23/CE, DLgs 19/08/2005 n. 191, GMP, GAMP(4), standard FACT e JACIE). La Criobanca è costituita da 2 aree principali: un locale adibito a sede dei computer di monitoraggio della sala e di quelli contenenti i data base (sala di controllo), e da una sala contenente i contenitori criogenici, ognuno dei quali è collegato alla sala controllo in modo che la temperatura venga costantemente controllata 24 ore su 24. L accesso alla sala controllo e alla sala congelatori avviene tramite l utilizzo di badge elettronici e solo il personale addetto e autorizzato può accedere all interno. La conservazione dei campioni viene fatta in sistemi criogenici in cui le provette contenenti i campioni biologici sono conservate in azoto liquido a temperatura di -196 C. Questi sistemi criogenici da un lato assicurano ottimali condizioni di stabilità per i campioni biologici, e dall altro rendono di facile identificazione i campioni archiviati attraverso sistemi di mappatura gestiti tramite data base, il tutto appositamente progettato per applicazioni specifiche. Nella struttura sono presenti 18 contenitori per il stoccaggio di materiale in azoto liquido, ognuno dei quali può contenere sino a campioni, e un congelatore per campioni UPTC con metodo della discesa controllata della temperatura. I campioni conservati sono circa , con una movimentazione media annua di circa nuovi campioni in ingresso e campioni in uscita. Organizzazione La gestione (accettazione, ricevimento e archiviazione dei dati) dei campioni provenienti dal Network Italian Dian è affidata al personale della Biobanca, così organizzato: Responsabile della Biobanca: Personale sanitario: Dr. Fabrizio Tagliavini Dr.ssa Suardi Silvia; Dr.ssa Luisa Palamara; Piero Tieni (Responsabile Criobanca) I campioni biologici già anonimizzati, una volta arrivati presso la Biobanca, vengono etichettati con apposite etichette riportanti un codice a barre univoco e tutti i dati disponibili (codice paziente, genere, anno di nascita, tipo di campione, data di prelievo, volume totale prelevato) vengono inseriti nel software di gestione della Biobanca dal personale sanitario addetto. Una volta terminato il processo di etichettatura, i campioni sono immediatamente trasferiti nei contenitori criogenici dal personale della CryoSol. I campioni biologici verranno conservati nella Biobanca anche oltre il termine dello studio. La privacy dei pazienti è così pienamente salvaguardata dalla protezione dei dati, che non sono consultabili se non dagli addetti ai lavori, e sono conservati in luogo non accessibile ai non autorizzati. Non compariranno mai da nessuna parte il Suo nome, il Suo indirizzo, la Sua data di nascita completa o altre informazioni sensibili che potrebbero ricondurre a Lei. Utilizzo dei campioni I campioni conservati nella Biobanca sono disponibili sia per indagini diagnostiche in tempi successivi al loro prelievo sia per studi clinici. L accesso al servizio deve essere preceduto dalla compilazione di appositi moduli di richiesta di consegna dei campioni in Biobanca (MOD A) e di moduli di richiesta di prelievo di campioni per uso personale (MOD B) spediti via fax al o tramite mail al seguente indirizzo di posta elettronica: neuropatologia@istitutobesta. La conservazione e la distribuzione dei campioni conservati in Biobanca avviene secondo gli accordi definiti nel documento di Accordo tra le Parti del Network. Peculiarità della Biobanca L aspetto innovativo della Biobanca consiste nella drastica riduzione dei tempi della ricerca, grazie alla possibilità per gli scienziati di disporre immediatamente di campioni biologici di persone affette, portatrici, o predisposte a patologie su base genetica o ambientale, o che manifestano variabilità alla risposta ai farmaci. La Biobanca facilita e rende più rapido il passaggio dalla ricerca di base alla ricerca traslazionale, ovvero al trasferimento dei risultati ottenuti in laboratorio, in vitro, all ambito clinico-assistenziale. Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 13
14 ALLEGATO 4. CODICE ETICO PER LA UTILIZZAZIONE DI MATERIALE BIOLOGICO A FINI DI RICERCA O SPERIMENTAZIONE Data dell ultima revisione: Questo Codice etico è stato elaborato dal Comitato Etico delle Istituzioni Ospedaliere Cattoliche Bresciane (CEIOC), che nel suo operare s ispira alla tradizione e all insegnamento della Chiesa Cattolica. Il codice è quindi da leggere alla luce di tale tradizione e di tale insegnamento. 1. Il presente Codice etico si applica al prelievo e all utilizzazione per fini di ricerca o sperimentazione di materiali biologici presso le istituzioni che fanno riferimento al CEIOC, siano o meno conservati tali materiali in una banca biologica. Si considera banca biologica ai sensi di questo Codice qualsiasi deposito di materiale biologico per fini di ricerca o sperimentazione. È vietata qualsiasi commercializzazione o utilizzazione a scopo di lucro del materiale biologico prelevato. 2. Il materiale biologico verrà acquisito e utilizzato per fini di ricerca o sperimentazione solo previo consenso informato della persona da cui il materiale proviene al prelievo, alla utilizzazione nell ambito di una specifica attività di ricerca o sperimentazione e, ove sia attuato, all inserimento in una banca biologica. L eventuale, successiva utilizzazione del materiale biologico per altre attività di ricerca o sperimentazione necessiterà di una nuova espressione del consenso. Il prelievo da persona non capace potrà essere effettuato solo quando assolutamente indispensabile, sulla base del consenso informato prestato da chi la rappresenti. Non si procederà comunque al prelievo in caso di dissenso della persona interessata o dei prossimi congiunti. Il consenso al deposito del materiale in una banca biologica potrà prevedere il consenso alla utilizzazione del medesimo materiale per ulteriori ricerche o sperimentazioni, approvate dal CEIOC, strettamente connesse all ambito dello studio proposto. Potrà altresì essere prestato consenso al deposito di materiale in una banca biologica per motivate esigenze di ricerca o sperimentazione future, e pertanto senza indicazione di specifiche attività di ricerca o sperimentazione già programmate. In tal caso andrà descritto con chiarezza l ambito scientifico d indagine in cui gli studi futuri, per i quali il consenso s intende prestato, potranno inquadrarsi, ferma la conformità degli stessi alle regole del Codice etico allegato. Queste disposizioni si applicano anche alla utilizzazione per fini di ricerca o sperimentazione di materiali biologici prelevati per motivi diagnostici o chirurgici, o distaccatisi per qualsiasi ragione, dal corpo di un individuo umano. 3. Il materiale biologico dovrà essere reso anonimo, in modo che non sia possibile, se non al responsabile della sperimentazione, della ricerca o della banca biologica e solo in vista di un beneficio del donatore, risalire alla persona che ne ha fatto donazione. 4. La gestione e l utilizzazione del materiale biologico dovranno essere conformi ai principi etici enunciati nell art. 2, commi 2 e 3, del Regolamento relativo all attività svolta dal CEIOC. Al rispetto di tali principi resta subordinato anche il parere positivo alla costituzione di una Banca biologica. I citati commi così recitano: Art. 2, comma 2: Il CEIOC opera per garantire, dal concepimento alla morte naturale, il rispetto per la vita umana e con esso la salvaguardia e la promozione del diritto alla salute e dei diritti dell uomo. Art. 2, comma 3: Il CEIOC si ispira alla tradizione e all insegnamento della Chiesa Cattolica, conformemente ai fini costitutivi delle istituzioni promotrici. 5. Non è autorizzata qualsivoglia utilizzazione attuale o futura di materiale biologico, sulla base di qualsivoglia motivazione, per obiettivi che non siano compatibili con i principi della morale cattolica e con le finalità perseguite dagli enti che hanno costituito il CEIOC. 6. Ogni singola ricerca o sperimentazione su materiale biologico effettuata presso le istituzioni che fanno riferimento al CEIOC o comunque effettuata su materiale biologico prelevato presso le medesime istituzioni è subordinata all approvazione del CEIOC, cui dev essere fornita completa documentazione e informazione, con riguardo, in particolare, al razionale, allo scopo, alla novità e al valore dello studio, al disegno sperimentale, alla dettagliata descrizione delle procedure e delle metodologie che saranno utilizzate, all analisi dei rischi e dei benefici per i soggetti coinvolti e la comunità. Quanto agli studi di genetica dovranno essere altresì indicate le modalità per una conservazione sicura dei campioni di DNA e dei dati raccolti o generati, nonché le modalità intese a tutelarne il carattere anonimo. 7. Il trasferimento di materiale biologico ad altri enti potrà avvenire, per ragioni importanti e documentate, solo ove l attività di ricerca o sperimentazione non possa essere effettuata presso le istituzioni ospedaliere che fanno riferimento al CEIOC. Il trasferimento sarà possibile solo nel caso in cui gli enti destinatari perseguano obiettivi analoghi a quelli propri delle istituzioni ospedaliere che fanno riferimento al CEIOC, in conformità al presente Codice etico. Sarà compito dei responsabili del progetto di ricerca o sperimentazione ovvero della banca biologica acquisire la certezza, prima di qualsiasi trasferimento di materiale biologico, che non ne verrà fatto un uso estraneo ai principi del presente Codice etico, nonché la documentazione scritta rilasciata dal responsabile della ricerca o della sperimentazione sul materiale biologico presso l istituzione destinataria e da una persona autorizzata ad agire in nome e per conto dell ente presso il quale l attività di ricerca o sperimentazione verrà effettuata dell impegno a operare nei soli limiti autorizzati, ai sensi del punto 8, dal CEIOC. 8. Ogni trasferimento di materiale biologico a enti diversi dalle istituzioni che fanno riferimento al CEIOC nonché ogni singola ricerca o sperimentazione sul medesimo materiale che sia da effettuarsi presso uno di tali enti è subordinata all approvazione del CEIOC, cui dev essere fornita completa documentazione e informazione, secondo quanto previsto al punto 6. Compiute le attività di ricerca o sperimentazione approvate dal CEIOC, tutto il materiale biologico trasferito e comunque tutto ciò che in qualsiasi forma ne residui dovrà essere restituito all istituzione facente riferimento al CEIOC che lo ha inviato, la quale ne informerà il CEIOC. Il materiale biologico trasferito potrà essere temporaneamente trattenuto dall ente destinatario solo ai fini di un eventuale ulteriore ricerca o sperimentazione già approvata dal CEIOC. Il materiale biologico trasferito non potrà essere ulteriormente trasferito o reso in qualsiasi modo disponibile, né interamente né in parte, a destinatari che non siano indicati nel documento di approvazione del CEIOC. 9. In caso di cessazione dell attività di una banca biologica nell ambito delle istituzioni che fanno riferimento al CEIOC il materiale biologico in essa depositato potrà essere ceduto solo a un altra istituzione che faccia riferimento al CEIOC. 10. Il presente Codice etico dev essere reso noto a tutti coloro ai quali si richiede il consenso per il prelievo, l utilizzazione e l eventuale deposito di materiale biologico e dev essere allegato al modulo di consenso informato. 11. La persona che ha espresso il consenso al deposito di materiale biologico presso una banca, o la persona che ha espresso il consenso in qualità di rappresentante nel caso di cui al comma 3 del punto 2, può ritirare in qualsiasi momento la propria autorizzazione alla conservazione e alla utilizzazione di quel materiale. Attività di ricerca o sperimentazione su materiali biologici comunque depositati presso le istituzioni ospedaliere che fanno riferimento al CEIOC prima della data di entrata in vigore di questo Codice etico potranno essere effettuate, fermo il rispetto di cui al punto 6, richiedendo il consenso della persona di cui al comma 1, ovvero della persona di cui al comma 3, del punto 2. Nel caso in cui la richiesta di tale consenso non sia possibile o risulti difficilmente praticabile si ritiene sufficiente dal punto di vista etico l approvazione dell attività di ricerca o sperimentazione, ai sensi del punto 6, da parte del CEIOC. 12. Le regole del presente codice etico si applicano, per quanto compatibili, anche ai materiali biologici eventualmente pervenuti in possesso, per fini di ricerca o sperimentazione, delle istituzioni che fanno riferimento al CEIOC. Questo Codice Etico è stato elaborato dal Comitato Etico delle Istituzioni Ospedaliere Cattoliche di Brescia (CEIOC) Data dell ultima revisione: 21 marzo 2002 Foglio Informativo per le forme autosomiche dominanti di malattia di Alzheimer 14
MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE DOMINANTI DI DEGENERAZIONE LOBARE FRONTOTEMPORALE
 Titolo del Progetto: NETWORK ITALIA PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER E DI DEGENERAZIONE LOBARE FRONTOTEMPORALE MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE
Titolo del Progetto: NETWORK ITALIA PER LE FORME AUTOSOMICHE DOMINANTI DI MALATTIA DI ALZHEIMER E DI DEGENERAZIONE LOBARE FRONTOTEMPORALE MODULO DI CONSENSO INFORMATO ARMONIZZATO PER LE FORME AUTOSOMICHE
CONSENSO INFORMATO PER CONSULENZA GENETICA PROTOCOLLO ARMONIZZATO DOCUMENTO PAZIENTE
 CONSENSO INFORMATO PER CONSULENZA GENETICA PROTOCOLLO ARMONIZZATO DOCUMENTO PAZIENTE Versione aggiornata al 18 Maggio 2015 INFORMATIVA Egregio Signore/Gentile Signora, Le demenze neurodegenerative primarie
CONSENSO INFORMATO PER CONSULENZA GENETICA PROTOCOLLO ARMONIZZATO DOCUMENTO PAZIENTE Versione aggiornata al 18 Maggio 2015 INFORMATIVA Egregio Signore/Gentile Signora, Le demenze neurodegenerative primarie
Informazione per il paziente. Raccolta di dati clinici di pazienti con tumore cerebrale per il gruppo cooperativo svizzero per lo studio del glioma
 Informazione per il paziente Raccolta di dati clinici di pazienti con tumore cerebrale per il gruppo cooperativo svizzero per lo studio del glioma Gentile Signora, gentile Signore, prenda il tempo necessario
Informazione per il paziente Raccolta di dati clinici di pazienti con tumore cerebrale per il gruppo cooperativo svizzero per lo studio del glioma Gentile Signora, gentile Signore, prenda il tempo necessario
Guida per i parenti e le persone di supporto. Possiamo sciogliere l'amiloidosi AL?
 Guida per i parenti e le persone di supporto Possiamo sciogliere l'amiloidosi AL? Grazie per il Suo interesse Cosa sono gli studi di ricerca clinica? Le è stato fornito il presente opuscolo perché qualcuno
Guida per i parenti e le persone di supporto Possiamo sciogliere l'amiloidosi AL? Grazie per il Suo interesse Cosa sono gli studi di ricerca clinica? Le è stato fornito il presente opuscolo perché qualcuno
Istituto Scientifico di Pavia Sede di Via Salvatore Maugeri 10. La MAMMOGRAFIA
 Istituto Scientifico di Pavia Sede di Via Salvatore Maugeri 10 La MAMMOGRAFIA INFORMATIVA PER PAZIENTI IS PV AL8-0 03/10/2011 INDICE Che cosa è la MAMMOGRAFIA? Perché sottoporsi alla MAMMOGRAFIA anche
Istituto Scientifico di Pavia Sede di Via Salvatore Maugeri 10 La MAMMOGRAFIA INFORMATIVA PER PAZIENTI IS PV AL8-0 03/10/2011 INDICE Che cosa è la MAMMOGRAFIA? Perché sottoporsi alla MAMMOGRAFIA anche
RICERCA E SVILUPPO DI NUOVI FARMACI
 RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
RICERCA E SVILUPPO DI NUOVI FARMACI In passato le scoperte dei farmaci erano occasionali. Si trattava di sostanze di derivazione vegetale o animale STRATEGIE DI RICERCA: Quali sono i fattori che influenzano
Informazione e dichiarazione di consenso per i partecipanti allo Studio svizzero di coorte HIV. Riassunto
 Gentile paziente, Informazione e dichiarazione di consenso per i partecipanti allo Studio svizzero di coorte HIV La invitiamo a partecipare allo Studio svizzero di coorte HIV (SHCS). Lo scopo degli studi
Gentile paziente, Informazione e dichiarazione di consenso per i partecipanti allo Studio svizzero di coorte HIV La invitiamo a partecipare allo Studio svizzero di coorte HIV (SHCS). Lo scopo degli studi
Procedura Operativa. Corretta identificazione del paziente
 REV. 0 Pag. 1 / 5 INDICE 1. Scopo 2. Campo di applicazione 3. Destinatari 4. Modalità di svolgimento delle attività 4.1) L applicazione del braccialetto 4.1.1) Pazienti in Pronto Soccorso 4.1.2) Pazienti
REV. 0 Pag. 1 / 5 INDICE 1. Scopo 2. Campo di applicazione 3. Destinatari 4. Modalità di svolgimento delle attività 4.1) L applicazione del braccialetto 4.1.1) Pazienti in Pronto Soccorso 4.1.2) Pazienti
Facsimile. prelievo di sangue (per analisi cliniche di laboratorio e per l estrazione di DNA)
 Consenso informato Dichiaro di aver preso visione del filmato informativo e di avere letto le informazioni inviatemi a casa. Mi è stato spiegato e mi è chiaro lo svolgimento, lo scopo e i rischi connessi
Consenso informato Dichiaro di aver preso visione del filmato informativo e di avere letto le informazioni inviatemi a casa. Mi è stato spiegato e mi è chiaro lo svolgimento, lo scopo e i rischi connessi
MODULO DI VERIFICA DELL IDONEITA DEL PAZIENTE ALL ESAME RM DA COMPILARSI DA PARTE DEL VALUTATORE
 MODULO DI VERIFICA DELL IDONEITA DEL PAZIENTE ALL ESAME RM DA COMPILARSI DA PARTE DEL VALUTATORE (da compilarsi da parte del Valutatore per ciascun paziente. Tale modulo andrà inviato tramite fax al Centro
MODULO DI VERIFICA DELL IDONEITA DEL PAZIENTE ALL ESAME RM DA COMPILARSI DA PARTE DEL VALUTATORE (da compilarsi da parte del Valutatore per ciascun paziente. Tale modulo andrà inviato tramite fax al Centro
ISTRUZIONE OPERATIVA Gestione della cartella clinica del donatore di sangue ed emocomponenti REDAZIONE, VERIFICA, APPROVAZIONE, EMISSIONE
 REDAZIONE, VERIFICA, APPROVAZIONE, EMISSIONE REDAZIONE Dott. Gino Bernuzzi, Dirigente Medico Servizio Immunoematologia e Medicina Trasfusionale APPROVAZIONE Dott. Alessandro Formentini Dirigente Medico.
REDAZIONE, VERIFICA, APPROVAZIONE, EMISSIONE REDAZIONE Dott. Gino Bernuzzi, Dirigente Medico Servizio Immunoematologia e Medicina Trasfusionale APPROVAZIONE Dott. Alessandro Formentini Dirigente Medico.
Altre patologie di rilievo :
 In data da parte del personale della U.O.C. di Diagnostica per Immagini di qeusto Istituto, mi è stata consegnata copia del presente modulo al fine di consentire un attenta lettura e valutazione di quanto
In data da parte del personale della U.O.C. di Diagnostica per Immagini di qeusto Istituto, mi è stata consegnata copia del presente modulo al fine di consentire un attenta lettura e valutazione di quanto
Le neuroimmagini: come la scienza e la tecnologia ci aiutano a studiare le funzioni del cervello. Event funded by FP7-Eu project DECIDE
 Le neuroimmagini: come la scienza e la tecnologia ci aiutano a studiare le funzioni del cervello Event funded by FP7-Eu project DECIDE Le neuroimmagini: visualizzazione in vivo del cervello Il termine
Le neuroimmagini: come la scienza e la tecnologia ci aiutano a studiare le funzioni del cervello Event funded by FP7-Eu project DECIDE Le neuroimmagini: visualizzazione in vivo del cervello Il termine
Con Voi per un passo avanti nella ricerca
 Con Voi per un passo avanti nella ricerca Informazioni sull utilizzo di dati e campioni dei pazienti Gentile Paziente, La diagnosi e la cura delle malattie negli ultimi decenni hanno compiuto enormi progressi.
Con Voi per un passo avanti nella ricerca Informazioni sull utilizzo di dati e campioni dei pazienti Gentile Paziente, La diagnosi e la cura delle malattie negli ultimi decenni hanno compiuto enormi progressi.
Presidio Ospedaliero di Faenza. Dipartimento di Diagnostica per Immagini e Radiologia Interventistica. U.O. di Medicina Nucleare
 Presidio Ospedaliero di Faenza Dipartimento di Diagnostica per Immagini e Radiologia Interventistica U.O. di Medicina Nucleare Direttore: Dott. Mirco Bartolomei La Medicina Nucleare Informazioni utili
Presidio Ospedaliero di Faenza Dipartimento di Diagnostica per Immagini e Radiologia Interventistica U.O. di Medicina Nucleare Direttore: Dott. Mirco Bartolomei La Medicina Nucleare Informazioni utili
Studio osservazionale prospettico: START2- POST VTE (nel contesto del Registro START2)
 Studio osservazionale prospettico: START2- POST VTE (nel contesto del Registro START2) Promosso da: Fondazione Arianna Anticoagulazione Centro Coordinatore: Angiologia, Bologna Fondazione senza fini di
Studio osservazionale prospettico: START2- POST VTE (nel contesto del Registro START2) Promosso da: Fondazione Arianna Anticoagulazione Centro Coordinatore: Angiologia, Bologna Fondazione senza fini di
MODELLO INFORMATIVO. Informazioni relative all esame diagnostico HEAD-UP TILT TEST
 MODELLO INFORMATIVO Informazioni relative all esame diagnostico HEAD-UP TILT TEST Io sottoscritto/a nato/a. il. dichiaro di essere stato/a informato/a in data dal dr.. DI ESSERE AFFETTO DALLA SEGUENTE
MODELLO INFORMATIVO Informazioni relative all esame diagnostico HEAD-UP TILT TEST Io sottoscritto/a nato/a. il. dichiaro di essere stato/a informato/a in data dal dr.. DI ESSERE AFFETTO DALLA SEGUENTE
Polimorfismo clinico e genetico: quali differenze e quali vantaggi
 A.O. Polo Universitario Ospedale L. Sacco, Milano Unità Operativa di Cardiologia Centro Malattie Rare Cardiologiche - Marfan Clinic Responsabile prof. Alessandro Pini Polimorfismo clinico e genetico: quali
A.O. Polo Universitario Ospedale L. Sacco, Milano Unità Operativa di Cardiologia Centro Malattie Rare Cardiologiche - Marfan Clinic Responsabile prof. Alessandro Pini Polimorfismo clinico e genetico: quali
PROTOCOLLO PER LA CORRETTA IDENTIFICAZIONE DEL PAZIENTE
 STRUTTURA IGIENE OSPEDALIERA E GESTIONE Versione n.01 del 12/03/2009 Pagina 1 di 6 PROTOCOLLO PER LA CORRETTA IDENTIFICAZIONE DEL PAZIENTE Redazione / Aggiornamento Verifica / Approvazione Autorizzazione
STRUTTURA IGIENE OSPEDALIERA E GESTIONE Versione n.01 del 12/03/2009 Pagina 1 di 6 PROTOCOLLO PER LA CORRETTA IDENTIFICAZIONE DEL PAZIENTE Redazione / Aggiornamento Verifica / Approvazione Autorizzazione
COMITATO ETICO PROVINCIALE DI BRESCIA ISTRUZIONI PER LA REDAZIONE DEI CONSENSI E DELLE INFORMATIVE OLTRE ALLE INDICAZIONI CONTENUTE NELLE GCP
 COMITATO ETICO PROVINCIALE DI BRESCIA ISTRUZIONI PER LA REDAZIONE DEI CONSENSI E DELLE INFORMATIVE OLTRE ALLE INDICAZIONI CONTENUTE NELLE GCP PER TUTTI GLI STUDI ISTRUZIONI PER LA FORMULAZIONE DEL CONSENSO
COMITATO ETICO PROVINCIALE DI BRESCIA ISTRUZIONI PER LA REDAZIONE DEI CONSENSI E DELLE INFORMATIVE OLTRE ALLE INDICAZIONI CONTENUTE NELLE GCP PER TUTTI GLI STUDI ISTRUZIONI PER LA FORMULAZIONE DEL CONSENSO
La scintigrafia di valutazione del transito gastrico
 Informazione per pazienti La scintigrafia di valutazione del transito gastrico Dipartimento Oncologico e Tecnologie Avanzate Medicina Nucleare Dott. Annibale Versari - Direttore INDICE Cos è e come funziona
Informazione per pazienti La scintigrafia di valutazione del transito gastrico Dipartimento Oncologico e Tecnologie Avanzate Medicina Nucleare Dott. Annibale Versari - Direttore INDICE Cos è e come funziona
OPUSCOLO INFORMATIVO PER IL PAZIENTE IN RADIOTERAPIA
 OPUSCOLO INFORMATIVO PER IL PAZIENTE IN RADIOTERAPIA Ospedale Castelli Verbania Con questa breve guida alla Radioterapia vogliamo dare alcune informazioni utili ai pazienti ed ai loro familiari al fine
OPUSCOLO INFORMATIVO PER IL PAZIENTE IN RADIOTERAPIA Ospedale Castelli Verbania Con questa breve guida alla Radioterapia vogliamo dare alcune informazioni utili ai pazienti ed ai loro familiari al fine
Good Clinical Practice (ICH- GCP): principi generali. Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016
 Good Clinical Practice (ICH- GCP): principi generali Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016 Good Clinical Practice: cosa sono? Standard etico e di qualità internazionale
Good Clinical Practice (ICH- GCP): principi generali Alessandra Foietta GMO Training & Compliance Manager Negrar 21 Ottobre 2016 Good Clinical Practice: cosa sono? Standard etico e di qualità internazionale
Degenza Breve Chirurgica
 Ospedale Ca Foncello di Treviso Degenza Breve Chirurgica Guida ai Servizi Gentile utente, questo opuscolo contiene alcune semplici informazioni che le potranno essere utili in vista dell intervento a cui
Ospedale Ca Foncello di Treviso Degenza Breve Chirurgica Guida ai Servizi Gentile utente, questo opuscolo contiene alcune semplici informazioni che le potranno essere utili in vista dell intervento a cui
Compilazione Richiesta Emocomponenti e relativo Consenso Informato INDICE. Data Descrizione Redatto Verificato Approvato
 Pag. 1 di 5 INDICE 1. SCOPO 2. CAMPO DI APPLICAZIONE 3. RIFERIMENTI 4. DEFINIZIONI 5. RESPONSABILITÀ 6. DESCRIZIONE ATTIVITA' Data Descrizione Redatto Verificato Approvato 11-12-2012 Emissione Dott.ssa
Pag. 1 di 5 INDICE 1. SCOPO 2. CAMPO DI APPLICAZIONE 3. RIFERIMENTI 4. DEFINIZIONI 5. RESPONSABILITÀ 6. DESCRIZIONE ATTIVITA' Data Descrizione Redatto Verificato Approvato 11-12-2012 Emissione Dott.ssa
Terapia Intensiva Neurochirurgica
 Ospedale Ca Foncello di Treviso Terapia Intensiva Neurochirurgica Guida ai Servizi Questo breve opuscolo ha lo scopo di fornirvi le informazioni utili e di carattere generale, per affrontare nel modo
Ospedale Ca Foncello di Treviso Terapia Intensiva Neurochirurgica Guida ai Servizi Questo breve opuscolo ha lo scopo di fornirvi le informazioni utili e di carattere generale, per affrontare nel modo
- Posso donare se sono in gravidanza? E se ho già partorito ma sto ancora allattando?
 - Posso donare se sono in gravidanza? E se ho già partorito ma sto ancora allattando? No, se una donna è in gravidanza o sta allattando, non verrà effettuata alcuna procedura di donazione, sia essa di
- Posso donare se sono in gravidanza? E se ho già partorito ma sto ancora allattando? No, se una donna è in gravidanza o sta allattando, non verrà effettuata alcuna procedura di donazione, sia essa di
Complementi di Informatica. Prof. Mauro Giacomini
 Complementi di Informatica Medica HIS - Definizione Prof. Mauro Giacomini HIS Sistemi informativi ospedalieri Non è stata data nessuna definizione univoca. In letteratura sono presenti molte tesi, alcune
Complementi di Informatica Medica HIS - Definizione Prof. Mauro Giacomini HIS Sistemi informativi ospedalieri Non è stata data nessuna definizione univoca. In letteratura sono presenti molte tesi, alcune
SCHEDA MEDICA. La presente scheda medica annulla e sostituisce qualsiasi altra scheda sia già stata consegnata ai Capi anche recentemente.
 Da consegnarsi il prima possibile ai Capi del Gruppo Scout AGESCI Tivoli 1 SCHEDA MEDICA La scheda medica che segue ha lo scopo di comunicare a noi Capi tutte le informazioni sanitarie che riguardano vostro
Da consegnarsi il prima possibile ai Capi del Gruppo Scout AGESCI Tivoli 1 SCHEDA MEDICA La scheda medica che segue ha lo scopo di comunicare a noi Capi tutte le informazioni sanitarie che riguardano vostro
INFORMATIVA PER IL PAZIENTE
 INFORMATIVA PER IL PAZIENTE (Mod. Versione 4 del 27 maggio 2013) 1) Finalità del trattamento dei dati personali Diagnosi e cura dei tumori rari. Ricerca retrospettiva e/o traslazionale sui tumori rari.
INFORMATIVA PER IL PAZIENTE (Mod. Versione 4 del 27 maggio 2013) 1) Finalità del trattamento dei dati personali Diagnosi e cura dei tumori rari. Ricerca retrospettiva e/o traslazionale sui tumori rari.
INFORMAZIONI PRELIMINARI PER L ISCRIZIONE AL REGISTRO SCHEDA SBMA (Malattia di Kennedy)
 INFORMAZIONI PRELIMINARI PER L ISCRIZIONE AL REGISTRO SCHEDA SBMA (Malattia di Kennedy) Prima di iscriversi al presente Registro, è importante capire di cosa si tratta e come saranno utilizzati i dati
INFORMAZIONI PRELIMINARI PER L ISCRIZIONE AL REGISTRO SCHEDA SBMA (Malattia di Kennedy) Prima di iscriversi al presente Registro, è importante capire di cosa si tratta e come saranno utilizzati i dati
DIRITTI. e DOVERI. del MALATO GUIDA PER L UTENTE. www.istituto-besta.it
 DIRITTI e DOVERI del MALATO GUIDA PER L UTENTE www.istituto-besta.it DIRITTI Il paziente ha diritto a Qualità delle cure Ricevere le cure più efficaci e di provata validità grazie a conoscenze scientifiche
DIRITTI e DOVERI del MALATO GUIDA PER L UTENTE www.istituto-besta.it DIRITTI Il paziente ha diritto a Qualità delle cure Ricevere le cure più efficaci e di provata validità grazie a conoscenze scientifiche
Direttore Sanitario: Dr.ssa Silvia Campagnari MAMMOGRAFIA
 Direttore Sanitario: Dr.ssa Silvia Campagnari MAMMOGRAFIA INFORMAZIONI COS E E un indagine che utilizza radiazioni ionizzanti (Raggi X), a basso dosaggio, per la diagnosi della patologia mammaria. Poiché
Direttore Sanitario: Dr.ssa Silvia Campagnari MAMMOGRAFIA INFORMAZIONI COS E E un indagine che utilizza radiazioni ionizzanti (Raggi X), a basso dosaggio, per la diagnosi della patologia mammaria. Poiché
DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE
 DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE Istruzioni per la compilazione Per la corretta esecuzione della manovra e per
DIPARTIMENTO ONCOLOGICO UNITA OPERATIVA SEMPLICE DI ONCOLOGIA RICHIESTA/CONSENSO INFORMATO PER INSERIMENTO DI PICC E MIDLINE Istruzioni per la compilazione Per la corretta esecuzione della manovra e per
REGIONE VENETO / Segreteria regionale Sanità e Sociale- ARSS Agenzia Regionale Sanitaria e Sociosanitaria
 Lista di verifica REQUITI MINIMI SPECIFICI E DI QUALITA' PER L'AUTORIZZAZIONE 1 - REQUITI STRUTTURALI LABPAT.AU.1.1 I locali e gli spazi sono dimensionati in funzione della tipologia e del volume dell'attività
Lista di verifica REQUITI MINIMI SPECIFICI E DI QUALITA' PER L'AUTORIZZAZIONE 1 - REQUITI STRUTTURALI LABPAT.AU.1.1 I locali e gli spazi sono dimensionati in funzione della tipologia e del volume dell'attività
POIA n. 04 PROTOCOLLO INTERAZIENDALE ACCERTAMENTO DEL TASSO ALCOOLEMICO IN PRONTO SOCCORSO
 Pagina 1 di 8 Revisione Data Causale 0 20/07/2009 Prima stesura 1 Recepimento nuovo format aziendale Fasi Funzioni Firma Data Resp. UO PS Nottola USL 7 Redazione Resp. UF Laboratorio AOUS Verifica Approvazione
Pagina 1 di 8 Revisione Data Causale 0 20/07/2009 Prima stesura 1 Recepimento nuovo format aziendale Fasi Funzioni Firma Data Resp. UO PS Nottola USL 7 Redazione Resp. UF Laboratorio AOUS Verifica Approvazione
INDICAZIONI CENTRO SPECIFICHE relative al CONSENSO INFORMATO in STUDI CLINICI
 COMITATO ETICO dell IDI-IRCCS INDICAZIONI CENTRO SPECIFICHE relative al CONSENSO INFORMATO in STUDI CLINICI 1/7 Indicazioni per l utilizzo di versioni modificate del modulo di consenso informato N.B.:
COMITATO ETICO dell IDI-IRCCS INDICAZIONI CENTRO SPECIFICHE relative al CONSENSO INFORMATO in STUDI CLINICI 1/7 Indicazioni per l utilizzo di versioni modificate del modulo di consenso informato N.B.:
UNITÁ OPERATIVA ANESTESIA E TERAPIA INTENSIVA AREA NORD - TERAPIA INTENSIVA BENTIVOGLIO DIPARTIMENTO SERVIZI
 UNITÁ OPERATIVA ANESTESIA E TERAPIA INTENSIVA AREA NORD - TERAPIA INTENSIVA BENTIVOGLIO DIPARTIMENTO SERVIZI 1/9 Attività L'unità operativa di Anestesia e Terapia Intensiva Area Nord eroga le proprie prestazioni
UNITÁ OPERATIVA ANESTESIA E TERAPIA INTENSIVA AREA NORD - TERAPIA INTENSIVA BENTIVOGLIO DIPARTIMENTO SERVIZI 1/9 Attività L'unità operativa di Anestesia e Terapia Intensiva Area Nord eroga le proprie prestazioni
Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica
 Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica IL PRESIDENTE DELL ISTITUTO SUPERIORE DI SANITÀ VISTO il decreto
Modalità di presentazione e tipologia dei dati da inserire nelle banche dati per il monitoraggio della terapia genica e cellulare somatica IL PRESIDENTE DELL ISTITUTO SUPERIORE DI SANITÀ VISTO il decreto
La Informazione per pazienti. scintigrafia tiroidea. Dipartimento Oncologico e Tecnologie Avanzate Medicina Nucleare
 La Informazione per pazienti scintigrafia tiroidea Dipartimento Oncologico e Tecnologie Avanzate Medicina Nucleare Dott. Annibale Versari - Direttore Gentile Signora, Gentile Signore, questo opuscolo è
La Informazione per pazienti scintigrafia tiroidea Dipartimento Oncologico e Tecnologie Avanzate Medicina Nucleare Dott. Annibale Versari - Direttore Gentile Signora, Gentile Signore, questo opuscolo è
Nota Informativa Importante. Guida alla Terapia per i Paziente. Guida alla Contraccezione. Modulo d'informazione e Consenso Informato
 AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
AIFA - Isotretinoina 16/03/2009 (Livello 2) AIFA Agenzia Italiana del Farmaco Isotretinoina Nota Informativa Importante Nuove Modalita' di Prescrizione per i Medicinali Contenenti Isotretinoina ad Uso
Informazioni per il PAZIENTE SPECT Cerebrale con leganti recettoriali pre sinaptici della Dopamina (123 Iodio DATSCAN) cod
 Informazioni per il PAZIENTE SPECT Cerebrale con leganti recettoriali pre sinaptici della Dopamina (123 Iodio DATSCAN) cod. 92.18.5 E un esame che si propone di identificare la presenza di recettori per
Informazioni per il PAZIENTE SPECT Cerebrale con leganti recettoriali pre sinaptici della Dopamina (123 Iodio DATSCAN) cod. 92.18.5 E un esame che si propone di identificare la presenza di recettori per
DIAGNOSTICA PER IMMAGINI CASA DI CURA PRIVATA SANATRIX
 DIAGNOSTICA PER IMMAGINI CASA DI CURA PRIVATA SANATRIX DIAGNOSTICA PER IMMAGINI Il servizio di Diagnostica per Immagini di Clinica Sanatrix si avvale di apparecchiature che, utilizzando varie forme di
DIAGNOSTICA PER IMMAGINI CASA DI CURA PRIVATA SANATRIX DIAGNOSTICA PER IMMAGINI Il servizio di Diagnostica per Immagini di Clinica Sanatrix si avvale di apparecchiature che, utilizzando varie forme di
Informazione Formazione e Addestramento del Personale
 Società Italiana Banche degli Occhi Torino, 10 ottobre 2009 IV Corso di Formazione Informazione Formazione e Addestramento del Personale Fondazione Banca degli Occhi del Veneto Normativa di riferimento
Società Italiana Banche degli Occhi Torino, 10 ottobre 2009 IV Corso di Formazione Informazione Formazione e Addestramento del Personale Fondazione Banca degli Occhi del Veneto Normativa di riferimento
Schema dello studio clinico di Fase 2b
 Sommario dei risultati dello studio clinico di Fase 2b di Ataluren presentato in occasione dell American Academy of Neurology Meeting il 16 Aprile 2010 Toronto, 16 Aprile 2010 - Un nuovo farmaco sperimentale
Sommario dei risultati dello studio clinico di Fase 2b di Ataluren presentato in occasione dell American Academy of Neurology Meeting il 16 Aprile 2010 Toronto, 16 Aprile 2010 - Un nuovo farmaco sperimentale
MODULO DI CONSENSO INFORMATO PER IL PAZIENTE
 Pagina 1 di 9 MODULO DI CONSENSO INFORMATO PER IL PAZIENTE Istruzioni per la compilazione del modulo: Prima di firmare il presente modulo, il paziente - o i genitori/tutori in caso di pazienti minori o
Pagina 1 di 9 MODULO DI CONSENSO INFORMATO PER IL PAZIENTE Istruzioni per la compilazione del modulo: Prima di firmare il presente modulo, il paziente - o i genitori/tutori in caso di pazienti minori o
Il monitoraggio degli studi clinici. Il punto di vista dello Sperimentatore. 10 giugno 2014
 Il monitoraggio degli studi clinici Il punto di vista dello Sperimentatore 10 giugno 2014 Lo Sperimentatore GCP 4.1 Qualifiche dello sperimentatore ed accordi 4.1.3 Lo sperimentatore deve conoscere le
Il monitoraggio degli studi clinici Il punto di vista dello Sperimentatore 10 giugno 2014 Lo Sperimentatore GCP 4.1 Qualifiche dello sperimentatore ed accordi 4.1.3 Lo sperimentatore deve conoscere le
CENTRO DI COSMETOLOGIA UNIVERSITÀ DI FERRARA VALUTAZIONE D EFFICACIA DI UNA DOCCIA SOLARE CON PEDANA VIBRANTE
 CENTRO DI COSMETOLOGIA UNIVERSITÀ DI FERRARA VALUTAZIONE D EFFICACIA DI UNA DOCCIA SOLARE CON PEDANA VIBRANTE PRODOTTO DATA DITTA BODYWAVE HIGH PERFORMANCE 08.2007 QUADRA MEDICAL S.R.L. VIA NARDI 98 36060
CENTRO DI COSMETOLOGIA UNIVERSITÀ DI FERRARA VALUTAZIONE D EFFICACIA DI UNA DOCCIA SOLARE CON PEDANA VIBRANTE PRODOTTO DATA DITTA BODYWAVE HIGH PERFORMANCE 08.2007 QUADRA MEDICAL S.R.L. VIA NARDI 98 36060
Codice partner: Profilo di segnalazione: All attenzione del legale rappresentante
 Rifer. a nota n. del Classificazione Oggetto Codice partner: Profilo di segnalazione: All attenzione del legale rappresentante La Banca d Italia, in attuazione del Decreto Legislativo del 19 novembre 2008,
Rifer. a nota n. del Classificazione Oggetto Codice partner: Profilo di segnalazione: All attenzione del legale rappresentante La Banca d Italia, in attuazione del Decreto Legislativo del 19 novembre 2008,
TROPONINA (compreso tra gli esami urgenti)
 MODALITA' DI RICHIESTA: Pazienti interni: tramite modulo interno prestampato. Pazienti esterni: tramite richiesta del medico curante. TROPONINA (compreso tra gli esami urgenti) PREPARAZIONE DEL PAZIENTE
MODALITA' DI RICHIESTA: Pazienti interni: tramite modulo interno prestampato. Pazienti esterni: tramite richiesta del medico curante. TROPONINA (compreso tra gli esami urgenti) PREPARAZIONE DEL PAZIENTE
Il benessere psicologico in adolescenza
 Il benessere psicologico in adolescenza Gruppo Be teen Unità di Igiene, Epidemiologia e Sanità Pubblica, Università degli Studi di Brescia Department of Public Health, Karolinska Institutet Che sentimento
Il benessere psicologico in adolescenza Gruppo Be teen Unità di Igiene, Epidemiologia e Sanità Pubblica, Università degli Studi di Brescia Department of Public Health, Karolinska Institutet Che sentimento
L ACCREDITAMENTO ISTITUZIONALE. Aspetti e requisiti generali Requisiti specifici dei Laboratori
 L ACCREDITAMENTO ISTITUZIONALE Aspetti e requisiti generali Requisiti specifici dei Laboratori Obiettivi della presentazione Approfondire il significato ed il modello di Accreditamento Istituzionale Analizzare
L ACCREDITAMENTO ISTITUZIONALE Aspetti e requisiti generali Requisiti specifici dei Laboratori Obiettivi della presentazione Approfondire il significato ed il modello di Accreditamento Istituzionale Analizzare
Accordo tra Regione Marche e Dipartimento della Gioventù e Servizio Civile Nazionale Intervento aggregazione 2^ edizione
 ALLEGATO B.1 Accordo tra Regione Marche e Dipartimento della Gioventù e Servizio Civile Nazionale FORMULARIO DI PRESENTAZIONE DELLA PROPOSTA PROGETTUALE (COMPRESE SCHEDE DEI PARTNER) I.1 DESCRIZIONE I.1.1
ALLEGATO B.1 Accordo tra Regione Marche e Dipartimento della Gioventù e Servizio Civile Nazionale FORMULARIO DI PRESENTAZIONE DELLA PROPOSTA PROGETTUALE (COMPRESE SCHEDE DEI PARTNER) I.1 DESCRIZIONE I.1.1
NORMATIVA ITALIANA VIGENTE
 Ricordate? (a) Esposizione di pazienti nell ambito della rispettiva diagnosi o trattamento medico; (b) esposizione di persone nell ambito della sorveglianza sanitaria professionale; (c) (d) esposizione
Ricordate? (a) Esposizione di pazienti nell ambito della rispettiva diagnosi o trattamento medico; (b) esposizione di persone nell ambito della sorveglianza sanitaria professionale; (c) (d) esposizione
REGOLAMENTO PER L UTILIZZO DEL MARCHIO CTI E PER IL RILASCIO DEL PATROCINIO CTI
 REGOLAMENTO PER L UTILIZZO DEL MARCHIO CTI E PER IL RILASCIO DEL PATROCINIO CTI UTILIZZO DEL MARCHIO CTI Il Marchio CTI è concesso: Approvato dal Comitato di Presidenza in data 4 luglio 2016 - ai soli
REGOLAMENTO PER L UTILIZZO DEL MARCHIO CTI E PER IL RILASCIO DEL PATROCINIO CTI UTILIZZO DEL MARCHIO CTI Il Marchio CTI è concesso: Approvato dal Comitato di Presidenza in data 4 luglio 2016 - ai soli
MODELLO DI COMUNICAZIONE AL RICHIEDENTE DELLA DECISIONE DEL COMITATO ETICO RELATIVA AL PARERE UNICO 1
 Appendice 6 MODELLO DI COMUNICAZIONE AL RICHIEDENTE DELLA DECISIONE DEL COMITATO ETICO RELATIVA AL PARERE UNICO 1 Il presente parere del comitato etico è stato compilato e stampato dal sito internet dell
Appendice 6 MODELLO DI COMUNICAZIONE AL RICHIEDENTE DELLA DECISIONE DEL COMITATO ETICO RELATIVA AL PARERE UNICO 1 Il presente parere del comitato etico è stato compilato e stampato dal sito internet dell
Modalità di identificazione del paziente International Patient Safety Goals IPSG IPSG. 1 Accuratezza della identificazione del paziente
 1 di 6 LISTA DI DISTRIBUZIONE Direttori Presidi Ospedalieri Direttori di Dipartimento Servizio Infermieristico Direttori UU.OO. Coordinatori Infermieristici UU.OO. Rev. Data Causale Redazione Verifica
1 di 6 LISTA DI DISTRIBUZIONE Direttori Presidi Ospedalieri Direttori di Dipartimento Servizio Infermieristico Direttori UU.OO. Coordinatori Infermieristici UU.OO. Rev. Data Causale Redazione Verifica
CLUB ITALIANO CAPSULA ENDOSCOPICA Sezione di studio della Società Italiana di Gastroenterologia
 GE_PO_16_M_01v01 PAG. 1 di 5 CLUB ITALIANO CAPSULA ENDOSCOPICA Sezione di studio della Società Italiana di Gastroenterologia CONSENSO INFORMATO PER L ESECUZIONE DELL ENTEROSCOPIA CON CAPSULA Given Video
GE_PO_16_M_01v01 PAG. 1 di 5 CLUB ITALIANO CAPSULA ENDOSCOPICA Sezione di studio della Società Italiana di Gastroenterologia CONSENSO INFORMATO PER L ESECUZIONE DELL ENTEROSCOPIA CON CAPSULA Given Video
Ospedale Civile San Bortolo Vicenza. Unità operativa di Medicina Interna
 Ospedale Civile San Bortolo Vicenza Unità operativa di Medicina Interna Cartella Integrata medico - infermieristica La documentazione integrata Medico - Infermieristica: Strumento per migliorare la qualità
Ospedale Civile San Bortolo Vicenza Unità operativa di Medicina Interna Cartella Integrata medico - infermieristica La documentazione integrata Medico - Infermieristica: Strumento per migliorare la qualità
MODULO DI CONSENSO ALLA GASTROSCOPIA
 Ospedale San Donato - Arezzo Servizio di Endoscopia Digestiva MODULO DI CONSENSO ALLA GASTROSCOPIA Gentile Signore/a, attraverso l'opuscolo informativo che le è stato consegnato ha potuto conoscere le
Ospedale San Donato - Arezzo Servizio di Endoscopia Digestiva MODULO DI CONSENSO ALLA GASTROSCOPIA Gentile Signore/a, attraverso l'opuscolo informativo che le è stato consegnato ha potuto conoscere le
FOGLIO INFORMATIVO E CONSENSO INFORMATO PER GASTROSCOPIA DIAGNOSTICA E TERAPEUTICA.
 FOGLIO INFORMATIVO E CONSENSO INFORMATO PER GASTROSCOPIA DIAGNOSTICA E TERAPEUTICA. Gentile Paziente, La gastroscopia è un esame endoscopico che permette la visualizzazione della mucosa dell esofago, dello
FOGLIO INFORMATIVO E CONSENSO INFORMATO PER GASTROSCOPIA DIAGNOSTICA E TERAPEUTICA. Gentile Paziente, La gastroscopia è un esame endoscopico che permette la visualizzazione della mucosa dell esofago, dello
Informazione per pazienti e familiari. La Ricerca e gli Studi Clinici
 Informazione per pazienti e familiari La Ricerca e gli Studi Clinici Introduzione L Azienda Ospedaliera di Reggio Emilia (ASMN) è un Istituto di Ricovero e Cura a Carattere Scientifico (IRCCS) nell ambito
Informazione per pazienti e familiari La Ricerca e gli Studi Clinici Introduzione L Azienda Ospedaliera di Reggio Emilia (ASMN) è un Istituto di Ricovero e Cura a Carattere Scientifico (IRCCS) nell ambito
Politica sulla Privacy
 Politica sulla Privacy 1 SCOPO Atos Medical ( Atos ) acquisisce Dati personali attraverso le comunicazioni e le interazioni con i pazienti, i professionisti sanitari, i dipendenti e con altre modalità.
Politica sulla Privacy 1 SCOPO Atos Medical ( Atos ) acquisisce Dati personali attraverso le comunicazioni e le interazioni con i pazienti, i professionisti sanitari, i dipendenti e con altre modalità.
Direttore Dr.ssa Tiziana Riscaldati. SIMT-POS 016 Gestione effetti indesiderati gravi o incidenti gravi o near miss.
 1 Prima Stesura Redattori: Cosenza Data: 17-04-2014 1 2 1 SCOPO Lo scopo della presente procedura è specificare le responsabilità e le modalità operative da adottare per la gestione delle reazioni indesiderati
1 Prima Stesura Redattori: Cosenza Data: 17-04-2014 1 2 1 SCOPO Lo scopo della presente procedura è specificare le responsabilità e le modalità operative da adottare per la gestione delle reazioni indesiderati
Dott.ssa Elena Tuvinelli
 Dott.ssa Elena Tuvinelli FONTI il consenso informato non è previsto da una normativa specifica, né come diritto soggettivo del paziente né come causa di esclusione della responsabilità civile né come scriminante
Dott.ssa Elena Tuvinelli FONTI il consenso informato non è previsto da una normativa specifica, né come diritto soggettivo del paziente né come causa di esclusione della responsabilità civile né come scriminante
SOFFRI DI TACHICARDIA PAROSSISTICA? SCOPRI COME CURARLA DEFINITIVAMENTE.
 SOFFRI DI TACHICARDIA PAROSSISTICA? SCOPRI COME CURARLA DEFINITIVAMENTE. Le tachicardie parossistiche sono aritmie che causano improvviso aumento dei battiti del cuore. I sintomi per il paziente possono
SOFFRI DI TACHICARDIA PAROSSISTICA? SCOPRI COME CURARLA DEFINITIVAMENTE. Le tachicardie parossistiche sono aritmie che causano improvviso aumento dei battiti del cuore. I sintomi per il paziente possono
AGGIORNAMENTO DEL CODICE DI RETE
 AGGIORNAMENTO DEL CODICE DI RETE 22.1 INTRODUZIONE... 222 22.2 COMITATO DI CONSULTAZIONE... 222 22.3 SOGGETTI TITOLATI ABILITATI A PRESENTARE RICHIESTE DI MODIFICA... 223 22.4 REQUISITI DI RICEVIBILITA
AGGIORNAMENTO DEL CODICE DI RETE 22.1 INTRODUZIONE... 222 22.2 COMITATO DI CONSULTAZIONE... 222 22.3 SOGGETTI TITOLATI ABILITATI A PRESENTARE RICHIESTE DI MODIFICA... 223 22.4 REQUISITI DI RICEVIBILITA
Le dimensioni del problema Inquadramento clinico generale
 Le Patologie Degenerative Neurologiche e il Territorio Le dimensioni del problema Inquadramento clinico generale Francesco Filippo Morbiato LE DIMENSIONI DEL PROBLEMA Le Patologie Neurodegenerative costituiscono
Le Patologie Degenerative Neurologiche e il Territorio Le dimensioni del problema Inquadramento clinico generale Francesco Filippo Morbiato LE DIMENSIONI DEL PROBLEMA Le Patologie Neurodegenerative costituiscono
La normativa sulla privacy è definita in Italia come normativa sulla PROTEZIONE DEI DATI PERSONALI
 Normativa sulla privacy COS E LA PRIVACY? La notevole diffusione di attività che utilizzano mezzi di trattamento elettronico delle informazioni ha reso possibile l accumulo di un numero enorme di informazioni
Normativa sulla privacy COS E LA PRIVACY? La notevole diffusione di attività che utilizzano mezzi di trattamento elettronico delle informazioni ha reso possibile l accumulo di un numero enorme di informazioni
La scintigrafia. per ricerca del linfonodo sentinella nel Melanoma. Informazione per pazienti
 La scintigrafia Informazione per pazienti per ricerca del linfonodo sentinella nel Melanoma Dipartimento Oncologico e Tecnologie Avanzate Medicina Nucleare Dott. Annibale Versari - Direttore INDICE Cos
La scintigrafia Informazione per pazienti per ricerca del linfonodo sentinella nel Melanoma Dipartimento Oncologico e Tecnologie Avanzate Medicina Nucleare Dott. Annibale Versari - Direttore INDICE Cos
Prevenzione della rosolia competenze e attività dei servizi igiene e sanità pubblica e pediatria di comunità
 Prevenzione della rosolia competenze e attività dei servizi igiene e sanità pubblica e pediatria di comunità Daniela Cavazzini Piano Nazionale di eliminazione del morbillo e della Rosolia congenita. Corso
Prevenzione della rosolia competenze e attività dei servizi igiene e sanità pubblica e pediatria di comunità Daniela Cavazzini Piano Nazionale di eliminazione del morbillo e della Rosolia congenita. Corso
Ospedale Ca Foncello di Treviso. Medicina d Urgenza Guida ai Servizi
 Ospedale Ca Foncello di Treviso Medicina d Urgenza Guida ai Servizi Lo scopo di questa guida è di fornire a Lei e i suoi familiari informazioni utili per affrontare con maggiore serenità e consapevolezza
Ospedale Ca Foncello di Treviso Medicina d Urgenza Guida ai Servizi Lo scopo di questa guida è di fornire a Lei e i suoi familiari informazioni utili per affrontare con maggiore serenità e consapevolezza
Modello di Cura (MdC) per le persone affette da Artrite Reumatoide
 Translation into: Completed by: Email: MdC 1 MdC 2 MdC 3 MdC 4 MdC 5 Italian Modello di Cura (MdC) per le persone affette da Artrite Reumatoide Annamaria Iuliano annamariaiuliano@hotmail.it Le persone
Translation into: Completed by: Email: MdC 1 MdC 2 MdC 3 MdC 4 MdC 5 Italian Modello di Cura (MdC) per le persone affette da Artrite Reumatoide Annamaria Iuliano annamariaiuliano@hotmail.it Le persone
PROCEDURE PER IL PRELIEVO BIOLOGICO
 Istituto di Ricerche Farmacologiche Mario Negri Milano 13 Aprile 2010 SOTTOPROGETTO ANALISI GENOME-WIDE PROCEDURE PER IL PRELIEVO BIOLOGICO 1 ORA CHE MI SONO CHIARI GLI OBIETTIVI COSA E COME CHE COSA DEVO
Istituto di Ricerche Farmacologiche Mario Negri Milano 13 Aprile 2010 SOTTOPROGETTO ANALISI GENOME-WIDE PROCEDURE PER IL PRELIEVO BIOLOGICO 1 ORA CHE MI SONO CHIARI GLI OBIETTIVI COSA E COME CHE COSA DEVO
I CONVEGNO PER INFERMIERI IN ONCOLOGIA Ospedale di S. Polo Monfalcone 20 Novembre La ricerca: Come, dove, quando?
 I CONVEGNO PER INFERMIERI IN ONCOLOGIA Ospedale di S. Polo Monfalcone 20 Novembre 2004 La ricerca: Come, dove, quando? Daniela Grosso, UO di Oncologia Medica, Azienda Ospedaliera di Padova L ASSISTENZA
I CONVEGNO PER INFERMIERI IN ONCOLOGIA Ospedale di S. Polo Monfalcone 20 Novembre 2004 La ricerca: Come, dove, quando? Daniela Grosso, UO di Oncologia Medica, Azienda Ospedaliera di Padova L ASSISTENZA
INVALIDITA CIVILE. L invalidità civile è quella che non deriva da cause di servizio, di guerra o di lavoro e viene espressa in percentuale.
 INVALIDITA CIVILE Per invalidità si intende l impedimento a svolgere le funzioni tipiche della vita quotidiana o di relazione a causa di un deficit fisico, psichico o intellettivo, della vista o dell udito.
INVALIDITA CIVILE Per invalidità si intende l impedimento a svolgere le funzioni tipiche della vita quotidiana o di relazione a causa di un deficit fisico, psichico o intellettivo, della vista o dell udito.
CONCORSO: LA PASSIONE DI ASSISTERE ATTIVA-MENTE
 Provincia Lombardo-Veneta Ordine Ospedaliero di S. Giovanni di Dio - Fatebenefratelli CENTRO S. GIOVANNI DI DIO - FATEBENEFRATELLI ISTITUTO DI RICOVERO E CURA A CARATTERE SCIENTIFICO (D.I. 19 dicembre
Provincia Lombardo-Veneta Ordine Ospedaliero di S. Giovanni di Dio - Fatebenefratelli CENTRO S. GIOVANNI DI DIO - FATEBENEFRATELLI ISTITUTO DI RICOVERO E CURA A CARATTERE SCIENTIFICO (D.I. 19 dicembre
Piano dei Test e Collaudo del software Titolo Documento
 Controllo delle copie Il presente documento, se non preceduto dalla pagina di controllo identificata con il numero della copia, il destinatario, la data e la firma autografa del Responsabile della Documentazione,
Controllo delle copie Il presente documento, se non preceduto dalla pagina di controllo identificata con il numero della copia, il destinatario, la data e la firma autografa del Responsabile della Documentazione,
ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI
 ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE
ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE
SERVIZI SPECIALISTICI LEGALI E TECNICO- SISTEMISTICI PER ADEGUAMENTO ATTIVITÀ AL CODICE DELLA PRIVACY.
 SERVIZI SPECIALISTICI LEGALI E TECNICO- SISTEMISTICI PER ADEGUAMENTO ATTIVITÀ AL CODICE DELLA PRIVACY. Il presente documento ha lo scopo di illustrare in dettaglio i servizi legali ed informatici specialistici
SERVIZI SPECIALISTICI LEGALI E TECNICO- SISTEMISTICI PER ADEGUAMENTO ATTIVITÀ AL CODICE DELLA PRIVACY. Il presente documento ha lo scopo di illustrare in dettaglio i servizi legali ed informatici specialistici
GARANTE PER LA PROTEZIONE DEI DATI PERSONALI. PROVVEDIMENTO 19 luglio 2006 (Gazzetta Ufficiale 8 agosto 2006, n. 183)
 GARANTE PER LA PROTEZIONE DEI DATI PERSONALI PROVVEDIMENTO 19 luglio 2006 (Gazzetta Ufficiale 8 agosto 2006, n. 183) INFORMATIVA SEMPLIFICATA PER MEDICI DI BASE Il Garante per la protezione dei dati personali
GARANTE PER LA PROTEZIONE DEI DATI PERSONALI PROVVEDIMENTO 19 luglio 2006 (Gazzetta Ufficiale 8 agosto 2006, n. 183) INFORMATIVA SEMPLIFICATA PER MEDICI DI BASE Il Garante per la protezione dei dati personali
Ministero della Salute
 Ministero della Salute Disposizioni in materia di medicinali per terapie avanzate preparati su IL MINISTRO Visto il decreto legislativo 24 aprile 2006, n. 219 successive direttive di modifica) relativa
Ministero della Salute Disposizioni in materia di medicinali per terapie avanzate preparati su IL MINISTRO Visto il decreto legislativo 24 aprile 2006, n. 219 successive direttive di modifica) relativa
Il Rettore. Decreto n (896) Anno 2013
 Il Rettore Decreto n. 58500 (896) Anno 2013 VISTI gli articoli 16 e 17 del decreto del Presidente della Repubblica n. 162/82 e l articolo 6 della legge n. 341/90; VISTO l articolo 32 del Regolamento Didattico
Il Rettore Decreto n. 58500 (896) Anno 2013 VISTI gli articoli 16 e 17 del decreto del Presidente della Repubblica n. 162/82 e l articolo 6 della legge n. 341/90; VISTO l articolo 32 del Regolamento Didattico
Istruzioni per la raccolta dei campioni per la conferma della diagnosi di morbillo, rosolia e parotite, e per la genotipizzazione virale
 ALLEGATO 4 Istruzioni per la raccolta dei campioni per la conferma della diagnosi di morbillo, rosolia e parotite, e per la genotipizzazione virale Per la conferma di laboratorio dei casi sospetti di morbillo
ALLEGATO 4 Istruzioni per la raccolta dei campioni per la conferma della diagnosi di morbillo, rosolia e parotite, e per la genotipizzazione virale Per la conferma di laboratorio dei casi sospetti di morbillo
11 26 marzo per gli istituti scolastici
 Conferenza Nazionale Permanente dei Presidi delle Facoltà di Scienze e Tecnologie Piano Nazionale Lauree Scientifiche verifica delle conoscenze per l ingresso 2011/2012 sessione anticipata per gli studenti
Conferenza Nazionale Permanente dei Presidi delle Facoltà di Scienze e Tecnologie Piano Nazionale Lauree Scientifiche verifica delle conoscenze per l ingresso 2011/2012 sessione anticipata per gli studenti
C O R O - Network Co-Ordinamento della Ricerca Oncologica
 C O R O - Network Co-Ordinamento della Ricerca Oncologica A. OBIETTIVI GENERALI DEL NETWORK ATTIVITÀ I. Stabilire una rete di risorse per le applicazioni cliniche della ricerca oncologica II. Fornire supporto
C O R O - Network Co-Ordinamento della Ricerca Oncologica A. OBIETTIVI GENERALI DEL NETWORK ATTIVITÀ I. Stabilire una rete di risorse per le applicazioni cliniche della ricerca oncologica II. Fornire supporto
CONSENSO ALL ESECUZIONE DI TEST GENETICI
 CONSENSO ALL ESECUZIONE DI TEST GENETICI Io sottoscritto/a............................................................................ nato/a a.................................... (...... ) il....................................
CONSENSO ALL ESECUZIONE DI TEST GENETICI Io sottoscritto/a............................................................................ nato/a a.................................... (...... ) il....................................
LINEE GUIDA PER LA RACCOLTA DEL CONSENSO INFORMATO FSE Versione per MMG PLS. Settembre 2016
 LINEE GUIDA PER LA RACCOLTA DEL CONSENSO INFORMATO FSE Versione per MMG PLS Settembre 2016 Indice del documento 1. Premessa 3 2. Il Fascicolo Sanitario Elettronico regionale 3 3. Tipologia di consensi
LINEE GUIDA PER LA RACCOLTA DEL CONSENSO INFORMATO FSE Versione per MMG PLS Settembre 2016 Indice del documento 1. Premessa 3 2. Il Fascicolo Sanitario Elettronico regionale 3 3. Tipologia di consensi
Progensa PCA3 Urine Specimen Transport Kit
 Istruzioni per i medici Progensa PCA3 Urine Specimen Transport Kit Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
Istruzioni per i medici Progensa PCA3 Urine Specimen Transport Kit Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
RESPONSABILITA TECNICO INFERMIERISTICHE NELLA GESTIONE
 RESPONSABILITA TECNICO INFERMIERISTICHE NELLA GESTIONE DEL DONATORE/PAZIENTE DI HPC-A Fiorito Rita Servizio Immunoematologia e Medicina Trasfusionale Milano Introduzione La gestione del donatore/paziente
RESPONSABILITA TECNICO INFERMIERISTICHE NELLA GESTIONE DEL DONATORE/PAZIENTE DI HPC-A Fiorito Rita Servizio Immunoematologia e Medicina Trasfusionale Milano Introduzione La gestione del donatore/paziente
DOMANDA DI ADESIONE ALLA DA VINCI EUROPEAN BIOBANK (DAVEB) COME UNITÀ DI RICERCA PREMESSA
 1 Page 1 of 5 (fac-simile, da inviare come raccomandata con ricevuta di ritorno, via mail come documento scannerizzato dopo averlo firmato via fax; se compilato al PC riempire solo il modulo relativo al
1 Page 1 of 5 (fac-simile, da inviare come raccomandata con ricevuta di ritorno, via mail come documento scannerizzato dopo averlo firmato via fax; se compilato al PC riempire solo il modulo relativo al
INFORMAZIONE AI LAVORATORI/ UTENTI DEL COLLEGIO PROCEDURE DI SICUREZZA: LAVORATRICI GESTANTI
 PROCEDURE DI SICUREZZA: LAVORATRICI GESTANTI Procedure di sicurezza: LAVORATRICI GESTANTI Autore: IEC S.r.l. Revisione: settembre 2014 INDICE 1 Destinatari...1 2 Obiettivo...1 3 Premessa...1 4 Principali
PROCEDURE DI SICUREZZA: LAVORATRICI GESTANTI Procedure di sicurezza: LAVORATRICI GESTANTI Autore: IEC S.r.l. Revisione: settembre 2014 INDICE 1 Destinatari...1 2 Obiettivo...1 3 Premessa...1 4 Principali
LICEO SCIENTIFICO STATALE A. GRAMSCI
 Premessa Il presente documento è relativo a tutti i web afferenti al dominio lsgramsci.it (www.lsgramsci.it, moodle.lsgramsci.it). Informativa per web Il Liceo Scientifico Antonio Gramsci rispetta la privacy
Premessa Il presente documento è relativo a tutti i web afferenti al dominio lsgramsci.it (www.lsgramsci.it, moodle.lsgramsci.it). Informativa per web Il Liceo Scientifico Antonio Gramsci rispetta la privacy
IISS E. Bona. Copia controllata
 Pagina 1 di 6 Copia controllata 1. Scopo e Campo di Applicazione La presente procedura stabilisce le responsabilità e le modalità per l efficace gestione delle non conformità riscontrate durante la progettazione,
Pagina 1 di 6 Copia controllata 1. Scopo e Campo di Applicazione La presente procedura stabilisce le responsabilità e le modalità per l efficace gestione delle non conformità riscontrate durante la progettazione,
Ospedale di Treviso. Medicina di Laboratorio Guida ai Servizi
 Ospedale di Treviso Medicina di Laboratorio Guida ai Servizi L Unità Operativa Complessa Medicina di Laboratorio è un struttura del Dipartimento di Patologia Clinica dell Azienda ULSS 9 di Treviso. Essa
Ospedale di Treviso Medicina di Laboratorio Guida ai Servizi L Unità Operativa Complessa Medicina di Laboratorio è un struttura del Dipartimento di Patologia Clinica dell Azienda ULSS 9 di Treviso. Essa
Lineaguida per la presentazione di un protocollo che prevede una ricerca genetica
 Lineaguida per la presentazione di un protocollo che prevede una ricerca genetica 1. RAZIONALE e OBIETTIVI: Dovranno essere indicati: il razionale generale che sottende alla raccolta dei campioni; gli
Lineaguida per la presentazione di un protocollo che prevede una ricerca genetica 1. RAZIONALE e OBIETTIVI: Dovranno essere indicati: il razionale generale che sottende alla raccolta dei campioni; gli
Introduzione. Obiettivi
 Tecniche di studio RM per la quantificazione di flusso intracerebrale e sue applicazioni. Dr TSRM Giorgi Riccardo Fondazione I.R.C.C.S. Istituto Neurologico Carlo Besta di Milano Introduzione Una delle
Tecniche di studio RM per la quantificazione di flusso intracerebrale e sue applicazioni. Dr TSRM Giorgi Riccardo Fondazione I.R.C.C.S. Istituto Neurologico Carlo Besta di Milano Introduzione Una delle
I. IL PROGETTO I.1 DESCRIZIONE
 ALLEGATO B1 intervento aggregazione FORMULARIO DI PRESENTAZIONE PROPOSTE PROGETTUALI (COMPRESE SCHEDE DEI PARTNER) I. IL PROGETTO I.1 DESCRIZIONE I.1.1 Titolo ed acronimo (Per l acronimo del progetto si
ALLEGATO B1 intervento aggregazione FORMULARIO DI PRESENTAZIONE PROPOSTE PROGETTUALI (COMPRESE SCHEDE DEI PARTNER) I. IL PROGETTO I.1 DESCRIZIONE I.1.1 Titolo ed acronimo (Per l acronimo del progetto si
REGOLAMENTO COMUNALE PER LA TENUTA DEL REGISTRO DEI TESTAMENTI BIOLOGICI DICHIARAZIONI ANTICIPATE DI TRATTAMENTO
 REGOLAMENTO COMUNALE PER LA TENUTA DEL REGISTRO DEI TESTAMENTI BIOLOGICI DICHIARAZIONI ANTICIPATE DI TRATTAMENTO 1 Indice Articolo 1- Istituzione del registro. Articolo 2 Definizioni. Articolo 3 - Iscrizione
REGOLAMENTO COMUNALE PER LA TENUTA DEL REGISTRO DEI TESTAMENTI BIOLOGICI DICHIARAZIONI ANTICIPATE DI TRATTAMENTO 1 Indice Articolo 1- Istituzione del registro. Articolo 2 Definizioni. Articolo 3 - Iscrizione
INFORMAZIONE E CONSENSO AL TEST COMBINATO
 Ospedale S. Maria Bianca - Mirandola Unità Operativa di Ostetricia e Ginecologia Direttore: Dr. P. Accorsi Responsabile: A. Ferrari Tel. 0535/602246 (dal lun. al ven.: ore 12-14) (Copia per la paziente)
Ospedale S. Maria Bianca - Mirandola Unità Operativa di Ostetricia e Ginecologia Direttore: Dr. P. Accorsi Responsabile: A. Ferrari Tel. 0535/602246 (dal lun. al ven.: ore 12-14) (Copia per la paziente)
