Legame covalente polare
|
|
|
- Stefano Carbone
- 6 anni fa
- Visualizzazioni
Transcript
1 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta minuscola) indica una carica parziale, sia positiva (δ+) per gli atomi poveri di elettroni sia negativa (δ-) per gli atomi ricchi di elettroni. Legame chimico: covalente polare Valori di elettronegatività di vari elementi della tavola periodica. In genere, l elettronegatività aumenta andando da sinistra a destra della tavola periodica e diminuisce andando dall alto verso il basso. I valori sono basati su una scala arbitraria, con F=4.0 e Cs=0.7. Il carbonio ha una elettronegatività pari a 2.5. Gli elementi colorati in rosso sono i più elettronegativi, quelli in verde hanno valori di elettronegatività intermedi, e quelli in giallo sono i meno elettronegativi. 1
2 Legame chimico: covalente polare Nel clorometano, CH 3 Cl, il legame C Cl è un legame covalente polare; (b) nel metillitio, CH 3 Li, il legame C Li è un legame covalente polare. Le rappresentazioni generate dal computer, dette mappe di potenziale elettrostatico, fanno uso di colori per mostrare le distribuzioni di carica calcolate: rosso per le zone ricche di elettroni, blu per le zone povere di elettroni. Effetto induttivo: polarizzazione della nuvola elettronica di un legame dovuta alla differenza di elettronegatività degli atomi coinvolti Legame chimico: covalente polare Il momento dipolare misura la polarità delle molecole Quando i centri di massa delle cariche positive e negative sono separati la molecola possiede momento dipolare (μ)( μ = q x r 1Debye = x Cm μ = 1,85 D 2
3 Legame chimico: covalente polare μ HF = 1.83 D Legame HF = 92 pm (92x10-12 m) Se il legame fosse ionico μ = (1,6x10-19 C) (92x10-12 m)= 1.5 x C x m (1.5 x C x m) x (1D/3.336 x C.m) = 4.4 D 1,83/4,4= 41% carattere ionico Legame chimico: covalente polare La geometria e la simmetria molecolare giocano un ruolo chiave nel n determinare μ I dipoli si sommano vettorialmente,, molecole simmetriche hanno μ = 0 3
4 Legame chimico: covalente polare Due coppie solitarie Contributo coppie solitarie Simmetria molecolare Legame chimico: covalente polare Cariche formali Carica formale positiva 4
5 Legame chimico: covalente polare Legame chimico: risonanza La risonanza N-O 122pm (N-O 130pm; N=O 116pm) Forme di risonanza Ibrido di risonanza 5
6 Legame chimico: risonanza Legame chimico: risonanza Le forme di risonanza differiscono solo per la posizione degli elettroni π o delle coppie di elettroni non condivisi La freccia ricurva 6
7 Legame chimico: risonanza Le forme di risonanza non sono necessariamente equivalenti Acetone Le forme di risonanza devono essere formule di Lewis corrette e seguire le normali regole di valenza L ibrido di risonanza è più stabile di ogni forma di risonanza Maggiore il numero di forme limite, maggiore la stabilità dell ibrido Legame chimico: risonanza Generalizzazione della risonanza per gruppi di tre atomi comprendenti un legame multiplo Legame multiplo 7
8 Acidi e basi: definizione di Brønsted/Lowry Acido Acido: dona uno ione H + Base: accetta uno ione H + Acido 8
9 Forza di acidi e basi: K a e pk a La reazione di acido acetico con H 2 O è un equilibrio: Un elevato valore di K a identifica un acido forte, un valore basso un acido debole Più grande è il valore di pk a, più debole è l acido 9
10 Qual è il pk a dell H 2 O? Qual è il pk a dell H 2 O? Quanto è concentrata l H 2 O? 1 mole di H 2 O ha la massa di 18g e occupa 18cm 3 per cui in 1 dm 3 vi saranno 1000/18=55.56mol = [ AH ] + HO 3 Ka A A ph = pka + log [ AH ] A ph maggiore del suo pk a l acido sarà più solubile, A - è più solubile che non l acido indissociato Tabella
11 Prevedere l andamento delle reazioni acido-base usando i valori di pka Acido acetico I prodotti devono essere più stabili (meno forti, meno reattivi) dei reagenti Alcuni acidi organici 11
12 L anione Alcune basi organiche Alcune basi organiche 12
13 Acidi e basi secondo Lewis Acido: acquista una coppia di elettroni Base: cede una coppia di elettroni Reazioni di alcuni acidi di Lewis con alcune basi di Lewis. Gli acidi di Lewis accettano una coppia di elettroni; le basi di Lewis cedono una coppia di elettroni. Notare come il movimento degli elettroni dalla base di Lewis all acido di Lewis viene indicato per mezzo delle frecce ricurve. 13
14 14
15 Possibile Acido acetico attacco protonato in più posizioni Correlazioni struttura-acidit acidità Lungo una riga della tabella periodica, le forze di legame sono pressoché paragonabili. Fattore dominante : elettronegatività dell atomo legato ad H. Polarità del legame con il protone nell acido indissociato Stabilità della base coniugata 15
16 Correlazioni struttura-acidit acidità Scendendo lungo una colonna della tavola periodica, l acidità aumenta (con il diminuire della forza del legame H-X) Influenza dell ibridazione Tanto maggiore è la percentuale di carattere s di un orbitale ibrido contenente una coppia di elettroni, tanto più fortemente tale coppia è attratta al nucleo, cioè un orbitale sp è più elettronegativo di un sp 2 che è più elettronegativo di sp 3 16
17 Effetti induttivi L effetto elettronico che trae origine dalle differenze di elettronegatività degli atomi e dalla conseguente polarizzazione dei legami si chiama effetto induttivo e si indica con +I (effetto di rilascio) e I (effetto di attrazione). I si trasmette attraverso i legami e dipende dalla distanza. Legame chimico: rappresentazioni Tabella
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Fondamenti di chimica organica Janice Gorzynski Smith Copyright 2009 The McGraw Hill Companies srl
 Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Soluzioni ai problemi proposti nel libro Capitolo 1 1.1 Il numero di massa è il numero dei protoni e dei neutroni. Il numero atomico è il numero dei protoni ed è identico per tutti gli isotopi. a. Numero
Introduzione alla Chimica Organica V Ed.
 William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
William H. Brown - Thomas Poon Introduzione alla Chimica Organica V Ed. Capitolo 2 2.1 Cosa sono gli acidi e le basi secondo Arrhenius? Un Acido di Arrhenius è una sostanze che sciolta in acqua produce
ACIDI E BASI ORGANICI: pka e ph
 Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
ACIDI e BASI: evoluzione del concetto
 ACIDI E BASI ACIDI e BASI: evoluzione del concetto Acidi e basi di Arrhenius Gli acidi sono composti che, in soluzione acquosa, si dissociano liberando ioni H +. Esempi: HCl, H 2 SO 4, HI, H 3 PO 4 Le
ACIDI E BASI ACIDI e BASI: evoluzione del concetto Acidi e basi di Arrhenius Gli acidi sono composti che, in soluzione acquosa, si dissociano liberando ioni H +. Esempi: HCl, H 2 SO 4, HI, H 3 PO 4 Le
Un compostoè costituito da due o più elementi in proporzioni costanti, ottenibili dai composti per trasformazioni chimiche.
 Le Formule Chimiche Un compostoè costituito da due o più elementi in proporzioni costanti, ottenibili dai composti per trasformazioni chimiche. La formula minima(o empirica): indica gli elementi che formano
Le Formule Chimiche Un compostoè costituito da due o più elementi in proporzioni costanti, ottenibili dai composti per trasformazioni chimiche. La formula minima(o empirica): indica gli elementi che formano
LEGAMI CHIMICI e GEOMETRIA MOLECOLARE
 DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
DAI LEGAMI CH HIMICI ALLA GEOMETRIA DELLE MOLECOLE. LEGAMI CHIMICI e GEOMETRIA MOLECOLARE Cos è un legame chimico? Il legame chimico non esiste Quanti tipi di legame? Legame ionico Legame covalente LEGAME
Teorie Acido-Base. valutazione degli acidi
 Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
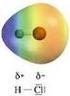 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
Legami covalenti polarizzati Molecole polari
 Legami covalenti polarizzati Molecole polari 1 Polarizzazione dei legami covalenti Il modo in cui due atomi legati covalentemente si dividono tra loro la coppia elettronica di legame dipende dalla tendenza
Legami covalenti polarizzati Molecole polari 1 Polarizzazione dei legami covalenti Il modo in cui due atomi legati covalentemente si dividono tra loro la coppia elettronica di legame dipende dalla tendenza
I LEGAMI CHIMICI. Configurazione elettronica stabile: è quella in cui tutti i livelli energetici dell atomo sono pieni di elettroni
 I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
I LEGAMI CIMICI In natura sono pochi gli elementi che presentano atomi allo stato libero. Gli unici elementi che sono costituiti da atomi isolati si chiamano gas nobili o inerti, formano il gruppo VIII
ESERCIZI ESERCIZI. il basso d. aumenta lungo un periodo da sinistra verso
 ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
ESERCIZI 1) L elettronegatività di un elemento: a è l energia che esso libera acquistando un elettrone e trasformandosi in ione negativo b è l energia necessaria per trasformarlo in ione positivo c indica
La chimica organica. Corso di Chimica Organica. I composti organici contengono carbonio Struttura elettronica e legame chimico
 2 nm Corso di Chimica Organica Synthesis of Anthropomorphic Molecules: The NanoPutians Di Stephanie H. Chanteau and James M. Tour J. Org. Chem., 68 (23), 8750-8766, 2003. Argomenti e materiale del corso:
2 nm Corso di Chimica Organica Synthesis of Anthropomorphic Molecules: The NanoPutians Di Stephanie H. Chanteau and James M. Tour J. Org. Chem., 68 (23), 8750-8766, 2003. Argomenti e materiale del corso:
Aspetti generali della Chimica Organica 1 parte
 Aspetti generali della Chimica Organica 1 parte Struttura e Legame: Il Carbonio nella Tabella Periodica Il Modello di Lewis Calcolo delle cariche formali Teoria della Risonanza Dove troviamo il carbonio
Aspetti generali della Chimica Organica 1 parte Struttura e Legame: Il Carbonio nella Tabella Periodica Il Modello di Lewis Calcolo delle cariche formali Teoria della Risonanza Dove troviamo il carbonio
Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà.
 TEORIE ACIDO-BASE Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà. Teoria di Arrhenius Arrhenius fu il primo a
TEORIE ACIDO-BASE Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà. Teoria di Arrhenius Arrhenius fu il primo a
Reazioni in soluzione acquosa
 Reazioni in soluzione acquosa Equazioni ioniche e molecolari Consideriamo le seguente reazione: Ca(OH) 2 (aq) + Na 2 CO 3 (aq) CaCO 3 (s) + 2 NaOH (aq) Essa è scritta come equazione molecolare anche se
Reazioni in soluzione acquosa Equazioni ioniche e molecolari Consideriamo le seguente reazione: Ca(OH) 2 (aq) + Na 2 CO 3 (aq) CaCO 3 (s) + 2 NaOH (aq) Essa è scritta come equazione molecolare anche se
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
= GEOMETRIA MOLECOLARE. (numero di legami) + (angolo di legame) = geometria. V.S.E.P.R.: Valence Shell Electron Pair Repulsion
 GEOMETRIA MOLECOLARE I legami covalenti sono direzionali I metodi sperimentali moderni permettono di conoscere sia la DISTANZA di legame (d) che l ANGOLO di legame (α), quindi una buona teoria del legame
GEOMETRIA MOLECOLARE I legami covalenti sono direzionali I metodi sperimentali moderni permettono di conoscere sia la DISTANZA di legame (d) che l ANGOLO di legame (α), quindi una buona teoria del legame
Elettronegatività Elettronegatività
 Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Elettronegatività Nel legame covalente tra atomi uguali, la nuvola elettronica è simmetrica rispetto ai due nuclei (es. H 2, Cl 2, F 2 ) legame covalente apolare. Nel legame covalente tra atomi con Z eff
Olimpiadi di Chimica
 Olimpiadi di Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più esterno
Olimpiadi di Chimica Acqua Oro Zucchero I Legami Chimici F N F F Il legame chimico il legame ionico Polare il legame covalente Dativo Gli elettroni di valenza sono gli elettroni del livello più esterno
Legame chimico: legame ionico, legame covalente, legame metallico
 Legame chimico: legame ionico, legame covalente, legame metallico Elettroni interni Categorie di elettroni elettroni del gas nobile che precede l elemento nella tavola periodica, riempiono tutti i livelli
Legame chimico: legame ionico, legame covalente, legame metallico Elettroni interni Categorie di elettroni elettroni del gas nobile che precede l elemento nella tavola periodica, riempiono tutti i livelli
CORSO DI CHIMICA ORGANICA. Testo consigliato: Chimica Organica H.Hart,D.J.Hart, L.E.Craine Zanichelli
 CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
CORSO DI CIMICA ORGANICA Testo consigliato: Chimica Organica.art,D.J.art, L.E.Craine Zanichelli Nucleo contenente neutroni e protoni 10-2 m Spazio extranucleare contenente elettroni NUMERO ATOMICO: numero
Reazioni in soluzione acquosa
 Reazioni in soluzione acquosa Equazioni ioniche e molecolari Consideriamo le seguente reazione: Ca(OH) 2 (aq) + Na 2 CO 3 (aq) CaCO 3 (s) + 2 NaOH (aq) Essa è scritta come equazione molecolare anche se
Reazioni in soluzione acquosa Equazioni ioniche e molecolari Consideriamo le seguente reazione: Ca(OH) 2 (aq) + Na 2 CO 3 (aq) CaCO 3 (s) + 2 NaOH (aq) Essa è scritta come equazione molecolare anche se
CHIMICA ORGANICA PER BIOTECNOLOGIE con esercitazioni di LABORATORIO D. Savoia
 CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
CHIMICA RGANICA PER BITECNLGIE con esercitazioni di LABRATRI D. Savoia Brown, Poon - Introduzione alla Chimica rganica Brown, Foote - Chimica rganica Bruyce - Chimica rganica Solomons McMurray Etc Cos
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
Legame covalente polare
 Legame covalente polare Nel caso di legame covalente omeopolare (H 2 o Cl 2 ) gli elettroni di legame sono equamente condivisi. Quando invece il legame è covalente eteropolare (HCl) gli elettroni di legame
Legame covalente polare Nel caso di legame covalente omeopolare (H 2 o Cl 2 ) gli elettroni di legame sono equamente condivisi. Quando invece il legame è covalente eteropolare (HCl) gli elettroni di legame
ORBITALE ATOMICO. Forma
 L ATOMO ORBITALE ATOMICO n (numero quantico principale) Energia e Dimensione l (numero quantico azimutale) Forma m l (numero quantico magnetico) Orientazione nello spazio l dipende da n assume n valori:
L ATOMO ORBITALE ATOMICO n (numero quantico principale) Energia e Dimensione l (numero quantico azimutale) Forma m l (numero quantico magnetico) Orientazione nello spazio l dipende da n assume n valori:
Corso di Laurea in CHIMICA (L.T.) Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule
 orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
orso di Laurea in IMIA (L.T.) IMIA RGANIA I con Elementi di Laboratorio Esercitazione n. 1 - Struttura delle molecole e modo di scrivere le formule TERMINI ED ARGMENTI DA NSERE PER L SVLGIMENT DEGLI ESERIZI
Definizioni. Vecchia: derivata da organismi viventi Nuova: la chimica dei composti del carbonio Da inorganico a organico, Wöhler, 1828
 CHIMICA ORGANICA 4 Definizioni Vecchia: derivata da organismi viventi Nuova: la chimica dei composti del carbonio Da inorganico a organico, Wöhler, 828 + - NH 4 OCN ammonio cianato calore O H 2 N C NH
CHIMICA ORGANICA 4 Definizioni Vecchia: derivata da organismi viventi Nuova: la chimica dei composti del carbonio Da inorganico a organico, Wöhler, 828 + - NH 4 OCN ammonio cianato calore O H 2 N C NH
Il Legame Chimico e la Struttura Molecolare
 2017 1 Il Legame Chimico e la Struttura Molecolare LEGAME CIMICO 2 In che modo gli atomi in una molecola o uno ione poliatomico interagiscono?! Perchè alcune molecole sono planari ed altre non lo sono?!
2017 1 Il Legame Chimico e la Struttura Molecolare LEGAME CIMICO 2 In che modo gli atomi in una molecola o uno ione poliatomico interagiscono?! Perchè alcune molecole sono planari ed altre non lo sono?!
Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole.
 4.1 Angolo di legame e forma delle molecole Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole. La forma e le dimensioni delle molecole, la disposizione
4.1 Angolo di legame e forma delle molecole Le proprietà delle sostanze dipendono dal tipo di legame che unisce gli atomi e dalla forma delle molecole. La forma e le dimensioni delle molecole, la disposizione
le SOSTANZE Sostanze elementari (ELEMENTI) COMPOSTI Costituiti da due o più atomi DIVERSI tra loro
 Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
Il legame chimico In natura gli atomi sono solitamente legati ad altri in unità più complesse che, se aggregate fra loro costituiscono quello che macroscopicamente percepiamo come materia, le SOSTANZE
Il legame chimico ATOMI MOLECOLE
 Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
Il legame chimico Gli atomi tendono a combinarsi con altri atomi per dare un sistema finale più stabile di quello iniziale (a minor contenuto di energia). ATOMI MOLECOLE 1 Stati repulsivi di non legame
FORMULE di LEWIS. Molecole biatomiche
 FORMULE di LEWIS Molecole biatomiche Contare gli elettroni di valenza dei due atomi Nella struttura di Lewis devono comparire tanti puntini quanti sono gli elettroni al punto 1). Disporre gli elettroni
FORMULE di LEWIS Molecole biatomiche Contare gli elettroni di valenza dei due atomi Nella struttura di Lewis devono comparire tanti puntini quanti sono gli elettroni al punto 1). Disporre gli elettroni
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
Esame del
 Chimica Generale ed Inorganica Esame del 08-02-2011 Chimica Generale Mazzi 1) La teoria VSEPR afferma che quando un atomo forma legami covalenti: A. tutti i suoi elettroni si respingono e si dispongono
Chimica Generale ed Inorganica Esame del 08-02-2011 Chimica Generale Mazzi 1) La teoria VSEPR afferma che quando un atomo forma legami covalenti: A. tutti i suoi elettroni si respingono e si dispongono
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 14 Le nuove teorie di legame 3 Sommario 1. I limiti della teoria di Lewis 2. Il legame chimico secondo la meccanica quantistica
Perché H 2 e non H? He e non He 2? H 2 O e non H 3 O?
 IL LEGAME CHIMICO Perché H 2 e non H? He e non He 2? H 2 O e non H 3 O? Configurazione degli elettroni diversa ed energeticamente più favorevole di quella degli atomi isolati? Ionico (trasferimento di
IL LEGAME CHIMICO Perché H 2 e non H? He e non He 2? H 2 O e non H 3 O? Configurazione degli elettroni diversa ed energeticamente più favorevole di quella degli atomi isolati? Ionico (trasferimento di
Sommario delle lezioni Legami chimici
 Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Delocalizzazione elettronica e risonanza
 Delocalizzazione elettronica e risonanza E sufficiente? La risonanza è quel fenomeno per cui una molecola può essere rappresentata attraverso diverse strutture che differiscano tra loro solo per una diversa
Delocalizzazione elettronica e risonanza E sufficiente? La risonanza è quel fenomeno per cui una molecola può essere rappresentata attraverso diverse strutture che differiscano tra loro solo per una diversa
combinazione di atomi tenuti insieme da forze più o meno un insieme caratteristico di proprietà
 IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
Capitolo 1 Introduzione Legame Chimico ed Isomeria
 himica rganica Scienze della Terra, dell Ambiente e del Territorio apitolo 1 Introduzione Legame himico ed Isomeria rganic hemistry, 5 th Edition L. G. Wade, Jr. Prentice all rganic hemistry, 3 rd Edition
himica rganica Scienze della Terra, dell Ambiente e del Territorio apitolo 1 Introduzione Legame himico ed Isomeria rganic hemistry, 5 th Edition L. G. Wade, Jr. Prentice all rganic hemistry, 3 rd Edition
1. Elettronegatività 2. Numero di ossidazione 3. Reazioni di ossidoriduzione (REDOX) 4. Bilanciamento redox
 Lezione 10 1. Elettronegatività 2. Numero di ossidazione 3. Reazioni di ossidoriduzione (REDOX) 4. Bilanciamento redox 5. Delocalizzazione elettronica e risonanza Elettronegatività Si definisce elettronegatività
Lezione 10 1. Elettronegatività 2. Numero di ossidazione 3. Reazioni di ossidoriduzione (REDOX) 4. Bilanciamento redox 5. Delocalizzazione elettronica e risonanza Elettronegatività Si definisce elettronegatività
GEOMETRIA MOLECOLARE. Ibridazione La teoria VSEPR
 GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
Che cosa è la chimica organica? E la chimica del carbonio, cioè la chimica che si occupa di studiare tutti quei composti che contengono l elemento
 Che cosa è la chimica organica? E la chimica del carbonio, cioè la chimica che si occupa di studiare tutti quei composti che contengono l elemento carbonio.. CENNI SU STRUTTURA ATOMICA: Rappresentazione
Che cosa è la chimica organica? E la chimica del carbonio, cioè la chimica che si occupa di studiare tutti quei composti che contengono l elemento carbonio.. CENNI SU STRUTTURA ATOMICA: Rappresentazione
Corso di Laurea Magistrale in FARMACIA
 CHIMICA ORGANICA Titolare: PROF. ANNA AIELLO Corso di Laurea Magistrale in FARMACIA Studio: II piano n N3 - Edificio laboratori di ricerca - Lab n N12 Ricevimento studenti: martedì dalle 11.30 alle 12.30
CHIMICA ORGANICA Titolare: PROF. ANNA AIELLO Corso di Laurea Magistrale in FARMACIA Studio: II piano n N3 - Edificio laboratori di ricerca - Lab n N12 Ricevimento studenti: martedì dalle 11.30 alle 12.30
LEGAMI CHIMICI. Gli elettroni esterni sono implicati nella formazione dei legami chimici
 LEGAMI CHIMICI Gli elettroni esterni sono implicati nella formazione dei legami chimici La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune
LEGAMI CHIMICI Gli elettroni esterni sono implicati nella formazione dei legami chimici La VALENZA di un elemento è data dal numero di elettroni che esso deve perdere, o acquistare, o mettere in comune
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
GEOMETRIA MOLECOLARE Ibridazione La teoria VSEPR 1 Ibridazione e geometria molecolare Teoria di Lewis e VB vista finora non sono in grado di descrivere correttamente la geometria di molte molecole anche
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Un po di calcoli N moli = massa [gr] / massa atomica [uma] N atomi = N moli * N A N A = numero di Avogadro Quanti
La Vita è una Reazione Chimica Acqua Oro Zucchero Relazioni di massa nelle reazioni chimiche Un po di calcoli N moli = massa [gr] / massa atomica [uma] N atomi = N moli * N A N A = numero di Avogadro Quanti
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
Legami Chimici. Insegnamento di Chimica Generale CCS CHI e MAT
 Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Legami Chimici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/ Esercizio 1 e 2
Insegnamento di Chimica Generale 083424 - CCS CHI e MAT Legami Chimici Prof. Dipartimento CMIC Giulio Natta http://iscamap.chem.polimi.it/citterio/education/general-chemistry-exercises/ Esercizio 1 e 2
PROPRIETA FISICHE DEI COMPOSTI ORGANICI
 PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
PRPRIETA FISICE DEI CMPSTI RGAICI I composti organici sono molto numerosi a causa del fatto che il legame σ tra due atomi di carbonio è particolarmente forte, a causa delle piccole dimensioni e del valore
HX X + H + MOH M + + OH -
 ACIDI E BASI LA TEORIA DI ARRHENIUS La prima vera teoria sulla natura degli acidi e delle basi appartiene a Svante Arrhenius, chimico svedese di fine 800 premio Nobel ACIDO Specie chimica che, in soluzione
ACIDI E BASI LA TEORIA DI ARRHENIUS La prima vera teoria sulla natura degli acidi e delle basi appartiene a Svante Arrhenius, chimico svedese di fine 800 premio Nobel ACIDO Specie chimica che, in soluzione
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
FORMAZIONE DI LEGAMI. Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato.
 FORMAZIONE DI LEGAMI Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato. Presa r come distanza internucleare si osserva che l'energia
FORMAZIONE DI LEGAMI Il legame chimico si definisce quando fra due atomi esistono delle forze che danno luogo alla formazione di un aggregato. Presa r come distanza internucleare si osserva che l'energia
Proprietà Chimico-fisiche dei composti organici
 Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Proprietà Chimico-fisiche dei composti organici Le costanti fisiche dei composti sono dei valori numerici associati con le proprietà misurabili di queste sostanze. Queste proprietà non variano e sono usate
Elettroni di VALENZA. Elettroni dell atomo. Elettroni INTERNI (di core) LE FORMULE DI LEWIS LA REGOLA DELL OTTETTO
 LE FORMULE DI LEWIS Elettroni dell atomo Elettroni di VALENZA Elettroni INTERNI (di core) LA REGOLA DELL OTTETTO Le strutture di Lewis NON danno informazioni sulla GEOMETRIA delle molecole! COME SI DISEGNANO
LE FORMULE DI LEWIS Elettroni dell atomo Elettroni di VALENZA Elettroni INTERNI (di core) LA REGOLA DELL OTTETTO Le strutture di Lewis NON danno informazioni sulla GEOMETRIA delle molecole! COME SI DISEGNANO
IL LEGAME COVALENTE A-A A + A - Legame covalente. Il legame covalente. H 2 Cl 2 O 2 N 2 H 2 O CO 2 NH 3 CH 4
 IL LEGAME COVALENTE 1 Il legame covalente 2 Cl 2 O 2 N 2 A-A A + A - 2 O CO 2 N 3 C 4 Legame covalente Teoria di Lewis Teoria del Legame di Valenza Teoria degli Orbitali Molecolari 2 1 I simboli di Lewis
IL LEGAME COVALENTE 1 Il legame covalente 2 Cl 2 O 2 N 2 A-A A + A - 2 O CO 2 N 3 C 4 Legame covalente Teoria di Lewis Teoria del Legame di Valenza Teoria degli Orbitali Molecolari 2 1 I simboli di Lewis
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta della struttura elettronica delle molecole, come quella
Legame covalente. H 1s un protone e un elettrone
 Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
Legame covalente H 1s un protone e un elettrone Il legame covalente è formato da una coppia di elettroni condivisa fra due atomi. L energia richiesta per separare gli atomi legati è detta energia di legame.
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR)
 TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
TEORIA DEL LEGAME DI VALENZA (VB) e GEOMETRIA MOLECOLARE (teoria VSEPR) Metodi basati sulla meccanica quantistica: VB e MO La descrizione più corretta e quantitativa della struttura elettronica delle molecole,
Chimica e chimica della vita. Chimica della vita. Atomi. Materia ed elementi. Tavola periodica degli elementi. Elementi ed atomi
 Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono
Chimica e chimica della vita Tocca, Oliver diceva, lanciandomi una barretta non c è niente al mondo come il tungsteno sinterizzato Batteva sulle barrette e queste emettevano un tintinnio profondo Il suono
Soluti in acqua. Elettroliti. Non elettroliti
 Soluti in acqua Elettroliti Forti Dissociazione Elettrolitica COMPLETA Soluto Deboli Dissociazione Elettrolitica NON COMPLETA Non elettroliti Dissociazione Elettrolitica NaCl (s) + acqua Na + (aq) + Cl
Soluti in acqua Elettroliti Forti Dissociazione Elettrolitica COMPLETA Soluto Deboli Dissociazione Elettrolitica NON COMPLETA Non elettroliti Dissociazione Elettrolitica NaCl (s) + acqua Na + (aq) + Cl
I Legami intermolecolari
 I Legami intermolecolari Legami tra gli atomi di una molecola riepilogando Ionico D >1,9 Legami forti Covalente D = differenza di elettronegatività tra gli atomi Metallico (dovuto alla dislocazione di
I Legami intermolecolari Legami tra gli atomi di una molecola riepilogando Ionico D >1,9 Legami forti Covalente D = differenza di elettronegatività tra gli atomi Metallico (dovuto alla dislocazione di
STRUTTURA DEGLI OSSIACIDI
 Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata STRUTTURA DEGLI OSSIACIDI Orbitali ibridi
Chimica Silvia LICOCCIA Professore Ordinario di Fondamenti Chimici per le Tecnologie Dipartimento di Scienze e Tecnologie Chimiche Università di Roma Tor Vergata STRUTTURA DEGLI OSSIACIDI Orbitali ibridi
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
1. L energia di legame. 2. I gas nobili e a regola dell ottetto. 3. Il legame covalente. 4. Il legame covalente dativo. 5. Il legame covalente polare
 Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il legame covalente dativo 5. Il legame covalente polare 6. Il legame ionico 7. I composti
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
Legame Covalente Polare e MOT. Polarità del legame aumenta con differenza di elettronegatività.
 Legame Covalente Polare e MOT Polarità del legame aumenta con differenza di elettronegatività. Legame Ionico Se differenza di elettronegatività è molto grande si ottiene un legame ionico. Legame Ionico
Legame Covalente Polare e MOT Polarità del legame aumenta con differenza di elettronegatività. Legame Ionico Se differenza di elettronegatività è molto grande si ottiene un legame ionico. Legame Ionico
Cos è la chimica organica
 Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Il legame chimico I: il legame covalente. Capitolo 9
 Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Il legame chimico I: il legame covalente Capitolo 9 Gli elettroni di valenza sono gli elettroni del livello più esterno di un atomo. Gli elettroni di valenza sono quelli che partecipano alla formazione
Il Monossido di Di-Idrogeno
 Il Monossido di Di-Idrogeno Equilibri in Soluzione Acquosa In soluzione acquosa, per un equilibrio generico: + + La legge di azione di massa si scrive: = Si usano le concentrazioni molari dei soluti in
Il Monossido di Di-Idrogeno Equilibri in Soluzione Acquosa In soluzione acquosa, per un equilibrio generico: + + La legge di azione di massa si scrive: = Si usano le concentrazioni molari dei soluti in
IL LEGAME A IDROGENO
 IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
IL LEGAME A IDROGENO Il legame idrogeno è un particolare tipo di interazione fra molecole che si forma ogni volta che un atomo di idrogeno, legato ad un atomo fortemente elettronegativo (cioè capace di
6. I gruppi funzionali
 6. I gruppi funzionali Si definisce GRUPP FUZIALE (W) un eteroatomo (o un aggruppamento di atomi) che, sostituito ad un idrogeno (o a un legame -) di un alcano, ne modifica la caratteristiche chimicofisiche
6. I gruppi funzionali Si definisce GRUPP FUZIALE (W) un eteroatomo (o un aggruppamento di atomi) che, sostituito ad un idrogeno (o a un legame -) di un alcano, ne modifica la caratteristiche chimicofisiche
Bagatti, Corradi, Desco, Ropa. Chimica. seconda edizione
 Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 7. e le proprietà delle sostanze SEGUI LA MAPPA 1 afferma che quando un atomo è legato
Bagatti, Corradi, Desco, Ropa Chimica seconda edizione Bagatti, Corradi, Desco, Ropa, Chimica seconda edizione Capitolo 7. e le proprietà delle sostanze SEGUI LA MAPPA 1 afferma che quando un atomo è legato
I legami chimici. Perché si formano i legami? Perché si formano i legami? 16/01/2019. Come e perché gli atomi si legano tra loro
 I legami chimici Come e perché gli atomi si legano tra loro Perché si formano i legami? In natura, se non in casi eccezionali, non si trovano atomi liberi. Per separare due atomi legati è necessario fornire
I legami chimici Come e perché gli atomi si legano tra loro Perché si formano i legami? In natura, se non in casi eccezionali, non si trovano atomi liberi. Per separare due atomi legati è necessario fornire
ATTENZIONE! Gran parte delle reazioni organiche sono reazioni acido- base.
 ATTENZINE! Gran parte delle reazioni organiche sono reazioni acido base. è ASSLUTAMENTE necessario conoscere i fondamena della chimica acido base Teoria di Arrhenius Acido: Sostanza che sciolta in acqua
ATTENZINE! Gran parte delle reazioni organiche sono reazioni acido base. è ASSLUTAMENTE necessario conoscere i fondamena della chimica acido base Teoria di Arrhenius Acido: Sostanza che sciolta in acqua
Cos è la chimica organica
 Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Teoria di Lewis. Un acido di Lewis è una specie chimica che può formare un legame covalente accettando una coppia di elettroni da un altra specie.
 Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Il legame chimico. Lezioni 17-20
 Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Il legame chimico Lezioni 17-20 1 Il legame chimico Le forze attrattive di natura elettrica che tengono uniti gli atomi in molecole o in composti ionici sono dette legami chimici. Legami atomici: covalente
Chimica. Lezione 2 Parte II Composti ionici e molecolari
 Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica Lezione 2 Parte II Composti ionici e molecolari Composti molecolari Gli ELEMENTI chimici (ad eccezione dei gas nobili) vivono in aggregati più o meno complessi Sono aggregati discreti (hanno un
Chimica e laboratorio
 ITIS H.HERTZ Progetto Monoennio Chimica e laboratorio PARTE PRIMA I MODULO: Struttura atomica e molecolare della materia PESO : 70% UNITA ORARIE PREVISTE : 20 h Unità A: ATOMI Descrivere le caratteristiche
ITIS H.HERTZ Progetto Monoennio Chimica e laboratorio PARTE PRIMA I MODULO: Struttura atomica e molecolare della materia PESO : 70% UNITA ORARIE PREVISTE : 20 h Unità A: ATOMI Descrivere le caratteristiche
Complementi di Chimica Organica. Composti Aromatici: Benzene C 6 H 6 (1825) (1865) Friedrich August Kekulé
 Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Composti Aromatici: Benzene C 6 6 (1825) (1865) Friedrich August Kekulé Composti Aromatici: Benzene, energia di coniugazione = -119.5 KJ/mol (-119.2 x 3 = -357.6) = -208.2 KJ/mol -357.6 KJ/mol (-208.2
Arrhenius. HCl H + + Cl - NaOH Na + + OH -
 Arrhenius Un acido è una sostanza che contiene H ed è in grado di cedere ioni H + e base è una sostanza che ha tendenza a cedere ioni OH - in acqua H 2 O HCl H + + Cl - H 2 O NaOH Na + + OH - Reazione
Arrhenius Un acido è una sostanza che contiene H ed è in grado di cedere ioni H + e base è una sostanza che ha tendenza a cedere ioni OH - in acqua H 2 O HCl H + + Cl - H 2 O NaOH Na + + OH - Reazione
Le proprietà periodiche degli elementi. Problema: ordinare gli elementi secondo un criterio logico e memorizzabile
 Le proprietà periodiche degli elementi Problema: ordinare gli elementi secondo un criterio logico e memorizzabile Nei periodi gli elementi presentano numero atomico crescente e le proprietà chimiche
Le proprietà periodiche degli elementi Problema: ordinare gli elementi secondo un criterio logico e memorizzabile Nei periodi gli elementi presentano numero atomico crescente e le proprietà chimiche
Geometria molecolare
 Geometria molecolare Le molecole possono essere rappresentate disponendo gli atomi in posizioni definite nello spazio in modo da costruire una figura geometrica Il modo più semplice per assegnare la geometria
Geometria molecolare Le molecole possono essere rappresentate disponendo gli atomi in posizioni definite nello spazio in modo da costruire una figura geometrica Il modo più semplice per assegnare la geometria
Le idee della chimica
 G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
G. Valitutti A.Tifi A.Gentile Seconda edizione Copyright 2009 Zanichelli editore Capitolo 10 I legami chimici 1. L energia di legame 2. I gas nobili e a regola dell ottetto 3. Il legame covalente 4. Il
Acidi e Basi. Capitolo 15
 Acidi e Basi Capitolo 15 Acidi Hanno un sapore agro. L aceto deve il suo sapore all acido acetico Gli agrumi contengono acido citrico. Provocano il cambio di colore nei coloranti vegetali. Reagiscono con
Acidi e Basi Capitolo 15 Acidi Hanno un sapore agro. L aceto deve il suo sapore all acido acetico Gli agrumi contengono acido citrico. Provocano il cambio di colore nei coloranti vegetali. Reagiscono con
Prof.Patrizia Gallucci
 Prof.Patrizia Gallucci MAPPA CONCETTUALE Gli atomi,ad eccezione dei gas nobili, si legano tra di loro a formare molecole o aggregati di ioni. Teoria di Lewis: Gli elettroni esterni, di valenza, sono implicati
Prof.Patrizia Gallucci MAPPA CONCETTUALE Gli atomi,ad eccezione dei gas nobili, si legano tra di loro a formare molecole o aggregati di ioni. Teoria di Lewis: Gli elettroni esterni, di valenza, sono implicati
H 2 O 2 (aq) 2e - + O 2 (g) H + (aq) MnO 2 (s) +2e H + (aq Mn 2+ (aq) +2 H 2 O (l).
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico-elettronico: H 2 2 (aq) + Mn 2 (s) + H + (aq) Mn 2+ (aq) + 2 (g) + H 2 (l). Calcolare la massa di Mn 2 (s) necessaria per
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
1. L energia di legame
 legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
legami chimici 1. L energia di legame Nonostante l enorme numero di combinazioni possibili fra gli atomi, non tutte sono realizzabili: un composto si forma solo se la sua energia potenziale è minore dei
Il legame chimico. Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici
 Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
Il legame chimico Gli atomi sia nelle sostanze elementari che nei composti sono tenuti insieme dai legami chimici Fra due atomi o fra due gruppi di atomi è presente un legame chimico quando l entità che
