forme e confezioni: "100 mg/50 ml soluzione per infusione" 1 sacca da 50 ml; "100 mg/50 ml
|
|
|
- Giuditta Motta
- 5 anni fa
- Visualizzazioni
Transcript
1 Autorizzazione all immissione in commercio del medicinale Fluconazolo Keironpharma Estratto determinazione n. 839/2012 del 12 giugno 2012 DESCRIZIONEDELMEDICINALEEATTRIBUZIONEN.AIC E'autorizzatal'immissioneincommerciodelmedicinale:FLUCONAZOLOKEIRONPHARMA,nelle formeeconfezioni:"100mg/50mlsoluzioneperinfusione"1saccada50ml;"100mg/50ml soluzioneperinfusione"5saccheda50ml;"100mg/50mlsoluzioneperinfusione"10saccheda 50ml;"100mg/50mlsoluzioneperinfusione"20saccheda50ml;"200mg/100mlsoluzioneper infusione"1saccada100ml;"200mg/100mlsoluzioneperinfusione"5saccheda100ml;"200 mg/100mlsoluzioneperinfusione"10saccheda100ml;"200mg/100mlsoluzioneperinfusione" 20saccheda100ml;"400mg/200mlsoluzioneperinfusione"1saccada200ml;"400mg/200ml soluzioneperinfusione"5saccheda200ml;"400mg/200mlsoluzioneperinfusione"10sacche da200ml;"400mg/200mlsoluzioneperinfusione"20saccheda200ml,allecondizionieconle specificazionidiseguitoindicateallecondizionieconlespecificazionidiseguitoindicate,purché sianoefficacialladatadientratainvigoredellapresentedeterminazione: TITOLAREAIC:KEIRONPHARMAS.r.L.,consedelegaleedomiciliofiscaleinViaAitoro,16/C,84091 Battipaglia(SA)Italia,CodiceFiscale Confezione:"100mg/50mlsoluzioneperinfusione"1saccada50ml AICn (inbase10)174F55(inbase32) FormaFarmaceutica:Soluzioneperinfusione ValiditàProdottoIntegro:treannidalladatadifabbricazione Composizione:ognisaccacontiene: PrincipioAttivo:fluconazolo100mg Eccipienti:sodiocloruro0,45g;acquaperpreparazioniiniettabili50ml Produttoredelprincipioattivo:AurobindoPharmaLimited,Unit VIII,Surveyn.13,I.D.A.Kazipally MedakDistrict,JinnaramMandal,GaddapotharamVillage,502319AndhraPradesh(India) Produttoredelprodottofinito:PanpharmaS.r.L.,ZonaIndustrialeValleUfita,83040Flumeri(AV), Italia(tuttelefasi) Confezione:"100mg/50mlsoluzioneperinfusione"5saccheda50ml AICn (inbase10)174F5K(inbase32) FormaFarmaceutica:Soluzioneperinfusione ValiditàProdottoIntegro:treannidalladatadifabbricazione Composizione:ognisaccacontiene: PrincipioAttivo:fluconazolo100mg Eccipienti:sodiocloruro0,45g;acquaperpreparazioniiniettabili50ml 23
2 Produttoredelprincipioattivo:AurobindoPharmaLimited,Unit VIII,Surveyn.13,I.D.A.Kazipally MedakDistrict,JinnaramMandal,GaddapotharamVillage,502319AndhraPradesh(India) Produttoredelprodottofinito:PanpharmaS.r.L.,ZonaIndustrialeValleUfita,83040Flumeri(AV), Italia(tuttelefasi) Confezione:"100mg/50mlsoluzioneperinfusione"10saccheda50ml AICn (inbase10)174F5X(inbase32) FormaFarmaceutica:Soluzioneperinfusione ValiditàProdottoIntegro:treannidalladatadifabbricazione Composizione:ognisaccacontiene: PrincipioAttivo:fluconazolo100mg Eccipienti:sodiocloruro0,45g;acquaperpreparazioniiniettabili50ml Produttoredelprincipioattivo:AurobindoPharmaLimited,Unit VIII,Surveyn.13,I.D.A.Kazipally MedakDistrict,JinnaramMandal,GaddapotharamVillage,502319AndhraPradesh(India) Produttoredelprodottofinito:PanpharmaS.r.L.,ZonaIndustrialeValleUfita,83040Flumeri(AV), Italia(tuttelefasi) Confezione:"100mg/50mlsoluzioneperinfusione"20saccheda50ml AICn (inbase10)174F69(inbase32) FormaFarmaceutica:Soluzioneperinfusione ValiditàProdottoIntegro:treannidalladatadifabbricazione Composizione:ognisaccacontiene: PrincipioAttivo:fluconazolo100mg Eccipienti:sodiocloruro0,45g;acquaperpreparazioniiniettabili50ml Produttoredelprincipioattivo:AurobindoPharmaLimited,Unit VIII,Surveyn.13,I.D.A.Kazipally MedakDistrict,JinnaramMandal,GaddapotharamVillage,502319AndhraPradesh(India) Produttoredelprodottofinito:PanpharmaS.r.L.,ZonaIndustrialeValleUfita,83040Flumeri(AV), Italia(tuttelefasi) Confezione:"200mg/100mlsoluzioneperinfusione"1saccada100ml AICn (inbase10)174F6D(inbase32) FormaFarmaceutica:Soluzioneperinfusione ValiditàProdottoIntegro:treannidalladatadifabbricazione Composizione:ognisaccacontiene: PrincipioAttivo:fluconazolo200mg Eccipienti:sodiocloruro0,9g;acquaperpreparazioniiniettabili100ml 24
3 Produttoredelprincipioattivo:AurobindoPharmaLimited,Unit VIII,Surveyn.13,I.D.A.Kazipally MedakDistrict,JinnaramMandal,GaddapotharamVillage,502319AndhraPradesh(India) Produttoredelprodottofinito:PanpharmaS.r.L.,ZonaIndustrialeValleUfita,83040Flumeri(AV), Italia(tuttelefasi) Confezione:"200mg/100mlsoluzioneperinfusione"5saccheda100ml AICn (inbase10)174F6S(inbase32) FormaFarmaceutica:Soluzioneperinfusione ValiditàProdottoIntegro:treannidalladatadifabbricazione Composizione:ognisaccacontiene: PrincipioAttivo:fluconazolo200mg Eccipienti:sodiocloruro0,9g;acquaperpreparazioniiniettabili100ml Produttoredelprincipioattivo:AurobindoPharmaLimited,Unit VIII,Surveyn.13,I.D.A.Kazipally MedakDistrict,JinnaramMandal,GaddapotharamVillage,502319AndhraPradesh(India) Produttoredelprodottofinito:PanpharmaS.r.L.,ZonaIndustrialeValleUfita,83040Flumeri(AV), Italia(tuttelefasi) Confezione:"200mg/100mlsoluzioneperinfusione"10saccheda100ml AICn (inbase10)174F74(inbase32) FormaFarmaceutica:Soluzioneperinfusione ValiditàProdottoIntegro:treannidalladatadifabbricazione Composizione:ognisaccacontiene: PrincipioAttivo:fluconazolo200mg Eccipienti:sodiocloruro0,9g;acquaperpreparazioniiniettabili100ml Produttoredelprincipioattivo:AurobindoPharmaLimited,Unit VIII,Surveyn.13,I.D.A.Kazipally MedakDistrict,JinnaramMandal,GaddapotharamVillage,502319AndhraPradesh(India) Produttoredelprodottofinito:PanpharmaS.r.L.,ZonaIndustrialeValleUfita,83040Flumeri(AV), Italia(tuttelefasi) Confezione:"200mg/100mlsoluzioneperinfusione"20saccheda100ml AICn (inbase10)174F7J(inbase32) FormaFarmaceutica:Soluzioneperinfusione ValiditàProdottoIntegro:treannidalladatadifabbricazione Composizione:ognisaccacontiene: PrincipioAttivo:fluconazolo200mg Eccipienti:sodiocloruro0,9g;acquaperpreparazioniiniettabili100ml 25
4 Produttoredelprincipioattivo:AurobindoPharmaLimited,Unit VIII,Surveyn.13,I.D.A.Kazipally MedakDistrict,JinnaramMandal,GaddapotharamVillage,502319AndhraPradesh(India) Produttoredelprodottofinito:PanpharmaS.r.L.,ZonaIndustrialeValleUfita,83040Flumeri(AV), Italia(tuttelefasi) Confezione:"400mg/200mlsoluzioneperinfusione"1saccada200ml AICn (inbase10)174F7L(inbase32) FormaFarmaceutica:Soluzioneperinfusione ValiditàProdottoIntegro:treannidalladatadifabbricazione Composizione:ognisaccacontiene: PrincipioAttivo:fluconazolo400mg Eccipienti:sodiocloruro1,8g;acquaperpreparazioniiniettabili200ml Produttoredelprincipioattivo:AurobindoPharmaLimited,Unit VIII,Surveyn.13,I.D.A.Kazipally MedakDistrict,JinnaramMandal,GaddapotharamVillage,502319AndhraPradesh(India) Produttoredelprodottofinito:PanpharmaS.r.L.,ZonaIndustrialeValleUfita,83040Flumeri(AV), Italia(tuttelefasi) Confezione:"400mg/200mlsoluzioneperinfusione"5saccheda200ml AICn (inbase10)174F7Y(inbase32) FormaFarmaceutica:Soluzioneperinfusione ValiditàProdottoIntegro:treannidalladatadifabbricazione Composizione:ognisaccacontiene: PrincipioAttivo:fluconazolo400mg Eccipienti:sodiocloruro1,8g;acquaperpreparazioniiniettabili200mlProduttoredelprincipio attivo: Aurobindo Pharma Limited, Unit VIII, Survey n. 13, I.D.A. Kazipally Medak District, JinnaramMandal,GaddapotharamVillage,502319AndhraPradesh(India) Produttoredelprodottofinito:PanpharmaS.r.L.,ZonaIndustrialeValleUfita,83040Flumeri(AV), Italia(tuttelefasi) Confezione:"400mg/200mlsoluzioneperinfusione"10saccheda200ml AICn (inbase10)174F8B(inbase32) FormaFarmaceutica:Soluzioneperinfusione ValiditàProdottoIntegro:treannidalladatadifabbricazione Composizione:ognisaccacontiene: PrincipioAttivo:fluconazolo400mg 26
5 Eccipienti:sodiocloruro1,8g;acquaperpreparazioniiniettabili200mlProduttoredelprincipio attivo: Aurobindo Pharma Limited, Unit VIII, Survey n. 13, I.D.A. Kazipally Medak District, JinnaramMandal,GaddapotharamVillage,502319AndhraPradesh(India) Produttoredelprodottofinito:PanpharmaS.r.L.,ZonaIndustrialeValleUfita,83040Flumeri(AV), Italia(tuttelefasi) Confezione:"400mg/200mlsoluzioneperinfusione"20saccheda200ml AICn (inbase10)174F8Q(inbase32) FormaFarmaceutica:Soluzioneperinfusione ValiditàProdottoIntegro:treannidalladatadifabbricazione Composizione:ognisaccacontiene: PrincipioAttivo:fluconazolo400mg Eccipienti:sodiocloruro1,8g;acquaperpreparazioniiniettabili200mlProduttoredelprincipio attivo: Aurobindo Pharma Limited, Unit VIII, Survey n. 13, I.D.A. Kazipally Medak District, JinnaramMandal,GaddapotharamVillage,502319AndhraPradesh(India) Produttoredelprodottofinito:PanpharmaS.r.L.,ZonaIndustrialeValleUfita,83040Flumeri(AV), Italia(tuttelefasi) INDICAZIONITERAPEUTICHE: CRIPTOCOCCOSI: FLUCONAZOLO KEIRONPHARMA (fluconazolo) è indicato nella terapia delle infezionimicoticheprofondedovuteacryptococcusneoformans,inclusequellechesi verificanoinpazienticoncompromissionedelsistemaimmunitariosecondariaapatologie maligne o a sindrome da immunodeficienza acquisita o le micosi secondarie a chemioterapiaantineoplastica.ilfarmacopuòquindiessereutilizzatoneltrattamento dellameningitecriptococcicaenellaterapiadimantenimentoperlaprevenzionedelle recidive,nonchéneltrattamentodellacriptococcosicutaneaepolmonare. 2) CANDIDIASI SISTEMICHE: incluse candidemia e candidiasi disseminata ed altre forme invasive di infezioni da Candida tra cui: esofagite, endocardite, peritonite, infezioni polmonari,gastrointestinali,oculariegenitourinarie. Pazientiaffettidapatologiemalignericoveratipressounitàditerapiaintensivasottoposti aterapieimmunosoppressiveochemioterapiaantineoplasticaoincondizionichepossano predisporreadinfezionidacandida. 3) CANDIDIASI delle MUCOSE: candidiasi orofaringea (mughetto) ed esofagea, infezioni broncopolmonari noninvasive, candiduria, candidiasi mucocutanea e candidiasi orale atrofica cronica. Il farmaco è inoltre indicato nella prevenzione delle recidive della candidiasiorofaringeainpazientiaids. 27
6 4) CANDIDIASI GENITALE: candidiasi vaginali acute e ricorrenti; profilassi per ridurre l incidenzadellericadutedellacandidiasivaginale(3opiùepisodiinunanno). Balaniteda Candida. 5) PAZIENTIIMMUNOCOMPROMESSI:E indicatoinoltrenellaprevenzionedelleinfezioni micoticheneipazienticoncompromissionedelsistemaimmunitariosecondariaapatolo giemaligneoasindromedaimmunodeficienzaacquisita,onellaprevenzionedellemicosi secondarieachemioterapiaantineoplastica. 6) DERMATOMICOSI: tinea pedis, tinea cruris, tinea corporis, tinea capitis e pytiriasis versicoloreneltrattamentodellecandidiasicutanee.neltrattamentodelleinfezionidella pelleedellemembranemucose,l usodelprodottodeveesserelimitatosoloaqueicasidi particolareestensioneogravitàchenonabbianorispostoallaterapiatopicatradizionale. 7) MICOSIENDEMICHEPROFONDE:coccidioidomicosi,paracoccidioidomicosi,sporotricosied istoplasmosineipazientiimmunocompetenti. Usoneibambini FLUCONAZOLOKEIRONPHARMA(fluconazolo)nondeveessereusatoperlatineacapitis. CLASSIFICAZIONEAIFINIDELLARIMBORSABILITÀ Confezione:AICn "100mg/50mlsoluzioneperinfusione"1saccada50ml Classedirimborsabilità: H Prezzoexfactory(IVAesclusa): EURO6,09 Prezzoalpubblico(IVAinclusa): EURO10,06 Confezione:AICn "100mg/50mlsoluzioneperinfusione"5saccheda50ml Classedirimborsabilità: H Prezzoexfactory(IVAesclusa): EURO30,48 Prezzoalpubblico(IVAinclusa): EURO50,30 Confezione:AICn "100mg/50mlsoluzioneperinfusione"10saccheda50ml Classedirimborsabilità: 28
7 H Prezzoexfactory(IVAesclusa): EURO60,95 Prezzoalpubblico(IVAinclusa): EURO100,60 Confezione:AICn "100mg/50mlsoluzioneperinfusione"20saccheda50ml Classedirimborsabilità: H Prezzoexfactory(IVAesclusa): EURO110,03 Prezzoalpubblico(IVAinclusa): EURO181,59 Confezione:AICn "200mg/100mlsoluzioneperinfusione"1saccada100ml Classedirimborsabilità: H Prezzoexfactory(IVAesclusa): EURO11,04 Prezzoalpubblico(IVAinclusa): EURO18,22 Confezione:AICn "200mg/100mlsoluzioneperinfusione"5saccheda100ml Classedirimborsabilità: H Prezzoexfactory(IVAesclusa): EURO55,20 Prezzoalpubblico(IVAinclusa): EURO91,10 Confezione:AICn "200mg/100mlsoluzioneperinfusione"10saccheda100ml Classedirimborsabilità: H Prezzoexfactory(IVAesclusa): EURO110,40 Prezzoalpubblico(IVAinclusa): 29
8 EURO182,20 Confezione:AICn "200mg/100mlsoluzioneperinfusione"20saccheda100ml Classedirimborsabilità: H Prezzoexfactory(IVAesclusa): EURO199,34 Prezzoalpubblico(IVAinclusa): EURO328,99 Confezione:AICn "400mg/200mlsoluzioneperinfusione"1saccada200ml Classedirimborsabilità: H Prezzoexfactory(IVAesclusa): EURO22,28 Prezzoalpubblico(IVAinclusa): EURO36,77 Confezione:AICn "400mg/200mlsoluzioneperinfusione"5saccheda200ml Classedirimborsabilità: H Prezzoexfactory(IVAesclusa): EURO111,40 Prezzoalpubblico(IVAinclusa): EURO183,85 Confezione:AICn "400mg/200mlsoluzioneperinfusione"10saccheda200ml Classedirimborsabilità: H Prezzoexfactory(IVAesclusa): EURO222,79 Prezzoalpubblico(IVAinclusa): EURO367,70 Confezione:AICn "400mg/200mlsoluzioneperinfusione"20saccheda200ml Classedirimborsabilità: 30
9 H Prezzoexfactory(IVAesclusa): EURO402,08 Prezzoalpubblico(IVAinclusa): EURO663,60 CLASSIFICAZIONEAIFINIDELLAFORNITURA Confezione:AICn "100mg/50mlsoluzioneperinfusione"1saccada50mlOSP: Medicinale soggetto a prescrizione medica limitativa, utilizzabile esclusivamente in ambiente ospedaliero Confezione:AICn "100mg/50mlsoluzioneperinfusione"5saccheda50mlOSP: Medicinale soggetto a prescrizione medica limitativa, utilizzabile esclusivamente in ambiente ospedaliero Confezione:AICn "100mg/50mlsoluzioneperinfusione"10saccheda50mlOSP: Medicinale soggetto a prescrizione medica limitativa, utilizzabile esclusivamente in ambiente ospedaliero Confezione:AICn "100mg/50mlsoluzioneperinfusione"20saccheda50mlOSP: Medicinale soggetto a prescrizione medica limitativa, utilizzabile esclusivamente in ambiente ospedaliero Confezione:AICn "200mg/100mlsoluzioneperinfusione"1saccada100mlOSP: Medicinale soggetto a prescrizione medica limitativa, utilizzabile esclusivamente in ambiente ospedaliero Confezione:AICn "200mg/100mlsoluzioneperinfusione"5saccheda100ml OSP:Medicinalesoggettoaprescrizionemedicalimitativa,utilizzabileesclusivamenteinambiente ospedaliero Confezione:AICn "200mg/100mlsoluzioneperinfusione"10saccheda100ml OSP:Medicinalesoggettoaprescrizionemedicalimitativa,utilizzabileesclusivamenteinambiente ospedaliero 31
10 Confezione:AICn "200mg/100mlsoluzioneperinfusione"20saccheda100ml OSP:Medicinalesoggettoaprescrizionemedicalimitativa,utilizzabileesclusivamenteinambiente ospedaliero Confezione:AICn "400mg/200mlsoluzioneperinfusione"1saccada200mlOSP: Medicinale soggetto a prescrizione medica limitativa, utilizzabile esclusivamente in ambiente ospedaliero Confezione:AICn "400mg/200mlsoluzioneperinfusione"5saccheda200ml OSP:Medicinalesoggettoaprescrizionemedicalimitativa,utilizzabileesclusivamenteinambiente ospedaliero Confezione:AICn "400mg/200mlsoluzioneperinfusione"10saccheda200ml OSP:Medicinalesoggettoaprescrizionemedicalimitativa,utilizzabileesclusivamenteinambiente ospedaliero Confezione:AICn "400mg/200mlsoluzioneperinfusione"20saccheda200ml OSP:Medicinalesoggettoaprescrizionemedicalimitativa,utilizzabileesclusivamenteinambiente ospedaliero DECORRENZADIEFFICACIADELLADETERMINAZIONE:dalgiornosuccessivoaquellodellasua pubblicazionenellagazzettaufficialedellarepubblicaitaliana. 12A
Determinazioni relative alla commercializzazione di medicinali per uso umano.
 Supplemento ordinario alla Gazzetta Ufficiale n. 112 del 15 maggio 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Supplemento ordinario alla Gazzetta Ufficiale n. 112 del 15 maggio 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
MEDICINALE DOXORUBICINA ACTAVIS PTC. TITOLARE AIC: ACTAVIS Group PTC ehf Reykjavíkurvegi 76 78, 220 Hafnarfjörður Islanda.
 Autorizzazione all immissione in commercio del medicinale «Doxorubicina Actavis PTC» Estratto determinazione n. 294/2012 del 3 aprile 2012 MEDICINALE DOXORUBICINAACTAVISPTC TITOLAREAIC: ACTAVISGroupPTCehf
Autorizzazione all immissione in commercio del medicinale «Doxorubicina Actavis PTC» Estratto determinazione n. 294/2012 del 3 aprile 2012 MEDICINALE DOXORUBICINAACTAVISPTC TITOLAREAIC: ACTAVISGroupPTCehf
Determinazioni relative alla commercializzazione di taluni medicinali per uso umano.
 Supplemento ordinario alla Gazzetta Ufficiale n. 151 del 30 giugno 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Supplemento ordinario alla Gazzetta Ufficiale n. 151 del 30 giugno 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
ESTRATTI, SUNTI E COMUNICATI
 ESTRATTI, SUNTI E COMUNICATI AGENZIA ITALIANA DEL FARMACO Autorizzazione all immissione in commercio del medicinale «Bisoprololo Aurobindo Pharma Italia» Estratto determinazione n. 308/2012 del 6 aprile
ESTRATTI, SUNTI E COMUNICATI AGENZIA ITALIANA DEL FARMACO Autorizzazione all immissione in commercio del medicinale «Bisoprololo Aurobindo Pharma Italia» Estratto determinazione n. 308/2012 del 6 aprile
0,05 mg/ml soluzione iniettabile o concentrato per soluzione per infusione 20 flaconcini in vetro AIC n /M (in base 10) 17P2F6 (in base 32)
 Autorizzazione all immissione in commercio del medicinale «Octreotide Teva» Estratto determinazione n. 395/2012 del 24 maggio 2012 MEDICINALE OCTREOTIDETEVA TITOLAREAIC: TevaItaliaS.r.l. ViaMessina38 20154Milano
Autorizzazione all immissione in commercio del medicinale «Octreotide Teva» Estratto determinazione n. 395/2012 del 24 maggio 2012 MEDICINALE OCTREOTIDETEVA TITOLAREAIC: TevaItaliaS.r.l. ViaMessina38 20154Milano
TITOLARE AIC: QUALITEC EUROPA S.L., Paseo Pintor Rosales, 42, Madrid, Spagna.
 Autorizzazione all immissione in commercio del medicinale per uso umano «Lansoprazolo Qualitec» Estratto determinazione n. 571/2013 del 14 giugno 2013 MEDICINALE LANSOPRAZOLOQUALITEC TITOLAREAIC: QUALITECEUROPAS.L.,PaseoPintorRosales,42,28008Madrid,Spagna.
Autorizzazione all immissione in commercio del medicinale per uso umano «Lansoprazolo Qualitec» Estratto determinazione n. 571/2013 del 14 giugno 2013 MEDICINALE LANSOPRAZOLOQUALITEC TITOLAREAIC: QUALITECEUROPAS.L.,PaseoPintorRosales,42,28008Madrid,Spagna.
24 mg capsule rigide a rilascio prolungato 28 capsule in blister PVC/PE/PVDC/AL
 Autorizzazione all immissione in commercio del medicinale «Galantamina Mylan» Estratto determinazione n. 224/2012 del 5 marzo 2012 MEDICINALE GALANTAMINAMYLAN TITOLAREAIC: MylanS.p.A. ViaVittorPisani,20
Autorizzazione all immissione in commercio del medicinale «Galantamina Mylan» Estratto determinazione n. 224/2012 del 5 marzo 2012 MEDICINALE GALANTAMINAMYLAN TITOLAREAIC: MylanS.p.A. ViaVittorPisani,20
5 mg compresse orodispersibili 60 compresse in blister OPA/AL/PVC/PET/AL AIC n /M (in base 10) 17VJH5 (in base 32)
 Autorizzazione all immissione in commercio del medicinale «Yasnoro» Estratto determinazione n. 387/2012 del 24 maggio 2012 MEDICINALE YASNORO TITOLAREAIC: Krka,d.d.,NovoMesto Šmarješkacesta6 8501Novomesto
Autorizzazione all immissione in commercio del medicinale «Yasnoro» Estratto determinazione n. 387/2012 del 24 maggio 2012 MEDICINALE YASNORO TITOLAREAIC: Krka,d.d.,NovoMesto Šmarješkacesta6 8501Novomesto
MEDICINALE RIVASTIGMINA TEVA ITALIA. TITOLARE AIC: Teva Italia S.r.l. Via Messina, Milano. Confezione
 Autorizzazione all immissione in commercio del medicinale «Rivastigmina Teva Italia» Estratto determinazione n. 345/2012 del 18 aprile 2012 MEDICINALE RIVASTIGMINATEVAITALIA TITOLAREAIC: TevaItaliaS.r.l.
Autorizzazione all immissione in commercio del medicinale «Rivastigmina Teva Italia» Estratto determinazione n. 345/2012 del 18 aprile 2012 MEDICINALE RIVASTIGMINATEVAITALIA TITOLAREAIC: TevaItaliaS.r.l.
5 mg compresse rivestite con film 100 compresse in blister PVC/PE/PVDC/AL AIC n /M (in base 10) 17LU4U (in base 32)
 Autorizzazione all immissione in commercio del medicinale «Simvastatina Ratiopharm» Estratto determinazione n. 417/2012 del 5 giugno 2012 MEDICINALE SIMVASTATINARATIOPHARM TITOLAREAIC: TevaItaliaS.r.l.
Autorizzazione all immissione in commercio del medicinale «Simvastatina Ratiopharm» Estratto determinazione n. 417/2012 del 5 giugno 2012 MEDICINALE SIMVASTATINARATIOPHARM TITOLAREAIC: TevaItaliaS.r.l.
MEDICINALE CANDESARTAN E IDROCLOROTIAZIDE DOC Generici. AIC n /M (in base 10) 16N6P5 (in base 32)
 Autorizzazione all immissione in commercio del medicinale per uso umano «Candesartan e Idroclorotiazide Doc Generici» Estratto determinazione n. 427/2012 del 27 giugno 2012 MEDICINALE CANDESARTANEIDROCLOROTIAZIDEDOCGenerici
Autorizzazione all immissione in commercio del medicinale per uso umano «Candesartan e Idroclorotiazide Doc Generici» Estratto determinazione n. 427/2012 del 27 giugno 2012 MEDICINALE CANDESARTANEIDROCLOROTIAZIDEDOCGenerici
500 mg compresse rivestite con film 5 compresse in blister PVC/ACLAR/AL AIC n /M (in base 10) 17MYB6 (in base 32)
 Autorizzazione all immissione in commercio del medicinale «Levoß oxacina PÞ zer» Estratto determinazione n. 270/2012 del 28 marzo 2012 MEDICINALE LEVOFLOXACINAPFIZER TITOLAREAIC: PfizerItaliaS.r.l. ViaIsonzo,71
Autorizzazione all immissione in commercio del medicinale «Levoß oxacina PÞ zer» Estratto determinazione n. 270/2012 del 28 marzo 2012 MEDICINALE LEVOFLOXACINAPFIZER TITOLAREAIC: PfizerItaliaS.r.l. ViaIsonzo,71
MEDICINALE QUETIAPINA AHCL
 Autorizzazione all immissione in commercio del medicinale «Quetiapina AHCL» Estratto determinazione n. 344/2012 del 18 aprile 2012 MEDICINALE QUETIAPINAAHCL TITOLAREAIC: AccordHealthcareItaliaS.r.l. CentroDirezionaleColleoni
Autorizzazione all immissione in commercio del medicinale «Quetiapina AHCL» Estratto determinazione n. 344/2012 del 18 aprile 2012 MEDICINALE QUETIAPINAAHCL TITOLAREAIC: AccordHealthcareItaliaS.r.l. CentroDirezionaleColleoni
50 mg compresse rivestite con film 210 compresse in blister OPA/AL/PVC/AL
 Autorizzazione all immissione in commercio del medicinale per uso umano «Acido Ibandronico EG» Estratto determinazione n. 749/2012 del 19 dicembre 2012 MEDICINALE ACIDOIBANDRONICOEG TITOLAREAIC: EGS.P.A.
Autorizzazione all immissione in commercio del medicinale per uso umano «Acido Ibandronico EG» Estratto determinazione n. 749/2012 del 19 dicembre 2012 MEDICINALE ACIDOIBANDRONICOEG TITOLAREAIC: EGS.P.A.
MEDICINALE OMEGASTATIN. TITOLARE AIC: So.Se.PHARM S.r.l. Via dei Castelli Romani, Pomezia (Roma) Italia. Confezione
 Autorizzazione all immissione in commercio del medicinale «Omegastatin» Estratto determinazione n. 227/2012 del 5 marzo 2012 MEDICINALE OMEGASTATIN TITOLAREAIC: So.Se.PHARMS.r.l. ViadeiCastelliRomani,22
Autorizzazione all immissione in commercio del medicinale «Omegastatin» Estratto determinazione n. 227/2012 del 5 marzo 2012 MEDICINALE OMEGASTATIN TITOLAREAIC: So.Se.PHARMS.r.l. ViadeiCastelliRomani,22
5 mg compresse orodispersibili 7 compresse in blister OPA/AL/PVC/CARTA/PET/AL
 Autorizzazione all immissione in commercio del medicinale «Desloratadina Doc Generici» Estratto determinazione n. 404/2012 del 4 giugno 2012 MEDICINALE DESLORATADINADOCGenerici TITOLAREAIC: DOCGenericiSrl
Autorizzazione all immissione in commercio del medicinale «Desloratadina Doc Generici» Estratto determinazione n. 404/2012 del 4 giugno 2012 MEDICINALE DESLORATADINADOCGenerici TITOLAREAIC: DOCGenericiSrl
25 mg compresse rivestite con film 100 compresse in flacone HDPE
 Autorizzazione all immissione in commercio del medicinale «Quetiapina Zentiva» Estratto determinazione n. 277/2012 del 28 marzo 2012 MEDICINALE QUETIAPINAZENTIVA TITOLAREAIC: ZENTIVAITALIAS.R.L. VialeL.Bodio,37/b
Autorizzazione all immissione in commercio del medicinale «Quetiapina Zentiva» Estratto determinazione n. 277/2012 del 28 marzo 2012 MEDICINALE QUETIAPINAZENTIVA TITOLAREAIC: ZENTIVAITALIAS.R.L. VialeL.Bodio,37/b
MEDICINALE MONTELUKAST EG. TITOLARE AIC: EG S.p.A. Via D. Scarlatti, Milano. Confezione
 Autorizzazione all immissione in commercio del medicinale «Montelukast EG» Estratto determinazione n. 459/2012 del 13 luglio 2012 MEDICINALE MONTELUKASTEG TITOLAREAIC: EGS.p.A.ViaD.Scarlatti,31 20124Milano
Autorizzazione all immissione in commercio del medicinale «Montelukast EG» Estratto determinazione n. 459/2012 del 13 luglio 2012 MEDICINALE MONTELUKASTEG TITOLAREAIC: EGS.p.A.ViaD.Scarlatti,31 20124Milano
MEDICINALE PIOGLITAZONE EG. TITOLARE AIC: EG S.P.A. Via D. Scarlatti, MILANO. Confezione
 Autorizzazione all immissione in commercio del medicinale «Pioglitazone EG» Estratto determinazione n. 261/2012 MEDICINALE PIOGLITAZONEEG TITOLAREAIC: EGS.P.A. ViaD.Scarlatti,31 20124MILANO Confezione
Autorizzazione all immissione in commercio del medicinale «Pioglitazone EG» Estratto determinazione n. 261/2012 MEDICINALE PIOGLITAZONEEG TITOLAREAIC: EGS.P.A. ViaD.Scarlatti,31 20124MILANO Confezione
Allegato II. Conclusioni scientifiche e motivazioni della sospensione delle autorizzazioni all immissione in commercio
 Allegato II Conclusioni scientifiche e motivazioni della sospensione delle autorizzazioni all immissione in commercio 8 Conclusioni scientifiche Sintesi generale della valutazione scientifica di prodotti
Allegato II Conclusioni scientifiche e motivazioni della sospensione delle autorizzazioni all immissione in commercio 8 Conclusioni scientifiche Sintesi generale della valutazione scientifica di prodotti
20 mg compresse gastroresistenti 50 compresse in blister OPA/AL/PVC/AL
 Autorizzazione all immissione in commercio del medicinale «Espeyen» Estratto determinazione n. 326/2012 dell 11 aprile 2012 MEDICINALE ESPEYEN TITOLAREAIC: SpecifarS.A. 1,28Octovrioustr. Ag.Varvara12351
Autorizzazione all immissione in commercio del medicinale «Espeyen» Estratto determinazione n. 326/2012 dell 11 aprile 2012 MEDICINALE ESPEYEN TITOLAREAIC: SpecifarS.A. 1,28Octovrioustr. Ag.Varvara12351
MEDICINALE ESOMEPRAZOLO PENSA. TITOLARE AIC: Pensa Pharma S.p.a. Via Ippolito Rosellini, Milano Italia. Confezione
 Autorizzazione all immissione in commercio del medicinale per uso umano «Esomeprazolo Pensa» Estratto determinazione n. 430/2012 del 27 giugno 2012 MEDICINALE ESOMEPRAZOLOPENSA TITOLAREAIC: PensaPharmaS.p.a.
Autorizzazione all immissione in commercio del medicinale per uso umano «Esomeprazolo Pensa» Estratto determinazione n. 430/2012 del 27 giugno 2012 MEDICINALE ESOMEPRAZOLOPENSA TITOLAREAIC: PensaPharmaS.p.a.
Provvedimenti relativi a medicinali per uso umano.
 Supplemento ordinario alla Gazzetta Ufficiale n. 241 del 15 ottobre 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Supplemento ordinario alla Gazzetta Ufficiale n. 241 del 15 ottobre 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
MEDICINALE ATORVASTATINA EG. TITOLARE AIC: EG S.p.A. Via D. Scarlatti, Milano. Confezione
 Autorizzazione all immissione in commercio del medicinale «Atorvastatina EG» Estratto determinazione n. 219/2012 del 5 marzo 2012 MEDICINALE ATORVASTATINAEG TITOLAREAIC: EGS.p.A. ViaD.Scarlatti,31 20124Milano
Autorizzazione all immissione in commercio del medicinale «Atorvastatina EG» Estratto determinazione n. 219/2012 del 5 marzo 2012 MEDICINALE ATORVASTATINAEG TITOLAREAIC: EGS.p.A. ViaD.Scarlatti,31 20124Milano
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Fluconazolo GERMED 100 mg Capsule 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene 100 mg di fluconazolo. Per
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Fluconazolo GERMED 100 mg Capsule 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene 100 mg di fluconazolo. Per
5 mg compresse masticabili 28 compresse in blister ALU/PE HDPE/PE ed essiccante/alu/opa
 Autorizzazione all immissione in commercio del medicinale «Mintalos» Estratto determinazione n. 449/2012 del 13 luglio 2012 MEDICINALE MINTALOS TITOLAREAIC: FarmaceuticiCaberS.p.A. VialeCittàd Europa,681
Autorizzazione all immissione in commercio del medicinale «Mintalos» Estratto determinazione n. 449/2012 del 13 luglio 2012 MEDICINALE MINTALOS TITOLAREAIC: FarmaceuticiCaberS.p.A. VialeCittàd Europa,681
FLUCONAZOLO ZENTIVA 100 MG CAPSULE RIGIDE FLUCONAZOLO ZENTIVA 150 MG CAPSULE RIGIDE
 FARMACOVIGILANZA FLUCONAZOLO ZENTIVA 100 MG CAPSULE RIGIDE FLUCONAZOLO ZENTIVA 150 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
FARMACOVIGILANZA FLUCONAZOLO ZENTIVA 100 MG CAPSULE RIGIDE FLUCONAZOLO ZENTIVA 150 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono
Miceti di interesse medico
 ANTIMICOTICI Miceti di interesse medico Miceti lievitiformi o lieviti: Pityrosporum ovale, Candida albicans, Cryptococcus neoformans Miceti filamentosi o muffe: dermatofiti o cheratinofili (tinea corporis,
ANTIMICOTICI Miceti di interesse medico Miceti lievitiformi o lieviti: Pityrosporum ovale, Candida albicans, Cryptococcus neoformans Miceti filamentosi o muffe: dermatofiti o cheratinofili (tinea corporis,
ESTRATTI, SUNTI E COMUNICATI
 ESTRATTI, SUNTI E COMUNICATI AGENZIA ITALIANA DEL FARMACO Autorizzazione all immissione in commercio del medicinale per uso umano «Atorvastatina Actavis Group PTC» Estratto determinazione n. 439/2012 del
ESTRATTI, SUNTI E COMUNICATI AGENZIA ITALIANA DEL FARMACO Autorizzazione all immissione in commercio del medicinale per uso umano «Atorvastatina Actavis Group PTC» Estratto determinazione n. 439/2012 del
Determinazioni relative all immissione in commercio di taluni medicinali per uso umano.
 Supplemento ordinario alla Gazzetta Ufficiale n. 108 del 10 maggio 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Supplemento ordinario alla Gazzetta Ufficiale n. 108 del 10 maggio 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Confezione 250 mg compresse rivestite con film 6 compresse in blister PVC/PVDC-AL AIC n /M (in base 10) 178MXR (in base 32)
 Autorizzazione all immissione in commercio del medicinale «Ciproß oxacina PÞ zer» MEDICINALE CIPROFLOXACINA PFIZER TITOLARE AIC: Pfizer Italia S.r.l. Via Isonzo, 71 04100 Latina Estratto determinazione
Autorizzazione all immissione in commercio del medicinale «Ciproß oxacina PÞ zer» MEDICINALE CIPROFLOXACINA PFIZER TITOLARE AIC: Pfizer Italia S.r.l. Via Isonzo, 71 04100 Latina Estratto determinazione
BANCA D ITALIA LA BANCA D ITALIA
 Generico / Equivalente di nuova registrazione CASPOFUNGIN ACCORD Codice ATC - Principio attivo: J02AX04-caspofungin Titolare: Accord Healthcare Limited G.U.U.E. 1 aprile 2016 Indicazioni terapeutiche Trattamento
Generico / Equivalente di nuova registrazione CASPOFUNGIN ACCORD Codice ATC - Principio attivo: J02AX04-caspofungin Titolare: Accord Healthcare Limited G.U.U.E. 1 aprile 2016 Indicazioni terapeutiche Trattamento
Conclusioni scientifiche
 ALLEGATO II Conclusioni scientifiche e motivi della modifica del riassunto delle caratteristiche del prodotto, dell'etichettatura e del foglio illustrativo presentati dall'agenzia europea per i medicinali
ALLEGATO II Conclusioni scientifiche e motivi della modifica del riassunto delle caratteristiche del prodotto, dell'etichettatura e del foglio illustrativo presentati dall'agenzia europea per i medicinali
Provvedimenti relativi alla commercializzazione
 Supplemento ordinario alla Gazzetta Ufficiale n. 89 del 16 aprile 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Supplemento ordinario alla Gazzetta Ufficiale n. 89 del 16 aprile 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Capitolo 1 - Bambino viaggiatore...1 Consigli generali...1 Profilassi antimalarica...2 Vaccinazioni...4 Bibliografia essenziale...
 vii INDICE Capitolo 1 - Bambino viaggiatore...1 Consigli generali...1 Profilassi antimalarica...2 Vaccinazioni...4 Bibliografia essenziale...9 Capitolo 2 - Botulismo...11 Epidemiologia...11 Clinica...11
vii INDICE Capitolo 1 - Bambino viaggiatore...1 Consigli generali...1 Profilassi antimalarica...2 Vaccinazioni...4 Bibliografia essenziale...9 Capitolo 2 - Botulismo...11 Epidemiologia...11 Clinica...11
MEDICINALE ATORVASTATINA PENSA. TITOLARE AIC: Pensa Pharma S.p.A. Via Ippolito Rosellini, Milano Italia. Confezione
 Autorizzazione all immissione in commercio del medicinale «Atorvastatina Pensa» Estratto determinazione n. 373/2012 del 27 aprile 2012 MEDICINALE ATORVASTATINAPENSA TITOLAREAIC: PensaPharmaS.p.A. ViaIppolitoRosellini,12
Autorizzazione all immissione in commercio del medicinale «Atorvastatina Pensa» Estratto determinazione n. 373/2012 del 27 aprile 2012 MEDICINALE ATORVASTATINAPENSA TITOLAREAIC: PensaPharmaS.p.A. ViaIppolitoRosellini,12
Confezione 100 mg/50 ml soluzione per infusione 5 flaconi in PE da 50 ml AIC n /M (in base 10) 13PKHL (in base 32)
 Autorizzazione all immissione in commercio del medicinale «Ciproß oxacina Kabi» MEDICINALE CIPROFLOXACINA KABI TITOLARE AIC: Fresenius Kabi Italia S.r.l. Via Camagre, 41 I-37063 Isola della Scala (Verona)
Autorizzazione all immissione in commercio del medicinale «Ciproß oxacina Kabi» MEDICINALE CIPROFLOXACINA KABI TITOLARE AIC: Fresenius Kabi Italia S.r.l. Via Camagre, 41 I-37063 Isola della Scala (Verona)
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ELAZOR 100 mg/50 ml Soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ELAZOR 100 mg/50 ml soluzione per infusione:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ELAZOR 100 mg/50 ml Soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ELAZOR 100 mg/50 ml soluzione per infusione:
Confezione 5 mg compresse rivestite con film 14 compresse in blister PVC/PE/PVDC/AL AIC n /M (in base 10) 17GR7V (in base 32)
 ... 1-3-2012 Autorizzazione all immissione in commercio del medicinale «Risedronato PÞ zer» MEDICINALE RISEDRONATO PFIZER TITOLARE AIC: Pfizer Italia S.r.l. Via Isonzo, 71 04100 Latina Estratto determinazione
... 1-3-2012 Autorizzazione all immissione in commercio del medicinale «Risedronato PÞ zer» MEDICINALE RISEDRONATO PFIZER TITOLARE AIC: Pfizer Italia S.r.l. Via Isonzo, 71 04100 Latina Estratto determinazione
MEDICINALE OTELUS. TITOLARE AIC: Specifar S.A. 1, 28 Octovriou str., Ag. Varvara Atene Grecia. Confezione
 Autorizzazione all immissione in commercio del medicinale «Otelus» Estratto determinazione n. 474/2012 del 13 luglio 2012 MEDICINALE OTELUS TITOLAREAIC: SpecifarS.A. 1,28Octovrioustr.,Ag.Varvara 12351Atene
Autorizzazione all immissione in commercio del medicinale «Otelus» Estratto determinazione n. 474/2012 del 13 luglio 2012 MEDICINALE OTELUS TITOLAREAIC: SpecifarS.A. 1,28Octovrioustr.,Ag.Varvara 12351Atene
Autorizzazione all immissione in commercio del medicinale per uso umano «Atorvastatina Mylan Italia»
 Autorizzazione all immissione in commercio del medicinale per uso umano «Atorvastatina Mylan Italia» Estratto determinazione n. 751/2012 del 19 dicembre 2012 MEDICINALE ATORVASTATINAMYLANITALIA TITOLAREAIC:
Autorizzazione all immissione in commercio del medicinale per uso umano «Atorvastatina Mylan Italia» Estratto determinazione n. 751/2012 del 19 dicembre 2012 MEDICINALE ATORVASTATINAMYLANITALIA TITOLAREAIC:
Confezione 20 mg capsule rigide gastroresistenti 7 capsule in blister OPA/AL/PVC-AL AIC n /M (in base 10) 16PKLB (in base 32)
 Autorizzazione all immissione in commercio del medicinale «Esomeprazolo Mylan» MEDICINALE ESOMEPRAZOLO MYLAN Estratto determinazione n. 2613/2011 TITOLARE AIC: MYLAN S.P.A. Via Vittor Pisani, 20 20124
Autorizzazione all immissione in commercio del medicinale «Esomeprazolo Mylan» MEDICINALE ESOMEPRAZOLO MYLAN Estratto determinazione n. 2613/2011 TITOLARE AIC: MYLAN S.P.A. Via Vittor Pisani, 20 20124
Provvedimenti relativi alla commercializzazione
 Supplemento ordinario alla Gazzetta Ufficiale n. 250 del 25 ottobre 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Supplemento ordinario alla Gazzetta Ufficiale n. 250 del 25 ottobre 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 1. DENOMINAZIONE DEL MEDICINALE ZEFLUGYN 50 mg capsule rigide ZEFLUGYN 100 mg capsule rigide ZEFLUGYN 150 mg capsule rigide ZEFLUGYN 200 mg capsule rigide RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2.
1. DENOMINAZIONE DEL MEDICINALE ZEFLUGYN 50 mg capsule rigide ZEFLUGYN 100 mg capsule rigide ZEFLUGYN 150 mg capsule rigide ZEFLUGYN 200 mg capsule rigide RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 2.
Foglio illustrativo: informazioni per il paziente
 Foglio illustrativo: informazioni per il paziente ELAZOR 50 mg capsule rigide ELAZOR 100 mg capsule rigide ELAZOR 150 mg capsule rigide ELAZOR 200 mg capsule rigide fluconazolo Legga attentamente questo
Foglio illustrativo: informazioni per il paziente ELAZOR 50 mg capsule rigide ELAZOR 100 mg capsule rigide ELAZOR 150 mg capsule rigide ELAZOR 200 mg capsule rigide fluconazolo Legga attentamente questo
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Diflucan 10 mg/ml polvere per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di sospensione ricostituita
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Diflucan 10 mg/ml polvere per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di sospensione ricostituita
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE FLUCONAZOLO ABC 100 mg capsule rigide FLUCONAZOLO ABC 150 mg capsule rigide FLUCONAZOLO ABC 200 mg capsule rigide 2. COMPOSIZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE FLUCONAZOLO ABC 100 mg capsule rigide FLUCONAZOLO ABC 150 mg capsule rigide FLUCONAZOLO ABC 200 mg capsule rigide 2. COMPOSIZIONE
FLUCONAZOLO DOC Generici è indicato nei neonati a termine, lattanti, infanti, bambini e adolescenti da 0 a 17 anni:
 1. DENOMINAZIONE DEL MEDICINALE FLUCONAZOLO DOC Generici 100 mg capsule rigide. FLUCONAZOLO DOC Generici 150 mg capsule rigide. FLUCONAZOLO DOC Generici 200 mg capsule rigide. 2. COMPOSIZIONE QUALITATIVA
1. DENOMINAZIONE DEL MEDICINALE FLUCONAZOLO DOC Generici 100 mg capsule rigide. FLUCONAZOLO DOC Generici 150 mg capsule rigide. FLUCONAZOLO DOC Generici 200 mg capsule rigide. 2. COMPOSIZIONE QUALITATIVA
Titolare dell autorizzazione all immissione in commercio nome, indirizzo Pfizer Corporation Austria Ges.m.b.H. Floridsdorfer Hauptstrasse 1 1210 Wien
 ALLEGATO I ELENCO DEI NOMI DEI MEDICINALI, DELLE FORME FARMACEUTICHE, DEI DOSAGGI, DELLE VIE DI SOMMINISTRAZIONE, DEI TITOLARI DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO NEGLI STATI MEMBRI Stato membro
ALLEGATO I ELENCO DEI NOMI DEI MEDICINALI, DELLE FORME FARMACEUTICHE, DEI DOSAGGI, DELLE VIE DI SOMMINISTRAZIONE, DEI TITOLARI DELL AUTORIZZAZIONE ALL IMMISSIONE IN COMMERCIO NEGLI STATI MEMBRI Stato membro
2 50 GBQ generatore di radionuclidi 1 generatore da 10 GBQ con 10 flaconcini in vetro per
 Autorizzazione all immissione in commercio del medicinale «Tekcis» Estratto determinazione n. 412/2012 del 4 giugno 2012 MEDICINALE TEKCIS TITOLAREAIC: CISbioS.p.A. PiazzadellaRepubblica,5 I20121Milano
Autorizzazione all immissione in commercio del medicinale «Tekcis» Estratto determinazione n. 412/2012 del 4 giugno 2012 MEDICINALE TEKCIS TITOLAREAIC: CISbioS.p.A. PiazzadellaRepubblica,5 I20121Milano
Confezione 500 mg compresse rivestite con film 4 compresse in blister ACLAR 3000/AL AIC n /M (in base 10) 163GH2 (in base 32)
 Autorizzazione all immissione in commercio del medicinale «Valaciclovir Arrow» Estratto determinazione n. 2049/2011 del 2 febbraio 2011 MEDICINALE VALACICLOVIR ARROW TITOLARE AIC: Arrow Generics Limited
Autorizzazione all immissione in commercio del medicinale «Valaciclovir Arrow» Estratto determinazione n. 2049/2011 del 2 febbraio 2011 MEDICINALE VALACICLOVIR ARROW TITOLARE AIC: Arrow Generics Limited
Confezione 500 mg compresse rivestite con film 20 compresse in blister PVC/PVDC/AL AIC n /M (in base 10) 1586F0(in base 32)
 Autorizzazione all immissione in commercio del medicinale per uso umano «Metformina Doc» MEDICINALE METFORMINA DOC Estratto determinazione n. 1297 del 3 luglio 2009 TITOLARE AIC: DOC Generici S.r.l. Via
Autorizzazione all immissione in commercio del medicinale per uso umano «Metformina Doc» MEDICINALE METFORMINA DOC Estratto determinazione n. 1297 del 3 luglio 2009 TITOLARE AIC: DOC Generici S.r.l. Via
MEDICINALE ARKAS. TITOLARE AIC: CRINOS S.P.A. Via Pavia, Milano. Confezione
 Autorizzazione all immissione in commercio del medicinale «Arkas» Estratto determinazione n. 218/2012 del 5 marzo 2012 MEDICINALE ARKAS TITOLAREAIC: CRINOSS.P.A. ViaPavia,6 20136Milano Confezione 10mgcompresserivestiteconfilm
Autorizzazione all immissione in commercio del medicinale «Arkas» Estratto determinazione n. 218/2012 del 5 marzo 2012 MEDICINALE ARKAS TITOLAREAIC: CRINOSS.P.A. ViaPavia,6 20136Milano Confezione 10mgcompresserivestiteconfilm
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Diflucan 50 mg capsule rigide Diflucan 100 mg capsule rigide Diflucan 150 mg capsule rigide Diflucan 200 mg capsule rigide 2.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Diflucan 50 mg capsule rigide Diflucan 100 mg capsule rigide Diflucan 150 mg capsule rigide Diflucan 200 mg capsule rigide 2.
FOGLIO ILLUSTRATIVO. Controindicazioni Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti.
 EFFIK ITALIA S.p.A. FOGLIO ILLUSTRATIVO LORENIL 2% crema Fenticonazolo nitrato Categoria farmacoterapeutica Antimicotico per uso topico. Indicazioni terapeutiche - Dermatomicosi da dermatofiti (Trichophyton,
EFFIK ITALIA S.p.A. FOGLIO ILLUSTRATIVO LORENIL 2% crema Fenticonazolo nitrato Categoria farmacoterapeutica Antimicotico per uso topico. Indicazioni terapeutiche - Dermatomicosi da dermatofiti (Trichophyton,
Foglio illustrativo: informazioni per il paziente. Falvin 2% crema Falvin 2% spray cutaneo, soluzione. fenticonazolo nitrato
 Foglio illustrativo: informazioni per il paziente Falvin 2% crema Falvin 2% spray cutaneo, soluzione fenticonazolo nitrato Legga attentamente questo foglio prima di usare questo medicinale perchè contiene
Foglio illustrativo: informazioni per il paziente Falvin 2% crema Falvin 2% spray cutaneo, soluzione fenticonazolo nitrato Legga attentamente questo foglio prima di usare questo medicinale perchè contiene
DETERMINAZIONE 24 novembre Regime di rimborsabilità e prezzo di vendita del medicinale per uso umano «Zarzio». (Determinazione /C320/2009).
 DETERMINAZIONE 24 novembre 2009. Regime di rimborsabilità e prezzo di vendita del medicinale per uso umano «Zarzio». (Determinazione /C320/2009). Regime di rimborsabilità e prezzo di vendita della specialità
DETERMINAZIONE 24 novembre 2009. Regime di rimborsabilità e prezzo di vendita del medicinale per uso umano «Zarzio». (Determinazione /C320/2009). Regime di rimborsabilità e prezzo di vendita della specialità
Autorizzazione all immissione in commercio di taluni medicinali per uso umano.
 Supplemento ordinario alla Gazzetta Ufficiale n. 75 del 29 marzo 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale -
Supplemento ordinario alla Gazzetta Ufficiale n. 75 del 29 marzo 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale -
Provvedimenti relativi a taluni medicinali per uso umano
 Supplemento ordinario alla Gazzetta Ufficiale n. 205 del 3 settembre 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Supplemento ordinario alla Gazzetta Ufficiale n. 205 del 3 settembre 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Confezione 10 mg compresse rivestite con film 10 compresse in blister PVC/PE/PVDC/AL AIC n /M (in base 10) 15GCPG (in base 32)
 Autorizzazione all immissione in commercio del medicinale per uso umano «Simvastatina BlueÞ sh» MEDICINALE SIMVASTATINA BLUEFISH Estratto determinazione n. 1517 del 29 dicembre 2009 TITOLARE AIC: Bluefish
Autorizzazione all immissione in commercio del medicinale per uso umano «Simvastatina BlueÞ sh» MEDICINALE SIMVASTATINA BLUEFISH Estratto determinazione n. 1517 del 29 dicembre 2009 TITOLARE AIC: Bluefish
Confezione 5 mg/ml soluzione per infusione 1 flaconcino in vetro da 50 ml AIC n /M (in base 10) 15T2G2 (in base 32)
 Autorizzazione all immissione in commercio del medicinale «Levoß oxacina ospira» MEDICINALE LEVOFLOXACINA OSPIRA TITOLARE AIC: ospira Italia S.r.l. Via Orazio, 20/22 Napoli Estratto determinazione n. 2571/2011
Autorizzazione all immissione in commercio del medicinale «Levoß oxacina ospira» MEDICINALE LEVOFLOXACINA OSPIRA TITOLARE AIC: ospira Italia S.r.l. Via Orazio, 20/22 Napoli Estratto determinazione n. 2571/2011
superficiali, sistemiche, sottocutanee cellulare, sulla parete cellulare, sul metabolismo fungino
 FARMACI ANTIFUNGINI FARMACI ANTIMICOTICI Classificati in: ØFarmaci che agiscono su micosi superficiali, sistemiche, sottocutanee ØFarmaci che agiscono su Candida, Aspergillus, ecc. ØFarmaci che agiscono
FARMACI ANTIFUNGINI FARMACI ANTIMICOTICI Classificati in: ØFarmaci che agiscono su micosi superficiali, sistemiche, sottocutanee ØFarmaci che agiscono su Candida, Aspergillus, ecc. ØFarmaci che agiscono
FLUCONAZOLO DOC Generici è indicato nei neonati a termine, lattanti, infanti, bambini e adolescenti da 0 a 17 anni:
 1. DENOMINAZIONE DEL MEDICINALE FLUCONAZOLO DOC Generici 100 mg capsule rigide. FLUCONAZOLO DOC Generici 150 mg capsule rigide. FLUCONAZOLO DOC Generici 200 mg capsule rigide. 2. COMPOSIZIONE QUALITATIVA
1. DENOMINAZIONE DEL MEDICINALE FLUCONAZOLO DOC Generici 100 mg capsule rigide. FLUCONAZOLO DOC Generici 150 mg capsule rigide. FLUCONAZOLO DOC Generici 200 mg capsule rigide. 2. COMPOSIZIONE QUALITATIVA
Consumi di antifungini e orientamenti prescrittivi nella realtà locale
 Hospital Meeting Infezioni invasive da Candida: attuali aspetti epidemiologici e nuove opzioni terapeutiche Consumi di antifungini e orientamenti prescrittivi nella realtà locale Dott.ssa Rossella Carletti
Hospital Meeting Infezioni invasive da Candida: attuali aspetti epidemiologici e nuove opzioni terapeutiche Consumi di antifungini e orientamenti prescrittivi nella realtà locale Dott.ssa Rossella Carletti
ANIDULAFUNGINA ( )
 ANIDULAFUNGINA (16-12-2008) Specialità: Ecalta (Pfizer Italia srl) Forma farmaceutica: FL 30 ML 100MG - Prezzo: euro 594 ATC: J02AX06 Categoria terapeutica: Altri antimicotici per uso sistemico Fascia
ANIDULAFUNGINA (16-12-2008) Specialità: Ecalta (Pfizer Italia srl) Forma farmaceutica: FL 30 ML 100MG - Prezzo: euro 594 ATC: J02AX06 Categoria terapeutica: Altri antimicotici per uso sistemico Fascia
Introduzione. Le micosi sono quasi sempre determinate da disturbi non fungini. Infatti, le micosi sono agevolate dall abbattimento delle barriere
 Introduzione Le micosi sono quasi sempre determinate da disturbi non fungini preesistenti: una condizione predisponente che in qualche modo disattiva uno o più meccanismi di difesa dell ospite. Infatti,
Introduzione Le micosi sono quasi sempre determinate da disturbi non fungini preesistenti: una condizione predisponente che in qualche modo disattiva uno o più meccanismi di difesa dell ospite. Infatti,
Supplemento ordinario n. 210 alla GAZZETTA UFFICIALE Serie generale - n. 202
 DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Ribavirina Teva Pharma BV» - autorizzata con procedura centralizzata europea dalla Commissione Europea. (Determinazione/C
DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Ribavirina Teva Pharma BV» - autorizzata con procedura centralizzata europea dalla Commissione Europea. (Determinazione/C
TITOLARE AIC: DI RENZO S.r.L. con sede legale e domicilio fiscale in Viale Manzoni, 59, Roma (RM) Italia, Codice Fiscale
 Autorizzazione all immissione in commercio del medicinale per uso umano «Risperidone Di Renzo» Estratto determinazione AIC/N n. 1498 del 26 giugno 2009 E' autorizzata l'immissione in commercio del medicinale:risperidone
Autorizzazione all immissione in commercio del medicinale per uso umano «Risperidone Di Renzo» Estratto determinazione AIC/N n. 1498 del 26 giugno 2009 E' autorizzata l'immissione in commercio del medicinale:risperidone
Foglio illustrativo: informazioni per il paziente. ELAZOR 100 mg/50 ml soluzione per infusione. fluconazolo
 Foglio illustrativo: informazioni per il paziente ELAZOR 100 mg/50 ml soluzione per infusione fluconazolo Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
Foglio illustrativo: informazioni per il paziente ELAZOR 100 mg/50 ml soluzione per infusione fluconazolo Legga attentamente questo foglio prima di prendere questo medicinale perché contiene importanti
IL DIRETTORE GENERALE. VISTI gli articoli 8 e 9 del decreto legislativo 30 luglio 1999, n. 300;
 DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Temozolomide Teva» (temozolomide) - autorizzata con procedura centralizzata europea dalla Commissione Europea.
DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Temozolomide Teva» (temozolomide) - autorizzata con procedura centralizzata europea dalla Commissione Europea.
Provvedimenti relativi a taluni medicinali per uso umano.
 Supplemento ordinario alla Gazzetta Ufficiale n. 100 del 30 aprile 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Supplemento ordinario alla Gazzetta Ufficiale n. 100 del 30 aprile 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Ebymect deve essere assunto due volte al giorno ai pasti, per ridurre le reazioni avverse gastrointestinali associate alla metformina.
 A LLEGATO Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominata Classe C (nn)) dedicata ai farmaci non ancora valutati ai fini della rimborsabilità nelle
A LLEGATO Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominata Classe C (nn)) dedicata ai farmaci non ancora valutati ai fini della rimborsabilità nelle
Confezione 5 mg compresse orodispersibili 1 compressa in blister OPA/ALU/PVC-AL AIC n /M (in base 10) 16JHH1 (in base 32)
 Autorizzazione all immissione in commercio del medicinale «Donepezil Teva Italia» Estratto determinazione n. 144/2012 del 26 gennaio 2012 MEDICINALE DONEPEZIL TEVA ITALIA TITOLARE AIC: Teva Italia S.r.l.
Autorizzazione all immissione in commercio del medicinale «Donepezil Teva Italia» Estratto determinazione n. 144/2012 del 26 gennaio 2012 MEDICINALE DONEPEZIL TEVA ITALIA TITOLARE AIC: Teva Italia S.r.l.
Update in Endocrinologia Clinica
 12 Congresso Nazionale AME Associazione Medici Endocrinologi Update in Endocrinologia Clinica 6th Joint Meeting with AACE Refreshment in Medicina Interna: Terapia antibiotica nel 2013 American Association
12 Congresso Nazionale AME Associazione Medici Endocrinologi Update in Endocrinologia Clinica 6th Joint Meeting with AACE Refreshment in Medicina Interna: Terapia antibiotica nel 2013 American Association
Titolare A.I.C.: HOSPIRA UK LTD Queensway Royal Leamington Spa Warwickshire CV31 RW Regno Unito
 DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Temozolomide ospira» (temozolomide) - autorizzata con procedura centralizzata europea dalla Commissione Europea.
DETERMINAZIONE 4 agosto 2010. Regime di rimborsabilità e prezzo di vendita del medicinale «Temozolomide ospira» (temozolomide) - autorizzata con procedura centralizzata europea dalla Commissione Europea.
Foglio illustrativo: informazioni per il paziente. Lomexin 2% shampoo. fenticonazolo nitrato
 Foglio illustrativo: informazioni per il paziente Lomexin 2% shampoo fenticonazolo nitrato Legga attentamente questo foglio prima di usare questo medicinale perchè contiene importanti informazioni per
Foglio illustrativo: informazioni per il paziente Lomexin 2% shampoo fenticonazolo nitrato Legga attentamente questo foglio prima di usare questo medicinale perchè contiene importanti informazioni per
Codice ATC - Principio Attivo: R03AL04 - indacaterol / glycopyrronium bromide Titolare: NOVARTIS EUROPHARM LTD GUUE 26/02/2016
 A LLEGATO Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominata Classe C (nn)) dedicata ai farmaci non ancora valutati ai fini della rimborsabilità nelle
A LLEGATO Inserimento, in accordo all articolo 12, comma 5 della Legge 189/2012, in apposita sezione (denominata Classe C (nn)) dedicata ai farmaci non ancora valutati ai fini della rimborsabilità nelle
Obiettivo della terapia è guarire l infezione in atto in collaborazione col sistema immunocompetente.
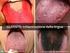 La profilassi non è una terapia Anna Maria Marata La profilassi non è una terapia Obiettivo della terapia è guarire l infezione in atto in collaborazione col sistema immunocompetente. Obiettivo della profilassi
La profilassi non è una terapia Anna Maria Marata La profilassi non è una terapia Obiettivo della terapia è guarire l infezione in atto in collaborazione col sistema immunocompetente. Obiettivo della profilassi
COSA C È DI NUOVO NEL TERRITORIO NUOVI PRINCIPI ATTIVI
 COSA C È DI NUOVO NEL TERRITORIO NUOVI PRINCIPI ATTIVI TORASEMIDE (Diuretici ad azione diuretica maggiore - C03CA04) Diuremid (LABORATORI GUIDOTTI) Diuresix (MENARINI) Toradiur (ROCHE) 10 mg 14 cpr divisibili
COSA C È DI NUOVO NEL TERRITORIO NUOVI PRINCIPI ATTIVI TORASEMIDE (Diuretici ad azione diuretica maggiore - C03CA04) Diuremid (LABORATORI GUIDOTTI) Diuresix (MENARINI) Toradiur (ROCHE) 10 mg 14 cpr divisibili
Estratto determinazione n del 18 dicembre 2009
 Autorizzazione all immissione in commercio del medicinale «Ossigeno Gas Tecnici Foligno» Estratto determinazione n. 2875 del 18 dicembre 2009 DESRIZIONE DEL MEDIINALE E ATTRIBUZIONE N. AI E' autorizzata
Autorizzazione all immissione in commercio del medicinale «Ossigeno Gas Tecnici Foligno» Estratto determinazione n. 2875 del 18 dicembre 2009 DESRIZIONE DEL MEDIINALE E ATTRIBUZIONE N. AI E' autorizzata
7,5 mg/ml soluzione iniettabile 10 flaconcini in PP da 10 ml AIC n /M (in base 10) 16B2FZ (in base 32)
 Autorizzazione all immissione in commercio del medicinale «Ropivacaina Ibigen» Estratto determinazione n. 416/2012 del 5 giugno 2012 MEDICINALE ROPIVACAINAIBIGEN TITOLAREAIC: IBIGENS.r.l. ViaFossignano,2
Autorizzazione all immissione in commercio del medicinale «Ropivacaina Ibigen» Estratto determinazione n. 416/2012 del 5 giugno 2012 MEDICINALE ROPIVACAINAIBIGEN TITOLAREAIC: IBIGENS.r.l. ViaFossignano,2
Provvedimenti relativi a taluni medicinali
 Supplemento ordinario alla Gazzetta Ufficiale n. 107 del 9 maggio 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Supplemento ordinario alla Gazzetta Ufficiale n. 107 del 9 maggio 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Autorizzazione all immissione in commercio di medicinali per uso umano.
 Supplemento ordinario alla Gazzetta Ufficiale n. 130 del 6 giugno 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
Supplemento ordinario alla Gazzetta Ufficiale n. 130 del 6 giugno 2012 - Serie generale Spediz. abb. post. 45% - art. - 1, art. comma 2, comma 1 20/b Legge 27-02-2004, 23-12-1996, n. n. 46-662 Filiale
5.3 Epidemiologia della Sindrome da Immunodeficienza Acquisita (AIDS) e dell infezione da HIV
 5.3 Epidemiologia della Sindrome da Immunodeficienza Acquisita (AIDS) e dell infezione da HIV 5.3.1 Epidemiologia della Sindrome da Immunodeficienza Acquisita (AIDS) Nel 1982 in Italia è stata avviata
5.3 Epidemiologia della Sindrome da Immunodeficienza Acquisita (AIDS) e dell infezione da HIV 5.3.1 Epidemiologia della Sindrome da Immunodeficienza Acquisita (AIDS) Nel 1982 in Italia è stata avviata
Confezione 20 mg compresse gastro-resistenti 7 compresse in blister ALU/ALU AIC n /M (in base 10) 156NMC (in base 32)
 MEDICINALE PANTOPRAZOLO RANBAXY TITOLARE AIC: Ranbaxy Italia S.p.A. Piazza Filippo Meda, 3 20121 Milano Italia Autorizzazione all immissione in commercio del medicinale per uso umano «Pantoprazolo Ranbaxy»
MEDICINALE PANTOPRAZOLO RANBAXY TITOLARE AIC: Ranbaxy Italia S.p.A. Piazza Filippo Meda, 3 20121 Milano Italia Autorizzazione all immissione in commercio del medicinale per uso umano «Pantoprazolo Ranbaxy»
AGENZIA ITALIANA DEL FARMACO COMUNICATO. Autorizzazione all'immissione in commercio del medicinale per uso. umano «Pioglitazone Mylan».
 AGENZIA ITALIANA DEL FARMACO COMUNICATO Autorizzazione all'immissione in commercio del medicinale per uso umano «Pioglitazone Mylan». (14A01049) (GU n.43 del 21-2-2014 - Suppl. Ordinario n. 15) Estratto
AGENZIA ITALIANA DEL FARMACO COMUNICATO Autorizzazione all'immissione in commercio del medicinale per uso umano «Pioglitazone Mylan». (14A01049) (GU n.43 del 21-2-2014 - Suppl. Ordinario n. 15) Estratto
Via endovenosa di somministrazione. Febbre e brividi alla prima infusione. Molecola polienica con 7 doppi legami nell anello macrocitico
 AMFOTERICINA B Molecola Farmacodinamica Farmacocinetica Indicazioni cliniche Interazioni Reazioni avverse Attività fungicida su C. albicans e non albicans, C. neoformans, Aspergillus e miceti dimorifi.
AMFOTERICINA B Molecola Farmacodinamica Farmacocinetica Indicazioni cliniche Interazioni Reazioni avverse Attività fungicida su C. albicans e non albicans, C. neoformans, Aspergillus e miceti dimorifi.
Confezioni autorizzate: EU/1/15/1025/001 AIC: /E In base 32: 1B8HB2 300 MG/150 MG COMPRESSA RIVESTITA CON FILM USO ORALE FLACONE (HDPE) 90
 Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione (denominataclassec(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilità nellemoredellapresentazionedapartedell
Inserimento,inaccordoall articolo12,comma5dellalegge189/2012,inappositasezione (denominataclassec(nn))dedicataaifarmacinonancoravalutatiaifinidellarimborsabilità nellemoredellapresentazionedapartedell
Provvedimenti concernenti taluni medicinali per uso umano
 Supplemento ordinario alla Gazzetta Ufficiale n. 166 del 20 luglio 2009 - Serie generale Spediz. abb. post. 45% - art. 2, comma 20/b Legge 23-12-1996, n. 662 - Filiale di Roma GAZZETTA UFFICIALE PA RTE
Supplemento ordinario alla Gazzetta Ufficiale n. 166 del 20 luglio 2009 - Serie generale Spediz. abb. post. 45% - art. 2, comma 20/b Legge 23-12-1996, n. 662 - Filiale di Roma GAZZETTA UFFICIALE PA RTE
FUNGHI O MICETI (oggetto di studio della micologia) Scanning electron micrograph of the asexual reproductive apparatus of Aspergillus niger
 FUNGHI O MICETI (oggetto di studio della micologia) Scanning electron micrograph of the asexual reproductive apparatus of Aspergillus niger 1) STRUTTURA DEI FUNGHI Circa 70.000 specie di cui circa 300
FUNGHI O MICETI (oggetto di studio della micologia) Scanning electron micrograph of the asexual reproductive apparatus of Aspergillus niger 1) STRUTTURA DEI FUNGHI Circa 70.000 specie di cui circa 300
Ringraziamenti e dedica pag. 3. Di cosa parla il testo pag. 5. Premessa generale pag. 9. Capitolo 1: L antibiotico-resistenza pag.
 Argomenti di Terapia Batterica Indice Ringraziamenti e dedica pag. 3 Di cosa parla il testo pag. 5 Premessa generale pag. 9 Capitolo 1: L antibiotico-resistenza pag. 23 - Biologia e farmacologia dell antibiotico-resistenza
Argomenti di Terapia Batterica Indice Ringraziamenti e dedica pag. 3 Di cosa parla il testo pag. 5 Premessa generale pag. 9 Capitolo 1: L antibiotico-resistenza pag. 23 - Biologia e farmacologia dell antibiotico-resistenza
Consiglio Regionale della Puglia
 LEGGE REGIONALE 12 FEBBRAIO 2014, N. 2 Modalita di erogazione dei farmaci e dei preparati galenici magistrali a base di cannabinoidi per finalita terapeutiche 2 LEGGE REGIONALE Modalita di erogazione dei
LEGGE REGIONALE 12 FEBBRAIO 2014, N. 2 Modalita di erogazione dei farmaci e dei preparati galenici magistrali a base di cannabinoidi per finalita terapeutiche 2 LEGGE REGIONALE Modalita di erogazione dei
Miceti. ! Eucarioti. ! Differenziati da animali e piante per : 1. Parete rigida di glucano e chitina
 MICETI o Funghi ! Eucarioti Miceti! Differenziati da animali e piante per : 1. Parete rigida di glucano e chitina 2. Nutrizione: chemiotrofi (privi di clorofilla) secrezione enzimi " degradazione substrato
MICETI o Funghi ! Eucarioti Miceti! Differenziati da animali e piante per : 1. Parete rigida di glucano e chitina 2. Nutrizione: chemiotrofi (privi di clorofilla) secrezione enzimi " degradazione substrato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Diflucan 2 mg/ml soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene 2 mg di fluconazolo. 1
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Diflucan 2 mg/ml soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene 2 mg di fluconazolo. 1
Autorizzazione all immissione in commercio del medicinale «Levoß oxacina Bioindustria L.I.M.»
 Autorizzazione all immissione in commercio del medicinale «Levoß oxacina Bioindustria L.I.M.» Estratto determinazione V&A.N n. 1203 del 4 ottobre 2011 DESCRIZIONE DEL MEDICINALE E ATTRIBUZIONE N. AIC E'
Autorizzazione all immissione in commercio del medicinale «Levoß oxacina Bioindustria L.I.M.» Estratto determinazione V&A.N n. 1203 del 4 ottobre 2011 DESCRIZIONE DEL MEDICINALE E ATTRIBUZIONE N. AIC E'
Candidemie in Medicina Interna Massimo Giusti
 Candidemie in Medicina Interna Massimo Giusti - Epidemiologia (1) - Sepsi in U.S.A. 1979-2000 Incremento del 200% negli ultimi 30 anni Candida spp in Europa tra i dieci patogeni più isolati 1 - The epidemiology
Candidemie in Medicina Interna Massimo Giusti - Epidemiologia (1) - Sepsi in U.S.A. 1979-2000 Incremento del 200% negli ultimi 30 anni Candida spp in Europa tra i dieci patogeni più isolati 1 - The epidemiology
Autorizzazione all'immissione in commercio del medicinale per uso umano «Pioglitazone Aurobindo».
 Gazzetta n. 100 del 30 aprile 2013 (vai al sommario) AGENZIA ITALIANA DEL FARMACO COMUNICATO Autorizzazione all'immissione in commercio del medicinale per uso umano «Pioglitazone Aurobindo». Estratto determinazione
Gazzetta n. 100 del 30 aprile 2013 (vai al sommario) AGENZIA ITALIANA DEL FARMACO COMUNICATO Autorizzazione all'immissione in commercio del medicinale per uso umano «Pioglitazone Aurobindo». Estratto determinazione
La Farmacia Territoriale e l approccio al paziente
 INTRODUZIONE E MICOSI DELLA CUTE Prof.ssa Gabriella Fabbrocini RUOLO DEL FARMACISTA NELL APPROCCIO AL PAZIENTE CON SEGNI E SINTOMI DERMATOLOGICI La Farmacia Territoriale e l approccio al paziente La Farmacia
INTRODUZIONE E MICOSI DELLA CUTE Prof.ssa Gabriella Fabbrocini RUOLO DEL FARMACISTA NELL APPROCCIO AL PAZIENTE CON SEGNI E SINTOMI DERMATOLOGICI La Farmacia Territoriale e l approccio al paziente La Farmacia
