HercepTest for Automated Link Platforms
|
|
|
- Marcello Abbate
- 7 anni fa
- Visualizzazioni
Transcript
1 HercepTest for Automated Link Platforms Codice SK edizione ( ) P04456IT_01_SK / p. 1/41
2 Sommario Pagina Finalità d uso...3 Cenni introduttivi - Mammella...4 Principio della procedura - Mammella...4 Materiali forniti - Mammella...5 Materiali necessari ma non forniti - Mammella...6 Precauzioni - Mammella...6 Conservazione - Mammella...7 Specimen preparation (Allestimento tessuto) - Mammella...8 Procedura per la colorazione - Mammella...9 Controllo di qualità - Mammella...11 Interpretazione della colorazione - Mammella...12 Limiti generali - Mammella...15 Limiti specifici del prodotto - Mammella...15 Caratteristiche prestazionali - Mammella...15 Risoluzione dei problemi - Mammella...19 Cenni introduttivi - Gastrico...21 Principio della procedura - Gastrico...21 Materiali forniti - Gastrico...22 Materiali necessari ma non forniti - Gastrico...23 Precauzioni - Gastrico...23 Conservazione - Gastrico...24 Specimen preparation (Allestimento tessuto) - Gastrico...25 Preparazione dei reagenti - Gastrico...25 Procedura per la colorazione - Gastrico...26 Interpretazione della colorazione - Gastrico...29 Limiti generali - Gastrico...32 Limiti specifici del prodotto - Gastrico...32 Caratteristiche prestazionali - Gastrico...33 Risoluzione dei problemi - Gastrico...37 Bibliografia...39 Spiegazione dei simboli...41 ( ) P04456IT_01_SK / p. 2/41
3 Finalità d uso Per uso diagnostico in vitro. Il test immunocitochimico semiquantitativo HercepTest consente di determinare l iperespressione della proteina HER2 nei tessuti affetti da tumore della mammella che sono stati sottoposti a trattamento di routine per la valutazione istologica e tessuto cancerogeno fissato in formalina e incluso in paraffina di pazienti con adenocarcinoma dello stomaco, compresa la giunzione gastroesofagea. Il test HercepTest è un valido strumento di supporto nella valutazione dei pazienti che devono essere dichiarati idonei al trattamento con Herceptin (trastuzumab) (vedere il foglietto illustrativo dell Herceptin ). NOTA solo per cancro mammario: tutti i pazienti ammessi agli studi clinici con Herceptin sono stati selezionati applicando un metodo di investigazione immunocitochimica ai fini della sperimentazione clinica (CTA, clinical trial assay). Nessuno dei pazienti ammessi agli studi clinici è stato selezionato con il test HercepTest. Il test HercepTest è stato comparato al CTA utilizzando una serie di campioni indipendenti. La conclusione è che produce risultati discretamente concordanti. L effettiva correlazione tra HercepTest e risultati clinici con Herceptin non è stata ancora stabilita. NOTA solo per cancro gastrico: tutti i pazienti nella fase III BO18255 dello studio ToGA sponsorizzato da Hoffmann-La Roche sono stati selezionati utilizzando l'herceptest (IHC) di Dako e il kit HER2 FISH pharmdx (FISH) di Dako. Lo studio ha dimostrato l utilità clinica di entrambi i test per la valutazione dello stato dell HER2 in pazienti con adenocarcinoma gastrico in stadio avanzato localmente non operabile, ricorrente e/o metastatico dello stomaco o della giunzione gastroesofagea. Per quanto riguarda questo kit (codice SK001), i volumi di reagente sono stati calcolati in modo specifico per piattaforme Link automatizzate Dako. In questo documento, l'adenocarcinoma gastrico con giunzione gastroesofagea viene chiamato anche cancro gastrico. HercepTest ed Herceptin sono marchi di fabbrica di Genentech, Inc. e sono soggetti alle licenze detenute da Dako Denmark A/S e F. Hoffmann-La Roche Ltd. Per applicazione per cancro mammario, fare riferimento alle pagine 4-20 Per applicazione per cancro gastrico, fare riferimento alle pagine Importante: si notino le differenze fra il tessuto di cancro alla mammella e il tessuto di cancro gastrico, specialmente all'interno delle sezioni di Interpretazione della colorazione. ( ) P04456IT_01_SK / p. 3/41
4 Carcinoma mammario Cenni introduttivi - Mammella Dati di base Il gene umano HER2 (noto anche con le sigle ERBB2 o NEU) codifica una proteina che è generalmente denominata proteina HER2 o p185 HER2. La proteina HER2 è un recettore di transmembrana ad attività tirosinchinasica con omologia per il recettore del fattore di crescita epidermico (EGFR o HER1) (1-8). La proteina HER2 è un componente normalmente espresso da numerosi tipi di cellule epiteliali (8). Una percentuale di pazienti con carcinoma mammario presenta una iperespressione della proteina HER2, come parte del processo di trasformazione maligna e di avanzamento del tumore (9). L iperespressione dell HER2 sulla superficie delle cellule di carcinoma mammario ha indicato la proteina come un possibile bersaglio nella terapia anticorpale. L Herceptin (trastuzumab) è un anticorpo monoclonale umanizzato (10) che presenta un elevata affinità di legame con la proteina HER2 e che, come si è dimostrato, è in grado di inibire la proliferazione delle cellule tumorali umane che iperesprimono la proteina HER2 sia in vitro, sia in vivo (11-13). Caratteristiche Il test HercepTest è stato sviluppato allo scopo di fornire un alternativa al CTA investigativo utilizzato negli studi clinici con Herceptin. Le prestazioni del test HercepTest per quanto riguarda l iperespressione della proteina HER2 sono state valutate da uno studio indipendente, nel quale i risultati del test HercepTest sono stati comparati ai risultati del CTA su un totale di 548 campioni di tumore mammario, nessuno dei quali proveniente da pazienti coinvolte nella sperimentazione con Herceptin. I risultati dei due tipi di test eseguiti sugli stessi campioni hanno evidenziato una concordanza del 79%. In base ai dati sulla concordanza è inoltre possibile evidenziare l alta probabilità che una lettura 3+ con il test HercepTest corrisponda ad una lettura positiva con il CTA, ossia l ammissione alla sperimentazione (2+ o 3+). Non è stata invece stabilita una correlazione altrettanto chiara tra una lettura 2+ con il test HercepTest e i risultati del CTA. Nel 42% circa dei casi (53 su 126), le letture 2+ con il test HercepTest sono risultate negative con il CTA (0 1+), quindi i pazienti non sarebbero stati ammessi alla sperimentazione clinica con Herceptin. Il test HercepTest produce un risultato di negatività all iperespressione della proteina HER2 (intensità della colorazione 0 e 1+), un risultato di debole positività (intensità della colorazione 2+) e un risultato di forte positività (intensità della colorazione 3+). Il test HercepTest non è idoneo a fornire informazioni prognostiche al paziente e al medico e il suo impiego in questo senso non è stato approvato. Principio della procedura - Mammella Il test HercepTest contiene i reagenti necessari per completare una procedura di colorazione immunocitochimica a due step su campioni trattati secondo le tecniche di routine e inclusi in paraffina. Dopo l incubazione con l anticorpo primario di coniglio anti-proteina HER2 umana, il kit prevede l impiego di un Visualization Reagent pronto all uso, il quale sfrutta la tecnologia a base di destrano. Il reagente in questione è composto sia da molecole di immunoglobuline secondarie di capra anti-coniglio, sia da molecole di perossidasi di rafano, legate ad una comune catena principale di destrano. Questa tecnologia elimina la necessità di applicare in modo sequenziale un anticorpo di collegamento e un anticorpo coniugato con perossidasi. La reazione crociata del Visualization Reagent con le immunoglobuline umane e il siero fetale di vitello è stata rimossa mediante assorbimento in base solida. La conversione enzimatica del cromogeno aggiunto successivamente dà origine alla formazione di un prodotto di reazione visibile in corrispondenza dell antigene. A questo punto è possibile procedere alla colorazione di contrasto del campione e montare un vetrino coprioggetto. L interpretazione dei risultati avviene per mezzo di un microscopio ottico. Per convalidare le serie di colorazione vengono forniti vetrini di controllo contenenti tre linee cellulari di tumore della mammella umano, debitamente fissati in formalina e inclusi in paraffina, i quali esprimono tre gradi di intensità della colorazione: 0, 1+ e 3+. Vi è una correlazione tra l intensità della colorazione di queste linee cellulari e il numero di recettori presenti in ogni cellula. Il test HercepTest for Automated Link Platforms codice SK001, può essere impiegato per la colorazione automatizzata con piattaforme Link automatizzate Dako. ( ) P04456IT_01_SK / p. 4/41
5 Carcinoma mammario Materiali forniti - Mammella Codice SK001 Il materiale elencato è sufficiente per effettuare 50 test (50 vetrini incubati con anticorpo primario anti-proteina HER2 e 50 vetrini incubati con il corrispondente reagente di controllo negativo). Il numero di test è calcolato in base all uso di 200 µl di ogni reagente per sezione di tessuto (22 mm x 22 mm), ad eccezione della Epitope Retrieval Solution. Il kit contiene materiale sufficiente per effettuare un massimo di 10 cicli di colorazione singoli. Quantità Descrizione 1 x 22 ml HercepTest Peroxidase-Blocking Reagent Perossido di idrogeno 3% contenente sodio azide (NaN 3) 15 mmol/l. 1 x 12 ml HercepTest Rabbit Anti-Human HER2 Protein Anticorpo pronto all uso isolato per affinità. Viene fornito in Tris/HCl 0,05 mol/l; NaCl 0,1 mol/l; NaN 3 15 mmol/l; ph 7,2 e con proteina stabilizzante. Immunogeno: frammento sintetico C-terminale (parte intracitoplasmica) della proteina HER2 accoppiato a emocianina di patella. Specificità: proteina HER2. Metodo di purificazione: l anticorpo viene isolato per affinità utilizzando un peptide immobilizzato della proteina HER2. 1 x 22 ml HercepTest Visualization Reagent Polimero di destrano coniugato con perossidasi di rafano e immunoglobuline di capra anti-immunoglobuline di coniglio isolate per affinità. Viene fornito in tampone Tris/HCl contenente proteina stabilizzante e un agente antimicrobico. 1 x 10 ml HercepTest Negative Control Reagent Frazione di immunoglobuline di siero di coniglio normale. Concentrazione della proteina equivalente alla concentrazione dell anticorpo anti-proteina HER2. Viene fornito in Tris/HCl 0,05 mol/l; NaCl 0,1 mol/l; NaN 3 15 mmol/l; ph 7,2 e con proteina stabilizzante. 2 x 22 ml HercepTest DAB Substrate Buffer Soluzione tampone substrato, a ph 7,5, contenente perossido di idrogeno < 0,1%, stabilizzanti, enhancer e un agente antimicrobico. 1 x 1 ml Cromogeno DAB HercepTest Soluzione cromogena contenente 3,3 -diaminobenzidina tetraidrocloruro (5%). 3 x 500 ml HercepTest Epitope Retrieval Solution (Containing Detergent) (10x) Tampone citrato 0,1 mol/l con un detergente. 2 x 5 vetrini HercepTest Control Slides Ogni vetrino contiene sezioni di tre linee cellulari di carcinoma mammario che sono state fissate in formalina e incluse in paraffina e che rappresentano livelli diversi di espressione della proteina HER2: MDA-231 (0), MDA-175 (1+), and SK-BR-3 (3+). I vetrini di controllo sono stati trattati termicamente per assicurare una maggiore aderenza delle sezioni al vetro. Se i vetrini vengono sottoposti ad ulteriori trattamenti termici per migliorare l aderenza delle sezioni al vetro, si corre il rischio di compromettere i risultati della colorazione. 10 x flaconi Flacone per reagente riempibile da parte dell utente, da 12 ml di capacità Ogni flacone può contenere 12 ml di reagente. Utilizzare i flaconi per la miscelazione e la conservazione della soluzione cromogeno-substrato (fare riferimento anche alla sezione Preparazione dei Reagenti). NOTA: tutti i reagenti sono formulati in modo specifico per questo test. Affinché il test abbia il livello di rendimento specificato, evitare sostituzioni di qualsiasi genere. ( ) P04456IT_01_SK / p. 5/41
6 Carcinoma mammario Materiali necessari ma non forniti - Mammella Precauzioni - Mammella Dako Wash Buffer, codice S3006 Colorante di contrasto: ematossilina, ad esempio Hematoxylin for Automated Link Platforms (codice SK308) Vetrini coprioggetto Acqua distillata o deionizzata Forno essiccante, in grado di mantenere una temperatura di 60 C o inferiore Etanolo, assoluto e al 95% Microscopio ottico (ingrandimento obiettivo 4-40x) Mezzo di montaggio, ad esempio Dako Faramount (codice S3025) o Dako Glycergel (codice C0563) Tessuti positivi e negativi da utilizzare come controlli di lavoro (vedere Controllo della qualità) Vetrini SuperFrost Plus, vetrini polilisinati oppure silanizzati, come Dako Silanized Slides (codice S3003) Xilene, toluene o sostituti dello xilene Il kit SK001 è formulato appositamente per l uso con piattaforme Link automatizzate Dako. Per ulteriori informazioni, consultare il manuale dell utente per le piattaforme Link automatizzate Dako. 1. Per uso diagnostico in vitro. 2. Per uso professionale. 3. Questo prodotto contiene sodio azide (NaN 3), una sostanza chimica fortemente tossica in forma pura. Sebbene non sia classificato come prodotto a rischio, la sodio azide alle concentrazioni indicate può reagire con il rame e il piombo delle tubature formando azidi metalliche fortemente esplosive. Durante lo smaltimento, sciacquare le tubature con abbondante acqua per prevenire l eventuale accumulo di azide (21). 4. HercepTest Peroxidase-Blocking Reagent, contiene perossido di idrogeno 3%. Su richiesta è disponibile una scheda di sicurezza per utenti professionisti. 5. HercepTest Rabbit Anti-Human HER2 Protein, HercepTest Visualization Reagent ed HercepTest Negative Control Reagent contengono materiale di origine animale. 6. Adottare le normali procedure previste per il trattamento dei prodotti di origine biologica. 7. I vetrini di controllo e i campioni, sia prima che dopo la fissazione, e tutti i materiali che entrano in contatto con essi devono essere trattati come materiali potenzialmente capaci di trasmettere un infezione, pertanto devono essere smaltiti assumendo tutte le precauzioni necessarie (22). Non pipettare mai i reagenti per bocca ed evitare che reagenti e campioni entrino in contatto con la pelle e le membrane mucose. In caso di contatto dei reagenti con zone sensibili, lavare la zona con abbondante acqua. 8. Evitare la contaminazione batterica dei reagenti, altrimenti potrebbe verificarsi un incremento della colorazione non specifica. 9. Tempi, temperature e modalità di incubazione diversi da quelli specificati possono generare risultati erronei. Un asciugatura eccessiva per più di un ora a 60 C può causare una diminuzione significativa o la perdita dell immunoreattività HER2 specifica associata alla membrana (17). 10. I reagenti sono stati diluiti in modo ottimale. Ulteriori diluizioni potrebbero causare la perdita di colorazione antigenica. 11. Tutti i reagenti sono formulati in modo specifico per questo test. Affinché il test abbia il livello di rendimento specificato, evitare sostituzioni di qualsiasi genere. 12. HercepTest Visualization Reagent ed HercepTest DAB Chromogen possono subire alterazioni se esposti a livelli di luce eccessivi. Non conservare i componenti del kit e non eseguire la colorazione in condizioni di luce intensa, ad esempio sotto la luce diretta del sole. 13. Indossare indumenti di protezione personale adeguati, per evitare il contatto con gli occhi e la pelle. 14. Una soluzione inutilizzata deve essere smaltita secondo le direttive locali, statali e federali. 15. Su richiesta, è disponibile una scheda di sicurezza per utenti professionisti. 16. L uso di volumi di reagente diversi da quelli raccomandati può comportare la perdita di immunoreattività HER2 visibile. Sezioni di tessuto maggiori di 22 mm x 22 mm richiedono l applicazione di 2-3x 200 µl di reagente in 2-3 aree di applicazione automatizzata. 17. HercepTest DAB Chromogen contiene 3,3 -diaminobenzidina tetraidrocloruro (bifenil-3,3,4,4 - tetrail tetra ammonio tetracloruro) all 1 5% e presenta un etichetta: Pericolo H350 Può provocare il cancro. H341 Sospettato di provocare alterazioni genetiche. P201 Procurarsi istruzioni specifiche prima dell uso. P280 Indossare guanti protettivi. Fare uso di un dispositivo di protezione degli occhi o del viso. Indossare indumenti protettivi. P308 + P313 IN CASO di esposizione o di possibile esposizione: Richiedere assistenza medica. P405 Conservare sotto chiave. P501 Smaltire il prodotto e il recipiente secondo ogni regolamento locale, regionale, nazionale e internazionale. 18. Residui di paraffina possono generare risultati falsi negativi. Di norma, l utilizzo di questo prodotto non è consentito ai minori di 18 anni. Gli utenti devono essere accuratamente informati relativamente alla procedura di lavoro adeguata, alle proprietà pericolose del prodotto e alle istruzioni di sicurezza necessarie (secondo la Direttiva dell Unione Europea 94/33/EC). Per ulteriori informazioni, fare riferimento alla scheda dati di i sicurezza (Safety Data Sheet, SDS) corrispondente. ( ) P04456IT_01_SK / p. 6/41
7 Carcinoma mammario USA: la sostanza 3,3 -diaminobenzidina (DAB) può essere nociva per inalazione, a contatto con la pelle e per ingestione. Materiale irritante per gli occhi e la pelle. In caso di contatto con la pelle, sciacquare le aree interessate con acqua e sapone. NOTA: sebbene la diaminobenzidina sia strutturalmente correlata alla benzidina, non esistono prove che la diaminobenzidina abbia proprietà cancerogene. Per lo smaltimento, attenersi alle normative locali, regionali o nazionali in materia. Conservazione - Mammella Conservare a 2 8 C quando non in uso su piattaform e Dako Automated Link. Conservare HercepTest Peroxidase-Blocking Reagent, HercepTest Visualization Reagent, HercepTest DAB Substrate Buffer e HercepTest DAB Chromogen al buio a 2 8 C. Non utilizzare il kit dopo la data di scadenza stampata all esterno della confezione. Se i reagenti sono conservati in condizioni diverse da quelle specificate, l utente deve verificarne le condizioni (14a, 14b). Si fa presente che anche i vetrini di controllo devono essere conservati a 2 8 C. Non sono stati osservati segni evidenti che suggeriscano l instabilità di questo prodotto, pertanto è opportuno analizzare un controllo positivo e un controllo negativo insieme ai campioni dei pazienti. Qualora si ottenga una colorazione imprevista, che non sia cioè giustificata da un cambiamento delle procedure di laboratorio ma sia dovuta ad un probabile problema del test HercepTest, contattare immediatamente l Assistenza Tecnica Dako. ( ) P04456IT_01_SK / p. 7/41
8 Carcinoma mammario Specimen preparation (Allestimento tessuto) - Mammella I campioni bioptici devono essere manipolati in modo da preservare il tessuto per la colorazione immunocitochimica. Adottare i metodi standard per il trattamento dei tessuti di tutti i campioni. 15 Sezioni incluse in paraffina Sono idonei all uso tutti i tessuti conservati in formalina tamponata neutra o in fissativo di Bouin per i trattamenti di routine e l inclusione in paraffina. Ad esempio, i campioni bioptici devono essere bloccati in uno spessore di 3 o 4 mm e fissati per ore in formalina tamponata neutra. I tessuti vengono successivamente disidratati attraverso il passaggio in una serie di alcoli e in xilene e sottoposti ad infiltrazione di paraffina fusa ad una temperatura non superiore a 60 C. I tessuti che esprimono l HER2, quando ven gano sottoposti a fissazione e inclusione in modo corretto e siano conservati al fresco (15 25 C), preserv ano la loro morfologia a tempo indeterminato prima del taglio delle sezioni e del montaggio su vetrino (15,16). Negli Stati Uniti, la norma 42 CFR (b) del Clinical Laboratory Improvement Act del 1988 prevede che i laboratori devono conservare i vetrini colorati per almeno dieci anni dalla data del saggio e devono altresì conservare blocchi di campioni per almeno due anni dalla data del saggio (16). I campioni di tessuto devono essere tagliati in sezioni di 4 5 µm, montati su vetrini e asciugati all aria a temperatura ambiente per un minimo di 12 ore (o fino all asciugatura) o a 37 C durante la notte o a 6 0 C per un ora. AVVISO: un calore eccessivo per più di un ora a 60 C può causare una diminuzione significativa o l a perdita dell immunoreattività HER2 specifica associata alla membrana (17). Per preservare l antigenicità, è necessario che le sezioni di tessuto montate sui vetrini (SuperFrost Plus, polilisinati, a carica positiva o vetrini silanizzati) vengano sottoposte alla procedura di colorazione entro 4-6 settimane dal sezionamento, purché conservate a temperatura ambiente (20 25 C) (18). I vetrini da uti lizzare per la valutazione della proteina HER2 e per la verifica della presenza di tumore devono essere preparati in contemporanea. Si consiglia di preparare almeno 5 vetrini: 1 per la presenza di tumore, 2 per la valutazione della proteina HER2 (uno per l incubazione con l anticorpo di coniglio anti-proteina HER2 umana e uno per l incubazione con il reagente di controllo negativo), più 2 vetrini di riserva. Per preservare l antigenicità, le sezioni di tessuto già montate sui vetrini (SuperFrost Plus, Poly-L-lysine o vetrini silanizzati) dovranno essere sottoposte alla colorazione entro 4 6 settimane dal sezionamento se conservate a temperatura ambiente (20 25 C) (18). L uso del test HercepTest su tessuti decalcificati non è stato approvato ed è fortemente sconsigliato. Consultare la pubblicazione Dako intitolata Education Guide: Immunochemical Staining Methods (19) e i riferimenti bibliografici 15 e 16 per ulteriori informazioni sulla preparazione dei campioni. Trattamento dei campioni prima della colorazione Per conseguire un rendimento ottimale del test, è necessario utilizzare un metodo di recupero dell epitopo in tampone citrato 0,01 mol/l. La soluzione idonea allo scopo è inclusa nel kit HercepTest. Questo metodo richiede il riscaldamento delle sezioni di tessuto montate su vetrini immerse in 0,01 mol/l di tampone citrato (20) a bagnomaria calibrato o Dako PT Link (Codice PT101 e PT200) alla temperatura richiesta (95 99 C ). I laboratori situati ad altitudini più elevate devono definire il metodo migliore per mantenere la temperatura richiesta. Gli altri metodi di recupero dell epitopo che sono stati esaminati non hanno assicurato la riproducibilità dei risultati. Eventuali variazioni della procedura descritta potrebbero compromettere i risultati. Preparazione dei reagenti - Mammella Per ragioni di praticità, prima di procedere alla colorazione è opportuno preparare i reagenti elencati di seguito: Epitope Retrieval Solution Diluire la soluzione HercepTest Epitope Retrieval Solution con un rapporto 1:10 utilizzando acqua distillata o deionizzata, in quantità sufficiente per completare la procedura di colorazione pianificata. La soluzione diluita può essere utilizzata a temperatura ambiente per una settimana oppure può essere conservata a 2 8 C p er un mese. Eliminare la soluzione diluita se appare torbida. Per ulteriori informazioni, fare riferimento al manuale dell utente per piattaforme Link automatizzate Dako. Tampone di lavaggio Diluire una quantità sufficiente di Dako Wash Buffer (Codice S3006) con un rapporto 1:10 utilizzando acqua distillata o deionizzata. Il tampone diluito può essere utilizzato a temperatura ambiente per una settimana oppure può essere conservato a 2 8 C per un mese. Eliminare la soluzione tampone se appare torbida. Per ulteriori informazioni, fare riferimento al manuale dell utente per piattaforme Link automatizzate Dako. Soluzione cromogeno-substrato (DAB) Preparare una soluzione cromogeno-substrato nei flaconi riempibili dall utente addizionando 25 µl di DAB Chromogen per 1 ml di DAB Substrate Buffer quindi miscelare. La soluzione substrato-cromogeno (DAB) così preparata è stabile per circa 5 giorni se conservata a 2 8 C. La soluzione deve essere agitata bene p rima dell uso. La comparsa di qualsiasi precipitato all interno della soluzione non ne altera la qualità di colorazione. Il flacone riempibile dall utente contenente la soluzione miscelata cromogeno-substrato deve essere identificato nella piattaforma Link automatizzata Dako prima dell uso. Fare riferimento alla guida per l utente per maggiori informazioni inerenti la piattaforma Link automatizzata Dako. NOTA: il colore del DAB Chromogen può passare da una tonalità chiara a un marrone acceso. Tutto ciò non altera le prestazioni del prodotto. Per la diluizione, seguire le linee guida contenute nell inserto. L aggiunta in eccesso di DAB Chromogen al DAB Buffered Substrate può determinare un deterioramento del segnale positivo. Colorazione di contrasto Il prodotto finale della reazione di colorazione DAB è insolubile in alcol e in acqua. Come colorante di contrasto ( ) P04456IT_01_SK / p. 8/41
9 Carcinoma mammario è possibile utilizzare il prodotto Hematoxylin per piattaforme Link automatizzate (Codice SK308). La procedura e i tempi di incubazione sono preimpostati nel software Dako Link. Non occorre preparare il reagente. Mezzo di montaggio Si consiglia di usare un mezzo di montaggio permanente e non acquoso. Tuttavia è accettabile anche un montaggio acquoso. Come mezzi di montaggio acquoso si consigliano i prodotti Dako Faramount Aqueous Mounting Medium, Ready-to-Use (Codice S3025) o Dako Glycergel Mounting Medium (codice C0563). Liquefare Glycergel prima dell uso riscaldando il mezzo fino a 40 C (±5) circa. Procedura per la colorazione - Mammella Note sulla procedura Prima dell uso, si consiglia di leggere attentamente le istruzioni fornite di seguito e studiare le caratteristiche di tutti i componenti (vedere la sezione Precauzioni). Evitare che le sezioni di tessuto si secchino in qualsiasi momento della procedura di colorazione. Le sezioni di tessuto secche possono presentare una maggiore colorazione aspecifica. La procedura e i tempi di incubazione per la colorazione sono preimpostati nel software Dako Link. Per istruzioni dettagliate sui protocolli di programmazione e sul caricamento di vetrini e reagenti, consultare il manuale dell utente per piattaforme Link automatizzate Dako. Se la procedura di colorazione viene interrotta, è possibile conservare i vetrini in un bagno tampone dopo l incubazione dell anticorpo primario, per non più di un ora a temperatura ambiente (20 25 C), senza ripercussioni sui risultati della colorazione. Deparaffinazione e reidratazione Prima della colorazione, i vetrini contenenti i tessuti devono essere deparaffinati per rimuovere il mezzo di inclusione e successivamente reidratati. Evitare la rimozione incompleta della paraffina. La presenza di eventuali residui del mezzo di inclusione può provocare un aumento della colorazione aspecifica. Questa operazione deve essere eseguita a temperatura ambiente (20 25 C). 1. Immergere i vetrini in un bagno di xilene e incubare per 5 (±1) minuti. Cambiare il bagno e ripetere il procedimento. 2. Picchiettare i vetrini per eliminare il liquido in eccesso e immergerli in etanolo assoluto per 3 (±1) minuti. Cambiare il bagno e ripetere il procedimento. 3. Picchiettare i vetrini per eliminare il liquido in eccesso e immergerli in etanolo al 95% per 3 (±1) minuti. Cambiare il bagno e ripetere il procedimento. 4. Picchiettare per eliminare il liquido in eccesso e immergere i vetrini in acqua distillata o deionizzata per almeno 30 secondi. Avviare la procedura di colorazione come delineato nella sezione protocollo di colorazione sotto recupero dell epitopo. Soluzioni alcoliche e allo Xilene devono essere cambiate dopo 40 vetrini. Utilizzare derivati allo xilene o al toluene, come ad esempio Histoclear. NOTA: le istruzioni e i reagenti forniti in questo kit sono stati studiati per assicurare prestazioni ottimali. L ulteriore diluizione dei reagenti o una variazione delle temperature di incubazione potrebbero generare risultati erronei o discordanti. Le differenze che esistono tra i laboratori (per quanto riguarda il modo di trattare il tessuto o di eseguire le procedure tecniche) possono compromettere la validità dei risultati del test in quanto strumento di selezione dei pazienti idonei alla terapia con Herceptin. Protocollo di colorazione La procedura e i tempi di incubazione per la colorazione sono preimpostati nel software della piattaforma Link automatizzata Dako. Dopo la rimozione della paraffina e la reidratazione, e il recupero dell epitopo inizia l elaborazione dei vetrini sullo strumento secondo le modalità descritte di seguito. ( ) P04456IT_01_SK / p. 9/41
10 Carcinoma mammario Fase 1: recupero dell epitopo Riempire i serbatoi Dako PT Module o la vaschetta per colorazione, ad es. vaschetta Coplin,con Epitope Retrieval Solution (fare riferimento alla preparazione dei reagenti). Per Dako PT Link (Codice PT101 e PT200): preriscaldare la soluzione diluita Epitope Retrieval nel serbatoio Dako PT Link a una temperatura di 85 C. Durante il riscaldamento, la soluzione Epitope Retrieval Solution assume un aspetto torbido. Posizionare le sezioni prive di paraffina a temperatura ambiente nei cestelli dei reagenti ed immergere i vetrini nella soluzione preriscaldata Epitope Retrieval Solution. Lasciare riscaldare Dako PT Link fino a 97 C e incubare per 40 minuti (±1) a 97 C. Lasciare raffreddare le sezioni in Dako PT Link finché la temperatura non raggiunge 85 C. Rim uovere i serbatoi PT Link con le sezioni da Dako PT Link. Lasciare i serbatoi sul tavolo per 10 minuti senza coperchio per raffredare ulteriormente. Lavare le sezioni con Wash Buffer. Per ulteriori informazioni, fare riferimento alla guida per utente di Dako PT Link. Per le vaschette Coplin: immergere in un bagnomaria le vaschette per la colorazione contenenti la soluzione diluita Epitope Retrieval Solution. Riscaldare il bagnomaria e la soluzione Epitope Retrieval Solution fino a C. Durante il riscaldamento, la soluzione Ep itope Retrieval Solution assume un aspetto torbido. Coprire le vaschette con i coperchi in modo da stabilizzare la temperatura e impedire l evaporazione. Immergere le sezioni deparaffinate a temperatura ambiente nelle vaschette con la soluzione Epitope Retrieval Solution precedentemente riscaldata. Riportare la temperatura del bagnomaria e della soluzione Epitope retrieval solution a C. Incubare per 40 minuti (±1) a C. Rimuovere tutta la vaschetta con i v etrini dal bagnomaria. Lasciare i vetrini a temperatura ambiente nella soluzione Epitope Retrieval Solution per 20 minuti (±1), in modo che si raffreddino. Decantare la soluzione Epitope Retrieval Solution e lavare le sezioni nel tampone di lavaggio Per conseguire prestazioni ottimali, immergere le sezioni nel tampone di lavaggio per 5 20 minuti dopo il recupero dell epitopo e prima della colorazione. NOTA: la soluzione Epitope Retrieval Solution è un prodotto monouso, idoneo a una sola applicazione. Non riutilizzare. Fase 2: procedura di colorazione Dopo il recupero dell epitopo, i vetrini posizionati nei cestelli dello strumento vengono collocati sulle piattaforme Link automatizzate Dako. Lo strumento esegue la procedura di colorazione opportuna applicando il reagente, monitorando il tempo di incubazione e sciacquando i vetrini tra un reagente e l altro. I tempi di incubazione sono preimpostati nel software Link Dako. Fase 3: colorazione di contrasto I vetrini possono essere sottoposti a colorazione di contrasto con Hematoxylin per piattaforme Link automatizzate Dako (Codice SK308). I protocolli di colorazione disponibili nel software Dako sono 2: uno prevede l uso dell ematossilina e uno no. Il tempo di incubazione con l ematossilina è preimpostato nel protocollo che prevede l uso di questa colorazione di contrasto. Per ulteriori informazioni sui protocolli, consultare il manuale dell utente Piattaforme Link automatizzate Dako. Fase 4: montaggio Si consiglia di usare un mezzo di montaggio permanente e non acquoso. Diversamente, è accettabile anche un mezzo di montaggio acquoso. È possibile montare i campioni e applicare i vetrini coprioggetto con un mezzo di montaggio acquoso, come ad esempio Dako Faramount (Codice S3025) o Dako Glycergel (codice C0563). NOTA: è possibile leggere i vetrini in qualunque momento. È tuttavia possibile che si verifichi un certo grado di scolorimento se i vetrini vengono coperti con un mezzo di montaggio acquoso e vengono esposti alla luce intensa per un periodo di una settimana. Per evitare che ciò accada, conservare i vetrini al buio a temperatura ambiente (20 25 C). ( ) P04456IT_01_SK / p. 10/41
11 Carcinoma mammario Controllo di qualità - Mammella Se le procedure consigliate per la fissazione, il trattamento e l inclusione dei tessuti vengono modificate in laboratorio, è possibile che i risultati presentino una certa variabilità. n tal caso, oltre ad utilizzare i vetrini di controllo forniti da Dako, occorre effettuare tutta una serie di controlli interni con regolarità. Negli Stati Uniti, vedere il riferimento n. (23) in Bibliografia e attenersi alle seguenti linee guida di controllo della qualità approvate: College of American Pathologists (CAP) Certification Program for Immunohistochemistry; CLSI (precedentemente NCCLS) Quality Assurance for Immunocytochemistry, Approved Guideline (24). Tabella 1: Finalità del controllo di qualità giornaliero Tessuto: fissato e trattato come il campione del paziente Controllo positivo: tessuti o cellule che contengono l antigene bersaglio da individuare (potrebbe essere presente nel tessuto del paziente). Il controllo ideale è un tessuto con una colorazione positiva debole, in quanto è più sensibile al deterioramento dell anticorpo o dell antigene. Controllo negativo: tessuto o cellule che si presume negativi (potrebbero trovarsi nel tessuto del paziente o nel tessuto di controllo positivo). Tessuto del paziente Vetrino di controllo fornito da Dako Anticorpo specifico e sistema di rivelazione Controllo di tutte le fasi dell analisi. Convalida delle procedure e dei reagenti utilizzati per la colorazione HER2. Rilevamento di una reattività crociata indesiderata dell anticorpo rispetto alle cellule e/o ai componenti cellulari. Rilevamento della colorazione specifica. Controllo della sola procedura di colorazione. Anticorpo non specifico* o tampone + stesso sistema di rivelazione usato con l anticorpo specifico Rilevamento della colorazione di fondo aspecifica. Rilevamento della colorazione di fondo aspecifica. Rilevamento della colorazione di fondo aspecifica. * Siero proveniente dalla stessa specie dell anticorpo specifico, ma non diretto contro lo stesso antigene bersaglio. Per individuare legami aspecifici con l anticorpo, ad es. legame della porzione Fc dell anticorpo ad opera del tessuto. Vetrino di controllo (fornito) Tutti i vetrini di controllo forniti nel kit contengono tre linee cellulari umane pellettizzate, fissate in formalina e incluse in paraffina, con valori di intensità di colorazione pari a 0, 1+ e 3+. È necessario utilizzare un vetrino in ogni procedura di colorazione. Valutando le linee cellulari sul vetrino di controllo fornito da Dako è possibile verificare la validità della procedura di colorazione. Tessuto di controllo positivo I controlli dovrebbero essere costituiti da campioni freschi di autopsia/biopsia/chirurgia che sono stati fissati, trattati e inclusi in paraffina nei tempi più brevi possibili, seguendo la medesima procedura utilizzata per i campioni dei pazienti da analizzare. I controlli positivi confermano se i tessuti sono stati preparati correttamente e se sono state adottate tecniche di colorazione corrette. È necessario includere un tessuto di controllo positivo per ogni set di condizioni di analisi previsto in ogni ciclo di colorazione. I controlli positivi devono produrre una colorazione positiva debole, così da evidenziare variazioni leggere nella sensibilità dell anticorpo primario. Se trattati diversamente dai campioni dei pazienti, i vetrini di controllo di questo kit o i campioni consentono di convalidare soltanto il rendimento del reagente, ma non di verificare la preparazione del tessuto. Come tessuto di controllo positivo ideale è possibile utilizzare un campione di carcinoma mammario umano invasivo (infiltrante) con iperespressione di proteina HER2 che abbia prodotto un risultato di positività 2+ in un test precedente. NOTA: i controlli positivi noti devono essere utilizzati esclusivamente per verificare il corretto rendimento dei tessuti trattati e dei reagenti per analisi, NON per formulare una diagnosi specifica dei campioni dei pazienti. Se i controlli positivi non producono una colorazione positiva, significa che i risultati ottenuti con i campioni dei pazienti analizzati non sono da ritenersi validi. Tessuto di controllo negativo In ogni ciclo di colorazione è necessario utilizzare un tessuto di controllo negativo (negativo alla proteina HER2) che sia stato fissato, trattato e incluso in paraffina secondo la medesima procedura adottata per i campioni dei pazienti da analizzare. In questo modo è possibile verificare la specificità dell anticorpo primario e fornire un indicazione della colorazione di fondo specifica. Il colon, il fegato e la tiroide sono idonei ad essere impiegati come tessuti di controllo negativi. Molteplici tipi di cellule presenti nella maggior parte delle sezioni tissutali offrono siti interni di controllo negativo (è necessaria una verifica dell utente). I dotti mammari normali possono fungere da controlli negativi interni. ( ) P04456IT_01_SK / p. 11/41
12 Carcinoma mammario Se si osserva una colorazione specifica nel tessuto di controllo negativo o nel sito di controllo interno, significa che i risultati ottenuti con i campioni dei pazienti analizzati non sono da ritenersi validi. Per ulteriori informazioni sulla programmazione dei vetrini di controllo, consultare il manuale dell utente per le piattaforme Link automatizzate Dako. Reagente di controllo negativo aspecifico Al posto dell anticorpo primario, è possibile utilizzare il reagente di controllo negativo (fornito nel kit) su una sezione di ogni campione con lo scopo di valutare la colorazione aspecifica e favorire l interpretazione della colorazione specifica nel sito dell antigene. Il periodo di incubazione del reagente di controllo negativo deve corrispondere a quello dell anticorpo primario. Verifica del saggio Prima di utilizzare per la prima volta un sistema di colorazione in una procedura diagnostica, l utente deve verificare la specificità del test applicandolo ad una serie di tessuti interni con caratteristiche note di rendimento IHC, che rappresentano tessuti positivi e negativi noti. Fare riferimento alle procedure sul controllo della qualità descritte in questa sezione del foglietto illustrativo e ai requisiti descritti nelle istruzioni CAP Certification Program for Immunohistochemistry e/o CLSI (precedentemente NCCLS) Quality Assurance for Immunocytochemistry, Approved Guideline (23). Le procedure per il controllo della qualità vanno ripetute per ogni nuovo lotto di anticorpi o tutte le volte che viene apportata una modifica ai parametri del saggio. A questo scopo è possibile utilizzare tessuti positivi da carcinomi mammari con valori noti per quanto rigurda l intensità della colorazione per la proteina HER2 (da 0 a 3+) e tessuti negativi quali colon, fegato e tiroide. Interpretazione della colorazione - Mammella Ai fini della determinazione dell iperespressione di proteina HER2, si devono valutare solo il pattern e l intensità della colorazione della membrana, facendo riferimento alla scala dei valori illustrata nella Tabella 2. La valutazione dei vetrini deve essere effettuata da un patologo qualificato, con un microscopio ottico. Per la valutazione della colorazione immunocitochimica e l assegnazione di un punteggio, occorre utilizzare un obiettivo con ingrandimento 10x. Per confermare il punteggio è utile un obiettivo 20-40x. La colorazione citoplasmatica deve essere considerata non specifica e non deve essere inclusa nell accertamento dell intensità di colorazione della membrana (8). Per indicazioni nella differenziazione dei valori di colorazione 0, 1+, 2+ e 3+, fare riferimento alle figure rappresentative di intensità di colorazione riportate nel manuale di interpretazione dell'herceptest per il carcinoma mammario di Dako. Limitare la valutazione ai soli campioni provenienti da pazienti affette da carcinoma mammario invasivo. In caso di carcinoma in situ e carcinoma invasivo presenti nello stesso campione, assegnare un punteggio al solo componente invasivo. Tabella 2: Criteri per la valutazione dell intensità della colorazione nella membrana cellulare Pattern di colorazione Colorazione assente o colorazione della membrana in meno del 10% delle cellule tumorali. Colorazione appena percettibile/debole della membrana in oltre il 10% delle cellule tumorali. Le cellule si colorano solo in una parte della membrana. Colorazione completa, da debole a moderata, della membrana in oltre il 10% delle cellule tumorali. Colorazione completa, forte, della membrana in oltre il 10% delle cellule tumorali. Punteggio (riferire al medico curante) Valutazione dell iperespressione della proteina HER2 (riferire al medico curante) 0 Negativa 1+ Negativa 2+ Positiva debole 3+ Positiva forte Il test HercepTest produce un risultato di negatività all iperespressione della proteina HER2 (intensità della colorazione 0 e 1+), un risultato di debole positività (intensità della colorazione 2+) e un risultato di forte positività (intensità della colorazione 3+). Il test HercepTest non è idoneo a fornire informazioni prognostiche al paziente e al medico e il suo impiego in questo senso non è stato approvato. Ad ogni ciclo di colorazione, è importante esaminare i vetrini in una sequenza specifica (vedere Tabella 3), in modo da poter determinare la validità della sessione di analisi ed effettuare una valutazione semiquantitativa dell intensità della colorazione del tessuto campione. ( ) P04456IT_01_SK / p. 12/41
13 Carcinoma mammario Tabella 3: Sequenza di valutazione dei vetrini Ordine di lettura dei vetrini 1. Vetrino di controllo contenente le tre linee cellulari Logica Un test valido è confermato da: presenza di colorazione marrone 3+ nella membrana cellulare (rimming) per quanto riguarda la linea cellulare di controllo 3+ (Control Cell Line SK-BR-3); rimming parziale marrone per quanto riguarda la linea cellulare di controllo 1+ (Control Cell Line MDA-175); colorazione assente per quanto riguarda la linea cellulare di controllo 0 (Control Cell Line MDA-231). Colorazione discontinua e punteggiata presente in un numero di cellule esiguo nella zona positiva 1+ (Control Cell Line MDA-175)e, sempre in questa linea cellulare, immunocolorazione a puntini anche nella zona di Golgi del citoplasma. 2. Vetrino con il tessuto di controllo positivo 3. Vetrino con il tessuto di controllo negativo 4. Vetrino con il tessuto del paziente, colorato con il reagente di controllo negativo 5. Vetrino con il tessuto del paziente, colorato con l anticorpo primario Presenza di colorazione marrone nella linea cellulare di controllo 0 (Control Cell Line MDA-231), ovvero negatività alla proteina HER2. Indica che non c è stata colorazione aspecifica durante il test. I risultati del test potrebbero non essere validi a causa dell eccessiva colorazione. Possibile presenza di colorazione marrone della membrana. La colorazione del citoplasma e dei tessuti negativi non deve superare 1+. L ASSENZA di colorazione specifica nel tessuto di controllo negativo conferma l assenza di reattività crociata con cellule/componenti cellulari. In caso di colorazione specifica della membrana nel tessuto di controllo negativo, i risultati ottenuti con i campioni dei pazienti non sono da ritenersi validi. L assenza di colorazione specifica della membrana conferma che l anticorpo primario marca in modo specifico l antigene bersaglio. Se il citoplasma dei campioni trattati con il reagente di controllo negativo (ad es. nel tessuto connettivo, nei leucociti, negli eritrociti o nel tessuto necrotico) si colora di marrone o di un altra tonalità scura, si è in presenza di colorazione di fondo aspecifica (da riferire nella sezione riservata ai commenti del foglio dati). Quando nel campione viene individuata l iperespressione di proteina HER2, compare un rimming marrone circoscritto alla membrana cellulare delle cellule tumorali che sono state trattate con l anticorpo primario. 1. Vetrino di controllo (fornito): il primo vetrino di controllo da analizzare è quello sottoposto a colorazione con HercepTest, il quale consente di verificare il corretto funzionamento di tutti i reagenti. La presenza di un prodotto della reazione di colore marrone (3,3 -diaminobenzidina, DAB) in corrispondenza della membrana cellulare indica reattività positiva. Un test valido è confermato da: presenza di colorazione marrone (rimming) nella circonferenza della membrana cellulare per quanto riguarda la linea cellulare di controllo 3+ (Control Cell Line SK-BR-3); rimming parziale marrone per quanto riguarda la linea cellulare di controllo 1+ (Control Cell Line MDA-175); colorazione assente per quanto riguarda la linea cellulare di controllo 0 (Control Cell Line MDA-231). Se anche una sola delle linee cellulari di controllo fornite produce risultati che esulano dai criteri descritti, tutti i risultati ottenuti con i campioni dei pazienti sono da ritenersi non validi. 2. Tessuto di controllo positivo: il secondo vetrino da analizzare è quello con il tessuto di controllo positivo. Questo vetrino consente di verificare l efficacia del metodo di fissazione e del processo di recupero dell epitopo. Per l interpretazione dei risultati della colorazione, prendere in considerazione le cellule intatte, in quanto le cellule necrotiche o degradate assumono spesso una colorazione aspecifica (25). La colorazione del tessuto tumorale deve essere marrone e interessare la membrana cellulare. Il citoplasma e i tessuti negativi all interno del campione possono colorarsi di marrone, tuttavia l intensità di questa colorazione non deve superare il punteggio Tessuto di controllo negativo: dopo il tessuto di controllo positivo è necessario analizzare il vetrino con il tessuto di controllo negativo, in modo da poter confermare la specificità della marcatura dell antigene bersaglio ad opera dell anticorpo primario. L assenza di colorazione specifica nel tessuto di controllo negativo conferma l assenza di reattività crociata del kit con cellule/componenti cellulari. Se si osserva una colorazione specifica nel tessuto di controllo negativo, i risultati ottenuti con i campioni dei pazienti analizzati non sono da ritenersi validi. In alternativa, è possibile utilizzare alcune di queste porzioni negative nel tessuto di controllo positivo a mo di controlli negativi (è necessaria una verifica dell utente). È possibile che si verifichi una lieve reazione (intensità della colorazione tra 0 e 1+) in gran parte dei tessuti epiteliali normali. Possono essere impiegati come tessuti di controllo negativi il colon, il fegato e la tiroide. Se è presente, la colorazione aspecifica apparirà piuttosto diffusa. È possibile osservare anche la colorazione sporadica del tessuto connettivo nelle sezioni sottoposte ad eccessiva fissazione in formalina. ( ) P04456IT_01_SK / p. 13/41
14 Carcinoma mammario Tessuto del paziente: in ultimo esaminare i campioni dei pazienti sottoposti a colorazione con HercepTest. L intensità della colorazione positiva deve essere valutata tenendo conto di possibili colorazioni di fondo aspecifiche ad opera del reagente di controllo negativo. Come accade per tutti gli esami immunocitochimici, un risultato negativo significa che l antigene ricercato non è stato trovato, ma non significa che l antigene non è presente nelle cellule e nei tessuti analizzati. Per informazioni specifiche sulla immunoreattività del test HercepTest, vedere i paragrafi Cenni introduttivi, Limiti e Caratteristiche prestazionali. Altri suggerimenti per interpretare correttamente i risultati della colorazione con HercepTest La maggioranza dei carcinomi mammari sottoposti a test per individuare l iperespressione della proteina HER2 totalizza 0 oppure 3+ punti. Mentre nella stragrande maggioranza dei casi l interpretazione è chiara, in una piccola percentuale residua di casi i campioni ottengono punteggi 1+ e 2+ e sono più difficili da classificare. Per l interpretazione della colorazione con HercepTest in laboratorio, è possibile attenersi alle seguenti linee guida. 1. Valutare sempre le linee cellulari di controllo per convalidare il rendimento del test. 2. Valutare sia i vetrini di controllo positivi, sia i vetrini di controllo negativi. 3. Si consiglia di colorare i campioni dei tessuti con ematossilina ed eosina (H&E), almeno per la prima valutazione. (La ragione è che il tumore potrebbe non essere evidente ad una prima osservazione del campione colorato con HercepTest. Invece un vetrino colorato con H&E consente al patologo di appurare la presenza del tumore). Il test HercepTest deve essere eseguito su una sezione a coppia (seriale) appartenente allo stesso blocco di paraffina del campione. 4. Valutare la presenza di iperespressione della proteina HER2 nelle sezioni utilizzando prima un ingrandimento basso: la maggior parte dei casi positivi è già evidente con un ingrandimento basso. 5. Per determinare la percentuale di cellule tumorali positive, scegliere le aree del campione meglio conservate e colorate. 6. Di regola, il punteggio da attribuire ai casi dovrebbe risultare ovvio ad un ingrandimento basso. In caso di dubbio tra i punteggi 1+ e 2+ con un ingrandimento basso, in genere il punteggio è Per verificare la colorazione della membrana, utilizzare un obiettivo con un ingrandimento di 20-40x. 8. Se si è colorata la membrana nella maggioranza delle cellule tumorali, il punteggio è 2+ o 3+. Passare ad un ingrandimento 20-40x per confermare il punteggio. 9. Nella maggior parte dei casi con punteggio 3+, si colora almeno l 80% delle cellule tumorali e la colorazione della membrana è intensa. 10. Se un campione è vicino al limite soglia per quanto riguarda la percentuale di cellule tumorali positive (10%), si consiglia di contare almeno 100 cellule tumorali e determinare la percentuale esatta di cellule che si sono colorate. 11. Se la membrana cellulare si è colorata completamente con un intensità debole-moderata in più del 10% delle cellule tumorali, il punteggio da assegnare al campione è 2+. Contestualmente si osserva in genere la colorazione incompleta della membrana nella maggior parte delle restanti cellule tumorali. 12. Se la colorazione della circonferenza della membrana è completa in meno del 10% delle cellule tumorali, il punteggio è 1+ (anche se nelle altre cellule tumorali si osserva una colorazione incompleta della membrana). 13. Se la percentuale di cellule tumorali con una colorazione circonferenziale della membrana completa o incompleta è inferiore al 10%, il punteggio è 0. ( ) P04456IT_01_SK / p. 14/41
15 Carcinoma mammario Limiti generali - Mammella Limiti specifici del prodotto - Mammella Caratteristiche prestazionali - Mammella 1. L immunocitochimica è una tecnica diagnostica multifase che richiede un addestramento specifico per quanto riguarda la scelta dei reagenti appropriati, la selezione, la fissazione e il trattamento dei tessuti, la preparazione del vetrino per l analisi immunocitochimica e l interpretazione dei risultati della colorazione. 2. La colorazione del tessuto dipende dal modo in cui il tessuto viene pretrattato. Una fissazione eseguita in maniera scorretta, il congelamento, lo scongelamento, il lavaggio, l essiccazione, il riscaldamento, il sezionamento o la contaminazione con altri tessuti o fluidi possono produrre artefatti, intrappolare l anticorpo o generare risultati falsi-negativi. Risultati incoerenti possono essere provocati anche da modifiche apportate ai metodi di fissazione e di inclusione o da irregolarità intrinseche del tessuto. 3. Una colorazione di contrasto eccessiva o incompleta può compromettere l interpretazione dei risultati. 4. L interpretazione clinica di qualsiasi colorazione positiva o assenza di colorazione non può prescindere dal contesto della presentazione clinica, della morfologia e di altri criteri istopatologici L interpretazione clinica di qualunque colorazione o della sua assenza deve essere completata da studi morfologici e da controlli adeguati nonché da altri test diagnostici. L interpretazione della colorazione è compito di un patologo qualificato, che deve avere una profonda conoscenza degli anticorpi, dei reagenti e dei metodi impiegati. La colorazione deve essere eseguita in un laboratorio autorizzato certificato, sotto la supervisione di un patologo, il quale esaminerà i vetrini colorati e garantirà la correttezza dei controlli positivi e negativi. 5. I tessuti delle persone infette dal virus dell epatite B e contenenti l antigene di superficie dell epatite B (HBsAg) possono essere interessati da una colorazione aspecifica con la perossidasi di rafano (26). 6. I reagenti potrebbero provocare reazioni impreviste in tipi di tessuto mai analizzati in passato. Inoltre non è escluso che possano verificarsi reazioni impreviste anche in tipi di tessuti già analizzati in passato, vista l elevata variabilità biologica dell espressione antigenica nelle neoplasie o in altri tessuti patologici (27). Si prega di voler comunicare eventuali reazioni impreviste all Assistenza Tecnica Dako, fornendo tutta la documentazione del caso. 7. È possibile ottenere falsi positivi a causa del legame non immunologico di proteine o di prodotti di reazione del substrato. Falsi positivi possono essere causati anche dall attività della pseudoperossidasi (eritrociti) e dall attività della perossidasi endogena (citocromo C) (27). 8. La procedura di colorazione verrà eseguita alla temperatura programmata (20 25 C). 1. L antigene presente nella linea cellulare di controllo 1+ (Control Cell Line MDA-175) è destinato a degradarsi nel tempo. Valutare i risultati del vetrino di controllo tenendo conto della data di scadenza del vetrino. La colorazione negativa delle cellule MDA-175 potrebbe indicare soltanto che il vetrino di controllo si è deteriorato. Conservare i vetrini di controllo a 2 8 C. 2. Il deterioramento dell antigene nel tessuto, nel tempo, può provocare risultati falsi-negativi. I campioni devono essere sottoposti a colorazione entro 4-6 settimane dal montaggio dei tessuti sui vetrini e devono essere conservati a temperatura ambiente (20 25 C) (28). 3. Non sostituire i reagenti del kit con reagenti che abbiano numeri di lotto diversi, né con reagenti di altri produttori. 4. Dalla valutazione della colorazione del citoplasma si possono ottenere risultati falsi. Ai fini dell interpretazione della colorazione, tenere conto esclusivamente della colorazione della membrana cellulare. 5. I vetrini di controllo che si colorano servono esclusivamente per verificare la validità del ciclo di colorazione e non devono essere impiegati per assegnare un punteggio alla colorazione delle sezioni di tessuto. 6. Di tanto in tanto è possibile che si formino i cosiddetti hot spot, ovvero punti circoscritti con una colorazione focale intensa (3+). La presenza di questi hot spot potrebbe essere dovuta ad una procedura di fissazione e/o trattamento del tessuto non uniforme. In questi casi, si consiglia di procedere all immunocolorazione di un secondo blocco di tessuto appartenente allo stesso campione. 7. Non è stato approvato l uso del test HercepTest su campioni trattati con fissativi diversi dalla formalina tamponata neutra o dal fissativo di Bouin. 8. Il punteggio ottenuto dall epitelio mammario normale deve essere 0 o 1+. Se l epitelio normale ottiene un punteggio superiore a 1+, ripetere il test. Gli epiteli normali di tonsille ed esofago possono colorarsi con un intensità fino a 2+. Dati di base Lo studio clinico (CTA) mirato ad individuare i pazienti idonei alla sperimentazione clinica con Herceptin era stato messo a punto per scopi di ricerca e non è più disponibile. Il test HercepTest è stato sviluppato allo scopo di fornire un metodo alternativo CTA di valore equiparabile. La sicurezza ed efficacia dell Herceptin erano state valutate in uno studio clinico controllato randomizzato e in un vasto studio open-labelled (vedere il foglietto illustrativo all interno della confezione dell Herceptin ). Tutti i pazienti ammessi alla sperimentazione con Herceptin presentavano valori elevati (iperespressione) di proteina HER2 secondo i test di immunocitochimica effettuati con il CTA in un laboratorio centrale. I pazienti erano considerati idonei al trattamento con Herceptin se il loro tumore presentava livelli di iperespressione di proteina HER2 pari a 2+ o 3+ (su una scala da 0 a 3+, dove 3+ rappresentava il livello massimo). Un analisi dei sottogruppi di risultati ottenuti da questi studi suggerisce che i pazienti con tessuti fortemente positivi (3+) alla proteina HER2 possono trarre maggiore beneficio dalla cura con Herceptin rispetto ai pazienti con tessuti più debolmente positivi (2+). Potenzialmente il grado di iperespressione della proteina HER2 è un indicatore importante dell eventuale efficacia della terapia con Herceptin. Dal momento che nessuna delle pazienti sottoposte a sperimentazione con Herceptin sono state selezionate utilizzando il test HercepTest, non è nota la correlazione tra il grado di positività e le probabilità di successo clinico della terapia con Herceptin. ( ) P04456IT_01_SK / p. 15/41
16 Carcinoma mammario Studi comparativi Gli studi eseguiti per caratterizzare il test HercepTest sono due. 1) Studio comparativo con il CTA. 2) Studio di accuratezza rispetto ad altri cinque test. Studio comparativo con il CTA (Clinical Trial Assay) Il test HercepTest è stato confrontato con il CTA utilizzato per identificare i pazienti idonei alla terapia con Herceptin. A questo scopo sono stati utilizzati 274 campioni di tessuti di tumore della mammella positivi alla proteina HER2 (2+ o 3+) e altrettanti campioni negativi alla proteina HER2. Nella Tabella 4 sono riportati i risultati in un grafico 2 x 2 dove i valori 0 e 1+ sono stati considerati negativi e i valori 2+ e 3+ sono stati considerati negativi. Tabella 4: Concordanza 2 x 2 del test HercepTest con il CTA (n di campioni) CTA (Clinical Trial Assay) Positivo Negativi Totale HercepTest Positivo Negativi Totale Concordanza: intervallo di confidenza al 95% = 79% (76 82%). La concordanza binaria complessiva tra il test HercepTest e il CTA si è attestata sul 79% (431 casi su 548), con un intervallo di confidenza al 95% bilaterale del 76 82%. Ventuno risultati su cento (21%) sono stati discordanti tra questi due metodi. I risultati del test HercepTest sono classificati su una scala da 0 a 3+ e sono interpretati come segue: negatività all iperespressione della proteina HER2 (intensità della colorazione 0 e 1+); debole positività (intensità della colorazione 2+); forte positività (intensità della colorazione 3+). Tabella 5: Concordanza 3 x 3 del test HercepTest con il CTA CTA (Clinical Trial Assay) Totale HercepTest Totale Questa rappresentazione 3 x 3 dello studio sulla concordanza evidenzia l alta probabilità che una lettura 3+ con il test HercepTest corrisponda ad una lettura positiva con il CTA, cioè risponda ai requisiti di idoneità alla sperimentazione con Herceptin (2+ o 3+). Non è stata invece stabilita una correlazione altrettanto chiara tra una lettura 2+ con il test HercepTest e i risultati del CTA. Nel 42% circa dei casi (53 su 126), le letture 2+ con il test HercepTest sono risultate negative con il CTA (0 o 1+), quindi le pazienti non sarebbero state ammesse alla sperimentazione clinica con Herceptin. ( ) P04456IT_01_SK / p. 16/41
17 Carcinoma mammario Accuratezza Il test HercepTest è stato provato su 2 vetrini per microscopia contenenti sezioni di tessuto incluse in paraffina provenienti da 168 tumori della mammella. In precedenza, questi tumori erano stati caratterizzati con cinque diverse tecniche per la determinazione dell amplificazione del gene HER2 e dell iperespressione della proteina HER2: Southern blot nel laboratorio interno; ibridazione in situ con sonde fluorescenti (FISH) per l amplificazione del DNA; analisi RNA mediante Northern blot; Western blot; immunocitochimica (ICC) su tessuti congelati (28). I risultati sono riassunti nella Tabella 6. Tabella 6: Confronto tra il metodo HercepTest e i risultati combinati (OE) dei metodi di amplificazione dei geni e i test di iperespressione della proteina HER2 Classificazione OE di riferimento + - Totale HercepTest Totale Corrispondenza dei risultati positivi: 43/69 = 62% Corrispondenza dei risultati negativi: 99/99 = 100% I risultati hanno evidenziato un livello di corrispondenza dell 85% (142 casi su 168) (intervallo di confidenza al 95% compreso tra 78% e 89%) tra intensità della colorazione da positività (2+ e 3+) e da negatività (0 e 1+) al test HercepTest. Nessuno dei campioni risultati negativi con i 5 diversi metodi è poi risultato positivo con il test HercepTest. Allo stesso tempo, sommando i risultati dei 5 diversi metodi si è registrato un numero maggiore di casi positivi. Riproducibilità Riproducibilità nella serie La riproducibilità nella serie è stata studiata in un laboratorio utilizzando 5 campioni con punteggi di intensità della colorazione ICC diversi. Ogni campione è stato elaborato in triplicato in modo mascherato e random. Il protocollo è stato applicato con un sistema di colorazione automatizzato. Tutti i campioni hanno generato risultati riproducibili al 100%. Riproducibilità tra serie La riproducibilità tra serie è stata studiata presso tre laboratori per un periodo di 4 giorni, utilizzando 5 campioni con punteggi di intensità della colorazione ICC diversi, selezionati in modo random e mascherati con una metodologia automatizzata. È stata osservata un ottima riproducibilità per i risultati positivi, al contrario dei risultati negativi (0 e 1+ contro 2+ e 3+), fatta eccezione per due campioni in un laboratorio, che hanno presentato una variazione da 1+ a 2+. La riproducibilità per i campioni con punteggi 2+ e 3+ è stata del 100%. Riproducibilità tra laboratori La riproducibilità tra laboratori è stata studiata presso tre laboratori geograficamente distinti, con 40 campioni identici selezionati in modo random e mascherati, i quali esprimevano livelli di intensità della colorazione ICC diversi. I vetrini appena tagliati sono stati inviati a tutti i laboratori scelti per il test, affinché venissero sottoposti a colorazione automatizzata e valutati da un patologo. Il risultato è stato una corrispondenza tra i laboratori tra l 83% e il 90% per una determinazione dicotoma di positività/negatività, dove i valori 0 e 1+ erano negativi e i valori 2+ e 3+ erano positivi all iperespressione della proteina HER2. Rispetto ai risultati ottenuti presso il laboratorio di riferimento che aveva condotto i test per il CTA, è risultata una discrepanza del 12,5% (15 su 120) nei risultati comparativi per la determinazione tra negativi (0 o 1+) e positivi (2+ o 3+). Un ulteriore 10% (12 su 120) dei risultati ha evidenziato una discrepanza tra i punteggi 2+ e 3+. ( ) P04456IT_01_SK / p. 17/41
18 Carcinoma mammario Immunoreattività La Tabella 7 fornisce un quadro dell immunoreattività all HercepTest relativamente alla serie di tessuti normali selezionati. Tutti i tessuti analizzati sono stati fissati in formalina e inclusi in paraffina e successivamente colorati con HercepTest secondo le istruzioni riportate nel foglietto illustrativo del prodotto. Tabella 7. Sommario della reattività a HercepTest dei tessuti normali Tipo di tessuto (n di campioni) Surrenale (3) Midollo osseo (3) Cervello/Cervelletto (3) Cervello/Cervelletto (3) Mammella (3) Collo dell utero (3) Colon (3) Esofago (3) Cuore (3) Rene (3) Fegato (3) Polmone (3) Cellule mesoteliali (3) Ovaio (3) Pancreas (3) Paratiroide (3) Nervo periferico (3) Pituitaria (3) Prostata (3) Ghiandola salivare (3) Muscolo scheletrico (3) Pelle (3) Intestino tenue (3) Milza (3) Stomaco (3) Testicolo (3) Timo (3) Tiroide (3) Tonsilla (3) Utero (3) Colorazione positiva dell elemento tissutale e pattern di colorazione Ghiandola mammaria (2/3 dei tessuti, intensità di colorazione 1+, < 5% delle cellule) Cellule epiteliali (1 su 3 dei tessuti, intensità di colorazione 1+, < 5% delle cellule, membrana e citoplasma, granulare) Cellule epiteliali del follicolo (1 su 3 dei tessuti, intensità di colorazione 1+, < 5% delle cellule, membrana e citoplasma) Epitelio squamoso (1 su 3 dei tessuti, intensità di colorazione 1+, < 5% delle cellule (2 su 3 dei tessuti, intensità di colorazione 2+, < 10-20% delle cellule. Membrana e citoplasma) Tessuto endometriale (2 su 3 dei tessuti, intensità di colorazione 1+, 30-60% delle cellule, citoplasma, granulare) In tutti i tessuti è stata riscontrata la colorazione della membrana, salvo diversa segnalazione. L intensità della colorazione di tutti e tre i campioni di ogni tipo di tessuto era la stessa, salvo diversa segnalazione. ( ) P04456IT_01_SK / p. 18/41
19 Carcinoma mammario Risoluzione dei problemi - Mammella Per informazioni, consultare la sezione Troubleshooting (risoluzione dei problemi) del manuale Dako citato in precedenza (19) oppure contattare l Assistenza Tecnica Dako per riferire di eventuali colorazioni insolite. Problema Probabile causa Intervento consigliato 1. colorazione dei vetrini. 1a. Errore di programmazione. I reagenti non sono stati utilizzati nell ordine corretto. 1a. Controllare il log dei vetrini per verificare che il programma selezionato sia corretto. 2. Colorazione debole dei vetrini. 3. Eccessiva colorazione di fondo dei vetrini. 1b. Sodio azide nella soluzione di lavaggio. 1c. Un riscaldamento eccessivo di sezioni di tessuto montate prima della deparaffinazione e del recupero dell antigene indotto dal calore può portare alla perdita di immunoreattività HER2 visibile. 2a. Recupero dell epitopo insufficiente. 2b. Tempi di incubazione del reagente insufficienti. 2c. È stato utilizzato un metodo di fissazione inadeguato. 2d. Un riscaldamento eccessivo di sezioni di tessuto montate prima della deparaffinazione e del recupero dell antigene indotto dal calore può provocare una diminuzione significativa dell immunoreattività HER2 visibile. 2e. Volume di reagente applicato insufficiente 3a. La paraffina è stata rimossa parzialmente. 3b. Sono stati utilizzati additivi amidacei nel montaggio delle sezioni sui vetrini. 3c. I vetrini sono stati risciacquati male. 3d. Le sezioni si sono asciugate durante la procedura di colorazione. 3e. È stato utilizzato un metodo di fissazione inadeguato. 3f. Legame aspecifico dei reagenti con il tessuto. 1b. Utilizzare solo Dako Wash Buffer, Codice S c. Far asciugare all aria le sezioni di tessuto a temperatura ambiente per un minimo di 12 ore o fino al completamento dell asciugatura. In alternativa, asciugare a 37 C durante la notte o asciugare a 60 C per un massimo di un ora. L asciugatura di sezioni di tessuto a temperature elevate deve essere eseguita solo in un forno calibrato con distribuzione uniforme del calore (17). 2a. Rivedere il log dei vetrini per verificare se il recupero dell epitopo è stato eseguito correttamente. 2b. Rivedere il log dei vetrini per verificare che i tempi di incubazione dei reagenti siano corretti. 2c. Controllare che il tessuto del paziente non sia fissato eccessivamente e che non sia stato utilizzato un fissativo alternativo. 2d. Far asciugare all aria le sezioni di tessuto a temperatura ambiente per un minimo di 12 ore o fino al completamento dell asciugatura. In alternativa, asciugare a 37 C durante la notte o asciugare a 60 C per un massimo di un ora. L asciugatura di sezioni di tessuto a temperature elevate deve essere eseguita solo in un forno calibrato con distribuzione uniforme del calore (17). 2e. Verificare le dimensioni della sezione (22 mm x 22 mm) di tessuto e il volume di reagente applicato. 3a. Utilizzare soluzioni fresche per la deparaffinazione. 3b. Evitare l uso di additivi amidacei per fare aderire le sezioni ai vetrini. Molti additivi sono immunoreattivi. 3c. Rivedere il log dei vetrini per confermare che i vetrini siano stati sciacquati correttamente. 3d. Controllare che sui vetrini sia stato applicato il volume di reagente corretto. 3e. Controllare che sia stato utilizzato un fissativo approvato. L uso di un fissativo alternativo potrebbe provocare una colorazione di fondo eccessiva. 3f. Controllare che il campione sia stato fissato correttamente e verificare la presenza di necrosi. ( ) P04456IT_01_SK / p. 19/41
20 Carcinoma mammario 4. Il tessuto si stacca dai vetrini. 5. Colorazione specifica troppo intensa. 6. Colorazione debole della linea cellulare del vetrino di controllo La soluzione Epitope Retrieval Solution ha un aspetto torbido quando viene riscaldata 8. La soluzione Epitope Retrieval Solution ha un aspetto torbido durante la conservazione (prima di scaldarla) 4a. Uso di vetrini errati. 4a. Utilizzare vetrini silanizzati, ad es. Dako Silanized Slides (Codice S3003), SuperFrost Plus o vetrini polilisinati. 5a. È stato utilizzato un metodo di 5a. Assicurarsi di utilizzare solo i fissativi fissazione inadeguato. 5b. Eccessivi tempi di incubazione del reagente. 5c. È stata utilizzata una soluzione di lavaggio inadeguata. 6a. Il protocollo seguito per il recupero dell epitopo non è corretto. 6b. Assenza di reazione con la soluzione cromogeno-substrato (DAB). 6c. Deterioramento del vetrino di controllo. 7. Quando viene riscaldata, la soluzione assume un aspetto torbido 8. La soluzione è stata conservata in modo scorretto, oppure ne è stata superata la data di scadenza e i metodi di fissazione approvati. 5b. Rivedere il log dei vetrini per verificare che i tempi di incubazione dei reagenti siano corretti. 5c. Utilizzare solo Dako Wash Buffer, Codice S a. Rivedere il log dei vetrini per verificare se il recupero dell epitopo è stato eseguito correttamente. 6b. Rivedere il log della sessione per verificare se il cromogeno è stato preparato correttamente. Rivedere il log dei vetrini per verificare che il tempo di incubazione del cromogeno sia corretto. 6c. Controllare la data di scadenza e le condizioni per la conservazione del kit stampate all esterno della confezione. 7. Ciò è normale e non influisce sulla colorazione. 8. Controllare la data di scadenza e le condizioni per la conservazione del kit stampate all esterno della confezione. Gettare via la soluzione di recupero dell'epitopo. NOTA: Se il problema non è imputabile a nessuna di queste cause o se l'intervento correttivo consigliato non si rivela efficace, contattare l'assistenza Tecnica Dako per ricevere ulteriori suggerimenti. Per ulteriori informazioni sulle tecniche di colorazione e sulla preparazione dei campioni, consultare il manuale disponibile presso Dako che è citato in precedenza: Handbook (19) Atlas of Immunohistology (29) and Immunoperoxidase Techniques. A Practical Approach to Tumor Diagnosis (30). ( ) P04456IT_01_SK / p. 20/41
21 Cenni introduttivi - Gastrico Dati di base Il gene umano HER2 (noto anche con le sigle ERBB2 o NEU) codifica una proteina che è generalmente denominata proteina HER2 o p185 HER2. La proteina HER2 è un recettore di transmembrana ad attività tirosinchinasica con omologia per il recettore del fattore di crescita epidermico (EGFR o HER1) (1-8). La proteina HER2 è un componente normalmente espresso da numerosi tipi di cellule epiteliali (8). L iperespressione della proteina HER2 e l amplificazione del gene HER2 nel cancro gastrico sono stati mostrati in molti studi (31). La positività all HER2 può essere rilevata in circa il 20% dei pazienti tramite IHC o FISH (31). Studi preclinici in vitro e in vivo hanno dimostrato che il trastuzumab (Herceptin ) è efficace in modelli di cancro gastrici differenti, portando così all'avvio di vari studi clinici (31-35). In uno studio di fase III BO18255, lo studio ToGA, i pazienti positivi all HER2 con adenocarcinoma in stadio avanzato localmente inoperabile, ricorrente e/o metastatico dello stomaco o della giunzione esofagea sono stati sottoposti in maniera randomizzata a terapia con 5 FU o capecitabina o cisplatina, da soli o in combinazione con il trastuzumab. È stato rilevato un aumento significativo nella sopravvivenza globale (OS) nei pazienti sottoposti al trattamento combinato di trastuzumab e chemioterapia (36, 37). L Herceptin (trastuzumab) è un anticorpo monoclonale umanizzato10 che presenta un elevata affinità di legame con la proteina HER2 e che, come si è dimostrato, è in grado di inibire la proliferazione delle cellule tumorali umane che iperesprimono la proteina HER2 sia in vitro, sia in vivo (32-35). Caratteristiche 3803 pazienti sono stati analizzati per verificare lo stato di HER2 per l inclusione nello studio ToGA. In questo studio, sia l iperespressione della proteina HER2 tramite IHC (HercepTest, Dako) sia l amplificazione del gene HER2 tramite FISH (HER2 FISH pharmdx, Dako) sono state misurate. Risultati di test validi sono stati ottenuti in 3665 campioni con test IHC o FISH e in 3280 campioni con entrambi i test. I risultati dello studio ToGA hanno mostrato che il 22,1% dei pazienti con cancro gastrico in stadio avanzato è risultato positivo all HER2, rilevato tramite IHC o FISH secondo la definizione dei criteri di selezione HER del ToGA (37). Rispetto all uso dell HercepTest nella valutazione dei pazienti che devono essere dichiarati idonei al trattamento con trastuzumab, vedere il foglietto illustrativo dell Herceptin. Principio della procedura - Gastrico Il test HercepTest contiene i reagenti necessari per completare una procedura di colorazione immunocitochimica a due step su campioni trattati secondo le tecniche di routine e inclusi in paraffina. Dopo l incubazione con l anticorpo primario di coniglio anti-proteina HER2 umana, il kit prevede l impiego di un Visualization Reagent pronto all uso, il quale sfrutta la tecnologia a base di destrano. Il reagente in questione è composto sia da molecole di immunoglobuline secondarie di capra anti-coniglio, sia da molecole di perossidasi di rafano, legate ad una comune catena principale di destrano. Questa tecnologia elimina la necessità di applicare in modo sequenziale un anticorpo di collegamento e un anticorpo coniugato con perossidasi. La reazione crociata del Visualization Reagent con le immunoglobuline umane e il siero fetale di vitello è stata rimossa mediante assorbimento in base solida. La conversione enzimatica del cromogeno aggiunto successivamente dà origine alla formazione di un prodotto di reazione visibile in corrispondenza dell antigene. A questo punto è possibile procedere alla colorazione di contrasto del campione e montare un vetrino coprioggetto. L interpretazione dei risultati avviene per mezzo di un microscopio ottico. Per convalidare le serie di colorazione vengono forniti vetrini di controllo contenenti tre linee cellulari di tumore della mammella umano, debitamente fissati in formalina e inclusi in paraffina, i quali esprimono tre gradi di intensità della colorazione: 0, 1+ e 3+. Vi è una correlazione tra l intensità della colorazione di queste linee cellulari e il numero di recettori presenti in ogni cellula. Il test HercepTest for Automated Link Platforms codice SK001, può essere impiegato per la colorazione automatizzata con piattaforme Link automatizzate Dako. ( ) P04456IT_01_SK / p. 21/41
22 Materiali forniti - Gastrico Codice SK001 Il materiale elencato è sufficiente per effettuare 50 test (50 vetrini incubati con anticorpo primario anti-proteina HER2 e 50 vetrini incubati con il corrispondente reagente di controllo negativo). Il numero di test è calcolato in base all uso di 200 µl di ogni reagente per sezione di tessuto (22 mm x 22 mm), ad eccezione della Epitope Retrieval Solution. Il kit contiene materiale sufficiente per effettuare un massimo di 10 cicli di colorazione singoli. Quantità 1 x 22 ml Descrizione HercepTest Peroxidase-Blocking Reagent Perossido di idrogeno 3% contenente sodio azide (NaN 3) 15 mmol/l. 1 x 12 ml HercepTest Rabbit Anti-Human HER2 Protein Anticorpo pronto all uso isolato per affinità. Viene fornito in Tris/HCl 0,05 mol/l; NaCl 0,1 mol/l; NaN 3 15 mmol/l; ph 7,2 e con proteina stabilizzante. Immunogeno: frammento sintetico C-terminale (parte intracitoplasmica) della proteina HER2 accoppiato a emocianina di patella. Specificità: proteina HER2. Metodo di purificazione: l anticorpo viene isolato per affinità utilizzando un peptide immobilizzato della proteina HER2. 1 x 22 ml HercepTest Visualization Reagent Polimero di destrano coniugato con perossidasi di rafano e immunoglobuline di capra anti-immunoglobuline di coniglio isolate per affinità. Viene fornito in tampone Tris/HCl contenente proteina stabilizzante e un agente antimicrobico. 1 x 10 ml HercepTest Negative Control Reagent Frazione di immunoglobuline di siero di coniglio normale. Concentrazione della proteina equivalente alla concentrazione dell anticorpo anti-proteina HER2. Viene fornito in Tris/HCl 0,05 mol/l; NaCl 0,1 mol/l; NaN 3 15 mmol/l; ph 7,2 e con proteina stabilizzante. 2 x 22 ml HercepTest DAB Substrate Buffer Soluzione tampone substrato, a ph 7,5, contenente perossido di idrogeno < 0,1%, stabilizzanti, enhancer e un agente antimicrobico. 1 x 1 ml Cromogeno DAB HercepTest Soluzione cromogena contenente 3,3 -diaminobenzidina tetraidrocloruro (5%). 3 x 500 ml HercepTest Epitope Retrieval Solution (Containing Detergent) (10x) Tampone citrato 0,1 mol/l con un detergente. 2 x 5 vetrini HercepTest Control Slides Ogni vetrino contiene sezioni di tre linee cellulari di carcinoma mammario che sono state fissate in formalina e incluse in paraffina e che rappresentano livelli diversi di espressione della proteina HER2: MDA-231 (0), MDA-175 (1+) e SK-BR-3 (3+). I vetrini di controllo sono stati trattati termicamente per assicurare una maggiore aderenza delle sezioni al vetro. Se i vetrini vengono sottoposti ad ulteriori trattamenti termici per migliorare l aderenza delle sezioni al vetro, si corre il rischio di compromettere i risultati della colorazione. 10 x flaconi Flacone per reagente riempibile da parte dell utente, da 12 ml di capacità Ogni flacone può contenere 12 ml di reagente. Utilizzare i flaconi per la miscelazione e la conservazione della soluzione cromogeno-substrato (fare riferimento anche alla sezione Preparazione dei Reagenti). Viene fornito all interno di una busta separata. ( ) P04456IT_01_SK / p. 22/41
23 Materiali necessari ma non forniti - Gastrico Precauzioni - Gastrico Dako Wash Buffer, codice S3006 Colorante di contrasto: ematossilina, ad esempio Hematoxylin for Automated Link Platforms (codice SK308) Vetrini coprioggetto Acqua distillata o deionizzata Forno essiccante, in grado di mantenere una temperatura di 60 C o inferiore Etanolo, assoluto e al 95% Microscopio ottico (ingrandimento obiettivo 4-40x) Mezzo di montaggio, ad esempio Dako Faramount (codice S3025) o Dako Glycergel (codice C0563) Tessuti positivi e negativi da utilizzare come controlli di lavoro (vedere Controllo della qualità) Vetrini SuperFrost Plus, vetrini polilisinati oppure silanizzati, come Dako Silanized Slides (codice S3003) Xilene, toluene o sostituti dello xilene Il kit SK001 è formulato appositamente per l uso con piattaforme Link automatizzate Dako. Per ulteriori informazioni, consultare il manuale dell utente per le piattaforme Link automatizzate Dako. 1. Per uso diagnostico in vitro. 2. Per uso professionale. 3. Questo prodotto contiene sodio azide (NaN 3), una sostanza chimica fortemente tossica in forma pura. Sebbene non sia classificato come prodotto a rischio, la sodio azide alle concentrazioni indicate può reagire con il rame e il piombo delle tubature formando azidi metalliche fortemente esplosive. Durante lo smaltimento, sciacquare le tubature con abbondante acqua per prevenire l eventuale accumulo di azide (21). 4. HercepTest Peroxidase-Blocking Reagent, contiene perossido di idrogeno 3%. Su richiesta è disponibile una scheda di sicurezza per utenti professionisti. 5. HercepTest Rabbit Anti-Human HER2 Protein, HercepTest Visualization Reagent ed HercepTest Negative Control Reagent contengono materiale di origine animale. 6. Adottare le normali procedure previste per il trattamento dei prodotti di origine biologica. 7. I vetrini di controllo e i campioni, sia prima che dopo la fissazione, e tutti i materiali che entrano in contatto con essi devono essere trattati come materiali potenzialmente capaci di trasmettere un infezione, pertanto devono essere smaltiti assumendo tutte le precauzioni necessarie (22). Non pipettare mai i reagenti per bocca ed evitare che reagenti e campioni entrino in contatto con la pelle e le membrane mucose. In caso di contatto dei reagenti con zone sensibili, lavare la zona con abbondante acqua. ( ) P04456IT_01_SK / p. 23/41
24 8. Evitare la contaminazione batterica dei reagenti, altrimenti potrebbe verificarsi un incremento della colorazione non specifica. 9. Tempi, temperature e modalità di incubazione diversi da quelli specificati possono generare risultati erronei. Un asciugatura eccessiva per più di un ora a 60 C può causare una diminuzione significativa o la perdita dell immunoreattività HER2 specifica associata alla membrana (17). 10. I reagenti sono stati diluiti in modo ottimale. Ulteriori diluizioni potrebbero causare la perdita di colorazione antigenica. 11. Tutti i reagenti sono formulati in modo specifico per questo test. Affinché il test abbia il livello di rendimento specificato, evitare sostituzioni di qualsiasi genere. 12. HercepTest Visualization Reagent ed HercepTest DAB Chromogen possono subire alterazioni se esposti a livelli di luce eccessivi. Non conservare i componenti del kit e non eseguire la colorazione in condizioni di luce intensa, ad esempio sotto la luce diretta del sole. 13. Per un'interpretazione precisa dei risultati dell'herceptest su campioni bioptici sottoposti a colorazione provenienti da adenocarcinomi gastrico con giunzione gastroesofagea, si consiglia un gruppo di almeno 5 cellule tumorali sottoposte a colorazione. Un cluster id almeno 5 cellule tumorali sottoposte a colorazione è composto di 5 cellule tumorali sottoposte a colorazione HER connesse. 14. Per ottenere un risultato affidabile, a causa della natura eterogenea dei campioni bioptici di cancro gastrico, è importante eseguire l'analisi IHC dell'her2 su campioni bioptici multipli (7-8) provenienti da regioni diverse del tumore. 15 Quando si osserva un livello elevato di eterogeneità nel campione, si consiglia di analizzare più blocchi di tessuto da resezioni di cancro gastrico (40). 16. Indossare indumenti di protezione personale adeguati, per evitare il contatto con gli occhi e la pelle. 17. Una soluzione inutilizzata deve essere smaltita secondo le direttive locali, statali e federali. 18. L uso di volumi di reagente diversi da quelli raccomandati può comportare la perdita di immunoreattività HER2 visibile. Sezioni di tessuto maggiori di 22 mm x 22 mm richiedono l applicazione di 2-3x 200 µl di reagente in 2-3 aree di applicazione automatizzata. 19. Su richiesta, è disponibile una scheda di sicurezza per utenti professionisti. 20. HercepTest DAB Chromogen contiene 3,3 -diaminobenzidina tetraidrocloruro (bifenil-3,3,4,4 - tetrail tetra ammonio tetracloruro) all 1-5% e presenta un etichetta: Pericolo H350 Può provocare il cancro. H341 Sospettato di provocare alterazioni genetiche. P201 Procurarsi istruzioni specifiche prima dell uso. P280 Indossare guanti protettivi. Fare uso di un dispositivo di protezione degli occhi o del viso. Indossare indumenti protettivi. P308 + P313 IN CASO di esposizione o di possibile esposizione: Richiedere assistenza medica. P405 Conservare sotto chiave. P501 Smaltire il prodotto e il recipiente secondo ogni regolamento locale, regionale, nazionale e internazionale. 21. Residui di paraffina possono generare risultati falsi negativi. Di norma, l utilizzo di questo prodotto non è consentito ai minori di 18 anni. Gli utenti devono essere accuratamente informati relativamente alla procedura di lavoro adeguata, alle proprietà pericolose del prodotto e alle istruzioni di sicurezza necessarie (secondo la Direttiva dell Unione Europea 94/33/EC). Per ulteriori informazioni, fare riferimento alla scheda dati di sicurezza (Safety Data Sheet, SDS) corrispondente. USA: la sostanza 3,3 -diaminobenzidina (DAB) può essere nociva per inalazione, a contatto con la pelle e per ingestione. Materiale irritante per gli occhi e la pelle. In caso di contatto con la pelle, sciacquare le aree interessate con acqua e sapone. NOTA: sebbene la diaminobenzidina sia strutturalmente correlata alla benzidina, non esistono prove che la diaminobenzidina abbia proprietà cancerogene. Per lo smaltimento, attenersi alle normative locali, regionali o nazionali in materia. Conservazione - Gastrico Conservare a 2 8 C quando non in uso su piattaform e Dako Automated Link. Conservare HercepTest Peroxidase-Blocking Reagent, HercepTest Visualization Reagent, HercepTest DAB Substrate Buffer e HercepTest DAB Chromogen al buio a 2 8 C. Non utilizzare il kit dopo la data di scadenza stampata all esterno della confezione. Se i reagenti sono conservati in condizioni diverse da quelle specificate, l utente deve verificarne le condizioni (14a, 14b). Si fa presente che anche i vetrini di controllo devono essere conservati a 2 8 C. Non sono stati osservati segni evidenti che suggeriscano l instabilità di questo prodotto, pertanto è opportuno analizzare un controllo positivo e un controllo negativo insieme ai campioni dei pazienti. Qualora si ottenga una colorazione imprevista, che non sia cioè giustificata da un cambiamento delle procedure di laboratorio ma sia dovuta ad un probabile problema del test HercepTest, contattare immediatamente l Assistenza Tecnica Dako. ( ) P04456IT_01_SK / p. 24/41
25 Specimen preparation (Allestimento tessuto) - Gastrico I campioni di adenocarcinoma gastrico con giunzione gastroesofagea provenienti da biopsie, escissioni o resezioni devono essere manipolati correttamente in modo da preservare il tessuto per la colorazione immunocitochimica. Adottare i metodi standard per il trattamento dei tessuti di tutti i campioni. 15 Durante l analisi di piccoli campioni bioptici, verificare la morfologia integra del tumore e la presenza di cellule tumorali sufficienti per la valutazione IHC. Se si esegue l'analisi HercepTest su un campione proveniente da biopsia, è necessario analizzare più (7-8) campioni bioptici da differenti regioni del tumore, al fine di garantire un'accurata determinazione dello stato dell'her2. Sezioni incluse in paraffina Sono idonei all uso i tessuti conservati in formalina tamponata neutra e inclusi in paraffina. Per esempio, i campioni devono essere bloccati in uno spessore di 3 o 4 mm e fissati per ore in formalina tamponata neutra. Nello studio ToGA, i campioni bioptici sono stati fissati per 6-8 ore (per riferimenti sullo studio, vedere (36)). I tessuti vengono successivamente disidratati attraverso il passaggio in una serie di alcoli e in xilene e sottoposti ad infiltrazione di paraffina fusa ad una temperatura non superiore a 60 C. I tessuti che esprimono l HER2, quando vengano sottoposti a fissazione e inclusione in modo corretto e siano conservati al fresco (15 25 C), preservano la loro morfologia a tempo indet erminato prima del taglio delle sezioni e del montaggio su vetrino (15,16). Negli Stati Uniti, la norma 42 CFR (b) del Clinical Laboratory Improvement Act del 1988 prevede che i laboratori devono conservare i vetrini colorati per almeno dieci anni dalla data del saggio e devono altresì conservare blocchi di campioni per almeno due anni dalla data del saggio (16). I campioni di tessuto devono essere tagliati in sezioni di 4 5 µm, montati su vetrini e asciugati all aria a temperatura ambiente per un minimo di 12 ore (o fino all asciugatura) o a 37 C durante la notte o a 6 0 C per un ora. AVVISO: un calore eccessivo per più di un ora a 60 C può causare una diminuzione significativa o l a perdita dell immunoreattività HER2 specifica associata alla membrana (17). Per preservare l antigenicità, è necessario che le sezioni di tessuto montate sui vetrini (SuperFrost Plus, polilisinati, a carica positiva o vetrini silanizzati) vengano sottoposte alla procedura di colorazione entro 4-6 settimane dal sezionamento, purché conservate a temperatura ambiente (20 25 C) (18). I vetrini da uti lizzare per la valutazione della proteina HER2 e per la verifica della presenza di tumore devono essere preparati in contemporanea. Si consiglia di preparare almeno 5 vetrini: 1 per la presenza di tumore, 2 per la valutazione della proteina HER2 (uno per l incubazione con l anticorpo di coniglio anti-proteina HER2 umana e uno per l incubazione con il reagente di controllo negativo), più 2 vetrini di riserva. Per preservare l antigenicità, le sezioni di tessuto già montate sui vetrini (SuperFrost Plus, Poly-L-lysine o vetrini silanizzati) dovranno essere sottoposte alla colorazione entro 4 6 settimane dal sezionamento se conservate a temperatura ambiente (20 25 C) (18). L uso del test HercepTest su tessuti decalcificati non è stato approvato ed è fortemente sconsigliato. Consultare la pubblicazione Dako intitolata Education Guide: Immunochemical Staining Methods (19) e i riferimenti bibliografici 15 e 16 per ulteriori informazioni sulla preparazione dei campioni. Trattamento dei campioni prima della colorazione Per conseguire un rendimento ottimale del test, è necessario utilizzare un metodo di recupero dell epitopo in tampone citrato 0,01 mol/l. La soluzione idonea allo scopo è inclusa nel kit HercepTest. Questo metodo richiede il riscaldamento delle sezioni di tessuto montate su vetrini immerse in 0,01 mol/l di tampone citrato (20) a bagnomaria calibrato o Dako PT Link (Codice PT101 e PT200) alla temperatura richiesta (95 99 C ). I laboratori situati ad altitudini più elevate devono definire il metodo migliore per mantenere la temperatura richiesta. Gli altri metodi di recupero dell epitopo che sono stati esaminati non hanno assicurato la riproducibilità dei risultati. Eventuali variazioni della procedura descritta potrebbero compromettere i risultati. Preparazione dei reagenti - Gastrico Per ragioni di praticità, prima di procedere alla colorazione è opportuno preparare i reagenti elencati di seguito: Epitope Retrieval Solution Diluire la soluzione HercepTest Epitope Retrieval Solution con un rapporto 1:10 utilizzando acqua distillata o deionizzata, in quantità sufficiente per completare la procedura di colorazione pianificata. La soluzione diluita può essere utilizzata a temperatura ambiente per una settimana oppure può essere conservata a 2 8 C p er un mese. Eliminare la soluzione diluita se appare torbida. Per ulteriori informazioni, fare riferimento al manuale dell utente per piattaforme Link automatizzate Dako. Tampone di lavaggio Diluire una quantità sufficiente di Dako Wash Buffer (Codice S3006) con un rapporto 1:10 utilizzando acqua distillata o deionizzata. Il tampone diluito può essere utilizzato a temperatura ambiente per una settimana oppure può essere conservato a 2 8 C per un mese. Eliminare la soluzione tampone se appare torbida. Per ulteriori informazioni, fare riferimento al manuale dell utente per piattaforme Link automatizzate Dako. ( ) P04456IT_01_SK / p. 25/41
26 Soluzione cromogeno-substrato (DAB) Preparare una soluzione cromogeno-substrato nei flaconi riempibili dall utente addizionando 25 µl di DAB Chromogen per 1 ml di DAB Substrate Buffer quindi miscelare. La soluzione substrato-cromogeno (DAB) così preparata è stabile per circa 5 giorni se conservata a 2 8 C. La soluzione deve essere agitata bene p rima dell uso. La comparsa di qualsiasi precipitato all interno della soluzione non ne altera la qualità di colorazione. Il flacone riempibile dall utente contenente la soluzione miscelata cromogeno-substrato deve essere identificato nella piattaforma Link automatizzata Dako prima dell uso. Fare riferimento alla guida per l utente per maggiori informazioni inerenti la piattaforma Link automatizzata Dako. NOTA: il colore del DAB Chromogen può passare da una tonalità chiara a un marrone acceso. Tutto ciò non altera le prestazioni del prodotto. Per la diluizione, seguire le linee guida contenute nell inserto. L aggiunta in eccesso di DAB Chromogen al DAB Buffered Substrate può determinare un deterioramento del segnale positivo. Colorazione di contrasto Il prodotto finale della reazione di colorazione DAB è insolubile in alcol e in acqua. Come colorante di contrasto è possibile utilizzare il prodotto Hematoxylin per piattaforme Link automatizzate (Codice SK308). La procedura e i tempi di incubazione sono preimpostati nel software Dako Link. Non occorre preparare il reagente. Mezzo di montaggio Si consiglia di usare un mezzo di montaggio permanente e non acquoso. Tuttavia è accettabile anche un montaggio acquoso. Come mezzi di montaggio acquoso si consigliano i prodotti Dako Faramount Aqueous Mounting Medium, Ready-to-Use (Codice S3025) o Dako Glycergel Mounting Medium (codice C0563). Liquefare Glycergel prima dell uso riscaldando il mezzo fino a 40 C (±5) circa. Procedura per la colorazione - Gastrico Note sulla procedura Prima dell uso, si consiglia di leggere attentamente le istruzioni fornite di seguito e studiare le caratteristiche di tutti i componenti (vedere la sezione Precauzioni). Evitare che le sezioni di tessuto si secchino in qualsiasi momento della procedura di colorazione. Le sezioni di tessuto secche possono presentare una maggiore colorazione aspecifica. La procedura e i tempi di incubazione per la colorazione sono preimpostati nel software Dako Link. Per istruzioni dettagliate sui protocolli di programmazione e sul caricamento di vetrini e reagenti, consultare il manuale dell utente per piattaforme Link automatizzate Dako. Se la procedura di colorazione viene interrotta, è possibile conservare i vetrini in un bagno tampone dopo l incubazione dell anticorpo primario, per non più di un ora a temperatura ambiente (20 25 C), senza ripercussioni sui risultati della colorazione. Deparaffinazione e reidratazione Prima della colorazione, i vetrini contenenti i tessuti devono essere deparaffinati per rimuovere il mezzo di inclusione e successivamente reidratati. Evitare la rimozione incompleta della paraffina. La presenza di eventuali residui del mezzo di inclusione può provocare un aumento della colorazione aspecifica. Questa operazione deve essere eseguita a temperatura ambiente (20 25 C). 1. Immergere i vetrini in un bagno di xilene e incubare per 5 (±1) minuti. Cambiare il bagno e ripetere il procedimento. 2. Picchiettare i vetrini per eliminare il liquido in eccesso e immergerli in etanolo assoluto per 3 (±1) minuti. Cambiare il bagno e ripetere il procedimento. 3. Picchiettare i vetrini per eliminare il liquido in eccesso e immergerli in etanolo al 95% per 3 (±1) minuti. Cambiare il bagno e ripetere il procedimento. 4. Picchiettare per eliminare il liquido in eccesso e immergere i vetrini in acqua distillata o deionizzata per almeno 30 secondi. Avviare la procedura di colorazione come delineato nella sezione protocollo di colorazione sotto recupero dell epitopo. Soluzioni alcoliche e allo Xilene devono essere cambiate dopo 40 vetrini. Utilizzare derivati allo xilene o al toluene, come ad esempio Histoclear. NOTA: le istruzioni e i reagenti forniti in questo kit sono stati studiati per assicurare prestazioni ottimali. L ulteriore diluizione dei reagenti o una variazione delle temperature di incubazione potrebbero generare risultati erronei o discordanti. Le differenze che esistono tra i laboratori (per quanto riguarda il modo di trattare il tessuto o di eseguire le procedure tecniche) possono compromettere la validità dei risultati del test in quanto strumento di selezione dei pazienti idonei alla terapia con Herceptin. Protocollo di colorazione La procedura e i tempi di incubazione per la colorazione sono preimpostati nel software della piattaforma Link automatizzata Dako. Dopo la rimozione della paraffina e la reidratazione, e il recupero dell epitopo inizia l elaborazione dei vetrini sullo strumento secondo le modalità descritte di seguito. ( ) P04456IT_01_SK / p. 26/41
27 Fase 1: recupero dell epitopo Riempire i serbatoi Dako PT Module o la vaschetta per colorazione, ad es. vaschetta Coplin,con Epitope Retrieval Solution (fare riferimento alla preparazione dei reagenti). Per Dako PT Link (Codice PT101 e PT200): preriscaldare la soluzione diluita Epitope Retrieval nel serbatoio Dako PT Link a una temperatura di 85 C. Durante il riscaldamento, la soluzione Epitope Retrieval Solution assume un aspetto torbido. Posizionare le sezioni prive di paraffina a temperatura ambiente nei cestelli dei reagenti ed immergere i vetrini nella soluzione preriscaldata Epitope Retrieval Solution. Lasciare riscaldare Dako PT Link fino a 97 C e incubare per 40 minuti (±1) a 97 C. Lasciare raffreddare le sezioni in Dako PT Link finché la temperatura non raggiunge 85 C. Rim uovere i serbatoi PT Link con le sezioni da Dako PT Link. Lasciare i serbatoi sul tavolo per 10 minuti senza coperchio per raffredare ulteriormente. Lavare le sezioni con Wash Buffer. Per ulteriori informazioni, fare riferimento alla guida per utente di Dako PT Link. Per le vaschette Coplin: immergere in un bagnomaria le vaschette per la colorazione contenenti la soluzione diluita Epitope Retrieval Solution. Riscaldare il bagnomaria e la soluzione Epitope Retrieval Solution fino a C. Durante il riscaldamento, la soluzione Epito pe Retrieval Solution assume un aspetto torbido. Coprire le vaschette con i coperchi in modo da stabilizzare la temperatura e impedire l evaporazione. Immergere le sezioni deparaffinate a temperatura ambiente nelle vaschette con la soluzione Epitope Retrieval Solution precedentemente riscaldata. Riportare la temperatura del bagnomaria e della soluzione Epitope retrieval solution a C. Incubare per 40 minuti (±1) a C. Rimuovere tutta la vaschetta con i v etrini dal bagnomaria. Lasciare i vetrini a temperatura ambiente nella soluzione Epitope Retrieval Solution per 20 minuti (±1), in modo che si raffreddino. Decantare la soluzione Epitope Retrieval Solution e lavare le sezioni nel tampone di lavaggio. Per conseguire prestazioni ottimali, immergere le sezioni nel tampone di lavaggio per 5 20 minuti dopo il recupero dell epitopo e prima della colorazione. NOTA: la soluzione Epitope Retrieval Solution è un prodotto monouso, idoneo a una sola applicazione. Non riutilizzare. Fase 2: procedura di colorazione Dopo il recupero dell epitopo, i vetrini posizionati nei cestelli dello strumento vengono collocati sulle piattaforme Link automatizzate Dako. Lo strumento esegue la procedura di colorazione opportuna applicando il reagente, monitorando il tempo di incubazione e sciacquando i vetrini tra un reagente e l altro. I tempi di incubazione sono preimpostati nel software Link Dako. Fase 3: colorazione di contrasto I vetrini possono essere sottoposti a colorazione di contrasto con Hematoxylin per piattaforme Link automatizzate Dako (Codice SK308). I protocolli di colorazione disponibili nel software Dako sono 2: uno prevede l uso dell ematossilina e uno no. Il tempo di incubazione con l ematossilina è preimpostato nel protocollo che prevede l uso di questa colorazione di contrasto. Per ulteriori informazioni sui protocolli, consultare il manuale dell utente Piattaforme Link automatizzate Dako. Fase 4: montaggio Si consiglia di usare un mezzo di montaggio permanente e non acquoso. Diversamente, è accettabile anche un mezzo di montaggio acquoso. È possibile montare i campioni e applicare i vetrini coprioggetto con un mezzo di montaggio acquoso, come ad esempio Dako Faramount (Codice S3025) o Dako Glycergel (codice C0563). Controllo di qualità - Gastrico NOTA: è possibile leggere i vetrini in qualunque momento. È tuttavia possibile che si verifichi un certo grado di scolorimento se i vetrini vengono coperti con un mezzo di montaggio acquoso e vengono esposti alla luce intensa per un periodo di una settimana. Per evitare che ciò accada, conservare i vetrini al buio a temperatura ambiente (20 25 C). Se le procedure consigliate per la fissazione, il trattamento e l inclusione dei tessuti vengono modificate in laboratorio, è possibile che i risultati presentino una certa variabilità. n tal caso, oltre ad utilizzare i vetrini di controllo forniti da Dako, occorre effettuare tutta una serie di controlli interni con regolarità. Negli Stati Uniti, vedere il riferimento n. (23) in Bibliografia e attenersi alle seguenti linee guida di controllo della qualità approvate: College of American Pathologists (CAP) Certification Program for Immunohistochemistry; CLSI (precedentemente NCCLS) Quality Assurance for Immunocytochemistry, Approved Guideline (24). ( ) P04456IT_01_SK / p. 27/41
28 Tabella 8: Finalità del controllo di qualità giornaliero Tessuto: fissato e trattato come il campione del paziente Controllo positivo: tessuti o cellule che contengono l antigene bersaglio da individuare (potrebbe essere presente nel tessuto del paziente). Il controllo ideale è un tessuto con una colorazione positiva debole, in quanto è più sensibile al deterioramento dell anticorpo o dell antigene. Controllo negativo: tessuto o cellule che si presume negativi (potrebbero trovarsi nel tessuto del paziente o nel tessuto di controllo positivo). Tessuto del paziente Vetrino di controllo fornito da Dako Anticorpo specifico e sistema di rivelazione Controllo di tutte le fasi dell analisi. Convalida delle procedure e dei reagenti utilizzati per la colorazione HER2. Rilevamento di una reattività crociata indesiderata dell anticorpo rispetto alle cellule e/o ai componenti cellulari. Rilevamento della colorazione specifica. Controllo della sola procedura di colorazione. Anticorpo non specifico* o tampone + stesso sistema di rivelazione usato con l anticorpo specifico Rilevamento della colorazione di fondo aspecifica. Rilevamento della colorazione di fondo aspecifica. Rilevamento della colorazione di fondo aspecifica. * Siero proveniente dalla stessa specie dell anticorpo specifico, ma non diretto contro lo stesso antigene bersaglio. Per individuare legami aspecifici con l anticorpo, ad es. legame della porzione Fc dell anticorpo ad opera del tessuto. Vetrino di controllo (fornito) Tutti i vetrini di controllo forniti nel kit contengono tre linee cellulari umane pellettizzate, fissate in formalina e incluse in paraffina, con valori di intensità di colorazione pari a 0, 1+ e 3+. È necessario utilizzare un vetrino in ogni procedura di colorazione. Valutando le linee cellulari sul vetrino di controllo fornito da Dako è possibile verificare la validità della procedura di colorazione. Tessuto di controllo positivo I controlli dovrebbero essere costituiti da campioni freschi di autopsia/biopsia/chirurgia che sono stati fissati, trattati e inclusi in paraffina nei tempi più brevi possibili, seguendo la medesima procedura utilizzata per i campioni dei pazienti da analizzare. I controlli positivi confermano se i tessuti sono stati preparati correttamente e se sono state adottate tecniche di colorazione corrette. È necessario includere un tessuto di controllo positivo per ogni set di condizioni di analisi previsto in ogni ciclo di colorazione. I controlli positivi devono produrre una colorazione positiva debole, così da evidenziare variazioni leggere nella sensibilità dell anticorpo primario. Se trattati diversamente dai campioni dei pazienti, i vetrini di controllo di questo kit o i campioni consentono di convalidare soltanto il rendimento del reagente, ma non di verificare la preparazione del tessuto. Utilizzare come controllo positivo ideale un tessuto di adenocarcinoma gastrico con giunzione gastroesofagea in cui l'iperespressione di proteina HER2 abbia prodotto un risultato di positività 2+ in un test precedente. NOTA: i controlli positivi noti devono essere utilizzati esclusivamente per verificare il corretto rendimento dei tessuti trattati e dei reagenti per analisi, NON per formulare una diagnosi specifica dei campioni dei pazienti. Se i controlli positivi non producono una colorazione positiva, significa che i risultati ottenuti con i campioni dei pazienti analizzati non sono da ritenersi validi. Tessuto di controllo negativo In ogni ciclo di colorazione è necessario utilizzare un tessuto di controllo negativo (negativo alla proteina HER2) che sia stato fissato, trattato e incluso in paraffina secondo la medesima procedura adottata per i campioni dei pazienti da analizzare. In questo modo è possibile verificare la specificità dell anticorpo primario e fornire un indicazione della colorazione di fondo specifica. Il colon, il fegato e la tiroide sono idonei ad essere impiegati come tessuti di controllo negativi. Molteplici tipi di cellule presenti nella maggior parte delle sezioni tissutali offrono siti interni di controllo negativo (è necessaria una verifica dell utente). Se si osserva una colorazione specifica nel tessuto di controllo negativo, i risultati ottenuti con i campioni dei pazienti analizzati non sono da ritenersi validi e il test deve essere rieseguito. Per ulteriori informazioni sulla programmazione dei vetrini di controllo, consultare il manuale dell utente per le piattaforme Link automatizzate Dako. Reagente di controllo negativo aspecifico Al posto dell anticorpo primario, è possibile utilizzare il reagente di controllo negativo (fornito nel kit) su una sezione di ogni campione con lo scopo di valutare la colorazione aspecifica e favorire l interpretazione della colorazione specifica nel sito dell antigene. Il periodo di incubazione del reagente di controllo negativo deve corrispondere a quello dell anticorpo primario. ( ) P04456IT_01_SK / p. 28/41
29 Verifica del saggio Prima di utilizzare per la prima volta un sistema di colorazione in una procedura diagnostica, l utente deve verificare la specificità del test applicandolo ad una serie di tessuti interni con caratteristiche note di rendimento IHC, che rappresentano tessuti positivi e negativi noti. Fare riferimento alle procedure sul controllo della qualità descritte in questa sezione del foglietto illustrativo e ai requisiti descritti nelle istruzioni CAP Certification Program for Immunohistochemistry e/o CLSI (precedentemente NCCLS) Quality Assurance for Immunocytochemistry, Approved Guideline (23). Le procedure per il controllo della qualità vanno ripetute per ogni nuovo lotto di anticorpi o tutte le volte che viene apportata una modifica ai parametri del saggio. Per la verifica del saggio, sono adatti i carcinomi gastrici con giunzione gastroesofagea con intensità di colorazione della proteina HER2 nota nella scala 0-3+ e i tessuti negativi, ad es. colon, fegato o tiroide. Interpretazione della colorazione - Gastrico Ai fini della determinazione dell espressione di proteina HER2, si devono valutare solo il pattern e l intensità della colorazione della membrana, facendo riferimento alla scala dei valori illustrata nella Tabella 9. La valutazione dei vetrini deve essere effettuata da un patologo qualificato, con un microscopio ottico. Per la valutazione della colorazione immunocitochimica e l assegnazione di un punteggio, occorre utilizzare un obiettivo con ingrandimento 10x. Per confermare il punteggio è utile un obiettivo 5-40x. La colorazione citoplasmatica deve essere considerata non specifica e non deve essere inclusa nell accertamento dell intensità di colorazione della membrana (8). Per indicazioni nella differenziazione dei valori di colorazione 0, 1+, 2+, and 3+, fare riferimento alle figure rappresentative di intensità e pattern di colorazione riportate nel manuale di interpretazione della colorazione HercepTest di Dako ( HercepTest Interpretation Manual Gastric Cancer ). Limitare la valutazione ai soli campioni provenienti da pazienti affetti da adenocarcinoma gastrico con giunzione gastroesofagea. In caso di metaplasia intestinale e adenocarcinoma gastrico presenti nello stesso campione, limitare la valutazione al solo componente dell'adenocarcinoma gastrico. Per l'interpretazione di campioni bioptici sottoposti a colorazione con HercepTest, si consiglia di utilizzare un gruppo di almeno 5 cellule tumorali sottoposte a colorazione. Un cluster id almeno 5 cellule tumorali sottoposte a colorazione è composto di 5 cellule tumorali sottoposte a colorazione HER connesse. Tabella 9. Interpretazione e punteggio della colorazione immunoistochimica dell HER2 Punteggio Campione chirurgico Pattern di colorazione reattività o nessuna reattività membranosa in <10% delle cellule tumorali Reattività membranosa scarsamente percettibile in 10% delle cellule tumorali; le cellule sono reattive sono in parte della membrana Reattività membranosa basolaterale o laterale, completa, da debole a moderata in 10% delle cellule tumorali Reattività membranosa basolaterale o laterale, completa, forte in 10% delle cellule tumorali Campione bioptico Pattern di colorazione reattività o nessuna reattività membranosa in nessuna cellula tumorale (o <5 in cluster) Cluster di cellule tumorali ( 5 cellule) con una reattività membranosa scarsamente percettibile indipendentemente dalle cellule tumorali sottoposte a colorazione Cluster di cellule tumorali ( 5 cellule) con una reattività membranosa laterale o basolaterale completa, da debole a moderata, indipendentemente dalle cellule tumorali sottoposte a colorazione Cluster di cellule tumorali ( 5 cellule) con una reattività membranosa laterale o basolaterale completa, forte, indipendentemente dalle cellule tumorali sottoposte a colorazione Valutazione dell iperespressione HER2 Negativo Negativo Equivoco Positivo Linee guida basate su Hofmann et al. (39). Il test HercepTest produce un risultato di negatività all iperespressione della proteina HER2 (punteggio 0 e 1+), un risultato equivoco (punteggio 2+) e un risultato positivo (punteggio 3+). Il test HercepTest non è idoneo a fornire informazioni prognostiche al paziente e al medico e il suo impiego in questo senso non è stato approvato. Ad ogni ciclo di colorazione, è importante esaminare i vetrini in una sequenza specifica (vedere Tabella 10), in modo da poter determinare la validità della sessione di analisi ed effettuare una valutazione semiquantitativa dell intensità della colorazione del tessuto campione. ( ) P04456IT_01_SK / p. 29/41
30 Tabella 10: Sequenza di valutazione dei vetrini Ordine di lettura dei vetrini 1. Vetrino di controllo contenente le tre linee cellulari Logica Un test valido è confermato da: presenza di colorazione marrone 3+ nella membrana cellulare (rimming) per quanto riguarda la linea cellulare di controllo 3+ (Control Cell Line SK-BR-3); rimming parziale marrone per quanto riguarda la linea cellulare di controllo 1+ (Control Cell Line MDA-175); colorazione assente per quanto riguarda la linea cellulare di controllo 0 (Control Cell Line MDA-231). Colorazione discontinua e punteggiata presente in un numero di cellule esiguo nella zona positiva 1+ (Control Cell Line MDA-175)e, sempre in questa linea cellulare, immunocolorazione a puntini anche nella zona di Golgi del citoplasma. 2. Vetrino con il tessuto di controllo positivo 3. Vetrino con il tessuto di controllo negativo 4. Vetrino con il tessuto del paziente, colorato con il reagente di controllo negativo 5. Vetrino con il tessuto del paziente, colorato con l anticorpo primario Presenza di colorazione marrone nella linea cellulare di controllo 0 (Control Cell Line MDA-231), ovvero negatività alla proteina HER2. Indica che non c è stata colorazione aspecifica durante il test. I risultati del test potrebbero non essere validi a causa dell eccessiva colorazione. Possibile presenza di colorazione marrone della membrana. La colorazione del citoplasma e dei tessuti negativi non deve superare 1+. L ASSENZA di colorazione specifica nel tessuto di controllo negativo conferma l assenza di reattività crociata con cellule/componenti cellulari. In caso di colorazione specifica della membrana nel tessuto di controllo negativo, i risultati ottenuti con i campioni dei pazienti non sono da ritenersi validi. L assenza di colorazione specifica della membrana conferma che l anticorpo primario marca in modo specifico l antigene bersaglio. Se il citoplasma dei campioni trattati con il reagente di controllo negativo (ad es. nel tessuto connettivo, nei leucociti, negli eritrociti o nel tessuto necrotico) si colora di marrone o di un altra tonalità scura, si è in presenza di colorazione di fondo aspecifica (da riferire nella sezione riservata ai commenti del foglio dati). Quando nel campione viene individuata l iperespressione di proteina HER2, compare un rimming marrone circoscritto alla membrana cellulare delle cellule tumorali che sono state trattate con l anticorpo primario. 1. Vetrino di controllo (fornito): il primo vetrino di controllo da analizzare è quello sottoposto a colorazione con HercepTest, il quale consente di verificare il corretto funzionamento di tutti i reagenti. La presenza di un prodotto della reazione di colore marrone (3,3 -diaminobenzidina, DAB) in corrispondenza della membrana cellulare indica reattività positiva. Un test valido è confermato da: presenza di colorazione marrone (rimming) nella circonferenza della membrana cellulare per quanto riguarda la linea cellulare di controllo 3+ (Control Cell Line SK-BR-3); rimming parziale marrone per quanto riguarda la linea cellulare di controllo 1+ (Control Cell Line MDA-175); colorazione assente per quanto riguarda la linea cellulare di controllo 0 (Control Cell Line MDA-231). Se anche una sola delle linee cellulari di controllo fornite produce risultati che esulano dai criteri descritti, tutti i risultati ottenuti con i campioni dei pazienti sono da ritenersi non validi. 2. Tessuto di controllo positivo: il secondo vetrino da analizzare è quello con il tessuto di controllo positivo. Questo vetrino consente di verificare l efficacia del metodo di fissazione e del processo di recupero dell epitopo. Per l interpretazione dei risultati della colorazione, prendere in considerazione le cellule intatte, in quanto le cellule necrotiche o degradate assumono spesso una colorazione aspecifica (25). La colorazione del tessuto tumorale deve essere marrone e interessare la membrana cellulare. Il citoplasma e i tessuti negativi all interno del campione possono colorarsi di marrone, tuttavia l intensità di questa colorazione non deve superare il punteggio Tessuto di controllo negativo: dopo il tessuto di controllo positivo è necessario analizzare il vetrino con il tessuto di controllo negativo, in modo da poter confermare la specificità della marcatura dell antigene bersaglio ad opera dell anticorpo primario. L assenza di colorazione specifica nel tessuto di controllo negativo conferma l assenza di reattività crociata del kit con cellule/componenti cellulari. Se si osserva una colorazione specifica nel tessuto di controllo negativo, i risultati ottenuti con i campioni dei pazienti analizzati non sono da ritenersi validi. In alternativa, è possibile utilizzare alcune di queste porzioni negative nel tessuto di controllo positivo a mo di controlli negativi (è necessaria una verifica dell utente). È possibile che si verifichi una lieve reazione (intensità della colorazione tra 0 e 1+) in gran parte dei tessuti epiteliali normali. Possono essere impiegati come tessuti di controllo negativi il colon, il fegato e la tiroide. Se è presente, la colorazione aspecifica apparirà piuttosto diffusa. È possibile osservare anche la colorazione sporadica del tessuto connettivo nelle sezioni sottoposte ad eccessiva fissazione in formalina. ( ) P04456IT_01_SK / p. 30/41
31 Tessuto del paziente: in ultimo esaminare i campioni dei pazienti sottoposti a colorazione con HercepTest. L intensità della colorazione positiva deve essere valutata tenendo conto di possibili colorazioni di fondo aspecifiche ad opera del reagente di controllo negativo. Come accade per tutti gli esami immunocitochimici, un risultato negativo significa che l antigene ricercato non è stato trovato, ma non significa che l antigene non è presente nelle cellule e nei tessuti analizzati. Per informazioni specifiche sulla immunoreattività del test HercepTest, vedere i paragrafi Cenni introduttivi, Limiti e Caratteristiche prestazionali. Altri suggerimenti per interpretare correttamente i risultati della colorazione con HercepTest Gli adenocarcinomi gastrici con giunzione gastroesofagea sottoposti a test per individuare l'iperespressione della proteina HER2 vengono valutati su una scala da 0 a 3+. Mentre nei casi con punteggio 0 e 3+ l interpretazione è chiara, in una piccola percentuale residua di casi i campioni ottengono punteggi 1+ e 2+ e sono più difficili da classificare. Per l interpretazione della colorazione con HercepTest in laboratorio, è possibile attenersi alle seguenti linee guida. 1. Valutare sempre le linee cellulari di controllo per convalidare il rendimento del test. 2. Valutare sia i vetrini di controllo positivi, sia i vetrini di controllo negativi. 3. Si consiglia di colorare i campioni dei tessuti con ematossilina ed eosina (H&E), almeno per la prima valutazione. (La ragione è che il tumore potrebbe non essere evidente ad una prima osservazione del campione colorato con HercepTest. Invece un vetrino colorato con H&E consente al patologo di appurare la presenza del tumore). Il test HercepTest deve essere eseguito su una sezione a coppia (seriale) appartenente allo stesso blocco di paraffina del campione. 4. Valutare la presenza di iperespressione della proteina HER2 nelle sezioni utilizzando prima un ingrandimento basso: la maggior parte dei casi positivi è già evidente con un ingrandimento basso. 5. Per verificare la colorazione della membrana, utilizzare un obiettivo con un ingrandimento di 20-40x per i casi con punteggio Per verificare la colorazione della membrana, utilizzare un obiettivo con un ingrandimento di 10-20x per i casi con punteggio 2+. Campione chirurgico 1. Per determinare la percentuale di cellule tumorali positive, scegliere le aree del campione meglio conservate e colorate. 2. Se si è colorata la membrana laterale o basolaterale nella maggioranza delle cellule tumorali, il punteggio è 2+ o Se la membrana laterale o basolaterale si è colorata completamente con un intensità forte in una percentuale pari o superiore al 10% delle cellule tumorali nei campioni chirurgici, il punteggio da assegnare al campione è Se la membrana laterale o basolaterale si è colorata completamente con un intensità da debole a moderata in una percentuale pari o superiore al 10% delle cellule tumorali nei campioni chirurgici, il punteggio da assegnare al campione è Se una percentuale pari o superiore al 10% delle cellule tumorali nei campioni chirurgici presenta una colorazione scarsamente percettibile solo parziale della membrana, il punteggio del campione è Se la percentuale di cellule tumorali nei campioni chirurgici con una colorazione parziale, indipendentemente dal pattern di colorazione (ad es. completo, basolaterale o laterale o parte della membrana), inferiore al 10%, il punteggio è Se non si evidenzia alcuna colorazione, il punteggio del campione chirurgico è 0. Campione bioptico 1. Un cluster id almeno 5 cellule tumorali sottoposte a colorazione è composto di 5 cellule tumorali sottoposte a colorazione HER connesse. 2. Se è presente un cluster di cellule tumorali di almeno 5 cellule tumorali sottoposte a colorazione con una colorazione membranosa laterale o basolaterale completa forte, il punteggio del campione bioptico è 3+, indipendentemente dalla percentuale di cellule tumorali sottoposte a colorazione. 3. Se è presente un cluster di cellule tumorali di almeno 5 cellule tumorali sottoposte a colorazione con una colorazione membranosa laterale o basolaterale completa da debole a moderata, il punteggio del campione bioptico è 2+, indipendentemente dalla percentuale di cellule tumorali sottoposte a colorazione. 4. Se è presente un cluster di cellule tumorali di almeno 5 cellule tumorali sottoposte a colorazione con una colorazione membranosa scarsamente percettibile e parziale della membrana, il punteggio del campione bioptico è 1+, indipendentemente dalla percentuale di cellule tumorali sottoposte a colorazione. 5. Se non si evidenzia alcuna colorazione, il punteggio del campione bioptico è Se si evidenzia una colorazione della membrana (indipendentemente dall'intensità della colorazione) in meno di 5 cellule tumorali del gruppo, il punteggio del campione bioptico è 0. ( ) P04456IT_01_SK / p. 31/41
32 Limiti generali - Gastrico Limiti specifici del prodotto - Gastrico 1. L immunocitochimica è una tecnica diagnostica multifase che richiede un addestramento specifico per quanto riguarda la scelta dei reagenti appropriati, la selezione, la fissazione e il trattamento dei tessuti, la preparazione del vetrino per l analisi immunocitochimica e l interpretazione dei risultati della colorazione. 2. La colorazione del tessuto dipende dal modo in cui il tessuto viene pretrattato. Una fissazione eseguita in maniera scorretta, il congelamento, lo scongelamento, il lavaggio, l essiccazione, il riscaldamento, il sezionamento o la contaminazione con altri tessuti o fluidi possono produrre artefatti, intrappolare l anticorpo o generare risultati falsi-negativi. Risultati incoerenti possono essere provocati anche da modifiche apportate ai metodi di fissazione e di inclusione o da irregolarità intrinseche del tessuto. 3. Una colorazione di contrasto eccessiva o incompleta può compromettere l interpretazione dei risultati. 4. L interpretazione clinica di qualsiasi colorazione positiva o assenza di colorazione non può prescindere dal contesto della presentazione clinica, della morfologia e di altri criteri istopatologici L interpretazione clinica di qualunque colorazione o della sua assenza deve essere completata da studi morfologici e da controlli adeguati nonché da altri test diagnostici. L interpretazione della colorazione è compito di un patologo qualificato, che deve avere una profonda conoscenza degli anticorpi, dei reagenti e dei metodi impiegati. La colorazione deve essere eseguita in un laboratorio autorizzato certificato, sotto la supervisione di un patologo, il quale esaminerà i vetrini colorati e garantirà la correttezza dei controlli positivi e negativi. 5. I tessuti delle persone infette dal virus dell epatite B e contenenti l antigene di superficie dell epatite B (HBsAg) possono essere interessati da una colorazione aspecifica con la perossidasi di rafano (26). 6. I reagenti potrebbero provocare reazioni impreviste in tipi di tessuto mai analizzati in passato. Inoltre non è escluso che possano verificarsi reazioni impreviste anche in tipi di tessuti già analizzati in passato, vista l elevata variabilità biologica dell espressione antigenica nelle neoplasie o in altri tessuti patologici (27). Si prega di voler comunicare eventuali reazioni impreviste all Assistenza Tecnica Dako, fornendo tutta la documentazione del caso. 7. È possibile ottenere falsi positivi a causa del legame non immunologico di proteine o di prodotti di reazione del substrato. Falsi positivi possono essere causati anche dall attività della pseudoperossidasi (eritrociti) e dall attività della perossidasi endogena (citocromo C) (27). 8. La procedura di colorazione verrà eseguita alla temperatura programmata (20 25 C). 1. L antigene presente nella linea cellulare di controllo 1+ (Control Cell Line MDA-175) è destinato a degradarsi nel tempo. Valutare i risultati del vetrino di controllo tenendo conto della data di scadenza del vetrino. La colorazione negativa delle cellule MDA-175 potrebbe indicare soltanto che il vetrino di controllo si è deteriorato. Conservare i vetrini di controllo a 2 8 C. 2. Il deterioramento dell antigene nel tessuto, nel tempo, può provocare risultati falsi-negativi. I campioni devono essere sottoposti a colorazione entro 4-6 settimane dal montaggio dei tessuti sui vetrini e devono essere conservati a temperatura ambiente (20 25 C) (28). 3. Non sostituire i reagenti del kit con reagenti che abbiano numeri di lotto diversi, né con reagenti di altri produttori. 4. Dalla valutazione della colorazione del citoplasma si possono ottenere risultati falsi. Ai fini dell interpretazione della colorazione, tenere conto esclusivamente della colorazione della membrana cellulare. 5. I vetrini di controllo che si colorano servono esclusivamente per verificare la validità del ciclo di colorazione e non devono essere impiegati per assegnare un punteggio alla colorazione delle sezioni di tessuto. 6. Di tanto in tanto è possibile che si formino i cosiddetti hot spot, ovvero punti circoscritti con una colorazione focale intensa (3+). La presenza di questi hot spot potrebbe essere dovuta ad una procedura di fissazione e/o trattamento del tessuto non uniforme. In questi casi, si consiglia di procedere all immunocolorazione di un secondo blocco di tessuto appartenente allo stesso campione. 7. Non è stato approvato l uso del test HercepTest su campioni trattati con fissativi diversi dalla formalina tamponata neutra. 8. Gli epiteli normali di tonsille ed esofago possono colorarsi con un intensità fino a Deve essere evitato l uso di campioni di cancro gastrico frantumati e l interpretazione della colorazione degli artefatti attorno a un bordo bioptico. ( ) P04456IT_01_SK / p. 32/41
33 Caratteristiche prestazionali - Gastrico Dati di base La sicurezza e l efficacia di trastuzumab (Herceptin ) è stata dimostrata in uno studio clinico (lo studio ToGA) (37,38). Lo studio è stato pensato come uno studio di fase III multicentro, randomizzato in aperto in pazienti positivi all HER2 con adenocarcinoma gastrico in stadio avanzato localmente non operabile, ricorrente e/o metastatico dello stomaco o della giunzione gastroesofagea. Nello studio ToGA, la positività all HER2 è stata definita come positiva all IHC (3+) (HercepTest, Dako) oppure e/o positiva tramite HER2 FISH (HER2/CEN17 2,0) (Kit HER2 FISH pharmdx, Dako). Dopo l inclusione nello studio, i pazienti sono stati sottoposti in maniera randomizzata a chemioterapia (5-FU o capecitabina e cisplatina) o chemioterapia più trastuzumab. L endpoint primario dello studio era la sopravvivenza complessiva (OS). Nello studio, sono stati randomizzati in totale 594 pazienti e 584 pazienti hanno assunto il farmaco di studio e sono stati inclusi nell intero insieme di analisi (FAS, full analyses set). Per l endpoint primario, la combinazione di chemioterapia più trastuzumab si è dimostrata statisticamente superiore rispetto alla sola chemioterapia. L OS mediana è aumentata da 11,1 a 13,8 mesi (p=0,0046), con un rapporto di pericolo di 0,74 (95 % CI: 0,60-0,91). Le curve di Kaplan-Meier per l OS sono mostrate in Figura 1. Probabilità di sopravvivenza 1,0 0,9 0,8 0,7 Test Log-rank P = 0,0046 0,6 0,5 0,4 0,3 0,2 0,1 11,1 13,8 Tempo (mesi) N. rimasti Fluoro/Cisp Tras/Fluoro/Cisp Gruppo di trattamento Fluoro/Cisp Tras/Fluoro/Cisp Figura 1. Curva di Kaplan-Meier curve dell OS (n=584). Analisi di sottogruppi esplorativi pre-specificati per stato HER2 sono stati eseguiti quando sono stati disponibili i dati. Due nuovi sottogruppi HER2 sono stati definiti post-hoc in base alla valutazione IHC: Gruppo 1 ( gruppo con espressione bassa dell HER2 ): IHC 0/FISH+ e IHC 1+/FISH+ (n=131) Gruppo 2 ( gruppo con espressione elevata dell HER2 ): IHC 2+/FISH+ e IHC 3+ compresi IHC 3+ (FISH positivo o FISH negativo o FISH nessun risultato (n=446)) In occasione della ripetizione post-hoc dell analisi primaria sull OS per il gruppo con espressione elevata dell HER2 (n=446), il beneficio in favore del trattamento combinato è risultato ancora maggiore. L OS mediana per il gruppo di pazienti sottoposti a chemioterapia più trastuzumab è aumentata a 16,0 mesi rispetto agli 11,8 mesi per i pazienti sottoposti solo a chemioterapia. Il rapporto di pericolo per questa analisi è sceso a 0,65 (95 % CI: 0,51-0,83). Le curve di Kaplan-Meier per l OS per il gruppo con espressione elevata dell HER2 sono mostrate in Figura 2. ( ) P04456IT_01_SK / p. 33/41
34 Probabilità di sopravvivenza 1,0 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 11,8 16,0 Tempo (mesi) N. rimasti Fluoro/Cisp Tras/Fluoro/Cisp Gruppo di trattamento Fluoro/Cisp Tras/Fluoro/Cisp Figura 2. Curva di Kaplan-Meier per l OS per il gruppo con espressione elevata dell HER2 (n=446). Lo studio ToGA ha mostrato che la combinazione dei test IHC e FISH è predittiva dell effetto del trattamento combinato con chemioterapia e trastuzumab; tuttavia, l analisi esplorativa post-hoc sembra indicare che livelli elevati della proteina HER2 (IHC2+/FISH+ and IHC3+) offra benefici maggiori. Ciò può essere spiegato dal fatto che la proteina è il target per trastuzumab. Per ulteriori informazioni sullo studio ToGA, vedere il foglietto illustrativo dell Herceptin. Riproducibilità Riproducibilità nella serie La riproducibilità nella serie è stata studiata in un laboratorio utilizzando 3 campioni con punteggi di intensità della colorazione IHC diversi. Ogni campione è stato elaborato in triplicato. Il protocollo è stato applicato con un sistema di colorazione automatizzato. Tutti i campioni hanno generato risultati riproducibili al 100%. La riproducibilità nella serie è stata studiata in un laboratorio utilizzando 11 campioni con punteggi di colorazione IHC diversi. Ogni campione è stato elaborato in triplicato. Questo protocollo è stato utilizzato con colorazione manuale. Tutti i campioni hanno generato risultati riproducibili al 100%. Riproducibilità tra serie e fra laboratori Le analisi HercepTest su 60 diversi campioni di cancro gastrico ottenuti da aree dello stomaco o da aree di giunzione gastroesofagea, risultati di resezioni chirurgiche e biopsie, sono state eseguite in cinque giorni non consecutivi, in tre siti di studio. I 60 campioni dello studio erano equamente distribuiti nelle tre categorie di stato dell'her2. Sei patologi hanno eseguito un totale di valutazioni dell'her2. La concordanza tra giorni (negativa, equivoca, positiva) ha assunto valori variabili tra l'83,1% e il 98,3%. In 47 dei 60 possibili confronti, la concordanza è stata del 90,0% o superiore. Nella Tabella 11 vengono mostrati alcuni esempi dei confronti tra un giorno e l'altro, con concordanze medie pari a 91,2%, 92,5% e 92,% per i tre siti. Le concordanze tra siti, nei confronti tra coppie di siti, sono state rispettivamente pari all'82,7%, al 75,0% e all'88,0% (vedere Tabella 12). Secondo quanto riportato nel testo di Fisher, non vi sono state differenze di risultati tra un sito e l'altro. Le concordanze tra osservatori riferite ai patologi di ciascun sito sono state pari all'88,0% nel Sito 1, all'83,6% nel Sito 2 e all'81,0% nel Sito 3 (Tabella 13). In conclusione, le analisi HercepTest sui campioni di cancro gastrico svolte in tre siti di studio hanno evidenziato un buon livello di concordanza tra le osservazioni, con riferimento ai giorni, ai siti e agli osservatori. ( ) P04456IT_01_SK / p. 34/41
35 Tabella 11. Concordanze complessive tra giorni in percentuale - 12 confronti su 60 Osservatore 1 Osservatore 2 Concordanza Concordanza CI95 LL 1 Concordanza CI95 LL 1 media Sito 1 Giorno 1 rispetto a giorno 2 Giorno 3 rispetto a giorno 4 85,0 74,4 93,3 84,9 93,3 84,9 93,3 84,9 91,2 Sito 2 Giorno 1 rispetto a giorno 2 Giorno 3 rispetto a giorno 4 95,0 87,3 83,1 72,0 96,7 89,7 95,0 87,3 92,5 Sito 3 Giorno 1 rispetto a giorno 2 Giorno 3 rispetto a giorno 4 90,0 80,5 91,7 82,7 96,7 89,7 91,7 82,7 92,5 1 CI95 LL: intervallo di confidenza del limite inferiore 95%. Tabella 12. Concordanze complessive tra siti in percentuale Concordanza CI95 LL 1 Concordanza media Sito 1 rispetto a sito 2 Sito 1 rispetto a sito 3 Sito 2 rispetto a sito 3 Giorno 1 rispetto a giorno 1 83,3 72,4 Giorno 2 rispetto a giorno 2 85,0 74,4 Giorno 3 rispetto a giorno 3 85,0 74,4 Giorno 4 rispetto a giorno 4 81,7 70,5 Giorno 5 rispetto a giorno 5 78,3 66,7 Giorno 1 rispetto a giorno 1 80,0 68,6 Giorno 2 rispetto a giorno 2 73,3 61,2 Giorno 3 rispetto a giorno 3 78,3 66,7 Giorno 4 rispetto a giorno 4 68,3 55,9 Giorno 5 rispetto a giorno 5 75,0 63,0 Giorno 1 rispetto a giorno 1 88,3 78,5 Giorno 2 rispetto a giorno 2 86,7 76,4 Giorno 3 rispetto a giorno 3 90,0 80,5 Giorno 4 rispetto a giorno 4 86,7 76,4 Giorno 5 rispetto a giorno 5 88,3 78,5 82,7 75,0 88,0 1 CI95 LL: intervallo di confidenza del limite inferiore 95%. ( ) P04456IT_01_SK / p. 35/41
36 Tabella 13. Concordanze tra osservatori in percentuale Sito 1 Sito 2 Sito 3 Concordanza CI 95 LL 1 Concordanza media Giorno 1 91,7 82,7 Giorno 2 91,7 82,7 Giorno 3 93,3 84,9 88,0 Giorno 4 83,3 72,4 Giorno 5 80,0 68,6 Giorno 1 86,4 76,0 Giorno 2 83,3 72,4 Giorno 3 83,3 72,4 83,6 Giorno 4 83,3 72,4 Giorno 5 81,7 70,5 Giorno 1 80,0 68,6 Giorno 2 78,3 66,7 Giorno 3 80,0 68,6 Giorno 4 78,3 66,7 Giorno 5 90,0 80,5 1 CI95 LL: intervallo di confidenza del limite inferiore 95%. 81,0 Immunoreattività La Tabella 14 fornisce un quadro dell immunoreattività all HercepTest relativamente alla serie di tessuti normali selezionati. Tutti i tessuti analizzati sono stati fissati in formalina e inclusi in paraffina e successivamente colorati con HercepTest secondo le istruzioni riportate nel foglietto illustrativo del prodotto. Tabella 14. Sommario della reattività a HercepTest dei tessuti normali Tipo di tessuto (n di campioni) Surrenale (3) Midollo osseo (3) Cervello/Cervelletto (3) Cervello/Cervelletto (3) Mammella (3) Collo dell utero (3) Colon (3) Esofago (3) Cuore (3) Rene (3) Fegato (3) Polmone (3) Cellule mesoteliali (3) Ovaio (3) Pancreas (3) Paratiroide (3) Nervo periferico (3) Pituitaria (3) Prostata (3) Ghiandola salivare (3) Muscolo scheletrico (3) Pelle (3) Intestino tenue (3) Milza (3) Stomaco (3) Testicolo (3) Timo (3) Tiroide (3) Tonsilla (3) Utero (3) Colorazione positiva dell elemento tissutale e pattern di colorazione Ghiandola mammaria (2/3 dei tessuti, intensità di colorazione 1+, < 5% delle cellule) Cellule epiteliali (1 su 3 dei tessuti, intensità di colorazione 1+, < 5% delle cellule, membrana e citoplasma, granulare) Cellule epiteliali del follicolo (1 su 3 dei tessuti, intensità di colorazione 1+, < 5% delle cellule, membrana e citoplasma) Epitelio squamoso (1 su 3 dei tessuti, intensità di colorazione 1+, < 5% delle cellule (2 su 3 dei tessuti, intensità di colorazione 2+, < 10-20% delle cellule. Membrana e citoplasma) Tessuto endometriale (2 su 3 dei tessuti, intensità di colorazione 1+, 30-60% delle cellule, citoplasma, granulare) In tutti i tessuti è stata riscontrata la colorazione della membrana, salvo diversa segnalazione. L intensità della colorazione di tutti e tre i campioni di ogni tipo di tessuto era la stessa, salvo diversa segnalazione. ( ) P04456IT_01_SK / p. 36/41
37 Risoluzione dei problemi - Gastrico Per informazioni, consultare la sezione Troubleshooting (risoluzione dei problemi) del manuale Dako citato in precedenza (19) oppure contattare l Assistenza Tecnica Dako per riferire di eventuali colorazioni insolite. Problema Probabile causa Intervento consigliato 1. 1a. Errore di programmazione. 1a. Controllare il log dei vetrini per colorazione I reagenti non sono stati verificare che il programma dei vetrini. utilizzati nell ordine corretto. selezionato sia corretto. 1b. Sodio azide nella soluzione di 1b. Utilizzare solo Dako Wash Buffer, 2. Colorazione debole dei vetrini. 3. Eccessiva colorazione di fondo dei vetrini. 4. Il tessuto si stacca dai vetrini. lavaggio. 1c. Un riscaldamento eccessivo di sezioni di tessuto montate prima della deparaffinazione e del recupero dell antigene indotto dal calore può portare alla perdita di immunoreattività HER2 visibile. Codice S c. Far asciugare all aria le sezioni di tessuto a temperatura ambiente per un minimo di 12 ore o fino al completamento dell asciugatura. In alternativa, asciugare a 37 C durante la notte o asciugare a 60 C per un massimo di un ora. L asciugatura di sezioni di tessuto a temperature elevate deve essere eseguita solo in un forno calibrato con distribuzione uniforme del calore (17). 2a. Recupero dell epitopo insufficiente. 2a. Rivedere il log dei vetrini per verificare se il recupero dell epitopo è stato eseguito correttamente. 2b. Tempi di incubazione del reagente insufficienti. 2c. È stato utilizzato un metodo di fissazione inadeguato. 2d. Un riscaldamento eccessivo di sezioni di tessuto montate prima della deparaffinazione e del recupero dell antigene indotto dal calore può provocare una diminuzione significativa dell immunoreattività HER2 visibile. 2e. Volume di reagente applicato insufficiente. 3a. La paraffina è stata rimossa parzialmente. 3b. Sono stati utilizzati additivi amidacei nel montaggio delle sezioni sui vetrini. 3c. I vetrini sono stati risciacquati male. 3d. Le sezioni si sono asciugate durante la procedura di colorazione. 3e. È stato utilizzato un metodo di fissazione inadeguato. 3f. Legame aspecifico dei reagenti con il tessuto. 2b. Rivedere il log dei vetrini per verificare che i tempi di incubazione dei reagenti siano corretti. 2c. Controllare che il tessuto del paziente non sia fissato eccessivamente e che non sia stato utilizzato un fissativo alternativo. 2d. Far asciugare all aria le sezioni di tessuto a temperatura ambiente per un minimo di 12 ore o fino al completamento dell asciugatura. In alternativa, asciugare a 37 C durante la notte o asciugare a 60 C per un massimo di un ora. L asciugatura di sezioni di tessuto a temperature elevate deve essere eseguita solo in un forno calibrato con distribuzione uniforme del calore (17). 2e. Verificare le dimensioni della sezione di tessuto (22 mm x 22 mm) e il volume di reagente applicato. 3a. Utilizzare soluzioni fresche per la deparaffinazione. 3b. Evitare l uso di additivi amidacei per fare aderire le sezioni ai vetrini. Molti additivi sono immunoreattivi. 3c. Rivedere il log dei vetrini per confermare che i vetrini siano stati sciacquati correttamente. 3d. Controllare che sui vetrini sia stato applicato il volume di reagente corretto. 3e. Controllare che sia stato utilizzato un fissativo approvato. L uso di un fissativo alternativo potrebbe provocare una colorazione di fondo eccessiva. 3f. Controllare che il campione sia stato fissato correttamente e verificare la presenza di necrosi. 4a. Uso di vetrini errati. 4a. Utilizzare vetrini silanizzati, ad es. Dako Silanized Slides (Codice S3003), SuperFrost Plus o vetrini polilisinati. ( ) P04456IT_01_SK / p. 37/41
38 Problema Probabile causa Intervento consigliato 5. Colorazione 5a. È stato utilizzato un metodo di specifica troppo fissazione inadeguato. intensa. fissazione approvati 6. Colorazione debole della linea cellulare del vetrino di controllo La soluzione Epitope Retrieval Solution ha un aspetto torbido quando viene riscaldata. 8. La soluzione Epitope Retrieval Solution ha un aspetto torbido durante la conservazione (prima di scaldarla). 5b. Eccessivi tempi di incubazione del reagente. 5c. È stata utilizzata una soluzione di lavaggio inadeguata. 6a. Il protocollo seguito per il recupero dell epitopo non è corretto. 6b. Assenza di reazione con la soluzione cromogenosubstrato (DAB). 6c. Deterioramento del vetrino di controllo. 7. Quando viene riscaldata, la soluzione assume un aspetto torbido. 8. La soluzione è stata conservata in modo scorretto, oppure ne è stata superata la data di scadenza. 5a. Assicurarsi di utilizzare solo i fissativi e i metodi di 5b. Rivedere il log dei vetrini per verificare che i tempi di incubazione dei reagenti siano corretti. 5c. Utilizzare solo Dako Wash Buffer, Codice S a. Rivedere il log dei vetrini per verificare se il recupero dell epitopo è stato eseguito correttamente. 6b. Rivedere il log della sessione per verificare se il cromogeno è stato preparato correttamente. Rivedere il log dei vetrini per verificare che il tempo di incubazione del cromogeno sia corretto. 6c. Controllare la data di scadenza e le condizioni per la conservazione del kit stampate all esterno della confezione. 7. Ciò è normale e non influisce sulla colorazione. 8. Controllare la data di scadenza e le condizioni per la conservazione del kit stampate all esterno della confezione. Gettare via la soluzione di recupero dell'epitopo. NOTA: se il problema non è imputabile a nessuna di queste cause o se l intervento correttivo consigliato non si rivela efficace, contattare l Assistenza Tecnica Dako per ricevere ulteriori suggerimenti. Per ulteriori informazioni sulle tecniche di colorazione e sulla preparazione dei campioni, consultare il manuale disponibile presso Dako che è citato in precedenza: Handbook (19) Atlas of Immunohistology (29) and Immunoperoxidase Techniques. A Practical Approach to Tumor Diagnosis (30). ( ) P04456IT_01_SK / p. 38/41
39 Bibliografia 1. Coussens L, Yang-Feng TL, Liao Y-C, Chen E, Gray A, McGrath J, et al. Tyrosine kinase receptor with extensive homology to EGF receptor shares chromosomal location with neu oncogene. Science 1985; 230: King CR, Kraus MH, Aaronson SA. Amplification of a novel v-erbb-related gene in a human mammary carcinoma. Science 1985; 229: Semba K, Kamata N, Toyoshima K, Yamamoto T. A v-erbb-related protooncogene, c-erbb-2, is distinct from the c-erbb-1/epidermal growth factor-receptor gene and is amplified in a human salivary gland adenocarcinoma. Proc Natl Acad Sci USA 1985; 82: Yamamoto T, Ikawa S, Akiyama T, Semba K, Nomura N, Miyajima N, et al. Similarity of protein encoded by the human c-erb-b-2 gene to epidermal growth factor receptor. Nature 1986; 319: Schechter AL, Hung M-C, Vaidyanathan L, Weinberg RA, Yang-Feng TL, Francke U, et al. The neu gene: an erbb-homologous gene distinct from and unlinked to the gene encoding the EGF receptor. Science 1985; 229: Bargmann CI, Hung M-C, Weinberg RA. The neu oncogene encodes an epidermal growth factor receptor-related protein. Nature 1986; 319: Natali PG, Nicotra MR, Bigotti A, Venturo I, Slamon DJ, Fendly BM, et al. Expression of the p185 encoded by HER2 oncogene in normal and transformed human tissues. Int J Cancer 1990; 45: Press MF, Cordon-Cardo C, Slamon DJ. Expression of the HER-2/neu proto-oncogene in normal human adult and fetal tissues. Oncogene 1990; 5: Lonardo F, Di Marco E, King CR, Pierce JH, Segatto O, Aaronson SA, et al. The normal erbb-2 product is an atypical receptor-like tyrosine kinase with constitutive activity in the absence of ligand. New Biologist 1990; 2: Carter P, Presta L, Gorman CM, Ridgway JBB, Henner D, Wong WLT, et al. Humanization of an anti-p185her2 antibody for human cancer therapy. Proc Natl Acad Sci USA 1992; 89: Hudziak RM, Lewis GD, Winget M, Fendly BM, Shepard HM, Ullrich A. p185her2 monoclonal antibody has antiproliferative effects in vitro and sensitizes human breast tumor cells to tumor necrosis factor. Mol Cell Biol 1989; 9: Lewis GD, Figari I, Fendly B, Wong WL, Carter P, Gorman C, et al. Differential responses of human tumor cell lines to anti-p185her2 monoclonal antibodies. Cancer Immunol Immunother 1993; 37: Baselga J, Norton L, Albanell J, Kim Y-M, Mendelsohn J. Recombinant humanized anti-her2 antibody (Herceptin ) enhances the antitumor activity of paclitaxel and doxorubicin against HER2/neu overexpressing human breast cancer xenografts. Cancer Res 1998; 58: a. Medical Laboratories Particular requirements for quality and competence, ISO 15189:2003 b. Clinical Laboratory Improvement Amendments of 1988: Final Rule, 57CFR7163, February 28, Sheehan DC, Hrapchak BB. Theory and practice of histotechnology. St. Louis: The C. V. Mosby Company; Kiernan JA. Histological and histochemical methods: theory & practice. New York: Pergamon Press Lundgaard Hansen B, Winther H, Moller K. Excessive section drying of breast cancer tissue prior to deparaffinisation and antigen retrieval causes a loss in HER2 immunoreactivity, Immunocytochemistry 2008;6, Dako California Inc., Data on file 19. Key M. Education Guide: Immunohistochemical Staining Methods. Fourth Edition. Dako, Carpinteria, California; Leong AS-Y, Milios J, Leong FJ. Epitope retrieval with microwaves. A comparison of citrate buffer and EDTA with three commercial retrieval solutions. Appl Immunohistochem 1996; 4: Department of Health, Education and Welfare, National Institutes for Occupational Safety and Health, Rockville, MD. Procedures for the decontamination of plumbing systems containing copper and/or lead azides. DHHS (NIOSH) Publ. No , Current 13. August 16, Clinical and Laboratory Standards Institute (formerly NCCLS). Protection of Laboratory Workers From Occupationally Acquired Infections; Approved Guideline Third Edition. CLSI document M29-A3 [ISBN ]. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania USA, Clinical and Laboratory Standards Institute (formerly NCCLS). Quality assurance for immunocytochemistry; Approved guideline. CLSI document MM4-A ( ) CLSI, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania USA; Elias JM, Gown AM, Nakamura RM, Wilbur DC, Herman GE, Jaffe ES, et al. Special report: quality control in immunohistochemistry. Am J Clin Pathol 1989; 92: Nadji M, Morales AR. Immunoperoxidase: Part I. The technique and its pitfalls. Lab Med 1983; 14: Omata M, Liew C-T, Ashcavai M, Peters RL. Nonimmunologic binding of horseradish peroxidase to hepatitis B surface antigen: a possible source of error in immunohistochemistry. Am J Clin Path 1980; 73: Herman GE, Elfont EA. The taming of immunohistochemistry: the new era of quality control. Biotech & Histochem 1991; 66: Press MF, Hung G, Godolphin W, Slamon DJ. Sensitivity of HER-2/neu antibodies in archival tissue samples: potential source of error in immunohistochemical studies of oncogene expression. Cancer Res 1994; 54: Tubbs RR, Gephardt GN, Petras RE. Specimen processing and quality assurance. Atlas of immunohistology. Chicago: Amer Soc Clin Pathol Press; 1986: Nadji M, Morales AR. Immunoperoxidase techniques. A practical approach to tumor diagnosis. Chicago: Amer Soc Clin Pathol Press; 1986 ( ) P04456IT_01_SK / p. 39/41
40 31. Jørgensen JT. Targeted HER2 Treatment in Advanced Gastric Cancer. Oncology 2010;78: Tanner M, Hollmén M, Junttila TT, Kapanen AI, Tomola S, SoiniY et al. Amplification of HER-2 in gastric carcinoma: association with Topoisomerase II alpha gene amplification, intestinal type, poor prognosis and sensitivity to trastuzumab. Ann Oncol 2005;16: Matsui Y, Inomata M, Tojigamori M, Sonoda K, Shiraishi N, Kitano S. Suppression of tumor growth in human gastric cancer with HER2 overexpression by an anti-her2 antibody in a murine model. Int J Oncol 2005; 27: Fujimoto-Ouchi K, Sekiguchi F, Yasuno H, Moriya Y, Mor K, Tanaka Y. Antitumor activity of trastuzumab in combination with chemotherapy in human gastric cancer xenograft models. Cancer Chemother Pharmacol 2007; 59: Kim SY, Kim HP, Kim YJ, Oh DY, Im S-A, Lee D et al. Trastuzumab inhibits the growth of human gastric cancer cell lines with HER2 amplification synergistically with cisplatin. Int J Oncol 2008; 32: Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A et al. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastroesophageal junction cancer (ToGA): a phase 3, open-label, randomized controlled trial. Lancet Bang Y, Chung J, Xu J, Lordick F, Sawaki A, Lipatov O et al. Pathological features of advanced Gastric Cancer (GC): Relationship to human epidermal growth factor receptor 2 (HER2) positivity in the global screening programme of the ToGA trial. J Clin Oncol 2009; 27:15s (suppl; abstr 4556). 38. Van Cutsem E, Kang YK, Chung HC, Shen L, Sawaki A, Lordick F, et al. Efficacy results from the ToGA trial: a phase III study of trastuzumab added to standard chemotherapy in first-line human epidermal growth factor receptor 2 (HER2)-positive advanced gastric cancer. (presentation ASCO 2009). 39. Hofmann M, Stoss O, Shi D, Büttner R, van de Vijver M, Kim W, et al. Assessment of a HER2 scoring system for gastric cancer: results from a validation study. Histopath 2008;52: Asioli S, Maletta F, Verdun di Cantogno L, Satolli MA, Schena M, Pecchioni C, et al. Approaching heterogeneity of human epidermal growth factor receptor 2 in surgical specimens of gastric cancer. Human Pathol 2012; 43;11: ( ) P04456IT_01_SK / p. 40/41
41 Spiegazione dei simboli N. di catalogo Limiti di temperatura Codice del lotto Fragile: maneggiare con cura Dispositivo medicodiagnostico in vitro Conservare al buio Utilizzare entro Pittogramma GHS (consultare la sezione Precauzioni) Consultare le istruzioni per l uso Contenuto sufficiente per <n> test Fabbricante Prodotto da: Dako Denmark A/S Produktionsvej 42 DK-2600 Glostrup Denmark Tel Fax Distribuito negli Stati Uniti da: Dako North America, Inc Via Real Carpinteria, California 93013, USA Tel. 805/ , Nr. Verde: 800/ Informazioni sugli ordini: Tel. 800/ Fax 805/ Assistenza Tecnica: Tel. 800/ ( ) P04456IT_01_SK / p. 41/41
EnVision G 2 Doublestain System, Rabbit/Mouse (DAB+/Permanent Red)
 EnVision G 2 Doublestain System, Rabbit/Mouse (DAB+/Permanent Red) Codice K5361 Seconda edizione Per l uso con anticorpi primari di coniglio e topo. Idoneo per 150 test. (114146-002) K5361/IT/SGA/13.10.06
EnVision G 2 Doublestain System, Rabbit/Mouse (DAB+/Permanent Red) Codice K5361 Seconda edizione Per l uso con anticorpi primari di coniglio e topo. Idoneo per 150 test. (114146-002) K5361/IT/SGA/13.10.06
URISTIKFIT LEV1 REF KCQURST1
 URISTIKFIT LEV1 REF KCQURST1 Per Uso Diagnostico In Vitro USO PREVISTO Il controllo URISTIKFIT è destinato all uso nel laboratorio clinico come materiale di controllo nelle procedure qualitative e semiquantitative
URISTIKFIT LEV1 REF KCQURST1 Per Uso Diagnostico In Vitro USO PREVISTO Il controllo URISTIKFIT è destinato all uso nel laboratorio clinico come materiale di controllo nelle procedure qualitative e semiquantitative
EnVision FLEX, High ph, (Dako Autostainer/Autostainer Plus)
 EnVision FLEX, High ph, (Dako Autostainer/Autostainer Plus) Codice K8010 5 a edizione Il kit contiene reagenti sufficienti per 400 600 test. Per Dako Autostainer/Autostainer Plus Reagenti facoltativi:
EnVision FLEX, High ph, (Dako Autostainer/Autostainer Plus) Codice K8010 5 a edizione Il kit contiene reagenti sufficienti per 400 600 test. Per Dako Autostainer/Autostainer Plus Reagenti facoltativi:
TECNICHE IMMUNOISTOCHIMICHE IN PATOLOGIA VETERINARIA: VANTAGGI E LIMITI. Pezzolato Marzia, DVM LAB Istopatologia - IZSTO
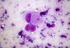 TECNICHE IMMUNOISTOCHIMICHE IN PATOLOGIA VETERINARIA: VANTAGGI E LIMITI Pezzolato Marzia, DVM LAB Istopatologia - IZSTO L immunoistochimica (IHC) serve per individuare un determinato antigene mediante
TECNICHE IMMUNOISTOCHIMICHE IN PATOLOGIA VETERINARIA: VANTAGGI E LIMITI Pezzolato Marzia, DVM LAB Istopatologia - IZSTO L immunoistochimica (IHC) serve per individuare un determinato antigene mediante
LOCALIZZAZIONE in situ DI PROTEINE IN CELLULE E TESSUTI
 LOCALIZZAZIONE in situ DI PROTEINE IN CELLULE E TESSUTI 1 Che cosa sono le proteine? Indispensabili per il corretto funzionamento 2 Dove si trovano le proteine? Le proteine sono macromolecole ubiquitarie,
LOCALIZZAZIONE in situ DI PROTEINE IN CELLULE E TESSUTI 1 Che cosa sono le proteine? Indispensabili per il corretto funzionamento 2 Dove si trovano le proteine? Le proteine sono macromolecole ubiquitarie,
Laura Borghi Anatomia Patologica Azienda ULSS 18 Rovigo
 Laura Borghi Anatomia Patologica Azienda ULSS 18 Rovigo Anatomia Patologica Azienda ULSS 18 Rovigo MARKERS PROGNOSTICI p16 INK4a / Ki67 IN UNA POPOLAZIONE SELEZIONATA HPV DNA-HR POSITIVO: CORRELAZIONE
Laura Borghi Anatomia Patologica Azienda ULSS 18 Rovigo Anatomia Patologica Azienda ULSS 18 Rovigo MARKERS PROGNOSTICI p16 INK4a / Ki67 IN UNA POPOLAZIONE SELEZIONATA HPV DNA-HR POSITIVO: CORRELAZIONE
Rischio Chimico. Definizioni
 Rischio Chimico Definizioni a) agenti chimici: tutti gli elementi o composti chimici, sia da soli sia nei loro miscugli, allo stato naturale o ottenuti, utilizzati o smaltiti, compreso lo smaltimento come
Rischio Chimico Definizioni a) agenti chimici: tutti gli elementi o composti chimici, sia da soli sia nei loro miscugli, allo stato naturale o ottenuti, utilizzati o smaltiti, compreso lo smaltimento come
ZytoDot SPEC HER2 Probe
 ZytoDot SPEC HER2 Probe C-3001-400 C-3001-100 40 (0.4 ml) 10 (0.1 ml) Per la rilevazione del gene umano HER2 mediante ibridazione in situ cromogenica (CISH).... Dispositivo per uso diagnostico in vitro
ZytoDot SPEC HER2 Probe C-3001-400 C-3001-100 40 (0.4 ml) 10 (0.1 ml) Per la rilevazione del gene umano HER2 mediante ibridazione in situ cromogenica (CISH).... Dispositivo per uso diagnostico in vitro
PROGENSA PCA3 Urine Specimen Transport Kit
 PROGENSA PCA3 Urine Specimen Transport Kit Istruzioni per i medici Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
PROGENSA PCA3 Urine Specimen Transport Kit Istruzioni per i medici Per l uso diagnostico in vitro. Solo per l esportazione dagli U.S.A. Istruzioni 1. Si consiglia di chiedere al paziente di bere una grande
INGEZIM Gluten Quanti Test Guida all utilizzo
 INGEZIM Gluten Quanti Test Guida all utilizzo 1 - INTRODUZIONE Il kit è basato su un saggio immunoenzimatico ELISA di tipo sandwich come dettato dal Codex Alimentarius. Ogni pozzetto è rivestito sul fondo
INGEZIM Gluten Quanti Test Guida all utilizzo 1 - INTRODUZIONE Il kit è basato su un saggio immunoenzimatico ELISA di tipo sandwich come dettato dal Codex Alimentarius. Ogni pozzetto è rivestito sul fondo
Sistema di rilevazione dei polimeri MultiVision: Polimeri Multivision anti-coniglio/ HRP + anti-topo/ AP
 Sistema di rilevazione dei polimeri MultiVision: Polimeri Multivision anti-coniglio/ HRP + anti-topo/ AP Pag. 1 di 5 USO PREVISTO: Per uso diagnostico in vitro. DISPONIBILITÀ: Codice catalogo Quantità
Sistema di rilevazione dei polimeri MultiVision: Polimeri Multivision anti-coniglio/ HRP + anti-topo/ AP Pag. 1 di 5 USO PREVISTO: Per uso diagnostico in vitro. DISPONIBILITÀ: Codice catalogo Quantità
ISTRUZIONI D USO IVD 0123 HLA CLASSE II REF 7029: HISTO TRAY DR 72 (10)
 ISTRUZIONI D USO IVD 0123 HISTO TRAY HLA CLASSE II PER USO DIAGNOSTICO IN VITRO REF 7029: HISTO TRAY DR 72 (10) 10 piastre Descrizione del prodotto La destinazione d uso dell HISTO TRAY è la tipizzazione
ISTRUZIONI D USO IVD 0123 HISTO TRAY HLA CLASSE II PER USO DIAGNOSTICO IN VITRO REF 7029: HISTO TRAY DR 72 (10) 10 piastre Descrizione del prodotto La destinazione d uso dell HISTO TRAY è la tipizzazione
Rischio Biologico D.lgs. 81/08
 Rischio Biologico D.lgs. 81/08 TITOLO X - ESPOSIZIONE AD AGENTI BIOLOGICI CAPO I - DISPOSIZIONI GENERALI Articolo 266 - Campo di applicazione 1. Le norme del presente Titolo si applicano a tutte le attività
Rischio Biologico D.lgs. 81/08 TITOLO X - ESPOSIZIONE AD AGENTI BIOLOGICI CAPO I - DISPOSIZIONI GENERALI Articolo 266 - Campo di applicazione 1. Le norme del presente Titolo si applicano a tutte le attività
Foglio illustrativo: informazioni per l utilizzatore. NEOMERCUROCROMO soluzione cutanea. Eosina/ Cloroxilenolo/ Propilenglicole
 Foglio illustrativo: informazioni per l utilizzatore NEOMERCUROCROMO soluzione cutanea Eosina/ Cloroxilenolo/ Propilenglicole Legga attentamente questo foglio prima di usare questo medicinale perchè contiene
Foglio illustrativo: informazioni per l utilizzatore NEOMERCUROCROMO soluzione cutanea Eosina/ Cloroxilenolo/ Propilenglicole Legga attentamente questo foglio prima di usare questo medicinale perchè contiene
QUANTA Chek Celiac Panel 708113
 QUANTA Chek Celiac Panel 708113 Finalità d uso Il Pannello Celiac QUANTA Chek TM è utilizzato per il controllo della qualità delle procedure per la ricerca degli autoanticorpi IFA ed ELISA. Ciascun siero
QUANTA Chek Celiac Panel 708113 Finalità d uso Il Pannello Celiac QUANTA Chek TM è utilizzato per il controllo della qualità delle procedure per la ricerca degli autoanticorpi IFA ed ELISA. Ciascun siero
Molti anticorpi gruppo-ematici reagiscono con i corrispondenti antigeni sui globuli rossi in vitro senza determinare alcun effetto visibile.
 Molti anticorpi gruppo-ematici reagiscono con i corrispondenti antigeni sui globuli rossi in vitro senza determinare alcun effetto visibile. Questi anticorpi sono delle molecole IgG che attaccano un solo
Molti anticorpi gruppo-ematici reagiscono con i corrispondenti antigeni sui globuli rossi in vitro senza determinare alcun effetto visibile. Questi anticorpi sono delle molecole IgG che attaccano un solo
GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA
 GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA Istruzioni Scrivere il proprio nome e cognome su questa pagina e sulla scheda delle risposte. Seguire le regole di sicurezza di laboratorio: se vengono
GARA NAZIONALE DI CHIMICA VIII EDIZIONE PROVA PRATICA Istruzioni Scrivere il proprio nome e cognome su questa pagina e sulla scheda delle risposte. Seguire le regole di sicurezza di laboratorio: se vengono
CLOSTRIDIUM DIFFICILE TOSSINE A e B
 MODALITA' DI RICHIESTA: Pazienti interni: tramite modulo interno prestampato. Pazienti esterni: tramite richiesta del medico curante. PREPARAZIONE DEL PAZIENTE ALL'ESAME: Nessuna. MODALITA' DI RACCOLTA
MODALITA' DI RICHIESTA: Pazienti interni: tramite modulo interno prestampato. Pazienti esterni: tramite richiesta del medico curante. PREPARAZIONE DEL PAZIENTE ALL'ESAME: Nessuna. MODALITA' DI RACCOLTA
1. Elementi d identificazione della sostanza o del preparato e della società /impresa produttrice
 Pagina 1 di 9 SCHEDA DEI DATI DI SICUREZZA Yotuel Dental Office 10 Minute kit (carbamide perossido 30%) with accelerator Secondo 93/42/CEE 1. Elementi d identificazione della sostanza o del preparato e
Pagina 1 di 9 SCHEDA DEI DATI DI SICUREZZA Yotuel Dental Office 10 Minute kit (carbamide perossido 30%) with accelerator Secondo 93/42/CEE 1. Elementi d identificazione della sostanza o del preparato e
Dispositivo di prelievo Aptima Multitest Swab
 Uso previsto Il dispositivo di prelievo Aptima Multitest Swab è previsto per l uso con i test Aptima. Il dispositivo di prelievo Aptima Multitest Swab è previsto per l uso per la raccolta di campioni vaginali
Uso previsto Il dispositivo di prelievo Aptima Multitest Swab è previsto per l uso con i test Aptima. Il dispositivo di prelievo Aptima Multitest Swab è previsto per l uso per la raccolta di campioni vaginali
RAPPORTO SULLA VALUTAZIONE DELLA CITOTOSSICITÀ DI UN IMPIANTO TITANMED
 RAPPORTO SULLA VALUTAZIONE DELLA CITOTOSSICITÀ DI UN IMPIANTO TITANMED Riferimento: Ns. pratica 3000900357 Valutazioni eseguite da: Dr.ssa Clara CASSINELLI... n. copie distribuite: 1 Testo e immagini sono
RAPPORTO SULLA VALUTAZIONE DELLA CITOTOSSICITÀ DI UN IMPIANTO TITANMED Riferimento: Ns. pratica 3000900357 Valutazioni eseguite da: Dr.ssa Clara CASSINELLI... n. copie distribuite: 1 Testo e immagini sono
Valutazione del test rapido Geenius HIV1/2 per la conferma degli anticorpi anti HIV1-2. Gianna Mazzarelli
 Valutazione del test rapido Geenius HIV1/2 per la conferma degli anticorpi anti HIV1-2 Gianna Mazzarelli 14/09/2015 Tempi di rilevazione di specifici markers di infezione HIV Test combinati Ag/Ab Ag ricombinanti
Valutazione del test rapido Geenius HIV1/2 per la conferma degli anticorpi anti HIV1-2 Gianna Mazzarelli 14/09/2015 Tempi di rilevazione di specifici markers di infezione HIV Test combinati Ag/Ab Ag ricombinanti
Allestimenti e diagnosi intra-day: tecniche a confronto. Mara Dal Santo Anatomia Patologica Ospedale S. Chiara - Trento
 Allestimenti e diagnosi intra-day: tecniche a confronto Mara Dal Santo Anatomia Patologica Ospedale S. Chiara - Trento 1 Nuove esigenze Domanda da parte dei Clinici Domanda da parte degli utenti Tempi
Allestimenti e diagnosi intra-day: tecniche a confronto Mara Dal Santo Anatomia Patologica Ospedale S. Chiara - Trento 1 Nuove esigenze Domanda da parte dei Clinici Domanda da parte degli utenti Tempi
PROTOCOLLO RACCOLTA SANGUE PER ANALISI OMICHE
 PROTOCOLLO RACCOLTA SANGUE PER ANALISI OMICHE 00028 Autori Vittorio Sirolli Gianluigi Zaza Contenuti Premesse - Introduzione separazione del plasma Premesse - Introduzione separazione del plasma release
PROTOCOLLO RACCOLTA SANGUE PER ANALISI OMICHE 00028 Autori Vittorio Sirolli Gianluigi Zaza Contenuti Premesse - Introduzione separazione del plasma Premesse - Introduzione separazione del plasma release
Scheda del protocollo QIAsymphony SP
 Scheda del protocollo QIAsymphony SP Protocollo DNA_Blood_400_V6_DSP Informazioni generali Per uso diagnostico in vitro. Questo protocollo è previsto per la purificazione del DNA genomico totale e mitocondriale
Scheda del protocollo QIAsymphony SP Protocollo DNA_Blood_400_V6_DSP Informazioni generali Per uso diagnostico in vitro. Questo protocollo è previsto per la purificazione del DNA genomico totale e mitocondriale
4F81BDSCHEDA TECNICA 4F81BD
 04011Pagina 1 di 5 pagine Codice prodotto: Nome prodotto: Consigliato per: Dimensioni disponibili: 120101 Gori Detergente concentrato rimuove alghe, muschio e strati verdi Tutti i legni per esterni 1 L
04011Pagina 1 di 5 pagine Codice prodotto: Nome prodotto: Consigliato per: Dimensioni disponibili: 120101 Gori Detergente concentrato rimuove alghe, muschio e strati verdi Tutti i legni per esterni 1 L
SCHEDA DI SICUREZZA. Conforme al Regolamento CE 1907/2006, come modificato dal Regolamento CE 453/2010
 Pag.1 di 5 1. IDENTIFICAZIONE DEL PRODOTTO 1.1 Nome commerciale: POLISMUR 685 Componente B 1.2 Uso: Usi sconsigliati: Impermeabilizzante, idrorepellente ed incolore per i trattamenti di cortine in muratura
Pag.1 di 5 1. IDENTIFICAZIONE DEL PRODOTTO 1.1 Nome commerciale: POLISMUR 685 Componente B 1.2 Uso: Usi sconsigliati: Impermeabilizzante, idrorepellente ed incolore per i trattamenti di cortine in muratura
Heat Shock Protein 27 (G3.1)
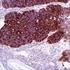 Identificazione Prodotto N Catalogo Descrizione 46946 HSP27 0,1 M (G3.1) 46947 HSP27 1 M (G3.1) 46945 HSP27 RTU M (G3.1) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Identificazione Prodotto N Catalogo Descrizione 46946 HSP27 0,1 M (G3.1) 46947 HSP27 1 M (G3.1) 46945 HSP27 RTU M (G3.1) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
ESAME MORFOLOGICO DEL SANGUE
 ESAME MORFOLOGICO DEL SANGUE Obiettivo Con l esame morfologico del sangue si intende differenziare gli elementi figurati del sangue, tramite la colorazione di May Grunwald-Giemsa, per poterli riconoscere
ESAME MORFOLOGICO DEL SANGUE Obiettivo Con l esame morfologico del sangue si intende differenziare gli elementi figurati del sangue, tramite la colorazione di May Grunwald-Giemsa, per poterli riconoscere
Striscia reattiva glicemia ematocrito emoglobina. N. modello: TD-4272 / GD40 DELTA
 Striscia reattiva glicemia ematocrito emoglobina AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori che eseguono
Striscia reattiva glicemia ematocrito emoglobina AVVERTENZE Per uso diagnostico in vitro (esclusivamente per uso esterno). Esclusivamente monouso. Il personale medico e gli altri operatori che eseguono
SERVIZIO SANITARIO NAZIONALE REGIONE BASILICATA Asl 4 - Matera SERVIZIO ASSISTENZA
 SERVIZIO SANITARIO NAZIONALE REGIONE BASILICATA Asl 4 - Matera SERVIZIO ASSISTENZA Pagina 2/6 SOMMARIO 1. SCOPO/OBIETTIVO...3 2. CAMPO DI APPLICAZIONE...3 3. RIFERIMENTI NORMATIVI E DOCUMENTALI...3 4.
SERVIZIO SANITARIO NAZIONALE REGIONE BASILICATA Asl 4 - Matera SERVIZIO ASSISTENZA Pagina 2/6 SOMMARIO 1. SCOPO/OBIETTIVO...3 2. CAMPO DI APPLICAZIONE...3 3. RIFERIMENTI NORMATIVI E DOCUMENTALI...3 4.
 ACIDITA su burro, margarine, panna e grassi semilavorati PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA PREPARAZIONE DEL CAMPIONE CONDIZIONI DI REAZIONE (Edit) Gli acidi grassi del campione, in
ACIDITA su burro, margarine, panna e grassi semilavorati PRINCIPIO REAGENTI PREPARAZIONE DEL REAGENTE STABILITA PREPARAZIONE DEL CAMPIONE CONDIZIONI DI REAZIONE (Edit) Gli acidi grassi del campione, in
A-1-Antichymotrypsin (Polyclonal)
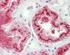 Identificazione Prodotto N Catalogo Descrizione 44421 Alpha-1-Antichymotrypsin 0,1 R (Poly) 44422 Alpha-1-Antichymotrypsin 1 R (Poly) 44197 Alpha-1-Antichymotrypsin RTU R (Poly) Definizione Dei Simboli
Identificazione Prodotto N Catalogo Descrizione 44421 Alpha-1-Antichymotrypsin 0,1 R (Poly) 44422 Alpha-1-Antichymotrypsin 1 R (Poly) 44197 Alpha-1-Antichymotrypsin RTU R (Poly) Definizione Dei Simboli
Tecnica di preparazione di vetrini istologici. By A. Pirola
 Tecnica di preparazione di vetrini istologici By A. Pirola Preparazione del materiale istologico Problema 1 I tessuti vanno incontro a fenomeni di degradazione Problema 2 La luce può attraversare solo
Tecnica di preparazione di vetrini istologici By A. Pirola Preparazione del materiale istologico Problema 1 I tessuti vanno incontro a fenomeni di degradazione Problema 2 La luce può attraversare solo
Cytokeratin Cocktail (AE1 & AE3)
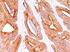 Identificazione Prodotto N Catalogo Descrizione 44575 Cytokeratin Cocktail 0,1 M (AE1&AE3) 44576 Cytokeratin Cocktail 1 M (AE1&AE3) 44277 Cytokeratin Cocktail RTU M (AE1&AE3) Definizione Dei Simboli P
Identificazione Prodotto N Catalogo Descrizione 44575 Cytokeratin Cocktail 0,1 M (AE1&AE3) 44576 Cytokeratin Cocktail 1 M (AE1&AE3) 44277 Cytokeratin Cocktail RTU M (AE1&AE3) Definizione Dei Simboli P
PICAFLOOR. Scheda Tecnica
 Rev. A PICAFLOOR Descrizione Caratteristiche generali Campi di applicazione Proprietà fisiche Preparazione Applicazione Confezioni Conservazione Precauzioni e avvertenze DESCRIZIONE Resina metacrilica
Rev. A PICAFLOOR Descrizione Caratteristiche generali Campi di applicazione Proprietà fisiche Preparazione Applicazione Confezioni Conservazione Precauzioni e avvertenze DESCRIZIONE Resina metacrilica
PIERREL FARMACEUTICI S.P.A. SCHEDA DI SICUREZZA: ALFA PIERREL
 PIERREL FARMACEUTICI S.P.A. SCHEDA DI SICUREZZA: ALFA PIERREL ISTRUZIONE OPERATIVA SICUREZZA DATA DI EMISSIONE: NOVEMBRE 2001 1. ELEMENTI IDENTIFICATIVI DEL PREPARATO E DELLA SOCIETÀ 1.1 ELEMENTI IDENTIFICATIVI
PIERREL FARMACEUTICI S.P.A. SCHEDA DI SICUREZZA: ALFA PIERREL ISTRUZIONE OPERATIVA SICUREZZA DATA DI EMISSIONE: NOVEMBRE 2001 1. ELEMENTI IDENTIFICATIVI DEL PREPARATO E DELLA SOCIETÀ 1.1 ELEMENTI IDENTIFICATIVI
Scheda dati di sicurezza Conforme a Direttiva 2001 / 58 / CE. 1. Identificazione della sostanza/preparazione e azienda
 1. Identificazione della sostanza/preparazione e azienda Definizione del prodotto: Uso previsto: BREF MULTIUSO detergente multiuso per superfici dure Denominazione ditta: Henkel S.p.A. Via Barrella n 6
1. Identificazione della sostanza/preparazione e azienda Definizione del prodotto: Uso previsto: BREF MULTIUSO detergente multiuso per superfici dure Denominazione ditta: Henkel S.p.A. Via Barrella n 6
IMPATH HER2 FISH. Identificazione del prodotto Cat. N. Descrizione ImPath HER2 FISH
 Identificazione del prodotto Cat. N. Descrizione 47862 ImPath HER2 FISH Uso previsto ImPath HER2 FISH (cat. n. 47862) è destinato all uso in combinazione con ImPath ISH Detection Kit (cat. n. 44996) per
Identificazione del prodotto Cat. N. Descrizione 47862 ImPath HER2 FISH Uso previsto ImPath HER2 FISH (cat. n. 47862) è destinato all uso in combinazione con ImPath ISH Detection Kit (cat. n. 44996) per
N:B. I puntali applicatori/miscelatori sono monouso.
 1. CARATTERISTICHE GENERALI Il gel sbiancante BY X tra 38% è utilizzato per sbiancare denti con discromie. Il gel viene applicato direttamente sui denti. Secondo la direttiva Medical Devices 93/42/CEE
1. CARATTERISTICHE GENERALI Il gel sbiancante BY X tra 38% è utilizzato per sbiancare denti con discromie. Il gel viene applicato direttamente sui denti. Secondo la direttiva Medical Devices 93/42/CEE
CE-5700A Manuale d uso
 CE-5700A Manuale d uso 0 Indice Pag 2 Introduzione Pag 2 Avvertenze Pag 3 Descrizione Pag 4 Istruzioni per l uso Pag 4 Specifiche Pag 5 Processi di pulizia Pag 6 Cura e manutenzione Pag 6 Smaltimento dei
CE-5700A Manuale d uso 0 Indice Pag 2 Introduzione Pag 2 Avvertenze Pag 3 Descrizione Pag 4 Istruzioni per l uso Pag 4 Specifiche Pag 5 Processi di pulizia Pag 6 Cura e manutenzione Pag 6 Smaltimento dei
SCHEDA DI SICUREZZA. Direttiva CEE 91/155
 SCHEDA DI SICUREZZA Direttiva CEE 91/155 1.0 IDENTIFICAZIONE PRODOTTO E SOCIETA' 1.1 Nome commerciale ALG 5-MB 1.2 Impieghi Addensante per stampa. 1.3 Produttore ed assistenza DATT CHIMICA SRL Via Clerici,
SCHEDA DI SICUREZZA Direttiva CEE 91/155 1.0 IDENTIFICAZIONE PRODOTTO E SOCIETA' 1.1 Nome commerciale ALG 5-MB 1.2 Impieghi Addensante per stampa. 1.3 Produttore ed assistenza DATT CHIMICA SRL Via Clerici,
PD-L1 IHC 28-8 pharmdx. SK test per l'utilizzo con Autostainer Link 48. Uso previsto Per uso diagnostico in vitro.
 PD-L1 IHC 28-8 pharmdx SK005 50 test per l'utilizzo con Autostainer Link 48 Uso previsto Per uso diagnostico in vitro. PD-L1 IHC 28-8 pharmdx è un saggio immunoistochimico qualitativo che utilizza Monoclonal
PD-L1 IHC 28-8 pharmdx SK005 50 test per l'utilizzo con Autostainer Link 48 Uso previsto Per uso diagnostico in vitro. PD-L1 IHC 28-8 pharmdx è un saggio immunoistochimico qualitativo che utilizza Monoclonal
ELENCO DELLE FRASI DI RISCHIO attualmente previste dalla U.E. per sostanze e preparati pericolosi (FRASI R)
 ELENCO DELLE FRASI DI RISCHIO attualmente previste dalla U.E. per sostanze e preparati pericolosi (FRASI R) R1 = esplosivo allo stato secco R2 = rischio di esplosione per urto, sfregamento, fuoco o altre
ELENCO DELLE FRASI DI RISCHIO attualmente previste dalla U.E. per sostanze e preparati pericolosi (FRASI R) R1 = esplosivo allo stato secco R2 = rischio di esplosione per urto, sfregamento, fuoco o altre
la dimostrazione dei linfomi di tipo B è possibile con studi di riarrangiamento genico clonale. Principi E Procedure
 Identificazione Prodotto N Catalogo Descrizione 44660 IgM 0,1 R (Poly) 44661 IgM 1 R (Poly) 44319 IgM RTU R (Poly) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
Identificazione Prodotto N Catalogo Descrizione 44660 IgM 0,1 R (Poly) 44661 IgM 1 R (Poly) 44319 IgM RTU R (Poly) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
SAFE - Scuola di Scienze Agrarie, Forestali, Alimentari ed Ambientali. School of Agriculture, forest, Food and Environmental sciences
 Protocollo SAFE Determinazione dell attività antiossidante Valutazione della resistenza allo stress ossidativo in presenza di perossido d idrogeno Soluzione di perossido d idrogeno 1,6 M. Esporre i campioni
Protocollo SAFE Determinazione dell attività antiossidante Valutazione della resistenza allo stress ossidativo in presenza di perossido d idrogeno Soluzione di perossido d idrogeno 1,6 M. Esporre i campioni
LINFONODO SENTINELLA: IL RUOLO DEL PATOLOGO. Dr. Giorgio Gardini U.O Anatomia Patologica Azienda Ospedaliera Reggio Emilia
 LINFONODO SENTINELLA: IL RUOLO DEL PATOLOGO Dr. Giorgio Gardini U.O Anatomia Patologica Azienda Ospedaliera Reggio Emilia REGISTRO TUMORI REGGIANO CASI INCIDENTI DI TUMORE DELLA MAMMELLA INFILTRANTE ANNI
LINFONODO SENTINELLA: IL RUOLO DEL PATOLOGO Dr. Giorgio Gardini U.O Anatomia Patologica Azienda Ospedaliera Reggio Emilia REGISTRO TUMORI REGGIANO CASI INCIDENTI DI TUMORE DELLA MAMMELLA INFILTRANTE ANNI
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione
 Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
Gestione infermieristica dei nuovi farmaci biologici nelle pazienti con carcinoma mammario: modalità di somministrazione Beniamino Micheloni U.O.C. Oncologia Medica Ospedale Sacro Cuore Don Calabria Negrar
Trattamento Evolution Pro
 Trattamento Evolution Pro ANTICRESPO / ONDE E RICCI CONTROLLATI EVOLUTION PRO SHAMPOO PRODOTTI NECESSARI: EVOLUTION PRO FRIZZ TAMER EVOLUTION PRO CONDITIONER PIASTRA J PREMIUM 1 STEP BY STEP - Trattamento
Trattamento Evolution Pro ANTICRESPO / ONDE E RICCI CONTROLLATI EVOLUTION PRO SHAMPOO PRODOTTI NECESSARI: EVOLUTION PRO FRIZZ TAMER EVOLUTION PRO CONDITIONER PIASTRA J PREMIUM 1 STEP BY STEP - Trattamento
Leggete l etichetta! Tutto quello che c è da sapere per un utilizzo sicuro dei detersivi e dei prodotti di pulizia per la casa
 Leggete l etichetta! Tutto quello che c è da sapere per un utilizzo sicuro dei detersivi e dei prodotti di pulizia per la casa Presto vedrete sui prodotti per la pulizia domestica nuove etichette con le
Leggete l etichetta! Tutto quello che c è da sapere per un utilizzo sicuro dei detersivi e dei prodotti di pulizia per la casa Presto vedrete sui prodotti per la pulizia domestica nuove etichette con le
Le seguenti istruzioni sono relative al sistema Dako EnVision+ System- HRP (AEC) (Dako EnVision+ System, HRP).
 Dako EnVision+ System-HRP (AEC) For Use with Mouse Primary Antibodies Codice n. K4004 115 ml Codice n. K4005 110 ml Uso previsto Per uso diagnostico in vitro. Le seguenti istruzioni sono relative al sistema
Dako EnVision+ System-HRP (AEC) For Use with Mouse Primary Antibodies Codice n. K4004 115 ml Codice n. K4005 110 ml Uso previsto Per uso diagnostico in vitro. Le seguenti istruzioni sono relative al sistema
Protocollo di predisinfezione/pulizia manuale e sterilizzazione degli inserti e delle lime SATELEC
 Protocollo di predisinfezione/pulizia manuale e sterilizzazione degli inserti e delle lime SATELEC Avvertenze: Non utilizzare lana d acciaio o prodotti di pulizia abrasivi. Evitare le soluzioni contenenti
Protocollo di predisinfezione/pulizia manuale e sterilizzazione degli inserti e delle lime SATELEC Avvertenze: Non utilizzare lana d acciaio o prodotti di pulizia abrasivi. Evitare le soluzioni contenenti
La chimica dei prodotti usati nelle tintolavanderie. A cura della D.ssa Silvia Barra, chimico
 La chimica dei prodotti usati nelle tintolavanderie A cura della D.ssa Silvia Barra, chimico Un po di sicurezza Schede di sicurezza: leggerle per lavorare in sicurezza e per sapere come usare, conservare
La chimica dei prodotti usati nelle tintolavanderie A cura della D.ssa Silvia Barra, chimico Un po di sicurezza Schede di sicurezza: leggerle per lavorare in sicurezza e per sapere come usare, conservare
Un anticorpo è una proteina prodotta dai linfociti B in risposta all ingresso nell organismo di un antigene.
 Un antigene è una molecola (proteica o polisaccaridica), o una sua parte, che è in grado di stimolare una risposta specifica del sistema immunitario. Affinché una molecola funga da antigene è necessario
Un antigene è una molecola (proteica o polisaccaridica), o una sua parte, che è in grado di stimolare una risposta specifica del sistema immunitario. Affinché una molecola funga da antigene è necessario
Il Nodulo Tiroideo. "Diagnostica Citologica" SOC Anatomia Patologica - Casale/Valenza
 Il Nodulo Tiroideo "Diagnostica Citologica" SOC Anatomia Patologica - Casale/Valenza FNAC Con il termine di FNAC (Fine Needle Aspiration Cytology) si intende un prelievo citologico eseguito mediante un
Il Nodulo Tiroideo "Diagnostica Citologica" SOC Anatomia Patologica - Casale/Valenza FNAC Con il termine di FNAC (Fine Needle Aspiration Cytology) si intende un prelievo citologico eseguito mediante un
VALUTAZIONE DEL POTERE BATTERICIDA (SANIFICANTE 10)
 VALUTAZIONE DEL POTERE BATTERICIDA (SANIFICANTE 10) 1. SCOPO Testare le capacità battericida del SANIFICANTE 10, detergente igienizzante a base di sali quaternari di ammonio, nelle condizioni di sporco
VALUTAZIONE DEL POTERE BATTERICIDA (SANIFICANTE 10) 1. SCOPO Testare le capacità battericida del SANIFICANTE 10, detergente igienizzante a base di sali quaternari di ammonio, nelle condizioni di sporco
Scheda di dati di sicurezza ai sensi del regolamento 1907/2006/CE, Articolo 31
 Pagina: 1/4 Stampato il: 06.03.2013 Numero versione 5 1 Identificazione della sostanza o della miscela e della società/impresa Identificatore del prodotto Denominazione commerciale: Meron AC polvere Usi
Pagina: 1/4 Stampato il: 06.03.2013 Numero versione 5 1 Identificazione della sostanza o della miscela e della società/impresa Identificatore del prodotto Denominazione commerciale: Meron AC polvere Usi
BENZILPENICILLINA BENZATINICA PREPARAZIONE INIETTABILI. Benzilpenicillina Benzatinica polvere sterile per preparazioni iniettabili
 1 1 1 1 1 1 1 1 0 1 0 1 0 1 1 01/FU Maggio 00 Commenti entro il 0 Settembre 00 NOTA: Corretta in seguito ai commenti della Dott.ssa Mozzetti La monografia è stata revisionata per armonizzarla con le altre
1 1 1 1 1 1 1 1 0 1 0 1 0 1 1 01/FU Maggio 00 Commenti entro il 0 Settembre 00 NOTA: Corretta in seguito ai commenti della Dott.ssa Mozzetti La monografia è stata revisionata per armonizzarla con le altre
Progesterone Receptor (Y85)
 Identificazione Prodotto N Catalogo Descrizione 44771 Progesterone Receptor 0,1 R (Y85) 44772 Progesterone Receptor 1 R (Y85) 44376 Progesterone Receptor RTU R (Y85) Definizione Dei Simboli P C A E S DIL
Identificazione Prodotto N Catalogo Descrizione 44771 Progesterone Receptor 0,1 R (Y85) 44772 Progesterone Receptor 1 R (Y85) 44376 Progesterone Receptor RTU R (Y85) Definizione Dei Simboli P C A E S DIL
EXTRA-GENE I Kit per l estrazione del DNA genomico 50 Estrazioni
 IT Istruzioni d uso EXTRA-GENE I Kit per l estrazione del DNA genomico 50 Estrazioni REF 7059 1. Descrizione del prodotto EXTRA-GENE è un kit per l estrazione veloce del DNA genomico senza l utilizzo di
IT Istruzioni d uso EXTRA-GENE I Kit per l estrazione del DNA genomico 50 Estrazioni REF 7059 1. Descrizione del prodotto EXTRA-GENE è un kit per l estrazione veloce del DNA genomico senza l utilizzo di
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44761 PLAP 0,1 M (NB10) 44762 PLAP 1 M (NB10) 44371 PLAP RTU M (NB10) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
Identificazione Prodotto N Catalogo Descrizione 44761 PLAP 0,1 M (NB10) 44762 PLAP 1 M (NB10) 44371 PLAP RTU M (NB10) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero
SCHEDA DI SICUREZZA. Nome Prodotto Configurazione Kit Codice. IL Test CK 8 x 10 ml CK R x 5 ml CK R2
 SCHEDA DI SICUREZZA DATA DI COMPILAZIONE: Marzo 2005 Rev. 0 1. IDENTIFICAZIONE PRODOTTO La seguente Scheda di Sicurezza si applica a: Nome Prodotto Configurazione Kit Codice IL Test CK 8 x 10 ml CK R1
SCHEDA DI SICUREZZA DATA DI COMPILAZIONE: Marzo 2005 Rev. 0 1. IDENTIFICAZIONE PRODOTTO La seguente Scheda di Sicurezza si applica a: Nome Prodotto Configurazione Kit Codice IL Test CK 8 x 10 ml CK R1
ANDREFIX. Scheda Tecnica
 Rev. A ANDREFIX Descrizione Caratteristiche generali Campi di applicazione Proprietà fisiche Preparazione Applicazione Confezioni Conservazione Precauzioni ed avvertenze DESCRIZIONE Impregnante idrorepellente
Rev. A ANDREFIX Descrizione Caratteristiche generali Campi di applicazione Proprietà fisiche Preparazione Applicazione Confezioni Conservazione Precauzioni ed avvertenze DESCRIZIONE Impregnante idrorepellente
REGIONE VENETO / Segreteria regionale Sanità e Sociale- ARSS Agenzia Regionale Sanitaria e Sociosanitaria
 Lista di verifica REQUITI MINIMI SPECIFICI E DI QUALITA' PER L'AUTORIZZAZIONE 1 - REQUITI STRUTTURALI LABPAT.AU.1.1 I locali e gli spazi sono dimensionati in funzione della tipologia e del volume dell'attività
Lista di verifica REQUITI MINIMI SPECIFICI E DI QUALITA' PER L'AUTORIZZAZIONE 1 - REQUITI STRUTTURALI LABPAT.AU.1.1 I locali e gli spazi sono dimensionati in funzione della tipologia e del volume dell'attività
Scheda dei Dati di Sicurezza Secondo le Direttive 91/155/CEE
 1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Sodio Silicato neutro, soluzione 1.2 Nome della societá o ditta: PANREAC
1. Identificazione della sostanza/preparato e della societá o ditta 1.1 Identificazione della sostanza o del preparato Denominazione: Sodio Silicato neutro, soluzione 1.2 Nome della societá o ditta: PANREAC
Scheda Volontaria Informativa di Prodotto per abrasivi flessibili basata sul formato di una Scheda Di Sicurezza CK917C
 pag. 1 di 6 Scheda Volontaria Informativa di Prodotto per abrasivi flessibili basata sul formato di una Scheda Di Sicurezza 1. Identificazione del prodotto e della società/impresa 1.1 Nome del prodotto
pag. 1 di 6 Scheda Volontaria Informativa di Prodotto per abrasivi flessibili basata sul formato di una Scheda Di Sicurezza 1. Identificazione del prodotto e della società/impresa 1.1 Nome del prodotto
Pulizia degli iniettori Diesel
 Pulizia degli iniettori Diesel con TUNAP microflex 938 - Pulitore diretto iniettori Diesel TUNAP Injecto Clean System 16 13310 1 Introduzione Il sistema TUNAP consente di utilizzare tecnologie avanzate,
Pulizia degli iniettori Diesel con TUNAP microflex 938 - Pulitore diretto iniettori Diesel TUNAP Injecto Clean System 16 13310 1 Introduzione Il sistema TUNAP consente di utilizzare tecnologie avanzate,
AMPICILLINA SODICA PREPARAZIONE INIETTABILE. Ampicillina sodica polvere sterile per preparazioni iniettabili
 1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
COMPARAZIONE DELLA METODICA AUTOMATICA SISH
 COMPARAZIONE DELLA METODICA AUTOMATICA SISH (Silver Enhanced In Situ Hybridization) CON LA METODICA MANUALE FISH (Fluorescence In Situ Hybridization) PER LA VALUTAZIONE DELLO STATO DEL GENE HER2 (neu)
COMPARAZIONE DELLA METODICA AUTOMATICA SISH (Silver Enhanced In Situ Hybridization) CON LA METODICA MANUALE FISH (Fluorescence In Situ Hybridization) PER LA VALUTAZIONE DELLO STATO DEL GENE HER2 (neu)
Lavaggio degli eritrociti
 1 Lavaggio degli eritrociti Le attività emolitica ed emoagglutinante del virus Sendai richiedono una soluzione di eritrociti umani lavati in tampone PBS e diluiti al 2% (v/v). Reagenti Sangue umano fresco.
1 Lavaggio degli eritrociti Le attività emolitica ed emoagglutinante del virus Sendai richiedono una soluzione di eritrociti umani lavati in tampone PBS e diluiti al 2% (v/v). Reagenti Sangue umano fresco.
ARTEFATTI E RISCHI DI ERRORE IN IMMUNOISTOCHIMICA U. Gianelli
 ARTEFATTI E RISCHI DI ERRORE IN IMMUNOISTOCHIMICA U. Gianelli Cattedra e Servizio di Anatomia Patologica DMCO - A. O. San Paolo e Fondazione Ospedale Maggiore Policlinico, Mangiagalli e Regina Elena significant
ARTEFATTI E RISCHI DI ERRORE IN IMMUNOISTOCHIMICA U. Gianelli Cattedra e Servizio di Anatomia Patologica DMCO - A. O. San Paolo e Fondazione Ospedale Maggiore Policlinico, Mangiagalli e Regina Elena significant
FIAMMA abrasivi S.a.s.
 SCHEDA DI SICUREZZA CORINDONE 1. IDENTIFICAZIONE DEL PRODOTTO E DELLA SOCIETÀ - Prodotto Corindone Artificiale Ossido di Alluminio - Nome commerciale del prodotto Corindone Rossobruno Corindone Semifriabile
SCHEDA DI SICUREZZA CORINDONE 1. IDENTIFICAZIONE DEL PRODOTTO E DELLA SOCIETÀ - Prodotto Corindone Artificiale Ossido di Alluminio - Nome commerciale del prodotto Corindone Rossobruno Corindone Semifriabile
Strumenti e Tecniche di studio in patologia
 Strumenti e Tecniche di studio in patologia Gli strumenti della patologia: Microscopia Biologia molecolare Indagini biochimiche Microscopia Ottica citopatologia ed istopatologia citochimica ed istochimica
Strumenti e Tecniche di studio in patologia Gli strumenti della patologia: Microscopia Biologia molecolare Indagini biochimiche Microscopia Ottica citopatologia ed istopatologia citochimica ed istochimica
PICAGEL IS 607/A. Scheda Tecnica
 Rev. A PICAGEL IS 607/A Descrizione Caratteristiche generali Campi di applicazione Proprietà fisiche Preparazione Applicazione Confezioni Conservazione Precauzioni ed avvertenze DESCRIZIONE Gelcoat poliestere
Rev. A PICAGEL IS 607/A Descrizione Caratteristiche generali Campi di applicazione Proprietà fisiche Preparazione Applicazione Confezioni Conservazione Precauzioni ed avvertenze DESCRIZIONE Gelcoat poliestere
Soluzione tamponata contenente perossido di idrogeno, detergente e sodio azide 0,015 mol/l.
 PD-L1 IHC 22C3 pharmdx SK006 50 test per l'utilizzo con Autostainer Link 48 Uso previsto Per uso diagnostico in vitro. PD-L1 IHC 22C3 pharmdx è un saggio immunoistochimico qualitativo che utilizza Monoclonal
PD-L1 IHC 22C3 pharmdx SK006 50 test per l'utilizzo con Autostainer Link 48 Uso previsto Per uso diagnostico in vitro. PD-L1 IHC 22C3 pharmdx è un saggio immunoistochimico qualitativo che utilizza Monoclonal
CAPITOLATO DI GARA PER L APPALTO DI DISPOSITIVI PER IL SERVIZIO DI ANATOMIA PATOLOGICA
 Allegato 2 CAPITOLATO DI GARA PER L APPALTO DI DISPOSITIVI PER IL SERVIZIO DI ANATOMIA PATOLOGICA ART.1- OGGETTO DELL APPALTO L appalto ha per oggetto la fornitura di dispositivi, per il Servizio di Anatomia
Allegato 2 CAPITOLATO DI GARA PER L APPALTO DI DISPOSITIVI PER IL SERVIZIO DI ANATOMIA PATOLOGICA ART.1- OGGETTO DELL APPALTO L appalto ha per oggetto la fornitura di dispositivi, per il Servizio di Anatomia
Scheda dati di sicurezza Conforme a ( CE ) n. 1907/2006-ISO
 1. Identificazione della sostanza/preparato e della società/impresa Definizione del prodotto: Uso Previsto: Elementi identificatori della società/impresa: Responsabile della scheda di sicurezza: Numero
1. Identificazione della sostanza/preparato e della società/impresa Definizione del prodotto: Uso Previsto: Elementi identificatori della società/impresa: Responsabile della scheda di sicurezza: Numero
Istruzioni per l'uso. Dycal. Idrossido di calcio radiopaco
 Istruzioni per l'uso Italiano Dycal Idrossido di calcio radiopaco 26 Dycal è un cemento a base di idrossido di calcio autoindurente, radiopaco e molto resistente. Non inibisce la polimerizzazione di materiali
Istruzioni per l'uso Italiano Dycal Idrossido di calcio radiopaco 26 Dycal è un cemento a base di idrossido di calcio autoindurente, radiopaco e molto resistente. Non inibisce la polimerizzazione di materiali
Per la conservazione viene aggiunta sodio azide a una concentrazione finale inferiore allo 0,1 %.
 Scheda Tecnica 0123 Technical File No.: 38 Prodotto: Categoria di prodotto secondo la classificazione CE: Albumina Bovina 22% 30% Allegato III Autocertificazione del produttore Struttura della scheda tecnica
Scheda Tecnica 0123 Technical File No.: 38 Prodotto: Categoria di prodotto secondo la classificazione CE: Albumina Bovina 22% 30% Allegato III Autocertificazione del produttore Struttura della scheda tecnica
Corso STEM Il papilloma virus (Prof.ssa Gabriella Di Cola)
 Corso STEM Il papilloma virus (Prof.ssa Gabriella Di Cola) Il papilloma virus (HPV) interessa maggiormente le donne intorno ai 25 anni di età; esso intacca la zona genitale, in particolare le cellule dell
Corso STEM Il papilloma virus (Prof.ssa Gabriella Di Cola) Il papilloma virus (HPV) interessa maggiormente le donne intorno ai 25 anni di età; esso intacca la zona genitale, in particolare le cellule dell
Dipartimento di Chimica, Materiali e Ingegneria Chimica "Giulio Natta" Servizio Prevenzione e Protezione Dipartimentale
 Dipartimento di Chimica, Materiali e Ingegneria Chimica "Giulio Natta" Servizio Prevenzione e Protezione Dipartimentale DCMIC/SIC/IOP.13.041 27.06.2014 - agg. 1 Procedura di sicurezza per l uso dei guanti
Dipartimento di Chimica, Materiali e Ingegneria Chimica "Giulio Natta" Servizio Prevenzione e Protezione Dipartimentale DCMIC/SIC/IOP.13.041 27.06.2014 - agg. 1 Procedura di sicurezza per l uso dei guanti
Principi E Procedure. Materiali E Metodi
 Identificazione Prodotto N Catalogo Descrizione 44586 EMA 0,1 M (E29) 44587 EMA 1 M (E29) 44282 EMA RTU M (E29) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
Identificazione Prodotto N Catalogo Descrizione 44586 EMA 0,1 M (E29) 44587 EMA 1 M (E29) 44282 EMA RTU M (E29) Definizione Dei Simboli P C A E S DIL DOC# DIS pronto uso concentrato asciti siero supernatante
PLATELIA ASPERGILLUS IgG Negative and Positive Controls
 PLATELIA ASPERGILLUS IgG Negative and Positive Controls 48 62786 Sieri Umani per il Controllo di Qualità 881090-2012/06 sommario 1. USO PREVISTO...27 2. INDICAZIONI PER L USO...27 3. REAGENTI...27 4. AVVERTENZE
PLATELIA ASPERGILLUS IgG Negative and Positive Controls 48 62786 Sieri Umani per il Controllo di Qualità 881090-2012/06 sommario 1. USO PREVISTO...27 2. INDICAZIONI PER L USO...27 3. REAGENTI...27 4. AVVERTENZE
Helicobacter pylori (Polyclonal)
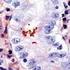 Identificazione Prodotto N Catalogo Descrizione 44626 Helicobacter pylori 0,1 R (Poly) 44627 Helicobacter pylori 1 R (Poly) 44302 Helicobacter pylori RTU R (Poly) Definizione Dei Simboli P C A E S DIL
Identificazione Prodotto N Catalogo Descrizione 44626 Helicobacter pylori 0,1 R (Poly) 44627 Helicobacter pylori 1 R (Poly) 44302 Helicobacter pylori RTU R (Poly) Definizione Dei Simboli P C A E S DIL
Dispense di Analisi Volumetrica
 Dispense di Analisi Volumetrica IIS Gobetti - Marchesini Casale sezione Tecnica Chimica e Materiali Analisi chimica, elaborazione dati e Laboratorio L analisi volumetrica è la procedura o il metodo analitico
Dispense di Analisi Volumetrica IIS Gobetti - Marchesini Casale sezione Tecnica Chimica e Materiali Analisi chimica, elaborazione dati e Laboratorio L analisi volumetrica è la procedura o il metodo analitico
Tecniche diagnostiche
 TEST DIAGNOSTICI Tecniche diagnostiche Infezione corrente Isolamento dell agente eziologico Identificazione del materiale genetico dell agente eziologico Segni clinici Alterazioni patognomoniche Alterazioni
TEST DIAGNOSTICI Tecniche diagnostiche Infezione corrente Isolamento dell agente eziologico Identificazione del materiale genetico dell agente eziologico Segni clinici Alterazioni patognomoniche Alterazioni
Il rischio chimico, cancerogeno e mutageno
 Il rischio chimico, cancerogeno e mutageno Secondo il Titolo IX del D.Lgs. 81/08 e l Accordo Stato Regioni del 21/12/2011 Modulo 1 disposizioni generali SPP EPC Titolo IX del D.Lgs. 81/08 2 Titolo IX del
Il rischio chimico, cancerogeno e mutageno Secondo il Titolo IX del D.Lgs. 81/08 e l Accordo Stato Regioni del 21/12/2011 Modulo 1 disposizioni generali SPP EPC Titolo IX del D.Lgs. 81/08 2 Titolo IX del
Scheda di Sicurezza Sodio Azide (NaN 3 ) Conc.: (0.1% a 0.9%) e (1.0% a 7.0%) Elenco Prodotti
 Scheda di Sicurezza Sodio Azide (NaN 3 ) Conc.: (0.1% a 0.9%) e (1.0% a 7.0%) Elenco Prodotti La seguente scheda di sicurezza è valida per l elenco dei prodotti indicati in tabella Codice Prodotto SOSTANZA
Scheda di Sicurezza Sodio Azide (NaN 3 ) Conc.: (0.1% a 0.9%) e (1.0% a 7.0%) Elenco Prodotti La seguente scheda di sicurezza è valida per l elenco dei prodotti indicati in tabella Codice Prodotto SOSTANZA
SCHEDA DI DATI DI SICUREZZA
 Data di preparazione 15-mar-2011 Numero di revisione 1 1. IDENTIFICAZIONE DELLA SOSTANZA/DEL PREPARATO E DELLA SOCIETÀ/DELL'IMPRESA Nome del prodotto Cat No. Sinonimi Utilizzi raccomandati AN0025 himici
Data di preparazione 15-mar-2011 Numero di revisione 1 1. IDENTIFICAZIONE DELLA SOSTANZA/DEL PREPARATO E DELLA SOCIETÀ/DELL'IMPRESA Nome del prodotto Cat No. Sinonimi Utilizzi raccomandati AN0025 himici
Aspetti metodologici della Citometria a Flusso: un esperienza pratica
 Aspetti metodologici della Citometria a Flusso: un esperienza pratica Moris Cadei Università degli Studi di Brescia Riccione, 22 Maggio 2009 Biopsie gastriche Nel nostro Servizio Diagnosi istopatologica
Aspetti metodologici della Citometria a Flusso: un esperienza pratica Moris Cadei Università degli Studi di Brescia Riccione, 22 Maggio 2009 Biopsie gastriche Nel nostro Servizio Diagnosi istopatologica
SCHEDA DI SICUREZZA. Secondo il regolamento REACH (EC) No. 1907/2006 del Parlamento europeo. profilo distanziatore prodotto da acciaio inossidabile
 SCHEDA DI SICUREZZA Secondo il regolamento REACH (EC) No. 1907/2006 del Parlamento europeo 1. Indicazione della sostanza/preparato e della ditta: Nome prodotto: Utilizzo: CHROMATECH ULTRA profilo distanziatore
SCHEDA DI SICUREZZA Secondo il regolamento REACH (EC) No. 1907/2006 del Parlamento europeo 1. Indicazione della sostanza/preparato e della ditta: Nome prodotto: Utilizzo: CHROMATECH ULTRA profilo distanziatore
SCHEDA DI SICUREZZA IN ACCORDO CON EC 91/155. Data: Mag. '99/Rev. 001 Pagina 1 di 5
 Data: Mag. '99/Rev. 001 Pagina 1 di 5 1 Elementi identificativi della sostanza * Specifica del prodotto: Principio attivo * Nome depositato: ANTEMA FELTRO * Produttore/Fornitore: OPOCRIN S.p.A. Via Pacinotti,
Data: Mag. '99/Rev. 001 Pagina 1 di 5 1 Elementi identificativi della sostanza * Specifica del prodotto: Principio attivo * Nome depositato: ANTEMA FELTRO * Produttore/Fornitore: OPOCRIN S.p.A. Via Pacinotti,
PALL GASKLEEN FILTRO PRECONDIZIONATO PER GAS ISTRUZIONI DI INSTALLAZIONE /SOSTITUZIONE
 PALL GASKLEEN FILTRO PRECONDIZIONATO PER GAS ISTRUZIONI DI INSTALLAZIONE /SOSTITUZIONE 1. INSTALLAZIONE SUGGERITA Figure 1 2. INSTALLAZIONE E SOSTITUZIONE DEL FILTRO È raccomandata la seguente procedura
PALL GASKLEEN FILTRO PRECONDIZIONATO PER GAS ISTRUZIONI DI INSTALLAZIONE /SOSTITUZIONE 1. INSTALLAZIONE SUGGERITA Figure 1 2. INSTALLAZIONE E SOSTITUZIONE DEL FILTRO È raccomandata la seguente procedura
Cytokeratin 7 (OV-TL 12/30)
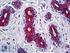 Identificazione Prodotto N Catalogo Descrizione 44565 Cytokeratin 7 0,1 M (OV-TL 12/30) 44566 Cytokeratin 7 1 M (OV-TL 12/30) 44272 Cytokeratin 7 RTU M (OV-TL 12/30) Definizione Dei Simboli P C A E S DIL
Identificazione Prodotto N Catalogo Descrizione 44565 Cytokeratin 7 0,1 M (OV-TL 12/30) 44566 Cytokeratin 7 1 M (OV-TL 12/30) 44272 Cytokeratin 7 RTU M (OV-TL 12/30) Definizione Dei Simboli P C A E S DIL
Le analisi prenatali
 L Amniocentesi L amniocentesi è l esame più utilizzato per la diagnosi prenatale di eventuali malattie genetiche. E una procedura che nella donna in gravidanza, tra la 15 e la 18 settimana, permette di
L Amniocentesi L amniocentesi è l esame più utilizzato per la diagnosi prenatale di eventuali malattie genetiche. E una procedura che nella donna in gravidanza, tra la 15 e la 18 settimana, permette di
EGFR pharmdx. Codice K1494 50 test per il sistema Dako Autostainer Edizione 9/27/2006. Uso previsto Per uso diagnostico In Vitro.
 EGFR pharmdx Codice K1494 50 test per il sistema Dako Autostainer Edizione 9/27/2006 Uso previsto Per uso diagnostico In Vitro. Il saggio EGFR pharmdx è un sistema di analisi qualitativa immunoistochimica
EGFR pharmdx Codice K1494 50 test per il sistema Dako Autostainer Edizione 9/27/2006 Uso previsto Per uso diagnostico In Vitro. Il saggio EGFR pharmdx è un sistema di analisi qualitativa immunoistochimica
Androgen Receptor (SP107)
 Identificazione Prodotto N Catalogo Descrizione 44425 Androgen Receptor 0,1 M (SP107) 44426 Androgen Receptor 1 M (SP107) 44199 Androgen Receptor RTU M (SP107) Definizione Dei Simboli P C A E S DIL DOC#
Identificazione Prodotto N Catalogo Descrizione 44425 Androgen Receptor 0,1 M (SP107) 44426 Androgen Receptor 1 M (SP107) 44199 Androgen Receptor RTU M (SP107) Definizione Dei Simboli P C A E S DIL DOC#
glucosio 2 etanolo + 2 CO 2 Prove comparative
 Fermentazione alcolica - Saccharomyces cerevisiae Impiego di cellule di cellule libere e immobilizzate (alginato di calcio) Finalità della sperimentazione Fase sperimentale Valutazione della capacità fermentativa
Fermentazione alcolica - Saccharomyces cerevisiae Impiego di cellule di cellule libere e immobilizzate (alginato di calcio) Finalità della sperimentazione Fase sperimentale Valutazione della capacità fermentativa
ISTRUZIONE OPERATIVA CAMPIONAMENTO ACQUA
 Pagina 1 di 6 ISTRUZIONE OPERATIVA REVISIONE NUMERO DATA REDATTA DA DIR (firma) VERIFICATA DA RAQ (firma) APPROVATA DA AMM (firma) PARAGRAFO REVISIONATO NUMERO MOTIVO 00 15-01-09 Prima emissione 01 22-04-13
Pagina 1 di 6 ISTRUZIONE OPERATIVA REVISIONE NUMERO DATA REDATTA DA DIR (firma) VERIFICATA DA RAQ (firma) APPROVATA DA AMM (firma) PARAGRAFO REVISIONATO NUMERO MOTIVO 00 15-01-09 Prima emissione 01 22-04-13
MECCANISMI D AZIONE DELLE ESPOSIZIONI AMBIENTALI ED OCCUPAZIONALI A CAMPI MAGNETICI ELF: VALUTAZIONE DELLE HSP IN PBL DI SOGGETTI ESPOSTI
 MECCANISMI D AZIONE DELLE ESPOSIZIONI AMBIENTALI ED OCCUPAZIONALI A CAMPI MAGNETICI ELF: VALUTAZIONE DELLE HSP IN PBL DI SOGGETTI ESPOSTI HEAT SHOCK PROTEINS (HSP70): SONO PROTEINE COINVOLTE NELLA RISPOSTA
MECCANISMI D AZIONE DELLE ESPOSIZIONI AMBIENTALI ED OCCUPAZIONALI A CAMPI MAGNETICI ELF: VALUTAZIONE DELLE HSP IN PBL DI SOGGETTI ESPOSTI HEAT SHOCK PROTEINS (HSP70): SONO PROTEINE COINVOLTE NELLA RISPOSTA
