Esercizi Struttura della Materia
|
|
|
- Graziana Venturi
- 5 anni fa
- Visualizzazioni
Transcript
1 Esercizi Struttura della Materia 1. Si consideri un gas di particelle identiche non interagenti in cui ogni particella può assumere i valori di energia 0,ɛ, 2ɛ, 3ɛ,.. Si consideri il gas classico e si calcoli i) la funzione di partizione nell ensemble canonico, ii) il calore specifico per particella, iii) il potenziale chimico. Si discuta per quali temperature è valida l approssimazione classica. 2. Si consideri l atomo di elio nello stato eccitato 1s2p. Stimare l energia di interazione elettrone-elettrone per funzioni d onda idrogenoidi sapendo che il potenziale prodotto dall elettrone 1s può essere descritto dal potenziale centrale con a o raggio di Bohr. U(r) = e2 4πɛ o r e2 ( πɛ o a o r )e 4r/ao 3. Si consideri una molecola di Ne 2 (massa atomica = uma). Il potenziale adiabatico tra due atomi di Ne sia dato da v(r) = 4ε((σ/r) 12 (σ/r) 6 ) con ε=3.08 mev e σ=275 pm in funzione della separazione r tra i due nuclei. Si valuti l energia di legame di tale dimero, tenendo conto del moto quantistico di punto zero, e si stimi il numero di stati vibrazionali legati in approssimazione armonica. 4. Si consideri un gas degenere di elettroni confinati in una dimensione con densita di 1/a o con a o raggio di Bohr. Calcolare il calore specifico a 300 K in unita di k B. 5. Si consideri l atomo di Be 2+ nello stato fondamentale con funzioni d onda idrogenenoidi e carica efficace assegnata dal principio variazionale. Calcolare la probabilità di trovare entrambi gli elettroni in una sfera di raggio a o centrata sul nucleo. 6. Si consideri il moto rotazionale della molecola 6 Li 18 F con distanza di equilibrio di 2.64 a o e stato elettronico 1 Σ. La funzione d onda rotationale è ψ(θ, φ) = C(cosθ + cosφsenθ) con C costante di normalizzazione. Calcolare il valor medio dell energia rotazionale. 7. L argento è un metallo monovalente con massa atomica M= u.m.a, e densità ρ=10.49 g/cm 3. Calcolare il contributo elettronico alla conducibilità termica sapendo che il libero cammino medio degli elettroni è di 50 nm. Si consideri il modello di elettroni liberi con massa efficace pari alla massa elettronica. 8. Si consideri la molecola biatomica CB. Discutere lo stato elettronico di stato fondamentale nello schema MO-LCAO ed assegnare il simbolo di termine e la sua degenerazione. 9. Un gas perfetto è composto da particelle distinguibili che hanno quattro possibili stati
2 di energia interna -E, 0, 0, +E con E=10 mev. Calcolare l entropia media per particella in funzione della temperatura. Calcolare la frazione di particelle sullo stato a energia 0 a 300 K. 10. Si consideri la molecola HF di lunghezza d=0.917 Å e momento di dipolo 0.8 Å e o. Calcolare la vita media del primo stato eccitato rotazionale. 11. Considerare la molecola B-H e il potenziale di Morse con livelli di energia hω(n ) - hωχ(n )2 con hωχ=40 cm 1 e hω =2368 cm 1. Stimare l energia media vibrazionale a temperatura ambiente in approssimazione armonica e la correzione anarmonica. 12. Utilizzando il modello di Hueckel, calcolare i livelli di energia, la loro degenerazione e occupazione per la molecola H 2 C=C=C=CH 2. Discutere lo stato di ibridizzazione dei diversi atomi di carbonio nella molecola. 13. Si determini la velocità del suono in un solido unidimensionale costituito da atomi di massa M=40 u.m.a, legati da potenziali armonici V ({x i }) = 1 2 K i(x i+1 x i a) 2 con K=300 kg s 2 e passo reticolare a=0.25 nm. 14. Si consideri una particella di massa m in una dimensione sottoposta al potenziale V (x) = + per x < 0 e V (x) = gx per x > 0 con g costante positiva. Si stimi l energia di stato fondamentale utilizzando il principio variazionale e la funzione di prova xexp( αx) con α parametro variazionale. 15. Si consideri un gas di elettroni liberi in 2 dimensioni. Calcolare l energia media per elettrone a temperatura zero per un gas ad una densità superciale di 3 elettroni/å Si consideri un gas di atomi di Li nello stato elettronico 2 S in presenza di un campo magnetico di 1 Tesla. Calcolare il contributo al calore specifico a 10 K dovuto all accoppiamento con il campo magnetico esterno. 17. Un sistema in equilibrio termico alla temperatura T é composto da N particelle distinguibili e non interagenti tra loro. Ogni particella ha a disposizione 2 stati degeneri di energia E 0 =0 e 4 stati degeneri di energia E 1 =25 mev. Calcolare l entropia per particella a 300 K. 18. Un campione di H 35 Cl gassoso alla temperatura di 1000 K é sottoposto ad un esperimento di spettroscopia di assorbimento infrarosso. Conoscendo la distanza molecolare d equilibrio R 0 =1.27 Å e la frequenza di vibrazione ν = 89.6 THz, si determini il numero quantico rotazionale dello stato inizialmente piú popolato, e le frequenze delle transizioni rotovibrazionali piú intense osservate nei rami P ed R.
3 19. Si consideri un esperimento di fotoemissione su un campione di sodio metallico (densitá ρ=0.95 g cm 3, peso atomico A=23, lavoro di estrazione 2.75 ev). Per gli elettroni nella banda di conduzione si assuma il modello di fermioni liberi non interagenti a temperatura nulla. Impiegando fotoni di lunghezza d onda 88 nm, quali sono la minima e massima energia cinetica degli elettroni fotoemessi dalla banda di conduzione? 20. L atomo di Nickel ha un primo stato eccitato [Ar]3d 9 4s che si trova 25.4 mev al di sopra dello stato fondamentale [Ar]3d 8 4s 2. Si assegni il simboli di termine dello stato eccitato e dello stato eccitato con le regole di Hund. Si valuti il contributo di questa eccitazione elettronica al calore specifico per unità di volume di vapori atomici di Nickel alla temperatura di 3200 K. 21. Calcolare la funzione di partizione gran canonica di un gas ideale classico di particelle di massa m a temperatura T e la relazione che intercorre tra potenziale chimico e numero medio di particelle nell ensemble gran canonico; verificare che, per quest ultima, si ottiene la stessa espressione dedotta nell ensemble canonico. 22. Si consideri l atomo di elio nello stato fondamentale con funzioni d onda idrogenenoidi. Calcolare la probabilità di trovare entrambi gli elettroni in una sfera di raggio a o centrata sul nucleo. 23.Si considerino particelle con spin 1/2 in un campo magnetico d intensità B, trascurando i gradi di libertà traslazionali, calcolare l energia media per particella in funzione della temperatura. 24. Si consideri la molecola planare ciclica C 4 H 4 (ciclobutadiene) con ibridizzazione sp 2. Calcolare i livelli di energia e la loro occupazione nello stato fondamentale utilizzando il modello di Huckel con elementi di matrice diagonali e fuori diagonale rispettivamente pari a α e β. 25.Calcolare la lunghezza di legame e il quanto di energia vibrazionale della molecola di HF assumendo che il potenziale d interazione tra i due atomi di in funzione della lunghezza di legame r della molecola sia dato da V (r) = V o (1 e a(r ro) ) 2 V o con V o =5.875 ev, r o =0.917 Å e a=2.25 Å Un campione di H 35 Cl gassoso alla temperatura di 1000 K é sottoposto ad un esperimento di spettroscopia di assorbimento infrarosso. Sapendo che la distanza molecolare d equilibrio R 0 =1.27 Å, si determini l energia della riga di assorbimento rotazionale piú intensa. 27. Si consideri la molecola N + 2 nello stato eccitato 1σ 2 g1σ 2 u2σ 2 g1π 2 u1π 1 g (solo elettroni di
4 valenza). Assegnare i possibili simboli di termine e le loro degenerazioni. 28. Si consideri la molecola planare AlCl 3 con l atomo di Al in configurazione sp 2. Calcolare il calore specifico per molecola ad alta temperatura applicando il principio di equipartizione dell energia. 29. Si consideri la molecola O 2 nello schema MO-LCAO. Calcolare le energie degli stati σ (leganti e antileganti) ottenuti dagli orbitali atomici 2s e 2p. Si trascuri l integrale di overlap e il mescolamento degli orbitali s e p (< u 2s (A) H u 2p (B) >= 0). Si assuma < u 2s (A) H u 2s (A) >= ev, < u 2p (A) H u 2p (A) >= ev, < u 2s (A) H u 2s (B) >= 7.32 ev, < u 2p (A) H u 2p (B) >= ev, dove A e B si riferiscono ai due atomi della molecola. 30. Si valuti la lunghezza della molecola di acido cloridrico deuterato D 35 Cl, sapendo che, in fase gassosa, due righe contigue del suo spettro di assorbimento rotazionale hanno lunghezza d onda pari a e µm, rispettivamente. Si indichi quale tra queste righe sia la più intensa con il campione alla temperatura di 300 K. 31. Si consideri un cristallo unidimensionale finito formato da N=6 siti con un elettrone per sito e con condizioni periodiche al contorno. Nell approssimazione tight-binding a un orbitale per sito, i livelli elettronici sono descritti dalla banda : E(k) = b 2tcos(ka), dove b=-5 ev e t=2 ev, a è la distanza tra atomi adiacenti, e k è il vettore d onda. Identificando i valori di k permessi dalla condizione al contorno di periodicità, si assegni l energia dell ultimo stato occupato. 32. Si consideri la funzione d onda elettronica (due elettroni) della molecola H 2 (d = 0.74 Å) nello schema MO-LCAO. Calcolare la probabilità relativa di trovare un elettrone su uno dei due nuclei rispetto alla probabilità di trovarlo nel punto medio della distanza internucleare per i) lo stato fondamentale, ii) il primo stato eccitato. L integrale di overlap S per lo stato atomico 1s vale S = Supponendo che gli elettroni di conduzione del potassio (Numero di massa= 39 a.m.u., ρ=0.87 g/cm 3 ) siano assimilabili ad un gas di elettroni liberi, calcolare l energia di Fermi a T=0 K e il calore specifico a 300 K. 34. Si consideri un gas di molecole di H 35 Br e si valutino i contributi traslazionale, rotazionale e vibrazionale all energia interna per molecola del gas a temperatura di 380 K sapendo che la distanza di legame è di 1.41 Å e la frequenza di vibrazione è di 2650 cm Calcolare la configurazione di stato fondamentale dell atomo Re [Xe]3f 14 4d 5 6s 2 nello schema jj.
5 36. Si consideri l atomo di Cl nello stato fondamentale 2 P. Lo splitting dovuto all interazione spin-orbita è di 881 cm 1. Calcolare il contributo al calore specifico (in unità di k B ) a 300 K dovuto all eccitazione elettronica tra i due stati della configurazione 2 P. 37. Si consideri un gas di molecole di H 2 O con tre le frequenze vibrationali ω 1 = 3741 cm 1, ω 2 = 3650 cm 1, ω 3 = 1589 cm 1. Calcolare il contributo vibrazionale al calore specifico a basse temperature, T= 10 K. 38. L argento è un metallo monovalente con massa atomica M= u.m.a, e densità ρ=10.49 g/cm 3. Calcolare la conducibilità elettrica sapendo che il libero cammino medio degli elettroni è di 50 nm. Si consideri il modello di elettroni liberi con massa efficace pari alla massa elettronica. 39.Stimare l energia di stato fondamentale dell atomo Be 2+ utilizzando funzioni d onda idrogenoidi e il principio variazionale. 40.Calcolare la vita media del primo stato eccitato vibrazionale della molecola di HF con potenziale interatomico descritto da un potenziale alla Morse V (r) = V o (1 e a(r ro) ) 2 V o con V o =5.87 ev, r o =0.917 Å lunghezza della molecola e a=2.25 Å 1. Si condideri un legame ionico e carica efficace pari alla carica elettronica. 41. Si consideri un semiconduttore con gap diretto di 1 ev nel punto Γ. La massa efficace di elettroni e buche è 0.1 m e. Si supponga di drogare il sistema n con una densità di donori N d e che i donori siano tutti ionizzati a 300 K. Calcolare la densità di donori N d in modo che la densità di buche p sia pari a 10 5 /cm 3. Il semiconducttore è non degenere? 42. Si consideri un atomo di azoto nello stato eccitato 1s 2 2s 1 2p 3 3d 1. Assegnare il simbolo di termine dello stato a più bassa energia secondo Hund.
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
Richiami. Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza
 Parte I Problemi Richiami Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza u ν = 8π hν c 3 ν e βhν 1, dove c è la velocità della luce
Parte I Problemi Richiami Esercizio 1.1. La radiazione elettromagnetica del corpo nero ha la seguente densità di energia per unità di frequenza u ν = 8π hν c 3 ν e βhν 1, dove c è la velocità della luce
INTERAZIONI DELLE RADIAZIONI CON LA MATERIA
 M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
Capitolo 4 Le spettroscopie. 1. Lo spettro elettromagnetico
 Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Capitolo 4 Le spettroscopie 1. Lo spettro elettromagnetico 2) Tipi di spettroscopia Emissione: transizione da livello superiore a livello inferiore Assorbimento: contrario 2.1 Spettroscopie rotazionali,
Corso di Laurea in FARMACIA
 Corso di Laurea in FARMACIA 2015 simulazione 1 FISICA Cognome nome matricola a.a. immatric. firma N Evidenziare le risposte esatte Una sferetta è appesa con una cordicella al soffitto di un ascensore fermo.
Corso di Laurea in FARMACIA 2015 simulazione 1 FISICA Cognome nome matricola a.a. immatric. firma N Evidenziare le risposte esatte Una sferetta è appesa con una cordicella al soffitto di un ascensore fermo.
MASSE ATOMICHE. 1,000 g di idrogeno reagiscono con 7,9367 g di ossigeno massa atomica ossigeno=2 x 7,9367=15,873 g (relativa all'idrogeno)
 MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
MASSE ATOMICHE Sono a volte impropriamente chiamate pesi atomici. All'epoca di Dalton non era possibile pesare i singoli atomi ma solo trovare la massa di un atomo relativa a quella di un altro acqua di
Indice generale. Prefazione
 26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
26-10-2009 10:41 Pagina VI Prefazione Ringraziamenti dell Editore Guida alla lettura XIII XV XVII Capitolo 0 Lessico della chimica 1 0.1 La chimica 1 0.1.1 Classificazioni della materia 2 0.1.2 Proprietà
SOLUZIONE ESERCIZIO 1.1
 SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
SOLUZIONE ESERCIZIO 1.1 La temperatura di fusione ed il coefficiente di espansione termica di alcuni metalli sono riportati nella tabella e nel diagramma sottostante: Metallo Temperatura di fusione [ C]
TEORIA QUANTISTICA E STRUTTURA ATOMICA
 TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
TEORIA QUANTISTICA E STRUTTURA ATOMICA Gli argomenti di queste lezioni sono trattati nel Capitolo 7 del testo e nei paragrafi 1, e 3 del Capitolo 8. Non ci sono parti da non considerare. La moderna definizione
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
SPETTROSCOPIA MOLECOLARE
 SPETTROSCOPIA MOLECOLARE La spettroscopia molecolare studia l assorbimento o l emissione delle radiazioni elettromagnetiche da parte delle molecole. Il dato sperimentale che si ottiene, chiamato rispettivamente
SPETTROSCOPIA MOLECOLARE La spettroscopia molecolare studia l assorbimento o l emissione delle radiazioni elettromagnetiche da parte delle molecole. Il dato sperimentale che si ottiene, chiamato rispettivamente
SPETTROSCOPIA INFRAROSSA
 SPETTROSCOPIA INFRAROSSA Metodi fisici in chimica organica spettroscopia IR Vibrazioni molecolari 400-4000 4000 cm -1 Spettri molto complessi anche per molecole semplici:! Riconoscimento sostanze incognite
SPETTROSCOPIA INFRAROSSA Metodi fisici in chimica organica spettroscopia IR Vibrazioni molecolari 400-4000 4000 cm -1 Spettri molto complessi anche per molecole semplici:! Riconoscimento sostanze incognite
Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA
 Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Indice PREFAZIONE ALLA SECONDA EDIZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi
Tabella periodica degli elementi
 Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
Tabella periodica degli elementi Perchè ha questa forma? Ovvero, esiste una regola per l ordinamento dei singoli atomi? Le proprietà dei materiali hanno una relazione con la tabella? L applicazione dei
L equilibrio dei gas. Lo stato di equilibrio di una data massa di gas è caratterizzato da un volume, una pressione e una temperatura
 Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
Termodinamica 1. L equilibrio dei gas 2. L effetto della temperatura sui gas 3. La teoria cinetica dei gas 4. Lavoro e calore 5. Il rendimento delle macchine termiche 6. Il secondo principio della termodinamica
May 5, 2013. Fisica Quantistica. Monica Sambo. Sommario
 May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
May 5, 2013 Bohr, Born,, Dirac e Pauli accettano in modo incondizionato la nuova fisica Einstein, De, e pur fornendo importanti contributi alla nuova teoria cercano di ottenere una descrizione CAUSALE
Indice. 1 La materia e la sua struttura. 2 La radioattività ed i processi nucleari
 Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
Indice PREFAZIONE XIII 1 La materia e la sua struttura 1.1. Le particelle fondamentali e la struttura dell atomo 2 1.2. Il numero atomico, il numero di massa, i nuclidi e gli isotopi 5 1.3. L unità di
LA GIUNZIONE PN. Sulla base delle proprietà elettriche i materiali si classificano in: conduttori semiconduttori isolanti
 LA GIUNZIONE PN Sulla base delle proprietà chimiche e della teoria di Bohr sulla struttura dell atomo (nucleo costituito da protoni e orbitali via via più esterni in cui si distribuiscono gli elettroni),
LA GIUNZIONE PN Sulla base delle proprietà chimiche e della teoria di Bohr sulla struttura dell atomo (nucleo costituito da protoni e orbitali via via più esterni in cui si distribuiscono gli elettroni),
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Laser in medicina 28/2/2004
 Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Laser in medicina 28/2/2004 Laser Sviluppo moderne tecniche di comunicazione fasci molto intensi di onde radio coerenti in bande di frequenza molto
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Laser in medicina 28/2/2004 Laser Sviluppo moderne tecniche di comunicazione fasci molto intensi di onde radio coerenti in bande di frequenza molto
Energia elettrica. L atomo nel suo complesso è neutro perché ha l equilibrio tra protoni ed elettroni presenti nello stesso numero.
 Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
Energia elettrica Si fonda sulla costituzione dell atomo che è costituito da particelle più piccole : neutroni (carica neutra) e protoni (carica +) che costituiscono il nucleo ed elettroni (carica negativa)
Introduzione alle tecniche spettroscopiche e all interazione radiazione/materia. Francesco Nobili
 Introduzione alle tecniche spettroscopiche e all interazione radiazione/materia Francesco Nobili TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tecniche analitiche basate sull interazione tra
Introduzione alle tecniche spettroscopiche e all interazione radiazione/materia Francesco Nobili TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tecniche analitiche basate sull interazione tra
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI
 PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI DEFINIZIONE DI VETRO LO STATO VETROSO È QUELLO DI UN SOLIDO BLOCCATO NELLA STRUTTURA DISORDINATA DI UN LIQUIDO (FASE AMORFA) SOLIDO:ORDINE A LUNGO RAGGIO
PREPARAZIONE E CARATTERIZZAZIONE DEI VETRI COLORATI DEFINIZIONE DI VETRO LO STATO VETROSO È QUELLO DI UN SOLIDO BLOCCATO NELLA STRUTTURA DISORDINATA DI UN LIQUIDO (FASE AMORFA) SOLIDO:ORDINE A LUNGO RAGGIO
Fluorescenza IR di eccimeri Xe 2 in gas denso
 Fluorescenza IR di eccimeri Xe 2 in gas denso A. F. Borghesani *,+ and G. Carugno + * Dipartimento di Fisica, Unità CNISM, Università di Padova + Istituto Nazionale di Fisica Nucleare, Sezione di Padova
Fluorescenza IR di eccimeri Xe 2 in gas denso A. F. Borghesani *,+ and G. Carugno + * Dipartimento di Fisica, Unità CNISM, Università di Padova + Istituto Nazionale di Fisica Nucleare, Sezione di Padova
SPETTROSCOPIA ATOMICA
 SPETTROSCOPIA ATOMICA Corso di laurea in Tecnologie Alimentari La spettroscopia atomica studia l assorbimento, l emissione o la fluorescenza di atomi o di ioni metallici. Le regioni dello spettro interessate
SPETTROSCOPIA ATOMICA Corso di laurea in Tecnologie Alimentari La spettroscopia atomica studia l assorbimento, l emissione o la fluorescenza di atomi o di ioni metallici. Le regioni dello spettro interessate
La legge di Lambert-Beer
 La legge di Lambert-Beer In questa esperienza determinerete la concentrazione di una soluzione incognita di permanganato di potassio per via spettrofotometrica. Generalita La spettroscopia si occupa dell
La legge di Lambert-Beer In questa esperienza determinerete la concentrazione di una soluzione incognita di permanganato di potassio per via spettrofotometrica. Generalita La spettroscopia si occupa dell
applicazioni di cromatografia gas massa serale 30 ore
 chimica e ambiente chimica applicazioni di cromatografia gas massa serale 30 ore Il percorso formativo prevede un breve ripasso dei principi teorici e delle caratteristiche strumentali della spettrometria
chimica e ambiente chimica applicazioni di cromatografia gas massa serale 30 ore Il percorso formativo prevede un breve ripasso dei principi teorici e delle caratteristiche strumentali della spettrometria
LE ONDE CLASSE DELLE LAUREE TRIENNALI DELLE PROFESSIONI SANITARIE DELLA RIABILITAZIONE. A. A. 2015-2016 Fabrizio Le Boffelli onde. P.
 CLASSE DELLE LAUREE TRIENNALI DELLE PROFESSIONI SANITARIE DELLA RIABILITAZIONE LE ONDE A. A. 2015-2016 Fabrizio Le Boffelli onde pag.1 LE ONDE Fenomeni ondulatori Periodo e frequenza Lunghezza d onda e
CLASSE DELLE LAUREE TRIENNALI DELLE PROFESSIONI SANITARIE DELLA RIABILITAZIONE LE ONDE A. A. 2015-2016 Fabrizio Le Boffelli onde pag.1 LE ONDE Fenomeni ondulatori Periodo e frequenza Lunghezza d onda e
LA MOLE LA MOLE 2.A PRE-REQUISITI 2.3 FORMULE E COMPOSIZIONE 2.B PRE-TEST
 LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
LA MOLE 2.A PRE-REQUISITI 2.B PRE-TEST 2.C OBIETTIVI 2.1 QUANTO PESA UN ATOMO? 2.1.1 L IDEA DI MASSA RELATIVA 2.1.2 MASSA ATOMICA RELATIVA 2.2.4 ESERCIZI SVOLTI 2.3 FORMULE E COMPOSIZIONE 2.4 DETERMINAZIONE
Elettrostatica. pag. 1. Elettrostatica
 Carica elettrica Legge di Coulomb Campo elettrico Principio di sovrapposizione Energia potenziale del campo elettrico Moto di una carica in un campo elettrico statico Teorema di Gauss Campo elettrico e
Carica elettrica Legge di Coulomb Campo elettrico Principio di sovrapposizione Energia potenziale del campo elettrico Moto di una carica in un campo elettrico statico Teorema di Gauss Campo elettrico e
Come costruire un computer quantistico
 Come costruire un computer quantistico Oliver Morsch CNR-INFM, Dipartimento di Fisica, Università di Pisa Introduzione: Fisica quantistica La fisica del c.q.: La sovrapposizione e gli stati entangled Problemi
Come costruire un computer quantistico Oliver Morsch CNR-INFM, Dipartimento di Fisica, Università di Pisa Introduzione: Fisica quantistica La fisica del c.q.: La sovrapposizione e gli stati entangled Problemi
Istituzioni di fisica della materia I Lezione 3. S. Solimeno lezione 3 1
 Istituzioni di fisica della materia I Lezione 3 S. Solimeno lezione 3 1 S. Solimeno lezione 3 2 S. Solimeno lezione 3 3 S. Solimeno lezione 3 4 S. Solimeno lezione 3 5 spettroscopia gamma di colori che
Istituzioni di fisica della materia I Lezione 3 S. Solimeno lezione 3 1 S. Solimeno lezione 3 2 S. Solimeno lezione 3 3 S. Solimeno lezione 3 4 S. Solimeno lezione 3 5 spettroscopia gamma di colori che
Le particelle elementari di interesse in Chimica sono: Particella simbolo massa carica spin
 Le particelle elementari di interesse in Chimica sono: Particella simbolo massa carica spin Elettrone e - 9.11x10-31 kg -1 ½ 5.486x10-4 u Protone p 1.67x10-27 kg +1 ½ 1.0073 u Neutrone n 1.67x10-27 kg
Le particelle elementari di interesse in Chimica sono: Particella simbolo massa carica spin Elettrone e - 9.11x10-31 kg -1 ½ 5.486x10-4 u Protone p 1.67x10-27 kg +1 ½ 1.0073 u Neutrone n 1.67x10-27 kg
Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia.
 G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
G. Digilio - principi_v10 versione 6.0 LA SPETTROSCOPIA Tutte le tecniche spettroscopiche si basano sulla interazione tra radiazione elettromagnetica e materia. La Spettroscopia di risonanza magnetica
Sorgenti di radiazione luminosa
 Sorgenti di radiazione luminosa Quello che differenzia le fonti di luce (e quindi la qualità della radiazione emessa) è il meccanismo con cui viene generata l onda elettromagnetica. Poiché l onda trasporta
Sorgenti di radiazione luminosa Quello che differenzia le fonti di luce (e quindi la qualità della radiazione emessa) è il meccanismo con cui viene generata l onda elettromagnetica. Poiché l onda trasporta
LE ONDE. Le onde Fisica Medica Lauree triennali nelle Professioni Sanitarie. P.Montagna gen-08. pag.1
 LE ONDE Fenomeni ondulatori Periodo e frequenza Lunghezza d onda e velocità Legge di propagazione Energia trasportata Onde meccaniche: il suono Onde elettromagnetiche Velocità della luce Spettro elettromagnetico
LE ONDE Fenomeni ondulatori Periodo e frequenza Lunghezza d onda e velocità Legge di propagazione Energia trasportata Onde meccaniche: il suono Onde elettromagnetiche Velocità della luce Spettro elettromagnetico
modulo: CHIMICA DEI POLIMERI
 CORSO PON Esperto nella progettazione, caratterizzazione e lavorazione di termoplastici modulo: CHIMICA DEI POLIMERI Vincenzo Venditto influenza delle caratteristiche strutturali, microstrutturali e morfologiche
CORSO PON Esperto nella progettazione, caratterizzazione e lavorazione di termoplastici modulo: CHIMICA DEI POLIMERI Vincenzo Venditto influenza delle caratteristiche strutturali, microstrutturali e morfologiche
UNITA 3 COMBUSTIONE, CARBURANTI, LUBRIFICANTI
 UNITA 3 COMBUSTIONE, CARBURANTI, LUBRIFICANTI Esercizio 3.1 Calcolare il potere calorifico superiore e inferiore del gas metano che brucia secondo la reazione CH 4 + 2 O 2 CO 2 + 2 H 2 O sapendo che l
UNITA 3 COMBUSTIONE, CARBURANTI, LUBRIFICANTI Esercizio 3.1 Calcolare il potere calorifico superiore e inferiore del gas metano che brucia secondo la reazione CH 4 + 2 O 2 CO 2 + 2 H 2 O sapendo che l
LA MATERIA MATERIA. COMPOSIZIONE (struttura) Atomi che la compongono
 LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
LA MATERIA 1 MATERIA PROPRIETÀ (caratteristiche) COMPOSIZIONE (struttura) FENOMENI (trasformazioni) Stati di aggregazione Solido Liquido Aeriforme Atomi che la compongono CHIMICI Dopo la trasformazione
RIVELATORI A SEMICONDUTTORE. Dal punto di vista della conducibilità elettrica i materiali si possono classificare in :
 Dal punto di vista della conducibilità elettrica i materiali si possono classificare in : (a) Metalli: banda di valenza (BV) e banda di conduzione (BC) sono sovrapposte (E g = 0 ev) (b) Semiconduttori:
Dal punto di vista della conducibilità elettrica i materiali si possono classificare in : (a) Metalli: banda di valenza (BV) e banda di conduzione (BC) sono sovrapposte (E g = 0 ev) (b) Semiconduttori:
Cenni di Teoria Cinetica dei Gas
 Cenni di Teoria Cinetica dei Gas Introduzione La termodinamica descrive i sistemi termodinamici tramite i parametri di stato (p, T,...) Sufficiente per le applicazioni: impostazione e progettazione di
Cenni di Teoria Cinetica dei Gas Introduzione La termodinamica descrive i sistemi termodinamici tramite i parametri di stato (p, T,...) Sufficiente per le applicazioni: impostazione e progettazione di
CdS Ingegneria Industriale: Corso di Chimica
 CdS Ingegneria Industriale: Corso di Chimica Docente : Informazioni generali Candida MILONE cmilone@ingegneria.unime.it Ricevimento Mar e Gio 15:00-17:00 Struttura del corso: Verifiche: 54 ore di lezioni
CdS Ingegneria Industriale: Corso di Chimica Docente : Informazioni generali Candida MILONE cmilone@ingegneria.unime.it Ricevimento Mar e Gio 15:00-17:00 Struttura del corso: Verifiche: 54 ore di lezioni
Chimica Fisica I. a.a. 2012/2013 S. Casassa
 a.a. 2012/2013 S. Casassa 1 Note Tecniche 2 Testi consigliati: G.K. Vemulapalli, Chimica Fisica", EdiSES, Napoli (1995). D.A. Mc Quarrie e J.D. Simon, Chimica Fisica: un approccio molecolare", Zanichelli,
a.a. 2012/2013 S. Casassa 1 Note Tecniche 2 Testi consigliati: G.K. Vemulapalli, Chimica Fisica", EdiSES, Napoli (1995). D.A. Mc Quarrie e J.D. Simon, Chimica Fisica: un approccio molecolare", Zanichelli,
Gruppo 10 Nickel Ni (1751)
 Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Gruppo 10 ickel i (1751) Proprietà i Pd Pt Z 28 46 78 umero di isotopi 5 6 6 naturali Massa atomica 58.69 106.42 195.08 onfigurazione [Ar]3d 8 4s 2 [Kr]4d 10 [Xe]4f 14 5d 9 6s 1 elettronica Aspetto Metallo
Spettroscopia atomica
 Spettroscopia atomica La spettroscopia atomica è una tecnica di indagine qualitativa e quantitativa, in cui una sostanza viene decomposta negli atomi che la costituiscono tramite una fiamma, un fornetto
Spettroscopia atomica La spettroscopia atomica è una tecnica di indagine qualitativa e quantitativa, in cui una sostanza viene decomposta negli atomi che la costituiscono tramite una fiamma, un fornetto
Teoria del campo cristallino (CFT)
 Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
Teoria del campo cristallino (CFT) Interazione elettrostatica (non covalente) tra: - leganti anionici cariche elettriche puntiformi - leganti neutri dipoli elettrici con la parte negativa verso il centro
1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. Anodo = Polo Positivo Anione = Ione Negativo. Catodo = Polo Negativo Catione = Ione Positivo
 1) Concetti Generali 1. Unità di Misura: A. Pressione 1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. B. Calore 1 joule = 10 7 Erg. 1 caloria = 4,185 joule. Anodo = Polo Positivo Anione = Ione
1) Concetti Generali 1. Unità di Misura: A. Pressione 1 atm = 760 mm Hg = 760 torr = 101300 N/m 2 =101300 Pa. B. Calore 1 joule = 10 7 Erg. 1 caloria = 4,185 joule. Anodo = Polo Positivo Anione = Ione
Corrente elettrica F i s i c a s p e r i m e n t a l e I I
 Corrente elettrica F i s i c a s p e r i m e n t a l e I I Per descrivere il moto di una singola carica introdurremo il vettore velocità Se, come in un metallo, abbiamo un numero enorme di cariche libere
Corrente elettrica F i s i c a s p e r i m e n t a l e I I Per descrivere il moto di una singola carica introdurremo il vettore velocità Se, come in un metallo, abbiamo un numero enorme di cariche libere
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI
 TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
Recenti Scoperte Scientifiche in Ottica
 Recenti Scoperte Scientifiche in Ottica Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 26 Maggio 2014 Secondo Meeting di Ottica e Optometria a Padova
Recenti Scoperte Scientifiche in Ottica Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 26 Maggio 2014 Secondo Meeting di Ottica e Optometria a Padova
Esempio prova di esonero Fisica Generale I C.d.L. ed.u. Informatica
 Esempio prova di esonero Fisica Generale I C.d.L. ed.u. Informatica Nome: N.M.: 1. Se il caffè costa 4000 /kg (lire al chilogrammo), quanto costa all incirca alla libbra? (a) 1800 ; (b) 8700 ; (c) 18000
Esempio prova di esonero Fisica Generale I C.d.L. ed.u. Informatica Nome: N.M.: 1. Se il caffè costa 4000 /kg (lire al chilogrammo), quanto costa all incirca alla libbra? (a) 1800 ; (b) 8700 ; (c) 18000
CORSO DI LAUREA IN SCIENZE FISICHE A.A. 2010/2011
 MANIFESTO DEGLI STUDI CORSO DI LAUREA IN SCIENZE FISICHE A.A. 2010/2011 1. Denominazione - Laurea in SCIENZE FISICHE 2. Classe Il Corso di laurea in Scienze Fisiche appartiene alla classe L-30 - Scienze
MANIFESTO DEGLI STUDI CORSO DI LAUREA IN SCIENZE FISICHE A.A. 2010/2011 1. Denominazione - Laurea in SCIENZE FISICHE 2. Classe Il Corso di laurea in Scienze Fisiche appartiene alla classe L-30 - Scienze
STATO LIQUIDO. Si definisce tensione superficiale (γ) il lavoro che bisogna fare per aumentare di 1 cm 2 la superficie del liquido.
 STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
STTO LIQUIDO Una sostanza liquida è formata da particelle in continuo movimento casuale, come in un gas, tuttavia le particelle restano a contatto le une alle altre e risentono sempre delle notevoli forze
Spettroscopia UV/Visibile. Visibile
 Spettroscopia UV/Visibile Visibile È una tecnica spettroscopica di assorbimento che sfrutta le radiazioni con λ tra 190 e 400 nm. L assorbimento di tali radiazioni da parte delle molecole provoca a delle
Spettroscopia UV/Visibile Visibile È una tecnica spettroscopica di assorbimento che sfrutta le radiazioni con λ tra 190 e 400 nm. L assorbimento di tali radiazioni da parte delle molecole provoca a delle
Scattering. Illuminiamo una soluzione con una luce di lunghezza d onda lontana da qualunque banda di assorbimento
 Scattering Illuminiamo una soluzione con una luce di lunghezza d onda lontana da qualunque banda di assorbimento Le molecole sono polarizzabili: la distribuzione degli elettroni può essere perturbata da
Scattering Illuminiamo una soluzione con una luce di lunghezza d onda lontana da qualunque banda di assorbimento Le molecole sono polarizzabili: la distribuzione degli elettroni può essere perturbata da
Il metodo scientifico
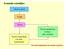 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Spettri molecolari. L assorbimento molecolare è più complesso dell assorbimento atomico perché in una molecola bisogna considerare:
 Spettroscopie Spettri molecolari L assorbimento molecolare è più complesso dell assorbimento atomico perché in una molecola bisogna considerare: Transizioni elettroniche Transizioni vibrazionali Transizioni
Spettroscopie Spettri molecolari L assorbimento molecolare è più complesso dell assorbimento atomico perché in una molecola bisogna considerare: Transizioni elettroniche Transizioni vibrazionali Transizioni
Esercizi sui Motori a Combustione Interna
 Esercizi sui Motori a Combustione Interna 6 MOTORE 4TEMPI AD ACCENSIONE COMANDATA (Appello del 08.0.000, esercizio N ) Un motore ad accensione comandata a 4 tempi di cilindrata V 000 cm 3, funzionante
Esercizi sui Motori a Combustione Interna 6 MOTORE 4TEMPI AD ACCENSIONE COMANDATA (Appello del 08.0.000, esercizio N ) Un motore ad accensione comandata a 4 tempi di cilindrata V 000 cm 3, funzionante
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
MATERIALI CERAMICI Classificazione e caratteristiche generali
 MATERIALI CERAMICI Classificazione e caratteristiche generali I materiali ceramici sono materiali inorganici non metallici, costituiti da elementi metallici e non metalici legati fra loro prevalentemente
MATERIALI CERAMICI Classificazione e caratteristiche generali I materiali ceramici sono materiali inorganici non metallici, costituiti da elementi metallici e non metalici legati fra loro prevalentemente
Struttura elettronica delle molecole. Teoria quantistica del legame chimico
 Strttra elettronica delle molecole. Teoria qantistica del legame chimico Lo ione idrogeno molecolare H 2 + Eq. Schroedinger singolo elettrone La fnzione d onda φ b soddisfa na eqazione analoga. Gli atovalori
Strttra elettronica delle molecole. Teoria qantistica del legame chimico Lo ione idrogeno molecolare H 2 + Eq. Schroedinger singolo elettrone La fnzione d onda φ b soddisfa na eqazione analoga. Gli atovalori
Radiazione atmosferica
 Radiazione atmosferica Fondamenti di meteorologia e climatologia Trento, 28 Aprile 2015 Radiazione elettromagnetica La radiazione elettromagnetica puó essere vista come un insieme di onde che si propagano
Radiazione atmosferica Fondamenti di meteorologia e climatologia Trento, 28 Aprile 2015 Radiazione elettromagnetica La radiazione elettromagnetica puó essere vista come un insieme di onde che si propagano
APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi. CAPITOLO 1 NMR Risonanza Magnetica Nucleare
 APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi CAPITOLO 1 NMR Risonanza Magnetica Nucleare INTRODUZIONE Nel 1946 due ricercatori, F. Block ed E.M.Purcell, hanno indipendentemente osservato per
APPUNTI DI RISONANZA MAGNETICA NUCLEARE Dr. Claudio Santi CAPITOLO 1 NMR Risonanza Magnetica Nucleare INTRODUZIONE Nel 1946 due ricercatori, F. Block ed E.M.Purcell, hanno indipendentemente osservato per
L E L E G G I D E I G A S P A R T E I
 L E L E G G I D E I G A S P A R T E I Variabili di stato Equazioni di stato Legge di Boyle Pressione, temperatura, scale termometriche Leggi di Charles/Gay-Lussac Dispense di Chimica Fisica per Biotecnologie
L E L E G G I D E I G A S P A R T E I Variabili di stato Equazioni di stato Legge di Boyle Pressione, temperatura, scale termometriche Leggi di Charles/Gay-Lussac Dispense di Chimica Fisica per Biotecnologie
MARIE CURIE PON 2010-2011 OBBIETTIVO B AZIONE 1 CORSO ENERGIA IN FORMAZIONE
 ISTITUTO TECNICO SETTORE TECNOLOGICO MARIE CURIE PON 2010-2011 OBBIETTIVO B AZIONE 1 CORSO ENERGIA IN FORMAZIONE L'EFFETTO FOTOVOLTAICO E LA PRODUZIONE DI ENERGIA ELETTRICA PhD ing. Mario S. D. Acampa
ISTITUTO TECNICO SETTORE TECNOLOGICO MARIE CURIE PON 2010-2011 OBBIETTIVO B AZIONE 1 CORSO ENERGIA IN FORMAZIONE L'EFFETTO FOTOVOLTAICO E LA PRODUZIONE DI ENERGIA ELETTRICA PhD ing. Mario S. D. Acampa
Capitolo 7. Tipi di Laser. 7.1 Laser a cristalli ionici. 7.1.1 Laser a rubino
 Capitolo 7 Tipi di Laser In questo capitolo vengono presentate le caratteristiche dei diversi tipi di laser. In realtà il numero di laser esistenti è di gran lunga superiore a quelli descritti, ma si è
Capitolo 7 Tipi di Laser In questo capitolo vengono presentate le caratteristiche dei diversi tipi di laser. In realtà il numero di laser esistenti è di gran lunga superiore a quelli descritti, ma si è
STRUTTURA E GEOMETRIA CRISTALLINA
 STRUTTURA E GEOMETRIA CRISTALLINA La struttura fisica dei materiali solidi dipende dalla disposizione degli atomi, ioni o molecole che compongono il solido e dalle forze che li legano fra loro. Quando
STRUTTURA E GEOMETRIA CRISTALLINA La struttura fisica dei materiali solidi dipende dalla disposizione degli atomi, ioni o molecole che compongono il solido e dalle forze che li legano fra loro. Quando
Indice PREFAZIONE. Capitolo 5 LE LEGGI DEL MOTO DI NEWTON 58 5.1 La terza legge di Newton 58
 Indice PREFAZIONE XV Capitolo 1 RICHIAMI DI MATEMATICA 1 1.1 Simboli, notazione scientifica e cifre significative 1 1.2 Algebra 3 1.3 Geometria e trigonometria 5 1.4 Vettori 7 1.5 Sviluppi in serie e approssimazioni
Indice PREFAZIONE XV Capitolo 1 RICHIAMI DI MATEMATICA 1 1.1 Simboli, notazione scientifica e cifre significative 1 1.2 Algebra 3 1.3 Geometria e trigonometria 5 1.4 Vettori 7 1.5 Sviluppi in serie e approssimazioni
VSEPR Polarità Ibridizzazione
 VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
Teoria quantistica della conduzione nei solidi e modello a bande
 Teoria quantistica della conduzione nei solidi e modello a bande Obiettivi - Descrivere il comportamento quantistico di un elettrone in un cristallo unidimensionale - Spiegare l origine delle bande di
Teoria quantistica della conduzione nei solidi e modello a bande Obiettivi - Descrivere il comportamento quantistico di un elettrone in un cristallo unidimensionale - Spiegare l origine delle bande di
IL FOTOVOLTAICO E L ARCHITETTURA
 IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
IL FOTOVOLTAICO E L ARCHITETTURA Prof. Paolo ZAZZINI Ing. Nicola SIMIONATO COME FUNZIONA UNA CELLA FOTOVOLTAICA EFFETTO FOTOVOLTAICO: Un flusso luminoso che incide su un materiale semiconduttore opportunamente
COMPOSTI DI COORDINAZIONE (complessi)
 Gli ioni dei metalli di transizione nei sistemi biologici non si presentano come acquoioni [M(H 2 O) n ] x+ ma come. COMPOSTI DI COORDINAZIONE (complessi) derivano dall interazione (coordinazione) tra
Gli ioni dei metalli di transizione nei sistemi biologici non si presentano come acquoioni [M(H 2 O) n ] x+ ma come. COMPOSTI DI COORDINAZIONE (complessi) derivano dall interazione (coordinazione) tra
COMPONENTI OTTICI ATTIVI
 COMPONENTI OTTICI ATTIVI Sono quei dispositivi necessari per lo scambio di informazioni su fibra ottica ossia per la trasmissione di impulsi luminosi. Si distinguono in convertitori elettro-ottici, convertitori
COMPONENTI OTTICI ATTIVI Sono quei dispositivi necessari per lo scambio di informazioni su fibra ottica ossia per la trasmissione di impulsi luminosi. Si distinguono in convertitori elettro-ottici, convertitori
6. Determinare il titolo del vapor d acqua che ad 8,00 bar ha un entalpia specifica di 2000 kj/kg.
 ESERCIZI DI FISICA TECNICA TERMODINAMICA APPLICATA Termodinamica degli stati 1. Utilizzando il piano pt e le tabelle A.3 del vapor d acqua saturo, si dica quali sono le fasi presenti nei sistemi costituiti
ESERCIZI DI FISICA TECNICA TERMODINAMICA APPLICATA Termodinamica degli stati 1. Utilizzando il piano pt e le tabelle A.3 del vapor d acqua saturo, si dica quali sono le fasi presenti nei sistemi costituiti
C V. gas monoatomici 3 R/2 5 R/2 gas biatomici 5 R/2 7 R/2 gas pluriatomici 6 R/2 8 R/2
 46 Tonzig La fisica del calore o 6 R/2 rispettivamente per i gas a molecola monoatomica, biatomica e pluriatomica. Per un gas perfetto, il calore molare a pressione costante si ottiene dal precedente aggiungendo
46 Tonzig La fisica del calore o 6 R/2 rispettivamente per i gas a molecola monoatomica, biatomica e pluriatomica. Per un gas perfetto, il calore molare a pressione costante si ottiene dal precedente aggiungendo
7.1 Laser a cristalli ionici o a stato solido
 Capitolo 7 Tipi di Laser In questo capitolo vengono presentate le caratteristiche dei diversi tipi di laser. In realtà il numero di laser esistenti è di gran lunga superiore a quelli descritti, ma si è
Capitolo 7 Tipi di Laser In questo capitolo vengono presentate le caratteristiche dei diversi tipi di laser. In realtà il numero di laser esistenti è di gran lunga superiore a quelli descritti, ma si è
Inquinamento da Campi Elettromagnetici
 Inquinamento da Campi Elettromagnetici Aspetti Tecnici, Sanitari, Normativi A cura di ECORICERCHE s.r.l. Lo Spettro Elettromagnetico ECORICERCHE s.r.l. 2 Elettrosmog: che cos è? E un termine entrato nell
Inquinamento da Campi Elettromagnetici Aspetti Tecnici, Sanitari, Normativi A cura di ECORICERCHE s.r.l. Lo Spettro Elettromagnetico ECORICERCHE s.r.l. 2 Elettrosmog: che cos è? E un termine entrato nell
4 FORZE FONDAMENTALI
 FORZA 4! QUANTE FORZE? IN NATURA POSSONO ESSERE OSSERVATE TANTE TIPOLOGIE DI FORZE DIVERSE: GRAVITA' O PESO, LA FORZA CHE SI ESERCITA TRA DUE MAGNETI O TRA DUE CORPI CARICHI, LA FORZA DEL VENTO O DELL'ACQUA
FORZA 4! QUANTE FORZE? IN NATURA POSSONO ESSERE OSSERVATE TANTE TIPOLOGIE DI FORZE DIVERSE: GRAVITA' O PESO, LA FORZA CHE SI ESERCITA TRA DUE MAGNETI O TRA DUE CORPI CARICHI, LA FORZA DEL VENTO O DELL'ACQUA
TECNICHE SPETTROSCOPICHE PER I BENI CULTURALI: SPETTROMETRIA DI FLUORESCENZA X
 Dipartimento di Scienze Chimiche TECNICHE SPETTROSCOPICHE PER I BENI CULTURALI: SPETTROMETRIA DI FLUORESCENZA X Analisi superficiali via XRF: Le misure sono effettuate in tempi dell ordine di qualche centinaio
Dipartimento di Scienze Chimiche TECNICHE SPETTROSCOPICHE PER I BENI CULTURALI: SPETTROMETRIA DI FLUORESCENZA X Analisi superficiali via XRF: Le misure sono effettuate in tempi dell ordine di qualche centinaio
Spettroscopia Raman. Trasmissione-assorbimento
 Spettroscopia Raman Quando una radiazione monocromatica di frequenza n o e incidente ad un sistema molecolare la luce viene: assorbita se ha energia pari ad una possibile transizione ad un livello energetico
Spettroscopia Raman Quando una radiazione monocromatica di frequenza n o e incidente ad un sistema molecolare la luce viene: assorbita se ha energia pari ad una possibile transizione ad un livello energetico
Quali conoscenze di base per comprendere l'innovazione?
 Quali conoscenze di base per comprendere l'innovazione? 2006-2015: dieci anni di SPAIS 2015 Anno internazionale della luce e delle tecnologie basate sulla luce IX Edizione Il Sole. La nostra stella e/è
Quali conoscenze di base per comprendere l'innovazione? 2006-2015: dieci anni di SPAIS 2015 Anno internazionale della luce e delle tecnologie basate sulla luce IX Edizione Il Sole. La nostra stella e/è
INDICAZIONI ED ESERCIZI PER LA PREPARAZIONE ALLA PROVA DI VERIFICA DI SETTEMBRE SCIENZE INTEGRATE (CHIMICA)
 ISTITUTO DI ISTRUZIONE SUPERIORE CHINO CHINI Via Pietro Caiani 68-50032 Borgo San Lorenzo (Fi) Tel. 055.8459.268 - Fax 055.8495.131 Sito Web: www.chinochini.it - E-mail: chinochini@tin.it - PEC FIIS02300N@PEC.ISTRUZIONE.IT
ISTITUTO DI ISTRUZIONE SUPERIORE CHINO CHINI Via Pietro Caiani 68-50032 Borgo San Lorenzo (Fi) Tel. 055.8459.268 - Fax 055.8495.131 Sito Web: www.chinochini.it - E-mail: chinochini@tin.it - PEC FIIS02300N@PEC.ISTRUZIONE.IT
3 Variabile intensiva coniugata alla quantità di moto 1
 EQUILIBRIO ERMODINAMICO LOCALE Contents 1 Variabili termodinamiche locali 1 2 Quantità di moto 1 3 Variabile intensiva coniugata alla quantità di moto 1 4 Densità delle variabili estensive 2 5 Equilibrio
EQUILIBRIO ERMODINAMICO LOCALE Contents 1 Variabili termodinamiche locali 1 2 Quantità di moto 1 3 Variabile intensiva coniugata alla quantità di moto 1 4 Densità delle variabili estensive 2 5 Equilibrio
Dispositivi optoelettronici (1)
 Dispositivi optoelettronici (1) Sono dispositivi dove giocano un ruolo fondamentale sia le correnti elettriche che i fotoni, le particelle base della radiazione elettromagnetica. Le onde elettromagnetiche
Dispositivi optoelettronici (1) Sono dispositivi dove giocano un ruolo fondamentale sia le correnti elettriche che i fotoni, le particelle base della radiazione elettromagnetica. Le onde elettromagnetiche
LEZIONE 5-6 GAS PERFETTI, CALORE, ENERGIA TERMICA ESERCITAZIONI 1: SOLUZIONI
 LEZIONE 5-6 G PERFETTI, CLORE, ENERGI TERMIC EERCITZIONI 1: OLUZIONI Gas Perfetti La temperatura è legata al movimento delle particelle. Un gas perfetto (ovvero che rispetta la legge dei gas perfetti PV
LEZIONE 5-6 G PERFETTI, CLORE, ENERGI TERMIC EERCITZIONI 1: OLUZIONI Gas Perfetti La temperatura è legata al movimento delle particelle. Un gas perfetto (ovvero che rispetta la legge dei gas perfetti PV
CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA. L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
 COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
COMPITI PER LE VACANZE E ATTIVITA PER IL RECUPERO a.s. 2014/2015 SECONDA E ITIS CHIMICA e LABORATORIO e SCIENZE E TECNOLOGIA L attività del lavoro estivo verrà verificato nei primi giorni dopo le vacanze.
La Spettroscopia EPR nello Studio di Sistemi di Interesse Biologico: Introduzione Prof. Riccardo Basosi
 La Spettroscopia EPR nello Studio di Sistemi di Interesse Biologico: Introduzione Prof. Riccardo Basosi Via A. De Gasperi 2, I- 53100 Siena, Italia. Tel: +39-0577-234240; Fax: +39-0577-2342439. http://www.chim.unisi.it/basosi/basosi.html
La Spettroscopia EPR nello Studio di Sistemi di Interesse Biologico: Introduzione Prof. Riccardo Basosi Via A. De Gasperi 2, I- 53100 Siena, Italia. Tel: +39-0577-234240; Fax: +39-0577-2342439. http://www.chim.unisi.it/basosi/basosi.html
Istituto di Istruzione Superiore L. da Vinci Civitanova Marche. Anno scolastico 2014-2015. Programma svolto. Docente: Silvana Venditti
 Anno scolastico 2014-2015 Programma svolto Docente: Silvana Venditti Disciplina: Scienze Naturali Classe : IV sez. E - Indirizzo Linguistico ARTICOLAZIONE DEI CONTENUTI E DEGLI OBIETTIVI SECONDO UNITA
Anno scolastico 2014-2015 Programma svolto Docente: Silvana Venditti Disciplina: Scienze Naturali Classe : IV sez. E - Indirizzo Linguistico ARTICOLAZIONE DEI CONTENUTI E DEGLI OBIETTIVI SECONDO UNITA
ISTITUTO ISTRUZIONE SUPERIORE POLO COMMERCIALE ARTISTICO GRAFICO MUSICALE
 a.s.2015/2016 CHIMICA, FISICA E SCIENZE ISTITUTO TECNICO GRAFICA E COMUNICAZIONE SCIENZE INTEGRATE (FISICA) A CURA DEL RESPONSABILE DELL'AMBITO TETI MERI L AMBITO DISCIPLINARE DI CHIMICA, FISICA E SCIENZE
a.s.2015/2016 CHIMICA, FISICA E SCIENZE ISTITUTO TECNICO GRAFICA E COMUNICAZIONE SCIENZE INTEGRATE (FISICA) A CURA DEL RESPONSABILE DELL'AMBITO TETI MERI L AMBITO DISCIPLINARE DI CHIMICA, FISICA E SCIENZE
Correnti e circuiti a corrente continua. La corrente elettrica
 Correnti e circuiti a corrente continua La corrente elettrica Corrente elettrica: carica che fluisce attraverso la sezione di un conduttore in una unità di tempo Q t Q lim t 0 t ntensità di corrente media
Correnti e circuiti a corrente continua La corrente elettrica Corrente elettrica: carica che fluisce attraverso la sezione di un conduttore in una unità di tempo Q t Q lim t 0 t ntensità di corrente media
Introduzione alla fisica quantistica
 Paola Pannuti Liceo Scientifico Ulivi Parma Introduzione alla fisica quantistica http://digilander.libero.it/la_prof_di_fisica/fisicaquantistica.pdf Dalle lezioni del professor Elio Fabri Dip. di fisica
Paola Pannuti Liceo Scientifico Ulivi Parma Introduzione alla fisica quantistica http://digilander.libero.it/la_prof_di_fisica/fisicaquantistica.pdf Dalle lezioni del professor Elio Fabri Dip. di fisica
TRM-8 Mini Termometro a raggi infrarossi. Manuale d uso
 TRM-8 Mini Termometro a raggi infrarossi Manuale d uso Emissività La maggior parte dei materiali di natura organica presentano una emissività di 0.95, questo valore è già stato reimpostato nello strumento.
TRM-8 Mini Termometro a raggi infrarossi Manuale d uso Emissività La maggior parte dei materiali di natura organica presentano una emissività di 0.95, questo valore è già stato reimpostato nello strumento.
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Esempio Esame di Fisica Generale I C.d.L. ed.u. Informatica
 Esempio Esame di Fisica Generale I C.d.L. ed.u. Informatica Nome: N.M.: 1. 1d (giorno) contiene all incirca (a) 8640 s; (b) 9 10 4 s; (c) 86 10 2 s; (d) 1.44 10 3 s; (e) nessuno di questi valori. 2. Sono
Esempio Esame di Fisica Generale I C.d.L. ed.u. Informatica Nome: N.M.: 1. 1d (giorno) contiene all incirca (a) 8640 s; (b) 9 10 4 s; (c) 86 10 2 s; (d) 1.44 10 3 s; (e) nessuno di questi valori. 2. Sono
