+ (ph < pi) 0/- (ph pi)
|
|
|
- Celia Santoro
- 4 anni fa
- Visualizzazioni
Transcript
1 Pianificare la separazione delle seguenti proteine utilizzando una colonna cromatografica contenente lo scambiatore di cationi CM-cellulosa. A quale valore di ph dobbiamo equilibrare la FS? Stabilire la carica di ciascuna proteina nelle condizioni prescelte pi Emoglobina 7,1 Citocromo c 10,6 Fibrinogeno 5,8 Ribonucleasi 7,8 Lisozima 11,0 carica + (ph < pi) + (ph < pi) 0/- (ph pi) + (ph < pi) + (ph < pi) Aumento Forza In quali condizioni sperimentali possiamo eluire le proteine?. ionica ([NaCl]) Ipotizzare il grafico di eluizione corrispondente ph = 6.0
2 Ass (276 nm) Si legano e devono essere eluite in modo differenziale Non si lega FIBRINOGENO pi 5.8 Hb pi 7.1 Ribonucleasi pi 7.8 Citocromo C pi 10.6 Lisozima pi 11.0 Aumento della [NaCl] nella fase mobile T. el. (min) V 0
3 Scegliere le condizioni sperimentali più opportune per purificare le seguenti proteine a partire da una miscela contenente: pi PM (kda) Emoglobina Albumina Ribonucleasi Lisozima Insulina Citocromo c Quale tipo o tipi di cromatografia si possono utilizzare? In quali condizioni sperimentali si deve lavorare? Indicare le condizioni iniziali e quelle di eluizione Ipotizzare il grafico di eluizione corrispondente
4 SCAMBIATORE CATIONICO (CM-CELLULOSA) EQUILIBRATA CON TAMPONE A ph Emoglobina Ribonucleasi Lisozima Citocromo C Albumina Insulina Sono immobilizzati in colonna: li eluisco con un gradiente crescente di forza ionica [NaCl] o di ph (da ph 6.0 a ph 12.0) Non si legano alla CM-cellulosa, sono eluite insieme col volume morto Ass (276 nm) Albumina, Insulina Hb pi 7.1 Ribonucleasi pi 7.8 Citocromo C pi 10.6 Lisozima pi 11.0 Tm T1 T2 T3 T4 T. el. (min)
5 GEL-FILTRAZIONE ALBUMINA Da INSULINA 6500 Da SEPHADEX G50: BIO-GEL P-10: BIO-GEL P30: Ass (276 nm) Albumina Eluisce col volume vuoto Insulina È compresa nel range di frazionamento; è eluita con un volume di ritenzione che dipende dal suo coefficiente di ripartizione T0 (V0) Tr (Vr) T. el. (min)
6 TECNICHE ANALITICHE DI RIVELAZIONE PER PROTEINE TECNICHE SPETTROSCOPICHE: Rivelazione in base all interazione fra proteine e radiazione elettromagnetica. Determinazione della concentrazione (quantificazione) Studio della struttura TECNICHE ELETTROFORETICHE: Rivelazione in base alla migrazione differenziale delle proteine in un campo elettrico Valutare il grado di purezza Determinazione peso molecolare (approssimativo) e del pi Identificazione se accoppiate a spettrometria di massa e immuno-rivelazione Quantificazione SAGGI FUNZIONALI: per es. enzimatici, interazione con ligandi, attività antibatterica/antivirale.. SPETTROMETRIA DI MASSA: Identificazione della/e proteina/e mediante la misura della massa molecolare con elevata accuratezza e precisione, determinazione della sequenza e delle modificazioni post-traduzionali Quantificazione Elevata sensibilità TECNICHE IMMUNOLOGICHE: Identificazione mediante interazione con anticorpi specifici (es: western-blotting) Determinazione della concentrazione (ELISA) Elevata sensibilità
7 TECNICHE ELETTROFORETICHE Sono tecniche di separazione che sfruttano la migrazione di molecole provviste di carica elettrica sotto l influsso di un campo elettrico. Le proteine possono avere un numero variabile di gruppi ionizzabili (catene R di His, Arg, Lys, Asp, Glu, Ammino-term., Carbossi-term.) e quindi ad un dato ph possono avere carica + o -, dunque hanno la capacità di muoversi in un campo elettrico. Molecole di interesse biologico che possono essere separate mediante elettroforesi: Aminoacidi Proteine Nucleotidi Acidi nucleici Tali molecole possono essere separate in base alla loro diversa MOBILITA ELETTROFORETICA
8 Molecole cariche che si muovono in un campo elettrico sono soggette all influenza di due diverse forze: Forza del campo elettrico Forza frizionale F el = q E F fr = v f q= intensità di carica elettrica E= intensità del campo elettrico applicato Ione + circondato da controioni - v= velocità di migrazione f = coefficiente frizionale, attrito esercitato dal mezzo sul movimento dello ione, dipende da: Dimensione e Forma dello IONE, Porosità del supporto, viscosità del mezzo _ +
9 In un campo elettrico costante le 2 forze si bilanciano F el = F fr q E = v f v = q E / f la velocità di migrazione dipende dall intensità di carica e del campo elettrico e dal coefficiente frizionale v = q E / f v/e = q/f = v/e = q/f Il rapporto fra velocità di migrazione e intensità di campo elettrico è la mobilità elettroforetica = v (quando l intensità del campo elettrico è unitaria) f = dipende dalla massa della molecola, dalle sue dimensioni e dalla viscosità del mezzo, per la legge di Stokes f = 6 π η r v r = raggio della molecola (o di Stokes) η = viscosità del mezzo v = velocità elettroforetica = q 6 π η r v
10 Elettroforesi zonale: uso di supporti per la separazione carta da filtro acetato di cellulosa risultati accettabili x molecole di piccole dimensioni, effetto frizionale minimo, la separazione si basa solo sulla carica gel di poliacrilamide gel di agarosio notevole aumento di risoluzione per effetto setaccio del gel, effetto frizionale molto forte
11 TECNICHE ELETTROFORETICHE SU GEL DI POLIACRILAMIDE (PAGE) 1) In condizioni native (PAGE nativa) 2) In condizioni denaturanti in presenza del detergente ionico SDS (SDS-PAGE), separa le proteine unicamente in base al PM 3) In gradiente di ph (Isoelettrofocalizzazione: IEF) separa le proteine unicamente in base al pi 4) Elettroforesi Bidimensionale (2D-PAGE) separa le proteine in base al pi e al PM
12 PolyAcrylamide Gel Electrophoresis (PAGE): utilizza un supporto di poliacrilamide La formazione di poliacrilmide è una reazione radicalica che richiede: 1) 2- Iniziatore: Ioni Persolfato, o Ammonio Persolfato (AP) >> S 2 O 8 2) Catalizzatore: N,N,N,N tetrametil-etilendiamina (TEMED) >> (CH 3 ) 2 -N-CH 2 -CH 2 -N(CH 3 ) 2 3) Monomeri di acrilamide (per formare le catene) 4) Monomeri di Bisacrilamide (per formare i ponti fra le catene) TEMED Radicale solforico TEMED Acrilamide Metilen-bisacrilamide Ioni persolfato Radicali solfato: INIZIATORI della reaz. Radicalica TEMED Polimerizzazione
13 I gel di poliacrilamide possono essere facilmente preparati in laboratorio scegliendo opportunamente le dimensioni con cui si formerà la maglia, il reticolo polimerico, queste sono definite dal valore di T (può variare tra 3 e 18%): DENSITA del gel, ossia la concentrazione totale di acrilamide espressa in %. acrilamide (g) + bis acrilamide (g) %T= x 100 volume (ml) T grande= maglie strette rallenta molecole in base alle loro dimensioni %T INTERVALLO DI FRAZIONAMENTO T piccolo= maglie larghe rallenta solo le molecole più grandi Un altro parametro usato per valutare la porosità del gel è la concentrazione percentuale (C%) del crosslinkante (bisacrilammide). bis acrilam (g) %C = x 100 acrilamide (g) + bis acrilam(g)
14 La polimerizzazione radicalica è molto veloce e la miscela acrilammide/bisacrilammide in presenza dei catalizzatori passa dallo stato liquido allo stato solido di gel. Acrilammide e bisacrilammide SONO TOSSICI quando sono nello stato di polvere o liquidi, perciò vanno maneggiati con ogni precauzione e con opportuni di dispositivi di protezione. Non sono più tossici nello stato di gel. La soluzione di acrilammide/bisacrilammide ancora liquida viene fatta polimerizzare sotto forma di strato sottile: nello spazio compreso fra due lastrine di vetro (0,75-1 mm), in modo da creare una setaccio molecolare uniforme nell intera superficie del gel. Riempimento dello spessore fra le lastrine con la soluzione di Acril./Bisacril.
15 Formazione dei pozzetti: inserimento di un «PETTINE» nella parte superiore della soluzione: verrà rimosso dopo che il gel ha polimerizzato Le lastrine con il gel polimerizzato vanno montate in un supporto opportuno (CAMERETTA ELETTROFORETICA) che permette di mettere a contatto la parte superiore e quella inferiore del gel con una soluzione tampone. Il tampone permette il contatto elettrico fra gel e elettrodi, e quindi garantisce la continuità del campo elettrico lungo tutto il gel Lastrine di vetro
16 CAMERETTA ELETTROFORETICA Utilizzando le lastrine col gel e una lastra di plastica viene assemblata una cameretta elettroforetica. Tampone dentro la cameretta interna La cameretta è alloggiata all interno di una camera più ampia. Viene versato il «tampone di corsa» nella cameretta interna e in quella esterna Le estremità del gel, e gli elettrodi sono immersi nel tampone. Tampone nella camera esterna
17 Sui pozzetti si possono caricare diversi campioni: proteine purificate, Miscele proteiche più o meno complesse Proteine incognite e proteine standard Il caricamento dei campioni va fatto in assenza di campo elettrico. Dopodiché la cameretta viene chiusa e si applica la corrente. Campioni Catodo CATODO negativo Direzione di migrazione Catodo ANODO positivo
18 Si applica il voltaggio collegando gli elettrodi ad un alimentatore Le proteine presenti nei campioni caricati nei pozzetti iniziano a muoversi attraverso il gel, nella direzione del campo elettrico. Proteine presenti in miscela sono separate per effetto della loro dimensione dal gel che funziona da setaccio molecolare. LE PROTEINE SI MUOVONO CON DIFFERENTE MOBILITÀ ELETTROFORETICA TEMPO DELLA CORSA ELETTROFORETICA SONO SEPARATE. E DURANTE IL
19 Preparazione campioni proteici: in soluzione tampone (a ph opportuno) + glicerolo (per aumentarne la densità) + tracciante (blue di bromofenolo) DEVE ESSERE UNA MOLECOLA CON: carica ( ) colorata basso PESO MOLECOLARE DEVE MUOVERSI NEL CAMPO ELLETTRICO (VERSO L ANODO), ATTRAVERSO LE MAGLIE DEL GEL, PIU VELOCEMENTE DI TUTTE LE PROTEINE PRESENTI NEI CAMPIONI CARICATI NEI POZZETTI Il tracciante consente di seguire la corsa elettroforetica dal momento che non è possibile visualizzare le proteine presenti nei campioni. La corsa è interrotta quando il tracciante arriva alla fine del gel: siamo sicuri che le proteine, che hanno una mobilità elettroforetica INFERIORE rispetto al tracciante non sono fuoriuscite dal gel.
20 FISSAZIONE E COLORAZIONE DEL GEL. Da effettuare al termine della corsa elettroforetica. Bisogna che le proteine siano immobilizzate nella posizione raggiunta durante la separazione elettroforetica e colorate in modo specifico. Si può utilizzare una soluzione che funziona da fissante e colorante insieme: per es., Coomassie Brilliant Blue in soluzione alcolica/acida Si immerge il gel nella soluzione fissante/colorante. Dopo un certo tempo si procede alla DECOLORAZIONE: il colorante è rimosso dal gel con una serie di lavaggi in soluzione acida/alcolica. Il colorante legato in modo aspecifico al gel è lavato via, rimangono colorate solo le proteine con cui il colorante ha interagito in modo specifico.
21 CONSERVAZIONE DEL GEL Il gel sviluppato può essere conservato a lungo termine se essiccato fra due fogli di cellophane: All aria In incubatore a temperatura superiore a quella ambiente
22 Direzione di migrazione PAGE NATIVA Per preparare un gel di poliacrilamide (x PAGE nativa) occorre: Soluzione acquosa contenente i monomeri di acrilamide e bisacrilamide Catalizzatori (AP e TEMED) Soluzione tampone a ph basico (per caricare negativamente le proteine) Le proteine con carica negativa si muoveranno verso l anodo, con mobilità elettroforetica diversa a seconda della loro intensità di carica e del coefficiente frizionale = q/f Il gel funziona da SETACCIO MOLECOLARE. Molecole più piccole, in movimento in un campo elettrico, con un coefficiente frizionale più basso e un intensità di carica più elevate hanno una mobilità elettroforetica più elevata. Molecole più grandi avranno una mobilità elettroforetica più bassa, sono rallentate.
23 SDS-PAGE = Elettroforesi su gel di poliacrilamide in presenza di sodio dodecil solfato (SDS) CONDIZIONI DENATURANTI Il detergente ionico SDS interagisce con le proteine con un rapporto costante: 1 molecola di SDS ogni 2 residui amminoacidici (1,4 g SDS/g proteina) proteina
24 Preparazione campioni proteici. Le proteine devono essere solubilizzate in: + soluzione tampone (a ph opportuno) + glicerolo (per aumentare la densità) + blue di bromofenolo (tracciante) + SDS (detergente ionico denaturante) + 2-mercaptoetanolo (x rompere i ponti S-S) HS-CH 2 -CH 2 -OH Incubazione a 100 C x 5 minuti (denaturazione al calore, ma la proteina non precipita per la presenza del detergente che ne aumenta la solubilità!) AGENTI DENATURANTI
25 La carica nativa della proteina viene mascherata: tutti i complessi SDSproteine sono carichi negativamente e il rapporto carica/massa (z/m) è simile per tutte le proteine. = q/ f q = z/m ( rapporto carica/massa) La mobilità elettroforetica dipende dal coefficiente frizionale, cioè dalla viscosità del supporto (che è la stessa per tutte le proteine caricate sullo stesso gel, in SDS-PAGE) e dal raggio si stokes delle proteine, cioè dalle loro DIMENSIONI MOLECOLARI (che possono essere diverse) e quindi dall azione di setaccio molecolare del gel. Applicazioni dell SDS-PAGE Analisi di miscele proteiche Valutazione purezza di una proteina Determinazione PM
26 Con l SDS-PAGE è possibile avere indicazioni sul peso molecolare delle proteine che sono separate elettroforeticamente, raffrontando la loro mobilità elettroforetica con quella di proteine a PM noto. Importante: le proteine a PM noto scelte vanno abbinate al T del gel e viceversa. Infatti migrano differentemente a seconda del T. es: kda kda PROTEINE A PM NOTO T=
27 DETERMINAZIONE DEL PESO MOLECOLARE Si sceglie la %T a cui preparare il gel Su un pozzetto si caricano proteine standard, a PM noto (bisogna scegliere proteine che rientrino nel range di frazionamento del gel) Su gli altri pozzetti si caricano le proteine a PM incognito A fine corsa si rivelano le bande e si misura la distanza percorsa dalle proteine standard rispetto al punto di partenza Si misura la distanza percorsa dalla proteine incognita SI COSTRUISCE UNA RETTA STANDARD
28 SDS-PAGE = separazione elettroforetica di proteine in condizioni denaturanti È persa la Struttura TERZIARIA e quella QUATERNARIA delle proteine Se una proteina nella sua conformazione nativa è costituita da 2 o più subunità diverse, in SDS-PAGE si ottiene la separazione delle subunità. Hb, pe es.: si separano le subunità beta da quelle alfa = 2 BANDE a PM diversi Proteina a PM incognito
29 PAGE DISCONTINUA Usata per migliorare il potere risolutivo dell elettroforesi: il gel finale è costituito da due gel con un %T differente: -GEL INFERIORE (RUNNING GEL o GEL DI SEPARAZIONE) -GEL SUPERIORE (STACKING GEL o GEL DI IMPACCAMENTO) Gel inferiore T (7-18%) Tris-HCl ph 8.8 Gel superiore T= 3-5% Tris-HCl ph 6.8 Ha un T più basso rispetto al running gel e possiede un ph più acido. NON HA NESSUN EFFETTO DI SETACCIO MOLECOLARE Viene preparato con un T maggiore rispetto al gel superiore e in una soluzione tampone a ph più alto. Dopo la sua polimerizzazione vi si versa sopra il gel superiore. I pozzetti sono formati nel gel superiore.
30 La funzione del gel superiore è quella di concentrare le proteine caricate nei diversi pozzetti in bande molto strette che si focalizzano tutte alla stessa altezza sulla parte superiore del running gel. Tampone della cella: Tris-glicina + SDS ph 8.3 Lo stacking gel ha ph 6.8: la glicina è quasi neutra (6.8 < pka2) e la glicina migra più lentamente rispetto agli ioni Cl - presenti nel gel. A questo ph la glicina (pi =5.9) è carica negativamente e sotto l effetto del campo elettrico entra nello stacking gel. Tris-glicina Tris-HCl Tris-HCl Nel running gel il ph è 8.8: glicina è di nuovo carica negativamente e migra insieme agli ioni Cl- verso l elettrodo positivo. Le proteine complessate dall SDS si trovano comprese tra gli ioni Cl - e la glicina, come schiacciate da questi due fronti ionici, e migrano tutte alla stessa elevata velocità: tutte raggiungono rapidamente il letto del gel inferiore e si focalizzano come delle strette bande.
31 T= 4% Tris-HCl ph 6.8 T = 7-18% Tris-HCl ph 8.8 I complessi SDS-proteine si muovono molto velocemente e formano una banda molto stretta = si concentrano. Tutte le protein entrano nel gel di separazione nello stesso momento, per tutte la separazione inizia dallo stesso starting point.
Elettroforesi = migrazione in campo elettrico
 Elettroforesi = migrazione in campo elettrico Molte molecole di interesse biologico possiedono gruppi ionizzabili. In opportune condizioni di ph presentano una carica elettrica + o e quindi sono in grado
Elettroforesi = migrazione in campo elettrico Molte molecole di interesse biologico possiedono gruppi ionizzabili. In opportune condizioni di ph presentano una carica elettrica + o e quindi sono in grado
3. ELETTROFORESI DI PROTEINE
 3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
V R V t. Proteine ad alto peso molecolare. Proteine a peso molecolare intermedio. Proteine a basso peso molecolare. Kd + piccolo.
 V 0 Proteine ad alto peso molecolare Proteine a peso molecolare intermedio V R V t Proteine a basso peso molecolare Kd elevato Kd piccolo Esclusione molecolare o gelfiltrazione = Volume totale V T = V
V 0 Proteine ad alto peso molecolare Proteine a peso molecolare intermedio V R V t Proteine a basso peso molecolare Kd elevato Kd piccolo Esclusione molecolare o gelfiltrazione = Volume totale V T = V
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
cromatografia Elettroforesi
 Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Elettroforesi di Tamara Benincasa
 Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Genomica e Proteomica
 Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Elettroforesi. Separazione differenziata di molecole cariche (aminoacidi, peptidi, proteine, Acidi nucleici, ecc) sottoposte a un campo elelttrico
 Elettroforesi Separazione differenziata di molecole cariche (aminoacidi, peptidi, proteine, Acidi nucleici, ecc) sottoposte a un campo elelttrico Principio: Migrazione di particelle cariche sotto l azione
Elettroforesi Separazione differenziata di molecole cariche (aminoacidi, peptidi, proteine, Acidi nucleici, ecc) sottoposte a un campo elelttrico Principio: Migrazione di particelle cariche sotto l azione
Metodi di studio delle proteine :
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
CORSO DI LAUREA IN BIOLOGIA GENERALE ED APPLICATA ESERCITAZIONE DEL CORSO DI ANALISI DI MACROMOLECOLE
 CORSO DI LAUREA IN BIOLOGIA GENERALE ED APPLICATA ESERCITAZIONE DEL CORSO DI ANALISI DI MACROMOLECOLE Anno accademico 2016-2017 L esperimento consiste nella analisi di due estratti proteici frazionati
CORSO DI LAUREA IN BIOLOGIA GENERALE ED APPLICATA ESERCITAZIONE DEL CORSO DI ANALISI DI MACROMOLECOLE Anno accademico 2016-2017 L esperimento consiste nella analisi di due estratti proteici frazionati
Elettroforesi: Separazione di molecole cariche mediante applicazione di un campo elettrico
 ELETTROFORESI 1 Elettroforesi: Separazione di molecole cariche mediante applicazione di un campo elettrico Cationi (+) Anioni (-) Polo negativo o CATODO Polo positivo o ANODO 1 Elettroforesi: Separazione
ELETTROFORESI 1 Elettroforesi: Separazione di molecole cariche mediante applicazione di un campo elettrico Cationi (+) Anioni (-) Polo negativo o CATODO Polo positivo o ANODO 1 Elettroforesi: Separazione
TECNICHE ELETTROFORETICHE
 TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa
 WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
Seminario di Cacciatore Rosalia
 Un organismo vivente è un sistema chimico complesso nel quale la materia organica viene sintetizzata, riprodotta, trasformata e decomposta in un incessante ed intenso susseguirsi di reazioni e processi
Un organismo vivente è un sistema chimico complesso nel quale la materia organica viene sintetizzata, riprodotta, trasformata e decomposta in un incessante ed intenso susseguirsi di reazioni e processi
L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche.
 L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche. L elettroforesi è una tecnica che viene usata per separare molecole
L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche. L elettroforesi è una tecnica che viene usata per separare molecole
TECNICHE ELETTROFORETICHE. - Purificazione di molecole: elettroforesi preparativa. - Controllo della purezza di una molecola in un campione
 TECNICHE ELETTROFORETICHE Aree di applicazione: - Purificazione di molecole: elettroforesi preparativa - Controllo della purezza di una molecola in un campione - Determinazione quantitativa di una molecola
TECNICHE ELETTROFORETICHE Aree di applicazione: - Purificazione di molecole: elettroforesi preparativa - Controllo della purezza di una molecola in un campione - Determinazione quantitativa di una molecola
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento
 TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
ESERCIZI 2. Spiegare il principio di.
 ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
Elettroforesi proteine ed acidi nucleici
 Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta)
 Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
2. Tecniche immunochimiche: Western blotting; ELISA; sandwich ELISA 3. Tecniche spettroscopiche: spettrofotometria UV/vis; spettrofluorimetria
 1. Tecniche elettroforetiche: SDS-PAGE 2. Tecniche immunochimiche: Western blotting; ELISA; sandwich ELISA 3. Tecniche spettroscopiche: spettrofotometria UV/vis; spettrofluorimetria Testo consigliato Keith
1. Tecniche elettroforetiche: SDS-PAGE 2. Tecniche immunochimiche: Western blotting; ELISA; sandwich ELISA 3. Tecniche spettroscopiche: spettrofotometria UV/vis; spettrofluorimetria Testo consigliato Keith
Strategie per la purificazione delle proteine
 Strategie per la purificazione delle proteine In una cellula ci possono essere molte proteine (ad esempio, ci sono circa 4300 geni in E. coli) Una singola proteina può rappresentare una frazione tra lo
Strategie per la purificazione delle proteine In una cellula ci possono essere molte proteine (ad esempio, ci sono circa 4300 geni in E. coli) Una singola proteina può rappresentare una frazione tra lo
Estrazione ed elettroforesi degli acidi nucleici
 Estrazione ed elettroforesi degli acidi nucleici Flavia Frabetti Estrazione acidi nucleici (DNA orna) Verifica tramite elettroforesi su gel di agarosio Amplificazione tramite PCR (da DNA) o RT-PCR (da
Estrazione ed elettroforesi degli acidi nucleici Flavia Frabetti Estrazione acidi nucleici (DNA orna) Verifica tramite elettroforesi su gel di agarosio Amplificazione tramite PCR (da DNA) o RT-PCR (da
5- Estrazione ed analisi di DNA
 5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
ESERCIZI 2. Spiegare il principio di.
 ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
Apparato elettroforesi
 Elettroforesi Tecniche che permettono di separare diverse macromolecole cariche tramite l applicazione di un campo elettrico. Apparato elettroforesi Fonte: Internet Utilizzata in biochimica e biologia
Elettroforesi Tecniche che permettono di separare diverse macromolecole cariche tramite l applicazione di un campo elettrico. Apparato elettroforesi Fonte: Internet Utilizzata in biochimica e biologia
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo
 Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
TECNICHE DI BIOLOGIA MOLECOLARE. Dott.ssa Francesca Santilli
 TECNICHE DI BIOLOGIA MOLECOLARE Dott.ssa Francesca Santilli Sin dai primi anni 60, i biologi molecolari hanno scoperto come caratterizzare, isolare e manipolare le componenti molecolari delle CELLULE e
TECNICHE DI BIOLOGIA MOLECOLARE Dott.ssa Francesca Santilli Sin dai primi anni 60, i biologi molecolari hanno scoperto come caratterizzare, isolare e manipolare le componenti molecolari delle CELLULE e
GENERALITA SULLA CROMATOGRAFIA
 GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
PURIFICAZIONE DELLE PROTEINE
 PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
TIPI di CROMATOGRAFIA
 Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
WESTERN BLOT o IMMUNOFISSAZIONE
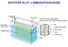 WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
Tecniche Elettroforetiche
 Tecniche Elettroforetiche Prof. Fabiana Passaro Telefono 081-7463627 Email fabiana.passaro@unina.it Sito Docente https://www.docenti.unina.it/fabiana.passaro Definizione L'elettroforesi è una tecnica che
Tecniche Elettroforetiche Prof. Fabiana Passaro Telefono 081-7463627 Email fabiana.passaro@unina.it Sito Docente https://www.docenti.unina.it/fabiana.passaro Definizione L'elettroforesi è una tecnica che
Passaggi preliminari di purificazione
 Passaggi preliminari di purificazione Estratto iniziale Omogenato contiene materiale insolubile che generalmente viene eliminato per centrifugazione. Talvolta la soluzione mostra torbidità (dovuta alla
Passaggi preliminari di purificazione Estratto iniziale Omogenato contiene materiale insolubile che generalmente viene eliminato per centrifugazione. Talvolta la soluzione mostra torbidità (dovuta alla
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Corso di Tecniche biomolecolari applicate Modulo Analisi di Macromolecole
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Corso di Tecniche biomolecolari applicate Modulo Analisi di Macromolecole 1. Elettroforesi su gel di poliacrilammide (PAGE nativa) L esperimento consiste
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Corso di Tecniche biomolecolari applicate Modulo Analisi di Macromolecole 1. Elettroforesi su gel di poliacrilammide (PAGE nativa) L esperimento consiste
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
ELETTROFORESI. Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico.
 ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
Modulo 3. Lavorare con le proteine
 Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Cosa determina l assorbanza di un cromoforo?
 Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
2. LA PURIFICAZIONE DI PROTEINE:
 2. LA PURIFICAZIONE DI PROTEINE: LA CROMATOGRAFIA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) LA PURIFICAZIONE DI PROTEINE Purificare
2. LA PURIFICAZIONE DI PROTEINE: LA CROMATOGRAFIA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) LA PURIFICAZIONE DI PROTEINE Purificare
0,8% riesce a separare un range di dimensioni da circa 500 bp a circa bp.
 L elettroforesi è una tecnica che utilizza un campo elettrico per separare e visualizzare frammenti di DNA in base al loro peso molecolare ed alla loro carica. Gli acidi nucleici, migrano sempre verso
L elettroforesi è una tecnica che utilizza un campo elettrico per separare e visualizzare frammenti di DNA in base al loro peso molecolare ed alla loro carica. Gli acidi nucleici, migrano sempre verso
WESTERN BLOTTING Tecnica che permette di valutare quanto è espressa una proteina e dove è localizzata. SDS-PAGE trasferimento saturazione
 WESTERN BLOTTING Tecnica che permette di valutare quanto è espressa una proteina e dove è localizzata. La procedura di Western Blotting consiste nei seguenti passaggi: - SDS-PAGE - trasferimento (blotting)
WESTERN BLOTTING Tecnica che permette di valutare quanto è espressa una proteina e dove è localizzata. La procedura di Western Blotting consiste nei seguenti passaggi: - SDS-PAGE - trasferimento (blotting)
cromatografia Esplorando le proteine
 Cromatografia Flavia Frabetti Tecnici di laboratorio 2010/2011 Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per
Cromatografia Flavia Frabetti Tecnici di laboratorio 2010/2011 Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per
Analisi di proteine:
 Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mm.dinardo@biologia.uniba.it Le proteine sono il prodotto dei geni: sono le proteine
Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mm.dinardo@biologia.uniba.it Le proteine sono il prodotto dei geni: sono le proteine
Analisi di proteine:
 Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mariamaddalena.dinardo@uniba.it Le proteine sono il prodotto dei geni: sono le
Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mariamaddalena.dinardo@uniba.it Le proteine sono il prodotto dei geni: sono le
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
SDS-PAGE/Western blot
 SDS-PAGE/Western blot preparare 2 gels: 7.5% di acrilamide, SPACERS 1.5 mm. Uno verrà utilizzato per il trasferimento su nitrocellulosa, l altro colorato con il blu di coomassie. caricare i campioni dell
SDS-PAGE/Western blot preparare 2 gels: 7.5% di acrilamide, SPACERS 1.5 mm. Uno verrà utilizzato per il trasferimento su nitrocellulosa, l altro colorato con il blu di coomassie. caricare i campioni dell
Estrazione di proteine da matrici alimentari, determinazione ed analisi
 Estrazione di proteine da matrici alimentari, determinazione ed analisi Laboratorio di Biochimica Generale (Responsabile attività: Prof. Rocco Rossano, Tutor: Dr.ssa Marilena Larocca) 1. Omogeneizzazione
Estrazione di proteine da matrici alimentari, determinazione ed analisi Laboratorio di Biochimica Generale (Responsabile attività: Prof. Rocco Rossano, Tutor: Dr.ssa Marilena Larocca) 1. Omogeneizzazione
1. Cromatografia per gel-filtrazione
 1. Cromatografia per gel-filtrazione La gel filtrazione è un metodo cromatografico che separa le sostanze in base alle loro dimensioni molecolari. I materiali che costituiscono il supporto per la gel-filtrazione
1. Cromatografia per gel-filtrazione La gel filtrazione è un metodo cromatografico che separa le sostanze in base alle loro dimensioni molecolari. I materiali che costituiscono il supporto per la gel-filtrazione
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
differente ripartizione delle sostanze tra due fasi immiscibili
 Cromatografia Dal greco chroma: colore, graphein: scrivere 1903 Mikhail Twsett E il termine generico che indica una serie di tecniche di separazione di molecole (anche molto simili in base alle loro proprietà
Cromatografia Dal greco chroma: colore, graphein: scrivere 1903 Mikhail Twsett E il termine generico che indica una serie di tecniche di separazione di molecole (anche molto simili in base alle loro proprietà
ELETTROFORESI. Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico.
 ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
Tecniche elettroforetiche:
 Tecniche elettroforetiche: Gel di agarosio, Nativa, SDS-PAGE, Isoelettrofocalizzazione, 2D-PAGE L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole
Tecniche elettroforetiche: Gel di agarosio, Nativa, SDS-PAGE, Isoelettrofocalizzazione, 2D-PAGE L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole
Tra nm Nucleotidi mono-fosfato
 Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
LA SPETTROMETRIA DI MASSA
 LA SPETTROMETRIA DI MASSA Tecnica che consente di caratterizzare e identificare composti sconosciuti e noti in base alla determinazione della loro massa molecolare e alla loro caratterizzazione strutturale
LA SPETTROMETRIA DI MASSA Tecnica che consente di caratterizzare e identificare composti sconosciuti e noti in base alla determinazione della loro massa molecolare e alla loro caratterizzazione strutturale
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE Cromatografia è il termine generico che indica una serie di tecniche di separazione di molecole simili in base alle loro proprietà chimiche e fisiche. Questo metodo di separazione
TECNICHE CROMATOGRAFICHE Cromatografia è il termine generico che indica una serie di tecniche di separazione di molecole simili in base alle loro proprietà chimiche e fisiche. Questo metodo di separazione
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007. Corso di: Laboratorio di Biologia II Chimica Biologica
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
Metodi colorimetrici. Metodi immunochimici
 WESTERN BLOTTING Metodi colorimetrici Metodi immunochimici SCOPO DEL WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING Colorazione (Blue Coomassie) Rilevazione con anticorpi SCOPO DEL WESTERN BLOTTING Tecnica
WESTERN BLOTTING Metodi colorimetrici Metodi immunochimici SCOPO DEL WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING Colorazione (Blue Coomassie) Rilevazione con anticorpi SCOPO DEL WESTERN BLOTTING Tecnica
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI
 METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
LUMINESCENZA. semiconduttore
 LUMINESCENZA LUMINESCENZA Elettroluminescenza Radioluminescenza Chemiluminescenza Bioluminescenza Termoluminescenza Triboluminescenza Sonoluminescenza Fotoluminescenza corrente elettrica in gas ionizzato
LUMINESCENZA LUMINESCENZA Elettroluminescenza Radioluminescenza Chemiluminescenza Bioluminescenza Termoluminescenza Triboluminescenza Sonoluminescenza Fotoluminescenza corrente elettrica in gas ionizzato
Elettroforesi - ++ In assenza di moti diffusivi/convettivi gli analiti neutri non possono spostarsi nel mezzo.
 Elettroforesi Con il termine elettroforesi si indica una famiglia di tecniche in cui la separazione di analiti viene effettuata sfruttandone la diversa migrazione sotto l azione di un campo elettrico:
Elettroforesi Con il termine elettroforesi si indica una famiglia di tecniche in cui la separazione di analiti viene effettuata sfruttandone la diversa migrazione sotto l azione di un campo elettrico:
Preparazione del campione analitico
 Preparazione del campione analitico Workflow per l analisi farmaceutica Lotto Totalità del materiale Campionamento Il campione deve essere rappresentativo del lotto Conservazione Preparazione campione
Preparazione del campione analitico Workflow per l analisi farmaceutica Lotto Totalità del materiale Campionamento Il campione deve essere rappresentativo del lotto Conservazione Preparazione campione
PURIFICAZIONE E CARATTERIZZAZIONE BIOCHIMICA DI UNA TREALASI DI INSETTO ESPRESSA COME PROTEINA ETEROLOGA IN Escherichia coli.
 PURIFICAZIONE E CARATTERIZZAZIONE BIOCHIMICA DI UNA TREALASI DI INSETTO ESPRESSA COME PROTEINA ETEROLOGA IN Escherichia coli. La trealasi (α,α-trealosio glucoidrolasi EC 3.2.1.28) è un enzima che catalizza
PURIFICAZIONE E CARATTERIZZAZIONE BIOCHIMICA DI UNA TREALASI DI INSETTO ESPRESSA COME PROTEINA ETEROLOGA IN Escherichia coli. La trealasi (α,α-trealosio glucoidrolasi EC 3.2.1.28) è un enzima che catalizza
Elettroforesi. Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita.
 Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Perche usare Gel di Poliacrilammide per separare le proteine?
 Perche usare Gel di Poliacrilammide per separare le proteine? I gel di poliacrilammide hanno una trama piu compatta I pori hanno dimensioni minori che nei gel di agarosio Le proteine sono molto piu piccole
Perche usare Gel di Poliacrilammide per separare le proteine? I gel di poliacrilammide hanno una trama piu compatta I pori hanno dimensioni minori che nei gel di agarosio Le proteine sono molto piu piccole
ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. v = E.q/f
 ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico Anioni ANODO (+) Cationi CATODO (-) v = E.q/f µ = v/e v = velocità di migrazione
ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico Anioni ANODO (+) Cationi CATODO (-) v = E.q/f µ = v/e v = velocità di migrazione
METODICHE DI IMMUNOCHIMICA
 METODICHE DI IMMUNOCHIMICA IMMUNOCHIMICA permette la determinazione quantitativa di proteine in tessuti e omogenati INTERAZIONI ANTIGENE-ANTICORPO L immunochimica si basa sulle interazioni antigene-anticorpo
METODICHE DI IMMUNOCHIMICA IMMUNOCHIMICA permette la determinazione quantitativa di proteine in tessuti e omogenati INTERAZIONI ANTIGENE-ANTICORPO L immunochimica si basa sulle interazioni antigene-anticorpo
LABORATORIO DI GENETICA SUMMER SCHOOL 2014
 P a g i n a 1 LABORATORIO DI GENETICA SUMMER SCHOOL 2014 PROTOCOLLO DI ESTRAZIONE DEL DNA DA TESSUTI VEGETALI GenElute Plant Genomic DNA Miniprep Kit (Sigma-Aldrich) https://www.google.it/url?sa=t&rct=j&q=&esrc=s&source=web&cd=2&cad=rja&uact=8&ved=0c
P a g i n a 1 LABORATORIO DI GENETICA SUMMER SCHOOL 2014 PROTOCOLLO DI ESTRAZIONE DEL DNA DA TESSUTI VEGETALI GenElute Plant Genomic DNA Miniprep Kit (Sigma-Aldrich) https://www.google.it/url?sa=t&rct=j&q=&esrc=s&source=web&cd=2&cad=rja&uact=8&ved=0c
FOCALIZZAZIONE ISOELETTRICA (IEF)
 FOCALIZZAZIONE ISOELETTRICA (IEF) ELETTROFORESI DI PROTEINE CRITERI DI SEPARAZIONE PAGE nativa densità di carica (pi), dimensioni, forma PAGE-SDS solo dimensioni IEF solo in base al punto isoelettrico
FOCALIZZAZIONE ISOELETTRICA (IEF) ELETTROFORESI DI PROTEINE CRITERI DI SEPARAZIONE PAGE nativa densità di carica (pi), dimensioni, forma PAGE-SDS solo dimensioni IEF solo in base al punto isoelettrico
Elettroforesi - ++ In assenza di moti diffusivi/convettivi gli analiti neutri non possono spostarsi nel mezzo.
 Elettroforesi Con il termine elettroforesi si indica una famiglia di tecniche in cui la separazione di analiti viene effettuata sfruttandone la diversa migrazione sotto l azione di un campo elettrico:
Elettroforesi Con il termine elettroforesi si indica una famiglia di tecniche in cui la separazione di analiti viene effettuata sfruttandone la diversa migrazione sotto l azione di un campo elettrico:
A = εlc c = A/εl c = 0.2/38000 M -1 cm -1 1 cm c = M = 5 μm
 COME PROCEDO? Ho una soluzione di una proteina purificata Preparo un bianco con lo stesso tampone utilizzato per dissolvere la proteina Effettuo l azzeramento dello spettrofotometro con il bianco e poi
COME PROCEDO? Ho una soluzione di una proteina purificata Preparo un bianco con lo stesso tampone utilizzato per dissolvere la proteina Effettuo l azzeramento dello spettrofotometro con il bianco e poi
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Quantizzazione del DNA con spettrofotometro
 Quantizzazione del DNA ed elettroforesi 1 Quantizzazione del DNA con spettrofotometro Al termine della metodica di estrazione, occorre quantificare il DNA isolato. Un metodo per quantificare in modo preciso
Quantizzazione del DNA ed elettroforesi 1 Quantizzazione del DNA con spettrofotometro Al termine della metodica di estrazione, occorre quantificare il DNA isolato. Un metodo per quantificare in modo preciso
a) un movimento contro gradiente di concentrazione che utilizza fonti primarie di energia
 1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Amplificazione mediante PCR (Polymerase Chain Reaction) del DNA estratto dalla saliva.
 OBIETTIVO DEL LAVORO SPERIMENTALE: TIPIZZAZIONE DEI CROMOSOMI SESSUALI X e Y Amplificazione mediante PCR (Polymerase Chain Reaction) del DNA estratto dalla saliva. Cromosoma X Cromosoma y La tipizzazione
OBIETTIVO DEL LAVORO SPERIMENTALE: TIPIZZAZIONE DEI CROMOSOMI SESSUALI X e Y Amplificazione mediante PCR (Polymerase Chain Reaction) del DNA estratto dalla saliva. Cromosoma X Cromosoma y La tipizzazione
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
SCOPO DEL WESTERN BLOTTING
 WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING Tecnica che consente di visualizzare/individuare UNA proteina tra milioni, grazie all utilizzo di anticorpi
WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING SCOPO DEL WESTERN BLOTTING Tecnica che consente di visualizzare/individuare UNA proteina tra milioni, grazie all utilizzo di anticorpi
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
METODI BIOCHIMICI ESERCIZI D ESAME (by NewSgrunt)
 METODI BIOCHIMICI ESERCIZI D ESAME 2002 2006 (by NewSgrunt) A) SPETTROSCOPIA UV/vis, LAMBERT-BEER, STUDIO DELLE PROTEINE 1A) Il Citocromo c è caratterizzato dai seguenti coefficienti di estinzione molare:
METODI BIOCHIMICI ESERCIZI D ESAME 2002 2006 (by NewSgrunt) A) SPETTROSCOPIA UV/vis, LAMBERT-BEER, STUDIO DELLE PROTEINE 1A) Il Citocromo c è caratterizzato dai seguenti coefficienti di estinzione molare:
Ele$roforesi. verso il catodo se hanno carica posi.va. Le par.celle si spostano. verso l'anodo se hanno carica nega.va
 Ele$roforesi L ele#roforesi è una tecnica anali.ca e separa.va basata sul movimento di par.celle cariche ele$ricamente quando immerse in un fluido per effe$o di un campo ele$rico applicato mediante una
Ele$roforesi L ele#roforesi è una tecnica anali.ca e separa.va basata sul movimento di par.celle cariche ele$ricamente quando immerse in un fluido per effe$o di un campo ele$rico applicato mediante una
Tecniche elettroforetiche. Applicazione: Proteolisi limitata
 Tecniche elettroforetiche Applicazione: Proteolisi limitata PRINCIPI GENERALI Elettroforesi: Migrazione di particelle cariche sotto l azione di un campo elettrico Il campo elettrico è generato applicando
Tecniche elettroforetiche Applicazione: Proteolisi limitata PRINCIPI GENERALI Elettroforesi: Migrazione di particelle cariche sotto l azione di un campo elettrico Il campo elettrico è generato applicando
Southern Blot: Per l analisi del DNA. (sonda = DNA o RNA). Northern Blot: Per l analisi dell RNA. (sonda = DNA o RNA).
 Southern Blot: Per l analisi del DNA. (sonda = DNA o RNA). Northern Blot: Per l analisi dell RNA. (sonda = DNA o RNA). Western Blot: Per l analisi delle proteine. (sonda = anticorpo). Una tecnica in cui
Southern Blot: Per l analisi del DNA. (sonda = DNA o RNA). Northern Blot: Per l analisi dell RNA. (sonda = DNA o RNA). Western Blot: Per l analisi delle proteine. (sonda = anticorpo). Una tecnica in cui
TECNICHE CENTRIFUGATIVE PRINCIPI DI BASE DELLA SEDIMENTAZIONE TIPI DI CENTRIFUGHE ULTRACENTRIFUGA ANALITICA
 TECNICHE CENTRIFUGATIVE PRINCIPI DI BASE DELLA SEDIMENTAZIONE TIPI DI CENTRIFUGHE ULTRACENTRIFUGA ANALITICA TIPI DI CENTRIFUGHE CENTRIFUGHE PREPARATIVE Consentono la separazione, isolamento e purificazione
TECNICHE CENTRIFUGATIVE PRINCIPI DI BASE DELLA SEDIMENTAZIONE TIPI DI CENTRIFUGHE ULTRACENTRIFUGA ANALITICA TIPI DI CENTRIFUGHE CENTRIFUGHE PREPARATIVE Consentono la separazione, isolamento e purificazione
VALUTAZIONE DELLA INTERAZIONE TRA ANTIGENE E ANTICORPO MEDIANTE TECNICA IMMUNOCHIMICA WESTERN BLOTTING
 VALUTAZIONE DELLA INTERAZIONE TRA ANTIGENE E ANTICORPO MEDIANTE TECNICA IMMUNOCHIMICA WESTERN BLOTTING Laboratorio di Biochimica Cellulare (Responsabile attività: Prof. Angela Ostuni; Tutor: Dr.ssa Agata
VALUTAZIONE DELLA INTERAZIONE TRA ANTIGENE E ANTICORPO MEDIANTE TECNICA IMMUNOCHIMICA WESTERN BLOTTING Laboratorio di Biochimica Cellulare (Responsabile attività: Prof. Angela Ostuni; Tutor: Dr.ssa Agata
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
v = velocità di migrazione della proteina in un campo elettrico E = forza del campo elettrico z = carica netta della proteina 3500 V catod o
 La prima e : Isoelectric focusing (IEF) v=e z f 1 step1 v = velocità di migrazione della proteina in un campo elettrico E = forza del campo elettrico z = carica netta della proteina Tot 76 kvh f = coefficiente
La prima e : Isoelectric focusing (IEF) v=e z f 1 step1 v = velocità di migrazione della proteina in un campo elettrico E = forza del campo elettrico z = carica netta della proteina Tot 76 kvh f = coefficiente
1. Quantificazione del genomico e determinazione della purezza
 ESERCITAZIONE 2 1. Quantificazione del genomico e determinazione della purezza Una volta estratto il DNA si procede con la quantificazione. Tale quantificazione viene fatta normalmente con l utilizzo di
ESERCITAZIONE 2 1. Quantificazione del genomico e determinazione della purezza Una volta estratto il DNA si procede con la quantificazione. Tale quantificazione viene fatta normalmente con l utilizzo di
Primo Levi Il sistema periodico
 Primo Levi Il sistema periodico L anidride carbonica [...] questo gas che costituisce la materia prima della vita, la scorta permanente a cui tutto ciò che cresce attinge, e il destino ultimo di ogni carne,
Primo Levi Il sistema periodico L anidride carbonica [...] questo gas che costituisce la materia prima della vita, la scorta permanente a cui tutto ciò che cresce attinge, e il destino ultimo di ogni carne,
concentrazione finale rispettivamente di 0.2 M e?%,a 55.c 60 minuti.
 SEPARAZIONE DELLE SUBUNITA' DELLA RIBULOSIO-1,5-DIFOSFATO CARBOSSILASI DA FOGLIE DI CARCIOFO. Cardinali A.,Miceli A.,Pacoda D. e Gallerani R. Centro di Biologia,Laboratorio di Chimica Biologica,Universita'
SEPARAZIONE DELLE SUBUNITA' DELLA RIBULOSIO-1,5-DIFOSFATO CARBOSSILASI DA FOGLIE DI CARCIOFO. Cardinali A.,Miceli A.,Pacoda D. e Gallerani R. Centro di Biologia,Laboratorio di Chimica Biologica,Universita'
O (PM:266,45), resina Dowex AG50W-X2, acido perclorico 65%.
 Parte sperimentale Reagenti CrCl 3 x 6H 2 O (PM:266,45), resina Dowex AG50W-X2, acido perclorico 65%. Procedura sperimentale Preparazione delle soluzioni eluenti Preparare le seguenti soluzioni madre di
Parte sperimentale Reagenti CrCl 3 x 6H 2 O (PM:266,45), resina Dowex AG50W-X2, acido perclorico 65%. Procedura sperimentale Preparazione delle soluzioni eluenti Preparare le seguenti soluzioni madre di
TECNICHE ANALITICHE DI RIVELAZIONE PER PROTEINE TECNICHE SPETTROSCOPICHE: Rivelazione in base all interazione fra proteine e radiazione
 TECNICHE ANALITICHE DI RIVELAZIONE PER PROTEINE TECNICHE SPETTROSCOPICHE: Rivelazione in base all interazione fra proteine e radiazione elettromagnetica. Determinazione della concentrazione (quantificazione)
TECNICHE ANALITICHE DI RIVELAZIONE PER PROTEINE TECNICHE SPETTROSCOPICHE: Rivelazione in base all interazione fra proteine e radiazione elettromagnetica. Determinazione della concentrazione (quantificazione)
Never impure protein PURIFICAZIONE DI PROTEINE
 Never waste pure thoughts on an impure protein PURIFICAZIONE DI PROTEINE PURIFICARE Purificare significa ottenere solamente la nostra molecola di interesse. Purificare una proteina per: Determinarne la
Never waste pure thoughts on an impure protein PURIFICAZIONE DI PROTEINE PURIFICARE Purificare significa ottenere solamente la nostra molecola di interesse. Purificare una proteina per: Determinarne la
Acidi nucleici come materiale di studio. DNA endogeno DNA esogeno (transgeni) RNA strutturale mrna
 Acidi nucleici come materiale di studio DNA endogeno DNA esogeno (transgeni) RNA strutturale mrna Isolamento DNA da cellule eucariotiche Isolamento acidi nucleici 1. lisi cellulare 2. purificazione 2a.
Acidi nucleici come materiale di studio DNA endogeno DNA esogeno (transgeni) RNA strutturale mrna Isolamento DNA da cellule eucariotiche Isolamento acidi nucleici 1. lisi cellulare 2. purificazione 2a.
