TECNICHE ELETTROFORETICHE. - Purificazione di molecole: elettroforesi preparativa. - Controllo della purezza di una molecola in un campione
|
|
|
- Serena Bianchi
- 6 anni fa
- Visualizzazioni
Transcript
1 TECNICHE ELETTROFORETICHE Aree di applicazione: - Purificazione di molecole: elettroforesi preparativa - Controllo della purezza di una molecola in un campione - Determinazione quantitativa di una molecola - Determinazione del P.M. di una molecola - PROTEOMICA
2 Le tecniche elettroforetiche sono applicabili ad un ampia serie di sostanze: - Proteine - Acidi nucleici -Peptidi - Amminoacidi - Acidi e basi organiche -Farmaci -Pesticidi - Anioni e cationi inorganici N.B.: Nei campioni da sottoporre a elettroforesi non devono essere presenti sostanze insolubili o grassi in sospensione
3 Le tecniche elettroforetiche sono influenzate da una serie di fattori legati alla natura del campione e non: - carica del campione - forma del campione - dimensioni del campione - ph del mezzo (tampone) - forza ionica del mezzo - concentrazione del mezzo MOBILITA ELETTROFORETICA - tipo di supporto - elettroendosmosi
4 Principali gruppi chimici coinvolti nel fenomeno dell elettroendoosmosi: - gruppi carbossilici (carta,..) - gruppi solfato (agarosio, ) - gruppi silanolici (vetro,..) parete del capillare parete del capillare I gruppi silanolici del vetro possono assumere carica negativa attraendo così i cationi dell elettrolita. Si forma una sorta di doppio strato di cariche elettriche (regione di separazione di carica). Al momento in cui viene applicato un campo elettrico, i cationi dell elettrolita, presenti nella regione di separazione di carica, migrano verso il catodo trascinando con sé la soluzione elettrolita (flusso elettroendoosmotico).
5 LEGGE DI OHM La resistenza R dipende da: - supporto -tampone - temperatura V = I x R V = voltaggio (V, Volts) I = intensità (A, Ampere) R = resistenza (Ω, Ohms) Durante una corsa elettroforetica, il passaggio di corrente porta ad un aumento della temperatura W è la potenza generata nel mezzo di resistenza R dal passaggio della corrente I W = I 2 x R La maggior parte di questa potenza viene dissipata sotto forma di calore
6 EFFETTI DEL CALORE - Il calore aumenta la velocità di diffusione dei campioni e degli ioni del tampone - Il calore determina comparsa di correnti convettive che portano al mescolamento dei campioni - Il calore può danneggiare i campioni (denaturazione di proteine, perdita di attività di enzimi) - Il calore può far diminuire la viscosità del tampone con riduzione della resistenza Sono necessari alimentatori stabilizzati e sistemi di refrigerazione del gel durante la corsa
7 ELETTROFORESI E un metodo di separazione basato sulla diversa velocità di migrazione di molecole cariche sottoposte ad un campo elettrico. Il gradiente di potenziale (E) generato da una differenza di potenziale (V) applicata tra due elettrodi, posti ad una distanza d l uno dall altro, è espresso dalla relazione: V E = d La forza F applicata su una molecola con carica q in risposta al potenziale applicato risulta essere: F = E x q
8 La velocità v con cui la molecola si muove sarà data da: v = E x q f con f, coefficiente frizionale, che dipende da: - dimensioni della molecola - forma della molecola - viscosità del mezzo (tampone) usato - dimensione dei pori del supporto in cui migra la molecola Solitamente si preferisce parlare di mobilità elettroforetica (µ): µ= q f
9 ELETTROFORESI SU GEL DI POLIACRILAMMIDE (PAGE: polyacrylamide gel electrophoresis) Per l analisi di proteine si usano di solito concentrazioni che vanno dal: 8% per grosse proteine o anche frammenti cellulari (es. agglomerati di proteine di membrana) 20% per proteine più piccole (fino a 1600 Da) Spesso vengono utilizzati gel preparati con un gradiente di concentrazione di poliacrilammide (es. 9-16%). La reazione di polimerizzazione avviene secondo un meccanismo radicalico che richiede uno starter ed un catalizzatore. TEMED (tetrametilendiammina). S 2 O e - SO SO 2-4 radicale con un e- spaiato R + M RM (R ) + M RMM + M RMMM...
10 CH 2 CH C O NH 2 CH 2 CH CH 2 CH CH 2 CH CH 2 CH CH 2 CH CH 2 CH + C O TEMED C O C O NH NH 2 NH 2 CH 2 NH C O CH 2 CH S 2 O 8 2- CH 2 CH CH 2 C O NH C O C O C O NH NH 2 NH 2 CH 2 NH C O CH CH 2 CH CH 2 CH CH 2 CH CH 2 CH C O C O C O C O NH 2 NH 2 NH 2 NH CH 2 CH 2 NH NH C O C O CH 2 CH CH 2 CH CH 2 CH CH 2 CH CH 2 CH CH 2 CH CH 2 CH C O C O C O C O C O NH 2 La dimensione dei pori dipende da due parametri: T = (a + b) 100 V a: massa in grammi di acrilammide b: massa in grammi di metilenebisacrilamide V: il volume in ml NH 2 NH 2 % C = b T= concentrazione totale in % 100 a + b % C= reticolazione % NH 2 NH 2
11 - valutazione della purezza di un campione - determinazione della massa molecolare - seconda dimensione in 2-DE Detergente Anionico PROCEDURA GENERALE Il campione viene solubilizzato in tampone contenente SDS e mercaptoetanolo 100 C per 5 min La proteina è così denaturata e presenta carica negativa proporzionale alla sua massa (~ 1 SDS ogni 2 aa) Il campione viene applicato al gel Applicazione campo elettrico (Il campione migra nello stacking gel) Il campione migra nel separating gel, separandosi nelle sue componenti
12 I campioni sono sciolti in una soluzione contenente: Tampone Tris ph 6.8 SDS Glicerolo (per aumentare la densità) 2-mercaptoetanolo o DTT (per ridurre eventuali ponti disolfuro) Blu di bromofenolo (indicatore della corsa) Eventuali detergenti
13 Miscela standard di proteine con peso molecolare noto stacking gel separating gel Stacking gel tampone tris-glicina ph 6.8 : Gly bassa mobilità (PI 6.1) Separating gel tampone tris-glicina ph 8.8 : Gly alta mobilità
14
15 ELETTROFORESI BIDIMENSIONALE (2-DE) PRIMA DIMENSIONE (IEF) Le proteine si separano in funzione del loro punto isoelettrico SECONDA DIMENSIONE (SDS-PAGE) La seconda corsa elettroforetica separa le proteine (già separate e distribuite sulla strip in base al proprio PI) in funzione del loro PESO MOLECOLARE. 3 pi 10 kda
16 Isoelettrofocalizzazione (IEF) Sfrutta come parametro di separazione il diverso punto isoelettrico (pi) delle proteine La carica netta di una proteina dipende dal valore di ph del mezzo. Richiede l uso di gradienti di ph: -anfoline -immobiline
17 CH 2 N (CH 2 ) n N CH 2 (CH 2 ) n (CH2)n NR 2 COOH Dove R = H o n = 2 o 3 (CH 2 ) n COOH Diagramma della formazione di un gradiente di ph mediante anfoline in un campo elettrico.
18 Gel di poliacrilammide da copolimerizzazione di: - acrilammide derivatizzata con gruppi tamponanti acidi deboli in genere con due gruppi carbossilici (pk 1 e pk 2 ) basi deboli in genere ammino gruppi terziari (pk 1, pk 2, pk 3 e pk 4 ) - monomeri di acrilammide Poliacrilammide copolimerizzata con immobiline
19
20 PROBLEMI : Presenza di componenti insolubuli Proteine di membrana Proteine nucleari Proteine poco abbondanti Proteine basiche Necessità di applicare una quantità di campione elevata Quantificazione del campione La preparazione del campione è il vero passaggio critico della 2-DE
21 PREPARAZIONE DEL CAMPIONE E una fase fondamentale per la buona riuscita di un E-2D PREVEDE DI: - conoscere le caratteristiche del campione - evitare degradazioni nel campione - evitare precipitazioni nel campione - evitare contaminazioni del campione
22 REGOLE GENERALI - Usare soluzioni pure - Usare inibitori di proteasi - Usare nucleasi o ultracentrifugazione - Eliminare componenti lipidiche (es. precipitazione con TCA o acetone) - Non superare livelli massimi di concentrazione proteica
23 TIPOLOGIA DEL CAMPIONE TESSUTO animale vegetale COLTURE CELLULARI fase di lisi animali vegetali lieviti batteri fase di lisi FLUIDI BIOLOGICI sangue saliva urina ecc. ALTRO terreno alimenti (farine, latte, ecc.) ecc.
24 METODI DI LISI DEL CAMPIONE FISICI trattamento al calore congelamento e scongelamento lisi osmotica CHIMICI detergenti (anionici, cationici e neutri) solventi organici ENZIMATICI enzimi che rompono le pareti di batteri, lieviti e cell. vegetali MECCANICI ultrasuoni (sonicatori) dispersori meccanici (ultraturrax, frullatori) sferette di vetro (glass beads) mortaio (sabbia di quarzo, abrasivi) potter celle a pressione (pressa francese)
25 CARATTERISTICHE DEL TAMPONE DI LISI PER CAMPIONI DA SOTTOPORRE A 2D-E NECESSITA DI: SOLUBILIZZARE, DENATURARE, RIDURRE E RIMUOVERE LE COMPONENTI INSOLUBILI NON-PROTEICHE SOLUZIONE STANDARD PER 2-DE2 DENATURANTI: 8M Urea o 2M Thiourea & 7M Urea DETERGENTI: 4% CHAPS o 2% CHAPS & 2% Sulfobetaine 3-10 AGENTI RIDUCENTI: 100mM DTT o 2mM TBP (Tributyl phosphine) and/or 65mM DTT ANFOLITI (range di ph variabile): % (TAMPONE (DEBOLE FORZA IONICA): Tris HCl 10 mm)
26 AGENTI DENATURANTI (UREA E TIOUREA) - rompono legami a idrogeno e interazioni idrofobiche - non hanno effetto sulla carica intrinseca delle proteine - possono formare cianati carbamilazione dei gruppi amminici delle proteine (la carica netta delle proteine cambia) PRECAUZIONI - Evitare il riscaldamento delle soluzioni - Deionizzare le soluzioni - Usare reattivi purificati - Usare soluzioni fresche o conservate a -20 C
27 AGENTI RIDUCENTI (DTT, DTE, MERCAPTOETANOLO, TRIBUTILFOSFINA) - rompono i ponti disolfuro intra e intercatena - completano il processo di denaturazione delle proteine Il DTT è forse il più usato. DIFETTO: migra verso l anodo durante la IEF, lasciando scoperta la zona basica del gel.
28 AGENTI DETERGENTI (NEUTRI) (CHAPS, sulfobetaina, octilglucoside..) facilitano il processo di distruzione delle membrane solubilizzano i lipidi e le sostanze poco solubili in mezzo acquoso rompono le interazioni proteina / proteina PRECAUZIONI: Non superare concentrazioni limite: 4% CHAPS 2% sulfobetaina 60 mm octilglucoside
29 ANFOLITI Miscele complesse di acidi poliammino-policarbossilici sintetici. Esistono in vari intervalli di ph. La scelta dipende dal campione che si vuole analizzare. facilitano la solubilizzazione delle proteine funzionano come scavanger per i cianati facilitano la precipitazione degli acidi nucleici inibiscono le interazioni fra proteine del campione e le immobiline usate nel gel della prima dimensione
30 DOSAGGIO DELLE PROTEINE TOTALI DEL CAMPIONE Fase fondamentale per: buona riproducibilità buona visualizzazione dei risultati corretta analisi comparativa dei dati ottenuti da due esperimenti N.B. Le proteine dei campioni trattati per l E-2D sono difficili da quantificare a causa della presenza di discrete quantità di riducenti, detergenti, anfoliti e tiourea Metodi comunemente usati per il dosaggio delle proteine totali e loro interferenze: Bradford (Coomassie) detergenti, anfoliti BCA (ac. Bicinconinico) riducenti, anfoliti, tiourea Talvolta può essere necessario prevedere una precipitazione selettiva delle proteine!!
Elettroforesi = migrazione in campo elettrico
 Elettroforesi = migrazione in campo elettrico Molte molecole di interesse biologico possiedono gruppi ionizzabili. In opportune condizioni di ph presentano una carica elettrica + o e quindi sono in grado
Elettroforesi = migrazione in campo elettrico Molte molecole di interesse biologico possiedono gruppi ionizzabili. In opportune condizioni di ph presentano una carica elettrica + o e quindi sono in grado
Genomica e Proteomica
 Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
Genomica e Proteomica Genomica: sequenziamento del DNA presente in un organismo e analisi dei geni (bioinformatica) Proteomica: analisi delle proteine di un organismo: Quali proteine in un dato momento
3. ELETTROFORESI DI PROTEINE
 3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
3. ELETTROFORESI DI PROTEINE Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) ELETTROFORESI PRINCIPI GENERALI Migrazione di particelle
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
ELETTROFORESI DI PROTEINE ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni
Metodi di studio delle proteine :
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D determinazione del peso molecolare Spettrofotometro
FOCALIZZAZIONE ISOELETTRICA (IEF)
 FOCALIZZAZIONE ISOELETTRICA (IEF) ELETTROFORESI DI PROTEINE CRITERI DI SEPARAZIONE PAGE nativa densità di carica (pi), dimensioni, forma PAGE-SDS solo dimensioni IEF solo in base al punto isoelettrico
FOCALIZZAZIONE ISOELETTRICA (IEF) ELETTROFORESI DI PROTEINE CRITERI DI SEPARAZIONE PAGE nativa densità di carica (pi), dimensioni, forma PAGE-SDS solo dimensioni IEF solo in base al punto isoelettrico
ELETTROFORESI DI PROTEINE
 ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
ELETTROFORESI DI PROTEINE Molto più complessa della separazione elettroforetica di DNA. forma delle proteine fortissime variazioni cariche delle proteine La > parte dei campioni di PROTEINE è più piccola
5- Estrazione ed analisi di DNA
 5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
+ (ph < pi) 0/- (ph pi)
 Pianificare la separazione delle seguenti proteine utilizzando una colonna cromatografica contenente lo scambiatore di cationi CM-cellulosa. A quale valore di ph dobbiamo equilibrare la FS? Stabilire la
Pianificare la separazione delle seguenti proteine utilizzando una colonna cromatografica contenente lo scambiatore di cationi CM-cellulosa. A quale valore di ph dobbiamo equilibrare la FS? Stabilire la
Strategie per la purificazione delle proteine
 Strategie per la purificazione delle proteine In una cellula ci possono essere molte proteine (ad esempio, ci sono circa 4300 geni in E. coli) Una singola proteina può rappresentare una frazione tra lo
Strategie per la purificazione delle proteine In una cellula ci possono essere molte proteine (ad esempio, ci sono circa 4300 geni in E. coli) Una singola proteina può rappresentare una frazione tra lo
Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa
 WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
WESTERN BLOTTING Permette l identificazione di specifiche proteine antigeniche in una soluzione complessa Tecnica di trasferimento delle proteine da un gel ad una membrana associata ad utilizzo di anticorpi
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento
 TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
Modulo 3. Lavorare con le proteine
 Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Estrazione di proteine - Scelta della fonte biologica
 Estrazione di proteine - Scelta della fonte biologica Proteine endogene Batteri Cellule eucariotiche Proteine ricombinanti Lieviti Tessuti Localizzazione della proteina PURIFICAZIONE DELLE PROTEINE 1 proteina
Estrazione di proteine - Scelta della fonte biologica Proteine endogene Batteri Cellule eucariotiche Proteine ricombinanti Lieviti Tessuti Localizzazione della proteina PURIFICAZIONE DELLE PROTEINE 1 proteina
Estrazione ed elettroforesi degli acidi nucleici
 Estrazione ed elettroforesi degli acidi nucleici Flavia Frabetti Estrazione acidi nucleici (DNA orna) Verifica tramite elettroforesi su gel di agarosio Amplificazione tramite PCR (da DNA) o RT-PCR (da
Estrazione ed elettroforesi degli acidi nucleici Flavia Frabetti Estrazione acidi nucleici (DNA orna) Verifica tramite elettroforesi su gel di agarosio Amplificazione tramite PCR (da DNA) o RT-PCR (da
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
Seminario di Cacciatore Rosalia
 Un organismo vivente è un sistema chimico complesso nel quale la materia organica viene sintetizzata, riprodotta, trasformata e decomposta in un incessante ed intenso susseguirsi di reazioni e processi
Un organismo vivente è un sistema chimico complesso nel quale la materia organica viene sintetizzata, riprodotta, trasformata e decomposta in un incessante ed intenso susseguirsi di reazioni e processi
Elettroforesi: Separazione di molecole cariche mediante applicazione di un campo elettrico
 ELETTROFORESI 1 Elettroforesi: Separazione di molecole cariche mediante applicazione di un campo elettrico Cationi (+) Anioni (-) Polo negativo o CATODO Polo positivo o ANODO 1 Elettroforesi: Separazione
ELETTROFORESI 1 Elettroforesi: Separazione di molecole cariche mediante applicazione di un campo elettrico Cationi (+) Anioni (-) Polo negativo o CATODO Polo positivo o ANODO 1 Elettroforesi: Separazione
Elettroforesi. Separazione differenziata di molecole cariche (aminoacidi, peptidi, proteine, Acidi nucleici, ecc) sottoposte a un campo elelttrico
 Elettroforesi Separazione differenziata di molecole cariche (aminoacidi, peptidi, proteine, Acidi nucleici, ecc) sottoposte a un campo elelttrico Principio: Migrazione di particelle cariche sotto l azione
Elettroforesi Separazione differenziata di molecole cariche (aminoacidi, peptidi, proteine, Acidi nucleici, ecc) sottoposte a un campo elelttrico Principio: Migrazione di particelle cariche sotto l azione
cromatografia Elettroforesi
 Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Tecniche Elettroforetiche
 Tecniche Elettroforetiche Prof. Fabiana Passaro Telefono 081-7463627 Email fabiana.passaro@unina.it Sito Docente https://www.docenti.unina.it/fabiana.passaro Definizione L'elettroforesi è una tecnica che
Tecniche Elettroforetiche Prof. Fabiana Passaro Telefono 081-7463627 Email fabiana.passaro@unina.it Sito Docente https://www.docenti.unina.it/fabiana.passaro Definizione L'elettroforesi è una tecnica che
TECNICHE DI BIOLOGIA MOLECOLARE. Dott.ssa Francesca Santilli
 TECNICHE DI BIOLOGIA MOLECOLARE Dott.ssa Francesca Santilli Sin dai primi anni 60, i biologi molecolari hanno scoperto come caratterizzare, isolare e manipolare le componenti molecolari delle CELLULE e
TECNICHE DI BIOLOGIA MOLECOLARE Dott.ssa Francesca Santilli Sin dai primi anni 60, i biologi molecolari hanno scoperto come caratterizzare, isolare e manipolare le componenti molecolari delle CELLULE e
TECNICHE ELETTROFORETICHE
 TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
TECNICHE ELETTROFORETICHE L elettroforesi e un metodo di separazione che si basa sulla diversa mobilita degli ioni (o di sostanze elettricamente cariche), quando posti all interno di un campo elettrico
Apparato elettroforesi
 Elettroforesi Tecniche che permettono di separare diverse macromolecole cariche tramite l applicazione di un campo elettrico. Apparato elettroforesi Fonte: Internet Utilizzata in biochimica e biologia
Elettroforesi Tecniche che permettono di separare diverse macromolecole cariche tramite l applicazione di un campo elettrico. Apparato elettroforesi Fonte: Internet Utilizzata in biochimica e biologia
Passaggi preliminari di purificazione
 Passaggi preliminari di purificazione Estratto iniziale Omogenato contiene materiale insolubile che generalmente viene eliminato per centrifugazione. Talvolta la soluzione mostra torbidità (dovuta alla
Passaggi preliminari di purificazione Estratto iniziale Omogenato contiene materiale insolubile che generalmente viene eliminato per centrifugazione. Talvolta la soluzione mostra torbidità (dovuta alla
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Elettroforesi di Tamara Benincasa
 Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
Elettroforesi di Tamara Benincasa L elettroforesi è una metodologia utilizzata in laboratorio attraverso la quale molecole biologiche (ammino acidi, peptidi, proteine, nucleotidi ed acidi nucleici), dotate
CORSO DI LAUREA IN BIOLOGIA GENERALE ED APPLICATA ESERCITAZIONE DEL CORSO DI ANALISI DI MACROMOLECOLE
 CORSO DI LAUREA IN BIOLOGIA GENERALE ED APPLICATA ESERCITAZIONE DEL CORSO DI ANALISI DI MACROMOLECOLE Anno accademico 2016-2017 L esperimento consiste nella analisi di due estratti proteici frazionati
CORSO DI LAUREA IN BIOLOGIA GENERALE ED APPLICATA ESERCITAZIONE DEL CORSO DI ANALISI DI MACROMOLECOLE Anno accademico 2016-2017 L esperimento consiste nella analisi di due estratti proteici frazionati
PURIFICAZIONE DELLE PROTEINE
 PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
Tecniche elettroforetiche
 Tecniche elettroforetiche Biochimica e biotecnologie degli alimenti Lezione 4 Elettroforesi L elettroforesi è la migrazione di ioni in un campo elettrico. L elettroforesi di proteine utilizza di norma
Tecniche elettroforetiche Biochimica e biotecnologie degli alimenti Lezione 4 Elettroforesi L elettroforesi è la migrazione di ioni in un campo elettrico. L elettroforesi di proteine utilizza di norma
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria livelli superiori contesto fisiologico funzione Condizioni denaturanti
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
ESERCIZI 2. Spiegare il principio di.
 ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
Analisi di proteine:
 Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mm.dinardo@biologia.uniba.it Le proteine sono il prodotto dei geni: sono le proteine
Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mm.dinardo@biologia.uniba.it Le proteine sono il prodotto dei geni: sono le proteine
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008. Eloise Mastrangelo
 Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Biochimica delle proteine Prof. M. Bolognesi a.a. 2007/2008 Eloise Mastrangelo Perché è importante determinare la struttura primaria delle proteine? 1. La conoscenza della sequenza amminoacidica delle
Analisi di proteine:
 Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mariamaddalena.dinardo@uniba.it Le proteine sono il prodotto dei geni: sono le
Analisi di proteine: Elettroforesi e Western Blot Seminario Metodologico per il Corso di Didattica Libera Marilena Dinardo mariamaddalena.dinardo@uniba.it Le proteine sono il prodotto dei geni: sono le
Analisi e purificazione di proteine
 Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Analisi e purificazione di proteine elettroforesi ultracentrifugazione cromatografia frammenti specifici sequenziamento struttura primaria contesto fisiologico livelli superiori funzione Elettrofores i
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta)
 Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo
 Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Esempi di tecniche analitiche che sono dirette applicazioni di elettromagnetismo spettrometria di massa elettroforesi Spettrometria di massa Tecnica per indagine che si basa sulla ionizzazione di una molecola
Estrazione di DNA. Laboratorio di Biologia Applicata
 Estrazione di DNA Laboratorio di Biologia Applicata Tecniche di estrazione Qualità del campione di partenza Numero di campioni Costo Tempo Semplicità e affidabilità Automazione Sicurezza Materiale biologico
Estrazione di DNA Laboratorio di Biologia Applicata Tecniche di estrazione Qualità del campione di partenza Numero di campioni Costo Tempo Semplicità e affidabilità Automazione Sicurezza Materiale biologico
La chimica della pelle
 La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
La chimica della pelle 1 Gli amminoacidi Queste unità hanno la particolare caratteristica di contenere nella stessa molecola un gruppo acido (- COOH) ed uno basico (- NH 2 ), legati tra loro attraverso
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
Jay Phelan, Maria Cristina Pignocchino. Scopriamo la biologia
 Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Caratteristiche delle membrane biologiche
 Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
ESERCIZI 2. Spiegare il principio di.
 ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
CROMATOGRAFIA A SCAMBIO IONICO IEC
 CROMATOGRAFIA A SCAMBIO IONICO IEC * WCX SCX SAX WAX *La costante dielettrica, indicata con e, è una grandezza fisica che quantifica la propensione di una sostanza a contrastare il campo elettrico presente
CROMATOGRAFIA A SCAMBIO IONICO IEC * WCX SCX SAX WAX *La costante dielettrica, indicata con e, è una grandezza fisica che quantifica la propensione di una sostanza a contrastare il campo elettrico presente
Biocatalizzatori. Tecniche di immobilizzazione e applicazioni biotecnologiche di cellule ed enzimi
 Biocatalizzatori Tecniche di immobilizzazione e applicazioni biotecnologiche di cellule ed enzimi BIOCATALIZZATORI Catalizzatori biologici per ottenere un prodotto di interesse Cellule in coltura l organismo
Biocatalizzatori Tecniche di immobilizzazione e applicazioni biotecnologiche di cellule ed enzimi BIOCATALIZZATORI Catalizzatori biologici per ottenere un prodotto di interesse Cellule in coltura l organismo
Analisi delle Proteine
 Analisi delle Proteine Elementi che costituiscono le proteine: idrogeno, carbonio, azoto, ossigeno e zolfo; tra cui l azoto è l elemento più distintivo nei cibi, l azoto varia da 13,4% a 19,1%. L analisi
Analisi delle Proteine Elementi che costituiscono le proteine: idrogeno, carbonio, azoto, ossigeno e zolfo; tra cui l azoto è l elemento più distintivo nei cibi, l azoto varia da 13,4% a 19,1%. L analisi
Southern Blot: Per l analisi del DNA. (sonda = DNA o RNA). Northern Blot: Per l analisi dell RNA. (sonda = DNA o RNA).
 Southern Blot: Per l analisi del DNA. (sonda = DNA o RNA). Northern Blot: Per l analisi dell RNA. (sonda = DNA o RNA). Western Blot: Per l analisi delle proteine. (sonda = anticorpo). Una tecnica in cui
Southern Blot: Per l analisi del DNA. (sonda = DNA o RNA). Northern Blot: Per l analisi dell RNA. (sonda = DNA o RNA). Western Blot: Per l analisi delle proteine. (sonda = anticorpo). Una tecnica in cui
2. Tecniche immunochimiche: Western blotting; ELISA; sandwich ELISA 3. Tecniche spettroscopiche: spettrofotometria UV/vis; spettrofluorimetria
 1. Tecniche elettroforetiche: SDS-PAGE 2. Tecniche immunochimiche: Western blotting; ELISA; sandwich ELISA 3. Tecniche spettroscopiche: spettrofotometria UV/vis; spettrofluorimetria Testo consigliato Keith
1. Tecniche elettroforetiche: SDS-PAGE 2. Tecniche immunochimiche: Western blotting; ELISA; sandwich ELISA 3. Tecniche spettroscopiche: spettrofotometria UV/vis; spettrofluorimetria Testo consigliato Keith
COS E LA PROTEOMICA? The total PROTEIN complement of a GENOME Proteoma proteine codificate modificazioni post-traduzionali
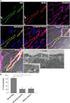 COS E LA PROTEOMICA? The total PROTEIN complement of a GENOME (M. Wilkins et al. Electrophoresis 1995,16 1090-95) La Proteomica è lo studio del PROTEOMA Ud'A [Biochimica Applicata 1] dia n. 1 Proteoma
COS E LA PROTEOMICA? The total PROTEIN complement of a GENOME (M. Wilkins et al. Electrophoresis 1995,16 1090-95) La Proteomica è lo studio del PROTEOMA Ud'A [Biochimica Applicata 1] dia n. 1 Proteoma
WESTERN BLOT o IMMUNOFISSAZIONE
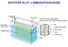 WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
WESTERN BLOT o IMMUNOFISSAZIONE BLOTTING Trasferimento di macromolecole su una membrana immobilizzante. Southern DNA - da Edward Southern 1970 Northern Western RNA Proteine SCOPO DEL WESTERN BLOTTING Consente
Biocatalizzatori. Tecniche di immobilizzazione e applicazioni biotecnologiche di cellule ed enzimi
 Biocatalizzatori Tecniche di immobilizzazione e applicazioni biotecnologiche di cellule ed enzimi BIOCATALIZZATORI Cellule in coltura l organismo viene cresciuto nel terreno A le cellule vengono raccolte
Biocatalizzatori Tecniche di immobilizzazione e applicazioni biotecnologiche di cellule ed enzimi BIOCATALIZZATORI Cellule in coltura l organismo viene cresciuto nel terreno A le cellule vengono raccolte
MATERIALE DIDATTICO. A supporto sono rese disponibili le slides delle lezioni
 MATERIALE DIDATTICO 1.Metodologie Biochimiche. Bonaccorsi, Contestabile, Di Salvo. Casa Editrice Ambrosiana. Ed.2012 2.Biochimica Applicata. Stoppini, Bellotti. EdiSES, 2012 3. Sono utilizzabili alcuni
MATERIALE DIDATTICO 1.Metodologie Biochimiche. Bonaccorsi, Contestabile, Di Salvo. Casa Editrice Ambrosiana. Ed.2012 2.Biochimica Applicata. Stoppini, Bellotti. EdiSES, 2012 3. Sono utilizzabili alcuni
METODICHE DI IMMUNOCHIMICA
 METODICHE DI IMMUNOCHIMICA IMMUNOCHIMICA permette la determinazione quantitativa di proteine in tessuti e omogenati INTERAZIONI ANTIGENE-ANTICORPO L immunochimica si basa sulle interazioni antigene-anticorpo
METODICHE DI IMMUNOCHIMICA IMMUNOCHIMICA permette la determinazione quantitativa di proteine in tessuti e omogenati INTERAZIONI ANTIGENE-ANTICORPO L immunochimica si basa sulle interazioni antigene-anticorpo
V R V t. Proteine ad alto peso molecolare. Proteine a peso molecolare intermedio. Proteine a basso peso molecolare. Kd + piccolo.
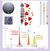 V 0 Proteine ad alto peso molecolare Proteine a peso molecolare intermedio V R V t Proteine a basso peso molecolare Kd elevato Kd piccolo Esclusione molecolare o gelfiltrazione = Volume totale V T = V
V 0 Proteine ad alto peso molecolare Proteine a peso molecolare intermedio V R V t Proteine a basso peso molecolare Kd elevato Kd piccolo Esclusione molecolare o gelfiltrazione = Volume totale V T = V
determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D
 Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
Metodi di studio delle proteine : determinazione della quantità determinazione della struttura primaria (sequenza a.a.) determinazione della struttura 3D Spettrofotometro cuvetta monocromatore rivelatore
1. Quantificazione del genomico e determinazione della purezza
 ESERCITAZIONE 2 1. Quantificazione del genomico e determinazione della purezza Una volta estratto il DNA si procede con la quantificazione. Tale quantificazione viene fatta normalmente con l utilizzo di
ESERCITAZIONE 2 1. Quantificazione del genomico e determinazione della purezza Una volta estratto il DNA si procede con la quantificazione. Tale quantificazione viene fatta normalmente con l utilizzo di
Elettroforesi Bidimensionale (2D)
 Elettroforesi Bidimensionale (2D) ine espresse dal gen Termine coniato per la prima volta al Siena 2D Electrophoresis meeting del 2004 Exon 1 Exon 2 Exon 3 Exon 1 Exon 2 Exon 3 Exon 1 Exon 2 Exon 3 Traduzione
Elettroforesi Bidimensionale (2D) ine espresse dal gen Termine coniato per la prima volta al Siena 2D Electrophoresis meeting del 2004 Exon 1 Exon 2 Exon 3 Exon 1 Exon 2 Exon 3 Exon 1 Exon 2 Exon 3 Traduzione
LUMINESCENZA. semiconduttore
 LUMINESCENZA LUMINESCENZA Elettroluminescenza Radioluminescenza Chemiluminescenza Bioluminescenza Termoluminescenza Triboluminescenza Sonoluminescenza Fotoluminescenza corrente elettrica in gas ionizzato
LUMINESCENZA LUMINESCENZA Elettroluminescenza Radioluminescenza Chemiluminescenza Bioluminescenza Termoluminescenza Triboluminescenza Sonoluminescenza Fotoluminescenza corrente elettrica in gas ionizzato
Elettroforesi proteine ed acidi nucleici
 Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
Elettroforesi proteine ed acidi nucleici Flavia Frabetti Tecnici di laboratorio 2010/2011 ELETTORFORESI metodo fisico di separazione che sfrutta la mobilità elettroforetica di molecole cariche, sottoposte
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007. Corso di: Laboratorio di Biologia II Chimica Biologica
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Anno Accademico 2006/2007 Corso di: Laboratorio di Biologia II Chimica Biologica Dott. Marcello MEROLA Parziale purificazione dell enzima Alcool Deidrogenasi
Cosa determina l assorbanza di un cromoforo?
 Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
ELETTROFORESI. Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico.
 ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
Le biomolecole si trovano negli organismi viventi
 Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea
 la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea Analisi delle sue proprietà fisiche e biologiche Come viene modulata la sua espressione
la purificazione può essere di tipo analitico o preparativo Purificare una proteina significa ottenerla in forma omogenea Analisi delle sue proprietà fisiche e biologiche Come viene modulata la sua espressione
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Corso di Tecniche biomolecolari applicate Modulo Analisi di Macromolecole
 CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Corso di Tecniche biomolecolari applicate Modulo Analisi di Macromolecole 1. Elettroforesi su gel di poliacrilammide (PAGE nativa) L esperimento consiste
CORSO DI LAUREA IN BIOLOGIA GENERALE E APPLICATA Corso di Tecniche biomolecolari applicate Modulo Analisi di Macromolecole 1. Elettroforesi su gel di poliacrilammide (PAGE nativa) L esperimento consiste
Composizione della sostanza azotata del latte vaccino (% rel)
 Composizione della sostanza azotata del latte vaccino (% rel) s1 29-35 Caseine s2 8-10 35-40 78 10-15 Materia Azotata Proteica ( ) lattoglobulina 4-8 8-9 94-95 Materia Azotata Totale (N*6,38) Proteine
Composizione della sostanza azotata del latte vaccino (% rel) s1 29-35 Caseine s2 8-10 35-40 78 10-15 Materia Azotata Proteica ( ) lattoglobulina 4-8 8-9 94-95 Materia Azotata Totale (N*6,38) Proteine
L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche.
 L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche. L elettroforesi è una tecnica che viene usata per separare molecole
L elettroforesi è una tecnica che consiste nella migrazione differenziata in un campo elettrico, di molecole elettricamente cariche. L elettroforesi è una tecnica che viene usata per separare molecole
DEMINERALIZZAZIONE PER SCAMBIO IONICO
 DEMINERALIZZAZIONE PER SCAMBIO IONICO PER DEMINERALIZZAZIONE DELL ACQUA SI INTENDE L ELIMINAZIONE DEGLI ELETTROLITI IN ESSA DISCIOLTI. QUESTO PROCESSO SI PUO REALIZZARE CHIMICAMENTE PER SCAMBIO IONICO
DEMINERALIZZAZIONE PER SCAMBIO IONICO PER DEMINERALIZZAZIONE DELL ACQUA SI INTENDE L ELIMINAZIONE DEGLI ELETTROLITI IN ESSA DISCIOLTI. QUESTO PROCESSO SI PUO REALIZZARE CHIMICAMENTE PER SCAMBIO IONICO
LE PROTEINE. SONO Polimeri formati dall unione di AMMINOACIDI (AA) Rende diversi i 20 AA l uno dall altro UN ATOMO DI C AL CENTRO
 LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
LE PROTEINE SONO Polimeri formati dall unione di ATOMI DI C, H, N, O CHE SONO AMMINOACIDI (AA) Uniti tra loro dal Legame peptidico 20 TIPI DIVERSI MA HANNO STESSA STRUTTURA GENERALE CON Catene peptidiche
Ele$roforesi. verso il catodo se hanno carica posi.va. Le par.celle si spostano. verso l'anodo se hanno carica nega.va
 Ele$roforesi L ele#roforesi è una tecnica anali.ca e separa.va basata sul movimento di par.celle cariche ele$ricamente quando immerse in un fluido per effe$o di un campo ele$rico applicato mediante una
Ele$roforesi L ele#roforesi è una tecnica anali.ca e separa.va basata sul movimento di par.celle cariche ele$ricamente quando immerse in un fluido per effe$o di un campo ele$rico applicato mediante una
I PROTIDI ASPETTI GENERALI
 I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
I PROTIDI ASPETTI GENERALI I PROTIDI O PROTEINE SONO SOSTANZE ORGANICHE AZOTATE, DI STRUTTURA MOLTO COMPLESSA, PRESENTI IN OGNI FORMA DI VITA. LE PROTEINE SONO COMPOSTI QUATERNARI, OSSIA SONO FORMATE DA
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI
 METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
Elettroforesi - ++ In assenza di moti diffusivi/convettivi gli analiti neutri non possono spostarsi nel mezzo.
 Elettroforesi Con il termine elettroforesi si indica una famiglia di tecniche in cui la separazione di analiti viene effettuata sfruttandone la diversa migrazione sotto l azione di un campo elettrico:
Elettroforesi Con il termine elettroforesi si indica una famiglia di tecniche in cui la separazione di analiti viene effettuata sfruttandone la diversa migrazione sotto l azione di un campo elettrico:
0,8% riesce a separare un range di dimensioni da circa 500 bp a circa bp.
 L elettroforesi è una tecnica che utilizza un campo elettrico per separare e visualizzare frammenti di DNA in base al loro peso molecolare ed alla loro carica. Gli acidi nucleici, migrano sempre verso
L elettroforesi è una tecnica che utilizza un campo elettrico per separare e visualizzare frammenti di DNA in base al loro peso molecolare ed alla loro carica. Gli acidi nucleici, migrano sempre verso
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 13 Cromatografia ed elettroforesi Concetti chiave: Il comportamento cromatografico di una proteina è influenzato da alcune
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
Perche usare Gel di Poliacrilammide per separare le proteine?
 Perche usare Gel di Poliacrilammide per separare le proteine? I gel di poliacrilammide hanno una trama piu compatta I pori hanno dimensioni minori che nei gel di agarosio Le proteine sono molto piu piccole
Perche usare Gel di Poliacrilammide per separare le proteine? I gel di poliacrilammide hanno una trama piu compatta I pori hanno dimensioni minori che nei gel di agarosio Le proteine sono molto piu piccole
Amminoacidi. Struttura base di un a-amminoacido
 Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Amminoacidi Struttura base di un a-amminoacido Forma non ionizzata Forma ionizzata, sale interno (zwitterione) Il carbonio α di tutti gli α-amminoacidi (tranne la glicina) è asimmetrico (=chirale) D-alanina
Tra nm Nucleotidi mono-fosfato
 Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Biochimica delle proteine Prof. M. Bolognesi a.a. 2006/2007. Eloise Mastrangelo
 Biochimica delle proteine Prof. M. Bolognesi a.a. 2006/2007 Eloise Mastrangelo Elettroforesi monodimensionale SDS-PAGE: Sodio DodecilSolfato-PoliAcrilammide Gel Elettroforesi L`elettroforesi su gel di
Biochimica delle proteine Prof. M. Bolognesi a.a. 2006/2007 Eloise Mastrangelo Elettroforesi monodimensionale SDS-PAGE: Sodio DodecilSolfato-PoliAcrilammide Gel Elettroforesi L`elettroforesi su gel di
PROPRIETA ACIDO-BASE DELLE SOLUZIONI SALINE
 PROPRIETA ACIDO-BASE DELLE SOLUZIONI SALINE Un sale è un solido ionico contenente un catione diverso da H + e un anione diverso da OH -. I sali sono degli elettroliti forti, cioè in acqua si dissociano
PROPRIETA ACIDO-BASE DELLE SOLUZIONI SALINE Un sale è un solido ionico contenente un catione diverso da H + e un anione diverso da OH -. I sali sono degli elettroliti forti, cioè in acqua si dissociano
Si definisce soluzione un sistema omogeneo (costituito da una sola fase) con più di un componente
 Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
Lezione 14 1.Soluzioni 2.Concentrazione 3.Proprietà colligative 1.Legge di Raoult 2.Abbassamento crioscopico 3.Innalzamento ebullioscopico 4.Pressione osmotica Le Soluzioni Si definisce soluzione un sistema
A = εlc c = A/εl c = 0.2/38000 M -1 cm -1 1 cm c = M = 5 μm
 COME PROCEDO? Ho una soluzione di una proteina purificata Preparo un bianco con lo stesso tampone utilizzato per dissolvere la proteina Effettuo l azzeramento dello spettrofotometro con il bianco e poi
COME PROCEDO? Ho una soluzione di una proteina purificata Preparo un bianco con lo stesso tampone utilizzato per dissolvere la proteina Effettuo l azzeramento dello spettrofotometro con il bianco e poi
Elettroforesi - ++ In assenza di moti diffusivi/convettivi gli analiti neutri non possono spostarsi nel mezzo.
 Elettroforesi Con il termine elettroforesi si indica una famiglia di tecniche in cui la separazione di analiti viene effettuata sfruttandone la diversa migrazione sotto l azione di un campo elettrico:
Elettroforesi Con il termine elettroforesi si indica una famiglia di tecniche in cui la separazione di analiti viene effettuata sfruttandone la diversa migrazione sotto l azione di un campo elettrico:
a) un movimento contro gradiente di concentrazione che utilizza fonti primarie di energia
 1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
1. Quale considerazione sulla struttura primaria di una proteina è vera? a) è caratteristica delle proteine insolubili b) i ponti S-S la stabilizzano c) i ponti H la stabilizzano d) la proteina assume
Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea.
 Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
Le Miscele Una miscela ha composizione variabile. Se le proprietà di una miscela nonsono uniformi (fasi diverse), la miscela è eterogenea. Se le proprietà sono uniformi, la miscela è una miscela omogenea
METODI DI SEPARAZIONE IN PROTEOMICA
 METODI DI SEPARAZIONE IN PROTEOMICA ELETTROFORESI DI PROTEINE INTATTE MONODIMENSIONALE BIDIMENSIONALE CROMATOGRAFIA MONODIMENSIONALE DI PROTEINE INTATTE GEL FILTRAZIONE AFFINITA CROMATOGRAFIA MONO o BIDIMENSIONALE
METODI DI SEPARAZIONE IN PROTEOMICA ELETTROFORESI DI PROTEINE INTATTE MONODIMENSIONALE BIDIMENSIONALE CROMATOGRAFIA MONODIMENSIONALE DI PROTEINE INTATTE GEL FILTRAZIONE AFFINITA CROMATOGRAFIA MONO o BIDIMENSIONALE
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
ELETTROFORESI. Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico.
 ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
ELETTROFORESI ELETTROFORESI Tecnica analitica che consente di separare molecole cariche grazie all applicazione di un campo elettrico. Anioni ANODO (+) Cationi CATODO (-) v = velocità di migrazione μ =
Dott. ssa Nadia D Ambrosi ----METODI BIOCHIMICI---- Ricevimento: Martedì (Dipartimento di Biologia, dente L)
 Dott. ssa Nadia D Ambrosi ----METODI BIOCHIMICI---- nadia.dambrosi@uniroma2.it Ricevimento: Martedì 14-16 (Dipartimento di Biologia, dente L) Organizzazione del corso: Lunedì h9-11 fino al 28/5 - didattica
Dott. ssa Nadia D Ambrosi ----METODI BIOCHIMICI---- nadia.dambrosi@uniroma2.it Ricevimento: Martedì 14-16 (Dipartimento di Biologia, dente L) Organizzazione del corso: Lunedì h9-11 fino al 28/5 - didattica
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
WESTERN BLOTTING Tecnica che permette di valutare quanto è espressa una proteina e dove è localizzata. SDS-PAGE trasferimento saturazione
 WESTERN BLOTTING Tecnica che permette di valutare quanto è espressa una proteina e dove è localizzata. La procedura di Western Blotting consiste nei seguenti passaggi: - SDS-PAGE - trasferimento (blotting)
WESTERN BLOTTING Tecnica che permette di valutare quanto è espressa una proteina e dove è localizzata. La procedura di Western Blotting consiste nei seguenti passaggi: - SDS-PAGE - trasferimento (blotting)
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
