LICEO SCIENTIFICO STATALE Filippo Lussana Bergamo
|
|
|
- Domenica Franceschini
- 8 anni fa
- Visualizzazioni
Transcript
1 LICEO SCIENTIFICO STATALE Filippo Lussana Bergamo PROGRAMMA DI SCIENZE EFFETTIVAMENTE SVOLTO a.s Classe 1F Base Testi in adozione : Scienze della Terra "OSSERVARE E CAPIRE LA TERRA " Autori : Palmieri e Parotto Ed. ZANICHELLI; Chimica "LE SOLUZIONI DELLA CHIMICA" primo biennio Autore: Celestino Ed. LINX SCIENZE DELLA TERRA Sistema Terra (da appunti) Cosa studiano le Scienze della Terra, il sistema Terra, feedback negativi e positivi. I problemi ambientali. Le risorse naturali ed energetiche Il pianeta Terra (capitolo 14 e da appunti) La nascita della geologia moderna (Hutton, Lyell, attualismo, catastrofismo) Forma e dimensioni della Terra. Interno della Terra: la Terra come pianeta stratificato. Il moto convettivo del mantello. La Terra e i suoi moti (da appunti) prove e conseguenze del moto di rotazione della Terra (alternanza del dì e della notte, schiacciamento polare, diversa velocità di fuga al variare della latitudine, prove di Guglielmini e di Foucault). Il reticolato geografico, meridiani e paralleli, le coordinate geografiche. Il moto di rivoluzione della Terra (orbita, eclittica, percorso apparente del Sole durante l'anno, punto vernale, punto della Bilancia); Leggi di Keplero, equinozi e solstizi, perielio e afelio, linea degli apsidi, le stagioni e durata delle stagioni. La legge di Newton. Le zone astronomiche. Idrosfera (Capitoli 9 e 10) I serbatoi dell'acqua e il ciclo dell'acqua. Le acque sotterranee. La risalita di acqua dal sottosuolo. Le acque sotterranee. Le falde acquifere. I fiumi e il paesaggio fluviale. I laghi e la classificazione dei laghi. I ghiacciai, i principali tipi di ghiacciaio e la struttura dei ghiacciai. Le acque oceaniche, oceani e mari, caratteristiche delle acque oceaniche. Il moto ondoso, le maree, le correnti. Il modellamento del rilievo (Capitolo 15 e da appunti) Agenti esogeni e agenti endogeni, alterazione chimica e degradazione fisica. Il carsismo e paesaggio carsico. La formazione del suolo. La risorsa suolo. Esempi di suolo (laterite, terre rosse, podzol). Le frane ed esempi di frane (video frana del Vajont).
2 CHIMICA (Capitoli: 1, 2, 3 e parte del 4 e da appunti) Gli stati fisici della materia: aeriforme ( differenza tra gas e vapore), liquido, solido.sistemi omogenei ed eterogenei, sostanze pure e miscugli, i miscugli omogenei ( soluzioni: soluto e solvente ) colloidi; metodi di separazione di miscugli omogenei ed eterogenei. Stati di aggregazione e passaggi di stato. Calore latente di fusione ed ebollizione. Curve di riscaldamento e di raffreddamento. Passaggi di stato. Dalle miscele alle sostanze pure. Differenza tra trasformazioni fisiche e trasformazioni chimiche, elementi e composti, tavola periodica degli elementi La legge di Lavoisier, la legge di Proust, la legge di Dalton, modello atomico di Dalton. Scrittura delle formule chimiche, delle reazioni chimiche, bilanciamento, indici e coefficienti. ATTIVITÀ DI LABORATORIO Norme di comportamento in laboratorio e criteri per la stesura di una relazione sulla attività di laboratorio; Tecniche di separazione dei miscugli: distillazione, cromatografia, filtrazione, centrifugazione Curva di riscaldamento: temperatura di ebollizione di acqua, Verifica sperimentale legge di Lavoisier Verifica sperimentale legge di Proust Ciclo dell'acqua Altre attività Approfondimenti con lavoro di gruppo (esecuzione di esercizi di chimica) Visione di filmati su: frana del Vajont, l'interno della Terra, leggi di Keplero, pendolo di Foucault, maree. Lavoro estivo 1) Rivedere ed eventualmente sistemare le relazioni delle attività di laboratorio. 2) Svolgere gli esercizi. 3) Leggere i capitoli indicati e rispondere per iscritto alla domande relative al libro: OLIVER SACHS-ZIO TUNGSTENO-ADELPHI Zio Tungsteno è l'autobiografia di Oliver Sacks, pubblicata per la prima volta nel L autore decide di scrivere questo libro per ripercorrere tutti i ricordi più belli della sua vita ed in particolare volge al passato uno sguardo misto di nostalgia e amore per la sua infanzia da chimico. Oliver Sacks fin dai primi capitoli focalizza l attenzione del lettore sulla sua passione per tutto ciò che aveva a che fare con la chimica. In particolare da bambino era affascinato ed estasiato dalla lucentezza, dal colore e dalle strane proprietà dei metalli, tanto da obbligare i genitori a rispondere a tutte le sue domande. Il momento di svolta avviene quando il piccolo Oliver, per avere informazioni più esaurienti riguardo alle sue curiosità, inizia a frequentare assiduamente lo zio Dave, riconosciuto dal bambino come Zio Tungsteno; egli possedeva una fabbrica di lampadine e il metallo più utilizzato e nel contempo anche il più interessante per Oliver era, appunto, il Tungsteno. Tutta la sua vita era totalmente centrata su questa grande passione; il racconto è scandito da descrizioni di metalli rari e meravigliosamente misteriosi e da descrizioni della famiglia del giovane alla quale era fortemente unito. Capitolo 1 1- Che colore ha il tungsteno in polvere? 2- Come si lavora la polvere di tungsteno per ottenere i filamenti delle lampadine? 3- Come si comporta il piombo immerso nel mercurio? E il tungsteno?
3 Capitolo 2 e 3 : riferimenti biografici dell' autore da leggere per capire il suo interesse per la chimica. Capitolo Quali sono i metalli che si rinvengono allo stato puro (o nativo)? 2 - Il platino è stato utilizzato in tempi lontani sia in America sia in Europa? 3 - Cosa succede all'alluminio ricoperto di mercurio? 4 - Quali sono i minerali contenenti tungsteno? Cosa significa il loro nome? 5 - Cosa è il metodo alluminotermico? A cosa serve? 6 - Cosa è la kimberlite? Quale elemento chimico contiene? Capitolo Prima dell'uso delle lampadine, come si illuminavano le abitazioni e le strade? 2 - Auer ed Edison quali metalli provarono per le loro lampadine? Spiega perché alcuni metalli furono scartati e perché altri furono utilizzati. 3 - Le lampadine dello zio Dave che caratteristiche avevano? Capitolo Spiega i due semplici esperimenti che l'autore indica chiamandoli "chimica da cucina" 2 - Spiega come si possono preparare cristalli? 3 - Gli acidi e gli alcali combinati, cosa formano? E' possibile il processo inverso? 4 - Cosa succede mettendo un pezzo di sodio nel cloro? che colore ha il cloro? Capitolo Indica alcune delle scoperte di Boyle in campo chimico e biologico. Quale era il merito delle sue descrizioni 2 - Indica alcuni degli esperimenti di Lavoisier e di quelli che hanno messo in discussione l'esistenza del flogisto. 3 - Ripetendo e modificando gli esperimenti di Priestley, Lavoisier scoprì un gas: Quale? 4 -Lavoisier introdusse nella chimica i simboli degli elementi? le equazioni chimiche una nuova terminologia? 5 - Descrivi due esperimenti che l'autore ha svolto per ottenere gas. 6 - Indica la frase che un matematico disse in seguito alla morte (avvenuta come?) di Lavoisier. Capitolo Alcuni contemporanei di Dalton non capirono l'importanza del suo lavoro e pensarono che la teoria atomica fosse una assurdità. Indica almeno due chimici e le parole che hanno usato nei confronti dell'opera di Dalton. 2 - Spiega il contributo di Avogadro e di Cannizzaro alla teoria atomica. Capitolo Cosa sono i gruppi secondo Mendeleev? 2 - In che anno Mendeleev pubblicò la tavola periodica? Quando / dove ha riflettuto sugli elementi prima di trovare un ordine/un modo logico per raggrupparli? Quale è il criterio con cui ha ordinato gli elementi? 3 - La sua tavola era completa o presentava spazi vuoti? perché? 4 - Rispetto alla tavola moderna (quella che trovate nei libri attualmente), mancavano delle famiglie /gruppi? Quali? 5 - Cosa sono le Terre rare? Mendeleev le conosceva? sono numerose? Indica alcuni loro nomi. 6 - Perché gli scienziati ipotizzarono che gli elementi della seconda serie di Terre rare (detti... ) fossero14? Capitolo Perché i coniugi Curie ipotizzarono che esistesse un elemento, allora sconosciuto, che fosse molto più radioattivo dell'uranio? come fecero ad isolarlo? Quale/i minerale/i, in quali quantità e quale procedimento utilizzarono per estrarlo? 2 - I coniugi Curie conoscevano la pericolosità dell'elemento? Veniva utilizzato anche fuori dai laboratori? Per quali usi? 3 - Cosa si osservava, al buio, attorno ai recipienti contenenti l'elemento?
4 4 - Da dove proveniva, secondo Marie Curie, l'energia emessa dall'elemento? Ha sostenuto la sua ipotesi o le ha abbandonate? Secondo te, perché? ESERCITAZIONI ESTIVE PER TUTTI 1 - Converti 18,9 g / cm3 in : a ) Kg /m3 b ) in g / ml c ) in g / L d ) in g / m3 2 Calcola il volume in litri di 3,00 Km2 di aria. 3 Due pezzi metallici hanno a - una massa di 1,5 Kg ed un volume di 77,6 cm3 b una massa di 500 g e un volume di 25,9 cm3. Di quale materiale sono composti? (puoi utilizzare la tabella della densità del tuo libro) 4 Quanto calore bisogna fornire (in cal) per far passare la temperature di 10 g di acqua da 5 C a 20 C? a - 2,5 X 10 2 b 1,5 X 102 c 2,0 X 102 d 5,0 X 10 e 4, 7 x Calcola il valore dell esercizio precedente con l unità SI. 6 Disegna ed indica la funzione del becher, della beuta e della centrifuga. 7-- Sono grandezze derivate nel S.I. : A ) volume, superficie C ) velocità, lunghezza B ) lunghezza, quantità di materia D ) tempo, massa 8 La massa di 2 Kg di piombo, rispetto alla massa di 2 Kg di acqua è : A) maggiore B ) minore C ) uguale D) più voluminosa E ) meno voluminosa F) non si può rispondere perché.. (se scegli questa alternativa completa la risposta) 9 Sul piatto di sinistra di una bilancia, sotto una campana di vetro chiusa ermeticamente, si mettono: un topolino, del formaggio da mangiare, dell acqua da bere ed una piccola bombola di ossigeno per respirare. Sul piatto di destra, si mettono dei pesi in modo da equilibrare la bilancia all inizio dell esperimento. Cosa succede con il passare dei giorni ai piatti della bilancia? 10 - Un miscuglio è formato da tre componenti X,Y, Z. Uno studente effettua una centrifugazione per recuperare X e, in seguito, ricorre ad una distillazione frazionata per separare Y e Z. In base a queste informazione, quale affermazione è SBAGLIATA? A ) sicuramente Y e Z sono liquidi B ) il miscuglio iniziale è eterogeneo C ) sicuramente X è un materiale liquido D ) il miscuglio tra Y e Z è omogeneo E ) mescolando X soltanto con Z si dovrebbe formare un miscuglio eterogeneo 11 - Converti 27,3 g / cm3 in : a ) Kg / m3 b ) in g / ml c ) in g / L 12 Calcola il volume in litri di 4,00 Km3 di aria. 13 Indica quali tra le sostanze sotto elencate sono sostanza pure (P), elementi ( E ), miscugli ( M ), composti ( C ).
5 - acqua di mare... - radon. - protossido di azoto. - idrogeno.. - emoglobina - sabbia aurifera. - vino rosso - aria pura ( non inquinata ) LE SOLUZIONI 1. Si pesano 25 g di un sale e sono sciolti in 125 g di acqua, calcola la concentrazione m/m%. (R. 16%) 2. Una soluzione di 450 cc ha una concentrazione del 10% V/V, calcola la quantità di soluto. (R. 45 cm3) 3. In un cilindro graduato ci sono 10,8 g di H2SO4 vengono diluiti fino a 45 ml, calcola la concentrazione m/m % sapendo che un densimetro immerso indica un valore di 1,140g/cm 3. (R. 21% m/m) 4. La densità di una soluzione di HCl vale 1,160 g/ml, sapendo che la sua concentrazione è di 27,00% m/m, calcola quanti grammi di soluto sono contenuti in 250 ml di soluzione. 5. Sapendo che la densità dell etanolo è 0,789 g/cm 3, calcola quanto alcool è contenuto in 33 cl (una lattina) delle rispettive bevande: a) birra bionda a 6,5 (V/V %) b) birra scura a 9 (V/V %) 6. Spendo che la dose massima giornaliera consigliata di alcol assunto è 45 g, calcola quanto volume delle seguenti bevande, si può assumere al giorno. a) vino bianco 12,0 (V/V %) b) vino Rosso 13,5 (V/V %) c) vino liquoroso 18 (V/V %) d) distillato 40 (V/V %) 7. Calcola quanto acido acetico è contenuto in 500 ml di aceto a 5,5 (m/v %) (R. 27,50 g) 8. La concentrazione di CO2 nell aria è di circa 360 ppm, sapendo che la densità media dell aria è 1,225 kg/m3, calcola quanti metri cubi d aria contengono un chilogrammo di diossido di carbonio. (non abbiamo fatto calcoli con ppm, ma non è difficile se si pensa che corrisponde a 1 mg/kg oppure a 1 mg/l. R m3) 9. La salinità di un bacino è di 34,5 g/l, calcola quanti litri di acqua si devono far evaporare per ottenere 2,00 kg di sale (R. 58,00 L) 10. Si pesano 3,40 g di KCl, e si diluiscono fino a 80,0 ml, calcola la concentrazione in g/l. 11. Una soluzione ha una concentrazione di 120 g/l, quale volume se ne deve prelevare perché contenga 15,0 g di soluto? (R g) 12. Per ottenere 24,0 ml di una soluzione idroalcolica al 50 % in volume, basta miscelare 12,0 ml di alcol puro con 12,0 ml di acqua distillata? Motiva la risposta. RAPPORTI PONDERALI 13. L ossido di calcio (calce viva) si ottiene dalla calcinazione del relativo carbonato (calcare), sapendo che da 100,09 g di sale si hanno 56,079 g di ossido, calcola quanto calcare si deve utilizzare per ottenere 250 kg di calce viva. (446,20 kg) 14. L esercizio precedente si spiega con la seguente reazione: CaCO3 CaO + CO2 Calcola quanto diossido di carbonio CO2 si ottiene calcinando quella stessa massa di calcare CaCO3. (R. 196,15 g) 15. La silvite è un minerale di formula KCl, sapendo che 39,102 g di potassio si combinano con 35,453 g di cloro, calcola: a) il rapporto di combinazione K/Cl (R. 1,102) b) La composizione % di K nel sale. (R. 52,42 % di Cl; 47,58 % di K)
6 c) Quanto minerale puro è necessario per estrarre 10 kg di K 16. In 34,015 g d acqua ossigenata H2O2 ci sono 2,0160 g di idrogeno. Calcola a) il rapporto di combinazione H/O (R. 0,063) b) il rapporto di composizione % di O nell acqua ossigenata c) quanti grammi di composto si possono ottenere con 10,00 g di idrogeno (168,73 g) 17. Nel cloruro di magnesio, il rapporto Mg/Cl è 0,347; calcola: a) quanto cloro si combina con 5 g di magnesio (R. 14,41 g) b) quanto magnesio si combina con 5 g di cloro (R. 1,736 g) c) quanto magnesio è contenuto in 100 g di sale (R. 25,50 g) d) quanto cloro è contenuto in 25 g di sale 18. L ematite Fe2O3 è il principale minerale di ferro, con un tenore teorico è del 69,94 %. Calcola: a) il rapporto di composizione Fe/O (R. 2,33) b) quanto ferro si ottiene da 150 kg di minerale (R. 104,91 g) c) quanto minerale contiene 1 kg di ferro (R. 1,43 kg) 19. Il rapporto di combinazione Si/O nel quarzo SiO2 è 0,467. Calcola quanto silicio è contenuto in 8 g di un cristallo puro di quarzo. (2,8 g) 20. Il minerale rutilo è diossido di titanio TiO2, la composizione in titanio è il 59,95%, calcola il rapporto di combinazione Ti/O.. BILANCIAMENTO Bilancia le seguenti reazioni Li + H2SO4 Li2SO4 + H2 Mg + Cl2 MgCl2 Fe + I2 FeI3 Cu2S + HCl CuCl + H2S Cr + HBr CrBr3 + H2 KCl + H2SO4 HCl + K2SO4 AgBr + Cl2 AgCl + Br2 Pb(NO3)2 + KI PbI2 + KNO3 FeO + C Fe + CO2 Al2O3 + C Al + CO2 NaF + H2O NaOH + F2 + H2 N2 + H2 NH3 Ca + O2 CaO CaO + H2O Ca(OH)2 C2H6 + O2 CO2 + H2O C3H8 + O2 CO2 + H2O C2H5OH + O2 CO2 + H2O NH4Cl + NaOH NH3 + NaCl + H2O Bergamo, 6 giugno 2014 Gli studenti La docente...
7
La percentuale massa/volume (%m/v) indica la quantità di soluto espressa in grammi presente in 100 ml di soluzione.
 La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
LICEO SCIENTIFICO F.LUSSANA PROGRAMMA DI SCIENZE EFFETTIVAMENTE SVOLTO CLASSE 1 N : Liceo Scientifico delle Scienze Applicate a.s.
 LICEO SCIENTIFICO F.LUSSANA PROGRAMMA DI SCIENZE EFFETTIVAMENTE SVOLTO CLASSE 1 N : Liceo Scientifico delle Scienze Applicate a.s. 2014-2015 Testi in adozione : Scienze della Terra LA TERRA, UN INTRODUZIONE
LICEO SCIENTIFICO F.LUSSANA PROGRAMMA DI SCIENZE EFFETTIVAMENTE SVOLTO CLASSE 1 N : Liceo Scientifico delle Scienze Applicate a.s. 2014-2015 Testi in adozione : Scienze della Terra LA TERRA, UN INTRODUZIONE
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola.
 Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
Una formula molecolare è una formula chimica che dà l'esatto numero degli atomi di una molecola. La formula empirica e una formula in cui il rappporto tra gli atomi e il piu semplice possibil Acqua Ammoniaca
SCALA DEI PESI ATOMICI RELATIVI E MEDI
 SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
SCALA DEI PESI ATOMICI RELATIVI E MEDI La massa dei singoli atomi ha un ordine di grandezza compreso tra 10-22 e 10-24 g. Per evitare di utilizzare numeri così piccoli, essa è espressa relativamente a
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Acqua azzurra, acqua chiara. Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao
 Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
Classificazione della materia: Sostanze pure e miscugli
 Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
Verifica sperimentale della legge di Proust delle proporzioni costanti
 Verifica sperimentale della legge di Proust delle proporzioni costanti Un lavoro degli studenti della classe 4B del Liceo Scientifico Ernesto Balducci di Pontassieve Gli scienziati francesi Antoine Lavoisier
Verifica sperimentale della legge di Proust delle proporzioni costanti Un lavoro degli studenti della classe 4B del Liceo Scientifico Ernesto Balducci di Pontassieve Gli scienziati francesi Antoine Lavoisier
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
Unità di misura. Perché servono le unità di misura nella pratica di laboratorio e in corsia? Le unità di misura sono molto importanti
 Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
Unità di misura Le unità di misura sono molto importanti 1000 è solo un numero 1000 lire unità di misura monetaria 1000 unità di misura monetaria ma il valore di acquisto è molto diverso 1000/mese unità
SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE
 SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE 1 STADIO Identificazione e definizione delle soluzioni Obiettivo : il bambino, attraverso un approccio fenomenologico, impara il concetto di SOLUZIONE
SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE 1 STADIO Identificazione e definizione delle soluzioni Obiettivo : il bambino, attraverso un approccio fenomenologico, impara il concetto di SOLUZIONE
Domanda 1 Quesiti preliminari
 Domanda 1 Quesiti preliminari 1.1 A che temperatura bolle l acqua nella vostra aula di scienze? 1.2 Se in una pentola senza coperchio posta su di un fornello ho dell acqua che bolle e continuo a riscaldare,
Domanda 1 Quesiti preliminari 1.1 A che temperatura bolle l acqua nella vostra aula di scienze? 1.2 Se in una pentola senza coperchio posta su di un fornello ho dell acqua che bolle e continuo a riscaldare,
I GAS GAS IDEALI. PV=nRT. Pressione Volume numero di moli Temperatura Costante dei gas. P V n T R. n, T= cost Legge di Boyle
 I GAS Pressione Volume numero di moli Temperatura Costante dei gas GAS IDEALI P V n T R n = 1 Isoterma: pv = cost Isobara: V/T = cost. Isocora: P/t = cost. n, T= cost Legge di Boyle n, P = cost Legge di
I GAS Pressione Volume numero di moli Temperatura Costante dei gas GAS IDEALI P V n T R n = 1 Isoterma: pv = cost Isobara: V/T = cost. Isocora: P/t = cost. n, T= cost Legge di Boyle n, P = cost Legge di
DIPARTIMENTO DI SCIENZE INTEGRATE CHIMICA FISICA SCIENZE DELLA TERRA - BIOLOGIA
 IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
Il bilanciamento delle reazioni chimiche
 1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
Prova cantonale di scienze naturali. Anno scolastico 2007-2008. Classi IV medie. Fila - A
 Prova cantonale di scienze naturali Anno scolastico 2007-2008 Classi IV medie Fila - A Sede: Classe: ome: Punteggio Prima parte Seconda parte Prova cantonale di scienze naturali IV media settembre 2007
Prova cantonale di scienze naturali Anno scolastico 2007-2008 Classi IV medie Fila - A Sede: Classe: ome: Punteggio Prima parte Seconda parte Prova cantonale di scienze naturali IV media settembre 2007
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Corso di Laurea in Chimica e Tecnologia Farmaceutiche Esame di Chimica Analitica e Complementi di Chimica Modulo di Chimica Analitica 8 Novembre 2012
 Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
Modulo di Chimica Analitica 8 Novembre 2012 1. Una soluzione viene preparata sciogliendo1210 mg di K 3 Fe(CN) 6 in 775 ml di acqua. Calcolare: a) la concentrazione analitica di K 3 Fe(CN) 6 b) la concentrazione
CHIMICA. Una teoria è scientifica solo se è falsificabile (cioè se è possibile sperimentalmente smentire le sue previsioni)
 CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
La combustione. Docente: prof.ssa Lobello Carmela
 La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
LE SOLUZIONI 1.molarità
 LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
Gas perfetti e sue variabili
 Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA
 EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
EMISSIONE E ASSORBIMENTO DI LUCE DA PARTE DELLA MATERIA Poiché la luce è energia trasportata da oscillazioni del campo elettrico (fotoni) e la materia è fatta di particelle elettricamente cariche (atomi
PROGETTO. SID - Scientiam Inquirendo Discere IBSE - Inquiry Based Science. Education
 PROGETTO SID - Scientiam Inquirendo Discere IBSE - Inquiry Based Science Education 1 Anno scolastico 2013 2014 Classe I A ottici Modulo: Affonda o galleggia? Agata Conti 2 Sintesi Il modulo offre l'opportunità
PROGETTO SID - Scientiam Inquirendo Discere IBSE - Inquiry Based Science Education 1 Anno scolastico 2013 2014 Classe I A ottici Modulo: Affonda o galleggia? Agata Conti 2 Sintesi Il modulo offre l'opportunità
IL SISTEMA INTERNAZIONALE DI MISURA
 IL SISTEMA INTERNAZIONALE DI MISURA UNITÀ SI Il sistema di misura standard, adottato su scala mondiale, è conosciuto come Système International d Unités. Le unità fondamentali da cui derivano tutte le
IL SISTEMA INTERNAZIONALE DI MISURA UNITÀ SI Il sistema di misura standard, adottato su scala mondiale, è conosciuto come Système International d Unités. Le unità fondamentali da cui derivano tutte le
MISCUGLI E TECNICHE DI SEPARAZIONE
 MISCUGLI E TECNICHE DI SEPARAZIONE Classe 1^A Grafico Questo documento è solo una presentazione e non deve ritenersi completo se non è accompagnato dalla lezione in classe. Prof. Zarini Marta CLASSIFICAZIONE
MISCUGLI E TECNICHE DI SEPARAZIONE Classe 1^A Grafico Questo documento è solo una presentazione e non deve ritenersi completo se non è accompagnato dalla lezione in classe. Prof. Zarini Marta CLASSIFICAZIONE
1. LE GRANDEZZE FISICHE
 1. LE GRANDEZZE FISICHE La fisica (dal greco physis, natura ) è una scienza che ha come scopo guardare, descrivere e tentare di comprendere il mondo che ci circonda. La fisica si propone di descrivere
1. LE GRANDEZZE FISICHE La fisica (dal greco physis, natura ) è una scienza che ha come scopo guardare, descrivere e tentare di comprendere il mondo che ci circonda. La fisica si propone di descrivere
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
'RPDQGHFRQFHWWXDOL Alcuni interrogativi su fenomeni fisici e chimici
 ,OPDWHULDOHGLGDWWLFRFKHVHJXHqVWDWRVFHOWRWUDGRWWRHDGDWWDWRGDO*UXSSRGLFKLPLFD GHOO,7,60DMRUDQDGL*UXJOLDVFR7RULQR0DUFR)DODVFD$QJHOR&LPHQLV3DROD&RVFLD /RUHGDQD$QJHOHUL$QWRQHOOD0DUWLQL'DULR*D]]ROD*UD]LD5L]]R*LXVL'L'LR
,OPDWHULDOHGLGDWWLFRFKHVHJXHqVWDWRVFHOWRWUDGRWWRHDGDWWDWRGDO*UXSSRGLFKLPLFD GHOO,7,60DMRUDQDGL*UXJOLDVFR7RULQR0DUFR)DODVFD$QJHOR&LPHQLV3DROD&RVFLD /RUHGDQD$QJHOHUL$QWRQHOOD0DUWLQL'DULR*D]]ROD*UD]LD5L]]R*LXVL'L'LR
MODULO D LE VENTI REGIONI ITALIANE VOLUME 1 CAPITOLO 2 ... ... ... ... ... ...
 VOLUME 1 CAPITOLO 2 MODULO D LE VENTI REGIONI ITALIANE ACQUE INTERNE 1. Parole per capire A. Conosci già queste parole? Scrivi il loro significato o fai un disegno: valle... ghiacciaio... vulcano... cratere...
VOLUME 1 CAPITOLO 2 MODULO D LE VENTI REGIONI ITALIANE ACQUE INTERNE 1. Parole per capire A. Conosci già queste parole? Scrivi il loro significato o fai un disegno: valle... ghiacciaio... vulcano... cratere...
DIARIO DI BORDO DOCENTE PIERA FERRARIO SCUOLA MEDIA STATALE A. DE FERRARIIS GALATONE
 DIARIO DI BORDO DOCENTE PIERA FERRARIO SCUOLA MEDIA STATALE A. DE FERRARIIS GALATONE MISCUGLI E SOLUZIONI La trattazione di questo argomento è avvenuta nell ambito dello studio dell acqua e delle sue proprietà
DIARIO DI BORDO DOCENTE PIERA FERRARIO SCUOLA MEDIA STATALE A. DE FERRARIIS GALATONE MISCUGLI E SOLUZIONI La trattazione di questo argomento è avvenuta nell ambito dello studio dell acqua e delle sue proprietà
Quiz di scienze l acqua
 Quiz di scienze l acqua 1. Da cos e composta l acqua? Idrogeno e ossigeno Tanti piccoli animaletti trasparenti chiamati pesci acquiferi E uno dei misteri dell umanita, gli scienziati non sono ancora riusciti
Quiz di scienze l acqua 1. Da cos e composta l acqua? Idrogeno e ossigeno Tanti piccoli animaletti trasparenti chiamati pesci acquiferi E uno dei misteri dell umanita, gli scienziati non sono ancora riusciti
FISICA. Le forze. Le forze. il testo: 2011/2012 La Semplificazione dei Testi Scolastici per gli Alunni Stranieri IPSIA A.
 01 In questa lezione parliamo delle forze. Parliamo di forza quando: spostiamo una cosa; solleviamo un oggetto; fermiamo una palla mentre giochiamo a calcio; stringiamo una molla. Quando usiamo (applichiamo)
01 In questa lezione parliamo delle forze. Parliamo di forza quando: spostiamo una cosa; solleviamo un oggetto; fermiamo una palla mentre giochiamo a calcio; stringiamo una molla. Quando usiamo (applichiamo)
MATERIA: tutto ciò che ha una MASSA, occupa un VOLUME e ha ENERGIA
 La materia La materia MATERIA: tutto ciò che ha una MASSA, occupa un VOLUME e ha ENERGIA Il mondo che ci circonda è costituito da materia. La chimica studia le proprietà della materia e i suoi cambiamenti.
La materia La materia MATERIA: tutto ciò che ha una MASSA, occupa un VOLUME e ha ENERGIA Il mondo che ci circonda è costituito da materia. La chimica studia le proprietà della materia e i suoi cambiamenti.
DALLA MOLE AI CALCOLI STECHIOMETRICI
 Conversione Massa Moli DALLA MOLE AI CALCOLI STECHIOMETRICI - ESERCIZI GUIDATI - LEGENDA DEI SIMBOLI: M = Peso molecolare m(g) = quantità in g di elemento o di composto n = numero di moli Ricorda che l'unità
Conversione Massa Moli DALLA MOLE AI CALCOLI STECHIOMETRICI - ESERCIZI GUIDATI - LEGENDA DEI SIMBOLI: M = Peso molecolare m(g) = quantità in g di elemento o di composto n = numero di moli Ricorda che l'unità
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
REGIONE PIEMONTE. Asse MATEMATICO (prova 1) Codice corso: Allievo: Cod. fiscale: ASSE CULTURALE MATEMATICO. Questionario
 Pagina 1 di 15 REGIONE PIEMONTE ASSE CULTURALE MATEMATICO Questionario Asse MATEMATICO (prova 1) Codice corso: Allievo: Cod. fiscale: Pagina 2 di 15 Modalità di erogazione Se la somministrazione della
Pagina 1 di 15 REGIONE PIEMONTE ASSE CULTURALE MATEMATICO Questionario Asse MATEMATICO (prova 1) Codice corso: Allievo: Cod. fiscale: Pagina 2 di 15 Modalità di erogazione Se la somministrazione della
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Cenni di geografia astronomica. Giorno solare e giorno siderale.
 Cenni di geografia astronomica. Tutte le figure e le immagini (tranne le ultime due) sono state prese dal sito Web: http://www.analemma.com/ Giorno solare e giorno siderale. La durata del giorno solare
Cenni di geografia astronomica. Tutte le figure e le immagini (tranne le ultime due) sono state prese dal sito Web: http://www.analemma.com/ Giorno solare e giorno siderale. La durata del giorno solare
La candela accesa. Descrizione generale. Obiettivi. Sequenza didattica e metodo di lavoro. Esperimenti sulla crescita delle piante
 Esperimenti sulla crescita delle piante unità didattica 1 La candela accesa Durata 60 minuti Materiali per ciascun gruppo - 1 candela - 1 vaso di vetro - 1 cronometro - 1 cannuccia - fiammiferi - 1 pezzo
Esperimenti sulla crescita delle piante unità didattica 1 La candela accesa Durata 60 minuti Materiali per ciascun gruppo - 1 candela - 1 vaso di vetro - 1 cronometro - 1 cannuccia - fiammiferi - 1 pezzo
Corso competenze di base Ambito chimico
 Laboratorio di Chimica dell ITIS E.Majorana di Grugliasco (www.itismajo.it/chimica) Corso competenze di base Ambito chimico (Prima parte) La dispensa è stata realizzata dalla prof. A. Martini con la collaborazione,
Laboratorio di Chimica dell ITIS E.Majorana di Grugliasco (www.itismajo.it/chimica) Corso competenze di base Ambito chimico (Prima parte) La dispensa è stata realizzata dalla prof. A. Martini con la collaborazione,
DINAMICA DEL PUNTO MATERIALE E CONCETTO DI FORZA. Dinamica: studio delle forze che causano il moto dei corpi
 DINAMICA DEL PUNTO MATERIALE E CONCETTO DI FORZA Dinamica: studio delle forze che causano il moto dei corpi 1 Forza Si definisce forza una qualunque causa esterna che produce una variazione dello stato
DINAMICA DEL PUNTO MATERIALE E CONCETTO DI FORZA Dinamica: studio delle forze che causano il moto dei corpi 1 Forza Si definisce forza una qualunque causa esterna che produce una variazione dello stato
LA CORRENTE ELETTRICA CONTINUA
 LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
Gas. Vapore. Forma e volume del recipiente in cui è contenuto. un gas liquido a temperatura e pressione ambiente. microscopico MACROSCOPICO
 Lo Stato Gassoso Gas Vapore Forma e volume del recipiente in cui è contenuto. un gas liquido a temperatura e pressione ambiente MACROSCOPICO microscopico bassa densità molto comprimibile distribuzione
Lo Stato Gassoso Gas Vapore Forma e volume del recipiente in cui è contenuto. un gas liquido a temperatura e pressione ambiente MACROSCOPICO microscopico bassa densità molto comprimibile distribuzione
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
Riepilogo programma di Chimica Ginnasio Anno scolastico 2011/2012
 Riepilogo programma di Chimica Ginnasio Anno scolastico 2011/2012 Misure e grandezze Grandezze fondamentali Grandezza fisica Simbolo della grandezza Unità di misura Simbolo dell unità di misura lunghezza
Riepilogo programma di Chimica Ginnasio Anno scolastico 2011/2012 Misure e grandezze Grandezze fondamentali Grandezza fisica Simbolo della grandezza Unità di misura Simbolo dell unità di misura lunghezza
IL CICLO DEI MATERIALI
 1 LA SOCIETA DEI CONSUMI La nostra società produce molti beni di consumo, perché la pubblicità ci convince che abbiamo bisogno di nuovi prodotti buttando quelli vecchi anche se perfettamente funzionanti,
1 LA SOCIETA DEI CONSUMI La nostra società produce molti beni di consumo, perché la pubblicità ci convince che abbiamo bisogno di nuovi prodotti buttando quelli vecchi anche se perfettamente funzionanti,
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Quesiti e problemi. 9 Calcola, con l aiuto della tavola periodica, la massa. 10 Calcola la massa molecolare di tre acidi piuttosto
 SUL LIBRO DA PAG 101 A PAG 10 Quesiti e problemi 1 La massa atomica e la massa molecolare 1 Qual è la definizione di unità di massa atomica u? a) è uguale a 1/12 della massa dell atomo di 12 C b) è uguale
SUL LIBRO DA PAG 101 A PAG 10 Quesiti e problemi 1 La massa atomica e la massa molecolare 1 Qual è la definizione di unità di massa atomica u? a) è uguale a 1/12 della massa dell atomo di 12 C b) è uguale
ACQUA POTABILE Questa figura illustra come venga resa potabile l acqua fornita alle case nelle città.
 (3) Filtro (4) Aggiunta di cloro (5) Analisi della qualità dell'acqua Laboratorio di Ricerca Educativa e Didattica COGNOME NOME CLASSE DATA VERIFICA DI ASSE SULL'ACQUA 1 Riserva d'acqua (Bacino idrico
(3) Filtro (4) Aggiunta di cloro (5) Analisi della qualità dell'acqua Laboratorio di Ricerca Educativa e Didattica COGNOME NOME CLASSE DATA VERIFICA DI ASSE SULL'ACQUA 1 Riserva d'acqua (Bacino idrico
I MOTI DELLA TERRA NELLO SPAZIO
 LC23.03.06 I MOTI DELLA TERRA NELLO SPAZIO Prerequisiti: conoscenza del sistema metrico decimale e delle figure geometriche conoscenza del pianeta Terra Obiettivi: studiare i moti che riguardano la Terra
LC23.03.06 I MOTI DELLA TERRA NELLO SPAZIO Prerequisiti: conoscenza del sistema metrico decimale e delle figure geometriche conoscenza del pianeta Terra Obiettivi: studiare i moti che riguardano la Terra
Lunghezza Massa Peso Volume Capacità Densità Peso specifico Superficie Pressione Forza Lavoro Potenza
 Misurare una grandezza La Grandezza 1. La grandezza è una caratteristica misurabile. Lunghezza Massa Peso Volume Capacità Densità Peso specifico Superficie Pressione Forza Lavoro Potenza 2. Misurare una
Misurare una grandezza La Grandezza 1. La grandezza è una caratteristica misurabile. Lunghezza Massa Peso Volume Capacità Densità Peso specifico Superficie Pressione Forza Lavoro Potenza 2. Misurare una
Progettazione disciplinare:
 PIANO DI LAVORO ANNUALE-PROGETTAZIONE INDIVIDUALE PER SINGOLA DISCIPLINA E PER CLASSE Classe 1A A.S. 2015/2016 Disciplina: CHIMICA Docente: Rosselli Antonino Ore settimanali: 3 (1 di laboratorio) Libro
PIANO DI LAVORO ANNUALE-PROGETTAZIONE INDIVIDUALE PER SINGOLA DISCIPLINA E PER CLASSE Classe 1A A.S. 2015/2016 Disciplina: CHIMICA Docente: Rosselli Antonino Ore settimanali: 3 (1 di laboratorio) Libro
2) Calcolare la molarità di una soluzione di acido solforico al 17%,d = 1.12 g/ml
 Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
Bari,11 gennaio 1999 Compito di analisi dei farmaci I 1) 1 ml di H 2 O 2 viene titolato con KMnO 4. Sono necessari 18.1 ml. La soluzione di KMnO 4 è 0.1023 N e la densità dell acqua ossigenata è 1.01 g/ml.
MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI
 MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI La materia è tutto ciò che ha una massa, energia e occupa spazio, cioè ha un volume; essa si classifica in base alla sua composizione chimica ed in
MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI La materia è tutto ciò che ha una massa, energia e occupa spazio, cioè ha un volume; essa si classifica in base alla sua composizione chimica ed in
Cognome. Nome Classe 1^ VERIFICA DI CHIMICA Recupero trimestre Data NB troverai le soluzioni nel testo in grassetto o sottolineato
 Cognome. Nome Classe 1^ ERIICA DI CHIMICA Recupero trimestre Data NB troverai le soluzioni nel testo in grassetto o sottolineato 1. Quale dei seguenti enunciati non descrive lo stato liquido? a) le particelle
Cognome. Nome Classe 1^ ERIICA DI CHIMICA Recupero trimestre Data NB troverai le soluzioni nel testo in grassetto o sottolineato 1. Quale dei seguenti enunciati non descrive lo stato liquido? a) le particelle
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
REAZIONI ESOTERMICHE ED ENDOTERMICHE
 REAZIONI ESOTERMICHE ED ENDOTERMICHE Obiettivo di questo esperimento è confrontare l effetto termico di 0,1 moli di diverse sostanze ioniche solide quando vengono sciolte in una stessa quantità di acqua.
REAZIONI ESOTERMICHE ED ENDOTERMICHE Obiettivo di questo esperimento è confrontare l effetto termico di 0,1 moli di diverse sostanze ioniche solide quando vengono sciolte in una stessa quantità di acqua.
CLASSI PRIME TECNICO GRAFICO. a.s. 2014/ 2015
 KIT DI RECUPERO DI GEOGRAFIA CLASSI PRIME TECNICO GRAFICO a.s. 2014/ 2015 MATERIALE DIDATTICO SOSPENSIONE DI GIUDIZIO GEOGRAFIA CLASSI PRIME Tecnico Grafico a.s. 2014 / 2015 COGNOME : NOME: CLASSE:. Il
KIT DI RECUPERO DI GEOGRAFIA CLASSI PRIME TECNICO GRAFICO a.s. 2014/ 2015 MATERIALE DIDATTICO SOSPENSIONE DI GIUDIZIO GEOGRAFIA CLASSI PRIME Tecnico Grafico a.s. 2014 / 2015 COGNOME : NOME: CLASSE:. Il
GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce)
 GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce) I MINERALI I minerali sono sostanze solide omogenee, inorganiche, esprimibili mediante
GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce) I MINERALI I minerali sono sostanze solide omogenee, inorganiche, esprimibili mediante
Volume. Unità accettata dal SI è il L (litro) Lunghezza = 1 dimensione Superficie = 2 dimensioni Volume = 3 dimensioni
 Il volume è lo spazio occupato da un corpo oppure la capacità di un contenitore. E una grandezza derivata estensiva, simbolo V, equazione dimensionale [V] = [l 3 ]. L unità di misura SI è il m 3 (metro
Il volume è lo spazio occupato da un corpo oppure la capacità di un contenitore. E una grandezza derivata estensiva, simbolo V, equazione dimensionale [V] = [l 3 ]. L unità di misura SI è il m 3 (metro
Capitolo 03 LA PRESSIONE ATMOSFERICA. 3.1 Esperienza del Torricelli 3.2 Unità di misura delle pressioni
 Capitolo 03 LA PRESSIONE ATMOSFERICA 3.1 Esperienza del Torricelli 3.2 Unità di misura delle pressioni 12 3.1 Peso dell aria I corpi solidi hanno un loro peso, ma anche i corpi gassosi e quindi l aria,
Capitolo 03 LA PRESSIONE ATMOSFERICA 3.1 Esperienza del Torricelli 3.2 Unità di misura delle pressioni 12 3.1 Peso dell aria I corpi solidi hanno un loro peso, ma anche i corpi gassosi e quindi l aria,
Capitolo 2 Le trasformazioni fisiche della materia
 Capitolo 2 Le trasformazioni fisiche della materia 1.Gli stati fisici della materia 2.I sistemi omogenei e i sistemi eterogenei 3.Le sostanze pure e i miscugli 4.I passaggi di stato 5. la teoria particellare
Capitolo 2 Le trasformazioni fisiche della materia 1.Gli stati fisici della materia 2.I sistemi omogenei e i sistemi eterogenei 3.Le sostanze pure e i miscugli 4.I passaggi di stato 5. la teoria particellare
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
GAS. I gas si assomigliano tutti
 I gas si assomigliano tutti Aeriforme liquido solido GAS Descrizione macroscopica e microscopica degli stati di aggregazione della materia Fornendo energia al sistema, le forze di attrazione tra le particelle
I gas si assomigliano tutti Aeriforme liquido solido GAS Descrizione macroscopica e microscopica degli stati di aggregazione della materia Fornendo energia al sistema, le forze di attrazione tra le particelle
LA TERRA E LA CHIMICA: LA TAVOLA PERIODICA DEGLI ELEMENTI ELEMENTI E COMPOSTI
 I.I.S. A. PACINOTTI IST. TECNICO STATALE INDUSTRIALE Antonio PACINOTTI IST. TECNICO STATALE per GEOMETRI "Giorgio MASSARI" http://www.iispacinottive.it/ Via Caneve, n. 93 30173 - Mestre (VE) tel. 041 5350355
I.I.S. A. PACINOTTI IST. TECNICO STATALE INDUSTRIALE Antonio PACINOTTI IST. TECNICO STATALE per GEOMETRI "Giorgio MASSARI" http://www.iispacinottive.it/ Via Caneve, n. 93 30173 - Mestre (VE) tel. 041 5350355
COMPITO DI CHIMICA DEL 19-04-2013
 COMPITO DI CHIMICA DEL 19-04-2013 1) Una certa quantità di solfato di ferro (II), sciolta in una soluzione acquosa di acido solforico, viene trattata con 1.0 10-3 mol di permanganato di potassio. Si ottengono
COMPITO DI CHIMICA DEL 19-04-2013 1) Una certa quantità di solfato di ferro (II), sciolta in una soluzione acquosa di acido solforico, viene trattata con 1.0 10-3 mol di permanganato di potassio. Si ottengono
DISTILLAZIONE e ANALISI MERCEOLOGICHE
 DISTILLAZIONE e ANALISI MERCEOLOGICHE ANNA M. DI MARIA Determinazione del grado alcolico del vino (distillazione semplice) pallone di ebollizione da 250 ml tubo adduttore con bolla di sicurezza refrigerante
DISTILLAZIONE e ANALISI MERCEOLOGICHE ANNA M. DI MARIA Determinazione del grado alcolico del vino (distillazione semplice) pallone di ebollizione da 250 ml tubo adduttore con bolla di sicurezza refrigerante
SISTEMA BINARIO DI DUE LIQUIDI VOLATILI TOTALMENTE MISCIBILI che seguono Raoult
 SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
Programmazione individuale per competenze CLASSE 3^B LSA. Materia: CHIMICA
 Programmazione individuale per competenze CLASSE 3^B LSA Materia: CHIMICA Situazione della classe Accordi con la classe Accordi con le altre discipline Correlazione con i progetti proposti alla classe
Programmazione individuale per competenze CLASSE 3^B LSA Materia: CHIMICA Situazione della classe Accordi con la classe Accordi con le altre discipline Correlazione con i progetti proposti alla classe
LA LEGGE DI GRAVITAZIONE UNIVERSALE
 GRAVIMETRIA LA LEGGE DI GRAVITAZIONE UNIVERSALE r La legge di gravitazione universale, formulata da Isaac Newton nel 1666 e pubblicata nel 1684, afferma che l'attrazione gravitazionale tra due corpi è
GRAVIMETRIA LA LEGGE DI GRAVITAZIONE UNIVERSALE r La legge di gravitazione universale, formulata da Isaac Newton nel 1666 e pubblicata nel 1684, afferma che l'attrazione gravitazionale tra due corpi è
Esperienza A: idrofilicità e idrofobicità
 Esperienza A: idrofilicità e idrofobicità Obiettivo: Fare osservare che alcune sostanze, mescolate all'acqua, danno luogo a soluzioni omogenee mentre altre danno miscele eterogenee. Dalla descrizione delle
Esperienza A: idrofilicità e idrofobicità Obiettivo: Fare osservare che alcune sostanze, mescolate all'acqua, danno luogo a soluzioni omogenee mentre altre danno miscele eterogenee. Dalla descrizione delle
TEORIA CINETICA DEI GAS
 TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
TEORIA CINETICA DEI GAS La teoria cinetica dei gas è corrispondente con, e infatti prevede, le proprietà dei gas. Nella materia gassosa, gli atomi o le molecole sono separati da grandi distanze e sono
Nascita e morte delle stelle
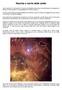 Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
Nascita e morte delle stelle Se la materia che componeva l universo primordiale fosse stata tutta perfettamente omogenea e diffusa in modo uguale, non esisterebbero né stelle né pianeti. C erano invece
Lo stato gassoso e le caratteristiche dei gas
 Lo stato gassoso e le caratteristiche dei gas 1. I gas si espandono fino a riempire completamente e ad assumere la forma del recipiente che li contiene 2. Igasdiffondonounonell altroesonoingradodimescolarsiintuttiirapporti
Lo stato gassoso e le caratteristiche dei gas 1. I gas si espandono fino a riempire completamente e ad assumere la forma del recipiente che li contiene 2. Igasdiffondonounonell altroesonoingradodimescolarsiintuttiirapporti
ATTIVITÀ DEL SINGOLO DOCENTE
 PIANO DI LAVORO DOCENTE MATERIA DESTINATARI ANNO SCOLASTICO 2013-14 Olga Pecorari SCIENZE NATURALI CLASSE PRIMA BES LICEO DELLE SCIENZE UMANE OP.ECONOMICO-SOCIALE COMPETENZE CONCORDATE CON CONSIGLIO DI
PIANO DI LAVORO DOCENTE MATERIA DESTINATARI ANNO SCOLASTICO 2013-14 Olga Pecorari SCIENZE NATURALI CLASSE PRIMA BES LICEO DELLE SCIENZE UMANE OP.ECONOMICO-SOCIALE COMPETENZE CONCORDATE CON CONSIGLIO DI
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
LA FORZA. Il movimento: dal come al perché
 LA FORZA Concetto di forza Principi della Dinamica: 1) Principio d inerzia 2) F=ma 3) Principio di azione e reazione Forza gravitazionale e forza peso Accelerazione di gravità Massa, peso, densità pag.1
LA FORZA Concetto di forza Principi della Dinamica: 1) Principio d inerzia 2) F=ma 3) Principio di azione e reazione Forza gravitazionale e forza peso Accelerazione di gravità Massa, peso, densità pag.1
La teleferica dilatazione termica lineare
 La teleferica dilatazione termica lineare Una teleferica di montagna è costituita da un cavo di acciaio (λ = 1,2 10-5 K -1 ) di lunghezza 5,4 km. D'estate, la temperatura del cavo può passare dai 5 gradi
La teleferica dilatazione termica lineare Una teleferica di montagna è costituita da un cavo di acciaio (λ = 1,2 10-5 K -1 ) di lunghezza 5,4 km. D'estate, la temperatura del cavo può passare dai 5 gradi
LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013
 LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013 CHIMICA NUCLEO FONDANTE A : MISURE E GRANDEZZE TRASFORMAZIONI CHIMICO-FISICHE DELLA MATERIA
LICEO SCIENTIFICO LEONARDO da VINCI REGGIO CALABRIA PROGRAMMA DI SCIENZE NATURALI CLASSE 2 a SEZ. Q A.S. 2012/2013 CHIMICA NUCLEO FONDANTE A : MISURE E GRANDEZZE TRASFORMAZIONI CHIMICO-FISICHE DELLA MATERIA
Tecnologie chimiche industriali
 Tecnologie chimiche industriali INDICAZIONI PER LA PROVA GRAFICA DI TECNOLOGIE CHIMICHE INDUSTRIALI Leggiamo attentamente la traccia e domandiamoci: 1. Quali sono i materiali di processo; 2. In quale stato
Tecnologie chimiche industriali INDICAZIONI PER LA PROVA GRAFICA DI TECNOLOGIE CHIMICHE INDUSTRIALI Leggiamo attentamente la traccia e domandiamoci: 1. Quali sono i materiali di processo; 2. In quale stato
) e 200 ml di NaOH 0.1 M. I volumi si considerano additivi.[ph = 4.085]
![) e 200 ml di NaOH 0.1 M. I volumi si considerano additivi.[ph = 4.085] ) e 200 ml di NaOH 0.1 M. I volumi si considerano additivi.[ph = 4.085]](/thumbs/26/9134725.jpg) Chimica Analitica Prova scritta del 19 Gennaio 2004 1) 375 ml di soluzione acquosa contengono 21.2 µg di un principio attivo. Esprimere la concentrazione della soluzione in parti per milione (ppm) [0.056
Chimica Analitica Prova scritta del 19 Gennaio 2004 1) 375 ml di soluzione acquosa contengono 21.2 µg di un principio attivo. Esprimere la concentrazione della soluzione in parti per milione (ppm) [0.056
DAI MISCUGLI ALLE SOSTANZE PURE
 Come si presenta la materia? DAI MISCUGLI ALLE SOSTANZE PURE Il criterio per distinguere i materiali è la presenza di una o più FASI porzioni di materia fisicamente distinte tra loro delimitate da nette
Come si presenta la materia? DAI MISCUGLI ALLE SOSTANZE PURE Il criterio per distinguere i materiali è la presenza di una o più FASI porzioni di materia fisicamente distinte tra loro delimitate da nette
IL TEMPO Pagine per l insegnante
 IL TEMPO Pagine per l insegnante Il tempo è una successione di avvenimenti, viene percepito grazie a mutamenti e ha una durata valutabile. A volte avvenimenti diversi accadono contemporaneamente; a volte
IL TEMPO Pagine per l insegnante Il tempo è una successione di avvenimenti, viene percepito grazie a mutamenti e ha una durata valutabile. A volte avvenimenti diversi accadono contemporaneamente; a volte
Programmazione individuale di Laboratorio Materia : Chimica e Laboratorio. Docenti : Giancarlo Cardone Classe : 2 CAT a.s.
 Programmazione individuale di Laboratorio Materia : Chimica e Laboratorio. Docenti : Giancarlo Cardone Classe : 2 CAT a.s. 2015-2016 Mondovi 05/11/2015 Prof. Giancarlo Cardone PROGRAMMAZIONE DELL ATTIVITA
Programmazione individuale di Laboratorio Materia : Chimica e Laboratorio. Docenti : Giancarlo Cardone Classe : 2 CAT a.s. 2015-2016 Mondovi 05/11/2015 Prof. Giancarlo Cardone PROGRAMMAZIONE DELL ATTIVITA
LIQUIDI. I esperimento
 LIQUIDI I esperimento TITOLO: Peso specifico dei liquidi OBIETTIVO: calcolare il peso specifico dei liquidi contenuti nelle bottigliette per capire di quale liquido si tratta. - 1 bilancia - 5 bottigliette
LIQUIDI I esperimento TITOLO: Peso specifico dei liquidi OBIETTIVO: calcolare il peso specifico dei liquidi contenuti nelle bottigliette per capire di quale liquido si tratta. - 1 bilancia - 5 bottigliette
Qui cade sua altezza
 Qui cade sua altezza Silvia Sbaragli N.R.D. Bologna DFA, SUPSI Locarno (Svizzera) Pubblicato in: Sbaragli S. (2010). Qui cade sua altezza. La Vita Scolastica. 18, 25-27. Nell insegnamento della matematica
Qui cade sua altezza Silvia Sbaragli N.R.D. Bologna DFA, SUPSI Locarno (Svizzera) Pubblicato in: Sbaragli S. (2010). Qui cade sua altezza. La Vita Scolastica. 18, 25-27. Nell insegnamento della matematica
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
