PROGRAMMA DI LABORATORIO a cura del dipartimento di scienze naturali
|
|
|
- Virginia Cecchini
- 8 anni fa
- Visualizzazioni
Transcript
1 PROGRAMMA DI LABORATORIO a cura del dipartimento di scienze naturali Anno Scolastico Ambito del progetto Ai confini tra due terre per la valorizzazione delle discipline scientifiche nel liceo classico A cura della prof. Maria Viotto e dei suoi allievi 1
2 ELENCO DELLE ESPERIENZE : CELLULE DI SUGHERO AL MICROSCOPIO : INTRODUZIONE ALLA MICROSCOPIA ( SCHEDA STORICA ) CONFRONTO TRA CELLULE VEGETALI DI SUGHERO, CIPOLLA ED ELODEA PER LE CLASSI V GINNASIO OSMOSI NELLE CELLULE DELLA CIPOLLLA PER LE CLASSI V GINNASIO SEPARAZIONE MEDIANTE CROMATOGRAFIA SU CARTA DEI PIGMENTI CONTENUTI IN UN INCHIOSTRO E NELLA CLOROFILLA DI UNA FOGLIA per le classi IV e V ginnasio MISURE DIRETTE E INDIRETTE PER LE CLASSI IV GINNASIO MISCUGLI E COMPOSTI PER LE CLASSI IV E V GINNASIO LA DENSITA E UNA PROPRIETA INTENSIVA PER LE CLASSI IV GINNASIO SOLUZIONI E MOLARITA PER LE CLASSI V GINNASIO E I LICEO IDROLISI SALINA PER LE CLASSI II LICEO DETERMINAZIONE DELL ACIDITA DEL SUCCO DI LIMONE PER LE CLASSI II LICEO LA PILA DI DANIELL PER LE CLASSI II LICEO DISSEZIONE DI UN CUORE DI UN MAIALE PER LE CLASSI II LICEO CLASSIFICAZIONE DI ALCUNI MINERALI SECONDO I SETTE SISTEMI PER LE CLASSI III LICEO ANALISI DEI CARBOIDRATI PER LE CLASSI III LICEO
3 CELLULE DI SUGHERO AL MICROSCOPIO: Questa fotografia presenta una superficie di legno di sughero a 400 ingrandimenti. Fu proprio osservando un pezzo di sughero attraverso il microscopio da lui stesso inventato che, nel 1665, l inglese Robert Hooke ( ) scoprì le cellule. In realtà Hooke non vide le cellule del sughero, ormai morte, ma le cavità da esse lasciate, simili appunto a delle piccole celle, da cui il nome. Nel 1665, Robert Hooke ( ) pubblicò un libro intitolato Micrographia. Hooke, era uno scienziato e inventore inglese che aveva costruito un microscopio ottico di gran lunga superiore ai modelli grossolani reperibili a quell epoca. Con esso egli esaminò una grande quantità di materiali - minerali, fibre tessili, e piccole piante e animali. Tra l altro esaminò il sughero. La descrizione che egli ne fece occupa una posizione così importante nella storia dei tentativi umani per comprendere la struttura fondamentale degli esseri viventi che è interessante sapere cosa egli disse: "Osservazione XVIII. Sullo schematismo o struttura del sughero e sulle cellule e pori di alcuni altri corpi leggeri." << Ho preso un bel pezzo di sughero chiaro e ne ho tagliato un frammento con un temperino ben affilato, in modo da lasciare la superficie ben liscia; quindi, esaminandola molto attentamente al microscopio, pensavo di riuscire a vedere che era porosa. Purtroppo non riuscii a distinguere chiaramente e con certezza i pori, né tanto meno che forma avessero. Tuttavia, in base alla leggerezza e alla morbidezza del sughero, pensando che la sua struttura non poteva essere tanto strana ma che probabilmente, se mi fossi applicato un po di più, sarei riuscito a distinguerla al microscopio, preparai con lo stesso temperino affilato e dallo stesso pezzo di prima una sottilissima fetta e la misi su una piastra portaoggetti nera perché il sughero è un corpo chiaro. Illuminandola direttamente con un raggio di luce proveniente da una lente piano-convessa, potei osservare in maniera chiarissima che il sughero era completamente perforato e poroso, simile ad un favo, ma con cellette irregolari. Nei seguenti particolari somigliava a un favo di api. Innanzitutto, per il fatto che era scarsamente costituito da materiale solido in confronto agli spazi vuoti che conteneva. Gli interstizi o pareti (come li chiamo io) o setti tra i pori erano infatti molto sottili in confronto ai pori stessi, come le sottili pellicole di cera rispetto alle cellette esagonali di un favo di api. Secondariamente, per il fatto che questi pori o cellule non erano molto profondi o spessi, ma erano costituiti da un gran numero di piccole caselle, derivate tutte da un unico lungo canalicolo continuo, mediante la formazione di diaframmi, come si vede nella figura, che rappresenta una sezione longitudinale dei pori. Io non li avevo notati prima (furono davvero i primi pori 3
4 microscopici che vidi e forse che furono visti, perché non trovai nessun scrittore o persona che li avesse menzionati prima) ma con la loro scoperta pensai di aver fatto balenare dinnanzi alla mia mente la vera e logica ragione di tutti i fenomeni del sughero, come ad esempio: Primo: se mi fossi chiesto la ragione della estrema leggerezza di tale corpo, il microscopio mi avrebbe detto che essa era la stessa per cui la schiuma, un favo vuoto, la lana, una spugna, la pietra pomice, ecc. sono leggeri, cioè una piccolissima quantità di sostanza solida si estende in proporzioni estremamente vaste. Secondo: sembrava non esservi nulla di più difficile da spiegare del fatto che il sughero non assorbe acqua, anche se lasciato galleggiare su di essa per lungo tempo, e che possa chiudere e trattenere aria all interno di una bottiglia, benché essa sia molto compressa e tendente ad aprirsi un passaggio, senza lasciar filtrare neanche una bolla. Anche qui il microscopio ci mostra che il sughero è impregnato d aria, la quale è contenuta nelle cellette. Sembra chiaro che né l acqua né l aria possono penetrare in esso, essendovi già un intus existens. Questa è la ragione per cui pezzi di sughero sono ottimi galleggianti per reti e tappi per fiale ed altri recipienti chiusi. Terzo: se ci si chiede perché il sughero, quando viene compresso, si presenta così elastico e capace di rigonfiarsi, e come può subire una così grande compressione, o contrazione delle dimensioni, e tornare in seguito come prima ad occupare lo stesso spazio, il microscopio ci dice che l intera massa consiste di una infinità di cellette o vescichette d aria, sostanza di per sé elastica, e che può subire una notevole compressione (come potei vedere diverse volte, servendomi solo delle mie mani, senza ricorrere a nessun congegno, e riuscendo a comprimerla a un ventesimo delle sue dimensioni normali vicino alla terra). Inoltre, sembra che le pareti sottili che circondano i pori abbiano esse pure una proprietà elastica, come in genere tutte le sostanze vegetali, in modo da facilitare il loro ritorno alla forma primitiva. Noi potremmo così scoprire facilmente e con certezza lo schematismo e la struttura anche di questi sottili setti e di numerosi altri corpi. Sembra che nulla si opponga a ciò e che presto sarà possibile renderci ragione di tutti i loro fenomeni, cioè quale è la causa della loro elasticità, e della resistenza di alcuni, della flessibilità e della capacità di tutti di reintegrarsi nella condizione iniziale, della friabilità e fragilità di altri, e così via. Ma fintantoché il microscopio, o qualche altro mezzo, non ci consentirà di scoprire il vero schematismo o la vera struttura di tutti i corpi, dobbiamo vagare nel buio, come è successo, e fare delle congetture sulla base di confronti e similitudini. Ma ritorniamo alla nostra osservazione. Contai parecchie file di questi pori e vidi che vi erano circa 40 cellule in un millimetro, cellule in un centimetro quadrato e 64 milioni di cellule in un centimetro cubo, un numero quasi incredibile..>> Il documento continua con una serie di domande e ragionamenti mediante i quali R. Hooke cerca di comprendere le proprietà del sughero alla luce di quanto osservato al microscopio. Hooke è il primo a descrivere le cellule, senza tuttavia coglierne il significato come unità strutturale di tutti gli esseri viventi. È comunque una delle tappe importanti nella storia della Biologia. 4
5 CONFRONTO TRA CELLULE VEGETALI DI SUGHERO, CIPOLLA ED ELODEA PER LE CLASSI V GINNASIO OBIETTIVO DELLA PROVA osservazione di fettine sottili di sughero, cipolla, elodea ricerca delle analogie e delle differenze tra sughero, cipolla, elodea confrontare quanto descritto per il sughero con il documento storico delle osservazioni fatte da Robert Hooke sul sughero con uno dei primi microscopi nel PROCEDIMENTO 1. realizzare una sottile sezione di sughero, depositarla su un vetrino portaoggetti con una goccia di acqua 2. effettuare l osservazione a piccolo ingrandimento (10X) e a massimo ingrandimento (40X); disegnare ed illustrare, in modo approfondito, ciò che si osserva. 3. ripetere le osservazioni con elodea e disegnare a 10X e 40X 4. ripetere le osservazioni con epidermide di cipolla a 10X e 40X utilizzando anche una goccia di Lugol Verifica e Valutazione dell attività in laboratorio: Confrontare i tre diversi tipi di cellule vegetali osservati evidenziando le analogie e le differenze. Disegni sul quaderno di laboratorio
6 Osmosi nelle cellule dell epitelio di cipolla per le classi V ginnasio Finalità: Osservare la brattea di una cipolla e il suo comportamento in una soluzione salina; Disegnare sul quaderno di laboratorio. Materiale utilizzato 1. Cipolla rossa. 2. Microscopio ottico. 3. Materiale per prelevare parti sottili della sostanza (lametta, bisturi, pinzette). 4. Vetrino porta oggetti. 5. Vetrino copri oggetti. 6. Acqua. 7. Pipetta. 8. NaCl e glucosio. Premessa teorica Nell ambito dello scambio di sostanze attraverso la membrana plasmatica (detta semipermeabile, perché impermeabile a certe molecole ma non ad altre) si individuano due tipi di trasporto. Il trasporto passivo (diffusione semplice, facilitata e osmosi) che non richiede energia in quanto avviene secondo gradiente di concentrazione e il trasporto attivo che necessita dell idrolisi dell ATP (molecola energetica) in quanto avviene contro il gradiente di concentrazione. La diffusione è il fenomeno mediante il quale si realizza il movimento casuale e spontaneo di molecole verso uno stato di equilibrio. La velocità di diffusione è influenzata da: 1. Diametro delle molecole o ioni (le sostanze piccole diffondono più velocemente); 2. Temperatura (maggior temperatura significa maggior movimento di particelle); 3. Carica elettrica della molecola; 4. Gradiente di concentrazione (differenza di concentrazione tra i due soluti). Ricordando la composizione della membrana plasmatica si afferma che le molecole apolari e di piccole dimensioni diffondono nella membrana grazie alla diffusione semplice, quelle polari diffondono grazie a proteine di trasporto o attraverso canali proteici siti sulle proteine intrinseche della membrana cellulare. L osmosi è il particolare fenomeno dove la diffusione riguarda l acqua. Separate dalla membrana cellulare possono esserci due soluzioni a diversa concentrazione. La più concentrata è detta ipertonica, l altra ipotonica. Risulta chiaro che è presente una minor percentuale d acqua nella soluzione ipertonica. L acqua, per osmosi, tende a muoversi da dove è concentrata maggiormente (sol. ipotonica) verso la soluzione ipertonica fino a raggiungere una concentrazione omogenea. Le due soluzioni diventano così isotoniche. Il movimento dell acqua è determinato solo dal gradiente di concentrazione. 6
7 In un organismo animale è fondamentale mantenere isotonici citoplasma e liquido extracellulare (detto matrice): un liquido ipertonico farebbe migrare l acqua oltre la membrana plasmatica sgonfiando le cellule; un liquido ipotonico farebbe gonfiare le cellule in modo pericoloso. Le cellule vegetali, invece, assorbono acqua che, immagazzinata nei vacuoli, genera pressione sulla parete cellulare dando turgidità al vegetale. Un eccessiva perdita d acqua, inoltre, farebbe staccare la membrana dalla parete della cellula provocandone la morte. Il trasporto attivo, il cui motore è l idrolisi dall ATP, sposta le sostanze contro il gradiente di concentrazione bruciando energia chimica, affinché alcune reazioni possano essere portate a termine. Esecuzione dell esperienza Preparazione del composto da osservare: 1. Apro la cipolla; 2. Prelevo un sottile strato della brattea rossa utilizzando lametta o pinzette; 3. Pongo sul vetrino porta oggetti il pezzettino di brattea; 4. Con la pipetta aggiungo una goccia d acqua; 5. Copro il composto con il vetrino copri oggetti. Preparazione del microscopio ottico e osservazione: 1. Colloco il tavolino porta oggetti al livello minimo con la vite macrometrica del microscopio; 2. Utilizzo l obiettivo a ingrandimento minimo; 3. Accendo il microscopio; 4. Metto il vetrino sul tavolino porta oggetti; 5. Con le viti dei grandi e piccoli spostamenti ( macrometrica e micrometrica ) cerco di mettere a fuoco il composto; 6. Compiuta la precedente messa a fuoco, ripeto l operazione del punto 5. con l obiettivo 10x; 7. Osservo il composto e lo disegno su carta; 8. Abbasso il tavolino porta oggetti al minimo e spengo il microscopio. Aggiunta della soluzione H 2 O + NaCl e soluzione di glucosio: 1. Preparo una soluzione di acqua e cloruro di sodio e una di glucosio ed acqua; 2. Tolgo il vetrino copri oggetti dal composto; 3. Verso qualche goccia di una e dell altra soluzione in due vetrini diversi; 4. Rimetto ai vetrini il copri oggetti; 5. Eseguo nuovamente i punti Preparazione del microscopio ottico e osservazione. Osservazioni Nel primo disegno osserviamo le cellule della brattea della cipolla: hanno forma con spigoli ben accentuati definiti dalla parete cellulare (spazio bianco tra le cellule in rosa). Con l ingrandimento 10x (cui va sommato l ingrandimento 10x delle lenti degli oculari per un totale di 100x) non si notano organuli all interno del citoplasma (colore rosato - rosso). 7
8 Con l aggiunta della soluzione salina o di quella di glucosio si osserva una riduzione di citoplasma. Si notano anche delle linee nere: esse evidenziano la membrana plasmatica staccatasi dalla parete cellulare. Si è dunque verificato un processo di osmosi attraverso il quale l acqua contenuta nei vacuoli e, in parte, nel citoplasma è uscita dalla cellula, sgonfiandola e facendo staccare la membrana plasmatica (processo di plasmolisi). La soluzione è sicuramente ipertonica: per renderla isotonica a se stesse le cellule hanno ceduto acqua. Conclusioni Con l aggiunta di una soluzione ipertonica rispetto all ambiente cellulare abbiamo osservato l osmosi dell acqua. La soluzione era sicuramente ipertonica perché si è verificato anche il fenomeno della plasmo lisi: la membrana plasmatica si è staccata dalla parete cellulare, quindi i vacuoli hanno ceduto acqua facendo raggrinzire e morire le cellule della cipolla rossa Separazione mediante cromatografia su carta dei pigmenti di un inchiostro e di una foglia per le classi IV e V ginnasio Introduzione La cromatografia è una tecnica di separazione che si basa sulla diversa velocità di migrazione che più sostanze sciolte in un solvente (eluente) hanno quando vengono depositate in un supporto adatto (carta da filtro, gel di silice o di allumina, ecc.) e vengono trasportate da un opportuno solvente, stratificandosi in punti diversi del supporto. La cromatografia permette quindi la separazione e la purificazione di miscele anche molto complesse di sostanze inorganiche ed organiche. Nella cromatografia su carta la fase fissa è costituita da una striscia di carta da filtro. I componenti della miscela da separare vengono depositate sotto forma di minuscole gocce ad una delle due estremità della striscia di carta. Quest'ultima viene inserita all'interno di un becher nel quale è presente un solvente il cui livello deve essere inferiore rispetto al punto in cui è stata depositata la miscela da separare. 8
9 Dopo un certo intervallo di tempo il solvente risale lungo il foglio di carta per capillarità, trascinando, a velocità diverse, le sostanze solubili presenti nella miscela che vengono così separate. Cromatografia su carta: procedura generale In un barattolo di vetro munito di coperchio inseriamo circa mezzo centimetro dell'opportuno solvente (come di seguito indicato). Ritagliamo un rettangolo di carta da filtro di altezza inferiore a quella del barattolo. Sulla carta da filtro tracciamo con la matita una linea orizzontale a circa 1,5 cm dal fondo del foglio. Tramite un capillare pratichiamo la "semina", depositando più gocce della miscela da separare in corrispondenza della linea orizzontale. Poniamo il rettangolo di carta all'interno del recipiente in modo che resti in posizione orizzontale stando attenti che il punto della semina si trovi al di sopra del livello dell'eluente. Tappiamo il barattolo e lasciamo che il solvente, risalendo per capillarità, trascini con se, a velocità diversa, i vari componenti solubili della miscela. Togliamo la carta dal barattolo quando il solvente si trova a 1-2 cm dal bordo superiore del foglio di carta. Evidenziamo con la matita l'altezza raggiunta dal solvente e quindi lasciamo asciugare il foglio di carta. Osserviamo infine le macchie dei diversi componenti della miscela e misuriamo, tramite una riga millimetrata, la distanza dalla linea di partenza. Separazione dei pigmenti di inchiostri: Scopo dell'esperienza Separare tramite cromatografia su carta i componenti di un inchiostro. Attrezzature e strumenti Vaso di vetro minuto di coperchio Carta da filtro Capillare di vetro Riga millimetrata Materiali e reagenti Alcol etilico C2H5OH Acetone CH3COCH3 Penne a sfera e pennarelli di diversi colori e marche 9
10 Procedimento Eluente: alcol etilico, acetone o una miscela dei due. Con pennarelli e penne a sfera di vari colori e di varie marche tracciare più punti sovrapposti sulla linea di partenza. Procedere come descritto in precedenza (procedura generale) Separazione dei pigmenti da una foglia: OBIETTIVO DELLA PROVA Estrazione e classificazione dei pigmenti di una foglia di Spinacia oleracea Materiale utilizzato: Alcune foglie di Spinacia oleracea (spinacio) Mortaio Pestello Pipetta Pasteur Alcool etilico Spatolina Carta da cromatografia Becher con coperchio Eluente Avio (miscela di isomeri dell esano e di cloropropano) Premessa teorica La fotosintesi La fotosintesi clorofilliana è un processo con il quale, mediante la clorofilla, l'energia solare (luce) viene trasformata in una forma di energia utilizzabile dagli organismi vegetali per la propria sussistenza. La quasi totalità della fotosintesi è compiuta da piante e alghe (che ricavano l'idrogeno dall'acqua). L equazione chimica che riassume il processo è: 6 CO2 + 6 H2O + Energia luminosa da C6H12O6 + 6 O2 La fotosintesi avviene in due fasi: una luminosa e una oscura. La prima comprende reazioni che possono avvenire solo in presenza di luce, mentre la seconda non richiede energia luminosa ed elabora i prodotti fotosintetici forniti dalla fase precedente. Nella fase luminosa la clorofilla, i carotenoidi e le ficocianine assorbono la luce nelle varie lunghezze d onda tipiche di ogni pigmento e si ha la produzione di ATP e NADPH. Nella fase oscura viene invece sintetizzato il carbonio a partire dalla CO2. Cromatografia L'invenzione della cromatografia viene attribuita al biochimico russo Mikhail Cvet nel 1906, quando riuscì, con questa tecnica, a separare la clorofilla da un estratto vegetale. Con il termine cromatografia oggi si indicano in genere tutte le varie tecniche separative, applicabili a miscele di sostanze. La cromatografia è molto usata per l'analisi dei cibi, delle droghe, del sangue, dei prodotti petroliferi. 10
11 Fasi di lavoro I. Abbiamo sminuzzato manualmente alcune foglie di spinaci all interno del mortaio; II. Con il pestello e alcune gocce di alcool etilico abbiamo ridotto in poltiglia i frammenti di foglia facendo fuoriuscire un succo verde, ricco di pigmenti; III. Con la pipetta Pasteur abbiamo estratto alcune gocce di succo e tracciato sulla carta da cromatografia una lunga linea a circa 2 cm. dal bordo inferiore; IV. Abbiamo lasciato asciugare; V. In seguito abbiamo ripetuto un altra volta le operazioni indicate ai punti III e IV ; VI. L assistente di laboratorio ha versato nel becher una piccola quantità di eluente Avio; VII. Abbiamo inserito nel becher la carta da cromatografia; VIII. Abbiamo notato come l eluente sia risalito attraverso la carta per capillarità; IX. Abbiamo notato come l eluente, risalendo, abbia trascinato con sé i pigmenti che si trovavano nella linea che avevamo tracciato. Conclusioni Durante questa esperienza abbiamo notato come l eluente, risalendo attraverso la carta, abbia diviso e reso riconoscibili i vari pigmenti presenti nelle foglie, trascinando più in alto quelli più leggeri. In questo elenco sono indicati i pigmenti riconosciuti nell ordine in cui l eluente li ha fatti emergere. Clorofilla A e B Verde intenso Xantofilla Verde giallastro Carotenoidi Giallo intenso Misurazioni dirette e indirette per le classi IV ginnasio Lo scopo delle esperienze tenutesi in laboratorio è quello di misurare il volume di determinati solidi con misurazioni dirette e indirette per stabilire quale delle due è più conveniente utilizzare in determinate situazioni. Materiale utilizzato Per l esperienza abbiamo utilizzato: Ø 3 solidi di differenti materiali e dimensioni; Ø un righello (sensibilità=1mm); 11
12 Ø un cilindro graduato (sensibilità=1ml); Ø uno spruzzino. Premessa teorica Una misurazione si può ottenere in due differenti modi: direttamente o indirettamente. Una misurazione diretta è tale quando non dobbiamo utilizzare formule e calcoli per ottenere il risultato: leggiamo il numero sullo strumento di misura. Sono pertanto misure dirette, ad esempio, la lunghezza e la massa. Le misurazioni indirette, invece, sfruttano formule matematiche applicandole a misure di altre grandezze per ottenerne una derivata e giungere al risultato. Alcuni esempi sono la densità e la velocità. Le misurazioni dirette sono in genere più affidabili, ma non sempre è possibile applicarle o può essere più conveniente utilizzare quelle indirette. Appunto per questo lo scopo delle esperienze è, come già detto, capire in che casi è più corretto utilizzare le une o le altre. Il materiale utilizzato è semplice e non sono necessari difficili passaggi per compiere le misurazioni. L unico strumento nuovo è il cilindro graduato, oggetto in vetro che contiene liquidi. Le misurazioni si leggono grazie ad un a serie di tacche orizzontali poste sul cilindro stesso. Ognuna di queste vale 1ml, cioè 1cm 3. Lo spruzzino contiene l acqua che abbiamo usato durante l esperienza. Montaggio ed esecuzione dell esperienza - Misurazione indiretta: per prima cosa ho misurato con il righello le dimensioni dei tre solidi e ho calcolato il volume. Anche i miei due compagni hanno eseguito lo stesso procedimento. Avevamo, così, tre misurazioni del volume e abbiamo adottato come misurazione reale la media delle tre. Abbiamo registrato tutti i dati sui nostri quaderni e siamo passati alla misurazione diretta. - Misurazione diretta: con lo spruzzino abbiamo versato nel cilindro graduato 30 ml d acqua. Per versare la giusta quantità di liquido bisogna procedere nel seguente modo: a. si immette una quantità di acqua che si avvicina a quella desiderata; b. il liquido tende ad essere più alto ai bordi, come se si arrampicasse: si forma quindi una superficie concava, in gergo un menisco; c. le ultime gocce si devono versare con lo sguardo perpendicolare al cilindro graduato e all altezza della tacca considerata. Quando il fondo del menisco si trova sulla tacca desiderata abbiamo raggiunto la quantità di liquido necessaria. Dopo aver versato 30 ml d acqua, abbiamo inserito nel cilindro il cubetto. Considerando che un corpo immerso in un liquido sposta una quantità di liquido pari al volume dell oggetto, l acqua si è alzata di livello nel cilindro graduato. Da questo consegue che la differenza tra il livello dell acqua e i 30 ml versati in origine costituisce il volume dei cubetti. 12
13 N.B.: il più grande dei tre solidi non è stato misurato con il metodo diretto a causa del fatto che il cilindro graduato non era sufficientemente largo per contenerlo. Dati e loro elaborazione Sono riportate le tabelle che raccolgono i dati delle misurazioni indirette (1) e quelle dirette (2). Volume calcolato con formule geometriche Solido Misura 1 [cm] Misura 2 [cm] Misura 3 [cm] Volume 1 [cm 3 ] Volume 2 [cm 3 ] Volume 3 [cm 3 ] Solido 1: l1 l l Solido 2: l1 l l Solido 3: l1 l l Volume per immersione Solido Misurazione 1 [cm 3 ] Misurazione 2 [cm 3 ] Misurazione 3 [cm 3 ] Solido Solido Osserviamo che il metodo diretto, il secondo utilizzato, ha dato in tutti i casi lo stesso volume, mentre il primo, il metodo indiretto, ha dato risultati più precisi. E necessario ricordare, però, che generalmente è il contrario, in quanto ci avvaliamo di un procedimento più veloce e con meno errori che si propagano durante i calcoli. Conclusioni Ho ottenuto il volume dei solidi in due modi differenti e ho accertato che, nel nostro caso, il primo metodo (indiretto) si è rivelato più preciso. Con la misurazione diretta, infatti, avremmo potuto pensare che i due solidi avessero lo stesso volume, fatto dimostratosi falso con la misurazione indiretta. Ho spiegato perché prima di ogni misurazione eseguibile con i due metodi, è opportuno domandarsi quale dei due sia più conveniente utilizzare, in quanto, come illustrato nelle due tabelle, non sempre le misurazioni dirette garantiscono i dati più affidabili. 13
14 I miscugli ed i composti per le classi IV e V ginnasio Materiali occorrenti: Zolfo in polvere - Ferro limatura - Acido cloridrico sol. 1:3 - Solfuro di carbonio - Calamita Mortaio - Vetreria. Richiami teorici: Per miscuglio si intende un insieme di sostanze che mantengono inalterate le loro caratteristiche originarie e che sono separabili con mezzi fisici semplici. Per composto si intende una sostanza con caratteristiche proprie che differiscono da quelle delle sostanze che lo hanno originato. Le sostanze originarie, elementi, sono sempre in rapporto costante. E' possibile ricavare gli elementi da un composto solo utilizzando dei sistemi chimico- fisici complessi ( es. elettrolisi ). Esecuzione dell'esperienza: Parte prima: analisi dei comportamenti chimico- fisici dei reagenti: Si dispone su un vetro da orologio una piccola quantità di limatura di ferro. Su un secondo vetro da orologio se ne dispone una di polvere di zolfo. Avvicinando una calamita alle due sostanze si osserva che il ferro risente del campo magnetico essendo attratto dalla calamita. Diversamente lo zolfo non è attratto e, quindi, non risente della vicinanza di un campo magnetico. Si recupera il ferro che aderisce alla calamita ponendolo in una provetta. In una seconda provetta si mette una piccola spatolata di polvere di zolfo. Si aggiungono ad entrambe 2 ml circa di acido cloridrico sol. 1:3. Si osserva che il ferro si consuma rapidamente con formazione di una soluzione di colore grigiastro, e sviluppo imponente di gas, secondo la reazione: Fe + 2HCl > FeCl 2 + H 2 Nella seconda provetta si nota, invece, che lo zolfo non si è sciolto e che una parte galleggia alla superficie: non è avvenuta, infatti, alcuna reazione. In altre due provette si pongono un paio di ml di solfuro di carbonio; si pone una punta di spatola di polvere di ferro in una delle due provette e nella seconda una simile quantità di zolfo ; si osserva che il ferro non dà alcuna reazione con il solfuro di carbonio, mentre lo zolfo rapidamente si solubilizza, dando una soluzione debolmente gialla. 14
15 Parte seconda : formazione del miscuglio ed analisi del suo comportamento: Si pesano 5.6 g. di limatura di ferro e 3.2 g. di polvere di zolfo; si pongono i due elementi in un piccolo mortaio o in un crogiolo mescolando e pestando la massa, fino ad ottenere una polvere uniforme di colore grigio chiaro; si suddivide il tutto in tre parti. Si prende la prima ponendola su un vetro da orologio avvicinando ad essa una calamita. Si osserva la separazione della polvere di ferro che aderisce alla calamita risentendo del campo magnetico; nel vetro resta solo la polvere di zolfo. Si prende la seconda parte di polvere e la si pone in una provetta aggiungendo 2 ml circa di acido cloridrico sol. 1:3. Si nota che il ferro reagisce colorando la soluzione di giallo- bruno, mentre lo zolfo resta inalterato, tendendo a disporsi alla superficie. La reazione che avviene può essere così descritta: (Fe + S) + 2HCl > FeCl 2 + H 2 + S Infine, si pone la terza aliquota in una provetta contenente 1 o 2 ml di solfuro di carbonio. Si nota che lo zolfo si scioglie completamente, ingiallendo la soluzione, mentre il ferro non dà alcuna reazione, depositandosi sul fondo. Le prove sopra effettuate indicano chiaramente che ci troviamo di fronte ad un miscuglio. Parte terza: formazione del composto ed analisi del suo comportamento: Si prepara un miscuglio come nella fase precedente, avendo l'accortezza di aggiungere un eccesso di zolfo, circa 1 o 2 g ( vedere nota operativa ) e lo si pone in un tubo da saggio asciutto. Si avvicina il tubo alla fiamma di un bunsen, tenendolo con una pinza, e lo si arroventa gradualmente; dopo di ciò si lascia raffreddare il tutto per alcuni istanti e si rompe il vetro recuperando la massa di colore scuro che si è formata. Si raccoglie la stessa nel mortaio, la si riduce in polvere e la si suddivide in tre parti. Si pone la prima parte su un vetro da orologio, avvicinando la calamita; non si nota alcuna influenza del campo magnetico. Si pone la seconda parte in una provetta e la si fa reagire con l'acido cloridrico; si verifica una reazione chimica con produzione di un gas dall'odore di uova marce, l'acido solfidrico ed il progressivo annerimento della soluzione, secondo la reazione: FeS + 2HCl > FeCl 2 + H 2 S Si pone, per ultimo, la restante parte in una provetta contenente 1 o 2 ml di solfuro di carbonio, osservando che nessun fenomeno chimico- fisico ha luogo. 15
16 Questi fatti indicano chiaramente un comportamento chimico diverso da quello degli elementi di origine e, quindi, l'avvenuta formazione di un composto, il solfuro di ferro II, secondo la reazione: T Fe + S > FeS Nota operativa: la formazione del solfuro di ferro, affinchè esso abbia le descritte caratteristiche, deve avvenire con un completo arroventamento. Poichè lo zolfo tende a fondere e ad evaporare è necessario operare con eccesso dello stesso. In caso contrario parte del ferro non reagisce conferendo al composto una relativa capacità a risentire del magnetismo. Prestare molta attenzione nell'uso del solfuro di carbonio, evitando di avvicinarlo a fiamme; se possibile operare sotto cappa La densità è una proprietà intensiva per le classi IV ginnasio Titolo Obiettivo Densità Determinare la densità di alcuni campioni allo stato solido e riconoscerli dal confronto con dati tabulati. Verificare se la densità é una grandezza intensiva o estensiva. Densità: Grandezza fisica che esprime il rapporto tra la massa ed il volume, nel S.I. viene misurata in Kg/m 3 Cenni teorici Massa: Quantità di materia contenuta in un corpo, la sua unità di misura è il Kg. Peso:E' la forza con cui un oggetto è attratto dalla Terra o da 16
17 qualsiasi altro grande corpo. Materiali usati Sostanze utilizzate Volume: Spazio tridimensionale occupato da un oggetto. Asta metallica, pinza a ragno, buretta, becher, bilancia tecnica, campioni di vari metalli, calibro, spruzzetta. Acqua. H 2 O Disegno schematico Procedimento Conclusioni A ciascun gruppo vengono assegnati dei campioni dello stesso materiale, di forma cilindrica e di dimensioni diverse tra loro. Su ognuno dei campioni vengono effettuate le seguenti operazioni: Determinare la massa del campione utilizzando la bilancia tecnica, annotare il valore in tabella. Riempire la buretta con acqua e dopo averla portata ad un volume noto ad es. 30 ml introdurre il primo campione nella buretta. Annotare il secondo volume nella tabella. Dalla differenza delle due letture si avrà il volume del campione. Con questo metodo il volume viene determinato direttamente. Dal rapporto fra la massa del campione ed il suo volume si determina la densità. Utilizzando il calibro ventesimale misurare l'altezza ed il diametro del campione, annotare i dati in tabella. Il volume sarà calcolato utilizzando la formula Sb* h, cioè (3,14*raggio 2 *altezza). Dal rapporto massa/volume si determina la densità, in questo caso col metodo indiretto. Dal confronto tra la densità media ottenuta e i valori di densità tabulati, si può identificare il campione, nel nostro caso esso è costituito da rame. 17
18 Dai dati riportati in tabella, tenuto conto dei possibili errori sperimentali, si osserva che all'aumento della massa corrisponde un aumento di volume, mentre il rapporto dei due parametri( M.e V.) resta sostanzialmente costante. Quindi si può concludere che la densità non dipende dalle dimensioni dei campioni esaminati. La densità é pertanto una grandezza intensiva. Tabella dati Campion i Massa campione( g) Volume iniziale(ml) Volume finale(ml ) V i - V f (ml ) Densità diretta(g/m l) V=Sb* h Densità indiretta(g/m l) Soluzioni e molarità per le classi V ginnasio e prime liceo Finalità: Creare soluzioni a molarità nota. Materiale utilizzato 1. Becher. 2. Pipetta. 3. Bacchetta in vetro per miscelare. 4. Cilindro graduato (sensibilità: 1ml). 18
19 5. Bilancia elettronica (sensibilità: 0.01g) 6. Sostanze utilizzate: a. Cloruro di sodio (NaCl) b. Solfato di rame pentaidrato (CuSO 4 *5H 2 O) c. Acqua distillata (H 2 O) Premessa teorica Una soluzione è un miscuglio omogeneo di due o più sostanze. Il materiale più abbondante è chiamato solvente, i materiali presenti in quantità minore sono definiti soluti. Un miscuglio si definisce omogeneo se si distingue una sola fase, una porzione di materia delimitata con proprietà intensive uniformi. Definizione di mole: una mole di una sostanza è una quantità di sostanza che contiene un numero definito di particelle. Il concetto di mole può essere utilizzato per esprimere la concentrazione di una soluzione, che si definisce come rapporto tra la quantità di soluto e una quantità unitaria di soluzione. Considerando però moli di soluto e litri di soluzione in cui il soluto è disciolto otteniamo la molarità, o concentrazione molare, di una soluzione. La molarità (unità di misura: mol/l o M) di una soluzione si calcola con la formula: M=n/V. La molarità è il rapporto tra il numero di moli di soluto e il volume (espresso in litri) della soluzione. Il numero di moli (unità di misura: mol) presenti in una quantità di una certa sostanza si calcola con la formula: n=m/m. Il numero di moli è uguale alla massa in grammi di campione fornito diviso per la massa molare, espressa in grammi mole, della sostanza. Prima parte Montaggio ed esecuzione dell esperienza 1. Calcolo la quantità di soluto: a. Calcolo il numero di moli di NaCl: n=m*v (molarità della soluzione * volume) b. Calcolo la massa di soluto necessaria: m=n*mm (numero di moli*massa molecolare) 2. Preparo la soluzione: a. Taro il becher b. Metto la quantità di soluto richiesta (0.14g) pesandola con la bilancia elettronica c. Aggiungo un po di acqua distillata d. Sciolgo il soluto con la bacchetta per miscelare e. Verso la soluzione nel cilindro graduato f. Facendo attenzione al menisco, aggiungo acqua distillata 19
20 g. Al fine di operare con maggiore precisione uso una pipetta per raggiungere il volume di soluzione desiderato (26ml). Dati e loro elaborazione NaCl Gruppo Molarità [M] Volume soluzione [ml] massa soluto [g] Calcolo il numero di moli: n=m*v=0.09m*0.026l= mol Calcolo la massa molecolare di NaCl: MM=Ma Na +Ma Cl =22.99u+35.45u=58.44u Massa molare di M(NaCl)=58.44g/mol Calcolo la massa di NaCl: m(nacl)=n*m= mol*58.44g=0.14g Seconda parte Montaggio ed esecuzione dell esperienza 1. Calcolo la quantità di soluto: a. Calcolo il numero di moli di CuSO 4 *5H 2 O: n=m*v (molarità della soluzione * volume) b. Calcolo la massa di soluto necessaria: m=n*mm (numero di moli*massa molecolare) 2. Preparo la soluzione: a. Taro il becher b. Metto la quantità di soluto richiesta (3.44g) pesandola con la bilancia elettronica c. Aggiungo un po di acqua distillata d. Sciolgo il soluto con la bacchetta per miscelare e. Verso la soluzione nel cilindro graduato f. Facendo attenzione al menisco, aggiungo acqua distillata g. Al fine di operare con maggiore precisione uso una pipetta per raggiungere il volume di soluzione desiderato (46ml). 20
L APPARATO CIRCOLATORIO
 L APPARATO CIRCOLATORIO Tutte le cellule del nostro corpo hanno bisogno di sostanze nutritive e di ossigeno per svolgere le loro funzioni vitali. Così, esiste il sangue, un tessuto fluido che porta in
L APPARATO CIRCOLATORIO Tutte le cellule del nostro corpo hanno bisogno di sostanze nutritive e di ossigeno per svolgere le loro funzioni vitali. Così, esiste il sangue, un tessuto fluido che porta in
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
ACIDI E BASI IN CASA. Scheda studente n.1
 Scheda studente n.1 Come interagisce ciascun liquido con la polvere di marmo? Seguite le istruzioni, osservate con attenzione ciò che accade e completate la tabella. polvere di marmo e le seguenti sostanze:
Scheda studente n.1 Come interagisce ciascun liquido con la polvere di marmo? Seguite le istruzioni, osservate con attenzione ciò che accade e completate la tabella. polvere di marmo e le seguenti sostanze:
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni
 Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
Corso di Laboratorio di Chimica Generale Esperienza 6: ph, sua misura e applicazioni Una delle più importanti proprietà di una soluzione acquosa è la sua concentrazione di ioni idrogeno. Lo ione H + o
L APPARATO CARDIO-CIRCOLATORIO
 L APPARATO CARDIO-CIRCOLATORIO L' APPARATO CARDIOCIRCOLATORIO è un sistema complesso costituito dal cuore e da una serie di condotti, i vasi sanguigni dentro i quali scorre il sangue. Il modo più semplice
L APPARATO CARDIO-CIRCOLATORIO L' APPARATO CARDIOCIRCOLATORIO è un sistema complesso costituito dal cuore e da una serie di condotti, i vasi sanguigni dentro i quali scorre il sangue. Il modo più semplice
... corso di chimica elettrochimica 1
 ... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
Dissociazione elettrolitica
 Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
DETERMINAZIONE DEL GRADO DI ACIDITÀ DI UN ACETO COMMERCIALE
 DETERMINAZIONE DEL GRADO DI ACIDITÀ DI UN ACETO COMMERCIALE L esperienza consiste nel misurare il grado di acidità di un aceto, acquistando i concetti di titolazione acido-base, punto di equivalenza, indicatore
DETERMINAZIONE DEL GRADO DI ACIDITÀ DI UN ACETO COMMERCIALE L esperienza consiste nel misurare il grado di acidità di un aceto, acquistando i concetti di titolazione acido-base, punto di equivalenza, indicatore
Esperimenti per gioco. Progetto realizzato dagli alunni del liceo O.M. Corbino.
 Esperimenti per gioco Progetto realizzato dagli alunni del liceo O.M. Corbino. Il progetto ha lo scopo di avvicinare i ragazzi al mondo della scienza tramite lo svolgimento di semplici esperienze di laboratorio
Esperimenti per gioco Progetto realizzato dagli alunni del liceo O.M. Corbino. Il progetto ha lo scopo di avvicinare i ragazzi al mondo della scienza tramite lo svolgimento di semplici esperienze di laboratorio
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
La combustione. Docente: prof.ssa Lobello Carmela
 La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
La combustione Percorso didattico realizzato dalla classe II D Istituto d Istruzione secondaria di I grado S Francesco d Assisi Francavilla Fontana (Br) Docente: prof.ssa Lobello Carmela Perché la combustione?
REAZIONI ESOTERMICHE ED ENDOTERMICHE
 REAZIONI ESOTERMICHE ED ENDOTERMICHE Obiettivo di questo esperimento è confrontare l effetto termico di 0,1 moli di diverse sostanze ioniche solide quando vengono sciolte in una stessa quantità di acqua.
REAZIONI ESOTERMICHE ED ENDOTERMICHE Obiettivo di questo esperimento è confrontare l effetto termico di 0,1 moli di diverse sostanze ioniche solide quando vengono sciolte in una stessa quantità di acqua.
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
PROGETTO. SID - Scientiam Inquirendo Discere IBSE - Inquiry Based Science. Education
 PROGETTO SID - Scientiam Inquirendo Discere IBSE - Inquiry Based Science Education 1 Anno scolastico 2013 2014 Classe I A ottici Modulo: Affonda o galleggia? Agata Conti 2 Sintesi Il modulo offre l'opportunità
PROGETTO SID - Scientiam Inquirendo Discere IBSE - Inquiry Based Science Education 1 Anno scolastico 2013 2014 Classe I A ottici Modulo: Affonda o galleggia? Agata Conti 2 Sintesi Il modulo offre l'opportunità
DETERMINAZIONE DEL GRADO DI ACIDITÀ DI UN ACETO COMMERCIALE
 DETERMINAZIONE DEL GRADO DI ACIDITÀ DI UN ACETO COMMERCIALE L esperienza consiste nel misurare il grado di acidità di un aceto, acquistando i concetti di titolazione acido-base, punto di equivalenza, indicatore
DETERMINAZIONE DEL GRADO DI ACIDITÀ DI UN ACETO COMMERCIALE L esperienza consiste nel misurare il grado di acidità di un aceto, acquistando i concetti di titolazione acido-base, punto di equivalenza, indicatore
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
Filtrazione semplice con imbuto.
 Filtrazione semplice con imbuto. Se si dispone di carta da filtro in fogli quadrati di 60 cm di lato, occorre tagliarli in 16 parti. Prendere una quadrato di carta da filtro di 15 cm di lato e piegarlo
Filtrazione semplice con imbuto. Se si dispone di carta da filtro in fogli quadrati di 60 cm di lato, occorre tagliarli in 16 parti. Prendere una quadrato di carta da filtro di 15 cm di lato e piegarlo
LA CHIMICA DEGLI ALIMENTI
 Sommario LA CHIMICA DEGLI ALIMENTI LA CHIMICA DEGLI ALIMENTI... 1 RICERCA DELLA VITAMINA C... 2 Metodo Qualitativo... 2 Metodo Quantitativo... 2 RICERCA DEGLI ZUCCHERI... 5 Metodo Qualitativo... 5 Metodo
Sommario LA CHIMICA DEGLI ALIMENTI LA CHIMICA DEGLI ALIMENTI... 1 RICERCA DELLA VITAMINA C... 2 Metodo Qualitativo... 2 Metodo Quantitativo... 2 RICERCA DEGLI ZUCCHERI... 5 Metodo Qualitativo... 5 Metodo
ATTREZZATURA DI LABORATORIO
 ATTREZZATURA DI LABORATORIO IN GENERALE RICORDIAMO CHE 1) il vetro pyrex non reagisce chimicamente con altre sostanze tranne che con l acido fluoridrico se riscaldato non si spacca 2) gli strumenti in
ATTREZZATURA DI LABORATORIO IN GENERALE RICORDIAMO CHE 1) il vetro pyrex non reagisce chimicamente con altre sostanze tranne che con l acido fluoridrico se riscaldato non si spacca 2) gli strumenti in
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Esperienza A: idrofilicità e idrofobicità
 Esperienza A: idrofilicità e idrofobicità Obiettivo: Fare osservare che alcune sostanze, mescolate all'acqua, danno luogo a soluzioni omogenee mentre altre danno miscele eterogenee. Dalla descrizione delle
Esperienza A: idrofilicità e idrofobicità Obiettivo: Fare osservare che alcune sostanze, mescolate all'acqua, danno luogo a soluzioni omogenee mentre altre danno miscele eterogenee. Dalla descrizione delle
GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce)
 GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce) I MINERALI I minerali sono sostanze solide omogenee, inorganiche, esprimibili mediante
GEOLOGIA (studio della litosfera) Essa si divide in MINERALOGIA (studio dei minerali) e PETROGRAFIA ( studio delle rocce) I MINERALI I minerali sono sostanze solide omogenee, inorganiche, esprimibili mediante
TECNICHE DI BASE PER LA SEPARAZIONE DEI COMPONENTI DI UNA MISCELA
 TECNICHE DI BASE PER LA SEPARAZIONE DEI COMPONENTI DI UNA MISCELA CENTRIFUGAZIONE La centrifugazione è un processo che permette di separare una fase solida immiscibile da una fase liquida o due liquidi
TECNICHE DI BASE PER LA SEPARAZIONE DEI COMPONENTI DI UNA MISCELA CENTRIFUGAZIONE La centrifugazione è un processo che permette di separare una fase solida immiscibile da una fase liquida o due liquidi
LE SOLUZIONI 1.molarità
 LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE
 SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE 1 STADIO Identificazione e definizione delle soluzioni Obiettivo : il bambino, attraverso un approccio fenomenologico, impara il concetto di SOLUZIONE
SOLUZIONI E MISCUGLI PERCORSO PER LA SCUOLA ELEMENTARE 1 STADIO Identificazione e definizione delle soluzioni Obiettivo : il bambino, attraverso un approccio fenomenologico, impara il concetto di SOLUZIONE
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI
 TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
TAVOLA DI PROGRAMMAZIONE PER GRUPPI DIDATTICI MATERIA: CHIMICA CLASSI: PRIME I II QUADRIMESTRE Competenze Abilità/Capacità Conoscenze* Attività didattica Strumenti Tipologia verifiche Osservare, descrivere
Pb Pb 2+ + 2e 2Ag + + 2e 2Ag
 ELETTROCHIMICA OBIETTIVO DELL ESPERIENZA: conoscere i fenomeni elettrici che si basano su trasformazioni chimiche che avvengono tramite l energia elettrica. Principio teorico: l elettrochimica studia quelle
ELETTROCHIMICA OBIETTIVO DELL ESPERIENZA: conoscere i fenomeni elettrici che si basano su trasformazioni chimiche che avvengono tramite l energia elettrica. Principio teorico: l elettrochimica studia quelle
Esercizi di Chimica (2 a prova in itinere)
 Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
Esercizi di Chimica (2 a prova in itinere) 3) Calcolare la normalità (N) di una soluzione ottenuta sciogliendo 3,5 g di H 3 PO 4 in 900 ml di acqua [0,119 N] 4) Quanti grammi di soluto sono contenuti in
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it
 LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
LA CORRENTE ELETTRICA Prof. Erasmo Modica erasmo@galois.it L INTENSITÀ DELLA CORRENTE ELETTRICA Consideriamo una lampadina inserita in un circuito elettrico costituito da fili metallici ed un interruttore.
DETERMINAZIONE DELL INTERVALLO DI VIRAGGIO DI ALCUNI INDICATORI ACIDO-BASE: Intervallo di viraggio ph
 CLASSE 2 A ocb 22/11/2009 1 DETERMINAZIONE DELL INTERVALLO DI VIRAGGIO DI ALCUNI INDICATORI ACIDO-BASE: Principi Teorici: gli indicatori acido-base sono sostanze organiche complesse, che si comportano
CLASSE 2 A ocb 22/11/2009 1 DETERMINAZIONE DELL INTERVALLO DI VIRAGGIO DI ALCUNI INDICATORI ACIDO-BASE: Principi Teorici: gli indicatori acido-base sono sostanze organiche complesse, che si comportano
Distinguere grandezze, unità di misura, strumenti di misura.
 L A 145 ATTIVITÀ 1 Distinguere grandezze, unità di misura, strumenti di misura. Il tuo libro di scienze; strumenti di misura e non di misura forniti dal tuo insegnante. Osserva il tuo libro di scienze
L A 145 ATTIVITÀ 1 Distinguere grandezze, unità di misura, strumenti di misura. Il tuo libro di scienze; strumenti di misura e non di misura forniti dal tuo insegnante. Osserva il tuo libro di scienze
Inizia presentazione
 Inizia presentazione Che si misura in ampère può essere generata In simboli A da pile dal movimento di spire conduttrici all interno di campi magnetici come per esempio nelle dinamo e negli alternatori
Inizia presentazione Che si misura in ampère può essere generata In simboli A da pile dal movimento di spire conduttrici all interno di campi magnetici come per esempio nelle dinamo e negli alternatori
Corrente elettrica. Esempio LA CORRENTE ELETTRICA CONTINUA. Cos è la corrente elettrica? Definizione di intensità di corrente elettrica
 Corrente elettrica LA CORRENTE ELETTRICA CONTINUA Cos è la corrente elettrica? La corrente elettrica è un flusso di elettroni che si spostano dentro un conduttore dal polo negativo verso il polo positivo
Corrente elettrica LA CORRENTE ELETTRICA CONTINUA Cos è la corrente elettrica? La corrente elettrica è un flusso di elettroni che si spostano dentro un conduttore dal polo negativo verso il polo positivo
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
1 a esperienza: il lievito produce anidride carbonica in presenza di zucchero
 1 a esperienza: il lievito produce anidride carbonica in presenza di zucchero DOMANDA DESTINATARI MATERIALE OCCORRENTE DESCRIZIONE DELL ESPERIMENTO La formazione di gas avviene in assenza di zucchero?
1 a esperienza: il lievito produce anidride carbonica in presenza di zucchero DOMANDA DESTINATARI MATERIALE OCCORRENTE DESCRIZIONE DELL ESPERIMENTO La formazione di gas avviene in assenza di zucchero?
CORRENTE E TENSIONE ELETTRICA LA CORRENTE ELETTRICA
 CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
LA LEGGE DI GRAVITAZIONE UNIVERSALE
 GRAVIMETRIA LA LEGGE DI GRAVITAZIONE UNIVERSALE r La legge di gravitazione universale, formulata da Isaac Newton nel 1666 e pubblicata nel 1684, afferma che l'attrazione gravitazionale tra due corpi è
GRAVIMETRIA LA LEGGE DI GRAVITAZIONE UNIVERSALE r La legge di gravitazione universale, formulata da Isaac Newton nel 1666 e pubblicata nel 1684, afferma che l'attrazione gravitazionale tra due corpi è
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
La candela accesa. Descrizione generale. Obiettivi. Sequenza didattica e metodo di lavoro. Esperimenti sulla crescita delle piante
 Esperimenti sulla crescita delle piante unità didattica 1 La candela accesa Durata 60 minuti Materiali per ciascun gruppo - 1 candela - 1 vaso di vetro - 1 cronometro - 1 cannuccia - fiammiferi - 1 pezzo
Esperimenti sulla crescita delle piante unità didattica 1 La candela accesa Durata 60 minuti Materiali per ciascun gruppo - 1 candela - 1 vaso di vetro - 1 cronometro - 1 cannuccia - fiammiferi - 1 pezzo
DAI MISCUGLI ALLE SOSTANZE PURE
 Come si presenta la materia? DAI MISCUGLI ALLE SOSTANZE PURE Il criterio per distinguere i materiali è la presenza di una o più FASI porzioni di materia fisicamente distinte tra loro delimitate da nette
Come si presenta la materia? DAI MISCUGLI ALLE SOSTANZE PURE Il criterio per distinguere i materiali è la presenza di una o più FASI porzioni di materia fisicamente distinte tra loro delimitate da nette
TECNOLOGIE CHIMICHE INDUSTRIALI, PRINCIPI DI AUTOMAZIONE E DI ORGANIZZAZIONE INDUSTRIALE
 PROGRAMMAZIONE DI LABORATORIO DI: TECNOLOGIE CHIMICHE INDUSTRIALI, PRINCIPI DI AUTOMAZIONE E DI ORGANIZZAZIONE INDUSTRIALE allegato 1 Prove meccaniche presso il laboratorio di edilizia Esperienza: Determinazione
PROGRAMMAZIONE DI LABORATORIO DI: TECNOLOGIE CHIMICHE INDUSTRIALI, PRINCIPI DI AUTOMAZIONE E DI ORGANIZZAZIONE INDUSTRIALE allegato 1 Prove meccaniche presso il laboratorio di edilizia Esperienza: Determinazione
LA CORRENTE ELETTRICA CONTINUA
 LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
LA CORRENTE ELETTRICA CONTINUA (Fenomeno, indipendente dal tempo, che si osserva nei corpi conduttori quando le cariche elettriche fluiscono in essi.) Un conduttore metallico è in equilibrio elettrostatico
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Capitolo 2 Le trasformazioni fisiche della materia
 Capitolo 2 Le trasformazioni fisiche della materia 1.Gli stati fisici della materia 2.I sistemi omogenei e i sistemi eterogenei 3.Le sostanze pure e i miscugli 4.I passaggi di stato 5. la teoria particellare
Capitolo 2 Le trasformazioni fisiche della materia 1.Gli stati fisici della materia 2.I sistemi omogenei e i sistemi eterogenei 3.Le sostanze pure e i miscugli 4.I passaggi di stato 5. la teoria particellare
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
Estrazione del DNA. 1. Introduzione
 Estrazione del DNA 1. Introduzione L obiettivo di questa esperienza è quello di osservare la molecola degli acidi nucleici, una volta separata dall involucro cellulare in cui è contenuta all interno della
Estrazione del DNA 1. Introduzione L obiettivo di questa esperienza è quello di osservare la molecola degli acidi nucleici, una volta separata dall involucro cellulare in cui è contenuta all interno della
P.D 4 Acqua come solvente P.D 4A Miscugli e separazione di miscugli Schede esperimenti Scuola secondaria di primo grado
 P.D 4 Acqua come solvente P.D 4A Miscugli e separazione di miscugli Schede esperimenti Scuola secondaria di primo grado ESPERIENZA: LE SOLUZIONI 3 bicchierini di plastica trasparenti sale zucchero Riempiamo
P.D 4 Acqua come solvente P.D 4A Miscugli e separazione di miscugli Schede esperimenti Scuola secondaria di primo grado ESPERIENZA: LE SOLUZIONI 3 bicchierini di plastica trasparenti sale zucchero Riempiamo
Il bilanciamento delle reazioni chimiche
 1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
1 Il bilanciamento delle reazioni chimiche Avete visto che gli atomi hanno diversi modi di unirsi l uno all altro. Si può anche iniziare a capire che una reazione chimica non è nient altro che un cambiamento
MISCUGLI E TECNICHE DI SEPARAZIONE
 MISCUGLI E TECNICHE DI SEPARAZIONE Classe 1^A Grafico Questo documento è solo una presentazione e non deve ritenersi completo se non è accompagnato dalla lezione in classe. Prof. Zarini Marta CLASSIFICAZIONE
MISCUGLI E TECNICHE DI SEPARAZIONE Classe 1^A Grafico Questo documento è solo una presentazione e non deve ritenersi completo se non è accompagnato dalla lezione in classe. Prof. Zarini Marta CLASSIFICAZIONE
Siamo così arrivati all aritmetica modulare, ma anche a individuare alcuni aspetti di come funziona l aritmetica del calcolatore come vedremo.
 DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
Tesina di scienze. L Elettricità. Le forze elettriche
 Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Tesina di scienze L Elettricità Le forze elettriche In natura esistono due forme di elettricità: quella negativa e quella positiva. Queste due energie si attraggono fra loro, mentre gli stessi tipi di
Cromatografia. Separazione dei componenti di una miscela di Inchiostri con un unico solvente
 CROMATOGRAFIA INCHIOSTRI DIVERSI con UNICO SOLVENTE INCHIOSTRO con SOLVENTI DIVERSI ESTRATTI VEGETALI Cromatografia La cromatografia (letteralmente "scrittura con il colore") è una tecnica di separazione
CROMATOGRAFIA INCHIOSTRI DIVERSI con UNICO SOLVENTE INCHIOSTRO con SOLVENTI DIVERSI ESTRATTI VEGETALI Cromatografia La cromatografia (letteralmente "scrittura con il colore") è una tecnica di separazione
Appunti sul galleggiamento
 Appunti sul galleggiamento Prof.sa Enrica Giordano Corso di Didattica della fisica 1B a.a. 2006/7 Ad uso esclusivo degli studenti frequentanti, non diffondere senza l autorizzazione della professoressa
Appunti sul galleggiamento Prof.sa Enrica Giordano Corso di Didattica della fisica 1B a.a. 2006/7 Ad uso esclusivo degli studenti frequentanti, non diffondere senza l autorizzazione della professoressa
Parte Seconda La Misura
 Il procedimento di misura è uno dei procedimenti fondamentali della conoscenza scientifica in quanto consente di descrivere quantitativamente una proprietà di un oggetto o una caratteristica di un fenomeno.
Il procedimento di misura è uno dei procedimenti fondamentali della conoscenza scientifica in quanto consente di descrivere quantitativamente una proprietà di un oggetto o una caratteristica di un fenomeno.
CHIMICA. Una teoria è scientifica solo se è falsificabile (cioè se è possibile sperimentalmente smentire le sue previsioni)
 CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
CHIMICA SCIENZA SPERIMENTALE: cioè si basa sul metodo sperimentale (Galileo è il precursore). Osservazione dei fenomeni (raccolta e interpretazioni dati) Formulazione ipotesi Verifica sperimentale (eventualmente
MPT Capitolo 12 Redox. Le ossidoriduzioni. Obiettivo. Definizioni di ossidazione e di riduzione
 1 Le ossidoriduzioni Obiettivo In questo capitolo svilupperemo i concetti fondamentali delle reazioni di ossido-riduzione. Si tratta di conoscenze fondamentali sia per la vita comune, sia, per molti di
1 Le ossidoriduzioni Obiettivo In questo capitolo svilupperemo i concetti fondamentali delle reazioni di ossido-riduzione. Si tratta di conoscenze fondamentali sia per la vita comune, sia, per molti di
LABORATORIO DI FISICA
 LABORATORIO DI FISICA 01.12.2014 Relazione: Davide Nali, Antonia Marongiu, Anna Buonocore, Valentina Atzori, Maria Sofia Piredda, Giulia Ghiani, Anna Maria Pala TITOLO: NON LASCIARMI AFFONDARE OBIETTIVO:
LABORATORIO DI FISICA 01.12.2014 Relazione: Davide Nali, Antonia Marongiu, Anna Buonocore, Valentina Atzori, Maria Sofia Piredda, Giulia Ghiani, Anna Maria Pala TITOLO: NON LASCIARMI AFFONDARE OBIETTIVO:
MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI
 MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI La materia è tutto ciò che ha una massa, energia e occupa spazio, cioè ha un volume; essa si classifica in base alla sua composizione chimica ed in
MODULO 3 - LA MATERIA: COMPOSIZIONE E TRASFORMAZIONI La materia è tutto ciò che ha una massa, energia e occupa spazio, cioè ha un volume; essa si classifica in base alla sua composizione chimica ed in
All interno dei colori primari e secondari, abbiamo tre coppie di colori detti COMPLEMENTARI.
 Teoria del colore La teoria dei colori Gli oggetti e gli ambienti che ci circondano sono in gran parte colorati. Ciò dipende dal fatto che la luce si diffonde attraverso onde di diversa lunghezza: ad ogni
Teoria del colore La teoria dei colori Gli oggetti e gli ambienti che ci circondano sono in gran parte colorati. Ciò dipende dal fatto che la luce si diffonde attraverso onde di diversa lunghezza: ad ogni
bicchieri di varia dimensione con un beccuccio per facilitare i travasi.
 Per contenere, prelevare e travasare liquidi e altre sostanze è indispensabile utilizzare strumenti di vetro che consentono un facile controllo visivo, si puliscono facilmente e non si corrodono. Per i
Per contenere, prelevare e travasare liquidi e altre sostanze è indispensabile utilizzare strumenti di vetro che consentono un facile controllo visivo, si puliscono facilmente e non si corrodono. Per i
Modulo didattico sulla misura di grandezze fisiche: la lunghezza
 Modulo didattico sulla misura di grandezze fisiche: la lunghezza Lezione 1: Cosa significa confrontare due lunghezze? Attività n 1 DOMANDA N 1 : Nel vostro gruppo qual è la matita più lunga? DOMANDA N
Modulo didattico sulla misura di grandezze fisiche: la lunghezza Lezione 1: Cosa significa confrontare due lunghezze? Attività n 1 DOMANDA N 1 : Nel vostro gruppo qual è la matita più lunga? DOMANDA N
IL CUORE NORMALE. La sua circolazione e il suo sviluppo
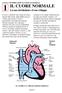 CAPITOLO THE NORMAL HEART: Its circulation and development 1 IL CUORE NORMALE La sua circolazione e il suo sviluppo Il cuore e i polmoni sono situati nel torace, protetti dallo sterno, dalla gabbia toracica
CAPITOLO THE NORMAL HEART: Its circulation and development 1 IL CUORE NORMALE La sua circolazione e il suo sviluppo Il cuore e i polmoni sono situati nel torace, protetti dallo sterno, dalla gabbia toracica
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ
 Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ Che cos è la corrente elettrica? Nei conduttori metallici la corrente è un flusso di elettroni. L intensità della corrente è il rapporto tra la quantità
Visione d insieme DOMANDE E RISPOSTE SULL UNITÀ Che cos è la corrente elettrica? Nei conduttori metallici la corrente è un flusso di elettroni. L intensità della corrente è il rapporto tra la quantità
FUNZIONAMENTO DI CUORE E CORONARIE
 Lega Friulana per il Cuore FUNZIONAMENTO DI CUORE E CORONARIE Materiale predisposto dal dott. Diego Vanuzzo, Centro di Prevenzione Cardiovascolare, Udine a nome del Comitato Tecnico-Scientifico della Lega
Lega Friulana per il Cuore FUNZIONAMENTO DI CUORE E CORONARIE Materiale predisposto dal dott. Diego Vanuzzo, Centro di Prevenzione Cardiovascolare, Udine a nome del Comitato Tecnico-Scientifico della Lega
Verifica sperimentale della legge di Proust delle proporzioni costanti
 Verifica sperimentale della legge di Proust delle proporzioni costanti Un lavoro degli studenti della classe 4B del Liceo Scientifico Ernesto Balducci di Pontassieve Gli scienziati francesi Antoine Lavoisier
Verifica sperimentale della legge di Proust delle proporzioni costanti Un lavoro degli studenti della classe 4B del Liceo Scientifico Ernesto Balducci di Pontassieve Gli scienziati francesi Antoine Lavoisier
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI
 DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
DETERMINAZIONE DEL PUNTO DI FINE TITOLAZIONE MEDIANTE METODI CHIMICO-FISICI - si sfrutta una proprietà chimico-fisica o fisica che varia nel corso della titolazione - tale proprietà è in genere proporzionale
I CIRCUITI ELETTRICI. Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi.
 I CIRCUITI ELETTRICI Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi. Definiamo ramo un tratto di circuito senza diramazioni (tratto evidenziato in rosso nella
I CIRCUITI ELETTRICI Prima di tutto occorre mettersi d accordo anche sui nomi di alcune parti dei circuiti stessi. Definiamo ramo un tratto di circuito senza diramazioni (tratto evidenziato in rosso nella
LEZIONE 12. Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA. Scaricato da Sunhope.it
 LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
LEZIONE 12 Idrolisi salina Indicatori di ph Soluzioni tampone Titolazioni acido-base IDROLISI SALINA Idrolisi salina Per IDROLISI SALINA si intende il fenomeno per il quale la dissoluzione in acqua di
La percentuale massa/volume (%m/v) indica la quantità di soluto espressa in grammi presente in 100 ml di soluzione.
 La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
La concentrazione delle soluzioni Le soluzioni sono costituite da quantità molto variabili dei loro componenti: se vogliamo fornire una indicazione precisa circa la loro composizione, è importante conoscere
SEMPLICEMENTE ACQUA. Museo Scienze Naturali Bergamo
 SEMPLICEMENTE ACQUA Museo Scienze Naturali Bergamo L ACIDITA Prendete i contenitori riempiti con varie sostanze di uso comune e provate a metterli in fila a partire dalla sostanza secondo voi più acida
SEMPLICEMENTE ACQUA Museo Scienze Naturali Bergamo L ACIDITA Prendete i contenitori riempiti con varie sostanze di uso comune e provate a metterli in fila a partire dalla sostanza secondo voi più acida
a 25 C da cui si ricava che:
 Equilibrio di autoionizzazione dell acqua Come già osservato l acqua presenta caratteristiche anfotere, potendosi comportare tanto da acido (con una sostanza meno acida che si comporta da base) quanto
Equilibrio di autoionizzazione dell acqua Come già osservato l acqua presenta caratteristiche anfotere, potendosi comportare tanto da acido (con una sostanza meno acida che si comporta da base) quanto
Elettrolisi del solfato di rame
 Elettrolisi del solfato di rame Calcolo dell equivalente equivalente elettrochimico del rame Calcolo del valore della carica elementare Un po di storia 1800 - Invenzione della pila di Volta 1807 - Davy,,
Elettrolisi del solfato di rame Calcolo dell equivalente equivalente elettrochimico del rame Calcolo del valore della carica elementare Un po di storia 1800 - Invenzione della pila di Volta 1807 - Davy,,
POLARITÀ DELLE SOSTANZE
 POLARITÀ DELLE SOSTANZE I liquidi si distinguono in polari e non polari. Obiettivo dell esperimento è controllare la polarità dei liquidi mediante bacchette caricate positivamente o negativamente. H2O
POLARITÀ DELLE SOSTANZE I liquidi si distinguono in polari e non polari. Obiettivo dell esperimento è controllare la polarità dei liquidi mediante bacchette caricate positivamente o negativamente. H2O
1. LE GRANDEZZE FISICHE
 1. LE GRANDEZZE FISICHE La fisica (dal greco physis, natura ) è una scienza che ha come scopo guardare, descrivere e tentare di comprendere il mondo che ci circonda. La fisica si propone di descrivere
1. LE GRANDEZZE FISICHE La fisica (dal greco physis, natura ) è una scienza che ha come scopo guardare, descrivere e tentare di comprendere il mondo che ci circonda. La fisica si propone di descrivere
Acqua azzurra, acqua chiara. Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao
 Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
Acqua azzurra, acqua chiara Istituto Comprensivo della Galilla Scuola Media Dessì - Ballao Proprietà fisiche Ecosistemi acquatici Origine della vita Ciclo dell acqua Acqua Scoperte Sensazioni Leggi La
DIPARTIMENTO DI SCIENZE INTEGRATE CHIMICA FISICA SCIENZE DELLA TERRA - BIOLOGIA
 IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
IISS A. De Pace Lecce A.S. 2012-2013 DIPARTIMENTO DI SCIENZE INTEGRATE FISICA SCIENZE DELLA TERRA - BIOLOGIA PIANI DI STUDIO DELLE DISCIPLINE SECONDO ANNO Piano di studi della disciplina DESCRIZIONE Lo
SCIENZE. Il Sistema Circolatorio. Chi sono? il testo:
 01 Chi sono? Uno è piccolo come una mosca, l altro è grande come un giocatore di basket, ma in tutti gli esseri viventi il cibo che essi mangiano (assorbono) e l aria (ossigeno) che respirano devono andare
01 Chi sono? Uno è piccolo come una mosca, l altro è grande come un giocatore di basket, ma in tutti gli esseri viventi il cibo che essi mangiano (assorbono) e l aria (ossigeno) che respirano devono andare
f(x) = 1 x. Il dominio di questa funzione è il sottoinsieme proprio di R dato da
 Data una funzione reale f di variabile reale x, definita su un sottoinsieme proprio D f di R (con questo voglio dire che il dominio di f è un sottoinsieme di R che non coincide con tutto R), ci si chiede
Data una funzione reale f di variabile reale x, definita su un sottoinsieme proprio D f di R (con questo voglio dire che il dominio di f è un sottoinsieme di R che non coincide con tutto R), ci si chiede
Prove associate al percorso INVESTIGAZIONI SUL MODELLO PARTICELLARE
 Titolo: Prove associate al percorso INVESTIGAZIONI SUL MODELLO PARTICELLARE Autore: Elisabetta Caroti Percorsi didattici associati: 1. Investigazioni sul modello particellare AVVERTENZA: Le domande che
Titolo: Prove associate al percorso INVESTIGAZIONI SUL MODELLO PARTICELLARE Autore: Elisabetta Caroti Percorsi didattici associati: 1. Investigazioni sul modello particellare AVVERTENZA: Le domande che
Universita Degli Studi Di Roma La Sapienza Corso di Laurea Magistrale in Scienze e Tecnologie per la conservazione dei Beni Culturali A.A.
 Universita Degli Studi Di Roma La Sapienza Corso di Laurea Magistrale in Scienze e Tecnologie per la conservazione dei Beni Culturali A.A. 2011-2012 Esame di: Laboratorio di Chimica del Restauro PhD M.P.
Universita Degli Studi Di Roma La Sapienza Corso di Laurea Magistrale in Scienze e Tecnologie per la conservazione dei Beni Culturali A.A. 2011-2012 Esame di: Laboratorio di Chimica del Restauro PhD M.P.
Esperimenti Informazioni per il PD
 Informazioni per il PD 1/7 Compito Gli alunni conducono degli esperimenti con il sale avendo così la possibilità di studiarlo in quanto composto chimico. Grazie ai vari esperimenti imparano anche quali
Informazioni per il PD 1/7 Compito Gli alunni conducono degli esperimenti con il sale avendo così la possibilità di studiarlo in quanto composto chimico. Grazie ai vari esperimenti imparano anche quali
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Classe 3 D Bucci Arianna Evangelista Andrea Palombo Leonardo Ricci Alessia Progetto di Scienze a.s. 2013/2014. Prof.ssa Piacentini Veronica
 Classe 3 D Bucci Arianna Evangelista Andrea Palombo Leonardo Ricci Alessia Progetto di Scienze a.s. 2013/2014 Prof.ssa Piacentini Veronica La corrente elettrica La corrente elettrica è un flusso di elettroni
Classe 3 D Bucci Arianna Evangelista Andrea Palombo Leonardo Ricci Alessia Progetto di Scienze a.s. 2013/2014 Prof.ssa Piacentini Veronica La corrente elettrica La corrente elettrica è un flusso di elettroni
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
USO DI EXCEL CLASSE PRIMAI
 USO DI EXCEL CLASSE PRIMAI In queste lezioni impareremo ad usare i fogli di calcolo EXCEL per l elaborazione statistica dei dati, per esempio, di un esperienza di laboratorio. Verrà nel seguito spiegato:
USO DI EXCEL CLASSE PRIMAI In queste lezioni impareremo ad usare i fogli di calcolo EXCEL per l elaborazione statistica dei dati, per esempio, di un esperienza di laboratorio. Verrà nel seguito spiegato:
Forze come grandezze vettoriali
 Forze come grandezze vettoriali L. Paolucci 23 novembre 2010 Sommario Esercizi e problemi risolti. Per la classe prima. Anno Scolastico 2010/11 Parte 1 / versione 2 Si ricordi che la risultante di due
Forze come grandezze vettoriali L. Paolucci 23 novembre 2010 Sommario Esercizi e problemi risolti. Per la classe prima. Anno Scolastico 2010/11 Parte 1 / versione 2 Si ricordi che la risultante di due
lo 2 2-1 - PERSONALIZZARE LA FINESTRA DI WORD 2000
 Capittol lo 2 Visualizzazione 2-1 - PERSONALIZZARE LA FINESTRA DI WORD 2000 Nel primo capitolo sono state analizzate le diverse componenti della finestra di Word 2000: barra del titolo, barra dei menu,
Capittol lo 2 Visualizzazione 2-1 - PERSONALIZZARE LA FINESTRA DI WORD 2000 Nel primo capitolo sono state analizzate le diverse componenti della finestra di Word 2000: barra del titolo, barra dei menu,
LEZIONE 1. Materia: Proprietà e Misura
 LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
LEZIONE 1 Materia: Proprietà e Misura MISCELE, COMPOSTI, ELEMENTI SOSTANZE PURE E MISCUGLI La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola
ESERCITAZIONI DI BIOLOGIA
 CORSO DI LAUREA IN SCIENZE DELLA FORMAZIONE PRIMARIA ESERCITAZIONI DI BIOLOGIA Lezione quinta parte Dott.ssa Annamaria Fiarè Gli oggetti che si osservano al MICROSCOPIO OTTICO sono generalmente trasparenti
CORSO DI LAUREA IN SCIENZE DELLA FORMAZIONE PRIMARIA ESERCITAZIONI DI BIOLOGIA Lezione quinta parte Dott.ssa Annamaria Fiarè Gli oggetti che si osservano al MICROSCOPIO OTTICO sono generalmente trasparenti
Pressione. Esempio. Definizione di pressione. Legge di Stevino. Pressione nei fluidi EQUILIBRIO E CONSERVAZIONE DELL ENERGIA NEI FLUIDI
 Pressione EQUILIBRIO E CONSERVAZIONE DELL ENERGIA NEI FLUIDI Cos è la pressione? La pressione è una grandezza che lega tra di loro l intensità della forza e l aerea della superficie su cui viene esercitata
Pressione EQUILIBRIO E CONSERVAZIONE DELL ENERGIA NEI FLUIDI Cos è la pressione? La pressione è una grandezza che lega tra di loro l intensità della forza e l aerea della superficie su cui viene esercitata
V= R*I. LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro.
 LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
Storia dei generatori di tensione e della corrente elettrica
 Storia dei generatori di tensione e della corrente elettrica Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia 1778 Alessandro Volta, in analogia al potenziale gravitazionale definito
Storia dei generatori di tensione e della corrente elettrica Prof. Daniele Ippolito Liceo Scientifico Amedeo di Savoia di Pistoia 1778 Alessandro Volta, in analogia al potenziale gravitazionale definito
Samuele Di Rita - Classe 2 B sa - 16/03/2015 - Gruppo 5: Di Rita, Dal Maso
 Samuele Di Rita - Classe 2 B sa - 16/03/2015 - Gruppo 5: Di Rita, Dal Maso SAGGI ANALITICI SU ALIMENTI CONTENENTI CARBOIDRATI OBIETTIVI Fase 1: Dimostrare, mediante l uso del distillato di Fehling, se
Samuele Di Rita - Classe 2 B sa - 16/03/2015 - Gruppo 5: Di Rita, Dal Maso SAGGI ANALITICI SU ALIMENTI CONTENENTI CARBOIDRATI OBIETTIVI Fase 1: Dimostrare, mediante l uso del distillato di Fehling, se
Concetti fondamentali su acidità e basicità delle soluzioni acquose
 Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
Concetti fondamentali su acidità e basicità delle soluzioni acquose Le molecole H 2 O dell acqua liquida pura possono andare incontro a dissociazione. Il processo può essere descritto come una reazione
LEZIONI N 24 E 25 UNIONI SALDATE
 LEZIONI N 24 E 25 UNIONI SALDATE Le saldature si realizzano prevalentemente con il metodo dell arco elettrico, utilizzando elettrodi rivestiti, che forniscono il materiale di apporto. Il collegamento è
LEZIONI N 24 E 25 UNIONI SALDATE Le saldature si realizzano prevalentemente con il metodo dell arco elettrico, utilizzando elettrodi rivestiti, che forniscono il materiale di apporto. Il collegamento è
Ripasso pre-requisiti di scienze per gli studenti che si iscrivono alle classi prime
 Ripasso pre-requisiti di scienze per gli studenti che si iscrivono alle classi prime Per seguire proficuamente i corsi di scienze della scuola superiore devi conoscere alcune definizioni e concetti di
Ripasso pre-requisiti di scienze per gli studenti che si iscrivono alle classi prime Per seguire proficuamente i corsi di scienze della scuola superiore devi conoscere alcune definizioni e concetti di
