MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 2. Riassunto delle caratteristiche del prodotto
|
|
|
- Alessandro Durante
- 6 anni fa
- Visualizzazioni
Transcript
1 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 2 Riassunto delle caratteristiche del prodotto
2 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 3 1. DENOMINAZIONE DEL MEDICINALE MabThera 100 mg (10 mg/ml) concentrato per soluzione per infusione. MabThera 500 mg (10 mg/ml) concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni soluzione contiene 10 mg/ml di rituximab. Ogni flaconcino monouso contenente 100 mg di rituximab. Ogni flaconcino monouso contenente 500 mg di rituximab. Il rituximab è un anticorpo monoclonale chimerico murino/umano ottenuto con tecniche di ingegneria genetica, costituito da una immunoglobulina glicosilata con le regioni costanti IgG1 di origine umana e con le sequenze della regione variabile della catena leggera e della catena pesante di origine murina. L anticorpo viene prodotto utilizzando una coltura di cellule di mammifero in sospensione (ovariche di Hamster Cinese) e purificato con cromatografia affine e scambio ionico, incluse procedure specifiche di inattivazione e rimozione virale. Per l elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA Concentrato per soluzione per infusione. Liquido limpido e incolore. 4. INFORMAZIONI CLINICHE 4.1 Indicazioni terapeutiche Linfoma non-hodgkin (LNH) MabThera è indicato per il trattamento di pazienti affetti da linfoma follicolare in III-IV stadio precedentemente non trattati, in associazione a chemioterapia. La terapia di mantenimento con MabThera è indicata per pazienti con linfoma follicolare ricaduto/ refrattario che rispondono a terapia di induzione con chemioterapia con o senza MabThera. MabThera in monoterapia è indicato per il trattamento di pazienti con linfoma follicolare in III-IV stadio che sono chemioresistenti o sono in seconda o successiva ricaduta dopo chemioterapia. MabThera è indicato per il trattamento di pazienti affetti da linfoma non-hodgkin, CD20 positivo, diffuso a grandi cellule B, in associazione a chemioterapia CHOP (ciclofosfamide, doxorubicina, vincristina, prednisolone). Leucemia linfatica cronica (LLC) MabThera in associazione a chemioterapia è indicato per il trattamento di pazienti con leucemia linfatica cronica precedentemente non trattata e recidiva/refrattaria. Sono disponibili solo dati limitati sull efficacia e la sicurezza per pazienti precedentemente trattati con anticorpi monoclonali, incluso MabThera, o per pazienti refrattari a un trattamento precedente con MabThera più chemioterapia. Vedere paragrafo 5.1 per ulteriori informazioni. Artrite reumatoide MabThera in associazione a metotressato è indicato per il trattamento dell artrite reumatoide attiva di grado grave in pazienti adulti che hanno mostrato un inadeguata risposta o un intolleranza ad altri farmaci antireumatici modificanti la malattia (DMARD), comprendenti uno o più inibitori del fattore di necrosi tumorale (TNF). 4.2 Posologia e modo di somministrazione Le infusioni di MabThera devono essere somministrate sotto lo stretto controllo di un medico esperto e in un ambiente con immediata disponibilità di apparecchiature per la rianimazione. Posologia Linfoma non-hodgkin Aggiustamenti del dosaggio durante il trattamento Non sono raccomandate riduzioni della dose di MabThera. Quando MabThera è somministrato in
3 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 4 Riassunto delle caratteristiche del prodotto associazione con chemioterapia, si devono applicare le riduzioni standard del dosaggio per i medicinali chemioterapici. Linfoma non-hodgkin follicolare Terapia di associazione La dose raccomandata di MabThera in associazione con chemioterapia per il trattamento di induzione di pazienti con LNH follicolare precedentemente non trattati o ricaduti/refrattari è di 375 mg/m 2 di superficie corporea per ciclo, fino a 8 cicli. MabThera deve essere somministrato il giorno 1 di ogni ciclo di chemioterapia, dopo somministrazione e.v. della componente glucocorticoidea della chemioterapia, se applicabile. Monoterapia/Mantenimento La dose raccomandata di MabThera usata come trattamento di mantenimento per pazienti con LNH follicolare ricaduto/resistente che hanno risposto al trattamento di induzione con chemioterapia, con o senza MabThera, è di 375 mg/m 2 di superficie corporea una volta ogni 3 mesi fino alla progressione della malattia o per un periodo massimo di due anni. La dose raccomandata di MabThera in monoterapia usata come trattamento di induzione per pazienti adulti con linfoma follicolare allo stadio III-IV che sono chemioresistenti o che sono alla seconda o successiva ricaduta dopo chemioterapia è di 375 mg/m 2 di superficie corporea, somministrata come infusione e.v. una volta alla settimana per quattro settimane. Per il ritrattamento con MabThera in monoterapia per pazienti che hanno risposto al precedente trattamento con MabThera in monoterapia per LNH follicolare ricaduto/refrattario, la dose raccomandata è di 375 mg/m 2 di superficie corporea, somministrata come infusione endovenosa una volta alla settimana per quattro settimane (vedere paragrafo 5.1). Linfoma non-hodgkin diffuso a grandi cellule B MabThera deve essere impiegato in associazione a chemioterapia CHOP. Il dosaggio raccomandato è di 375 mg/m 2 di superficie corporea, somministrato il giorno 1 di ogni ciclo di chemioterapia per 8 cicli dopo infusione endovenosa della componente glucocorticoidea del CHOP. Non sono ancora state stabilite la sicurezza e l efficacia di MabThera in associazione ad altre chemioterapie nel linfoma non- Hodgkin diffuso a grandi cellule B. Leucemia linfatica cronica Per i pazienti con LLC si raccomanda la profilassi con adeguata idratazione e somministrazione di uricostatici con inizio 48 ore prima dell inizio della terapia per ridurre il rischio di sindrome da lisi tumorale. Per i pazienti con LLC la cui conta dei linfociti è > 25 x 10 9 /l si raccomanda di somministrare prednisone/prednisolone 100 mg per via endovenosa immediatamente prima dell infusione di MabThera per diminuire la percentuale e la gravità delle reazioni acute da infusione e/o la sindrome da rilascio di citochine. Il dosaggio raccomandato di MabThera in associazione a chemioterapia in pazienti precedentemente non trattati e recidivi/refrattari è di 375 mg/m 2 di superficie corporea somministrato il giorno 0 del primo ciclo di trattamento seguito da 500 mg/m 2 di superficie corporea somministrato il giorno 1 di ogni ciclo successivo per 6 cicli totali. La chemioterapia deve essere somministrata dopo infusione di MabThera. Artrite reumatoide Ai pazienti in terapia con MabThera deve essere consegnata la scheda di allerta per il paziente. Un ciclo di MabThera consiste di due infusioni endovenose da 1000 mg ciascuna. Il dosaggio raccomandato di MabThera è di 1000 mg per infusione endovenosa, seguita da una seconda infusione endovenosa di 1000 mg due settimane dopo. L attività della malattia deve essere monitorata regolarmente. Sono disponibili dati clinici limitati relativi alla sicurezza e all efficacia di ulteriori cicli di terapia con MabThera. In una piccola coorte osservazionale, circa 600 pazienti con evidenza di attività persistente di malattia hanno ricevuto 2-5 cicli ripetuti di trattamento 6-12 mesi dopo il ciclo prece-
4 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 5 dente (vedere paragrafi 4.8 e 5.1). In alcuni pazienti dopo il primo ciclo di MabThera si sviluppano anticorpi antichimerici umani (HACA) (vedere paragrafo 5.1). La presenza di HACA può essere associata ad un peggioramento delle rezioni infusionali o allergiche dopo la seconda infusione di cicli successivi. Inoltre, in un caso con HACA, si è osservata la mancata deplezione delle cellule B dopo la somministrazione di ulteriori cicli di terapia. Quindi, il rapporto rischio/beneficio della terapia con MabThera deve essere attentamente valutato prima della somministrazione di cicli successivi di MabThera. Se si considera un ciclo ripetuto di trattamento, esso deve essere somministrato dopo un intervallo di almeno 16 settimane. Una terapia pre-esistente con glucocorticoidi, salicilati, farmaci antinfiammatori non steroidei o analgesici può essere continuata durante il trattamento con MabThera. I pazienti con artrite reumatoide devono ricevere un trattamento con 100 mg di metilprednisolone endovena 30 minuti prima della somministrazione di MabThera al fine di ridurre il tasso e la severità delle reazioni infusionali acute (vedere il modo di somministrazione). Prima infusione di ciascun ciclo La velocità di infusione iniziale consigliata è di 50 mg/h; dopo i primi 30 minuti può essere incrementata di 50 mg/h ogni 30 minuti, fino a raggiungere un massimo di 400 mg/h. Seconda infusione di ciascun ciclo Successive dosi di MabThera possono essere infuse alla velocità iniziale di 100 mg/h ed essere incrementate di 100 mg/h ad intervalli di 30 minuti, fino a raggiungere un massimo di 400 mg/h. Popolazioni particolari Uso pediatrico MabThera non è raccomandato nei bambini e negli adolescenti a causa della mancanza di dati sulla sicurezza e efficacia. Anziani Non è necessaria la modifica del dosaggio in pazienti anziani (di età >65 anni). Modo di somministrazione La premedicazione con glucorticoidi deve essere presa in considerazione se MabThera non è somministrato in associazione con chemioterapia contenente glucocorticoidi per il trattamento dei linfomi non-hodgkin e della leucemia linfatica cronica. La premedicazione che consiste di un antipiretico e di un antistaminico, ad esempio paracetamolo e difenidramina, deve sempre essere somministrata prima di ogni infusione di MabThera. Prima infusione La velocità di infusione iniziale raccomandata è 50 mg/h; dopo i primi 30 minuti, può essere aumentata con incrementi di 50 mg/h ogni 30 minuti, fino a un massimo di 400 mg/h. Successive infusioni Le successive dosi di MabThera possono essere somministrate con una velocità iniziale di 100 mg/h, e si può aumentare di 100 mg/h ad intervalli di 30 minuti, fino a un massimo di 400 mg/h. La soluzione di MabThera preparata deve essere somministrata per infusione endovenosa tramite deflussore dedicato. Non deve essere somministrata come push o bolus endovenoso. I pazienti devono essere attentamente monitorati per l insorgenza della sindrome da rilascio di citochine (vedere paragrafo 4.4). Ai pazienti che sviluppano reazioni gravi, soprattutto grave dispnea, broncospasmo o ipossia, deve essere immediatamente interrotta l infusione. I pazienti con linfoma non-hodgkin devono poi essere valutati per la presenza di sindrome da lisi tumorale tramite l effettuazione di idonei esami di laboratorio e per la presenza di infiltrazione polmonare tramite radiografia del torace. In tutti i pazienti, l infusione non deve essere ripresa fino alla completa risoluzione di tutti i sintomi e alla normalizzazione dei valori di laboratorio e della radiografia del torace. Soltanto a questo punto l infusione può essere ripresa a una velocità iniziale ridotta della metà rispetto a quella pre-
5 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 6 Riassunto delle caratteristiche del prodotto cedentemente adottata. Qualora dovessero di nuovo verificarsi le stesse gravi reazioni avverse, la decisione di interrompere il trattamento deve essere attentamente considerata caso per caso. Le reazioni, lievi o moderate, correlate all infusione (vedere paragrafo 4.8) generalmente rispondono alla riduzione della velocità di infusione. Quando i sintomi migliorano, la velocità di infusione può essere aumentata. 4.3 Controindicazioni Controindicazioni all uso nel linfoma non-hodgkin e nella leucemia linfatica cronica Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti o alle proteine di origine murina. Infezioni attive, gravi (vedere paragrafo 4.4). Controindicazioni all uso nell artrite reumatoide Ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti o alle proteine di origine murina. Infezioni attive, gravi (vedere paragrafo 4.4). Scompenso cardiaco grave (classe IV New York Heart Association) o malattia cardiaca grave e non controllabile. 4.4 Avvertenze speciali e precauzioni di impiego Leucoencefalopatia Multifocale Progressiva L impiego di MabThera può essere associato ad un aumentato rischio di Leucoencefalopatia Multifocale Progressiva (PML). I pazienti devono essere monitorati ad intervalli regolari per ogni sintomo neurologico nuovo o in peggioramento o per segni suggestivi di PML. In caso di sospetta PML, le ulteriori somministrazioni devono essere sospese fino a quando la diagnosi di PML sia stata esclusa. Il medico deve valutare il paziente per determinare se i sintomi sono indicativi di disfunzione neurologica e, se così fosse, se questi sintomi sono possibilmente suggestivi di PML. Deve essere richiesta una consulenza neurologica se clinicamente indicata. In caso di dubbio, deve essere presa in considerazione un ulteriore valutazione, che includa esami quali la RMN preferibilmente con contrasto, il test CSF per valutare il DNA del virus JC e ripetute valutazioni neurologiche. Il medico deve essere particolarmente attento ai sintomi suggestivi di PML che il paziente può non notare (ad esempio sintomi cognitivi, neurologici o psichiatrici). Occorre inoltre consigliare al paziente di informare il proprio partner o il proprio curante riguardo il trattamento, poiché essi possono notare sintomi dei quali il paziente non è a conoscenza. Se un paziente sviluppa PML, la somministrazione di MabThera deve essere definitivamente interrotta. A seguito di ricostituzione del sistema immunitario nei pazienti immunocompromessi con PML, si sono notati stabilizzazione o miglioramento. Non è noto se la diagnosi precoce di PML e la sospensione della terapia con MabThera possano portare ad una stabilizzazione o ad un miglioramento simili. Linfoma non-hodgkin e leucemia linfatica cronica I pazienti con elevata massa tumorale o con elevato numero ( 25 x 10 9 /l) di cellule neoplastiche circolanti come i pazienti con LLC, che possono essere esposti a un rischio maggiore di sindrome da rilascio di citochine particolarmente grave, devono essere trattati con estrema cautela. Questi pazienti devono essere monitorati molto attentamente per tutto il corso della prima infusione. In questi pazienti deve essere preso in considerazione, per la prima infusione, l utilizzo di una velocità di infusione ridotta o una suddivisione della dose in due giorni durante il primo ciclo e in ogni ciclo successivo se la conta dei linfociti è ancora > 25 x 10 9 /l. La sindrome grave da rilascio di citochine è caratterizzata da dispnea grave, spesso accompagnata da broncospasmo e ipossia, oltre a febbre, brividi, tremito, orticaria e angioedema. Questa sindrome può essere associata ad alcune caratteristiche della sindrome da lisi tumorale come iperuricemia, iperkaliemia, ipocalcemia, iperfosfatemia, insufficienza renale acuta, concentrazione elevata di lattato deidrogenasi (LDH) e può essere associata ad insufficienza respiratoria acuta e morte. L insufficienza respiratoria acuta può essere accompagnata da eventi quali l infiltrazione interstiziale polmonare o l edema polmonare, visibili alla radiografia del
6 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 7 torace. La sindrome si manifesta frequentemente entro una o due ore dall inizio della prima infusione. I pazienti con anamnesi di insufficienza polmonare o con infiltrazione tumorale del polmone possono essere esposti a un rischio superiore di scarsi risultati e devono essere trattati con maggiore cautela. Ai pazienti che sviluppano sindrome grave da rilascio di citochine deve essere immediatamente sospesa l infusione (vedere paragrafo 4.2) e deve essere somministrato un trattamento sintomatico aggressivo. Poiché il miglioramento iniziale dei sintomi clinici può essere seguito da un peggioramento, questi pazienti devono essere monitorati attentamente fino alla risoluzione o all esclusione della sindrome da lisi tumorale e dell infiltrazione polmonare. L ulteriore trattamento dei pazienti dopo la completa risoluzione di sintomi e segni ha raramente portato al ripetersi della sindrome grave da rilascio di citochine. Nel 10 % dei pazienti trattati con MabThera sono state osservate reazioni avverse correlate all infusione, compresa la sindrome da rilascio di citochine (vedere paragrafo 4.8) accompagnata da ipotensione e broncospasmo. Questi sintomi sono generalmente reversibili con l interruzione dell'infusione di MabThera e con la somministrazione di farmaci antipiretici, antistaminici e, occasionalmente, ossigeno, soluzioni saline endovena o farmaci broncodilatatori, e glucocorticoidi se necessario. Per le reazioni gravi vedere la sindrome da rilascio di citochine descritta sopra. In seguito alla somministrazione endovenosa di proteine sono state riportate nei pazienti reazioni di tipo anafilattico e altre reazioni di ipersensibilità. Diversamente dalla sindrome da rilascio di citochine, le reazioni di ipersensibilità si verificano tipicamente entro minuti dall inizio dell infusione. In caso di reazione allergica nel corso della somministrazione di MabThera, i prodotti medicinali per il trattamento delle reazioni di ipersensibilità, ad es. epinefrina (adrenalina), antistaminici e glucocorticoidi, devono essere disponibili per l'uso immediato. Le manifestazioni cliniche dell anafilassi possono apparire simili alle manifestazioni cliniche della sindrome da rilascio di citochine (descritta sopra). Le reazioni attribuite a ipersensibilità sono state riportate con minor frequenza rispetto a quelle attribuite al rilascio di citochine. Durante l infusione di MabThera si può verificare ipotensione, pertanto si deve prendere in considerazione la sospensione di medicinali anti-ipertensivi 12 ore prima dell infusione di MabThera. Nei pazienti trattati con MabThera si sono verificati casi di angina pectoris o aritmia cardiaca, come flutter atriale e fibrillazione, insufficienza cardiaca o infarto miocardico. Pertanto i pazienti con anamnesi di malattia cardiaca e/o chemioterapia cardiotossica devono essere attentamente monitorati. Sebbene MabThera non sia mielosoppressivo in monoterapia, deve essere posta particolare attenzione nel considerare il trattamento di pazienti con neutrofili < 1,5 x 10 9 /l e/o con conta delle piastrine < 75 x 10 9 /l, poiché per questo tipo di popolazione si ha una limitata esperienza clinica. MabThera è stato utilizzato in 21 pazienti che avevano effettuato trapianto di midollo osseo autologo e in altri gruppi a rischio con una presumibile ridotta funzionalità midollare senza indurre mielotossicità. Durante il trattamento con MabThera in monoterapia si deve considerare la necessità di effettuare con regolarità l emocromo completo, con conta piastrinica. Quando MabThera viene somministrato in associazione a chemioterapia CHOP o CVP (ciclofosfamide, vincristina e prednisone), si deve effettuare con regolarità l emocromo completo, secondo l usuale pratica clinica. Infezioni gravi, anche fatali, possono avvenire durante la terapia con MabThera (vedere paragrafo 4.8). MabThera non deve essere somministrato a pazienti con infezioni attive gravi (ad esempio tubercolosi, sepsi e infezioni opportunistiche, vedere paragrafo 4.3). I medici devono essere cauti quando prendono in considerazione l uso di MabThera in pazienti con storia di infezioni ricorrenti o croniche o con condizioni di base che possono ulteriormente predisporre i pazienti a infezioni gravi (vedere paragrafo 4.8). Casi di riattivazione di epatite B sono stati riportati in soggetti che hanno ricevuto MabThera incluse segnalazioni di epatite fulminante ad esito fatale. La maggior parte di questi soggetti riceveva anche chemioterapia citotossica. Informazioni limitate provenienti da uno studio in pazienti con LLC recidiva/refrattaria suggeriscono che il trattamento con MabThera può anche peggiorare l esito di infezioni di epatite
7 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 8 Riassunto delle caratteristiche del prodotto B primarie. Lo screening del virus dell epatite B (HBV) deve essere preso in considerazione nei pazienti ad alto rischio prima dell inizio del trattamento con MabThera. I portatori di epatite B e i pazienti con storia di epatite B devono essere attentamente monitorati per segni clinici e di laboratorio di infezione HBV attiva durante e per diversi mesi dopo la terapia con MabThera. Casi molto rari di Leucoencefalopatia Multifocale Progressiva (PML) sono stati riportati durante l uso post-marketing di MabThera nel LNH e nella LLC (vedere paragrafo 4.8). La maggior parte dei pazienti aveva ricevuto rituximab in associazione a chemioterapia o come parte di un programma trapiantologico con cellule staminali ematopoietiche. La sicurezza dell immunizzazione con vaccini virali vivi, in seguito alla terapia con MabThera, non è stata studiata per pazienti con LNH e LCC e non si raccomanda la vaccinazione con vaccini con virus vivo. I pazienti trattati con MabThera possono ricevere vaccinazioni con virus non vivo. Comunque le percentuali di risposta ai vaccini con virus non vivo possono essere ridotte. In uno studio non randomizzato, pazienti con LNH a basso grado ricaduto che hanno ricevuto MabThera in monoterapia quando confrontati con controlli non trattari di volontari sani hanno avuto una più bassa percentuale di risposte alla vaccinazione con antigeni di richiamo del tetano (16% rispetto a 81%) e neoantigeni Keyhole Limpet Haemocyanin (KLH) (4% rispetto a 69% quando valutati per un aumento nel titolo anticorpale >2 volte). Per pazienti con LCC sono prevedibili risultati simili considerando le similitudini tra le due patologie, tuttavia ciò non è stato valutato mediante studi clinici. La media dei titoli anticorpali pre-terapeutici contro un pannello di antigeni (Streptococcus pneumoniae, influenza A, parotite, rosolia, varicella) è stata mantenuta per almeno 6 mesi dopo il trattamento con MabThera. Artrite reumatoide Reazioni infusionali MabThera è associato a reazioni infusionali, che possono essere correlate al rilascio di citochine e/o di altri mediatori chimici. La premedicazione con glucocorticoidi endovena riduce significativamente l incidenza e la severità di questi eventi (vedere paragrafo 4.8). La maggior parte degli eventi infusionali riportati erano di severità da lieve a moderata. La percentuale di pazienti che presentano tali reazioni diminuisce con le infusioni successive. Le reazioni riportate erano generalmente reversibili con la riduzione della velocità dell infusione o interruzione della somministrazione di MabThera e la somministrazione di antipiretici, antistaminici e, occasionalmente, ossigeno, soluzione salina endovena o broncodilatatori, e glucocorticoidi, se necessario. Nella maggior parte dei casi, l infusione può essere ripresa riducendo la velocità al 50 % (per esempio da 100 mg/h a 50 mg/h), quando i sintomi sono stati completamente risolti. Reazioni anafilattiche e altre reazioni di ipersensibilità sono state riportate in seguito a somministrazione endovenosa di proteine, compreso MabThera, ai pazienti. Medicinali per il trattamento delle reazioni di ipersensibilità, ad es. epinefrina (adrenalina), antistaminici e glucocorticoidi, devono essere disponibili per l uso immediato, in caso di reazioni allergiche durante la somministrazione di MabThera. La presenza di HACA può essere associata ad un peggioramento delle reazioni infusionali o allergiche dopo la seconda infusione di cicli successivi (vedere paragrafo 5.1). Negli studi clinici 10 su 990 (1 %) pazienti affetti da artrite reumatoide, che hanno ricevuto una prima infusione di MabThera a qualsiasi dosaggio, hanno manifestato una reazione grave durante l infusione (vedere paragrafo 4.8). Non ci sono dati relativi alla sicurezza di MabThera nei pazienti con scompenso cardiaco moderato (classe III NYHA) o malattia cardiaca grave e non controllabile. Nei pazienti trattati con MabThera, si è osservato che condizioni preesistenti di ischemia cardiaca, quali l angina pectoris, sono divenute sintomatiche, così come fibrillazione e flutter atriale. Inoltre, nei pazienti con anamnesi di cardiopatia, prima del trattamento con MabThera deve essere considerato il rischio di complicanze cardiovascolari conseguenti alle reazioni infusionali e i pazienti devono essere attentamente monitorati durante la somministrazione. Durante l infusione di MabThera si può verificare ipo-
8 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 9 tensione, pertanto si deve prendere in considerazione la sospensione di farmaci anti-ipertensivi 12 ore prima dell infusione di MabThera. Infezioni Infezioni gravi, inclusi eventi fatali, possono verificarsi durante la terapia con MabThera (vedere paragrafo 4.8). MabThera non deve essere somministrato ai pazienti con infezione attiva grave (ad es. tubercolosi, sepsi e infezioni opportunistiche, vedere paragrafo 4.3) o ai pazienti gravemente immunocompromessi (ad es. ipogammaglobulinemia o laddove i valori di CD4 o CD8 sono molto bassi). I medici devono prestare attenzione nel considerare l impiego di MabThera nei pazienti con anamnesi di infezioni ricorrenti o croniche o con condizioni sottostanti che possono ulteriormente predisporre i pazienti a gravi infezioni (vedere paragrafo 4.8). I pazienti che manifestano segni e sintomi di infezione in seguito a trattamento con MabThera, devono essere prontamente valutati e adeguatemente trattati. Prima di iniziare un ciclo successivo di trattamento con MabThera, i pazienti devono essere rivalutati per qualsiasi rischio potenziale di infezioni. Casi molto rari di Leucoencefalopatia Multifocale Progressiva (PML) sono stati riportati in seguito all impiego di MabThera per il trattamento dell artrite reumatoide e di patologie autoimmuni inclusi il Lupus Eritematoso Sistemico (LES) e la vasculite. Nei pazienti con linfoma non-hodgkin che hanno ricevuto rituximab in associazione con chemioterapia citotossica, sono stati riportati casi molto rari di riattivazione di epatite B (vedere linfoma non-hodgkin). Immunizzazione I medici devono rivedere lo status delle vaccinazioni del paziente e seguire le linee guida vigenti per l immunizzazione prima della terapia con MabThera. La vaccinazione deve essere completata almeno 4 settimane prima della prima somministrazione di MabThera. La sicurezza dell immunizzazione con vaccini virali vivi seguente alla terapia con MabThera non è stata studiata. Perciò la vaccinazione con vaccini con virus vivo non è raccomandata durante la terapia con MabThera o durante il periodo di deplezione delle cellule B periferiche. I pazienti trattati con MabThera possono ricevere vaccinazioni con virus non vivo. Comunque, le percentuali di risposta ai vaccini con virus non vivo possono essere ridotte. In uno studio randomizzato, pazienti con artrite reumatoide trattati con MabThera e metotressato hanno avuto percentuali di risposta sovrapponibili a quelle dei pazienti che hanno ricevuto solo metotressato agli antigeni di richiamo del tetano (39% rispetto a 42%), ridotte percentuali al vaccino polisaccaride del pneumococco (43% rispetto a 82% ad almeno 2 sierotipi di anticorpi anti-pneumococco) e ai neoantigeni KLH (47% rispetto a 93%), quando dati 6 mesi dopo MabThera. Se vengono richieste vaccinazioni con virus non vivo durante la terapia con MabThera, queste devono essere completate almeno 4 settimane prima dell inizio del successivo ciclo di MabThera. Nell esperienza globale di ripetuti trattamenti di MabThera in un anno, le percentuali di pazienti con titoli anticorpali positivi contro S. pneumoniae, influenza, parotite, rosolia, varicella e tossina del tetano sono state generalmente simili alle percentuali al basale. Impiego concomitante/sequenziale di altri DMARD Non è raccomandato l impiego concomitante di MabThera e di terapie antireumatiche diverse da quelle specificate nell indicazione e nella posologia relative all artrite reumatoide. Ci sono dati limitati da studi clinici per valutare pienamente la sicurezza dell uso sequenziale dopo MabThera di altri DMARD (inclusi inibitori del TNF e altri biologici) (vedere paragrafo 4.5). I dati disponibili indicano che la percentuale di infezioni clinicamente rilevanti è invariata quando tali terapie sono utilizzate in pazienti precedentemente trattati con MabThera; comunque i pazienti devono essere strettamente osservati per segni di infezione se agenti biologici e/o DMARD vengono utilizzati dopo la terapia con MabThera. Neoplasie I farmaci immunomodulatori possono aumentare il rischio di neoplasie. Sulla base dell esperienza limitata con MabThera nei pazienti affetti da artrite reumatoide (vedere paragrafo 4.8) non si può
9 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 10 Riassunto delle caratteristiche del prodotto escludere, al momento, un possibile rischio di sviluppo di tumori solidi, sebbene i dati attuali non sembrino suggerire un incremento di tale rischio. 4.5 Interazioni con altri medicinali ed altre forme di interazione Al momento si hanno dati limitati sulla possibile interazione di farmaci con MabThera. In pazienti con LLC, la co-somministrazione con MabThera non sembra avere un effetto sulla farmacocinetica di fludarabina o ciclofosfamide. In aggiunta, non c è un apparente effetto di fludarabina e ciclofosfamide sulla farmacocinetica di rituximab. La co-somministrazione con metotressato non ha avuto alcun effetto sulla farmacocinetica di MabThera nei pazienti con artrite reumatoide. I pazienti che hanno sviluppato anticorpi anti-proteine murine o anti-chimerici (HAMA/HACA) possono avere reazioni allergiche o di ipersensibilità quando vengono trattati con altri anticorpi monoclonali diagnostici o terapeutici. In una piccola coorte di pazienti con artrite reumatoide, 280 pazienti hanno ricevuto successivamente una terapia con altri DMARD; di questi 185 hanno ricevuto un DMARD biologico dopo MabThera. In questi pazienti, la percentuale di infezioni clinicamente rilevanti durante la terapia con MabThera è stata 6,99 su 100 pazienti/anno, confrontata con 5,49 per 100 pazienti/anno dopo il trattamento con il DMARD biologico. 4.6 Gravidanza e allattamento Gravidanza È noto che le immunoglobuline IgG oltrepassano la barriera placentare. I livelli di cellule B nei neonati umani in seguito a esposizione materna a MabThera non sono stati valutati nel corso degli studi clinici. Non ci sono dati adeguati e ben controllati di studi su donne in gravidanza, comunque in neonati nati da madri esposte a rituximab durante la gravidanza sono state riportate transitoria deplezione delle cellule-b e linfocitopenia. Per questo motivo non si deve somministrare MabThera in donne in gravidanza ad eccezione che il possibile beneficio superi il potenziale rischio. Dato che rituximab ha un lungo tempo di ritenzione nei pazienti con deplezione di cellule B, donne in età fertile devono usare metodi contraccettivi efficaci nel corso del trattamento e fino a 12 mesi dal completamento della terapia con MabThera. Studi di tossicità nelle fasi di sviluppo, condotti nelle scimmie cynomolgus, non hanno rilevato alcuna evidenza di embriotossicità in utero. Nella prole delle madri animali esposte a MabThera è stata osservata la deplezione delle cellule B durante la fase postnatale. Allattamento Non si sa se il rituximab è escreto nel latte materno. Tuttavia, poiché le IgG materne sono escrete nel latte umano e il rituximab è stato rilevato nel latte di scimmie che allattano, le donne non devono allattare al seno durante il trattamento con MabThera e nei 12 mesi successivi al trattamento con MabThera. 4.7 Effetti sulla capacità di guidare veicoli e sull uso di macchinari Non sono stati effettuati studi sugli effetti di MabThera sulla capacità di guidare veicoli e sull uso di macchinari, anche se l'attività farmacologica e gli eventi avversi ad oggi riportati non danno indicazione che tali effetti siano probabili. 4.8 Effetti indesiderati Esperienza nel linfoma non-hodgkin e nella leucemia linfatica cronica Il profilo di sicurezza globale di MabThera nel linfoma non-hodgkin e nella leucemia linfatica cronica si basa su dati di pazienti in studi clinici e sulla sorveglianza post-marketing. Questi pazienti sono stati trattati con MabThera in monoterapia (come trattamento di induzione o come trattamento di mantenimento post-induzione) o in associazione a chemioterapia. Le reazioni avverse da farmaco (ADR) osservate più frequentemente in pazienti che hanno ricevuto MabThera sono state le reazioni correlate all infusione che sono avvenute nella maggior parte dei pazienti durante la prima infusione. L incidenza di sintomi correlati all infusione diminuisce significativamente con le successive infusioni ed è meno dell 1 % dopo otto dosi di MabThera. Gli eventi infettivi (soprattutto batterici e virali) si sono
10 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 11 verificati nel % circa dei pazienti con LNH trattati in studi clinici e nel 30-50% circa dei pazienti con LLC trattati in studi clinici. Le reazioni avverse al farmaco gravi più frequentemente riportate o osservate sono state: Reazioni correlate all infusione (incluse la sindrome da rilascio di citochine e la sindrome da lisi tumorale), vedere paragrafo 4.4. Infezioni, vedere paragrafo 4.4. Eventi cardiovascolari, vedere paragrafo 4.4. Altre ADR gravi riportate includono la riattivazione di epatite B e la PML (vedere paragrafo 4.4). Le frequenze delle ADR riportate con MabThera in monoterapia o in associazione con chemioterapia sono riassunte nelle tabelle sottostanti. All interno di ciascuna classe di frequenza, gli effetti indesiderati sono riportati in ordine decrescente di gravità. La frequenza è definita come molto comune ( 1/10), comune (da 1/100 a < 1/10), non comune (da 1/1000 a < 1/100) e raro (da 1/10000 a < 1/1000). Le ADR identificate solo durante la sorveglianza post-marketing e per le quali non è possibile stimare una frequenza, sono elencate come sconosciute. Tabella 1 ADR riportate negli studi clinici o durante la sorveglianza post-marketing in pazienti con LNH e LLC trattati con MabThera in monoterapia/mantenimento o in associazione a chemioterapia Classificazione Molto comune Comune Non comune Sconosciuta per sistemi e organi Infezioni infezioni batteriche, sepsi, + polmonite, Infezioni virali ed infestazioni infezioni virali, + infezione febbrile, gravi 2, + bronchite + herpes zoster, + infezioni del tratto respiratorio, infezioni fungine, infezioni a eziologia sconosciuta, + bronchite acuta, + sinusite, epatite B 1 Patologie neutropenia, anemia, disturbi della neutropenia del sistema leucopenia, + pancitopenia, coagulazione, tardiva 3, aumento emolinfopoietico + neutropenia + granulocitopenia anemia aplastica, transitorio dei febbrile, anemia emolitica, livelli sierici + trombocitopenia linfoadenopatia di IgM 3 Disturbi reazioni correlate ipersensibilità sindrome del sistema all infusione, da lisi tumorale 4, immunitario angioedema sindrome da rilascio di citochine 4, malattia da siero, anafilassi, trombocitopenia acuta reversibile correlata all infusione 4
11 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 12 Riassunto delle caratteristiche del prodotto Classificazione Molto comune Comune Non comune Sconosciuta per sistemi e organi Disturbi iperglicemia, del metabolismo perdita di peso, e della nutrizione edema periferico, edema facciale, aumento della LDH, ipocalcemia Disturbi psichiatrici depressione, nervosismo Patologie parestesia, disgeusia neuropatia dei del sistema ipoestesia, nervi cranici, nervoso agitazione, insonnia, neuropatia vasodilatazione, periferica, capogiro, ansia paralisi del nervo facciale 5, perdita di altri sensi 5 Patologie dell'occhio disturbi della perdita grave lacrimazione, della vista 5 congiuntivite Patologie Tinnito, otalgia perdita dell'orecchio dell udito 5 e del labirinto Patologie cardiache + infarto + insufficienza insufficienza miocardico 4e6, del ventricolo cardiaca 4e6, aritmia, sinistro, eventi cardiaci + fibrillazione atriale, + tachicardia severi 4e6 tachicardia, sopraventricolare, + disturbi cardiaci + tachicardia ventricolare, + angina, + ischemia miocardica, bradicardia Patologie vascolari ipertensione, vasculite ipotensione (sprattutto ortostatica, cutanea), ipotensione vasculite leucocitoclastica Patologie broncospasmo 4, asma, insufficienza respiratorie, patologie respiratorie, bronchiolite respiratoria 4, toraciche dolore toracico, obliterante, infiltrati e mediastiniche dispnea, incremento disturbi polmonari,polmonari, della tosse, rinite ipossia malattia polmonare interstiziale 7
12 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 13 Classificazione Molto comune Comune Non comune Sconosciuta per sistemi e organi Patologie nausea vomito, diarrea, dilatazione perforazione gastrointestinali dolore addominale, addominale gastrodisfagia, stomatite, intestinale 7 constipazione, dispepsia, anoressia, irritazione della gola Patologie della cute prurito, rash, orticaria, sudorazione, reazioni cutanee e del tessuto + alopecia sudorazioni notturne, bollose gravi, sottocutaneo + disordini della cute necrolisi epidermica tossica 7 Patologie del sistema Ipertonia, mialgia, muscoloscheletrico, artralgia, dolore del tessuto connettivo alla schiena, e delle ossa dolore al collo, dolore Patologie renali insufficienza e urinarie renale 4 Patologie sistemiche febbre, brividi, dolore in sede dolore al sito e condizioni relative astenia, cefalea tumorale, vampate, di infusione alla sede di malessere, somministrazione sindrome da freddo, + stanchezza, + brividi, + insufficienza multi-organo 4 Esami diagnostici diminuzione dei livelli di IgG Per ciascuna voce, la frequenza si è basata sulle reazioni di qualsiasi grado (da lieve a grave) ad eccezione delle voci contrassegnate con "+" dove la frequenza si è basata solo sulle reazioni gravi ( di grado 3 secondo i criteri di tossicità comuni NCI). È riportata solo la frequenza più elevata osservata negli studi 1 include riattivazione e infezioni primarie; frequenza basata sul regime R-FC nella LLC recidiva/refrattaria 2 vedere anche la sottostante sezione infezione 3 vedere anche la sottostante sezione reazioni avverse ematologiche 4 vedere anche la sottostante sezione reazioni avverse correlate all infusione. Raramente riportati casi fatali 5 segni e sintomi di neuropatia dei nervi cranici. Si è manifestata in tempi diversi fino a diversi mesi dal completamento della terapia con MabThera 6 osservate soprattutto in pazienti con precedenti patologie cardiache e/o chemioterapia cardiotossica e sono state soprattutto associate con reazioni correlate all infusione 7 inclusi casi fatali I seguenti termini sono stati riportati come eventi avversi durante gli studi clinici, tuttavia, sono stati riportati con un incidenza simile o inferiore nei bracci MabThera rispetto ai bracci di controllo: tossicità ematologia, infezione neutropenica, infezione del tratto urinario, disturbi del sensorio, piressia. Reazioni correlate all infusione Segni e sintomi caratteristici di una reazione correlata all infusione sono stati riportati in più del 50% dei pazienti in studi clinici e sono stati osservati soprattutto durante la prima infusione, generalmente
13 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 14 Riassunto delle caratteristiche del prodotto nelle prime due ore. Questi sintomi comprendono soprattutto febbre, brividi e rigidità. Altri sintomi includono vampate, angioedema, broncospasmo, vomito, nausea, orticaria/rash, stanchezza, cefalea, irritazione della gola, rinite, prurito, dolore, tachicardia, ipertensione, ipotensione, dispnea, dispepsia, astenia e sintomi della sindrome da lisi tumorale. Reazioni gravi correlate all infusione (come broncospasmo, ipotensione) si sono verificate fino al 12 % dei casi. Ulteriori reazioni riportate in alcuni casi sono state infarto del miocardio, fibrillazione atriale ed edema polmonare e trombocitopenia acuta reversibile. Esacerbazione di condizioni cardiache preesistenti come angina pectoris o insufficienza cardiaca congestizia oppure eventi cardiaci severi (insufficienza cardiaca, infarto del miocardio, fibrillazione atriale), edema polmonare, insufficienza multi-organo, sindrome da lisi tumorale, sindrome da rilascio da citochine, insufficienza renale e insufficienza respiratoria sono state riportate con una frequenza inferiore o sconosciuta. L incidenza di sintomi correlati all infusione è diminuita sostanzialmente con le infusioni successive ed è < 1% dei pazienti dall ottavo ciclo di trattamento contenente MabThera. Infezioni MabThera induce deplezione delle cellule B nel % circa dei pazienti, ma questo evento è stato associato ad una diminuzione delle immunoglobuline sieriche solo in una minoranza di pazienti. Infezioni localizzate da candida come da Herpes zoster sono state riportate con una incidenza più elevata nel braccio contenente MabThera in studi randomizzati. Infezioni gravi sono state riportate nel 4 % circa dei pazienti trattati con MabThera in monoterapia. Frequenze più elevate di tutte le infezioni, incluse infezioni di grado 3 o 4, sono state osservate durante il trattamento di mantenimento con MabThera della durata di due anni se confrontate con l osservazione. Non si è verificata tossicità cumulativa in termini di infezioni riportate nel periodo di trattamento della durata di due anni. In aggiunta, durante il trattamento con MabThera sono state riportate altre infezioni virali gravi, sia nuove, che riattivate o esacerbate, alcune delle quali sono state fatali. La maggior parte dei pazienti aveva ricevuto MabThera in associazione alla chemioterapia o come parte di un trapianto di cellule staminali ematopoietiche. Esempi di queste infezioni virali gravi sono infezioni causate da virus herpetici (Citomegalovirus, Virus Varicella Zoster e Herpes Simplex), JC virus (leucoencefalopatia multifocale progressiva (PML)) e virus dell epatite C. Sono stati riportati casi di riattivazione di epatite B, la maggior parte dei quali si sono verificati in soggetti che hanno ricevuto MabThera in associazione con chemioterapia citotossica. In pazienti con LLC recidiva/refrattaria, l incidenza di infezione di epatite B di grado 3/4 (riattivazione e infezione primaria) è stata del 2 % in R-FC vs 0 % in FC. Si è osservata progressione del sarcoma di Kaposi in pazienti esposti a rituximab con sarcoma di Kaposi pre-esistente. Questi casi si sono verificati in indicazioni non approvate e la maggior parte dei pazienti erano HIV positivi. Reazioni avverse ematologiche Negli studi clinici con impiego di MabThera in monoterapia somministrato per 4 settimane, anomalie ematologiche si sono verificate in una minoranza di pazienti e sono state generalmente lievi e reversibili. Neutropenia grave (grado 3/4) è stata riportata nel 4,2 % dei pazienti, anemia nell 1,1 % e trombocitopenia nell 1,7 % dei pazienti. Durante il trattamento di mantenimento con MabThera della durata di due anni, leucopenia (5 % vs 2%, grado 3/4) e neutropenia (10 % vs 4 %, grado 3/4) sono state riportate con un incidenza più elevata quando confrontata con l osservazione. L incidenza di trombocitopenia è stata bassa (< 1 %, grado 3/4) e non è stata differente tra i bracci di trattamento. Negli studi con MabThera in associazione con chemioterapia, leucopenia di grado 3/4 (R-CHOP 88 % vs CHOP 79 %, R-FC 23 % vs FC 12 %), neutropenia (R-CVP 24 % vs CVP 14 %; R-CHOP 97 % vs CHOP 88 %, R-FC 30 % vs FC 19 % nella LLC precedentemente non trattata), pancitopenia (R-FC 3 % vs FC 1 % nella LLC precedentemente non trattata), sono state riportate generalmente con fre-
14 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 15 quenze più elevate quando confrontate con chemioterapia da sola. Comunque, l incidenza più elevata di neutropenia in pazienti trattati con MabThera e chemioterapia non è stata associata ad una incidenza più alta di infezioni e infestazioni se confrontata con pazienti trattati con sola chemioterapia e la neutropenia non è stata prolungata nel gruppo MabThera. Non sono state riportate differenze nell incidenza di anemia. Sono stati riportati alcuni casi di neutropenia tardiva che si sono verificati più di quattro settimane dopo l ultima infusione di MabThera. Nello studio di prima linea sulla LLC, i pazienti in stadio Binet C hanno manifestato più eventi avversi nel braccio R-FC rispetto al braccio FC (R-FC 83% vs FC 71%). Nello studio sulla LLC recidiva/refrattaria, è stata riportata trombocitopenia di grado 3/4 nell 11 % dei pazienti nel gruppo R-FC vs il 9 % dei pazienti nel gruppo FC. Negli studi con MabThera in pazienti con macroglobulinemia di Waldestrom, aumenti transitori dei livelli sierici di IgM sono stati osservati dopo l inizio del trattamento, i quali possono essere associati con iperviscosità e sintomi correlati. L aumento transitorio di IgM generalmente ritorna almeno al livello basale entro 4 mesi. Reazioni cardiovascolari Negli studi clinici con MabThera in monoterapia sono state riportate reazioni cardiovascolari nel 18,8 % dei pazienti con ipotensione e ipertensione quali eventi più frequentemente riportati. Sono stati riportati durante l infusione casi di aritmia di grado 3 o 4 (incluse tachicardia ventricolare e sopraventricolare) e angina pectoris. Durante il trattamento di mantenimento, l incidenza di disordini cardiaci di grado 3/4 è stata paragonabile tra i pazienti trattati con MabThera e l osservazione. Eventi cardiaci sono stati riportati come eventi avversi seri (inclusa la fibrillazione atriale, l infarto del miocardio, l insufficienza ventricolare sinistra, l ischemia del miocardio) nel 3 % dei pazienti trattati con MabThera confrontato con < 1% dell osservazione. Negli studi di valutazione di MabThera in associazione con chemioterapia, l incidenza di aritmie cardiache di grado 3 e 4, soprattutto aritmie sopraventricolari come la tachicardia e il flutter/fibrillazione atriali, è stata più elevata nel gruppo R-CHOP (14 pazienti, 6,9 %) se confrontato con il gruppo CHOP (3 pazienti, 1,5 %). Tutte queste aritmie si sono verificate nel contesto dell infusione di MabThera o sono state associate con condizioni predisponenti quali febbre, infezione, infarto acuto del miocardio o patologia respiratoria e cardiovascolare preesistente. Non è stata osservata differenza tra il gruppo R-CHOP e CHOP in termini di incidenza di altri eventi cardiaci di grado 3 e 4 inclusi l insufficienza cardiaca, la patologia del miocardio e le manifestazioni di patologia delle arterie coronariche. Nella LLC, l incidenza globale di disordini cardiaci di grado 3 o 4 è stata bassa sia nello studio di prima linea (4% R-FC, 3% FC) che nello studio sulla recidiva/refrattaria (4% R-FC, 4% FC). Apparato respiratorio Sono stati riportati casi di malattia polmonare interstiziale, alcuni con esito fatale. Eventi neurologici Durante il periodo di trattamento, quattro pazienti (2 %) trattati con R-CHOP, tutti con fattori di rischio cardiovascolare hanno manifestato accidenti tromboembolici cerebrovascolari durante il primo ciclo di trattamento. Non c è stata differenza tra i gruppi di trattamento in termini di incidenza di altri eventi tromboembolici. Al contrario, tre pazienti (1,5 %) hanno avuto eventi cerebrovascolari nel gruppo CHOP, i quali si sono manifestati tutti durante il periodo di follow-up. Nella LLC, l incidenza globale di disordini del sistema nervoso di grado 3 o 4 è stata bassa sia nello studio di prima linea (4% R-FC, 4% FC) che nello studio sulla recidiva/refrattaria (3% R-FC, 3% FC). Disordini gastro-intestinali È stata osservata perforazione gastrointestinale che in alcuni casi ha portato a morte in pazienti che ricevevano MabThera per il trattamento di linfoma non-hodgkin. Nella maggior parte di questi casi, MabThera era somministrato con la chemioterapia.
15 MabtheraRCP_32pag_ ok:Layout 1 09/06/10 16:20 Pagina 16 Riassunto delle caratteristiche del prodotto Livelli di IgG Nello studio clinico che ha valutato MabThera nel trattamento di mantenimento la mediana dei livelli di IgG è stata sotto il limite inferiore di normalità (LLN) (< 7 g/l) dopo il trattamento di induzione sia nel gruppo osservazione che nel gruppo MabThera. Nel gruppo osservazione, la mediana dei livelli di IgG è aumentata successivamente sopra il LLN, ma è rimasta costante nel gruppo MabThera. La percentuale di pazienti con livelli di IgG sotto il LLN è stata del 60 % circa nel gruppo MabThera nei due anni del periodo di trattamento, mentre è diminuita nel gruppo osservazione (36 % dopo due anni). Sottopopolazioni di pazienti - MabThera in monoterapia Pazienti anziani ( 65 anni): L incidenza delle ADR di tutti i gradi e di grado 3/4 è stata simile nei pazienti anziani rispetto a pazienti più giovani (< 65 anni). Malattia bulky Si è verificata un incidenza più elevata di ADR di grado 3/4 in pazienti con malattia bulky rispetto a pazienti senza malattia bulky (25,6 % vs 15,4 %). L incidenza di ADR di ogni grado è stata simile in questi due gruppi. Ritrattamento La percentuale di pazienti che hanno riportato ADR durante il ritrattamento con ulteriori cicli di MabThera è stata simile alla percentuale di pazienti che hanno riportato ADR durante l esposizione iniziale (ADR di ogni grado e di grado 3/4). Sottopopolazioni di pazienti Terapia di associazione con MabThera Pazienti anziani ( 65 anni) L incidenza di eventi avversi di grado 3/4 a livello dell apparato emolinfopoietico è stata più alta in pazienti anziani se confrontati a pazienti più giovani (< 65 anni), con leucemia linfatica cronica precedentemente non trattata o recidiva/refrattaria. Esperienza nell artrite reumatoide Il profilo di sicurezza globale di MabThera nell artrite reumatoide si basa sui dati provenienti da pazienti trattati in studi clinici e dalla sorveglianza post-marketing. L efficacia clinica di MabThera, somministrato insieme a metotressato, è stata studiata in tre studi clinici controllati, in doppio cieco (uno di fase III, due di fase II) in pazienti con artrite reumatoide. Più di 1000 pazienti hanno ricevuto almeno un ciclo di trattamento e sono stati seguiti per un periodo variabile da 6 mesi a più di 3 anni; circa 600 pazienti hanno ricevuto due o più cicli di trattamento durante il periodo di follow up. I pazienti hanno ricevuto 2 dosi da 1000 mg di MabThera separate da un intervallo di due settimane, in associazione a metotressato (10-25 mg/settimana). Le infusioni di MabThera sono state somministrate dopo infusione endovenosa di 100 mg di metilprednisolone; i pazienti hanno anche ricevuto un trattamento con prednisone orale per 15 giorni.le reazioni avverse, che si sono verificate con almeno una differenza del 2 % rispetto al braccio di controllo e più frequentemente nei pazienti che avevano ricevuto almeno un infusione di MabThera rispetto ai pazienti che avevano ricevuto placebo nello studio di fase III e rispetto alla popolazione combinata compresa negli studi di fase II, sono elencate nella tabella sottostante. La frequenza è definita come molto comune ( 1/10) e comune ( 1/100 a < 1/10). All interno di ciascuna classe di frequenza, gli effetti indesiderati sono riportati in ordine decrescente di gravità. Le reazioni avverse più frequenti ritenute dovute all assunzione di 2 dosi da 1000 mg di MabThera negli studi di fase II e III, sono state le reazioni infusionali acute. Le reazioni infusionali si sono verificate nel 15 % dei pazienti in seguito alla prima infusione di rituximab e nel 5 % dei pazienti trattati con placebo. Le reazioni infusionali sono diminuite al 2 % in seguito alla seconda infusione sia nel gruppo rituximab sia nel gruppo placebo. In aggiunta alle reazioni avverse osservate negli studi clinici sull artrite reumatoide condotti con rituximab, sono stati riportati durante l esperienza post-marketing leucoencefalopatia multifocale progressiva (PML)(vedere paragrafo 4.4) e reazione simil malattia da siero.
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE MabThera 100 mg concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE MabThera 100 mg concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE MabThera 100 mg concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE MabThera 100 mg concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene
Specialità: Mabthera (Roche SpA) Forma farmaceutica: 1fl ev 500mg - Prezzo: euro fl 10ml 100mg - Prezzo: euro
 RITUXIMAB Linfoma non-hodgkin: La terapia di mantenimento per pazienti con linfoma follicolare ricaduto/refrattario che rispondono a terapia di induzione con chemioterapia con o senza Rituximab. (09-01-2007)
RITUXIMAB Linfoma non-hodgkin: La terapia di mantenimento per pazienti con linfoma follicolare ricaduto/refrattario che rispondono a terapia di induzione con chemioterapia con o senza Rituximab. (09-01-2007)
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
RITUXIMAB in associazione a metotressato è indicato per il trattamento dell artrite reumatoide attiva di grado severo in pazienti adulti.
 RITUXIMAB in associazione a metotressato è indicato per il trattamento dell artrite reumatoide attiva di grado severo in pazienti adulti. (28-02-2007) Specialità: Mabthera (Roche SpA) Forma farmaceutica:
RITUXIMAB in associazione a metotressato è indicato per il trattamento dell artrite reumatoide attiva di grado severo in pazienti adulti. (28-02-2007) Specialità: Mabthera (Roche SpA) Forma farmaceutica:
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
La terapia di mantenimento con MabThera è indicata per il trattamento di pazienti con linfoma follicolare che rispondono a terapia di induzione.
 1. DENOMINAZIONE DEL MEDICINALE MabThera 100 mg concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene 10 mg di rituximab. Ogni flaconcino contiene 100 mg di
1. DENOMINAZIONE DEL MEDICINALE MabThera 100 mg concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene 10 mg di rituximab. Ogni flaconcino contiene 100 mg di
RITUXIMAB L01XC02 REBUILDING LIVES
 RITUXIMAB L01XC02 REBUILDING LIVES RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. MabThera 100 mg concentrato per soluzione per infusione. MabThera 500 mg concentrato per
RITUXIMAB L01XC02 REBUILDING LIVES RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. MabThera 100 mg concentrato per soluzione per infusione. MabThera 500 mg concentrato per
FRISIUM 10 MG CAPSULE RIGIDE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
FARMACOVIGILANZA FRISIUM 10 MG CAPSULE RIGIDE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione V&A/1598/2013 del 27 settembre
Allegato I. Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio
 Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Sulla base del Rapporto di valutazione
Allegato I Conclusioni scientifiche e motivazioni per la variazione dei termini dell'/delle autorizzazione/i all immissione in commercio 1 Conclusioni scientifiche Sulla base del Rapporto di valutazione
INFORMATI VACCINATI PROTETTI VACCINO EPATITE Β
 EPATITE B SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DALL EPATITE B? INFORMATI VACCINATI PROTETTI VACCINO EPATITE Β RICORDA CHE: L epatite B causa un infiammazione acuta del fegato,
EPATITE B SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DALL EPATITE B? INFORMATI VACCINATI PROTETTI VACCINO EPATITE Β RICORDA CHE: L epatite B causa un infiammazione acuta del fegato,
Contiene il virus vivo attenuato ceppo Oka/Merck Contiene il virus vivo attenuato ceppo Oka Tra +2 e +8 Tra +2 e +8
 Varivax Varilrix Ditta Sanofi Pasteur MSD GlaxoSmithKline Ceppo virus varicella Temperatura di conservazione Immunogenicità Inizio della risposta immunitaria Durata della risposta immunitaria Efficacia
Varivax Varilrix Ditta Sanofi Pasteur MSD GlaxoSmithKline Ceppo virus varicella Temperatura di conservazione Immunogenicità Inizio della risposta immunitaria Durata della risposta immunitaria Efficacia
AZIENDA OSPEDALIERA S. CROCE E CARLE - CUNEO. Il protocollo vaccinale per la malattia invasiva da Streptococcus pneumoniae
 AZIENDA OSPEDALIERA S. CROCE E CARLE - CUNEO Il protocollo vaccinale per la malattia invasiva da Streptococcus pneumoniae A cura del C.I.O. (C. Bonada, P.Pellegrino, G. Raineri) giugno 2015 Condizioni
AZIENDA OSPEDALIERA S. CROCE E CARLE - CUNEO Il protocollo vaccinale per la malattia invasiva da Streptococcus pneumoniae A cura del C.I.O. (C. Bonada, P.Pellegrino, G. Raineri) giugno 2015 Condizioni
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 41 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
Allegato III. Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo
 Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
Allegato III Emendamenti alle sezioni pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio illustrativo Nota: Il Riassunto delle Caratteristiche del Prodotto, l etichettatura e il foglio
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
Allegato III. Modifiche alle apposite sezioni dei Riassunti delle Caratteristiche del Prodotto e dei Fogli Illustrativi
 Allegato III Modifiche alle apposite sezioni dei Riassunti delle Caratteristiche del Prodotto e dei Fogli Illustrativi 46 Modifiche da inserire nelle apposite sezioni del riassunto delle caratteristiche
Allegato III Modifiche alle apposite sezioni dei Riassunti delle Caratteristiche del Prodotto e dei Fogli Illustrativi 46 Modifiche da inserire nelle apposite sezioni del riassunto delle caratteristiche
SINDROME DA ANTICORPI ANTI-FOSFOLIPIDI
 SINDROME DA ANTICORPI ANTI-FOSFOLIPIDI Malattia caratterizzata da trombosi arteriose e/o venose ricorrenti, aborti ripetuti, trombocitopenia,, in associazione a titoli medio-alti di anticorpi anti-fosfolipidi
SINDROME DA ANTICORPI ANTI-FOSFOLIPIDI Malattia caratterizzata da trombosi arteriose e/o venose ricorrenti, aborti ripetuti, trombocitopenia,, in associazione a titoli medio-alti di anticorpi anti-fosfolipidi
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
INFORMATI VACCINATI PROTETTI VACCINO VARICELLA
 VARICELLA SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DALLA VARICELLA? INFORMATI VACCINATI PROTETTI VACCINO VARICELLA RICORDA CHE: La varicella contratta in età adulta può comportare
VARICELLA SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DALLA VARICELLA? INFORMATI VACCINATI PROTETTI VACCINO VARICELLA RICORDA CHE: La varicella contratta in età adulta può comportare
Allegato IV. Conclusioni scientifiche
 Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
Allegato IV Conclusioni scientifiche 1 Conclusioni scientifiche Il 7 giugno 2017, la Commissione europea (CE) è stata informata di un caso mortale di insufficienza epatica fulminante in un paziente trattato
La BPCO e le comorbilità. Federico Sciarra
 La BPCO e le comorbilità Federico Sciarra La BPCO, essendo una malattia cronica con caratteristiche di infiammazione sistemica, facilmente coesiste con altre patologie sia acute che croniche, che influenzano
La BPCO e le comorbilità Federico Sciarra La BPCO, essendo una malattia cronica con caratteristiche di infiammazione sistemica, facilmente coesiste con altre patologie sia acute che croniche, che influenzano
SINDROMI DA IMMUNODEFICIENZA
 www.fisiokinesiterapia.biz SINDROMI DA IMMUNODEFICIENZA Sindromi da immunodeficienza La causa più comune di deficienza immunitaria è la denutrizione Nei paesi sviluppati, le immunodeficienze possono essere
www.fisiokinesiterapia.biz SINDROMI DA IMMUNODEFICIENZA Sindromi da immunodeficienza La causa più comune di deficienza immunitaria è la denutrizione Nei paesi sviluppati, le immunodeficienze possono essere
MabThera. rituximab. Che cos è MabThera? Per che cosa si usa MabThera? Riassunto destinato al pubblico
 EMA/614203/2010 EMEA/H/C/000165 Riassunto destinato al pubblico rituximab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/614203/2010 EMEA/H/C/000165 Riassunto destinato al pubblico rituximab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
Nel caso del mieoloma multiplo, un tumore che colpisce un tipo di globuli bianchi detti cellule plasmatiche, Revlimid è usato:
 EMA/112959/2016 EMA/H/C/000717 Riassunto destinato al pubblico lenalidomide Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/112959/2016 EMA/H/C/000717 Riassunto destinato al pubblico lenalidomide Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una
 1 2 Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una dose e l altra deve essere sempre almeno di 4 ore.
1 2 Prima dei 15 anni il dosaggio di paracetamolo dipende dal peso del bambino e deve essere compreso tra i 10 e i 15 mg/kg/dose; l intervallo tra una dose e l altra deve essere sempre almeno di 4 ore.
Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali
 Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
Allegato II Modifica del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo presentata dall'agenzia Europea per i Medicinali Il Riassunto delle Caratteristiche del Prodotto e il foglio
VARICELLA SCHEDA INFORMATIVA PER PERSONALE INFIERMERISTICO E AUSILIARIO WHAT YOU NEED TO KNOW
 VARICELLA SCHEDA INFORMATIVA PER PERSONALE INFIERMERISTICO E AUSILIARIO WHAT YOU NEED TO KNOW SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DALLA VARICELLA? INFORMATI! VACCINATI! PROTETTI!
VARICELLA SCHEDA INFORMATIVA PER PERSONALE INFIERMERISTICO E AUSILIARIO WHAT YOU NEED TO KNOW SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DALLA VARICELLA? INFORMATI! VACCINATI! PROTETTI!
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
LA GESTIONE E LA PRESA IN CARICO DELLE REAZIONI ALLERGICHE ALESSIA ZARDINI INFERMIERA U.O. ONCOLOGIA OSPEDALE S. CUORE DON CALABRIA NEGRAR
 LA GESTIONE E LA PRESA IN CARICO DELLE REAZIONI ALLERGICHE ALESSIA ZARDINI INFERMIERA U.O. ONCOLOGIA OSPEDALE S. CUORE DON CALABRIA NEGRAR LINEE GUIDA NCCN Le reazioni allergiche vengono classificate in:
LA GESTIONE E LA PRESA IN CARICO DELLE REAZIONI ALLERGICHE ALESSIA ZARDINI INFERMIERA U.O. ONCOLOGIA OSPEDALE S. CUORE DON CALABRIA NEGRAR LINEE GUIDA NCCN Le reazioni allergiche vengono classificate in:
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Novembre 2015 TECFIDERA (DIMETILFUMARATO): NUOVE MISURE PER MINIMIZZARE IL RISCHIO DI
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Novembre 2015 TECFIDERA (DIMETILFUMARATO): NUOVE MISURE PER MINIMIZZARE IL RISCHIO DI
prodotto nel lievito Saccharomyces cerevisiae (ceppo ) mediante tecnologia del DNA ricombinante
 1. DENOMINAZIONE DEL MEDICINALE HBVAXPRO 40 microgrammi sospensione iniettabile Vaccino dell epatite B (DNA ricombinante) 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una dose (1 ml) contiene: Antigene di
1. DENOMINAZIONE DEL MEDICINALE HBVAXPRO 40 microgrammi sospensione iniettabile Vaccino dell epatite B (DNA ricombinante) 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una dose (1 ml) contiene: Antigene di
LE NUOVE PROSPETTIVE DELLA FARMACO VIGILANZA E DELLA DISPOSITIVOVIGILANZA IN OSPEDALE DR. BRUNO LENZI D.H.ONCOLOGICO ARGENTA 11 13 GIUGNO 2013
 LE NUOVE PROSPETTIVE DELLA FARMACO VIGILANZA E DELLA DISPOSITIVOVIGILANZA IN OSPEDALE DR. BRUNO LENZI D.H.ONCOLOGICO ARGENTA 11 13 GIUGNO 2013 A.D.R. = ADVERSE DRUG REACTION EFFETTO NOCIVO E NON VOLUTO
LE NUOVE PROSPETTIVE DELLA FARMACO VIGILANZA E DELLA DISPOSITIVOVIGILANZA IN OSPEDALE DR. BRUNO LENZI D.H.ONCOLOGICO ARGENTA 11 13 GIUGNO 2013 A.D.R. = ADVERSE DRUG REACTION EFFETTO NOCIVO E NON VOLUTO
AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri)
 AIFA - Natalizumab (Tysabri) 18/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri) Nota Informativa Importante Del 18 Febbraio 2010 file:///c /documenti/notys120.htm [18/02/2010
AIFA - Natalizumab (Tysabri) 18/02/2010 (Livello 2) AIFA Agenzia Italiana del Farmaco Natalizumab (Tysabri) Nota Informativa Importante Del 18 Febbraio 2010 file:///c /documenti/notys120.htm [18/02/2010
A.I.E.O.P. Gruppo Immunodeficienze primitive SCHEDA DI REGISTRAZIONE
 A.I.E.O.P. Gruppo Immunodeficienze primitive SCHEDA DI REGISTRAZIONE Questa scheda deve essere compilata ed inviata al più presto per ogni paziente affetto da XLA, CGD e CVID e THI. Centro / Istituto Cod.
A.I.E.O.P. Gruppo Immunodeficienze primitive SCHEDA DI REGISTRAZIONE Questa scheda deve essere compilata ed inviata al più presto per ogni paziente affetto da XLA, CGD e CVID e THI. Centro / Istituto Cod.
Foglio illustrativo. In caso di reazioni da ipersensibilità il trattamento deve essere interrotto immediatamente e non ripreso.
 Foglio illustrativo IMMUCYTAL Compresse IMMUCYTAL Granulato per soluzione orale Categoria Farmacoterapeutica Vaccini batterici. Indicazioni terapeutiche Profilassi delle infezioni batteriche ricorrenti
Foglio illustrativo IMMUCYTAL Compresse IMMUCYTAL Granulato per soluzione orale Categoria Farmacoterapeutica Vaccini batterici. Indicazioni terapeutiche Profilassi delle infezioni batteriche ricorrenti
4. INFORMAZIONI CLINICHE
 ALLEGATO 1: MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO (RCP) Il Riassunto delle Caratteristiche del Prodotto di abacavir solfato (ZIAGEN) è stato modificato sulla base delle osservazioni
ALLEGATO 1: MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO (RCP) Il Riassunto delle Caratteristiche del Prodotto di abacavir solfato (ZIAGEN) è stato modificato sulla base delle osservazioni
Principio attivo: Polisaccaride capsulare purificato Vi di Salmonella Typhi (ceppo Ty2)
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TYPHIM Vi Soluzione iniettabile per uso intramuscolare Vaccino antitifico da polisaccaride capsulare Vi 2. COMPOSIZIONE QUALITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TYPHIM Vi Soluzione iniettabile per uso intramuscolare Vaccino antitifico da polisaccaride capsulare Vi 2. COMPOSIZIONE QUALITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. HBVAXPRO 40 microgrammi/ml
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO HBVAXPRO 40 microgrammi/ml 1. DENOMINAZIONE DEL MEDICINALE HBVAXPRO 40 microgrammi/ml Sospensione iniettabile Vaccino dell epatite B (DNA ricombinante) 2. COMPOSIZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO HBVAXPRO 40 microgrammi/ml 1. DENOMINAZIONE DEL MEDICINALE HBVAXPRO 40 microgrammi/ml Sospensione iniettabile Vaccino dell epatite B (DNA ricombinante) 2. COMPOSIZIONE
ALLEGATOA alla Dgr n del 03 novembre 2014 pag. 1/5
 giunta regionale 9^ legislatura ALLEGATOA alla Dgr n. 2056 del 03 novembre 2014 pag. 1/5 PRESCRIZIONE DI PRODOTTI IMMUNOTERAPICI PROVVISTI DI AIC INDICATI NEL TRATTAMENTO DELLA RINITE ALLERGICA NELLA REGIONE
giunta regionale 9^ legislatura ALLEGATOA alla Dgr n. 2056 del 03 novembre 2014 pag. 1/5 PRESCRIZIONE DI PRODOTTI IMMUNOTERAPICI PROVVISTI DI AIC INDICATI NEL TRATTAMENTO DELLA RINITE ALLERGICA NELLA REGIONE
SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE
 ALLEGATO 1 SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE Cognome Nome Regione Comune ASL Codice fiscale Data di Nascita DATI ANAGRAFICI ED INFORMAZIONI
ALLEGATO 1 SORVEGLIANZA ATTIVA DEGLI EVENTI AVVERSI DOPO VACCINAZIONE ANTI-HPV SCHEDA CLINICA INDIVIDUALE Cognome Nome Regione Comune ASL Codice fiscale Data di Nascita DATI ANAGRAFICI ED INFORMAZIONI
RoActemra. tocilizumab. Che cos è RoActemra? Per che cosa si usa RoActemra? Riassunto destinato al pubblico
 EMA/18167/2014 EMEA/H/C/000955 Riassunto destinato al pubblico tocilizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
EMA/18167/2014 EMEA/H/C/000955 Riassunto destinato al pubblico tocilizumab Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per. Illustra il modo in cui il comitato per i medicinali
IDI FARMACEUTICI srl - Via dei Castelli Romani 83/85-00040 POMEZIA (Roma).
 ALOXIDIL 2% soluzione cutanea (Minoxidil) COMPOSIZIONE QUALI - QUANTITATIVA. L'ALOXIDIL è una soluzione contenente minoxidil, alla concentrazione del 2% (pari a 20 mg/ml) ed eccipienti costituiti da glicole
ALOXIDIL 2% soluzione cutanea (Minoxidil) COMPOSIZIONE QUALI - QUANTITATIVA. L'ALOXIDIL è una soluzione contenente minoxidil, alla concentrazione del 2% (pari a 20 mg/ml) ed eccipienti costituiti da glicole
Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici
 Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici Gruppo Multidisciplinare sui Farmaci Biologici in Reumatologia Regione Emilia Romagna C. Salvarani,
Trattamento Sistemico dell Artrite Reumatoide nell Adulto con particolare riferimento ai farmaci biologici Gruppo Multidisciplinare sui Farmaci Biologici in Reumatologia Regione Emilia Romagna C. Salvarani,
Allegato III. Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
Allegato III Emendamenti ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Gli emendamenti al riassunto delle caratteristiche del prodotto e al foglio
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
 SCHEDA PER LA PRESCRIZIONE DI ENBREL nella PSORIASI Farmaco H REGIONE LAZIO Paziente (Nome /Cognome) Codice Fiscale Data di Nascita sesso M F Regione di residenza dell assistito Azienda USL Domicilio:
SCHEDA PER LA PRESCRIZIONE DI ENBREL nella PSORIASI Farmaco H REGIONE LAZIO Paziente (Nome /Cognome) Codice Fiscale Data di Nascita sesso M F Regione di residenza dell assistito Azienda USL Domicilio:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
FARMACOVIGILANZA LORMETAZEPAM ZENTIVA 2,5 MG/ML GOCCE ORALI, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla Determinazione
Per alcune vaccinazioni, la protezione immunitaria indotta dura tutta la vita In altri casi, per ottenere una immunità protratta, sono necessari
 VACCINAZIONE La vaccinazione è una misura di profilassi che ha lo scopo di dare un immunità attiva specifica nei confronti di una determinata malattia infettiva. Per alcune vaccinazioni, la protezione
VACCINAZIONE La vaccinazione è una misura di profilassi che ha lo scopo di dare un immunità attiva specifica nei confronti di una determinata malattia infettiva. Per alcune vaccinazioni, la protezione
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di concentrato per soluzione per infusione contiene 10 mg di docetaxel.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Docetaxel Hospira 10 mg/ml Concentrato per Soluzione per Infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di concentrato
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Docetaxel Hospira 10 mg/ml Concentrato per Soluzione per Infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml di concentrato
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Medicinale non più autorizzato
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Docefrez 20 mg polvere e solvente per concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Docefrez 20 mg polvere e solvente per concentrato per soluzione per infusione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Modulo 4. Manifestazioni cliniche e possibili complicanze dell'asma allergico
 Modulo 4 Manifestazioni cliniche e possibili complicanze dell'asma allergico Classificazione di gravità prima dell inizio del trattamento STEP 4 Grave persistente STEP 3 Moderato persistente STEP 2 Lieve
Modulo 4 Manifestazioni cliniche e possibili complicanze dell'asma allergico Classificazione di gravità prima dell inizio del trattamento STEP 4 Grave persistente STEP 3 Moderato persistente STEP 2 Lieve
Introduzione. Tabella 1. Segnalazioni pervenute ad oggi relative al progetto Meap Nazionale
 Introduzione Ad oggi le segnalazioni di reazione avversa al farmaco pervenute al centro coordinatore del progetto Meap Nazionale sono 104 (Tabella 1.a.). Il 22% delle ADR sono risultate reazioni gravi
Introduzione Ad oggi le segnalazioni di reazione avversa al farmaco pervenute al centro coordinatore del progetto Meap Nazionale sono 104 (Tabella 1.a.). Il 22% delle ADR sono risultate reazioni gravi
PRESENTAZIONI ATIPICHE DELLE MALATTIE NELL ANZIANO. Prof. Giampaolo Bianchi Dipartimento di Scienze Mediche e Chirurgiche Università di Bologna
 PRESENTAZIONI ATIPICHE DELLE MALATTIE NELL ANZIANO Prof. Giampaolo Bianchi Dipartimento di Scienze Mediche e Chirurgiche Università di Bologna CAUSE PRINCIPALI: Alterata/diminuita risposta immunitaria
PRESENTAZIONI ATIPICHE DELLE MALATTIE NELL ANZIANO Prof. Giampaolo Bianchi Dipartimento di Scienze Mediche e Chirurgiche Università di Bologna CAUSE PRINCIPALI: Alterata/diminuita risposta immunitaria
Allegato III. Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo
 Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
Allegato III Modifiche ai paragrafi pertinenti del riassunto delle caratteristiche del prodotto e del foglio illustrativo Nota: Queste modifiche ai paragrafi pertinenti del Riassunto delle Caratteristiche
IldocumentoGOLD completo(w ORKSHOPREPORTS)èconsultabilesulsitowww.goldcopd.it
 GUIDA RAPIDA PER LA GESTIONE AMBULATORIALE DELLA BPCO Basatasuprogettoglobaleperladiagnosi,gestionee prevenzionebpco (Aggiornamento2007) IldocumentoGOLD completo(w ORKSHOPREPORTS)èconsultabilesulsitowww.goldcopd.it
GUIDA RAPIDA PER LA GESTIONE AMBULATORIALE DELLA BPCO Basatasuprogettoglobaleperladiagnosi,gestionee prevenzionebpco (Aggiornamento2007) IldocumentoGOLD completo(w ORKSHOPREPORTS)èconsultabilesulsitowww.goldcopd.it
GAZZETTA UFFICIALE DELLA REPUBBLICA ITALIANA Serie generale n. 115
 AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
AGENZIA ITALIANA DEL FARMACO DETERMINAZIONE 9 Maggio 2007 Modifica degli stampati dei medicinali contenenti farmaci antinfiammatori non steroidei (FANS) non selettivi per uso sistemico - ATC M01A. omissis
LO SHOCK ANAFILATTICO
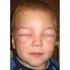 LO SHOCK ANAFILATTICO LO SHOCK - DEFINIZIONE Si definisce come una grave e diffusa alterazione della perfusione tessutale, che determina danno e morte cellulare GLI SHOCK - CLASSIFICAZIONE 1. IPOVOLEMICO
LO SHOCK ANAFILATTICO LO SHOCK - DEFINIZIONE Si definisce come una grave e diffusa alterazione della perfusione tessutale, che determina danno e morte cellulare GLI SHOCK - CLASSIFICAZIONE 1. IPOVOLEMICO
MORBILLO, PAROTITE E ROSOLIA (MPR) SCHEDA INFORMATIVA PER PERSONALE INFERMIERISTICO E AUSILIARIO
 MORBILLO, PAROTITE E ROSOLIA (MPR) SCHEDA INFORMATIVA PER PERSONALE INFERMIERISTICO E AUSILIARIO WHAT YOU NEED TO KNOW SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DAL MORBILLO, DALLA
MORBILLO, PAROTITE E ROSOLIA (MPR) SCHEDA INFORMATIVA PER PERSONALE INFERMIERISTICO E AUSILIARIO WHAT YOU NEED TO KNOW SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DAL MORBILLO, DALLA
LEUCEMIA LINFATICA CRONICA
 LEUCEMIA LINFATICA CRONICA NEOPLASIE (SINDROMI) LINFOPROLIFERATIVE CRONICHE Le sindromi linfoproliferative croniche sono malattie monoclonali neoplastiche prevalenti nell adulto anziano caratterizzate
LEUCEMIA LINFATICA CRONICA NEOPLASIE (SINDROMI) LINFOPROLIFERATIVE CRONICHE Le sindromi linfoproliferative croniche sono malattie monoclonali neoplastiche prevalenti nell adulto anziano caratterizzate
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO
 ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
ALLEGATO III MODIFICHE DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO E DEL FOGLIO ILLUSTRATIVO 25 MODIFICHE DA INCLUDERE NEI PARAGRAFI PERTINENTI DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO DELLE
I U N O VERE E FALSE CONTROINDICAZIONI AI VACCINI. Quaderni ASRI. SERVIZIO SANITARIO REGIONALE EMILIA-ROMAGNA Azienda Unità Sanitaria Locale di Rimini
 G 2010 I U G N O SERVIZIO SANITARIO REGIONALE EMILIA-ROMAGNA Azienda Unità Sanitaria Locale di Rimini Quaderni ASRI VERE E FALSE CONTROINDICAZIONI AI VACCINI 128 a cura di: Unità Pediatrica del Dipartimento
G 2010 I U G N O SERVIZIO SANITARIO REGIONALE EMILIA-ROMAGNA Azienda Unità Sanitaria Locale di Rimini Quaderni ASRI VERE E FALSE CONTROINDICAZIONI AI VACCINI 128 a cura di: Unità Pediatrica del Dipartimento
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE RoActemra 20 mg/ml concentrato per soluzione per infusione. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascun
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE RoActemra 20 mg/ml concentrato per soluzione per infusione. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ciascun
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE neohepatect 50 UI/ml; soluzione per infusione 2.COMPOSIZIONE QUALITATIVA E QUANTITATIVA Immunoglobulina umana anti epatite B
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE neohepatect 50 UI/ml; soluzione per infusione 2.COMPOSIZIONE QUALITATIVA E QUANTITATIVA Immunoglobulina umana anti epatite B
La sorveglianza degli eventi avversi a vaccino. Roberto Raschetti
 La sorveglianza degli eventi avversi a vaccino Studio sulle segnalazioni avverse da vaccino nei primi due anni di vita in Italia, 1999-2004 Obiettivi descrivere e quantificare gli eventi avversi a vaccini
La sorveglianza degli eventi avversi a vaccino Studio sulle segnalazioni avverse da vaccino nei primi due anni di vita in Italia, 1999-2004 Obiettivi descrivere e quantificare gli eventi avversi a vaccini
Terapia malattie infiammatorie croniche intestinali. IBD: rettocolite ulcerosa e morbo di Crohn
 Terapia malattie infiammatorie croniche intestinali IBD: rettocolite ulcerosa e morbo di Crohn Prevalenza EU e USA 1-2 per 1000 Sintomi: diarrea, dolore addominale, anemia, perdita di peso. Crohn: patologia
Terapia malattie infiammatorie croniche intestinali IBD: rettocolite ulcerosa e morbo di Crohn Prevalenza EU e USA 1-2 per 1000 Sintomi: diarrea, dolore addominale, anemia, perdita di peso. Crohn: patologia
ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI
 ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE
ALLEGATO CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE DEL FARMACO CHE DEVONO ESSERE IMPLEMENTATE DAGLI STATI MEMBRI CONDIZIONI O RESTRIZIONI RELATIVE ALL UTILIZZO SICURO ED EFFICACE
MANIFESTAZIONI NEUROLOGICHE IN CORSO DI INFEZIONE DA HIV
 MANIFESTAZIONI NEUROLOGICHE IN CORSO DI INFEZIONE DA HIV L'HIV è stato isolato nel tessuto cerebrale e nel liquor, edèpresente nel SNC fin dai primi stadi dell'infezione virale generalizzata I disturbi
MANIFESTAZIONI NEUROLOGICHE IN CORSO DI INFEZIONE DA HIV L'HIV è stato isolato nel tessuto cerebrale e nel liquor, edèpresente nel SNC fin dai primi stadi dell'infezione virale generalizzata I disturbi
DIF-TET-ALL -ADULTI sospensione iniettabile in siringa pre-riempita J07AM51 senza conservanti RIASSUNTO DELLE CARATTERISTICHE
 1 DIF-TET-ALL -ADULTI sospensione iniettabile in siringa pre-riempita J07AM51 senza conservanti RIASSUNTO DELLE CARATTERISTICHE Voce n. 7 1. DENOMINAZIONE DELLA SPECIALITÀ MEDICINALE: DIF-TET-ALL -ADULTI
1 DIF-TET-ALL -ADULTI sospensione iniettabile in siringa pre-riempita J07AM51 senza conservanti RIASSUNTO DELLE CARATTERISTICHE Voce n. 7 1. DENOMINAZIONE DELLA SPECIALITÀ MEDICINALE: DIF-TET-ALL -ADULTI
Cosa è l HPV. E un VIRUS Costituito da un nucleo centrale (core) di DNA rivestito da un involucro di natura proteica
 L INFEZIONE DA HPV Cosa è l HPV E un VIRUS Costituito da un nucleo centrale (core) di DNA rivestito da un involucro di natura proteica Identificati 100 tipi di HPV che possono interessare l uomo. Di questi
L INFEZIONE DA HPV Cosa è l HPV E un VIRUS Costituito da un nucleo centrale (core) di DNA rivestito da un involucro di natura proteica Identificati 100 tipi di HPV che possono interessare l uomo. Di questi
Terzo Meeting di Ematologia non Oncologica Firenze gennaio
 Dichiarazione di Trasparenza dei Rapporti Commerciali: La sottoscritta in qualità di Relatore, ai sensi dell art. 3.3 sul conflitto di interessi, dichiara che negli ultimi due anni non ha intrattenuto
Dichiarazione di Trasparenza dei Rapporti Commerciali: La sottoscritta in qualità di Relatore, ai sensi dell art. 3.3 sul conflitto di interessi, dichiara che negli ultimi due anni non ha intrattenuto
DIFTERITE, TETANO E PERTOSSE
 DIFTERITE, TETANO E PERTOSSE SCHEDA INFORMATIVA PER PERSONALE INFIERMERISTICO E AUSILIARIO WHAT YOU NEED TO KNOW SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DALLA DIFTERITE, DAL
DIFTERITE, TETANO E PERTOSSE SCHEDA INFORMATIVA PER PERSONALE INFIERMERISTICO E AUSILIARIO WHAT YOU NEED TO KNOW SEI SICURO DI USARE MISURE DI PREVENZIONE ADEGUATE PER PROTEGGERTI DALLA DIFTERITE, DAL
 www.fisiokinesiterapia.biz LA TERAPIA DELL ARTRITE REUMATOIDE Concetti introduttivi e nuove terapie farmacologiche MODELLO EVOLUTIVO AR A- Popolazione generale + Fattori di rischio B- Poliartrite infiammatoria
www.fisiokinesiterapia.biz LA TERAPIA DELL ARTRITE REUMATOIDE Concetti introduttivi e nuove terapie farmacologiche MODELLO EVOLUTIVO AR A- Popolazione generale + Fattori di rischio B- Poliartrite infiammatoria
Progetto M.E.A.P. (Monitoraggio degli Eventi Avversi in Pediatria) RAPPORTO BIMESTRALE (gennaio-febbraio)
 Progetto M.E.A.P. (Monitoraggio degli Eventi Avversi in Pediatria) RAPPORTO BIMESTRALE (gennaio-febbraio) Anno 2010 1 Introduzione Nel bimestre gennaio-febbraio 2010, sono pervenute al centro coordinatore
Progetto M.E.A.P. (Monitoraggio degli Eventi Avversi in Pediatria) RAPPORTO BIMESTRALE (gennaio-febbraio) Anno 2010 1 Introduzione Nel bimestre gennaio-febbraio 2010, sono pervenute al centro coordinatore
DIAGNOSI DIFFERENZIALE INTEGRATA
 DIAGNOSI DIFFERENZIALE INTEGRATA SINTOMI GENERALI Variazioni ponderali Affaticamento e debolezza Sudorazioni e variazioni termiche Dolore VARIAZIONI PONDERALI Chiedere se ha seguito una dieta specifica,
DIAGNOSI DIFFERENZIALE INTEGRATA SINTOMI GENERALI Variazioni ponderali Affaticamento e debolezza Sudorazioni e variazioni termiche Dolore VARIAZIONI PONDERALI Chiedere se ha seguito una dieta specifica,
La vaccinazione HPV in Friuli Venezia Giulia
 La vaccinazione HPV in Friuli Venezia Giulia T. Gallo Azienda Sanitaria Universitaria Integrata Udine Trieste, 12 giugno 2017 Strategia vaccinale contro l HPV in Italia Intesa Stato-Regioni 20/12/2007:
La vaccinazione HPV in Friuli Venezia Giulia T. Gallo Azienda Sanitaria Universitaria Integrata Udine Trieste, 12 giugno 2017 Strategia vaccinale contro l HPV in Italia Intesa Stato-Regioni 20/12/2007:
16/01/2017. Regione Puglia
 Regione Puglia Lo stato di salute dell anziano in Puglia e i benefici delle corrette politiche vaccinali per la prevenzione di influenza, polmonite pneumococcica e herpes zoster Cinzia Germinario 1 Epidemiologia
Regione Puglia Lo stato di salute dell anziano in Puglia e i benefici delle corrette politiche vaccinali per la prevenzione di influenza, polmonite pneumococcica e herpes zoster Cinzia Germinario 1 Epidemiologia
prodotto nel lievito Saccharomyces cerevisiae (ceppo ) mediante tecnologia del DNA ricombinante
 1. DENOMINAZIONE DEL MEDICINALE HBVAXPRO 10 microgrammi sospensione iniettabile in siringa pre-riempita Vaccino dell epatite B (DNA ricombinante) 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una dose (1
1. DENOMINAZIONE DEL MEDICINALE HBVAXPRO 10 microgrammi sospensione iniettabile in siringa pre-riempita Vaccino dell epatite B (DNA ricombinante) 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una dose (1
Additions appear in italics and underlined deletions in italics and strikethrough
 ALLEGATO III 1 AMENDMENTS TO BE INCLUDED IN THE RELEVANT SECTIONS OF THE SUMMARY OF PRODUCT CHARACTERISTICS OF NIMESULIDE CONTAINING MEDICINAL PRODUCTS (SYSTEMIC FORMULATIONS) Additions appear in italics
ALLEGATO III 1 AMENDMENTS TO BE INCLUDED IN THE RELEVANT SECTIONS OF THE SUMMARY OF PRODUCT CHARACTERISTICS OF NIMESULIDE CONTAINING MEDICINAL PRODUCTS (SYSTEMIC FORMULATIONS) Additions appear in italics
batrevac sospensione iniettabile vaccino influenzale
 batrevac sospensione iniettabile vaccino influenzale RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Batrevac sospensione iniettabile (vaccino influenzale inattivato preparato
batrevac sospensione iniettabile vaccino influenzale RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Batrevac sospensione iniettabile (vaccino influenzale inattivato preparato
FOCUSVEN 5% GEL. Benzidamina cloridrato Gel
 FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
FOCUSVEN 5% GEL Benzidamina cloridrato Gel CATEGORIA FARMACO TERAPEUTICA Antinfiammatorio non steroideo per uso topico INDICAZIONI TERAPEUTICHE Dolori muscolari ed articolari, flebiti acute e croniche.
DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE. Variazioni degli stampati relativamente agli aspetti della sicurezza
 FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
FARMACOVIGILANZA DORZOLAMIDE E TIMOLOLO ZENTIVA 20 MG/ML + 5 MG/ML COLLIRIO, SOLUZIONE Variazioni degli stampati relativamente agli aspetti della sicurezza Le modifiche agli stampati sono conseguenti alla
PROFILASSI IMMUNITARIA
 PROFILASSI IMMUNITARIA Ha lo scopo di aumentare la resistenza dei soggetti sani verso gli agenti patogeni e si basa su : VACCINOPROFILASSI SIEROPROFILASSI VACCINOPROFILASSI I vaccini sono dei preparati
PROFILASSI IMMUNITARIA Ha lo scopo di aumentare la resistenza dei soggetti sani verso gli agenti patogeni e si basa su : VACCINOPROFILASSI SIEROPROFILASSI VACCINOPROFILASSI I vaccini sono dei preparati
( ) %'!"#$%!&'(!)*%%+!,-.$%!$/ $%!&.$%!*# 0 # $, $%!-'(!)"$& +1 (( (!)*%%!"(!!($%!&(
 !"##"$!"!" %""!&"' ) %'!"#$%!&'!)*%%+!,-.$%!$/ $%!&.$%!*# 0 # $, $%!-'!)"$& +1!)*%%!"!!$%!&!,-.$%!$/ $%!&.$%!*# 2*+## $!!"!"! ""!&"*#,-!*! 1/3 4 56 78!9#7 # 6 1#/ 3 ' *,,!:%"$%!- 6 / #6,*)$!*;$:%"$%!-'
!"##"$!"!" %""!&"' ) %'!"#$%!&'!)*%%+!,-.$%!$/ $%!&.$%!*# 0 # $, $%!-'!)"$& +1!)*%%!"!!$%!&!,-.$%!$/ $%!&.$%!*# 2*+## $!!"!"! ""!&"*#,-!*! 1/3 4 56 78!9#7 # 6 1#/ 3 ' *,,!:%"$%!- 6 / #6,*)$!*;$:%"$%!-'
Patologie del sistema emolinfopoietico Molto rari: Linfoadenopatia 1 Disturbi del metabolismo e della nutrizione Comuni: perdita di appetito 2 Disturb
 di effetti indesiderati correlabili a precedenti immunizzazioni. La presenza di infezioni lievi non costituisce controindicazione. L'infezione da virus HIV non è considerata una controindicazione. A scopo
di effetti indesiderati correlabili a precedenti immunizzazioni. La presenza di infezioni lievi non costituisce controindicazione. L'infezione da virus HIV non è considerata una controindicazione. A scopo
La vaccinazione per l influenza stagionale
 La vaccinazione per l influenza stagionale Sigismondo Ferrante 1 12 settembre 2009 2 Roma, 23 luglio2009 1 Obiettivi della campagna vaccinale stagionale contro l influenza riduzione del rischio individuale
La vaccinazione per l influenza stagionale Sigismondo Ferrante 1 12 settembre 2009 2 Roma, 23 luglio2009 1 Obiettivi della campagna vaccinale stagionale contro l influenza riduzione del rischio individuale
Il glatiramer acetato è efficace per il trattamento della sclerosi multipla recidivante-remittente? Come si confronta con l interferone beta?
 Round 1, Question 1 Il glatiramer acetato è efficace per il trattamento della sclerosi multipla recidivante-remittente? Come si confronta con l interferone beta? Round 1, Question 2 Quale antibiotico è
Round 1, Question 1 Il glatiramer acetato è efficace per il trattamento della sclerosi multipla recidivante-remittente? Come si confronta con l interferone beta? Round 1, Question 2 Quale antibiotico è
ASSISTENZA. Le segnalazioni di reazioni avverse ai farmaci nella ASL BT nel 2009
 ASSISTENZA Le segnalazioni di reazioni avverse ai farmaci nella ASL BT nel 2009 Nel 23,6% dei casi registrati è stato necessario ospedalizzare il paziente o prolungarne la degenza Ancona Domenica (1) Antifora
ASSISTENZA Le segnalazioni di reazioni avverse ai farmaci nella ASL BT nel 2009 Nel 23,6% dei casi registrati è stato necessario ospedalizzare il paziente o prolungarne la degenza Ancona Domenica (1) Antifora
EFFETTI DEGLI INCIDENTI CON ELEMENTI DI PRIMO
 Manuale Operativo SEPES Capitolo 4 EFFETTI DEGLI INCIDENTI CON ELEMENTI DI PRIMO SOCCORSO II PARTE 4.6 GRAVE REAZIONE ALLERGICA (anafilassi) Dott.ssa Carla Debbia Si tratta di una gravissima reazione allergica,
Manuale Operativo SEPES Capitolo 4 EFFETTI DEGLI INCIDENTI CON ELEMENTI DI PRIMO SOCCORSO II PARTE 4.6 GRAVE REAZIONE ALLERGICA (anafilassi) Dott.ssa Carla Debbia Si tratta di una gravissima reazione allergica,
INFARTO MIOCARDICO ACUTO: ISCHEMIA MIOCARDICA PROLUNGATA CON NECROSI CELLULARE DOVUTA A PATOLOGIE CORONARICHE, DISTURBI DEL RITMO, TROMBO-EMBOLIE
 1" ANGINA PECTORIS: DOLORE AL PETTO CHE DURA SOLO POCHI MINUTI E SCOMPARE CON IL RIPOSO A CAUSA DI UNA DISCREPANZA FABBISOGNO E CAPACITÀ DI RIFORNIMENTO DI O 2 INFARTO MIOCARDICO ACUTO: ISCHEMIA MIOCARDICA
1" ANGINA PECTORIS: DOLORE AL PETTO CHE DURA SOLO POCHI MINUTI E SCOMPARE CON IL RIPOSO A CAUSA DI UNA DISCREPANZA FABBISOGNO E CAPACITÀ DI RIFORNIMENTO DI O 2 INFARTO MIOCARDICO ACUTO: ISCHEMIA MIOCARDICA
Insufficienza cardiaca cronica (ICC)
 Insufficienza cardiaca cronica (ICC) Dr. med Nicola Ferrari Medico capoclinica CCT 19 novembre 2011 Classi funzionali NYHA (New York Heart Association) Parametro di giudizio: sintomo Dispnea 1 2 3 4 Nessuna
Insufficienza cardiaca cronica (ICC) Dr. med Nicola Ferrari Medico capoclinica CCT 19 novembre 2011 Classi funzionali NYHA (New York Heart Association) Parametro di giudizio: sintomo Dispnea 1 2 3 4 Nessuna
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. HBVAXPRO 5 microgrammi/0,5 ml
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO HBVAXPRO 5 microgrammi/0,5 ml 1. DENOMINAZIONE DEL MEDICINALE HBVAXPRO 5 microgrammi/0,5 ml Sospensione iniettabile Vaccino dell epatite B (DNA ricombinante)
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO HBVAXPRO 5 microgrammi/0,5 ml 1. DENOMINAZIONE DEL MEDICINALE HBVAXPRO 5 microgrammi/0,5 ml Sospensione iniettabile Vaccino dell epatite B (DNA ricombinante)
EVENTI MAGGIORI CARDIOVASCOLARI E CEREBROVASCOLARI (MACCE) A 12 MESI NEI SOPRAVVISSUTI AD INFARTO ACUTO DEL MIOCARDIO. PROTOCOLLO OPERATIVO
 EVENTI MAGGIORI CARDIOVASCOLARI E CEREBROVASCOLARI (MACCE) A 12 MESI NEI SOPRAVVISSUTI AD INFARTO ACUTO DEL MIOCARDIO. PROTOCOLLO OPERATIVO - Definizione Per ASL di residenza: proporzione di pazienti sopravvissuti
EVENTI MAGGIORI CARDIOVASCOLARI E CEREBROVASCOLARI (MACCE) A 12 MESI NEI SOPRAVVISSUTI AD INFARTO ACUTO DEL MIOCARDIO. PROTOCOLLO OPERATIVO - Definizione Per ASL di residenza: proporzione di pazienti sopravvissuti
Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali. Meccanismo di azione e interazioni farmacologiche
 A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Fendrix sospensione iniettabile Vaccino antiepatite B (rdna) (adiuvato, adsorbito). 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Fendrix sospensione iniettabile Vaccino antiepatite B (rdna) (adiuvato, adsorbito). 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Medicinale non più autorizzato
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE MabCampath 10 mg/ml concentrato per soluzione per infusione. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml contiene
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE MabCampath 10 mg/ml concentrato per soluzione per infusione. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 1 ml contiene
Principi attivi Anatossina difterica purificata...non meno di 2 U.I.* Anatossina tetanica purificata...non meno di 20 U.I.**
 Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE DIFTAVAX sospensione iniettabile. Vaccino difterico e tetanico adsorbito per adulti e bambini di età superiore a 7 anni. 2.
Riassunto delle caratteristiche del prodotto 1. DENOMINAZIONE DEL MEDICINALE DIFTAVAX sospensione iniettabile. Vaccino difterico e tetanico adsorbito per adulti e bambini di età superiore a 7 anni. 2.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. HBVAXPRO 10 microgrammi/ml
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO HBVAXPRO 10 microgrammi/ml 1. DENOMINAZIONE DEL MEDICINALE HBVAXPRO 10 microgrammi/ml Sospensione iniettabile Vaccino dell epatite B (DNA ricombinante) 2. COMPOSIZIONE
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO HBVAXPRO 10 microgrammi/ml 1. DENOMINAZIONE DEL MEDICINALE HBVAXPRO 10 microgrammi/ml Sospensione iniettabile Vaccino dell epatite B (DNA ricombinante) 2. COMPOSIZIONE
