REGISTRO DELLE LEZIONI 2005/2006. Tipologia
|
|
|
- Gabriela Casagrande
- 5 anni fa
- Visualizzazioni
Transcript
1 Presentazione del corso e degli obiettivi formativi. Norme di sicurezza in laboratorio. Analisi volumetrica: generalità, alcalimetria, acidimetria, sostanze madri, indicatori di neutralizzazione normali, misti, schermati e loro scelta. Normex. Teoria della preparazione di NaOH esente da carbonati. Organizzazione di un quaderno di laboratorio. Determinazione sperimentale del titolo di HCl circa 0,1 N con indicatore giusto ed errato, per l'individuazione di un errore sistematico. Determinazione sperimentale del titolo di NaOH esente da carbonati con HCl previamente titolato. Addì Addì Teoria della determinazione di miscele: NaOH + Na2CO3 con metodo di Warder e di Winkler; NaHCO3 + Na2CO3 e calcoli relativi. Costruzione curve di titolazione per l'evidenziazione del punto equivalente e relativa scelta dell'indicatore per Acido Forte + Base Forte e per Na2CO3 + HCl. Principi della titolazione di acidi poliprotici e curva di titolazione di H3PO4. ANALISI CONTROLLATA: Determinazione di H3PO4 con NaOH previamente titolata. Addì Addì Argentometria: generalità, metodi di Mohr, Fajans ed indicatori di adsorbimento, metodo indiretto di Volhard. Costruzione curva di titolazione pcl/ml Ag+. Ricerca del titolo di AgNO3 circa 0,1 N con metodo di Mohr. Addì Addì
2 ANALISI CONTROLLATA: Determinazione dello ione Br- con il metodo di Fajans. Permanganometria: generalità, ricerca del titolo di KMnO4 circa 0,1 N con C2O4=, As2O3, Fe elettrolitico, esempi di analisi dirette ed indirette(h2o2, S2O8=, C2O4=); metodo di Zimmermann-Reinhardt per i minerali di Fe. Calcolo numerico per la determinaziuone dei volumi di H2O2. Addì Addì Ricerca del titolo di KMnO4 circa 0,1 N con Na2C2O3. ANALISI CONTROLLATA:determinazione dello ione C2O4=. Applicazione della statistica ai dati sperimentali: calcolo delle medie e delle deviazioni standard; confronto di una media sperimentale con un valore noto; saggio di significatività(test F o di Snedecor), test Q, o di Dixon-Dean, per lo scarto di un valore all'apparenza discordante. Addì Addì Iodo-Iodimetria: generalità, importanza del ph, ricerca del titolo di S2O3= con IO3-, BrO3-, MnO4-;Cr2O7= e di I2 con As2O3 e tampone. Esempi di analisi: Cu++, Pb++ (indiretta), polvere sbiancante (cloro attivo), clorati, ipocloriti, solfiti e bisolfiti. Ricerca del titolo di Na2S2O3 circa 0,1 N. Calcoli statistici applicati ai dati sperimentali ottenuti. Addì Addì
3 Bicromatometria, Cerimetria: generalità e vantaggi rispetto al KMnO4, indicatori di ox-red, esempi di analisi. Iodatometria: generalità e reazioni concomitanti, esempi di analisi. Bromatometria: generalità ed esempi di analisi dirette ed indirette (metalli con orto-idrossichinolina). Inizio ANALISI CONTROLLATA: Pb++ precipitato come cromato e sua determinazione iodometrica indiretta. Addì Addì Errore relativo in analisi volumetrica per neutralizzazioni, precipitazioni, ossido-riduzioni, complessamenti. Curva fi/logc, pendenza e sua importanza. Esercizi numerici. Continuazione analisi Pb++ Addì Addì Statistica: Gaussiana e grandezze caratteristiche. Coefficiente t di Student, intervalli di confidenza; confronto di medie (test t appaiato, confronto di differenze individuali) ed esempi numerici. Correlazione e coefficiente di correlazione. Continuazione analisi Pb++. Addì Addì
4 Campionamento di materiali eterogenei e segregati, applicazione di metodi statistici ed esempi numerici. Complessometria: metodi di Liebig e Liebig-Dénigès per la determinazione dei Cianuri con Ag+ a titolo noto. Andamento della curva pag/fi. Chelometria: generalità, indicatori metallocromici, mascheranti e demascheranti, metodi di analisi diretto, retrotitolazione, spostamento e determinazione indiretta di anioni. Andamento della curva pm/ml di EDTA in relazione alla costante di stabilità del complesso. Addì ANALISI CONTROLLATA: Idrazina con KIO3 in ambiente fortemente cloridrico. Addì Analisi gravimetrica: aspetti teorici della precipitazione, proprietà dei colloidi, tecnica operativa, precipitazione omogenea, agenti precipitanti organici, peso appropriato del campione, esempi di analisi indirette, volatilizzazione, estrazione, accenno all'analisi elettrogravimetrica. Separazioni: brevi cenni di cromatog. di adsorb., ripartizione, scambio ionico ed es. di separazine di cationi. Separazione per formazione di complessi e mediante precipitazione. Addì ANALISI CONTROLLATA: determinazione di Zn++ con EDTA 0,05 M Addì Potenziometria: tipi di elettrodi, legge di Nernst, pila, determinazione della FEM di una pila con il metodo di Poggendorff. Curve di titolazione potenziometriche di neutralizzazione, di precipitazione e di ossido-riduzione. ANALISI CONTROLLATA: Separazione Ca++/Mg++ con EDTA 0,05 M. Addì Addì
5 Elettrolisi diretta e a potenziale controllato, schema circuito, ricerca pratica del potenziale di scarica incognito di una sostanza, determinazione della corrente iniziale e di k per la determinazione della quantità di elettricità Q,depolarizzanti. Leggi di Faraday. Elettrogravimetria e titolazioni coulombometriche. Cenno ai vari elettrodi iono-selettivi e al loro uso, importanza della costante di selettività. Addì ANALISI STRUMENTALE: Analisi potenziometrica: Fe++ con Ce+4 0,01 N; H3PO4 con NaOH 0,1000 N. Ricerca del punto equivalente con la regola del prolungamento dei tratti rettilinei ed elaborazione dati. Addì Introduzione alla voltammetria, polarografia, mono e biamperometria. Spiegazione dell'esperienza biamperometrica di I2 con S2O3=. Esercitazione sulle Ox-Red. ANALISI STRUMENTALE: determinazione I- + Cl- con metodo potenziometrico; determinazione I2 con metodo biamperometrico. Costruzione grafici ed elaborazione dati. Addì Addì Spettrofotometria: generalità, dimostrazione della legge di Lambert-Beer, determinazione pratica del coefficiente di estinzione, applicazioni della spettrofotometria con particolare riguardo alle curve di titolazione spettrofotometriche. Spiegazione dell'esperienza di laboratorio, in UV, per la determinazione di una concentrazione incognita di KMnO4, con la curva di calibrazione e determinazione delle concentrazioni dei componenti la miscela KMnO4 e K2Cr2O7. Addì ANALISI STRUMENTALE: Determinazione elettrogravimetrica di Cu++ e determinazione coulombometrica di Na2S2O3 con I2 generato in situ. Addì
6 HPLC: richiami sui processi cromatografici di adsorbimento, ripartizione, scambio ionico ed esclusione dimensionale. Meccanismo separativo, migrazione differenziale e allargamento di banda, fattori che la producono. Applicabilità dell'hplc: preparativa, semipreparativa e analitica. Cromatografo analitico tradizionale e nuove evoluzioni. Descrizione dettagliata di tutte le parti costituenti l'hplc e loro funzionamento. Addì Determinazione qualitativa e quantitativa, con HPLC, della caffeina in un estratto di the, mediante curva di calibrazione. Addì :00-11:00 AAS: generalità sull'assorbimento atomico,aas a fiamma e con fornetto a grafite, descrizione particolareggiata, funzionamento e loro uso. Determinazione, con fornetto a grafite, dello ione Manganese in acqua, seguendo il metodo delle aggiunte standard Addì Addì AAS: determinazione del Magnesio in acqua con la fiamma e curva di calibrazione. Spettrofotometria: determinazione quantitativa dei componenti una miscela (KMnO4 + K2Cr2O7) con curva di calibrazione. Cromatografia e Gas Cromatografia: principi teorici, messa a punto del gas cromatografo, spiegazione del metodo dello standard interno e della esperienza sulla quantificazione, per mezzo del suddetto metodo, della caffeina nella Coca Cola e nella Red Bull, usando la teofillina come standard interno. Addì Addì :00-18:00 10:00-12:00
7 Inizio determinazione della caffeina: preparazione dei campioni, iniziando dall'estrazione. Continuazione della determinazione della caffeina nella Coca Cola e nella Red Bull, con Teofillina come standatd interno, previa estrazione e costruzione della curva di calibrazione. Addì Addì :00-13:00 15:00-18:00 Elaborazione dei dati ottenuti mediante il soft dello strumento ed analisi critica dei suddetti dati. Addì
REGISTRO DELLE LEZIONI 2004/2005. Addì Tipologia. Addì Tipologia
 Introduzione al corso Introduzione alla Analisi dei medicinali Codici di purezza Farmacopea Cenni di gravimetria Addì 27-09-2004 Addì 28-09-2004 Attrezzature per l analisi quantitativa. Bilance a doppio
Introduzione al corso Introduzione alla Analisi dei medicinali Codici di purezza Farmacopea Cenni di gravimetria Addì 27-09-2004 Addì 28-09-2004 Attrezzature per l analisi quantitativa. Bilance a doppio
Descrizione del Corso Il corso è articolato in lezioni teoriche ed esercitazioni sperimentali.
 Informazioni Corso Scuola di Farmacia e Nutraceutica Corso di Laurea Magistrale in Farmacia Analisi dei Medicinali I SSD: CHIM/08 CFU 9 II anno, II semestre A.A. 2017/18 Informazioni Docente Anna Artese,
Informazioni Corso Scuola di Farmacia e Nutraceutica Corso di Laurea Magistrale in Farmacia Analisi dei Medicinali I SSD: CHIM/08 CFU 9 II anno, II semestre A.A. 2017/18 Informazioni Docente Anna Artese,
Corso di Laurea triennale in Chimica
 Università degli Studi di Cagliari Corso di Laurea triennale in Chimica Chimica Analitica I e Laboratorio 1 (Modulo A) CFU 6 Docente Prof. Davide Atzei SSD CHIM/01 Tel. +39 070 675 4460 Fa. +39 070 675
Università degli Studi di Cagliari Corso di Laurea triennale in Chimica Chimica Analitica I e Laboratorio 1 (Modulo A) CFU 6 Docente Prof. Davide Atzei SSD CHIM/01 Tel. +39 070 675 4460 Fa. +39 070 675
PROGRAMMA SVOLTO A. S. 2014/ istituto "ALBERTI-PORRO" Analisi Chimica 3 E
 Nome docenti Castellino Daniele Romagnollo Lidia Materia insegnata Analisi Chimica Classe Previsione numero ore di insegnamento 3 E ore complessive di insegnamento di cui in compresenza di cui di approfondimento
Nome docenti Castellino Daniele Romagnollo Lidia Materia insegnata Analisi Chimica Classe Previsione numero ore di insegnamento 3 E ore complessive di insegnamento di cui in compresenza di cui di approfondimento
ISTITUTO SUPERIORE ENRICO FERMI. PROGRAMMAZIONE DEL GRUPPO DISCIPLINARE a.s. 2018//2019 INDIRIZZO SCOLASTICO: BIENNIO IT X TRIENNIO IT LSSA
 ISTITUTO SUPERIORE ENRICO FERMI PROGRAMMAZIONE DEL GRUPPO DISCIPLINARE a.s. 2018//2019 INDIRIZZO SCOLASTICO: BIENNIO IT X TRIENNIO IT LSSA DISCIPLINA: Chimica Analitica Strumentale CLASSE: IV CCH ORE SETTIMANALI:
ISTITUTO SUPERIORE ENRICO FERMI PROGRAMMAZIONE DEL GRUPPO DISCIPLINARE a.s. 2018//2019 INDIRIZZO SCOLASTICO: BIENNIO IT X TRIENNIO IT LSSA DISCIPLINA: Chimica Analitica Strumentale CLASSE: IV CCH ORE SETTIMANALI:
CHIMICA ANALITICA INTRODUZIONE
 CHIMICA ANALITICA INTRODUZIONE Carlo I.G. Tuberoso Appunti didattici uso laboratorio ver. 00 La CHIMICA ANALITICA è definita la disciplina scientifica che sviluppa e applica metodi, strumenti e strategie
CHIMICA ANALITICA INTRODUZIONE Carlo I.G. Tuberoso Appunti didattici uso laboratorio ver. 00 La CHIMICA ANALITICA è definita la disciplina scientifica che sviluppa e applica metodi, strumenti e strategie
PROGRAMMAZIONE ANNUALE DI ANALISI CHIMICA
 ISTITUTO TECNICO INDUSTRIALE B. PASCAL PROGRAMMAZIONE ANNUALE DI ANALISI CHIMICA Anno scolastico 2012/13 Classi 4A chim Docenti prof.ssa Emilia Angelini prof.ssa Cristina Giacobbe Finalità Fornire le basi
ISTITUTO TECNICO INDUSTRIALE B. PASCAL PROGRAMMAZIONE ANNUALE DI ANALISI CHIMICA Anno scolastico 2012/13 Classi 4A chim Docenti prof.ssa Emilia Angelini prof.ssa Cristina Giacobbe Finalità Fornire le basi
Parti svolte dal libro di testo Chimica Analitica Quantitativa
 PROGRAMMA DEL CORSO DI CHIMICA ANALITICA 1 CON LABORATORIO a.a. 2007-2008 E stato seguito il testo: Daniel C. Harris, Chimica Analitica Quantitativa, Seconda Edizione Italiana, Ed. Zanichelli, 2005 mentre
PROGRAMMA DEL CORSO DI CHIMICA ANALITICA 1 CON LABORATORIO a.a. 2007-2008 E stato seguito il testo: Daniel C. Harris, Chimica Analitica Quantitativa, Seconda Edizione Italiana, Ed. Zanichelli, 2005 mentre
PROGRAMMA DEL CORSO DI CHIMICA ANALITICA 1 CON LABORATORIO a.a
 PROGRAMMA DEL CORSO DI CHIMICA ANALITICA 1 CON LABORATORIO a.a. 2009-2010 Testo consigliato: Daniel C. Harris, Chimica Analitica Quantitativa, Seconda Edizione Italiana, Ed. Zanichelli, 2005 Alcune parti
PROGRAMMA DEL CORSO DI CHIMICA ANALITICA 1 CON LABORATORIO a.a. 2009-2010 Testo consigliato: Daniel C. Harris, Chimica Analitica Quantitativa, Seconda Edizione Italiana, Ed. Zanichelli, 2005 Alcune parti
CHIMICA ANALITICA I E LABORATORIO A - L
 DIPARTIMENTO DI SCIENZE CHIMICHE Corso di laurea in Chimica Anno accademico 2017/2018-2 anno CHIMICA ANALITICA I E LABORATORIO A - L 12 CFU - 1 semestre Docente titolare dell'insegnamento GIUSEPPE ARENA
DIPARTIMENTO DI SCIENZE CHIMICHE Corso di laurea in Chimica Anno accademico 2017/2018-2 anno CHIMICA ANALITICA I E LABORATORIO A - L 12 CFU - 1 semestre Docente titolare dell'insegnamento GIUSEPPE ARENA
1)Calcolare il ph di una soluzione che contenga al9%(w/w)naoh ed abbia una densità pari a 1.098g/ml.
 Compito di Analisi dei farmaci I Bari,3 febbraio 1999 1)Calcolare il ph di una soluzione che contenga al9%(w/w)naoh ed abbia una densità pari a 1.098g/ml. 1)Quale deve essere la sensibilità della bilancia
Compito di Analisi dei farmaci I Bari,3 febbraio 1999 1)Calcolare il ph di una soluzione che contenga al9%(w/w)naoh ed abbia una densità pari a 1.098g/ml. 1)Quale deve essere la sensibilità della bilancia
REGISTRO DELLE LEZIONI 2004/2005. Tipologia. Addì Tipologia. Addì Tipologia
 Presentazione del corso. Stadi di una anlisi: campionamento, trattamento dei costituenti, analisi, calcolo ed interpretazione dati. Cifre significative ed approssimazione. Misure della concentrazione in
Presentazione del corso. Stadi di una anlisi: campionamento, trattamento dei costituenti, analisi, calcolo ed interpretazione dati. Cifre significative ed approssimazione. Misure della concentrazione in
Chimica Analitica Docente di riferimento Prof. DANILO SCIARRONE.
 Docente di riferimento Prof. DANILO SCIARRONE http://www.sepsci.unime.it dsciarrone@unime.it INTRODUZIONE Obiettivi formativi Il corso di fornisce allo Studente le nozioni fondamentali di chimica analitica
Docente di riferimento Prof. DANILO SCIARRONE http://www.sepsci.unime.it dsciarrone@unime.it INTRODUZIONE Obiettivi formativi Il corso di fornisce allo Studente le nozioni fondamentali di chimica analitica
Programmazione di CHIMICA ANALITICA E STRUMENTALE. Classe: 4 a A CHIMICI
 R E P U B B L I C A I T A L I A N A I.T.I. MINERARIO G. ASPRONI - IGLESIAS A.S. 2014-2015 Programmazione di CHIMICA ANALITICA E STRUMENTALE Classe: 4 a A CHIMICI INSEGNANTE TEORICO Silvia Chinedda INSEGNANTE
R E P U B B L I C A I T A L I A N A I.T.I. MINERARIO G. ASPRONI - IGLESIAS A.S. 2014-2015 Programmazione di CHIMICA ANALITICA E STRUMENTALE Classe: 4 a A CHIMICI INSEGNANTE TEORICO Silvia Chinedda INSEGNANTE
A.S. 2016/2017 PROGRAMMA SVOLTO E INDICAZIONI PER IL RECUPERO ESTIVO. Proff. ZANNI PAOLO e FRANCHINI MANUELA. docenti di ANALISI CHIMICA STRUMENTALE
 A.S. 2016/2017 PROGRAMMA SVOLTO E INDICAZIONI PER IL RECUPERO ESTIVO Proff. ZANNI PAOLO e FRANCHINI MANUELA docenti di ANALISI CHIMICA STRUMENTALE Classe 3^B Moduli Contenuti Mod. 1 L atomo e la mole,
A.S. 2016/2017 PROGRAMMA SVOLTO E INDICAZIONI PER IL RECUPERO ESTIVO Proff. ZANNI PAOLO e FRANCHINI MANUELA docenti di ANALISI CHIMICA STRUMENTALE Classe 3^B Moduli Contenuti Mod. 1 L atomo e la mole,
Misure di ph e titolazione acidobase con metodo potenziometrico
 - Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
- Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
LABORATORIO DI ANALISI DEI FARMACI II A - L
 DIPARTIMENTO DI SCIENZE DEL FARMACO Corso di laurea magistrale in Chimica e tecnologia farmaceutiche Anno accademico 2017/2018-3 anno LABORATORIO DI ANALISI DEI FARMACI II A - L CHIM/08-6 CFU - 1 semestre
DIPARTIMENTO DI SCIENZE DEL FARMACO Corso di laurea magistrale in Chimica e tecnologia farmaceutiche Anno accademico 2017/2018-3 anno LABORATORIO DI ANALISI DEI FARMACI II A - L CHIM/08-6 CFU - 1 semestre
Analisi Chimico-Farmaceutiche e Tossicologiche 1
 Analisi Chimico-Farmaceutiche e Tossicologiche 1 Corso A (A H) Prof.ssa Alessia Carocci E-mail: alessia.carocci@uniba.it Studio: stanza 429, III Piano Tel: 080/5442745 Ricevimento studenti: lunedì, mercoledì,
Analisi Chimico-Farmaceutiche e Tossicologiche 1 Corso A (A H) Prof.ssa Alessia Carocci E-mail: alessia.carocci@uniba.it Studio: stanza 429, III Piano Tel: 080/5442745 Ricevimento studenti: lunedì, mercoledì,
REGISTRO DELLE LEZIONI 2005/2006. Tipologia. Addì Tipologia. Addì Tipologia
 Presentazione del corso. Modalità di svolgimento della prova di esame. Introduzione all'analisi organica qualitativa. Analisi organica qualitativa: comportamento alla calcinazione. Saggio di Laissagne
Presentazione del corso. Modalità di svolgimento della prova di esame. Introduzione all'analisi organica qualitativa. Analisi organica qualitativa: comportamento alla calcinazione. Saggio di Laissagne
PROGRAMMAZIONE ANNUALE DI ANALISI CHIMICA. Finalità
 ISTITUTO TECNICO INDUSTRIALE B. PASCAL PROGRAMMAZIONE ANNUALE DI ANALISI CHIMICA Anno scolastico 2012/13 Classi 3A chim Docenti prof.ssa Emilia Angelini prof.ssa Siriana Giustini Finalità Fornire le basi
ISTITUTO TECNICO INDUSTRIALE B. PASCAL PROGRAMMAZIONE ANNUALE DI ANALISI CHIMICA Anno scolastico 2012/13 Classi 3A chim Docenti prof.ssa Emilia Angelini prof.ssa Siriana Giustini Finalità Fornire le basi
COMPITO DI ANALISI DEI FARMACI I BARI,14 GIUGNO 1999
 COMPITO DI ANALISI DEI FARMACI I BARI,14 GIUGNO 1999 1)Un campione da 24.7 L di aria estratta nelle vicinanze di un forno è stato passato su pentossido di iodio a 150 C dove CO è stato trasformato in CO
COMPITO DI ANALISI DEI FARMACI I BARI,14 GIUGNO 1999 1)Un campione da 24.7 L di aria estratta nelle vicinanze di un forno è stato passato su pentossido di iodio a 150 C dove CO è stato trasformato in CO
cognome e nome turno banco data Indicare i CALCOLI per ESTESO Nei RIQUADRI TRATTEGGIATI riportare i dati con le CIFRE SIGNIFICATIVE appropriate
 PREPARAZIONE e STANDARDIZZAZIONE di una SOLUZIONE di ACIDO CLORIDRICO densità HCl (aq) conc. (g/ml) % peso prelievo HCl (aq) conc. (ml) mmoli HCl = volume matraccio (ml) titolo previsto HCl (aq) diluito
PREPARAZIONE e STANDARDIZZAZIONE di una SOLUZIONE di ACIDO CLORIDRICO densità HCl (aq) conc. (g/ml) % peso prelievo HCl (aq) conc. (ml) mmoli HCl = volume matraccio (ml) titolo previsto HCl (aq) diluito
I.T.I.S. E. FERMI _ MODENA
 I.T.I.S. E. FERMI _ MODENA Programma svolto del corso di Analisi Chimica, Elab. Dati e Laboratorio Classe 3^C a.s. 2011-12 Docenti: Giorgia Messori, Claudia Tacconi I l libro di testo utilizzato è stato
I.T.I.S. E. FERMI _ MODENA Programma svolto del corso di Analisi Chimica, Elab. Dati e Laboratorio Classe 3^C a.s. 2011-12 Docenti: Giorgia Messori, Claudia Tacconi I l libro di testo utilizzato è stato
PROGRAMMAZIONE DIDATTICA ANNUALE DI DIPARTIMENTO
 PROGRAMMAZIONE DIDATTICA ANNUALE DI DIPARTIMENTO ANNO SCOLASTICO 2016-17 DIPARTIMENTO DI CHIMICA CHIMICA ANALITICA E STRUMENTALE TRIENNIO VICENZA, 08/10/2016 DOCENTI BONOMI RENATO CRACCO PIERGIORGIO DALLA
PROGRAMMAZIONE DIDATTICA ANNUALE DI DIPARTIMENTO ANNO SCOLASTICO 2016-17 DIPARTIMENTO DI CHIMICA CHIMICA ANALITICA E STRUMENTALE TRIENNIO VICENZA, 08/10/2016 DOCENTI BONOMI RENATO CRACCO PIERGIORGIO DALLA
ANALISI VOLUMETRICA Metodo Volumetrico Titolazione volume di standard reagire completamente con l analita
 ANALISI VOLUMETRICA Metodo di analisi che si basa sulla titolazione. La concentrazione di un analita viene determinata misurando la sua capacità a combinarsi con un Reagente Standard (S.M.). (Esiste anche
ANALISI VOLUMETRICA Metodo di analisi che si basa sulla titolazione. La concentrazione di un analita viene determinata misurando la sua capacità a combinarsi con un Reagente Standard (S.M.). (Esiste anche
Indice. Prefazione. 4 Statistica 61 Il numero dei miei globuli rossi è troppo alto oggi? 4-1 Distribuzione gaussiana dell errore 62
 Indice Prefazione 0 Il processo analitico 1 Il ruolo centrale della chimica analitica 0-1 Il lavoro del chimico analitico 2 0-2 I passaggi comuni nelle analisi chimiche 7 Box 0-1 Come preparare un campione
Indice Prefazione 0 Il processo analitico 1 Il ruolo centrale della chimica analitica 0-1 Il lavoro del chimico analitico 2 0-2 I passaggi comuni nelle analisi chimiche 7 Box 0-1 Come preparare un campione
SCHEDA per l esperienza ACIDO-BASE
 SCHEDA per l esperienza ACIDO-BASE NaOH ca. 0.1 M Seconda fase: standardizz. con KHFt Massa pesata NaOH: g Dissoluzione: in ca. litri di acqua deionizzata bollita Prima titolazione: massa pesata di KHFt:
SCHEDA per l esperienza ACIDO-BASE NaOH ca. 0.1 M Seconda fase: standardizz. con KHFt Massa pesata NaOH: g Dissoluzione: in ca. litri di acqua deionizzata bollita Prima titolazione: massa pesata di KHFt:
Chimica Analitica II
 Chimica Analitica II Corso di laurea triennale in Chimica Obiettivo del corso conoscenza dei principi fondamentali e della strumentazione relativi a tecniche analitiche strumentali di uso comune Durata
Chimica Analitica II Corso di laurea triennale in Chimica Obiettivo del corso conoscenza dei principi fondamentali e della strumentazione relativi a tecniche analitiche strumentali di uso comune Durata
Analisi chimico-farmaceutiche e tossicologiche I
 Analisi chimico-farmaceutiche e tossicologiche I Corso I Z Prof.ssa Alessia Catalano E-mail: alessia.catalano@uniba.it Tel: 080/5442745 Stanza 429 - III piano Ricevimento studenti: lunedì, mercoledì, venerdì
Analisi chimico-farmaceutiche e tossicologiche I Corso I Z Prof.ssa Alessia Catalano E-mail: alessia.catalano@uniba.it Tel: 080/5442745 Stanza 429 - III piano Ricevimento studenti: lunedì, mercoledì, venerdì
1 Me Me (s) Me + (aq) + e -
 ELETTROCHIMICA 1 Me Me (s) Me + (aq) + e - Me + DOPPIO STRATO (+) (-) all interfaccia elettrodo-soluzione 2 Se inizialmente prevale la reazione 1, la lamina metallica si carica negativamente (eccesso di
ELETTROCHIMICA 1 Me Me (s) Me + (aq) + e - Me + DOPPIO STRATO (+) (-) all interfaccia elettrodo-soluzione 2 Se inizialmente prevale la reazione 1, la lamina metallica si carica negativamente (eccesso di
Analisi del cemento. Progetto sostieni una classe. 4A a.s.2015/2016
 Analisi del cemento Progetto sostieni una classe 4A a.s.2015/2016 Progetto sostieni una classe Il progetto nasce come collaborazione tra l azienda Cementirossi e il nostro Istituto al fine di integrare
Analisi del cemento Progetto sostieni una classe 4A a.s.2015/2016 Progetto sostieni una classe Il progetto nasce come collaborazione tra l azienda Cementirossi e il nostro Istituto al fine di integrare
Titolazione acido debole (diprotico)
 Titolazione acido debole (diprotico) Calcolo ph spontaneo (acido debole da solo) H 2 O + H 2 O H 3 O + + OH - H 2 B + H 2 O HB - + H 3 O + HB - + H 2 O B 2- + H 3 O + 5 incognite 5 equazioni indipendenti
Titolazione acido debole (diprotico) Calcolo ph spontaneo (acido debole da solo) H 2 O + H 2 O H 3 O + + OH - H 2 B + H 2 O HB - + H 3 O + HB - + H 2 O B 2- + H 3 O + 5 incognite 5 equazioni indipendenti
ISTITUTO TECNICO INDUSTRIALE E. FERMI - MODENA
 ISTITUTO TECNICO INDUSTRIALE E. FERMI - MODENA PROGRAMMAZIONE DIDATTICA EDUCATIVA di CHIMICA ANALITICA E STRUMENTALE Classe 3^ G anno scolastico 2016/2017 Docenti: prof. Paola Morganti - Antonietta Grande
ISTITUTO TECNICO INDUSTRIALE E. FERMI - MODENA PROGRAMMAZIONE DIDATTICA EDUCATIVA di CHIMICA ANALITICA E STRUMENTALE Classe 3^ G anno scolastico 2016/2017 Docenti: prof. Paola Morganti - Antonietta Grande
ELETTROCHIMICA: studia le relazioni tra energia chimica ed energia elettrica
 ELETTROCHIMICA: studia le relazioni tra energia chimica ed energia elettrica Pila Energia chimica? energia elettrica Si basa su reazioni redox con G < 0 Cella di elettrolisi Energia elettrica? energia
ELETTROCHIMICA: studia le relazioni tra energia chimica ed energia elettrica Pila Energia chimica? energia elettrica Si basa su reazioni redox con G < 0 Cella di elettrolisi Energia elettrica? energia
LABORATORIO DI CHIMICA
 LABORATORIO DI CHIMICA Presentazione 3 a ESPERIENZA Titolazione Acido-Base ANALISI VOLUMETRICA Tipi di titolazioni Esistono diversi tipi di titolazione, classificati in funzione della reazione su cui si
LABORATORIO DI CHIMICA Presentazione 3 a ESPERIENZA Titolazione Acido-Base ANALISI VOLUMETRICA Tipi di titolazioni Esistono diversi tipi di titolazione, classificati in funzione della reazione su cui si
APPLICAZIONE DI RIDUCENTI IN VOLUMETRICA
 APPLICAZIONE DI RIDUCENTI IN VOLUMETRICA Le sostanze riducenti reagiscono con l O 2 dell aria, per questo motivo è meglio conservarle in atmosfera inerte. Metodo: agente riducente non standardizzato +
APPLICAZIONE DI RIDUCENTI IN VOLUMETRICA Le sostanze riducenti reagiscono con l O 2 dell aria, per questo motivo è meglio conservarle in atmosfera inerte. Metodo: agente riducente non standardizzato +
1 - Titolazioni acido-base e ph
 1 - Titolazioni acido-base e ph Procedimento (m.m. di NH 3 = 17,03) Moli di NaOH consumate (1,04 x 10-3 ) Moli di HCl iniziali (7,75 x 10-3 ) Moli di NH 3 (6,71 x 10-3 ) Massa di NH 3 (114,3 mg) Concentrazione
1 - Titolazioni acido-base e ph Procedimento (m.m. di NH 3 = 17,03) Moli di NaOH consumate (1,04 x 10-3 ) Moli di HCl iniziali (7,75 x 10-3 ) Moli di NH 3 (6,71 x 10-3 ) Massa di NH 3 (114,3 mg) Concentrazione
Compito di analisi dei farmaci I. Bari,9 settembre 1998
 Compito di analisi dei farmaci I Bari,9 settembre 1998 1) L acido formico in una soluzione 0.1 M è dissociato per il 4.6%.50 ml di questa soluzione si diluiscono a 250 ml con acqua e si titolano con NaOH
Compito di analisi dei farmaci I Bari,9 settembre 1998 1) L acido formico in una soluzione 0.1 M è dissociato per il 4.6%.50 ml di questa soluzione si diluiscono a 250 ml con acqua e si titolano con NaOH
+ NO 2 + 3H 2 O = Ce +3 + NO 3 + 2H 3 O +, b) 0.478 g
 1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
1) Una soluzione di Na 3 PO 4 (PM = 163.94) viene titolata con una soluzione di AgNO 3 (PM = 169.87) a) Scrivere l equazione chimica del processo di titolazione e specificare di quale tecnica si tratta
Principi di Analisi Farmaceutica Quantitativa + Laboratorio di Analisi Quantitativa
 UNIVERSITÀ DEGLI STUDI DI MILANO FACOLTÀ DI SCIENZE DEL FARMACO Farmacia III anno linea M-Z Principi di Analisi Farmaceutica Quantitativa + Laboratorio di Analisi Quantitativa 6 + 2 CFU (48 + 32 ore) Alessandro
UNIVERSITÀ DEGLI STUDI DI MILANO FACOLTÀ DI SCIENZE DEL FARMACO Farmacia III anno linea M-Z Principi di Analisi Farmaceutica Quantitativa + Laboratorio di Analisi Quantitativa 6 + 2 CFU (48 + 32 ore) Alessandro
Complessometria M + L
 Complessometria Analisi volumetrica per formazione di complessi M + L ML M (nucleo centrale) è un acido di Lewis (accettore di coppie di elettroni) L (legante) è una base di Lewis (donatore di coppie di
Complessometria Analisi volumetrica per formazione di complessi M + L ML M (nucleo centrale) è un acido di Lewis (accettore di coppie di elettroni) L (legante) è una base di Lewis (donatore di coppie di
POSSIBILI DOMANDE PER L ESAME DI CHIMICA ANALITICA
 POSSIBILI DOMANDE PER L ESAME DI CHIMICA ANALITICA 1 Come si definisce la chimica analitica? 2 Come si definisce un componente da determinare? 3 Quali sono i metodi di analisi in chimica analitica? Descriverli
POSSIBILI DOMANDE PER L ESAME DI CHIMICA ANALITICA 1 Come si definisce la chimica analitica? 2 Come si definisce un componente da determinare? 3 Quali sono i metodi di analisi in chimica analitica? Descriverli
POTENZIOMETRIA 27/04/2017 USA I POTENZIALI ELETTRODICI PER MISURARE LA CONCENTAZIONE DEGLI ANALITI. Equazione di Nernst PRINCIPI GENERALI
 POTENZIOMETRIA USA I POTENZIALI ELETTRODICI PER MISURARE LA CONCENTAZIONE DEGLI ANALITI Oss ne Rid E E Equazione di Nernst 0 RT a ln nf a oss rid PRINCIPI GENERALI Non è possibile determinare i valori
POTENZIOMETRIA USA I POTENZIALI ELETTRODICI PER MISURARE LA CONCENTAZIONE DEGLI ANALITI Oss ne Rid E E Equazione di Nernst 0 RT a ln nf a oss rid PRINCIPI GENERALI Non è possibile determinare i valori
Metodi per stabilire il Punto di Equivalenza. Metodo Gay Lussac/Mulder: metodo del punto chiaro
 Metodi per stabilire il Punto di Equivalenza Metodo Gay Lussac/Mulder: metodo del punto chiaro Metodo preciso introdotto dall autore e corretto da Mulder. Consiste nell aggiungere il reattivo precipitante
Metodi per stabilire il Punto di Equivalenza Metodo Gay Lussac/Mulder: metodo del punto chiaro Metodo preciso introdotto dall autore e corretto da Mulder. Consiste nell aggiungere il reattivo precipitante
Elettrodi Il loro potenziale è funzione dell attivit
 Elettrodi Il loro potenziale è funzione dell attivit attività (o concentrazione) delle specie contenute nelle soluzioni in cui sono immersi. Queste attività possono quindi essere determinate tramite misure
Elettrodi Il loro potenziale è funzione dell attivit attività (o concentrazione) delle specie contenute nelle soluzioni in cui sono immersi. Queste attività possono quindi essere determinate tramite misure
PIANO DI LAVORO ANNUALE - A.S
 ISTITUTO D ISTRUZIONE SUPERIORE "G. VERONESE - G. MARCONI" e-mail: veis00200g@pec.istruzione.it C.F. 81002030278 - Cod. Min. VEIS00200G SEZIONE ASSOCIATA G. MARCONI - 30014 CAVARZERE (VE) Via T. Serafin,
ISTITUTO D ISTRUZIONE SUPERIORE "G. VERONESE - G. MARCONI" e-mail: veis00200g@pec.istruzione.it C.F. 81002030278 - Cod. Min. VEIS00200G SEZIONE ASSOCIATA G. MARCONI - 30014 CAVARZERE (VE) Via T. Serafin,
I sessione I prova
 I sessione 2014 Tema n. 1: Il doppio legame Tema n. 2: Nuovi processi nell industria petrolchimica Tema n. 3: Descrivere i differenti meccanismi di formazione delle molecole a partire dai singoli atomi
I sessione 2014 Tema n. 1: Il doppio legame Tema n. 2: Nuovi processi nell industria petrolchimica Tema n. 3: Descrivere i differenti meccanismi di formazione delle molecole a partire dai singoli atomi
Argentometria. D.C. Harris, Elementi di chimica analitica, Zanichelli Capitolo 6
 Argentometria D.C. Harris, Elementi di chimica analitica, Zanichelli Capitolo 6 1 Il titolante è, di solito, una soluzione standard di AgNO 3. (N.B.: AgNO 3 è fotosensibile e bisogna evitare di lavorare
Argentometria D.C. Harris, Elementi di chimica analitica, Zanichelli Capitolo 6 1 Il titolante è, di solito, una soluzione standard di AgNO 3. (N.B.: AgNO 3 è fotosensibile e bisogna evitare di lavorare
PIANO DI STUDIO DELLA DISCIPLINA DISCIPLINA: CHIMICA ANALITICA E STRUMENTALE
 Tel. 0331 635718 fax 0331 679586 info@isisfacchinetti.it www.isisfacchinetti.it ISIS C. Facchinetti via Azimonti, 5-21053 Castellanza Rev. 0 del 13/07/15 DISCIPLINA: CHIMICA ANALITICA E STRUMENTALE PIANO
Tel. 0331 635718 fax 0331 679586 info@isisfacchinetti.it www.isisfacchinetti.it ISIS C. Facchinetti via Azimonti, 5-21053 Castellanza Rev. 0 del 13/07/15 DISCIPLINA: CHIMICA ANALITICA E STRUMENTALE PIANO
PROGETTO A.G.I.R.E. POR ARPA Calabria ARPA Emilia R.
 PROGETTO A.G.I.R.E. POR ARPA Calabria ARPA Emilia R. Trasferimento di conoscenze e protocolli operativi finalizzati al controllo delle emissioni in atmosfera, al monitoraggio di qualità dell aria e della
PROGETTO A.G.I.R.E. POR ARPA Calabria ARPA Emilia R. Trasferimento di conoscenze e protocolli operativi finalizzati al controllo delle emissioni in atmosfera, al monitoraggio di qualità dell aria e della
ph e Soluzioni Tampone
 ph e Soluzioni Tampone Diverse definizioni di acido e base. Acidi e Basi 1. Arrhenius: l acido rilascia H + mentre le basi rilasciano OH - incompleta! 2. Bronsted-Lowry: l acido cede 1 o più protoni in
ph e Soluzioni Tampone Diverse definizioni di acido e base. Acidi e Basi 1. Arrhenius: l acido rilascia H + mentre le basi rilasciano OH - incompleta! 2. Bronsted-Lowry: l acido cede 1 o più protoni in
ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO E BUONE PRASSI IN LABORATORIO M - Z
 DIPARTIMENTO DI SCIENZE DEL FARMACO Corso di laurea magistrale in Farmacia Anno accademico 2018/2019-2 anno ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO E BUONE PRASSI IN LABORATORIO M -
DIPARTIMENTO DI SCIENZE DEL FARMACO Corso di laurea magistrale in Farmacia Anno accademico 2018/2019-2 anno ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO E BUONE PRASSI IN LABORATORIO M -
Reazioni di ossido-riduzione (redox) - Come stabilire il verso di una redox? -
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
3. Le Reazioni Chimiche
 . Le Reazioni Chimiche Equazioni Chimiche e Reazioni Chimiche il simbolismo delle reazioni chimiche il bilanciamento delle equazioni chimiche Reazioni di Precipitazione le soluzioni acquose le reazioni
. Le Reazioni Chimiche Equazioni Chimiche e Reazioni Chimiche il simbolismo delle reazioni chimiche il bilanciamento delle equazioni chimiche Reazioni di Precipitazione le soluzioni acquose le reazioni
CHIMICA ANALITICA AMBIENTALE
 Università degli Studi di Cagliari Facoltà di Scienze MM.FF.NN. CHIMICA ANALITICA AMBIENTALE STRUMENTALE 9 1 Sensibilità 2 Limite di rivelabilità Harris, Chimica Analitica Quantitativa, Zanichelli, Cap.
Università degli Studi di Cagliari Facoltà di Scienze MM.FF.NN. CHIMICA ANALITICA AMBIENTALE STRUMENTALE 9 1 Sensibilità 2 Limite di rivelabilità Harris, Chimica Analitica Quantitativa, Zanichelli, Cap.
Cromatografia ionica (IC)
 Cromatografia ionica (IC) Il principio di base della cromatografia ionica è lo scambio ionico su resine scambiatrici forti, che costituiscono la fase stazionaria con cui sono impaccate le colonne, in parziale
Cromatografia ionica (IC) Il principio di base della cromatografia ionica è lo scambio ionico su resine scambiatrici forti, che costituiscono la fase stazionaria con cui sono impaccate le colonne, in parziale
Titolazioni Redox. Analisi volumetrica basata su una reazione di ossido-riduzione. La somma delle due coppie coniugate ossido-riduttive
 Titolazioni Redox Analisi volumetrica basata su una reazione di ossido-riduzione Ossidante (accettore di elettroni si riduce) Riducente (donatore di elettroni si ossida) ox 1 + ne - rid 1 rid 2 ox 2 +
Titolazioni Redox Analisi volumetrica basata su una reazione di ossido-riduzione Ossidante (accettore di elettroni si riduce) Riducente (donatore di elettroni si ossida) ox 1 + ne - rid 1 rid 2 ox 2 +
CHIMICA ANALITICA E STRUMENTALE
 R E P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS A.S. 2015/2016 PROGRAMMAZIONE DI CHIMICA ANALITICA E STRUMENTALE Classe: 4 a A
R E P U B B L I C A I T A L I A N A ISTITUTO DI ISTRUZIONE SECONDARIA SUPERIORE MINERARIO G. ASPRONI E. FERMI DI IGLESIAS A.S. 2015/2016 PROGRAMMAZIONE DI CHIMICA ANALITICA E STRUMENTALE Classe: 4 a A
FORMULARIO DI CHIMICA
 ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
I.T.I.S. E. FERMI _ MODENA
 I.T.I.S. E. FERMI _ MODENA Programma svolto del corso di Chimica Analitica e Strumentale Classe 3^C a.s. 2015-16 Docenti: Giorgia Messori, Claudia Tacconi Il libro di testo utilizzato è stato: Chimica
I.T.I.S. E. FERMI _ MODENA Programma svolto del corso di Chimica Analitica e Strumentale Classe 3^C a.s. 2015-16 Docenti: Giorgia Messori, Claudia Tacconi Il libro di testo utilizzato è stato: Chimica
Al Dirigente Scolastico e p.c. Al Referente per l orientamento e p.c. ai docenti dell area tecnico-scientifica
 Al Dirigente Scolastico e p.c. Al Referente per l orientamento e p.c. ai docenti dell area tecnico-scientifica Oggetto: PROGETTO RACCORDO CON LE SCUOLE SECONDARIA DI PRIMO GRADO Nell ambito del progetto
Al Dirigente Scolastico e p.c. Al Referente per l orientamento e p.c. ai docenti dell area tecnico-scientifica Oggetto: PROGETTO RACCORDO CON LE SCUOLE SECONDARIA DI PRIMO GRADO Nell ambito del progetto
ESERCIZI POTENZIOMETRIA
 ESERCIZI POTENZIOMETRIA A. SPUNTI DI RIFLESSIONE 1. Quali sono i probabili fenomeni che permettono a un elettrodo al platino di assumere il potenziale di una soluzione contenente la coppia Fe 3+ /Fe 2+?
ESERCIZI POTENZIOMETRIA A. SPUNTI DI RIFLESSIONE 1. Quali sono i probabili fenomeni che permettono a un elettrodo al platino di assumere il potenziale di una soluzione contenente la coppia Fe 3+ /Fe 2+?
ossidazione/riduzione, ossidante/riducente
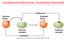 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox 0 +5 +2 +4 Cu(s) + HNO 3 (aq) Cu(NO 3 ) 2 + NO 2 (g) + H 2 O(l) Determinazione dei numeri di ossidazione Cu(s) + 2HNO 3 (aq)
ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO E BUONE PRASSI IN LABORATORIO M - Z
 DIPARTIMENTO DI SCIENZE DEL FARMACO Corso di laurea magistrale in Farmacia Anno accademico 2017/2018-2 anno ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO E BUONE PRASSI IN LABORATORIO M -
DIPARTIMENTO DI SCIENZE DEL FARMACO Corso di laurea magistrale in Farmacia Anno accademico 2017/2018-2 anno ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO E BUONE PRASSI IN LABORATORIO M -
Lezione 4. Le soluzioni Acidi e Basi Reazioni Chimiche La Concentrazione delle Soluzioni
 2018 Lezione 4. Le soluzioni Acidi e Basi Reazioni Chimiche La Concentrazione delle Soluzioni Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è la sostanza (o sostanze) presente/i in
2018 Lezione 4. Le soluzioni Acidi e Basi Reazioni Chimiche La Concentrazione delle Soluzioni Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è la sostanza (o sostanze) presente/i in
ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO E BUONE PRASSI IN LABORATORIO M - Z
 DIPARTIMENTO DI SCIENZE DEL FARMACO Corso di laurea magistrale in Farmacia Anno accademico 2016/2017-2 anno ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO E BUONE PRASSI IN LABORATORIO M -
DIPARTIMENTO DI SCIENZE DEL FARMACO Corso di laurea magistrale in Farmacia Anno accademico 2016/2017-2 anno ANALISI DELLE SOSTANZE INORGANICHE DI IMPIEGO FARMACEUTICO E BUONE PRASSI IN LABORATORIO M -
Elettrochimica. Studia la relazione fra variazione di energia libera e flussi di cariche in una reazione chimica.
 Elettrochimica Studia la relazione fra variazione di energia libera e flussi di cariche in una reazione chimica. Fornisce il modo per ricavare lavoro elettrico da una reazione spontanea = cella galvanica
Elettrochimica Studia la relazione fra variazione di energia libera e flussi di cariche in una reazione chimica. Fornisce il modo per ricavare lavoro elettrico da una reazione spontanea = cella galvanica
ANALISI SISTEMATICA DEI CATIONI
 ANALISI SISTEMATICA DEI CATIONI Particolare procedura analitica attraverso la quale tutte le specie cationiche presenti in una ipotetica miscela vengono inizialmente separate in gruppi, mediante l uso
ANALISI SISTEMATICA DEI CATIONI Particolare procedura analitica attraverso la quale tutte le specie cationiche presenti in una ipotetica miscela vengono inizialmente separate in gruppi, mediante l uso
Principi di Analisi Farmaceutica Quantitativa + Laboratorio di Analisi Quantitativa
 UNIVERSITÀ DEGLI STUDI DI MILANO FACOLTÀ DI SCIENZE DEL FARMACO Farmacia III anno linea M-Z Principi di Analisi Farmaceutica Quantitativa + Laboratorio di Analisi Quantitativa 6 + 2 CFU (48 + 32 ore) Alessandro
UNIVERSITÀ DEGLI STUDI DI MILANO FACOLTÀ DI SCIENZE DEL FARMACO Farmacia III anno linea M-Z Principi di Analisi Farmaceutica Quantitativa + Laboratorio di Analisi Quantitativa 6 + 2 CFU (48 + 32 ore) Alessandro
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Bari,7 luglio 1999 Compito di Analisi dei Farmaci I
 Bari,7 luglio 1999 Compito di Analisi dei Farmaci I Quale quantità di potassio bromato dovrà essere pesata per liberare una quantità di iodio che reagisca con 30 ml di sodio tiosolfato, del quale 42.56
Bari,7 luglio 1999 Compito di Analisi dei Farmaci I Quale quantità di potassio bromato dovrà essere pesata per liberare una quantità di iodio che reagisca con 30 ml di sodio tiosolfato, del quale 42.56
COULOMETRIA. Elettricità trasportata da una corrente di 1Ampere/sec.
 COULOMETRIA E un metodo di misura della quantità di corrente necessaria a trasformare un analita in uno stato di ossidazione diverso. Coulometria, elettrogravimetria sfruttano la proporzione esistente
COULOMETRIA E un metodo di misura della quantità di corrente necessaria a trasformare un analita in uno stato di ossidazione diverso. Coulometria, elettrogravimetria sfruttano la proporzione esistente
I ANNO II ANNO III ANNO
 Scuola di: SCIENZE E TECNOLOGIE Corso di Laurea in: CHIMICA Anno di Corso: 2018/2019 Schema di Curriculum Map ottenuta raggruppando le attività formative in base alle aree di apprendimento individuate
Scuola di: SCIENZE E TECNOLOGIE Corso di Laurea in: CHIMICA Anno di Corso: 2018/2019 Schema di Curriculum Map ottenuta raggruppando le attività formative in base alle aree di apprendimento individuate
Sommario della lezione 24. Equilibri di solubilità. Chimica Organica. Elettrochimica
 Sommario della lezione 24 Equilibri di solubilità Chimica Organica Elettrochimica EQUILIBRI DI SOLUBILITA Solubilità È la concentrazione del soluto in una soluzione satura (dove è presente il corpo di
Sommario della lezione 24 Equilibri di solubilità Chimica Organica Elettrochimica EQUILIBRI DI SOLUBILITA Solubilità È la concentrazione del soluto in una soluzione satura (dove è presente il corpo di
REGISTRO DELLE LEZIONI 2004/2005. Tipologia. Addì Tipologia. Addì Tipologia
 Cenni della teoria ondulatoria. Duplice comportamento dell'elettrone onda-particella. Tavola periodica di Mendelew, tavola periodica moderna, proprietà generali degli elementi. blocco s, p, d, f. Introduzione
Cenni della teoria ondulatoria. Duplice comportamento dell'elettrone onda-particella. Tavola periodica di Mendelew, tavola periodica moderna, proprietà generali degli elementi. blocco s, p, d, f. Introduzione
2.1 Iodimetria-iodometria
 .1 Iodimetria-iodometria Sono metodi analitici basati su reazioni di ossidoriduzione in cui una delle due coppie redox è I / I - Equazione della semireazione di riduzione dello iodio I + e - I - E = 0,535
.1 Iodimetria-iodometria Sono metodi analitici basati su reazioni di ossidoriduzione in cui una delle due coppie redox è I / I - Equazione della semireazione di riduzione dello iodio I + e - I - E = 0,535
ossidazione/riduzione, ossidante/riducente
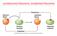 ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
ossidazione/riduzione, ossidante/riducente Esercizio tipo: bilanciamento redox +6-1 -1 +3-1 K 2 Cr 2 O 7 (aq) + HI(aq) KI(aq) + CrI 3 (aq) + I 2 (s) + H 2 O(l) 0 K 2 Cr 2 O 7 (aq) + 6HI(aq) KI(aq) + 2CrI
Indirizzo: Chimica, materiali e biotecnologie -Articolazione Biotecnologie sanitarie CHIMICA ANALITICA E STRUMENTALE 3 anno
 Indirizzo: Chimica, materiali e biotecnologie -Articolazione Biotecnologie sanitarie CHIMICA ANALITICA E STRUMENTALE 3 anno UDA CONOSCENZE COMPETENZE ABILITA UDA N. 1 Gli acidi e le Ore: 11 Settembre-
Indirizzo: Chimica, materiali e biotecnologie -Articolazione Biotecnologie sanitarie CHIMICA ANALITICA E STRUMENTALE 3 anno UDA CONOSCENZE COMPETENZE ABILITA UDA N. 1 Gli acidi e le Ore: 11 Settembre-
Elettrochimica. le trasformazioni redox spontanee (DG < 0) l energia elettrica in celle elettrolitiche per ottenere
 Elettrochimica studia le relazioni tra processi chimici ed energia elettrica. i. e. si interessa dei processi che coinvolgono il trasferimento di elettroni (reazioni di ossido riduzione). Sfrutta: le trasformazioni
Elettrochimica studia le relazioni tra processi chimici ed energia elettrica. i. e. si interessa dei processi che coinvolgono il trasferimento di elettroni (reazioni di ossido riduzione). Sfrutta: le trasformazioni
III verifica 2005/06 (A) Colonna.. Riga...
 Sono riportate le soluzioni commentate del compito A. Per gli altri compiti sono riportate (a volte in maniera succinta) le soluzioni dei quesiti, 2,4,6,8,9. Per gli altri quesiti, potete ricavare il procedimento
Sono riportate le soluzioni commentate del compito A. Per gli altri compiti sono riportate (a volte in maniera succinta) le soluzioni dei quesiti, 2,4,6,8,9. Per gli altri quesiti, potete ricavare il procedimento
MISURE POTENZIOMETRICHE DIRETTE
 MISURE POTENZIOMETRICHE DIRETTE Sono utilizzate per calcolare la concentrazione della specie di cui è disponibile l'elettro indicatore. Metodo semplice - Bisogna fare prima una curva di taratura potenziale/
MISURE POTENZIOMETRICHE DIRETTE Sono utilizzate per calcolare la concentrazione della specie di cui è disponibile l'elettro indicatore. Metodo semplice - Bisogna fare prima una curva di taratura potenziale/
Cellule galvaniche ed elettrolitiche
 Cellule galvaniche ed elettrolitiche Cella voltaica = galvanica fornisce E. elettrica (+) Cella elettrolitica richiede dall esterno corrente elettrica (-) La cella composta dai due semielementi Zn/Cu nei
Cellule galvaniche ed elettrolitiche Cella voltaica = galvanica fornisce E. elettrica (+) Cella elettrolitica richiede dall esterno corrente elettrica (-) La cella composta dai due semielementi Zn/Cu nei
Reazioni in Soluzioni Acquose. Capitolo 4
 Reazioni in Soluzioni Acquose Capitolo 4 Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è(sono) la(le) sostanza(e) presente(i) in minore quantità Il solvente è la sostanza presente
Reazioni in Soluzioni Acquose Capitolo 4 Una soluzione è una miscela omogenea di 2 o più sostanze Il soluto è(sono) la(le) sostanza(e) presente(i) in minore quantità Il solvente è la sostanza presente
1.2.5 Titolazioni acido-base
 1.2.5 Titolazioni acidobase Queste titolazioni si basano su reazioni di neutralizzazione in cui un acido cede un protone ad una base capace di accettarlo. Nel caso più semplice di un acido forte (es. HCl)
1.2.5 Titolazioni acidobase Queste titolazioni si basano su reazioni di neutralizzazione in cui un acido cede un protone ad una base capace di accettarlo. Nel caso più semplice di un acido forte (es. HCl)
Esperienza n. 3. Analisi di una miscela di NaHCO 3 e Na 2 CO 3
 Esperienza n. 3 Laboratorio di Chimica Analisi di una miscela di NaHCO 3 e Na 2 CO 3 OBBIETTIVI Lo scopo di questa esperienza è quello di risalire alla composizione percentuale di una miscela di carbonato
Esperienza n. 3 Laboratorio di Chimica Analisi di una miscela di NaHCO 3 e Na 2 CO 3 OBBIETTIVI Lo scopo di questa esperienza è quello di risalire alla composizione percentuale di una miscela di carbonato
Studio delle trasformazioni dell energia chimica e dell energia elettrica
 ELETTROCHIMICA Studio delle trasformazioni dell energia chimica e dell energia elettrica Conduttori elettrolitici: soluzioni di acidi, di basi e di sali, nonché sali fusi. Ioni che partecipano alle reazioni
ELETTROCHIMICA Studio delle trasformazioni dell energia chimica e dell energia elettrica Conduttori elettrolitici: soluzioni di acidi, di basi e di sali, nonché sali fusi. Ioni che partecipano alle reazioni
Pile 1) Indicare gli schemi dei semielementi formati dalle seguenti semicoppie redox e scrivere la corrispondente equazione di Nernst:
 ile 1) Indicare gli schemi dei semielementi formati dalle seguenti semicoppie redox e scrivere la corrispondente equazione di Nernst: a) HO + + e - H (g) + HO b) Al + + e - Al(s) c) O(g) + 4 HO + + 4e
ile 1) Indicare gli schemi dei semielementi formati dalle seguenti semicoppie redox e scrivere la corrispondente equazione di Nernst: a) HO + + e - H (g) + HO b) Al + + e - Al(s) c) O(g) + 4 HO + + 4e
ANALISI DEI FARMACI I
 ANALISI DEI FARMACI I TESTI CONSIGLIATI Skoog - West - Holler - (Crouch): Fondamenti di chimica analitica Harris: Chimica analitica quantitativa Per la Conduttimetria Cozzi - Protti - Ruaro: Analisi chimica
ANALISI DEI FARMACI I TESTI CONSIGLIATI Skoog - West - Holler - (Crouch): Fondamenti di chimica analitica Harris: Chimica analitica quantitativa Per la Conduttimetria Cozzi - Protti - Ruaro: Analisi chimica
PROPRIETA ACIDO-BASE DELLE SOLUZIONI SALINE
 PROPRIETA ACIDO-BASE DELLE SOLUZIONI SALINE Un sale è un solido ionico contenente un catione diverso da H + e un anione diverso da OH -. I sali sono degli elettroliti forti, cioè in acqua si dissociano
PROPRIETA ACIDO-BASE DELLE SOLUZIONI SALINE Un sale è un solido ionico contenente un catione diverso da H + e un anione diverso da OH -. I sali sono degli elettroliti forti, cioè in acqua si dissociano
Le reazioni chimiche 2
 Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
Programma Misure ed Unità di misura. Incertezza della misura. Cifre significative. Notazione scientifica. Atomo e peso atomico. Composti, molecole e ioni. Formula molecolare e peso molecolare. Mole e massa
ANALISI VOLUMETRICA. si misura il volume di reagente richiesto dalla reazione con l analita TITOLAZIONI
 ANALISI VOLUMETRICA si misura il volume di reagente richiesto dalla reazione con l analita Metodi volumetrici TITOLAZIONI in una titolazione, si aggiungono aliquote di soluzione di reagente a concentrazione
ANALISI VOLUMETRICA si misura il volume di reagente richiesto dalla reazione con l analita Metodi volumetrici TITOLAZIONI in una titolazione, si aggiungono aliquote di soluzione di reagente a concentrazione
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Le soluzioni La diluizione è il procedimento per preparare una soluzione meno concentrata da una soluzione più concentrata. Diluizione Aggiungi Solvente
La Vita è una Reazione Chimica Acqua Oro Zucchero Le soluzioni La diluizione è il procedimento per preparare una soluzione meno concentrata da una soluzione più concentrata. Diluizione Aggiungi Solvente
LABORATORIO DI ANALISI DEI FARMACI I A - L
 DIPARTIMENTO DI SCIENZE DEL FARMACO Corso di laurea magistrale in Chimica e tecnologia farmaceutiche Anno accademico 2016/2017-2 anno LABORATORIO DI ANALISI DEI FARMACI I A - L CHIM/08-6 CFU - 2 semestre
DIPARTIMENTO DI SCIENZE DEL FARMACO Corso di laurea magistrale in Chimica e tecnologia farmaceutiche Anno accademico 2016/2017-2 anno LABORATORIO DI ANALISI DEI FARMACI I A - L CHIM/08-6 CFU - 2 semestre
Sapienza Università di Roma Facoltà di Farmacia e Medicina Anno Accademico 2014/2015
 Facoltà di Farmacia e Medicina Anno Accademico 2014/2015 Corso di Laurea in Chimica e Tecnologie Farmaceutiche Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Dott. Giuseppe La Regina Programma
Facoltà di Farmacia e Medicina Anno Accademico 2014/2015 Corso di Laurea in Chimica e Tecnologie Farmaceutiche Corso di Analisi Chimico-Farmaceutica e Tossicologica I (M-Z) Dott. Giuseppe La Regina Programma
Titolazioni di Precipitazione
 Titolazioni di Precipitazione Le!tolazioni di precipitazione si basano su reazioni che generano compos2 poco solubili L agente 2tolante è anche de8o agente precipitante La velocità di formazione di un
Titolazioni di Precipitazione Le!tolazioni di precipitazione si basano su reazioni che generano compos2 poco solubili L agente 2tolante è anche de8o agente precipitante La velocità di formazione di un
Chimica Analitica e Laboratorio 2
 Chimica Analitica e Laboratorio 2 Modulo di Spettroscopia Analitica Presentazione corso Nome del corso: Chimica Analitica e Laboratorio 2 CFU: 12 Modulo: Spettroscopia Analitica CFU: 6 Orario n Orario
Chimica Analitica e Laboratorio 2 Modulo di Spettroscopia Analitica Presentazione corso Nome del corso: Chimica Analitica e Laboratorio 2 CFU: 12 Modulo: Spettroscopia Analitica CFU: 6 Orario n Orario
UNIVERSITA' DEGLI STUDI DELLA BASILICATA DIPARTIMENTO DI SCIENZE
 Insegnamento ANALISI DEI FARMACI I Corso di studio: FARMACIA Anno di Corso: II Periodo II didattico: Tipologia: B Totale Crediti: 12 Tipo Esame: prova pratica/scritto/orale Valutazione: voto Lingua di
Insegnamento ANALISI DEI FARMACI I Corso di studio: FARMACIA Anno di Corso: II Periodo II didattico: Tipologia: B Totale Crediti: 12 Tipo Esame: prova pratica/scritto/orale Valutazione: voto Lingua di
