PRINCIPI DELLA SPETTROMETRIA DI MASSA
|
|
|
- Fortunato Ferraro
- 4 anni fa
- Visualizzazioni
Transcript
1 PP DELLA SPETTMETA D MASSA A differenza delle altre tecniche analitiche (, UV-vis, M) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni invece di molecole, è un metodo di analisi distruttivo. n uno spettrometro di massa usato per analisi organica, di solito abbiamo a che fare con l analisi di ioni positivi derivati da molecole. La ionizzazione semplice di una molecola si rappresenta con l equazione: M: M. e Lo ione M. si chiama ione molecolare. La massa (m) e la carica (z) dello ione vengono misurate dallo spettrometro di massa e quello che è importante è il loro rapporto. Spesso si formano ioni con una sola carica positiva è quindi il rapporto è uguale alla massa dello ione che, a sua volta, è legata alla massa della molecola (dato che l elettrone ha una massa piccolissima, 5.49 x 10-4 rispetto alla massa di un protone). La risoluzione di un buon spettrometro di massa è 1 amu (atomic mass number) su10 4 amu. Lo ione molecolare ha una configurazione elettronica con un numero dispari di elettroni. Frammentazione Se stiamo formando uno ione molecolare con una carica positiva, significa che dobbiamo raggiungere il potenziale di ionizzazione della molecola. Questo valore dipende dalla natura dell M, dato che è da questo orbitale molecolare che l elettrone sarà rimosso. primi potenziali di ionizzazione della maggior parte delle molecole organiche cadono nell intervallo 8-15 ev l processo di ionizzazione spesso usa energie molto maggiori di quella necessaria per la ionizzazione. Questo eccesso di energia può essere trasferito allo ione molecolare quando si forma, sotto forma di energia rotazionale, vibrazionale o elettronica. Le ultime due sono le più importanti per la spettrometria di massa, perché la frammentazione di questi stati eccitati produce un nuovo ione ed una particella neutra. 1
2 Lo ione molecolare può seguire due percorsi di frammentazione: M. A. M. B. el primo caso si ha la frammentazione a un catione con numero pari di elettroni ed una specie neutra con un elettrone dispari. el secondo caso si ha frammentazione a uno ione con numero dispari di elettroni ed una specie neutra con numero pari di elettroni. n questo caso la specie neutra può essere una molecola stabile Prendiamo una molecola semplice come 6 e consideriamo possibili percorsi di frammentazione dello ione molecolare che comportino solo scissione del legame -, ma con formazione di un atomo neutro, di un radicale neutro e di una molecola neutra..... La frammentazione non si ferma qui, perché gli ioni frammento possono a loro volta frammentarsi, subendo anch essi perdita di specie neutre con numero pari o dispari di elettroni. step a M. step b A 1. B. step a step b D 4. Tutte queste frammentazioni formano un insieme di ioni che a loro volta danno luogo allo spettro di massa del composto in questione. La conoscenza dei percorsi tipici di frammentazione permette la ricostruzione di un andamento di frammentazione (fragmentation pattern) caratteristico.
3 l cammino di frammentazione dipende da quattro fattori principali: - la forza dei legami che si devono rompere - la stabilità dei prodotti di frammentazione, sia ioni che specie neutre - le energie interne degli ioni che si frammentano - l intervallo di tempo tra la formazione degli ioni e la loro rivelazione. L SPETT D MASSA SEMPLE Analizziamo uno spettro di massa semplice. Un modo comune di mostrare uno spettro di massa è quello di una traccia che si può ottenere direttamente dal registratore della maggior parte degli spettrometri. onsideriamo il metanolo:, Peso Molecolare = i si aspetta che il valore più grande m/z sia. nvece, osservando bene lo spettro, si osserva un segnale di intensità piccola (abbondanza relativa bassa), a M 1. isotopi Attorno ai picchi grandi ci possono essere picchi di abbondanza relativa bassa. Per esempio, una piccola parte di molecole di metanolo avrà 1 (1.08% di abbondanza naturale) invece di 1 e qualche atomo di idrogeno sarà (D) (0.015%) invece di 1. due tracce dello spettro di massa del metanolo, una registrata con una sensibilità dieci volte maggiore dell altra. Questo permette di vedere anche i picchi meno abbondanti. m/z attribuzione Lo ione con m/z è lo ione molecolare: a parte un picolissimo picco a m/z, è lo ione di massa più elevata nello spettro l picco più intenso viene chiamato picco base dello spettro. Ad esso si assegna l abbondanza relativa 100%: le abbondanze relative degli altri picchi si misurano rispetto a questo.
4 La frammentazione sarà tanto più facile quanto più stabile è il catione che si forma. Se sono possibili più frammentazioni che formano cationi di stabilità analoga, sarà preferita la frammentazione che dà il radicale più stabile. e e.. m/z = 7. m/z = 57 m/z = 4 e. m/z = 57 e. m/z = 4 m/z = 7. 4
5 M -9 M -15 M M -9 M -15 M ALL aratteristica strutturale degli alcooli - legato a sp aratteristiche Spettrali Spettrometria di massa Lo ione molecolare ha intensità piuttosto bassa per gli alcooli primari e secondari, è di solito assente negli spettri degli alcooli terziari La frammentazione più importante avviene tra il α all ed il β (carbocatione stabile) '' '.. '' ' '' ' l gruppo alchilico più grande viene perso più facilmente (radicale più stabile). 5
6 1-esanolo, P.M M - -esanolo, P.M. 10 M M - M - M - 7 -metil--pentanolo P.M. 10 M - 6
7 UV-visibile stretching - Solo legami σ: le transizioni n σ* richiedono λ = nm (lontano UV): fuori dal comune intervallo picco stretto, cm -1 ( libero) picco largo, cm -1 ( in legame ) stretching cm -1 egli spettri di film liquido si vede solo la banda dell impegnato in legame idrogeno; in soluzione si vedono entrambe. (liquido puro) (in l 4 ) 1-esanolo in l 4 1-esanolo film liquido 7
8 1 M 1 M L effetto - dell diminuisce la densità elettronica attorno al nucleo del 1 : deschermato L effetto - dell diminuisce la densità elettronica attorno al nucleo del 1 : deschermato a.5δ l nucleo 1 dell può risuonare in un intervallo ampio di chemical shift, tra 0.5 e 5.0 δ; la posizione dipende da vari fattori (concentrazione, temperatura, solvente, legame idrogeno, ecc.) - L dell è sufficientemente acido ( mobile) per dare equilibrio acido-base veloce rispetto al tempo di risposta dell M Questo significa che, di solito, l non si ferma sull abbastanza a lungo per influenzare il campo magnetico di un su un adiacente, né per esserne influenzato. l dell è un singoletto, un po allargato, a meno di rallentare lo scambio, per esempio abbassando la temperatura, eliminando le impurezze acide, usando soluzioni diluite. es.: metanolo
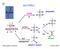
9 Se si vuole confermare che un segnale nello spettro 1 M sia dovuto a, si aggiunge alla soluzione qualche goccia di D D D D D l protone mobile scambia con D ed il segnale diminuisce o scompare del tutto esempio: 1-propanolo A B B A A B BASE a - alcossido d c.... b a AD a,d ossidazione aldeidi e chetoni b b,c X alcheni 9
10 ottura del legame - SSTTUZE ULEFLA - ELMAZE S 4 Δ - è un cattivo gruppo uscente: può essere trasformato in un buon gruppo uscente per protonazione reazioni in ambiente acido.... u: - buon gruppo uscente u u: - = -, -, l -, F - esempi: ( ) ( ) l ( ) - ( ) -l A parità di alcool, la reattività dipende dalla forza dell'acido F l pk a forza acida crescente reattività crescente verso gli alcooli A parità di acido, la reattività dipende dal tipo dell'alcool metile < primario < secondario < terziario reattività crescente degli alcooli con X Su questa diversa reattività si basa il saggio di riconoscimento degli alcooli (saggio di Lucas) 5 alcool terziario ( ) - l ( ) -l 10
11 alcool secondario ( ) - l Znl ( ) -l Znl alcool primario - l -l Δ l cloruro che si forma è immiscibile con la fase acquosa e si deposita sul fondo (ha densità maggiore dell'acqua). on S 4 stesso ordine di reattività S 4 terziario ( ) - 60 S 4 secondario ( ) S 4 primario on S 4 si riesce ad isolare il prodotto di sostituzione solo a temperatura molto bassa - - S S - 4, - nucleofilo debole S 4 S ottimo gruppo uscente Meccanismo: veloce lento S 4 veloce 11
12 rientamento: S 4 prevalente S 4 Saytzeff unico prodotto ome sempre, quando si formano carbocationi, c è possibilità di trasposizione S 4 95 Se con S 4 si trattano 1,-dioli:,-dimetil-,-butandiolo (pinacolo),-dimetilbutanone (pinacolone) TASPSZE PALA : - 1
13 Può migrare anche un : : Se i sostituenti del diolo sono diversi: viene protonato l' più basico - migra il gruppo che lascia il carbocatione più stabile MEASM della SSTTUZE degli alcooli in ambiente acido Sostituzione di - S 1 o S? con metanolo ed alcooli primari S X - δ- X δ X- stato di transizione con alcooli secondari e terziari S 1 X - X 1
14 però.. La sostituzione dell' può avvenire anche in ambiente non acido l gruppo - può essere sostituito SL DP TASFMAZE U BU GUPP USETE Gli alcooli si possono trasformare in alogenuri alchilici usando cloruri di P e S Pl Pl 5 Sl tricloruro di fosforo pentacloruro di fosforo cloruro di tionile - Pl -l P - Pl 5 -l Pl l - Sl -l S l Questi composti trasformano l in un buon gruppo uscente, che viene sostituito con un meccanismo S (e quindi gli alcooli terziari non reagiscono) P e S hanno un buon gruppo uscente (l), che viene sostituito dall alcool ( nucleofilo) on Pl l Pl 4 l Pl 4 l - Pl 4 buon gruppo uscente buon gruppo uscente l Pl 4 Pl l on Sl l S l l - S l buon gruppo uscente l S l buon gruppo uscente -l S l 14
15 on Pl l Pl l l Pl Pl buon gruppo uscente l P l l P l l buon gruppo uscente P l l P l P l buon gruppo uscente P ADAMET STEEM 1. on Pl l P l l (S)--butanolo P l l - l P l clorofosfito di (S)--butile essuno dei legami del * è stato interessato dalla reazione. l P l - l S l ()--clorobutano - Pl nversione di configurazione analogamente con Pl 5 15
16 on Sl L andamento stereochimico dipende dalle condizioni di reazione 1. S l l S l (S)--butanolo - S l l clorosolfito di (S)--butile n presenza di base (ammina terziaria): : l l - u -. S l - l S l S l - ()--clorobutano nversione di configurazione n assenza di base, nel solvente poco polare (dietil etere) l è indissociato manca il nucleofilo forte gabbia del solvente. S l S i l - S l coppia ionica (S)--clorobutano S i: il nucleofilo entra dalla stessa parte: ritenzione della configurazione 16
17 ALTE EAZ DEGL ALL ALL ME AD - Per avere formazione completa di alcossido: a - a 1/ EAZ GL AD Formazione di esteri a) Acidi carbossilici Formazione di esteri carbossilici Meccanismo: v. reazioni acidi carbossilici b) Acidi inorganici Formazione di esteri degli acidi inorganici 1,,-propantriolo nome corrente: glicerolo triestere dell acido nitrico trinitroglicerina 17
18 Meccanismo: 1. formazione di - (reazione acido-base) ione T (elettrofilo). reazione di.. : - nitrato di metile S S solfato acido di metile S S solfato dimetilico 0 S S S 4 Δ alcheni c) Acidi solfonici S acido p-toluensolfonico S p-toluensolfonato di (tosilato) Per avere completamente il solfonato, l alcool si fa reagire con il cloruro di p-metil benzensolfonile l S S S l tosilato di Ts Formare il tosilato è un altro modo di trasformare l in un buon gruppo uscente l - S - Ts l Ts.. S - Ts Ts - 18
19 EAZ D SSDAZE degli Alcooli ssidazione biologica dell'etanolo alcool deidrogenasi [] - SoA SoA acetilcoenzima A trigliceridi, ecc. ssidazione chimica alcool 1 o [- ] [] alcool o [- ] [] X alcool o [- ] X ossidanti tipici KMn 4, - r 4 conc. a r 4 K r 7 ATTEZE! [] - Gli alcooli terziari non vengono ossidati; però alcuni ossidanti sono acidi e come tali possono reagire con gli alcooli terziari ESSUA EAZE alchene prodotti di ossidazione dell'alchene Meccanismo (semplificato) - r r(v) r r r(v) - ESEMP KMn 4,, tampone basico 7% 19
20 ( ) 5 ( ) 5 75% Per ossidare gli alcooli primari ad aldeide è necessario usare reagenti speciali, particolarmente blandi (mild) in condizioni controllate. eattivo di Jones K r 7, S 4 diluito, ( ) = eccesso di reattivo eattivo di ollins r. ( ) 5 ( ) 5 clorocromato di piridinio (P). r. l -etil-1-esanolo -etilesanale 87% ssidazione dei DL reagente caratteristico 4 acido periodico scissione perché la reazione avvenga è necessario che i due - siano su adiacenti 0
21 La scissione del legame - avviene anche se sono adiacenti un - ed un = 4 La scissione del legame - non avviene se sono adiacenti un - ed una funzione - 4 nessuna reazione 4 nessuna reazione 4 nessuna reazione Se ci sono più di due - su adiacenti, TUTT i legami - si rompono 4 Meccanismo:.... 1
22 ETE aratteristica strutturale degli eteri - - aratteristiche Spettrali Spettrometria di massa La frammentazione più importante avviene tra il α all ed il β (carbocatione stabile).. ' M - 7 diisopropil etere, P.M. 10 M - UV-visibile Solo legami σ: le transizioni n σ* richiedono λ = nm (lontano UV): fuori dal comune intervallo stretching cm -1
23 dipropil etere 1 M 1 M L effetto - dell diminuisce la densità elettronica attorno al nucleo del 1 : deschermato L effetto - dell diminuisce la densità elettronica attorno al nucleo del 1 : deschermato a.5δ A B B A A B
24 .. --'.. Fra gli eteri, quelli più usati come solvente, oltre al dietil etere, sono P EATTV USAT SPESS ME SLVET quelli ciclici ossaciclopentano (tetraidrofurano) 1,4-diossacicloesano (diossano) Danno reazione solo con, a caldo.... '.. - Δ ' ' ' reazione acido-base sostituzione nucleofila esempio: Δ - - se c'è un eccesso di e si lascia il tempo, anche gli alcooli reagiscono con = = però Δ Viene attaccato da - SL il sp - ecc. legame (aromatico- più forte di (alifatico)- Gli eteri ciclici con anelli tesi sono più reattivi perché, con l'apertura dell'anello, hanno sollievo dalla tensione d'anello SSALBUTA reagiscono anche con, a caldo APETUA DELL'AELL 4
25 Δ meccanismo: - SSALPPA MLT EATTV APETUA DELL'AELL a) con ULEFL FT S - u: - u u esempio: - - :S S S Se l'ossaciclopropano è sostituito, la reazione ha un orientamento dovuto al meccanismo (S ) EGSPEFTA' EGSELETTVTA' Di due "regioni" del substrato possibili e simili una sola viene attaccata Di due "regioni" del substrato possibili e simili una viene attaccata di preferenza - S S eazione regiospecifica; reazione stereospecifica S : più reattivo meno sostituito S : attacco di u da parte opposta al gruppo uscente 5
26 b) in assenza di ULEFL FT Bisogna rendere -- un miglior gruppo uscente apertura dell'anello acido-catalizzata :.. l processo è S 1, ma non si forma un vero carbocatione, per l'interazione con il doppietto elettronico dell'ossigeno S δ δ δ δ parziale carbocatione primario parziale carbocatione secondario (se ne forma di più) δ δ δ δ.. S prodotto principale prodotto secondario eazione regioselettiva; reazione stereospecifica Si forma più (ma non solo) parziale carbocatione secondario PLETE L (ETE A) attacco di u da parte opposta al gruppo uscente 18-orona-6 18-rown-6 6
27 7 K 1-rown-4 15-rown-5 PTAD catione n complesso PTAT n
28 AMME aratteristica strutturale delle ammine : aratteristiche Spettrali Spettrometria di massa Lo ione molecolare è quasi sempre presente La frammentazione più importante avviene tra il α all ed il β (carbocatione stabile) '' '.. '' ' Per le ammine vale la regola dell azoto '' ' La regola dell azoto E una regola universale che riguarda sia gli ioni molecolari che i frammenti con una singola carica. tutti gli ioni con numero dispari di elettroni hanno valori m/z pari, tranne quando contengono un numero dispari di atomi di azoto Questa regola viene dal fatto che l azoto ha massa atomica pari e valenza dispari. 0 ( = ) 1-butanammina, P.M. 7 M 1
29 dietilammina, P.M. 7 M - M UV-visibile Solo legami σ: le transizioni n σ* richiedono λ = nm (lontano UV): fuori dal comune intervallo stretching cm -1 DUE bande per le ammine primarie; una banda per le ammine secondarie (debole se alifatiche, forte se aromatiche). Le amine terziarie non hanno assorbimento bending - nelle ammine primarie, banda larga cm -1 nelle ammine secondarie verso 1500 cm -1 stretching cm -1 1-butanammina
30 %T -butanammina cm -1 dietilammina 1 M L effetto - dell diminuisce la densità elettronica attorno al nucleo del 1 : deschermato 1-butanammina A B D A B D 1 M L effetto - dell diminuisce la densità elettronica attorno al nucleo del 1 : deschermato a.5- δ Anche l sull è mobile: scambia abbastanza rapidamente da non dare accoppiamento con nuclei adiacenti
31 terz-butilammina : atomo basico, atomo nucleofilo cattivo gruppo uscente, anche in seguito a protonazione ESSUA EAZE 1. come atomo basico o nucleofilo con acidi con come elettrofilo SL con ammine terziarie ( ) - ( ) % 4
32 invece di si possono usare peracidi : con alogenuri alchilici - La reazione dà miscele di prodotti, perché anche il prodotto della sostituzione è nucleofilo Quando l alchilazione dell ammina si esegue fino al sale di ammonio si parla di METLAZE ESAUETE con acido nitroso La reazione con è la reazione più caratteristica delle ammine, che permette di distinguere tra ammine primarie, secondarie e terziarie. Fatti sperimentali: ammine primarie alcooli, alcheni, sviluppo di gas ammine secondarie - nitrosammina precipitato giallo ammine terziarie ESSUA EAZE L'acido nitroso si genera in situ a l al 5
33 MEASM ammine primarie catione nitrosonio.. alcool alchene E in comune ai diversi tipi di ammina i sali di diazonio si possono isolare solo con le ammine aromatiche a 0-5 isolabile ammine secondarie.. ammine terziarie : i sali di ammonio quaternari possono essere usati come catalizzatori di trasferimento di fase l a - ESSUA EAZE (neanche a caldo) solubile in solvente idrocarburico (solvente non polare) solubile in acqua 6
34 4 se contiene almeno 4 atomi di, è solubile sia in acqua (per l' positivo) che in solventi non polari (per ) - 4 l - a 4 a l - - porta in fase organica il reagente nucleofilo - 4 ' l 4 l - ' 4 - a l - a 4 l pessimo gruppo uscente Metilazione esauriente - Degradazione di ofmann eazione utilizzata per la determinazione della struttura di ammine Esempi:.. - metilazione esauriente - Ag β Ag : - β-eliminazione Δ : 7
35 - Ag Ag : - - β Δ - Ag Ag - β - Δ.. 1) ) Ag - Δ 1) - Δ ) Ag 1) Δ ) Ag - 8
36 Applicazione: sintesi del cicloottatetraene (Wilstätter) a, omposto naturale estratto dalla corteccia del melograno Ag / Δ - 96% Ag / Δ S 4 84% 84% 90% ( ) - 94,5% - 97,5% 7% - non isolato Ag / Δ ( ) Ag esa complessiva: % ( ) 68% (per i due passaggi) 10-0% Gli -ossidi delle ammine terziarie danno β-eliminazione Eliminazione di ope - ( ) ' [] ( ) ' ([] = reagente ossidante, per esempio ) meccanismo: -.. :.. ( ) ' δ- δ ( ) ' ' -( ) reazione stereospecifica eliminazione sin 9
37 Esercitazione n. 1 - eazioni degli alogenuri alchilici. 1. Dare definizione ed un esempio per ciascuno dei seguenti termini: on sottovalutate questo tipo di esercizio: è importante saper esporre in modo chiaro e sintetico i concetti. Se si è capito un concetto, bisogna saperlo esprimere! Provate ad esprimerlo con parole vostre, prima di guardare le risposte. a) nucleofilo eagente che partecipa alla formazione di un nuovo legame con una coppia di elettroni eagente che partecipa alla formazione di un nuovo b) elettrofilo legame con orbitale vuoto c) gruppo uscente Atomo (o insieme di atomi) che si stacca dal centro di reazione la coppia di elettroni di legame eazione in cui un atomo (o insieme di atomi) esce dal d) sostituzione centro di reazione e viene sostituito da un altro eazione di sostituzione nucleofila bimolecolare, in cui e) reazione S substrato e nucleofilo prendono parte allo stato di transizione dell unico stadio eazione di sostituzione nucleofila unimolecolare, in assenza f) reazione S 1 di u forte, in cui il substrato si dissocia nello stadio lento ed il u si lega al carbocatione nello stadio veloce g) solvolisi eazione di sostituzione nucleofila in cui il u (debole) è il solvente polare protico (acqua, alcooli, acidi carbossilici) h) eliminazione eazione in cui due atomi (o insiemi di atomi) escono da due adiacenti (che si danno legame π) formando una molecola piccola e neutra. i) reazione E j) reazione E1 eazione di eliminazione bimolecolare in un unico stadio. Accompagna S se u forte è anche B forte eazione di eliminazione unimolecolare in due stadi, dal carbocatione per perdita di in β. Accompagna sempre S 1 k) trasposizione Migrazione di un metile (più difficilmente di un ) da una posizione a quella adiacente per dare un carbocatione più stabile l) ingombro sterico Spazio occupato da un gruppo (tenendo conto anche della rotazione attorno ai legami -) m) composto litioorganico omposto con legame -Li ( molto negativo: praticamente carbanione, u forte, B forte) n) reattivo di Grignard omposto con legame -Mg ( molto negativo: praticamente carbanione, u forte, B forte) o) dialchilcuprato di litio uli, omposto con legame -u ( molto negativo: praticamente carbanione, u forte, B forte); complessivamente anione, con Li come ione di bilanciamento 1
38 . Scrivere le seguenti reazioni, identificando, in ogni caso, il reagente nucleofilo, l'atomo nucleofilo, l'atomo elettrofilo, il gruppo uscente: a) clorometano a E l u - l - b) -bromobutano K E - - u c) 1-iodo--metilpropano cianuro di potassio (K) E - - u d) bromocicloesano metantiolato di sodio ( Sa) E S u - - S e) iodoetano ammoniaca - E u f) bromometano trimetilfosfina, P( ) E u - P( ) P( ). Per ciascuna delle seguenti serie, mettere i gruppi in ordine crescente di: (1) basicità () nucleofilicità () capacità come gruppo uscente: basicità: capacità di donare elettroni a capacità come gruppo uscente: inverso della basicità nucleofilicità: capacità di donare elettroni a E
39 - - basicità nucleofilicità capacità come gruppo uscente F - l basicità nucleofilicità capacità come gruppo uscente basicità - P - capacità come gruppo uscente - - P nucleofilicità basicità capacità come gruppo uscente nucleofilicità F - S - F S - S basicità capacità come gruppo uscente nucleofilicità S
40 4. he cosa rappresentano (a), (b) e (c) nei seguenti diagrammi di energia? a) Energia di attivazione (ΔG = ) b) Stato di transizione c) ΔG della reazione a) Energia di attivazione (ΔG = ) dello stadio lento b) Energia di attivazione (ΔG = ) dello stadio lento c) ΔG della reazione 5. Disegnare il diagramma dell'energia per la reazione S 1 che dal - bromo--metil-butano porta al -metil--butanolo. per S 1 δ δ- δ δ E δ δ- - coordinata di reazione 4
41 6. Mettere i seguenti carbocationi in ordine di stabilità crescente (spiegare): Un carbocatione è una specie a difetto elettronico: è stabilizzato se delocalizza la carica per risonanza oppure se ci sono sostituenti alchilici (a rilascio elettronico per effetto induttivo, ) < < < 7. ndicare il raggruppamento allilico o benzilico nei seguenti composti, specificando anche se è primario, secondario o terziario: a) -clorociclopentene; b) -cloro--fenilpropano; c) 1-bromo--metilenecicloesano; d) bromocicloesilfenilmetano; e) -cloro-5-metilciclopentene l l allilico benzilico allilico benzilico allilico l 5
42 10. ndividuare nelle seguenti strutture gli atomi di carbonio e di idrogeno in β all'alogeno, specificando quanti tipi di idrogeno α ci sono in ciascun composto e scrivendo i prodotti di eliminazione: a) -bromopentano β β' b) 1-bromo-1-metilciclopentano β β' β c) bromocicloesano β β d) bromobenzene β β niente eliminazione (alogenuro arilico) e) bromometilcicloesano β f) 1-bromo--metilbutano β g) -iodopentano β β 6
43 11. a) Quale è l'alchene più stabile tra -metil-1-butene e -metil--butene? L alchene con il maggior numero di sostituenti sul = < b) Quale sarà il prodotto principale di una E1 eseguita sul -bromo--metilpentano? E1 β β > c) Quale è il prodotto principale di eliminazione E1 dell'1-bromo-1- metilcicloesano? β E1 β > 1. Quali composti, tra i seguenti, contengono un buon gruppo uscente: a) -iodo--metilpropano; b) -bromonaftalene; c) clorociclopentano; d) iodobenzene; e) -cloropropene; f) -cloropropene. Buon gruppo uscente: gruppo (poco basico) che ospita bene gli elettroni di legame dopo la scissione eterolitica dal sp l l l 7
44 1. ndicare quale atomo di carbonio può essere attaccato da un nucleofilo nei seguenti composti: Un u attaccherà un sp 1 o con un buon gruppo uscente u: - a) bromometano b) bromociclopentano c) 1-bromo-1- metilcicloesano d) bromobenzene e) bromuro di benzile f) bromuro di m-bromobenzile g) 1-bromo-1-bromometilcicloesano 14. Scrivere le strutture di risonanza dei seguenti carbocationi: ecc. ecc. PU' ESSEE STABLZZAT PE SAZA 8
45 15. Quali dei seguenti sono composti organometallici: a) g; b) ( 6 5 ) Mg; c) ( ) Si - a. un composto è organometallico quando contiene almeno un legame -metallo g Mg - Si a 16. Dare il nome ai seguenti composti: Mgl a) 6 5 Mgl cloruro di fenilmagnesio b) Mgl cloruro di propilmagnesio c) ( ) 4 Li esillitio d) ( ) uli dimetilcuprato di litio e) ( 6 5 ) uli ) uli difenilcuprato di litio 17. ompletare le seguenti reazioni, scrivendo i prodotti di sostituzione (se ce n'è) a) 1-iodopentano - - b) bromociclopentano metantiolato di sodio - S - S - c) clorobenzene acqua l nessuna reazione d) cloruro di p-clorobenzile - l - l - l l e) 1-cloro-1-butene - nessuna reazione l 9
46 18. ompletare le seguenti reazioni, indicando tutti i possibili prodotti di sostituzione, il meccanismo e specificando il nome dei prodotti: a) 1-bromo--metilenecicloesano (= 1-bromo--metilidenecicloesano) - - u forte S -metilidenecicloesancarbonitrile b) 1-bromo--metilenecicloesano metanolo assenza di u forte; solvente polare protico 1-metilidene-- metossicicloesano S 1-1-metossimetilcicloesene c) -clorometilnaftalene S - l - S S -mercaptometilnaftalene u forte S g) fenolo cloruro di benzile l benzil fenil etere u debole, solvente polare protico - ecc. S 1 10
47 d) fenossido di sodio (=fenato = ) cloruro di benzile - l u forte S benzil fenil etere e) 1-cloro-,4-esadiene metossido di sodio l - u forte S 1-metossi-,4-esadiene f) 1-cloro-,4-esadiene metanolo l assenza di u forte; solvente polare protico S 1 1-metossi-,4-esadiene -metossi-1,4-esadiene 5-metossi-1,-esadiene 11
48 19. Scrivere i prodotti (ed i relativi nomi) delle seguenti reazioni S : a) cloroetano etossido di sodio in etanolo l - S dietil etere b) 1-bromo--feniletano cianuro di sodio in acetone - S -fenilpropanonitrile c) clorocicloesano metantiolato di sodio l - S S S cicloesil metil solfuro d) 1-clorodecano ioduro di sodio in acetone l S - 1-iododecano e) piridina (= azabenzene) ioduro di metile S - ioduro di -metilpiridinio f) 1-bromo-,-dimetilbutano ammoniaca (in eccesso) S (eccesso) -,-dimetil-1-butanammina 1
49 0. Quale sarà il prodotto organico principale in ciascuna delle seguenti reazioni? ndicare il tipo di meccanismo: a) ioduro di terz-butile metanolo u debole, solvente protico S 1 E1 b) fenossido di sodio ioduro di metile - (a ) S u forte c) -cloro--metilbutano metossido di sodio l - (a ) alogenuro terziario d) -bromopentano idrossido di sodio in etanolo a caldo - Δ u forte, B forte la temperatura elevata favorisce l eliminazione e) -bromo--metilbutano terz-butossido di potassio - alogenuro terziario u forte, B forte u forte, B forte ofmann E E E 1
50 f) ()--bromobutano acido acetico u debole, solvente protico () E1.. S 1 (S) () 1. seguenti alogenuri alchilici vengono riscaldati in K metanolica. Scrivere i prodotti delle reazioni di deidroalogenazione, indicando il prevalente quando ce n'è più di uno: a) cis-1-bromo--metilcicloesano K a caldo > E b) trans-1-bromo--metilcicloesano c) 4-cloroeptano l 14
51 . ompletare le seguenti reazioni, specificando il nome del composto organico che si forma: a) -iodonaftalene magnesio, in dietil etere Mg Mg ioduro di -naftilmagnesio b) 1-iodocicloesene magnesio, in dietil etere Mg Mg ioduro di cicloesenilmagnesio c) bromocicloesano magnesio, in dietil etere Mg Mg bromuro di cicloesilmagnesio d) cloruro di benzile magnesio, in dietil etere Mgl l Mg cloruro di benzilmagnesio. Scrivere i prodotti della reazione dello ioduro di metilmagnesio con: a) acqua δ- Mg 4 Mg() base acido b) etanolo c) ammoniaca d) fenolo Mg Mg 4 Mg 4 ( )Mg - Mg Mg 4 e) etilammina Mg - 4 Mg f) acido acetico Mg 4 - Mg g) propino Mg 4 - Mg 15
52 4. ompletare le seguenti reazioni, specificando il nome del prodotto organico: a) bromocicloesano litio b) ciclopentillitio dietilammina Li Li Li cicloesillitio δ- δ Li ( ) ( ) - Li ciclopentano c) bromuro di etile magnesio Mg Mg bromuro di etilmagnesio d) bromuro di fenilmagnesio acido formico ( metanoico) Mg - Mg benzene e) butillitio ioduro rameoso Li u [( )u]li uli dibutilcuprato di litio f) butillitio acqua Li Li butano 5. Scrivere le equazioni chimiche delle reazioni del -metil--bromopentano con: a) etanolo; b) etossido di sodio; c) magnesio; d) litio. - Mg Mg Li Li Li 16
53 Esercitazione n. 1 - eazioni di alcooli, dioli, eteri, ammine, sali di ammonio. 1. Scrivere il prodotto, specificandone il nome, della reazione con P di: - P - P S a) 1-propanolo b) -propanolo c) 1-butanolo P P 11- bromopropano -bromopropano P 1-bromobutano d) alcool isobutilico P 1-bromo--metilpropano e) cis--metilciclopropanolo P trans-1-bromo--metilciclopropano f) 1-terz-butil-1-cicloesanolo g),,6,6-tetrametilcicloesanolo P P nessuna reazione ( terziario) nessun prodotto (ingombro sterico). Scrivere i prodotti della reazione degli alcooli dell'esercizio precedente con: a) acido solforico concentrato, a caldo; b) con concentrato. on metanolo ed alcooli primari: bimolecolare; con alcooli secondari e terziari: carbocatione a) 1-propanolo S 4, Δ 1
54 b) -propanolo S 4, Δ c) 1-butanolo S 4, Δ d) alcool isobutilico S 4, Δ e) cis--metilciclopropanolo S 4, Δ f) 1-terz-butil-1-cicloesanolo S 4, Δ
55 g),,6,6-tetrametilcicloesanolo trasp. S 4 Δ trasp.. Scrivere le reazioni dell'1-pentanolo con i seguenti reagenti, specificando i nomi dei prodotti: a) terz-butossido di potassio ( ) - K ( ) 4 - K ( ) b) sodio metallico 1-pentossido (di potassio) a ( ) 4 - a 1/ 1-pentossido (di sodio) c) metillitio Li ( ) 4 - Li 4 1-pentossido (di litio) d) concentrato 1-iodopentano e) l Znl Znl l l 1-cloropentano
56 f) acido solforico concentrato, a caldo S 4, Δ 1-pentene g) P P 1-bromopentano h) Sl Sl l 1-cloropentano i) K r 7 S 4 in acqua K r 7 S 4, acido pentanoico 4. ompletare le seguenti reazioni: a) trans--metilciclopentanolo,-dimetil--iodobutano u debole; solvente protico alogenuro secondario trasp. 4
57 b),-dimetil-1-butanolo l, Znl l Znl trasp. l l - l l c) cicloesilmetanolo acido solforico concentrato, a caldo S 4, Δ d) biciclo-[4.4.0]-decan-1-olo S 4 S 4, Δ 5. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si formano: a) -butanolo acido solforico concentrato S 4, Δ -butene 1-butene 5
58 b) -propanolo acido cromico c) -butanolo d) 1-propanolo r S 4 r 4 propanone (dimetil chetone; acetone) e) alcool terz-butilico KMn 4 -bromobutano -butene 1-butene r 4 ac.propanoico KMn 4 ESSUA EAZE f) etil isopropil etere a caldo, Δ iodoetano -propanolo -iodopropano etanolo g),-butandiolo 4 4 propanale 6
59 6. ompletare le seguenti reazioni, specificando il nome dei composti organici: a) ()--butanolo cloruro di p-toluensolfonile (= p-metilbenzensolfonile); S -l S () b) p-toluensolfonato di (S)-1-metilpropile a (S) S (a ) - l () p-toluensolfonato di sec-butile (di 1- metilpropile) S - () -bromobutano c) cicloottanolo r / S 4 in acetone r / S 4 in cicloottanone d) ciclopentilmetanolo r.piridina r ciclopentancarbaldeide e) ciclopentanolo l/znl l/znl l clorociclopentano ciclopentene 7
60 f) cicloottilmetanolo bromuro di etilmagnesio - Mg Mg cicloottilmetossido etano g) terz-butossido di potassio ioduro di metile - (K ) h) metossido di sodio ioduro di terz-butile - metil terz-butil etere metilpropene metanolo i) 1-butanolo j) ciclopentanolo S 4 a caldo 1-bromobutano S 4 ciclopentene k) etossido di sodio 1-bromobutano - a butil etil etere l) etossido di sodio -metil--bromobutano - a -metil--butene -metil-1-butene 8
61 7. Scrivere le reazioni dei seguenti alcooli con (1) a r 7 / S 4, () il reattivo di Jones, () r.piridina, (4) KMn 4 in ambiente basico, (5) acido nitrico: (1) a r 7 S 4 (= r 4 ) () reattivo di Jones: a r 7 S 4 diluito in acetone (= r 4 ) () r. (4) SSDAT a) 1-butanolo (),() (1),(),(4) b) -butanolo (1),(),(),(4) c) 1-metilcicloesanolo (1),(),() ESSUA EAZE 9
62 8. Scrivere le reazioni con acido cromico dei seguenti composti: r 4 ossidante a) cicloesanolo b) 1-metilcicloesanolo ESSUA EAZE c) -metilcicloesanolo d) etanolo 9. Scrivere le reazioni del cicloesilmetanolo con ciascuno dei seguenti reagenti: a) a r 7 / S 4, b) reattivo di Jones; c) reattivo di ollins; d) clorocromato di piridinio. b), c), d) a) 10. Scrivere le reazioni di disidratazione catalizzata da acido solforico per i seguenti alcooli: S 4, Δ eliminazione di a) 1-esanolo b) -esanolo 10
63 c) -pentanolo d) 1-metilciclopentanolo e) idrossimetilciclopentano f) -metilciclopentanolo 11. ompletare le seguenti reazioni: a) 1-metossi--(-metossietil)cicloesano ( equivalenti) a caldo - 11
64 b) -metilossacicloesano (un equivalente), a caldo S - c) -metilossacicloesano (due equivalenti), a caldo d) (S)--pentanolo cloruro di p-toluensolfonile S l (S) S (S) e) ()--butanolo S 4 a caldo S 4 () f) ossaciclobutano concentrato, a caldo g),4-dimetilossaciclopentano concentrato, a caldo 1
65 1. ompletare le seguenti reazioni (se c'è reazione), specificando i nomi dei composti organici: a) isopropil sec-butil etere concentrato, a caldo, Δ b) etil terz-butil etere concentrato a caldo, Δ ESSUA EAZE c) dibutil etere a concentrata, a caldo d) dibutil etere a metallico a, Δ a ESSUA EAZE e) etossibenzene a caldo, Δ sp f) ossaciclopropano, g) trans--butil--metilossaciclopropano, 1
66 h) metilossaciclopropano metanammina i) terz-butossido di potassio 1-bromobutano - - ( ) 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si formano: a) metanammina iodometano - dimetilammina 14
67 b) -propanammina acido nitroso ( ) c) cloruro di etiltrimetilammonio K a caldo K K d) idrossido di (1-metilpropil)trimetilammonio a caldo ompletare le seguenti reazioni: a) dimetilpropilammina ; b) il prodotto ottenuto in (a) sottoposto a riscaldamento; - - Δ c) bromuro di trimetil(-metilbutil)ammonio K a caldo. K Δ 15
68 15. Prevedere i prodotti di metilazione esauriente (degradazione di ofmann) dei seguenti composti: β K α Δ β α β K Δ ( ) K Δ ( ) β α K Δ β α β K Δ K Δ K Δ 16
69 K Δ α β K Δ K Δ K Δ K Δ β β K Δ 1. ompletare le reazioni del cis--metilcicloesanolo, con i seguenti reagenti, specificando l'andamento stereochimico; a) P ; b) Sl /piridina; c) l/ Znl ; d) concentrato; e) cloruro di p-toluensolfonile/piridina e poi a. a) P P S trans b) Sl /piridina Sl, piridina S l trans 17
70 c) l/ Znl l, Znl S 1 l l alcheni trans cis d) concentrato S 1 trans cis alcheni e) cloruro di p-toluensolfonile/piridina e poi a S -l S cis - S trans 18
Esercitazione n Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio.
 Esercitazione n. 1 - Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio. 1. Scrivere il prodotto, specificandone il nome, della reazione con P di: R- P R- P S N 2 a) 1-propanolo b) 2-propanolo
Esercitazione n. 1 - Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio. 1. Scrivere il prodotto, specificandone il nome, della reazione con P di: R- P R- P S N 2 a) 1-propanolo b) 2-propanolo
Esercitazione n Reazioni degli alogenuri alchilici.
 Esercitazione n. 1 - Reazioni degli alogenuri alchilici. 1. Dare definizione ed un esempio per ciascuno dei seguenti termini: Non sottovalutate questo tipo di esercizio: è importante saper esporre in modo
Esercitazione n. 1 - Reazioni degli alogenuri alchilici. 1. Dare definizione ed un esempio per ciascuno dei seguenti termini: Non sottovalutate questo tipo di esercizio: è importante saper esporre in modo
Esercitazione n Reazioni degli alogenuri alchilici.
 Esercitazione n. 12 - Reazioni degli alogenuri alchilici. 1. Dare definizione ed un esempio per ciascuno dei seguenti termini: Non sottovalutate questo tipo di esercizio: è importante saper esporre in
Esercitazione n. 12 - Reazioni degli alogenuri alchilici. 1. Dare definizione ed un esempio per ciascuno dei seguenti termini: Non sottovalutate questo tipo di esercizio: è importante saper esporre in
ALCOOLI R-O-H C H. ... a. alcossido H C O - BASE H C O H + H C X. alcheni. a,d. ossidazione. aldeidi e chetoni. b b,c
 ALLI.. --.. BASE a - alcossido c d b.... a himica rganica e Laboratorio AID a,d ossidazione aldeidi e chetoni b b,c X alcheni ottura del legame SSTITUZINE NULEFILA Br Br 2 Br - 2 ELIMINAZINE 2 S 4 Δ 2
ALLI.. --.. BASE a - alcossido c d b.... a himica rganica e Laboratorio AID a,d ossidazione aldeidi e chetoni b b,c X alcheni ottura del legame SSTITUZINE NULEFILA Br Br 2 Br - 2 ELIMINAZINE 2 S 4 Δ 2
La risoluzione di un buon spettrometro di massa è 1 amu (atomic mass number) su10 4 amu.
 PRINIPI DELLA SPETTRMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
PRINIPI DELLA SPETTRMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
La risoluzione di un buon spettrometro di massa è 1 amu (atomic mass number) su10 4 amu.
 PRINCIPI DELLA SPETTROMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
PRINCIPI DELLA SPETTROMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
Esercitazione n Reazioni degli alcani
 Esercitazione n 10 - Reazioni degli alcani 1 assificare ciascuno degli idrogeni indicati come primario, secondario, terziario, allilico o benzilico: a) (C ) CC b) (C ) C c) primario d) e) terziario secondario
Esercitazione n 10 - Reazioni degli alcani 1 assificare ciascuno degli idrogeni indicati come primario, secondario, terziario, allilico o benzilico: a) (C ) CC b) (C ) C c) primario d) e) terziario secondario
AMMINE. con acidi RNH 2. con O come elettrofilo RNH 2 + H + + R NH 3 NESSUNA REAZIONE. atomo basico, atomo nucleofilo
 AMME : 2 1. come atomo basico o nucleofilo atomo basico, atomo nucleofilo cattivo gruppo uscente, anche in seguito a protonazione ESSUA EAZE con acidi 2 con come elettrofilo SL con ammine terziarie 2 2
AMME : 2 1. come atomo basico o nucleofilo atomo basico, atomo nucleofilo cattivo gruppo uscente, anche in seguito a protonazione ESSUA EAZE con acidi 2 con come elettrofilo SL con ammine terziarie 2 2
Esercitazione n Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio.
 09/05/01 Esercitazione n. 1 - Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio. 1. Scrivere il prodotto, specificandone il nome, della reazione con P di: R- P R- P S N a) 1-propanolo b) -propanolo
09/05/01 Esercitazione n. 1 - Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio. 1. Scrivere il prodotto, specificandone il nome, della reazione con P di: R- P R- P S N a) 1-propanolo b) -propanolo
Esercitazione - Reazioni degli alcani
 Esercitazione - Reazioni degli alcani assificare ciascuno degli idrogeni indicati come primario, secondario, terziario, allilico o benzilico: a) ( ) b) ( ) c) primario d) e) terziario secondario allilico
Esercitazione - Reazioni degli alcani assificare ciascuno degli idrogeni indicati come primario, secondario, terziario, allilico o benzilico: a) ( ) b) ( ) c) primario d) e) terziario secondario allilico
M: M +. + e. La risoluzione di un buon spettrometro di massa è 1 amu (atomic mass number) su10 4 amu.
 PINIPI DELLA SPETTMETIA DI MASSA A differenza delle altre tecniche analitiche (I, UV-vis, NM) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni invece
PINIPI DELLA SPETTMETIA DI MASSA A differenza delle altre tecniche analitiche (I, UV-vis, NM) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni invece
C = 9.5 (a -50 C); 15 (a 25 C); 21 (a 100 C)
 a 50 22 K RT = 102 kcal/mole K = 10 (1)/102 = 10 098 = 95 a 25 298 K RT = 17 kcal/mole K = 10 (1)/17 = 10 07 = 54 a 100 7 K RT = 171 kcal/mole K = 10 (1)/171 = 10 058 = 8 K = D/ D = K x { K = 100 D = 100
a 50 22 K RT = 102 kcal/mole K = 10 (1)/102 = 10 098 = 95 a 25 298 K RT = 17 kcal/mole K = 10 (1)/17 = 10 07 = 54 a 100 7 K RT = 171 kcal/mole K = 10 (1)/171 = 10 058 = 8 K = D/ D = K x { K = 100 D = 100
Le reazioni degli alogenuri alchilici: le sostituzioni nucleofile e le eliminazioni
 Le reazioni degli alogenuri alchilici: le sostituzioni nucleofile e le eliminazioni δ - X δ X = F, l, o I Dato il carattere elettrofilo del carbonio alogeno sostituito, buona parte della chimica degli
Le reazioni degli alogenuri alchilici: le sostituzioni nucleofile e le eliminazioni δ - X δ X = F, l, o I Dato il carattere elettrofilo del carbonio alogeno sostituito, buona parte della chimica degli
Esercitazione n Reazioni degli alogenuri alchilici.
 Esercitazione n. 11 Reazioni degli alogenuri alchilici. 1. Dare definizione ed un esempio per ciascuno dei seguenti termini: a) nucleofilo Reagente che partecipa alla formazione di un nuovo legame con
Esercitazione n. 11 Reazioni degli alogenuri alchilici. 1. Dare definizione ed un esempio per ciascuno dei seguenti termini: a) nucleofilo Reagente che partecipa alla formazione di un nuovo legame con
Capitolo 8 Alcoli e Fenoli
 Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
1. Scrivere la formula di struttura di tutti i possibili isomeri aventi le seguenti formule molecolari: a. C 5 H 12 ; b. C 2 H 5 Cl; c. C 4 H 10 O.
 1. Scrivere la formula di struttura di tutti i possibili isomeri aventi le seguenti formule molecolari: a. C 5 12 ; b. C 2 5 Cl; c. C 4 10. 2. Scrivere la formula di struttura dei seguenti composti: a.
1. Scrivere la formula di struttura di tutti i possibili isomeri aventi le seguenti formule molecolari: a. C 5 12 ; b. C 2 5 Cl; c. C 4 10. 2. Scrivere la formula di struttura dei seguenti composti: a.
H H. R R δ+ R H. δ Cl
 Alogenuri alchilici: nomenclatura e reattività Nomenclatura: due possibilità a) Per gli alogenuri più semplici: residuo alchilico + nome dell alogeno (Es metilbromuro, etilbromuro). b) Per molecole più
Alogenuri alchilici: nomenclatura e reattività Nomenclatura: due possibilità a) Per gli alogenuri più semplici: residuo alchilico + nome dell alogeno (Es metilbromuro, etilbromuro). b) Per molecole più
Addizioni nucleofile. Addizioni a C=O
 Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione
 Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione Queste reazioni hanno rilevanza prevalentemente per la sintesi organica Nucleofilo OH - Alogenuri
Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione Queste reazioni hanno rilevanza prevalentemente per la sintesi organica Nucleofilo OH - Alogenuri
Appunti di Chimica Organica Elementi per CdL Ostetricia CHIMICA ORGANICA. Appunti di Lezione. Elementi per il corso di Laurea In Ostetricia
 Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Unità didattica 6. Cosa è una sostutizione? Reazioni di Sostituzione degli Alogenuri Alchilici
 Cosa è una sostutizione? Unità didattica 6 Reazioni di Sostituzione degli Alogenuri Alchilici Capitolo 7 e 8 di Brown e Poon L atomo o il gruppo che è sostituito o eliminato in queste reazioni è detto
Cosa è una sostutizione? Unità didattica 6 Reazioni di Sostituzione degli Alogenuri Alchilici Capitolo 7 e 8 di Brown e Poon L atomo o il gruppo che è sostituito o eliminato in queste reazioni è detto
Reazioni degli alcoli
 Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
Gruppi funzionali. aldeidi
 Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
ALCOLI. Tabella dei valori di pka compresi tra 10 e estere acetacetico. pka CH HC. acetilene COOEt 24.0.
 ALLI Indice: intesi degli alcossidi 2 intesi di Williamson degli eteri 2 intesi degli alogenuri alchilici 3 intesi degli esteri 6 Disidratazione degli alcoli ad eteri 7 Disidratazione degli alcoli ad alcheni
ALLI Indice: intesi degli alcossidi 2 intesi di Williamson degli eteri 2 intesi degli alogenuri alchilici 3 intesi degli esteri 6 Disidratazione degli alcoli ad eteri 7 Disidratazione degli alcoli ad alcheni
È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica
 aratteristica strutturale degli alogenuri ALOGENO È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica + - 2 2 Br elettronegativo, con parziale carica negativa questo NON
aratteristica strutturale degli alogenuri ALOGENO È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica + - 2 2 Br elettronegativo, con parziale carica negativa questo NON
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Esercitazione n Reazioni degli alcani
 Esercitazione n 11 - Reazioni degli alcani 1 assificare ciascuno degli idrogeni indicati come primario, secondario, terziario, allilico o benzilico: a) ( ) C b) ( ) CH c) H primario d) e) terziario H H
Esercitazione n 11 - Reazioni degli alcani 1 assificare ciascuno degli idrogeni indicati come primario, secondario, terziario, allilico o benzilico: a) ( ) C b) ( ) CH c) H primario d) e) terziario H H
REAZIONI DEGLI ALCHENI
 REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
R-X ALOGENURI ALCHILICI. F Cl Br I. Nomenclatura. In genere si indicano con. + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo
 ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
 SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
Ammine : caratteristiche strutturali
 Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Alcoli e Tioli. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcoli e Tioli Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcoli e Tioli Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Reazioni Stereospecifiche e Stereoselettive
 Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
ALCOLI, ETERI, TIOLI. Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
Esercitazione n Reazioni sulle reazioni di alcheni.
 Esercitazione n. 1 - Reazioni sulle reazioni di alcheni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) -butene b) -butene acqua, in ambiente acido -bromobutano,
Esercitazione n. 1 - Reazioni sulle reazioni di alcheni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) -butene b) -butene acqua, in ambiente acido -bromobutano,
Alogenuri alchilici. Alogenuri alchilici: funzioni. Varietà di funzione dei composti alogenati. Figura
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: nomenclatura Alogenuri alchilici o aloalcani Bromo Alogenuri alchilici: struttura
Reattività degli alogenuri alchilici
 Reattività degli alogenuri alchilici 1 3 Meccanismo della Reazione di Sostituzione Nucleofila 4 5 Meccanismo unimolecolare: sostituzione nucleofila unimolecolare (SN1) Un alogenuro che reagisca con questo
Reattività degli alogenuri alchilici 1 3 Meccanismo della Reazione di Sostituzione Nucleofila 4 5 Meccanismo unimolecolare: sostituzione nucleofila unimolecolare (SN1) Un alogenuro che reagisca con questo
N H CH 3 H 3 C. Ammine. Struttura. Classificazione. Nomenclatura. Reattività
 Ammine Struttura lassificazione omenclatura Reattività 3 3 elle ammine gli orbitali dell azoto sono ibridati sp 3. 3 degli orbitali ibridi sono impegnati nella formazione di legami con o. Il quarto orbitale
Ammine Struttura lassificazione omenclatura Reattività 3 3 elle ammine gli orbitali dell azoto sono ibridati sp 3. 3 degli orbitali ibridi sono impegnati nella formazione di legami con o. Il quarto orbitale
Reazioni di eliminazione
 Reazioni di eliminazione Reazioni di eliminazione Gli alogenuri alchilici oltre ad essere buoni substrati per reazioni di sostituzione nucleofila alifatica sono anche buoni substrati per reazioni di eliminazione.
Reazioni di eliminazione Reazioni di eliminazione Gli alogenuri alchilici oltre ad essere buoni substrati per reazioni di sostituzione nucleofila alifatica sono anche buoni substrati per reazioni di eliminazione.
Figura. Alogenuri alchilici
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni Alogenuri alchilici: nomenclatura Alogenuri
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni Alogenuri alchilici: nomenclatura Alogenuri
Alogenuri alchilici. Alogenuri alchilici: funzioni. Varietà di funzione dei composti alogenati. Figura
 Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati 1 Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni 2 Alogenuri alchilici: nomenclatura Alogenuri
Figura Alogenuri alchilici Alogenuri alchilici: funzioni Varietà di funzione dei composti alogenati 1 Alogenuri alchilici: funzioni Alogenuri alchilici: funzioni 2 Alogenuri alchilici: nomenclatura Alogenuri
Reazioni degli Alogenuri Alchilici. Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici.
 Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
Stabilità. 1. più sostituito = più stabile. 2. trans più stabile del cis; E più stabile del Z. II. Relazione struttura-reattività R C R R R
 Alcheni 1 II. Relazione struttura-reattività 1. più sostituito = più stabile Stabilità R R R R R > > R R, R 2 2 > R 2 > R R 2 2 2. trans più stabile del cis; E più stabile del Z repulsione trans-2-butene
Alcheni 1 II. Relazione struttura-reattività 1. più sostituito = più stabile Stabilità R R R R R > > R R, R 2 2 > R 2 > R R 2 2 2. trans più stabile del cis; E più stabile del Z repulsione trans-2-butene
Esercitazione n Reazioni degli alcani
 Esercitazione n 10 - Reazioni degli alcani 1 assificare ciascuno degli idrogeni indicati come primario, secondario, terziario, allilico o benzilico: a) ( ) b) ( ) c) primario d) e) terziario secondario
Esercitazione n 10 - Reazioni degli alcani 1 assificare ciascuno degli idrogeni indicati come primario, secondario, terziario, allilico o benzilico: a) ( ) b) ( ) c) primario d) e) terziario secondario
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Esercitazione n Reazioni e meccanismi di aldeidi e chetoni.
 19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
ALCOLI, ETERI, TIOLI. Alcol: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcol: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Tiolo: molecola contenente un gruppo -SH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno
ALCOLI, ETERI, TIOLI Alcol: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Tiolo: molecola contenente un gruppo -SH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno
Esercitazione n Reazioni acido-base. 3. Nelle seguenti reazioni acido-base individuare l'acido e la base: H NH
 Esercitazione n 10 Reazioni acidobase Nelle seguenti reazioni acidobase individuare l'acido e la base: 1) N : 2 N 4 2 2) N 4 2 N ) 2 2 2 BASE 4) BASE AID AID AID BASE N N BASE AID 2 6) 5) 2 AID BASE N
Esercitazione n 10 Reazioni acidobase Nelle seguenti reazioni acidobase individuare l'acido e la base: 1) N : 2 N 4 2 2) N 4 2 N ) 2 2 2 BASE 4) BASE AID AID AID BASE N N BASE AID 2 6) 5) 2 AID BASE N
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Reazioni di Eliminazione: E1 e E2 Sintesi di alcheni (olefine) 1 E1 Eliminazione Unimolecolare Processo del tutto analogo alla S N 1 2 Reattività dei carbocationi 1. Sostituzione 2. Eliminazione 3. Addizione
Reazioni di Eliminazione: E1 e E2 Sintesi di alcheni (olefine) 1 E1 Eliminazione Unimolecolare Processo del tutto analogo alla S N 1 2 Reattività dei carbocationi 1. Sostituzione 2. Eliminazione 3. Addizione
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1
 REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
Unità didattica 8. Alcoli ed eteri sono gli analoghi organici dell acqua. Alcoli eteri epossidi e composti solforati
 Unità didattica 8 Alcoli eteri epossidi e composti solforati Alcoli ed eteri sono gli analoghi organici dell acqua Un alcol si definisce primario, secondario o terziario a seconda del tipo di carbonio
Unità didattica 8 Alcoli eteri epossidi e composti solforati Alcoli ed eteri sono gli analoghi organici dell acqua Un alcol si definisce primario, secondario o terziario a seconda del tipo di carbonio
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Ammine R N + H. ammina terziaria ammina secondaria ammina primaria sale di ammonio quaternario
 AMMINE Ammine Le ammine possono essere considerate dei derivati dell ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alchilici o arilici. Il simbolo generale per una ammina
AMMINE Ammine Le ammine possono essere considerate dei derivati dell ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alchilici o arilici. Il simbolo generale per una ammina
CHIMICA ORGANICA I. Corso di laurea in CHIMICA, CHIMICA APPLICATA, SCIENZA DEI MATERIALI
 CHIMICA RGANICA I Corso di laurea in CHIMICA, CHIMICA APPLICATA, SCIENZA DEI MATERIALI Esercitazione n. 11 - Reazioni degli alogenuri alchilici. TERMINI ED ARGMENTI PER L SVLGIMENT DEGLI ESERCIZI DI QUEST
CHIMICA RGANICA I Corso di laurea in CHIMICA, CHIMICA APPLICATA, SCIENZA DEI MATERIALI Esercitazione n. 11 - Reazioni degli alogenuri alchilici. TERMINI ED ARGMENTI PER L SVLGIMENT DEGLI ESERCIZI DI QUEST
Ammine. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Alogenuri. alchilici. arilici. vinilici. l atomo di alogeno è legato ad un carbonio sp 2. l atomo di alogeno è legato ad un carbonio sp 3
 Alogenuri alchilici l atomo di alogeno è legato ad un carbonio sp 3 Br 2-bromo-pentano vinilici l atomo di alogeno è legato ad un carbonio sp 2 Cl cloruro di vinile arilici l atomo di alogeno è legato
Alogenuri alchilici l atomo di alogeno è legato ad un carbonio sp 3 Br 2-bromo-pentano vinilici l atomo di alogeno è legato ad un carbonio sp 2 Cl cloruro di vinile arilici l atomo di alogeno è legato
ALCHENI: Reazioni del doppio legame
 ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
ALCHINI. legame π. Una frammentazione importante dà un valore m/z = 39, che corrisponde al carbocatione propargilico +. + R. +
 AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 9, che corrisponde al carbocatione propargilico.. 2 2 2 1-ottino 4-ottino
AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 9, che corrisponde al carbocatione propargilico.. 2 2 2 1-ottino 4-ottino
26. Scrivere per ciascuno dei seguenti nomi la formula (semicondensata e a linea di legame) corrispondente: Cl Cl (CH 3 CHCH 2 ) 2 CH CH.
 6. Scrivere per ciascuno dei seguenti nomi la formula (semicondensata e a linea di legame) corrispondente: cloruro di isobutile cloro metilpropano ( ) bromociclopentano, dibromocicloesano iodoeptano,,
6. Scrivere per ciascuno dei seguenti nomi la formula (semicondensata e a linea di legame) corrispondente: cloruro di isobutile cloro metilpropano ( ) bromociclopentano, dibromocicloesano iodoeptano,,
FENOLI: nomenclatura IUPAC
 FENOLI, AMMINE ed ENAMMINE FENOLI: nomenclatura IUPAC I fenoli sono composti la cui caratteristica strutturale è quella di possedere un gruppo idrossile ( OH) legato a un anello benzenico. Il sistema it
FENOLI, AMMINE ed ENAMMINE FENOLI: nomenclatura IUPAC I fenoli sono composti la cui caratteristica strutturale è quella di possedere un gruppo idrossile ( OH) legato a un anello benzenico. Il sistema it
ALCHINI. Spettrometria di massa C CH 2 R. + CARATTERISTICA FUNZIONALE: legame π. Caratteristiche Spettrali
 AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 39, che corrisponde al carbocatione propargilico 2 +. +. + + 2 2 2
AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 39, che corrisponde al carbocatione propargilico 2 +. +. + + 2 2 2
Reattività degli Alcheni. Addizione elettrofila
 Reattività degli Alcheni Addizione elettrofila Reattività degli alcheni Abbiamo visto che il gruppo funzionale che caratterizza un alchene è il doppio legame carbonio-carbonio. Tutti i composti che presentano
Reattività degli Alcheni Addizione elettrofila Reattività degli alcheni Abbiamo visto che il gruppo funzionale che caratterizza un alchene è il doppio legame carbonio-carbonio. Tutti i composti che presentano
1. Completare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: CH 3 O, H +
 Esercitazione n. 14 - Reazioni sulle reazioni di alcheni, alchini e dieni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) 2-butene b) 2-butene acqua,
Esercitazione n. 14 - Reazioni sulle reazioni di alcheni, alchini e dieni. 1. ompletare le seguenti reazioni, specificando i nomi dei composti organici che si ottengono: a) 2-butene b) 2-butene acqua,
Capitolo 7 Composti organici alogenati
 himica Organica Informazione Scientifica sul Farmaco apitolo 7 omposti organici alogenati Organic hemistry, 5 th Edition L. G. Wade, Jr. Introduzione I composti organici alogenati sono importanti per vari
himica Organica Informazione Scientifica sul Farmaco apitolo 7 omposti organici alogenati Organic hemistry, 5 th Edition L. G. Wade, Jr. Introduzione I composti organici alogenati sono importanti per vari
Composti Carbossilici. Reattività
 omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
Esercitazione n Reazioni e meccanismi di acidi carbossilici e derivati.
 Esercitazione n. 16 Reazioni e meccanismi di acidi carbossilici e derivati. 1. Scrivere i prodotti (specificandone il nome) che si ottengono quando l'acido butanoico viene fatto reagire con ciascuno dei
Esercitazione n. 16 Reazioni e meccanismi di acidi carbossilici e derivati. 1. Scrivere i prodotti (specificandone il nome) che si ottengono quando l'acido butanoico viene fatto reagire con ciascuno dei
Chimica organica: i derivati degli idrocarburi Capitolo C3
 himica organica: i derivati degli idrocarburi apitolo 3 VERIFIA LE TUE NSENZE 1 A 2 B 3 4 D 5 A 6 D 7 8 A 9 B 10 A 11 D 12 B 13 14 15 B 16 B 17 A 18 D 19 20 B 21 D 22 23 B 24 B 25 A 26 D 27 B 28 29 A 30
himica organica: i derivati degli idrocarburi apitolo 3 VERIFIA LE TUE NSENZE 1 A 2 B 3 4 D 5 A 6 D 7 8 A 9 B 10 A 11 D 12 B 13 14 15 B 16 B 17 A 18 D 19 20 B 21 D 22 23 B 24 B 25 A 26 D 27 B 28 29 A 30
REATTIVITÀ DI R-XR M + R
 ... X.. M. M. M. M. M 2e- trasferiti dalla superficie metallica in 1 o 2 stadi EATTIVITÀ DI -X... X. -.. Ṙ.. - M + M + δ- δ+ -M nucleofilo -X elettrofilo 1) EAZIONE DI WUTZ -X + - Na + - + Na + X - 2)
... X.. M. M. M. M. M 2e- trasferiti dalla superficie metallica in 1 o 2 stadi EATTIVITÀ DI -X... X. -.. Ṙ.. - M + M + δ- δ+ -M nucleofilo -X elettrofilo 1) EAZIONE DI WUTZ -X + - Na + - + Na + X - 2)
Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di:
 Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di: 1. riduzione del gruppo carbonilico (-1) 2. sostituzione elettrofila aromatica (-1) 3. eliminazione (-1) 4. addizione al
Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di: 1. riduzione del gruppo carbonilico (-1) 2. sostituzione elettrofila aromatica (-1) 3. eliminazione (-1) 4. addizione al
Verifiche dei Capitoli - Tomo C
 Soluzioni Verifiche dei Capitoli - Tomo C Per ogni Capitolo sono presentate le soluzioni delle Verifiche, delle Autoverifiche, delle Competenze e dei quesiti proposti nelle schede di Laboratorio. VERIFICHE
Soluzioni Verifiche dei Capitoli - Tomo C Per ogni Capitolo sono presentate le soluzioni delle Verifiche, delle Autoverifiche, delle Competenze e dei quesiti proposti nelle schede di Laboratorio. VERIFICHE
Alchini. Suffisso: -ino. d. H 3 CCH 2 CC CH
 Alchini Suffisso: -ino Indicare la posizione del triplo legame con il numero che lo contraddistingue nella catena. La numerazione comincia sempre dall estremità più prossima al triplo legame. 3 3 2 2 2
Alchini Suffisso: -ino Indicare la posizione del triplo legame con il numero che lo contraddistingue nella catena. La numerazione comincia sempre dall estremità più prossima al triplo legame. 3 3 2 2 2
TECNICHE DI PURIFICAZIONE dei solidi
 TEIE DI PUIFIAZIE dei solidi I solidi volatili si possono purificare per sublimazione, processo che comporta il passaggio dalla fase solida a quella vapore e la condensazione dalla fase vapore alla fase
TEIE DI PUIFIAZIE dei solidi I solidi volatili si possono purificare per sublimazione, processo che comporta il passaggio dalla fase solida a quella vapore e la condensazione dalla fase vapore alla fase
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
Capitolo 24 Dai gruppi funzionali ai polimeri
 Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Gli alcoli vengono classificati come primari, secondari e terziari in base alla natura del carbonio che lega il gruppo ossidrilico
 Gli alcoli vengono classificati come primari, secondari e terziari in base alla natura del carbonio che lega il gruppo ossidrilico Legami idrogeno. Il legame carbonio-ossigeno è un legame polare, con una
Gli alcoli vengono classificati come primari, secondari e terziari in base alla natura del carbonio che lega il gruppo ossidrilico Legami idrogeno. Il legame carbonio-ossigeno è un legame polare, con una
Gli alogenuri alchilici R-X X= Cl, Br, F, I. Alogeno alcani o alogenuri alchilici
 Gli alogenuri alchilici R-X X= Cl, Br, F, I Alogeno alcani o alogenuri alchilici 1 CH 3 CH 2 CH 2 Cl cloropropano /cloruro dipropile CH 3 CH 3 C Cl 2,2-dimetil-1-cloroetano / terbutilcloruro CH 3 Cl 1-clorocicloesano
Gli alogenuri alchilici R-X X= Cl, Br, F, I Alogeno alcani o alogenuri alchilici 1 CH 3 CH 2 CH 2 Cl cloropropano /cloruro dipropile CH 3 CH 3 C Cl 2,2-dimetil-1-cloroetano / terbutilcloruro CH 3 Cl 1-clorocicloesano
ESERCIZI SPETTROMETRIA DI MASSA
 ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 SSTITUZINI NUCLEFILE H H H H H + HBr + H H 2 H Br SUBSTRATI alogenuri, eteri, epossidi, esteri solfonici Possibili meccanismi S N 1, S N 2, S N 2, S n i 1 Generalità Gruppo uscente (LG) deve essere una
SSTITUZINI NUCLEFILE H H H H H + HBr + H H 2 H Br SUBSTRATI alogenuri, eteri, epossidi, esteri solfonici Possibili meccanismi S N 1, S N 2, S N 2, S n i 1 Generalità Gruppo uscente (LG) deve essere una
14/11/2018. Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile.
 Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
Capitolo 4 Reazioni degli alcheni
 himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
Reattività degli alogenuri alchilici
 Reattività degli alogenuri alchilici 1 Sono composti organici che contengono almeno un legame carbonio-alogeno (C X) X (F, Cl, Br, I) Il carbonio è sp3 Possono contenere più legami C X: composti polialogenati.
Reattività degli alogenuri alchilici 1 Sono composti organici che contengono almeno un legame carbonio-alogeno (C X) X (F, Cl, Br, I) Il carbonio è sp3 Possono contenere più legami C X: composti polialogenati.
Composti carbonilici
 Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
ALOGENURI ALCHILICI. H Br NH 2. H N Br CH 2. O Cl. CH CCl 2 CH. C Cl. CCl 3 DDT. porpora di Tiro. tirossina. Hanno molti impieghi:
 ALGENURI ALILII anno molti impieghi: l l l l 2 l solvente per lavaggio a secco insetticida l 3 DDT lacrimogeno Si trovano raramente in natura: I I N Br I I 2 tirossina N 2 2 Br N porpora di Tiro himica
ALGENURI ALILII anno molti impieghi: l l l l 2 l solvente per lavaggio a secco insetticida l 3 DDT lacrimogeno Si trovano raramente in natura: I I N Br I I 2 tirossina N 2 2 Br N porpora di Tiro himica
IDROCARBURI INSATURI: GLI ALCHENI HANNO ALMENO UN DOPPIO LEGAME NELLA STRUTTURA NOMENCLATURA: RADICE COME NEGLI IDROCARBURI, DESINENZA -ENE
 IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
Alcoli ed eteri Composti organici che contengono legami singoli C-O
 Alcoli ed eteri Composti organici che contengono legami singoli C-O Chimica Organica CH 3 CH 2 CH 3 CH 2 O CH 2 CH 3 Alcol etilico etanolo Etere etilico dietiletere Fenolo idrossibenzene Nomenclatura degli
Alcoli ed eteri Composti organici che contengono legami singoli C-O Chimica Organica CH 3 CH 2 CH 3 CH 2 O CH 2 CH 3 Alcol etilico etanolo Etere etilico dietiletere Fenolo idrossibenzene Nomenclatura degli
2) Scrivere il nome sistematico per i composti elencati di seguito:
 Chimica Organica Alcheni 1) Disegnare la struttura per le molecole elencate: a. 3,3- dimetilciclopentene c. etil vinil etere b. 6- bromo- 2,3- dimetil- 2- esene d. allil alcol 2) Scrivere il nome sistematico
Chimica Organica Alcheni 1) Disegnare la struttura per le molecole elencate: a. 3,3- dimetilciclopentene c. etil vinil etere b. 6- bromo- 2,3- dimetil- 2- esene d. allil alcol 2) Scrivere il nome sistematico
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio.
 La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
Reazioni degli alcani
 Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
Corso di Laurea Triennale in Biotecnologie, AA 2016/17, Esame di Chimica Organica, Nominativo.Matricola
 Corso di Laurea Triennale in Biotecnologie, AA 2016/17, Esame di Chimica Organica, 19-06-2017 Nominativo.Matricola Esercizio 1a. Il cis-2-pentene viene trattato con Br 2 in diclorometano. a) Descrivere
Corso di Laurea Triennale in Biotecnologie, AA 2016/17, Esame di Chimica Organica, 19-06-2017 Nominativo.Matricola Esercizio 1a. Il cis-2-pentene viene trattato con Br 2 in diclorometano. a) Descrivere
SOSTITUZIONI NUCLEOFILA SU CARBONI SATURI
 SOSTITUZIONI NUCLEOFILA SU CABONI SATUI Es di cleofili: H 2 O, OH, CO 2 H, e lo loro basi coniugate (OH -, O -, COO - ) H 2 S, SH e basi coniugate; NH 3, NH 2 -, le ammine e i loro derivati CN -, C i carbanioni,
SOSTITUZIONI NUCLEOFILA SU CABONI SATUI Es di cleofili: H 2 O, OH, CO 2 H, e lo loro basi coniugate (OH -, O -, COO - ) H 2 S, SH e basi coniugate; NH 3, NH 2 -, le ammine e i loro derivati CN -, C i carbanioni,
CICLOALCHENI. legame π C. Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico +. + R CH + CH 2 CH CH 2
 ALENI ILALENI ARATTERISTIA FUNZINALE: legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico. R. R 2 2 2
ALENI ILALENI ARATTERISTIA FUNZINALE: legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 41, che corrisponde al carbocatione allilico. R. R 2 2 2
R OH. alcol primario (1 ) alcol secondario (2 ) alcol terziario (3 )
 ALLI R Suffisso: -ol o olo R R R R R alcol primario (1 ) alcol secondario (2 ) alcol terziario (3 ) Si sceglie la catena carboniosa più lunga contenente anche l ossidrile e si deduce il nome dell alcano
ALLI R Suffisso: -ol o olo R R R R R alcol primario (1 ) alcol secondario (2 ) alcol terziario (3 ) Si sceglie la catena carboniosa più lunga contenente anche l ossidrile e si deduce il nome dell alcano
Una reazione chimica può avvenire in uno o più stadi; l insieme degli stadi costituisce il MECCANISMO DI REAZIONE.
 Una reazione chimica può avvenire in uno o più stadi; l insieme degli stadi costituisce il MECCANISMO DI REAZIONE. Ogni passaggio del meccanismo è costituito da reagenti e prodotti e deve essere bilanciato
Una reazione chimica può avvenire in uno o più stadi; l insieme degli stadi costituisce il MECCANISMO DI REAZIONE. Ogni passaggio del meccanismo è costituito da reagenti e prodotti e deve essere bilanciato
CHIMICA ORGANICA I con Elementi di Laboratorio Corso di Laurea in CHIMICA, Chimica Applicata, Scienza dei Materiali (L.T.)
 IMIA GANIA I con Elementi di Laboratorio orso di Laurea in IMIA, himica Applicata, Scienza dei Materiali (L.T.) Esercitazione n. 8 Aspetti generali di reazioni e meccanismi. TEMINI ED AGMENTI PE L SVLGIMENT
IMIA GANIA I con Elementi di Laboratorio orso di Laurea in IMIA, himica Applicata, Scienza dei Materiali (L.T.) Esercitazione n. 8 Aspetti generali di reazioni e meccanismi. TEMINI ED AGMENTI PE L SVLGIMENT
Esercitazione n. 8 - Aspetti generali di reazioni e meccanismi
 Esercitazione n. 8 Aspetti generali di reazioni e meccanismi 1. Dare una definizione dei seguenti termini: coordinata di reazione; stadio di una reazione; stato di transizione, reagente radicalico; scissione
Esercitazione n. 8 Aspetti generali di reazioni e meccanismi 1. Dare una definizione dei seguenti termini: coordinata di reazione; stadio di una reazione; stato di transizione, reagente radicalico; scissione
