M: M +. + e. La risoluzione di un buon spettrometro di massa è 1 amu (atomic mass number) su10 4 amu.
|
|
|
- Rosalia Mancini
- 5 anni fa
- Visualizzazioni
Transcript
1 PINIPI DELLA SPETTMETIA DI MASSA A differenza delle altre tecniche analitiche (I, UV-vis, NM) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni invece di molecole, è un metodo di analisi distruttivo. In uno spettrometro di massa usato per analisi organica, di solito abbiamo a che fare con l analisi di ioni positivi derivati da molecole. La ionizzazione semplice di una molecola si rappresenta con l equazione: M: M. e Lo ione M. si chiama ione molecolare. La massa (m) e la carica (z) dello ione vengono misurate dallo spettrometro di massa e quello che è importante è il loro rapporto. Spesso si formano ioni con una sola carica positiva è quindi il rapporto è uguale alla massa dello ione che, a sua volta, è legata alla massa della molecola (dato che l elettrone ha una massa piccolissima, 5.49 x 10-4 rispetto alla massa di un protone). La risoluzione di un buon spettrometro di massa è 1 amu (atomic mass number) su10 4 amu. Lo ione molecolare ha una configurazione elettronica con un numero dispari di elettroni. Frammentazione Se stiamo formando uno ione molecolare con una carica positiva, significa che dobbiamo raggiungere il potenziale di ionizzazione della molecola. Questo valore dipende dalla natura dell M, dato che è da questo orbitale molecolare che l elettrone sarà rimosso. I primi potenziali di ionizzazione della maggior parte delle molecole organiche cadono nell intervallo 8-15 ev Il processo di ionizzazione spesso usa energie molto maggiori di quella necessaria per la ionizzazione. Questo eccesso di energia può essere trasferito allo ione molecolare quando si forma, sotto forma di energia rotazionale, vibrazionale o elettronica. Le ultime due sono le più importanti per la spettrometria di massa, perché la frammentazione di questi stati eccitati produce un nuovo ione ed una particella neutra. 1
2 Lo ione molecolare può seguire due percorsi di frammentazione: M. A N. M. B. N Nel primo caso si ha la frammentazione a un catione con numero pari di elettroni ed una specie neutra con un elettrone dispari. Nel secondo caso si ha frammentazione a uno ione con numero dispari di elettroni ed una specie neutra con numero pari di elettroni. In questo caso la specie neutra può essere una molecola stabile Prendiamo una molecola semplice come 6 e consideriamo possibili percorsi di frammentazione dello ione molecolare che comportino solo scissione del legame -, ma con formazione di un atomo neutro, di un radicale neutro e di una molecola neutra..... La frammentazione non si ferma qui, perché gli ioni frammento possono a loro volta frammentarsi, subendo anch essi perdita di specie neutre con numero pari o dispari di elettroni. step Ia M. step Ib A N 1. B. N step IIa step IIb N 3 D N 4. Tutte queste frammentazioni formano un insieme di ioni che a loro volta danno luogo allo spettro di massa del composto in questione. La conoscenza dei percorsi tipici di frammentazione permette la ricostruzione di un andamento di frammentazione (fragmentation pattern) caratteristico.
3 Il cammino di frammentazione dipende da quattro fattori principali: - la forza dei legami che si devono rompere - la stabilità dei prodotti di frammentazione, sia ioni che specie neutre - le energie interne degli ioni che si frammentano - l intervallo di tempo tra la formazione degli ioni e la loro rivelazione. L SPETT DI MASSA SEMPLIE Analizziamo uno spettro di massa semplice. Un modo comune di mostrare uno spettro di massa è quello di una traccia che si può ottenere direttamente dal registratore della maggior parte degli spettrometri. onsideriamo il metanolo: 3, Peso Molecolare = 3 i si aspetta che il valore più grande m/z sia 3. Invece, osservando bene lo spettro, si osserva un segnale di intensità piccola (abbondanza relativa bassa), a M 1. isotopi Attorno ai picchi grandi ci possono essere picchi di abbondanza relativa bassa. Per esempio, una piccola parte di molecole di metanolo avrà 13 (1.08% di abbondanza naturale) invece di 1 e qualche atomo di idrogeno sarà (D) (0.015%) invece di 1. due tracce dello spettro di massa del metanolo, una registrata con una sensibilità dieci volte maggiore dell altra. Questo permette di vedere anche i picchi meno abbondanti. m/z attribuzione 3. 3 Lo ione con m/z 3 è lo ione molecolare: a parte un picolissimo picco a m/z 33, è lo ione di massa più elevata nello spettro Il picco più intenso viene chiamato picco base dello spettro. Ad esso si assegna l abbondanza relativa 100%: le abbondanze relative degli altri picchi si misurano rispetto a questo. 3
4 La frammentazione sarà tanto più facile quanto più stabile è il catione che si forma. Se sono possibili più frammentazioni che formano cationi di stabilità analoga, sarà preferita la frammentazione che dà il radicale più stabile. e e m/z = m/z = 57 m/z = e m/z = 57 e m/z = 43 3 m/z =
5 M -9 M -15 M M -9 M -15 M 5
6 ASPETTI PATII PE EFFETTUAE UNA EAZINE IMIA Per effettuare una reazione chimica correttamente, si deve eseguire un certo numero di operazioni: 1. Si purificano (se necessario) reagenti e solventi.. Si mescolano i reagenti nelle opportune condizioni di reazione. 3. Si segue l andamento della reazione. 4. Si lavora la reazione. 5. Si analizza il grezzo della reazione. 6. Si separano i prodotti. 7. Si controlla la purezza dei prodotti. 8. Si purificano (se necessario) i prodotti. 9. Tutti le operazioni vanno descritte SUBIT in un QUADEN DI LABATI, insieme alle eventuali osservazioni che si ritengano importanti, in caso di ripetizione della reazione (ad es., variazione di colore, formazione di precipitato, sviluppo di gas, ecc.) TENIE DI PUIFIAZINE I liquidi (sia reagenti che solventi) si purificano per DISTILLAZINE, un processo che porta il liquido in fase vapore vapore e poi condensa nuovamente il vapore a liquido Un liquido bolle quando la sua pressione di vapore è uguale alla pressione esterna (equazione di lausius-lapeyron) il liquido bolle 6
7 Pressione atmosferica normale omposti con calori di vaporizzazione più alti hanno pressioni di vapore più basse e quindi serve più energia per vaporizzarli (p.e. maggiore) I liquidi basso-bollenti (p.e. < 150 ) contenenti impurezze non volatili si possono purificare per distillazione semplice a pressione ambiente - Il liquido viene portato all ebollizione con un opportuna fonte di calore (EVITAE FIAMME LIBEE: i composti organici sono di solito infiammabili!!!) - il vapore viene fatto passare attraverso un tubo freddo (refrigerante), dove condensa e viene raccolto in un pallone. E importante asscurare una buona agitazione del liquido in ebollizione (ancoretta magnetica, oppure pietruzze da ebollizione) per evitare bumping, che può mandare nel pallone di raccolta del liquido non purificato. Apparecchiatura per la distillazione semplice a pressione atmosferica esce entra 7
8 8
9 tubo a cloruro di calcio (se bisogna evitare l umidità) I liquidi alto-bollenti (p.e. > 150 ) contenenti impurezze non volatili si possono purificare per distillazione semplice sotto vuoto, per evitare che il riscaldamento eccessivo provochi decomposizione termica Apparecchiatura per la distillazione semplice a pressione ridotta 9
10 Se non si conosce la pressione (e non si può misurare), si può ricavare con l aiuto del grafico: 30 torr onoscendo il p.e. a 760 torr, si collega il p.e. sperimentale (prima scala) con quello a pressione atmosferica (seconda scala) e si prolunga la retta fino a leggere la pressione (terza scala). Se il liquido ha un punto di ebollizione molto alto (anche a pressione ridotta) ed è immiscibile con l acqua, si può ricorrere alla DISTILLAZINE IN ENTE DI VAPE. Alla temperatura di ebollizione dell acqua, il vapore di questo liquido in equilibrio con esso contribuisce al raggiungimento della pressione esterna e viene trascinato via dall acqua che bolle. Al termine della distillazione, il liquido e l acqua formano due fasi separate. 10
11 ALLI aratteristica strutturale degli alcooli - legato a sp 3 aratteristiche Spettrali Spettrometria di massa Lo ione molecolare ha intensità piuttosto bassa per gli alcooli primari e secondari, è di solito assente negli spettri degli alcooli terziari La frammentazione più importante avviene tra il α all ed il β (carbocatione stabile) '' '.. '' ' '' ' Il gruppo alchilico più grande viene perso più facilmente (radicale più stabile). 11
12 1-esanolo, P.M M - 1-esanolo, P.M. 10 M M - M - 3 M metil--pentanolo P.M. 10 M
13 I UV-visibile stretching - Solo legami σ: le transizioni n σ* richiedono λ = nm (lontano UV): fuori dal comune intervallo picco stretto, cm -1 ( libero) picco largo, cm -1 ( in legame ) stretching cm -1 Negli spettri di film liquido si vede solo la banda dell impegnato in legame idrogeno; in soluzione si vedono entrambe. 3 (liquido puro) 3 (in l 4 ) 1-esanolo in l 4 1-esanolo film liquido 13
14 13 NM 1 NM L effetto -I dell diminuisce la densità elettronica attorno al nucleo del 13 : deschermato L effetto -I dell diminuisce la densità elettronica attorno al nucleo del 1 : deschermato a 3.5δ Il nucleo 1 dell può risuonare in un intervallo ampio di chemical shift, tra 0.5 e 5.0 δ; la posizione dipende da vari fattori (concentrazione, temperatura, solvente, legame idrogeno, ecc.) - L dell è sufficientemente acido ( mobile) per dare equilibrio acido-base veloce rispetto al tempo di risposta dell NM Questo significa che, di solito, l non si ferma sull abbastanza a lungo per influenzare il campo magnetico di un su un adiacente, né per esserne influenzato. l dell è un singoletto, un po allargato, a meno di rallentare lo scambio, per esempio abbassando la temperatura, eliminando le impurezze acide, usando soluzioni diluite. es.: metanolo
15 Se si vuole confermare che un segnale nello spettro 1 NM sia dovuto a, si aggiunge alla soluzione qualche goccia di D D D D D Il protone mobile scambia con D ed il segnale diminuisce o scompare del tutto esempio: 1-propanolo A B 3 B A A B BASE a - alcossido d c.... b a AID a,d ossidazione aldeidi e chetoni b b,c X alcheni 15
16 ottura del legame - SSTITUZINE NULEFILA 3 Br 3 Br 3 Br - ELIMINAZINE S 4 Δ - è un cattivo gruppo uscente: può essere trasformato in un buon gruppo uscente per protonazione reazioni in ambiente acido.... Nu: - buon gruppo uscente Nu Nu: - = I -, Br -, l -, F - esempi: 3 Br 3 Br ( 3 ) I ( 3 ) 3 l ( 3 ) -I ( 3 ) 3 -l A parità di alcool, la reattività dipende dalla forza dell'acido F l Br I pk a forza acida crescente reattività crescente verso gli alcooli A parità di acido, la reattività dipende dal tipo dell'alcool metile < primario < secondario < terziario reattività crescente degli alcooli con X Su questa diversa reattività si basa il saggio di riconoscimento degli alcooli (saggio di Lucas) 5 alcool terziario ( 3 ) 3 - l ( 3 ) 3 -l 16
17 alcool secondario ( 3 ) - l Znl ( 3 ) -l Znl alcool terziario 3 - l Δ 3 -l Il cloruro che si forma è immiscibile con la fase acquosa e si deposita sul fondo (ha densità maggiore dell'acqua). on S 4 stesso ordine di reattività S 4 3 terziario ( 3 ) S 4 secondario ( 3 ) terziario S on S 4 si riesce ad isolare il prodotto di sostituzione solo a temperatura molto bassa - - S S - 4, - nucleofilo debole S 4 S ottimo gruppo uscente Meccanismo: veloce lento 3 S veloce
18 rientamento: S prevalente 3 S 4 3 Saytzeff unico prodotto ome sempre, quando si formano carbocationi, c è possibilità di trasposizione 3 S Se con S 4 si trattano 1,-dioli: ,3-dimetil-,3-butandiolo (pinacolo) 3 3,3-dimetilbutanone (pinacolone) TASPSIZINE PINALIA :
19 Può migrare anche un : : Se i sostituenti del diolo sono diversi: viene protonato l' più basico migra il gruppo che lascia il carbocatione più stabile MEANISM della SSTITUZINE degli alcooli in ambiente acido Sostituzione di - S N 1 o S N? con metanolo ed alcooli primari S N 3 3 X - δ- X δ X- 3 3 stato di transizione con alcooli secondari e terziari S N X X 19
20 però.. La sostituzione dell' può avvenire anche in ambiente non acido Il gruppo - può essere sostituito SL DP TASFMAZINE IN UN BUN GUPP USENTE Gli alcooli si possono trasformare in alogenuri alchilici usando cloruri di P e S Pl 3 Pl 5 Sl tricloruro di fosforo pentacloruro di fosforo cloruro di tionile 3 - Pl 3 3 -l 3 P 3 - Pl 5 -l Pl 3 l - Sl -l S l Questi composti trasformano l in un buon gruppo uscente, che viene sostituito con un meccanismo S N (e quindi gli alcooli terziari non reagiscono) P e S hanno un buon gruppo uscente (l), che viene sostituito dall alcool ( nucleofilo) on Pl l Pl 4 l Pl 4 l - Pl 4 buon gruppo uscente buon gruppo uscente l Pl 4 Pl 3 l on Sl l S l l - S l buon gruppo uscente l S l buon gruppo uscente -l S l 0
21 on Pl 3 l Pl l l Pl Pl buon gruppo uscente l P l l P l l buon gruppo uscente P l l P l P l buon gruppo uscente P ANDAMENT STEEIMI 1. on Pl 3 3 l P l 3 l (S)--butanolo 3 P 3 l l - 3 l P l 3 clorofosfito di (S)--butile Nessuno dei legami del * è stato interessato dalla reazione. 3 l P l - l 3 S N 3 l 3 ()--clorobutano - Pl Inversione di configurazione analogamente con Pl 5 1
22 on Sl L andamento stereochimico dipende dalle condizioni di reazione 1. S l 3 3 l S l 3 3 (S)--butanolo - 3 S l l 3 clorosolfito di (S)--butile In presenza di base (ammina terziaria): 3 N: l 3 N l - Nu -. 3 S l - 3 l S N 3 l S l - 3 ()--clorobutano Inversione di configurazione In assenza di base, nel solvente poco polare (dietil etere) l è indissociato manca il nucleofilo forte gabbia del solvente. 3 S l S N i 3 l - S 3 l 3 3 coppia ionica 3 (S)--clorobutano S N i: il nucleofilo entra dalla stessa parte: ritenzione della configurazione
23 ALTE EAZINI DEGLI ALLI ALLI ME AIDI Per avere formazione completa di alcossido: 3 Na 3 - Na 1/ EAZINI N GLI AIDI Formazione di esteri a) Acidi carbossilici b) Acidi inorganici N N N N N N 3 3
24 Meccanismo: 1. formazione di N - (reazione acido-base) N N N N N ione NITNI (elettrofilo). reazione di N : 3 N 3.. N - 3 N nitrato di metile 3 S 3 S solfato acido di metile 3 S 3 3 S 3 solfato dimetilico 0 S S S 4 Δ alcheni c) Acidi solfonici S acido p-toluensolfonico S 3 3 p-toluensolfonato di (tosilato) Per avere completamente il solfonato, l alcool si fa reagire con il cloruro di p-metil benzensolfonile l S 3 S 3 S 3 l tosilato di Ts Formare il tosilato è un altro modo di trasformare l in un buon gruppo uscente l - 3 S N - Ts l 3 Ts.. 3 S N - 3 Ts 3 3 Ts 3-3 4
25 EAZINI DI SSIDAZINE ssidazione biologica dell'etanolo alcool deidrogenasi [] 3 - SoA 3 SoA acetilcoenzima A trigliceridi, ecc. ssidazione chimica alcool 1 o [- ] [] alcool o [- ] [] X alcool 3 o [- ] 3 X ossidanti tipici KMn 4, - r 4 N 3 conc. Na r 4 K r 7 ATTENZINE! 3 [] - Gli alcooli terziari non vengono ossidati; però alcuni ossidanti sono acidi e come tali possono reagire con gli alcooli terziari NESSUNA EAZINE alchene prodotti di ossidazione dell'alchene Meccanismo (semplificato) - r r(vi) r r r(iv) - ESEMPI KMn 4,, tampone basico 3 3 7% 5
26 N 3 Br ( ) 5 Br ( ) 5 75% Per ossidare gli alcooli primari ad aldeide è necessario usare reagenti speciali, particolarmente blandi (mild) in condizioni controllate. eattivo di Jones K r 7, S 4 diluito, ( 3 ) = eccesso di reattivo eattivo di ollins r 3. N 3 ( ) 5 3 ( ) 5 clorocromato di piridinio (P) N. r. 3 l -etil-1-esanolo -etilesanale 87% ssidazione dei DILI reagente caratteristico I 4 acido periodico scissione I 3 perché la reazione avvenga è necessario che i due - siano su adiacenti 6
27 La scissione del legame - avviene anche se sono adiacenti un - ed un = I 4 I 3 La scissione del legame - non avviene se sono adiacenti un - ed una funzione - I 4 nessuna reazione I 4 nessuna reazione 3 I 4 nessuna reazione Se ci sono più di due - su adiacenti, TUTTI i legami - si rompono I 4 3 Meccanismo:.... I I I 3 7
28 ETEI aratteristica strutturale degli eteri - - aratteristiche Spettrali Spettrometria di massa La frammentazione più importante avviene tra il α all ed il β (carbocatione stabile).. ' M diisopropil etere, P.M. 10 M UV-visibile Solo legami σ: le transizioni n σ* richiedono λ = nm (lontano UV): fuori dal comune intervallo I stretching cm
29 dipropil etere 13 NM 1 NM L effetto -I dell diminuisce la densità elettronica attorno al nucleo del 13 : deschermato L effetto -I dell diminuisce la densità elettronica attorno al nucleo del 1 : deschermato a 3.5δ A B B A A B 9
30 P EATTIVI USATI SPESS ME SLVENTI.. --'.. Fra gli eteri, quelli più usati come solvente, oltre al dietil etere, sono quelli ciclici ossaciclopentano (tetraidrofurano) 1,4-diossacicloesano (diossano) Danno reazione solo con I, a caldo.... ' I.. I - Δ 'I I ' ' reazione acido-base sostituzione nucleofila esempio: 3 I 3 Δ 3 I I 3 se c'è un eccesso di I e si lascia il tempo, anche gli alcooli reagiscono con I 3 3 I I 3 I = = 3 però 3 I Δ 3 I Viene attaccato da I - SL il sp ecc. legame (aromatico- più forte di (alifatico)- Gli eteri ciclici con anelli tesi sono più reattivi perché, con l'apertura dell'anello, hanno sollievo dalla tensione d'anello SSAILBUTANI reagiscono anche con Br, a caldo APETUA DELL'ANELL 30
31 Δ Br Br meccanismo: Br Br - SSAILPPANI MLT EATTIVI APETUA DELL'ANELL a) con NULEFILI FTI S N - Nu: - Nu Nu esempio: - - :S 3 S 3 S 3 Se l'ossaciclopropano è sostituito, la reazione ha un orientamento dovuto al meccanismo (S N ) EGISPEIFIITA' EGISELETTIVITA' Di due "regioni" del substrato possibili e simili una sola viene attaccata Di due "regioni" del substrato possibili e simili una viene attaccata di preferenza 3-3 S 3 3 S 3 eazione regiospecifica; reazione stereospecifica S N : più reattivo meno sostituito S N : attacco di Nu da parte opposta al gruppo uscente 31
32 b) in assenza di NULEFILI FTI Bisogna rendere -- un miglior gruppo uscente apertura dell'anello acido-catalizzata : Il processo è S N 1, ma non si forma un vero carbocatione, per l'interazione con il doppietto elettronico dell'ossigeno S 3 3 δ δ δ δ 3 3 parziale carbocatione primario parziale carbocatione secondario (se ne forma di più) δ δ δ δ S prodotto principale prodotto secondario eazione regioselettiva; reazione stereospecifica Si forma più (ma non solo) parziale carbocatione secondario PLIETEI ILII (ETEI NA) attacco di Nu da parte opposta al gruppo uscente 18-orona-6 18-rown-6 3
33 33 K 1-rown-4 15-rown-5 N N N N N N IPTAND catione n complesso IPTAT n N N N N
ALCOOLI R-O-H C H. ... a. alcossido H C O - BASE H C O H + H C X. alcheni. a,d. ossidazione. aldeidi e chetoni. b b,c
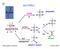 ALLI.. --.. BASE a - alcossido c d b.... a himica rganica e Laboratorio AID a,d ossidazione aldeidi e chetoni b b,c X alcheni ottura del legame SSTITUZINE NULEFILA Br Br 2 Br - 2 ELIMINAZINE 2 S 4 Δ 2
ALLI.. --.. BASE a - alcossido c d b.... a himica rganica e Laboratorio AID a,d ossidazione aldeidi e chetoni b b,c X alcheni ottura del legame SSTITUZINE NULEFILA Br Br 2 Br - 2 ELIMINAZINE 2 S 4 Δ 2
La risoluzione di un buon spettrometro di massa è 1 amu (atomic mass number) su10 4 amu.
 PRINIPI DELLA SPETTRMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
PRINIPI DELLA SPETTRMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
La risoluzione di un buon spettrometro di massa è 1 amu (atomic mass number) su10 4 amu.
 PRINCIPI DELLA SPETTROMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
PRINCIPI DELLA SPETTROMETRIA DI MASSA A differenza delle altre tecniche analitiche (IR, UV-vis, NMR) in cui il campione rimane intatto dopo l analisi, la spettrometria di massa, che forma ed utilizza ioni
Capitolo 8 Alcoli e Fenoli
 Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli e Tioli. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcoli e Tioli Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Alcoli e Tioli Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Gruppi funzionali. aldeidi
 Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Appunti di Chimica Organica Elementi per CdL Ostetricia CHIMICA ORGANICA. Appunti di Lezione. Elementi per il corso di Laurea In Ostetricia
 Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
ALCOLI, ETERI, TIOLI. Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
Reazioni degli Alogenuri Alchilici. Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici.
 Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
Reazioni degli Alogenuri Alchilici Reazioni di sostituzione nucleofila alifatica degli alogenuri alchilici. Un nucleofilo ( reagente amante del nucleo) è un qualsiasi reagente che dona una coppia non condivisa
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Reazioni degli alcoli
 Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
Addizioni nucleofile. Addizioni a C=O
 Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Unità didattica 8. Alcoli ed eteri sono gli analoghi organici dell acqua. Alcoli eteri epossidi e composti solforati
 Unità didattica 8 Alcoli eteri epossidi e composti solforati Alcoli ed eteri sono gli analoghi organici dell acqua Un alcol si definisce primario, secondario o terziario a seconda del tipo di carbonio
Unità didattica 8 Alcoli eteri epossidi e composti solforati Alcoli ed eteri sono gli analoghi organici dell acqua Un alcol si definisce primario, secondario o terziario a seconda del tipo di carbonio
AMMINE. con acidi RNH 2. con O come elettrofilo RNH 2 + H + + R NH 3 NESSUNA REAZIONE. atomo basico, atomo nucleofilo
 AMME : 2 1. come atomo basico o nucleofilo atomo basico, atomo nucleofilo cattivo gruppo uscente, anche in seguito a protonazione ESSUA EAZE con acidi 2 con come elettrofilo SL con ammine terziarie 2 2
AMME : 2 1. come atomo basico o nucleofilo atomo basico, atomo nucleofilo cattivo gruppo uscente, anche in seguito a protonazione ESSUA EAZE con acidi 2 con come elettrofilo SL con ammine terziarie 2 2
S N. Reazioni di Sostituzione Nucleofila. Nucleofilo: Nu: + C X C + Nu + X - Sostituzione Nucleofila:
 Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
Reazioni di Sostituzione Nucleofila S N Sostituzione Nucleofila: Reazione in cui un nucleofilo è sostituito da un altro Nucleofilo: Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 Reazioni di Eliminazione: E1 e E2 Sintesi di alcheni (olefine) 1 E1 Eliminazione Unimolecolare Processo del tutto analogo alla S N 1 2 Reattività dei carbocationi 1. Sostituzione 2. Eliminazione 3. Addizione
Reazioni di Eliminazione: E1 e E2 Sintesi di alcheni (olefine) 1 E1 Eliminazione Unimolecolare Processo del tutto analogo alla S N 1 2 Reattività dei carbocationi 1. Sostituzione 2. Eliminazione 3. Addizione
ALCOLI. Tabella dei valori di pka compresi tra 10 e estere acetacetico. pka CH HC. acetilene COOEt 24.0.
 ALLI Indice: intesi degli alcossidi 2 intesi di Williamson degli eteri 2 intesi degli alogenuri alchilici 3 intesi degli esteri 6 Disidratazione degli alcoli ad eteri 7 Disidratazione degli alcoli ad alcheni
ALLI Indice: intesi degli alcossidi 2 intesi di Williamson degli eteri 2 intesi degli alogenuri alchilici 3 intesi degli esteri 6 Disidratazione degli alcoli ad eteri 7 Disidratazione degli alcoli ad alcheni
ALCOLI E FENOLI ALCOL FENOLO. Scaricato da Sunhope.it
 Indice Alcoli e fenoli: gruppo funzionale Alcoli: nomenclatura e classificazione Fenoli: nomenclatura Alcoli: principali reazioni Fenoli Eteri Epossidi Tioli Tioeteri ALLI E FENLI Alcoli e fenoli sono
Indice Alcoli e fenoli: gruppo funzionale Alcoli: nomenclatura e classificazione Fenoli: nomenclatura Alcoli: principali reazioni Fenoli Eteri Epossidi Tioli Tioeteri ALLI E FENLI Alcoli e fenoli sono
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE
 SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
SOSTITUZIONE NUCLEOFILA BIMOLECOLARE Elettrofilo (atomo di C) Nucleofilo Alogenuri metilici, primari e molti secondari reagiscono con nucleofili attraverso un processo bimolecolare. 1 Processo a 10 e-,
ASPETTI PRATICI PER EFFETTUARE UNA REAZIONE CHIMICA
 ASPETTI PRATICI PER EFFETTUARE UNA REAZIONE CHIMICA Per effettuare una reazione chimica correttamente, si deve eseguire un certo numero di operazioni: 1. Si purificano (se necessario) reagenti e solventi.
ASPETTI PRATICI PER EFFETTUARE UNA REAZIONE CHIMICA Per effettuare una reazione chimica correttamente, si deve eseguire un certo numero di operazioni: 1. Si purificano (se necessario) reagenti e solventi.
Unità didattica 6. Cosa è una sostutizione? Reazioni di Sostituzione degli Alogenuri Alchilici
 Cosa è una sostutizione? Unità didattica 6 Reazioni di Sostituzione degli Alogenuri Alchilici Capitolo 7 e 8 di Brown e Poon L atomo o il gruppo che è sostituito o eliminato in queste reazioni è detto
Cosa è una sostutizione? Unità didattica 6 Reazioni di Sostituzione degli Alogenuri Alchilici Capitolo 7 e 8 di Brown e Poon L atomo o il gruppo che è sostituito o eliminato in queste reazioni è detto
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione
 Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione Queste reazioni hanno rilevanza prevalentemente per la sintesi organica Nucleofilo OH - Alogenuri
Reattività degli alogenuri alchilici: Reazioni di sostituzione nucleofila alifatica Reazioni di eliminazione Queste reazioni hanno rilevanza prevalentemente per la sintesi organica Nucleofilo OH - Alogenuri
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1
 REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni
ALCHINI. legame π. Una frammentazione importante dà un valore m/z = 39, che corrisponde al carbocatione propargilico +. + R. +
 AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 9, che corrisponde al carbocatione propargilico.. 2 2 2 1-ottino 4-ottino
AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 9, che corrisponde al carbocatione propargilico.. 2 2 2 1-ottino 4-ottino
ALCHINI. Spettrometria di massa C CH 2 R. + CARATTERISTICA FUNZIONALE: legame π. Caratteristiche Spettrali
 AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 39, che corrisponde al carbocatione propargilico 2 +. +. + + 2 2 2
AATTEISTIA FUNZINALE: ALINI legame π aratteristiche Spettrali Spettrometria di massa Una frammentazione importante dà un valore m/z = 39, che corrisponde al carbocatione propargilico 2 +. +. + + 2 2 2
Esercitazione n Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio.
 Esercitazione n. 1 - Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio. 1. Scrivere il prodotto, specificandone il nome, della reazione con P di: R- P R- P S N 2 a) 1-propanolo b) 2-propanolo
Esercitazione n. 1 - Reazioni di alcooli, dioli, eteri, ammine, sali di ammonio. 1. Scrivere il prodotto, specificandone il nome, della reazione con P di: R- P R- P S N 2 a) 1-propanolo b) 2-propanolo
REAZIONI DEGLI ALCHENI
 REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
ALOGENURI ALCHILICI. H Br NH 2. H N Br CH 2. O Cl. CH CCl 2 CH. C Cl. CCl 3 DDT. porpora di Tiro. tirossina. Hanno molti impieghi:
 ALGENURI ALILII anno molti impieghi: l l l l 2 l solvente per lavaggio a secco insetticida l 3 DDT lacrimogeno Si trovano raramente in natura: I I N Br I I 2 tirossina N 2 2 Br N porpora di Tiro himica
ALGENURI ALILII anno molti impieghi: l l l l 2 l solvente per lavaggio a secco insetticida l 3 DDT lacrimogeno Si trovano raramente in natura: I I N Br I I 2 tirossina N 2 2 Br N porpora di Tiro himica
ALCOLI, ETERI, TIOLI. Alcol: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcol: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Tiolo: molecola contenente un gruppo -SH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno
ALCOLI, ETERI, TIOLI Alcol: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Tiolo: molecola contenente un gruppo -SH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno
Le reazioni degli alogenuri alchilici: le sostituzioni nucleofile e le eliminazioni
 Le reazioni degli alogenuri alchilici: le sostituzioni nucleofile e le eliminazioni δ - X δ X = F, l, o I Dato il carattere elettrofilo del carbonio alogeno sostituito, buona parte della chimica degli
Le reazioni degli alogenuri alchilici: le sostituzioni nucleofile e le eliminazioni δ - X δ X = F, l, o I Dato il carattere elettrofilo del carbonio alogeno sostituito, buona parte della chimica degli
È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica
 aratteristica strutturale degli alogenuri ALOGENO È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica + - 2 2 Br elettronegativo, con parziale carica negativa questo NON
aratteristica strutturale degli alogenuri ALOGENO È la presenza dell alogeno che conferisce alla molecola la reattività caratteristica + - 2 2 Br elettronegativo, con parziale carica negativa questo NON
H H. R R δ+ R H. δ Cl
 Alogenuri alchilici: nomenclatura e reattività Nomenclatura: due possibilità a) Per gli alogenuri più semplici: residuo alchilico + nome dell alogeno (Es metilbromuro, etilbromuro). b) Per molecole più
Alogenuri alchilici: nomenclatura e reattività Nomenclatura: due possibilità a) Per gli alogenuri più semplici: residuo alchilico + nome dell alogeno (Es metilbromuro, etilbromuro). b) Per molecole più
ESERCIZI SPETTROMETRIA DI MASSA
 ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
ESERCIZI SPETTROMETRIA DI MASSA A SPUNTI DI RIFLESSIONE 1. In cosa differiscono le tecniche soft da quelle strong? 2. Con quali tecniche si hanno maggiori probabilità di ottenere ioni molecolari? 3. Per
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio.
 La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
La chimica organica si occupa dello studio della struttura, delle proprietà e delle reazioni dei composti del carbonio. Proteine, zuccheri, lipidi, DNA.. farmaci arta, fibre, plastica s2p2 Z=6 2p 1s 2
Stabilità. 1. più sostituito = più stabile. 2. trans più stabile del cis; E più stabile del Z. II. Relazione struttura-reattività R C R R R
 Alcheni 1 II. Relazione struttura-reattività 1. più sostituito = più stabile Stabilità R R R R R > > R R, R 2 2 > R 2 > R R 2 2 2. trans più stabile del cis; E più stabile del Z repulsione trans-2-butene
Alcheni 1 II. Relazione struttura-reattività 1. più sostituito = più stabile Stabilità R R R R R > > R R, R 2 2 > R 2 > R R 2 2 2. trans più stabile del cis; E più stabile del Z repulsione trans-2-butene
Reazioni Stereospecifiche e Stereoselettive
 Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Capitolo 4 Reazioni degli alcheni
 himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
himica Organica Informazione Scientifica sul Farmaco apitolo 4 Reazioni degli alcheni Organic hemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: richiami generali sulle reazioni chimice reattività
ione molecolare poco intenso ma visibile frammentazioni di tutti i legami C-C: serie di picchi separati di 14 u.m.a. (C n
 Alcani ione molecolare poco intenso ma visibile frammentazioni di tutti i legami C-C: serie di picchi separati di 14 u.m.a. (C n H 2n+1, m/z 43, 57, 71, 85, 99 ), con intensità massima per i cationi a
Alcani ione molecolare poco intenso ma visibile frammentazioni di tutti i legami C-C: serie di picchi separati di 14 u.m.a. (C n H 2n+1, m/z 43, 57, 71, 85, 99 ), con intensità massima per i cationi a
Reazioni degli alcani
 Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
Principali tipi di ioni
 Principali tipi di ioni Ione molecolare Ioni di frammentazione Ioni di riarrangiamento Ioni a carica multipla Ioni metastabili Ioni negativi Ioni di interazione ione-molecola 1 Lo ione molecolare Lo ione
Principali tipi di ioni Ione molecolare Ioni di frammentazione Ioni di riarrangiamento Ioni a carica multipla Ioni metastabili Ioni negativi Ioni di interazione ione-molecola 1 Lo ione molecolare Lo ione
14/11/2018. Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile.
 Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
Aldeidi e chetoni sono composti caratterizzati dalla presenza del gruppo funzionale carbonile. L atomo di carbonio ibridato sp 2 è legato a un atomo di ossigeno da un doppio legame. L ossigeno è più elettronegativo
IDROCARBURI INSATURI: GLI ALCHENI HANNO ALMENO UN DOPPIO LEGAME NELLA STRUTTURA NOMENCLATURA: RADICE COME NEGLI IDROCARBURI, DESINENZA -ENE
 IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
R-X ALOGENURI ALCHILICI. F Cl Br I. Nomenclatura. In genere si indicano con. + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo
 ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
ALOGENURI ALCHILICI In genere si indicano con Nomenclatura R-X + - Il legame C-X è polarizzato, ciò rende il carbonio elettrofilo X F Cl Br I 3-Bromo-2-metilpentano 4-Bromo-cicloesene trans-2-clorocicloesanolo
Reattività degli alogenuri alchilici
 Reattività degli alogenuri alchilici 1 3 Meccanismo della Reazione di Sostituzione Nucleofila 4 5 Meccanismo unimolecolare: sostituzione nucleofila unimolecolare (SN1) Un alogenuro che reagisca con questo
Reattività degli alogenuri alchilici 1 3 Meccanismo della Reazione di Sostituzione Nucleofila 4 5 Meccanismo unimolecolare: sostituzione nucleofila unimolecolare (SN1) Un alogenuro che reagisca con questo
Idrocarburi Saturi. Reazioni
 Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Composti Carbossilici. Reattività
 omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
Reazioni degli Alcani
 Reazioni degli Alcani Alogenazione: una reazione di sostituzione: un atomo di H viene sostituito da un atomo di Cl CH + 4 Cl 2 Cl + HCl La reazione di alogenazione degli alcani è una reazione che porta
Reazioni degli Alcani Alogenazione: una reazione di sostituzione: un atomo di H viene sostituito da un atomo di Cl CH + 4 Cl 2 Cl + HCl La reazione di alogenazione degli alcani è una reazione che porta
Eteri, Epossidi, Solfuri
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Eteri, Epossidi, Solfuri Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Eteri, Epossidi, Solfuri Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base
I composti organici. Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H)
 I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
Capitolo 7 Composti organici alogenati
 himica Organica Informazione Scientifica sul Farmaco apitolo 7 omposti organici alogenati Organic hemistry, 5 th Edition L. G. Wade, Jr. Introduzione I composti organici alogenati sono importanti per vari
himica Organica Informazione Scientifica sul Farmaco apitolo 7 omposti organici alogenati Organic hemistry, 5 th Edition L. G. Wade, Jr. Introduzione I composti organici alogenati sono importanti per vari
Esercitazione n Reazioni e meccanismi di aldeidi e chetoni.
 19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
19. a) Scrivere l'equazione chimica ed il meccanismo della reazione che avviene tra etanale e metanolo, in presenza di acidi. b) Spiegare come varia la reattività se con metanolo si fa reagire l'aldeide
combinazione di atomi tenuti insieme da forze più o meno un insieme caratteristico di proprietà
 IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
IL LEGAME CHIMICO La regola dell ottetto sebbene una semplificazione rende conto del perchè gli atomi reagiscono. In natura, solo i gas nobili sono presenti come specie monoatomiche. Anche le sostanze
Aldeidi e chetoni. 1) Rottura α 2) Rottura i. Più pronunciate nei chetoni. 3) Rottura β con trasposizione di H in γ (McLafferty)
 Aldeidi e chetoni Hanno potenziale di ionizzazione inferiore a quello degli alcooli dunque lo ione molecolare è più intenso e più facilmente osservabile anche in aldeidi e chetoni superiori. 1) Rottura
Aldeidi e chetoni Hanno potenziale di ionizzazione inferiore a quello degli alcooli dunque lo ione molecolare è più intenso e più facilmente osservabile anche in aldeidi e chetoni superiori. 1) Rottura
TECNICHE DI PURIFICAZIONE dei solidi
 TEIE DI PUIFIAZIE dei solidi I solidi volatili si possono purificare per sublimazione, processo che comporta il passaggio dalla fase solida a quella vapore e la condensazione dalla fase vapore alla fase
TEIE DI PUIFIAZIE dei solidi I solidi volatili si possono purificare per sublimazione, processo che comporta il passaggio dalla fase solida a quella vapore e la condensazione dalla fase vapore alla fase
R OH. alcol primario (1 ) alcol secondario (2 ) alcol terziario (3 )
 ALLI R Suffisso: -ol o olo R R R R R alcol primario (1 ) alcol secondario (2 ) alcol terziario (3 ) Si sceglie la catena carboniosa più lunga contenente anche l ossidrile e si deduce il nome dell alcano
ALLI R Suffisso: -ol o olo R R R R R alcol primario (1 ) alcol secondario (2 ) alcol terziario (3 ) Si sceglie la catena carboniosa più lunga contenente anche l ossidrile e si deduce il nome dell alcano
Ammine : caratteristiche strutturali
 Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Risonanza Magnetica Nucleare NMR
 Risonanza Magnetica Nucleare NMR Numeri quantici di spin di alcuni nuclei Gli isotopi più abbondanti di C e O non hanno spin Element 1 H 2 H 12 C 13 C 14 N 16 O 17 O 19 F N.ro quantico di Spin 1/2 1 0
Risonanza Magnetica Nucleare NMR Numeri quantici di spin di alcuni nuclei Gli isotopi più abbondanti di C e O non hanno spin Element 1 H 2 H 12 C 13 C 14 N 16 O 17 O 19 F N.ro quantico di Spin 1/2 1 0
Reazioni di eliminazione
 Reazioni di eliminazione Reazioni di eliminazione Gli alogenuri alchilici oltre ad essere buoni substrati per reazioni di sostituzione nucleofila alifatica sono anche buoni substrati per reazioni di eliminazione.
Reazioni di eliminazione Reazioni di eliminazione Gli alogenuri alchilici oltre ad essere buoni substrati per reazioni di sostituzione nucleofila alifatica sono anche buoni substrati per reazioni di eliminazione.
Gli Alogenuri Alchilici
 Gli Alogenuri Alchilici l l F Br F F l F F l l 1,2-Dicloroetano (solvente) Aloetano (anestetico) Freon 12 (fluido refrigerante) egole IUPA per la Nomenclatura degli Alogenuri Alchilici 1.Trovare e nominare
Gli Alogenuri Alchilici l l F Br F F l F F l l 1,2-Dicloroetano (solvente) Aloetano (anestetico) Freon 12 (fluido refrigerante) egole IUPA per la Nomenclatura degli Alogenuri Alchilici 1.Trovare e nominare
Prof.ssa Stacca Prof.ssa Stacca
 La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
Gli alcoli vengono classificati come primari, secondari e terziari in base alla natura del carbonio che lega il gruppo ossidrilico
 Gli alcoli vengono classificati come primari, secondari e terziari in base alla natura del carbonio che lega il gruppo ossidrilico Legami idrogeno. Il legame carbonio-ossigeno è un legame polare, con una
Gli alcoli vengono classificati come primari, secondari e terziari in base alla natura del carbonio che lega il gruppo ossidrilico Legami idrogeno. Il legame carbonio-ossigeno è un legame polare, con una
Composti carbonilici. Chimica Organica II
 Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Sostituzione nucleofila Addizione a gruppi carbonilici Addizione a doppi legami attivati
 himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
REATTIVITÀ DI R-XR M + R
 ... X.. M. M. M. M. M 2e- trasferiti dalla superficie metallica in 1 o 2 stadi EATTIVITÀ DI -X... X. -.. Ṙ.. - M + M + δ- δ+ -M nucleofilo -X elettrofilo 1) EAZIONE DI WUTZ -X + - Na + - + Na + X - 2)
... X.. M. M. M. M. M 2e- trasferiti dalla superficie metallica in 1 o 2 stadi EATTIVITÀ DI -X... X. -.. Ṙ.. - M + M + δ- δ+ -M nucleofilo -X elettrofilo 1) EAZIONE DI WUTZ -X + - Na + - + Na + X - 2)
Ammine. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Ammine R N + H. ammina terziaria ammina secondaria ammina primaria sale di ammonio quaternario
 AMMINE Ammine Le ammine possono essere considerate dei derivati dell ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alchilici o arilici. Il simbolo generale per una ammina
AMMINE Ammine Le ammine possono essere considerate dei derivati dell ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alchilici o arilici. Il simbolo generale per una ammina
Reazioni di decomposizione
 Reazioni di decomposizione Uno ione ad elett.. dispari Ione a elett.. pari + radicale Uno ione ad elett.. dispari Ione a elett.. dispari + molecola neutra Uno ione ad elett.. pari Ione a elett.. pari +
Reazioni di decomposizione Uno ione ad elett.. dispari Ione a elett.. pari + radicale Uno ione ad elett.. dispari Ione a elett.. dispari + molecola neutra Uno ione ad elett.. pari Ione a elett.. pari +
L effetto del sostituente (induttivo e coniugativo) modifica:
 L effetto del sostituente (induttivo e coniugativo) modifica: 1 la densità elettronica del centro di reazione influenza la REATTIVITA Se da un atomo di ad un altro cambia la distribuzione degli elettroni
L effetto del sostituente (induttivo e coniugativo) modifica: 1 la densità elettronica del centro di reazione influenza la REATTIVITA Se da un atomo di ad un altro cambia la distribuzione degli elettroni
Acidi carbossilici e derivati
 Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Una reazione chimica può avvenire in uno o più stadi; l insieme degli stadi costituisce il MECCANISMO DI REAZIONE.
 Una reazione chimica può avvenire in uno o più stadi; l insieme degli stadi costituisce il MECCANISMO DI REAZIONE. Ogni passaggio del meccanismo è costituito da reagenti e prodotti e deve essere bilanciato
Una reazione chimica può avvenire in uno o più stadi; l insieme degli stadi costituisce il MECCANISMO DI REAZIONE. Ogni passaggio del meccanismo è costituito da reagenti e prodotti e deve essere bilanciato
Alcoli ed eteri Composti organici che contengono legami singoli C-O
 Alcoli ed eteri Composti organici che contengono legami singoli C-O Chimica Organica CH 3 CH 2 CH 3 CH 2 O CH 2 CH 3 Alcol etilico etanolo Etere etilico dietiletere Fenolo idrossibenzene Nomenclatura degli
Alcoli ed eteri Composti organici che contengono legami singoli C-O Chimica Organica CH 3 CH 2 CH 3 CH 2 O CH 2 CH 3 Alcol etilico etanolo Etere etilico dietiletere Fenolo idrossibenzene Nomenclatura degli
Facoltà di Scienze M.F.N.
 Facoltà di Scienze M.F.N. Laboratorio di Chimica rganica II Anno Accademico. Relazione Gruppo: Modello Modello: a cura di V. Lucchini, M. Selva 1 Generale. + Tutti i composti impiegati nelle sintesi descritte
Facoltà di Scienze M.F.N. Laboratorio di Chimica rganica II Anno Accademico. Relazione Gruppo: Modello Modello: a cura di V. Lucchini, M. Selva 1 Generale. + Tutti i composti impiegati nelle sintesi descritte
Acidi carbossilici: nomenclatura. alcano -> acido alcanoico
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Alogenuri. alchilici. arilici. vinilici. l atomo di alogeno è legato ad un carbonio sp 2. l atomo di alogeno è legato ad un carbonio sp 3
 Alogenuri alchilici l atomo di alogeno è legato ad un carbonio sp 3 Br 2-bromo-pentano vinilici l atomo di alogeno è legato ad un carbonio sp 2 Cl cloruro di vinile arilici l atomo di alogeno è legato
Alogenuri alchilici l atomo di alogeno è legato ad un carbonio sp 3 Br 2-bromo-pentano vinilici l atomo di alogeno è legato ad un carbonio sp 2 Cl cloruro di vinile arilici l atomo di alogeno è legato
Si trovano generalmente come dimeri ciclici a causa dei legami a idrogeno
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di:
 Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di: 1. riduzione del gruppo carbonilico (-1) 2. sostituzione elettrofila aromatica (-1) 3. eliminazione (-1) 4. addizione al
Domanda 1 La reazione di formazione di emiacetali ed acetali è una reazione di: 1. riduzione del gruppo carbonilico (-1) 2. sostituzione elettrofila aromatica (-1) 3. eliminazione (-1) 4. addizione al
3 a esperienza di laboratorio : DISTILLAZIONE DEL CLORURO DI t-butile
 3 a esperienza di laboratorio : DISTILLAZIONE DEL CLORURO DI t-butile Anno accademico 2014/2015 DISTILLAZIONE La distillazione è una tecnica usata per separare e purificare i liquidi à tre punti chiave:
3 a esperienza di laboratorio : DISTILLAZIONE DEL CLORURO DI t-butile Anno accademico 2014/2015 DISTILLAZIONE La distillazione è una tecnica usata per separare e purificare i liquidi à tre punti chiave:
N H CH 3 H 3 C. Ammine. Struttura. Classificazione. Nomenclatura. Reattività
 Ammine Struttura lassificazione omenclatura Reattività 3 3 elle ammine gli orbitali dell azoto sono ibridati sp 3. 3 degli orbitali ibridi sono impegnati nella formazione di legami con o. Il quarto orbitale
Ammine Struttura lassificazione omenclatura Reattività 3 3 elle ammine gli orbitali dell azoto sono ibridati sp 3. 3 degli orbitali ibridi sono impegnati nella formazione di legami con o. Il quarto orbitale
Composti carbonilici
 Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
ALCHENI: Reazioni del doppio legame
 ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
ALCENI: REATTIVITÀ ALCENI: Reazioni del doppio legame Reazione di addizione Addizioni ioniche Addizioni con meccanismo concertato ADDIZIONI IONICE ADDIZIONE DI ACIDI ALOGENIDRICI ADDIZIONE DI ACQUA ROTTURA
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: H 2 O 2(aq) + MnO 4
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 2(aq) + Mn 4 -(aq) 2(g) + Mn 2(s) + - (aq) + 2 (l). Calcolare il volume di 2 (g), misurato a 1.0 atm e 25
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 2(aq) + Mn 4 -(aq) 2(g) + Mn 2(s) + - (aq) + 2 (l). Calcolare il volume di 2 (g), misurato a 1.0 atm e 25
Test di ingresso LM Scienze Chimiche A. A
 Università degli Studi di Cagliari Test di ingresso LM Scienze Chimiche A. A. 2009-2010 Test di ingresso alla LM in Scienze Chimiche A.A. 2009 2010 1 Chimica Analitica 1) Indicare, tra quelle riportate
Università degli Studi di Cagliari Test di ingresso LM Scienze Chimiche A. A. 2009-2010 Test di ingresso alla LM in Scienze Chimiche A.A. 2009 2010 1 Chimica Analitica 1) Indicare, tra quelle riportate
Identificazione degli alcoli
 Identificazione degli alcoli R-OH Stato fisico Gli alcoli sono sostanze neutre caratterizzate dalla presenza di un gruppo ossidrilico legato ad un atomo di carbonio alifatico. I primi termini degli alcoli
Identificazione degli alcoli R-OH Stato fisico Gli alcoli sono sostanze neutre caratterizzate dalla presenza di un gruppo ossidrilico legato ad un atomo di carbonio alifatico. I primi termini degli alcoli
Capitolo 24 Dai gruppi funzionali ai polimeri
 Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
PROGRAMMA EFFETTIVAMENTE SVOLTO DAL DOCENTE
 Ministero dell istruzione, dell università e della ricerca Istituto d Istruzione Superiore Severi-Correnti IIS Severi-Correnti 02-318112/1 via Alcuino 4-20149 Milano 02-33100578 codice fiscale 97504620150
Ministero dell istruzione, dell università e della ricerca Istituto d Istruzione Superiore Severi-Correnti IIS Severi-Correnti 02-318112/1 via Alcuino 4-20149 Milano 02-33100578 codice fiscale 97504620150
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 SSTITUZINI NUCLEFILE H H H H H + HBr + H H 2 H Br SUBSTRATI alogenuri, eteri, epossidi, esteri solfonici Possibili meccanismi S N 1, S N 2, S N 2, S n i 1 Generalità Gruppo uscente (LG) deve essere una
SSTITUZINI NUCLEFILE H H H H H + HBr + H H 2 H Br SUBSTRATI alogenuri, eteri, epossidi, esteri solfonici Possibili meccanismi S N 1, S N 2, S N 2, S n i 1 Generalità Gruppo uscente (LG) deve essere una
Composti carbonilici Acidi carbossilici
 Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Esercitazione n. 8 - Aspetti generali di reazioni e meccanismi
 Esercitazione n. 8 Aspetti generali di reazioni e meccanismi 1. Dare una definizione dei seguenti termini: coordinata di reazione; stadio di una reazione; stato di transizione, reagente radicalico; scissione
Esercitazione n. 8 Aspetti generali di reazioni e meccanismi 1. Dare una definizione dei seguenti termini: coordinata di reazione; stadio di una reazione; stato di transizione, reagente radicalico; scissione
Formule di risonanza. Chimica Organica II. Come individuarle: Come valutarne l importanza:
 Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Formule di risonanza Come individuarle: Le formule di risonanza devono rispettare le regole delle strutture di Lewis La posizione dei nuclei deve rimanere fissa (le formule di risonanza vengono scritte
Composti carbonilici. Componente principale dell aceto. Principio attivo di molti farmaci. Resina per abbigliamento
 Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
Composti carbonilici Composti carbonilici Acido acetico Si trovano nella maggior parte delle molecole biologiche, farmaceutiche e di sintesi Componente principale dell aceto Principio attivo di molti farmaci
PIANO DI STUDIO DELLA DISCIPLINA CHIMICA ORGANICA
 CHIMICA ORGANICA PIANO DELLE 5 CHIMICA, MATERIALI E BIOTECNOLOGIE SETTORE TECNOLOGICO Anno 2018/2019 DA n. 1 L'atomo e le teorie di legame Periodo: Settembre -Ottobre Rappresentare una specie chimica organica
CHIMICA ORGANICA PIANO DELLE 5 CHIMICA, MATERIALI E BIOTECNOLOGIE SETTORE TECNOLOGICO Anno 2018/2019 DA n. 1 L'atomo e le teorie di legame Periodo: Settembre -Ottobre Rappresentare una specie chimica organica
Aldeidi e Chetoni. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Aldeidi e Chetoni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Aldeidi e Chetoni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
