Acidi Carbossilici e Derivati
|
|
|
- Adelaide Piccinini
- 9 anni fa
- Visualizzazioni
Transcript
1 Acidi arbossilici e Derivati 1
2 Acidi arbossilici 2
3 IUPA: acido alcanoico Il carbonio carbossilico prende sempre il numero 1 Nomi comuni: Molti acidi alifatici hanno nomi storici. La posizione dei sostituenti è indicata con lettere greche. N. di Struttura comune: IUPA: Nomenclatura ε δ γ β α nome base nome comune 1 form- acido formico 2 3 acet- acido acetico propion- acido propionico butirr- acido butirrico valeri- acido valerico capro- acido caproico 3
4 Nomenclatura Esempi acido α-clorobutirrico 2 N l acido γ-amminobutirrico GABA acido γ-fenilvalerico Br acido δ-bromocaproico 4
5 Nomenclatura di acidi ciclici Alifatici: Acidi cicloalcancarbossilici. Aromatici: derivati dell acido benzoico acido cicloesancarbossilico acido benzoico acido o-idrossibenzoico acido salicilico 5
6 Acidi grassi saturi 12 acido laurico 14 acido miristico 16 acido palmitico 18 acido stearico 20 acido arachico 6
7 Acidi Grassi Insaturi 16 acido palmitoleico p.f. 0 º 18 acido oleico p.f. 13 º 18 acido linoleico p.f. 5 º 18 acido linolenico p.f. 11 º 20 acido arachidonico p.f. 49 º 7
8 Nomenclatura di Acidi Bicarbossilici IUPA: acido alcandioico omune: da ricordare N. di Struttura nome IUPA nome comune acido etandioico acido ossalico 2 acido propandioico acido malonico ( 2 ) 2 acido butandioico acido succinico ( 2 ) 3 acido pentandioico acido glutarico ( 2 ) 4 acido esandioico acido adipico ( 2 ) 5 acido eptandioico acido pimelico acido fumarico acido maleico acido ftalico acido isoftalico acido tereftalico 8
9 Gli acidi carbossilici hanno p.eb. e p.f. maggiori di molecole con lo stesso PM PM 58 peb 0 VDW Proprietà fisiche 3 2 PM 58 peb 48 VDW, DD PM 60 peb 97 VDW, DD, B forza intermolecolare crescente 3 PM 60 peb 118 VDW, DD, 2B Gli acidi carbossilici esistono in forma dimera: Solubilità 2 = 1 3 miscibili con acqua 4 10 via via meno solubili > 10 insolubili VDW = van der Waals; DD = dipolo-dipolo; B = legame idrogeno 9
10 Sintesi di acidi carbossilici 1. ssidazione di alcoli 1 con 2 r 4 o KMn 4 in 2 S ssidazione di aldeidi con r 3 o KMn 4 in 2 S 4 o Ag(I) ammoniacale Ag(N 3 ) 2 (eattivo di Tollens). 3. ssidazione di alchilbenzeni con KMn 4 /Na/ o r 3 2 S 4 / 2 /. 4. a) ssidazione di alcheni con KMn 4 in Na a caldo b) ssidazione di alcheni e alchini con arbonatazione di reattivi di Grignard. 6. Idrolisi di derivati degli acidi e nitrili. 7. ssidazione di metilchetoni (eazione aloformica). 10
11 Acidi carbossilici via ossidazione 1. Da alcoli primari 2. Da aldeidi 3. Da aromatici sostituiti 1. K 2 r 7 2 S 4, 2 entrambi i legami - sono sostituiti da legami - 2. KMn 4 o K 2 r o o KMn 4 i deve essere almeno 1 legame - 11
12 eazioni di rottura ossidativa 1. ottura di alcheni Potassio permanganato a caldo 2. ottura di Alchini Potassio permanganato a caldo zonolisi 1. = KMn 4 + ' 2. 1) 3 2) 2 + ' 1) 3 2)
13 arbonatazione di eattivi di Grignard δ Mg X δ + Et MgX 13
14 Idrolisi di derivati degli acidi e nitrili G G G 2 + G dove G = X,, N 2, N, N 2, N + o - 2 N 2 ( ) - vedi infra 14
15 Derivati degli acidi carbossilici 15
16 Derivati degli acidi carbossilici X ' acido alogenuro acido X = l, Br anidride estere N N ' N ' N " ammide 1 ammide 2 ammide 3 nitrile G strutturalmente diverso, chimicamente affine 16
17 Nomenclatura A. Alogenuri acidi l l etanoil cloruro (acetil cloruro) Br butanoil bromuro (butirril bromuro) cicloesancarbonil cloruro Br benzoil bromuro 17
18 Nomenclatura B. Anidridi + ' 800 ' + 2 = : anidride alcanoica : anidride alcanoica alcanoica anidride etanoica (anidride acetica) anidride metanoica propanoica (anidride formica propionica) 18
19 B. Anidridi cicliche Nomenclatura anidride butandioica (anidride succinica) anidride cis-butendioica (anidride maleica) anidride 4-cicloesene-1,2-dicarbossilica anidride 1,2-benzenedicarbossilica (anidride ftalica) 19
20 Nomenclatura. Esteri alchil alcanoato ottil etanoato (ottil acetato) arancia etil butanoato (etil butirrato) ananas 3-metilbutil etanoato (isopentil acetato, isoamil acetato) banana 3 metil 2-idrossibenzoato (metil salicilato) menta 20
21 . Esteri ciclici o lattoni Nomenclatura Dare il nome all acido carbossilico, tagliare il suffisso -ico, e aggiungere olattone. α β β-lattone 3-propionolattone β-propionolattone α β γ γ-lattone 4-butanolattone γ-butirolattone α β δ γ δ-lattone 5-pentanolattone δ-valerolattone butanolattone β-butirolattone 5-esanolattone δ-caprolattone 21
22 Esempi di composti con un gruppo lattonico Vitamina o acido ascorbico. È una vitamina idrosolubile sintetizzata dalle piante ma non dall uomo per cui è necessario assumerla con la dieta. Ginkgolide B è uno dei componenti attivi dell estratto del ginkgo biloba. 22
23 D. Ammidi IUPA: N-alchilalcanammide comune: acido ico + ammide Nomenclatura N 2 propanammide (propionammide) N 2 ciclopentancarbossammide N 3 N-metiletanammide (N-metilacetammide) N( 3 ) 2 N,N-dimetilmetanammide (N,N-dimetilformammide, DMF) NEt 2 3 N,N-dietil-m-metilbenzammide (N,N-dietil-m-toluammide, DEET) 23
24 D. Ammidi cicliche o lattami Dare il nome all acido carbossilico, tagliare il suffisso -ico, e aggiungere -olattame. α β N β-lattame β-propionolattame α Nomenclatura 2 1 α N β γ γ-lattame γ-butirolattame β 3 N 3 3-butanolattame β-butirolattame β α N β δ γ δ-lattame δ-pentanolattame 3 4 α 2 1 γ N 5 6 δ ε 6-esanolattame ε-caprolattame 24
25 Lattami penicilline penicillina G cefalosporine cefalexina 2 N S N N S N 3 N 3 2 efetamet 25
26 E. Nitrili Nomenclatura IUPA: alcanonitrile comune: nome dell acido ico + onitrile 3 N etanonitrile (acetonitrile) N 2-metilpropanonitrile (isobutirronitrile) N benzenecarbonitrile (benzonitrile) 26
27 rdine di precedenza dei GF > > > > ' X N 2 acido carbossilico anidride estere alcanoil alogenuro ammide > N nitrile > > > ' aldeide chetone alcool > N 2 ammina 27
28 eattività 28
29 Interconversione dei gruppi funzionali Idrolisi Formazione di alogenuri Formazione di esteri Formazione di ammidi Formazione di anidridi 2 l 2 Sl 2 (Pl 3 ) l 2 Na N 3 2 A N 3 N 3 N P N 2 N 3 ' 29
30 ommento 1. Tutti i derivati si idrolizzano ad acido. 2. Vi sono delle conversioni di sola andata. 3. I nitrili sono connessi al resto attraverso l ammide. 4. l e, che sono localizzati simmetricamente, svolgono il ruolo centrale nelle trasformazioni. 5. Le vie preferite per arrivare dall acido all estere o all ammide non sono quelle dirette, ma quelle che passano per il cloruro o l anidride perché non richiedono catalisi. 30
31 = G =.... δ+ G δ =.... acido basico elettrofilo eattività di acidi e derivati 1. Deprotonazione + N 3 - N Protonazione G + A G + A 3. Idrolisi + G Formazione di acil cloruri + Sl 2 l 5. Formazione di Esteri - Esterificazione G Formazione di ammidi - Ammonolisi =.. Nu G =.... S N acile Nu G Nu =.... N 2 = G + N 3 N 2 7. Formazione di anidridi l iduzione LiAl G o - 2 N 2 9. eazione con organometallici 3 G 1 MgX Disidratazione di ammidi N 2 + P 2 5 N 11. Trasposizione di ofmann di ammidi N Br 2 + Na N 2
32 Deprotonazione - Acidità L aspetto più importante è il legame polare, che viene rotto da una base. Gli acidi carbossilici sono donatori di protoni (acidi di Bronsted-Lowry): pk a 3 5, acidi deboli. :B B + stabilizzato per risonanza pk + a N 3 36 ~50 (ivedere gli effetti induttivi e di risonanza sulla acidità) 32
33 Effetti induttivi Acidità F 2 2 >l 2 2 >Br 2 2 > 3 2 pk a l 3 2 >l 2 2 >l 2 2 > 3 2 pk a l 2 > 2 > 2 l l pk a N 2 3 pk a
34 onversione a sali carbossilati 1. eazione con metalli attivi (Na, K) 2. eazione con basi forti 3. eazione con basi deboli 1. Na 0 Na + + ½ 2 2. Na Na Na 3 Na I sali sono cristallini, non-volatili, si decompongono per riscaldamento a
35 Basi per deprotonare gli acidi basicità crescente Base Na + 3 N 3 Na 2 3 Na + 3 Na + Na Na + acido coniugato pka N
36 Basicità Il gruppo carbossilico (e derivati) può essere protonato da acidi forti (-A) all ossigeno carbonilico (3 forme di risonanza). A + :A pka 5.2 L equilibrio è spostato a sinistra tranne nel caso dell 2 S 4 in cui la forma protonata è abbondante (50%). 36
37 Sostituzione Nucleofila Acile (addizione-eliminazione) 1. Aldeidi e chetoni che non hanno legato al carbonio carbonilico un gruppo uscente subiscono addizione nucleofila (v. capitolo aldeidi e chetoni). (') :Nu 2 Nu (') e + (') si addizionano Nu Nu intermedio tetraedrico 37
38 Sostituzione nucleofila acilica (addizione-eliminazione) 2. I derivati degli acidi, che hanno legato al carbonio carbonilico un gruppo uscente o un gruppo che può diventare buon LG, subiscono sostituzione nucleofila: G 1 stadio: addizione :Nu lento Nu G intermedio tetraedrico 2 stadio: eliminazione G Nu Nu sostituisce G Questa reazione è chiamata sostituzione nucleofila acilica. G = l,,,, N 2, N, N 2 Nel caso dei cloruri acidi e delle anidridi l e sono buoni LG e non vi è necessità di catalisi. 38
39 Sostituzione nucleofila acilica eattività osservata: l > > > N 2 > G + Nu - S.T.1 E a G Nu intermedio tetraedrico S.T.2 ammett: S.T.1 simile a I, intermedio ~ stessa Energia per tutti i G energia di partenza diversa Nu + G - l N 2 - S.T.1 39
40 Struttura e eattività G = l, cloruri acidi l l loro appartiene al 3 periodo: sovrapposizione scarsa stabilità G =, anidridi, esteri, acidi G = N, ammidi ' N ' '' N '' ' ' N meno elettronegativo di, porta meglio carica positiva G =, sali strutture di risonanza uguali 40
41 La reatività è legata alla struttura Stabilizzazione Velocità relative di idrolisi l molto piccola ' piccola 10 7 moderata 1.0 Più stabilizzato è il carbonile, meno reattivo è. N ' grande < 10-2 '' 41
42 S N acile con catalizzatore acido Nel caso degli acidi, esteri, ammidi, i rispettivi gruppi,, N 2 diventano buoni LG solo protonandosi, quindi è necessaria catalisi acida. :Nu lento Nu A + 2 Nu intermedio tetraedrico Nu Nu 42
43 Anche il 1 stadio può richiedere catalisi, quando il Nu è debole, come ad es. 2 nelle idrolisi: S N acile con catalizzatore acido estere prototropia: spostamento di un protone da un sito basico ad un altro all interno di una molecola + A : 2 lento Nu prototropia
44 Formazione di Acidi - Idrolisi Tutti i derivati degli acidi reagiscono con acqua a dare l acido carbossilico. 1. I cloruri e le anidridi reagiscono violentemente a t.a.: 3 l l Gli esteri devono avere un catalizzatore acido o basico: Le ammidi devono avere un catalizzatore acido o basico & riscaldamento: 3 N N I nitrili devono avere un catalizzatore acido o basico e riscaldamento progressivo: l 2 S 4 2 S 4 3 N N N
45 a. loruri acidi l b. Esteri (ambiente basico) 2 Meccanismo delle Idrolisi l l l - ' ' + ' irreversibile non buon LG, ma consente formazione legame = (179 Kcal/mole) = 18 +' 45
46 Saponificazione 2 3 Na triacilgliceroli o grassi glicerina 1 - Na Na Na + sapone gni triacilglicerolo è un triestere che contiene tre lunghe catene idrocarburiche da 12 a 20, che possono essere sature (acidi grassi saturi) o contenere doppi legami Z (acidi grassi insaturi). Nelle cellule, questa reazione è catalizzata da lipasi. 46
47 Meccanismo Idrolisi Acida degli Esteri c. Esteri (ambiente acido), reversibile ' + senza cat la reazione è lenta ' ' 2 2 intermedio tetraedrico protonato + ' intermedio tetraedrico ' ' 2 = 2 18 intermedio tetraedrico protonato 47
48 d. Nitrili & Ammidi (ambiente acido) N: + N 2 Meccanismo Idrolisi 2 =N 2 equilibrio ammido-immidol =N N 2 = N 2 = + N 2 = 2 N 2 N 2 N 3 e. Nitrili & Ammidi (ambiente basico) N: N 2 = =N N 2 2 = =N = + N 4 = = N 2 + N 3 = + N N 3
49 Formazione di acil alogenuri Si usano alogenuri di acidi inorganici Sl 2 (cloruro di tionile), Pl 3, Pl 5, PBr 3, PBr 5. + Sl 2 l + S 2 + l N Meccanismo per Sl 2 e Pl 3 : N l 1. = = l l S l + S 2 + l l = S l l S= l = l S= l 2. = l P l l l = Pl l l = + P()l 2 49
50 Formazione di esteri 1. Da acidi carbossilici con e catalisi di un acido minerale (Fischer) attraverso l uso di diazometano (esteri metilici) 2. Da cloruri acidi 3. Da anidridi acide 1. ' N N 2 50
51 Formazione di Esteri - Esterificazione a. Esterificazione di Fischer (dagli acidi e alcoli): reversibile ' ' ' ' 51
52 Formazione di Esteri - Esterificazione b. Da acil cloruri e anidridi (metodo di elezione) l + + l + + l = = l c. Da un estere per transesterificazione. = + = l l = = = = 52
53 Formazione di ammidi Ammonolisi 1. Diretta conversione di acidi ad ammidi (industriale) 2. Da cloruri acidi 3. Da anidridi 4. Da esteri N 3 +N 3 l N 2 N 2 ammide ' +"N 2 +" 2 N N" N" 2 ammide 2 ammide 3 Vista dalla parte delle ammine è un acilazione all azoto 53
54 Meccanismo di Ammonolisi N 3 N + 4 N 3 N 3 N 3 l ' - 2 N 2 l l N 3 N 2 l N 3 N 2 ' ' N 3 N 2 ' N N 2 N + 4 N 2
55 Formazione di immidi Le immidi sono ammidi doppie in cui un guppo amminico è legato a due gruppi acilici. La immide più comune è la succinimmide. N pka 8.5 Le immidi cicliche si preparano per riscaldamento del sale di diammonio dei diacidi. N N 4 + calore N 55
56 Formazione di Anidridi 1. Disidratazione di acidi (industriale) Dal cloruro dell acido e dal sale dell acido stesso o di un altro acido (anidridi miste) l + - Na + 56
57 Formazione di Anidridi icliche Si formano da acidi bicarbossilici per forte riscaldamento: acido succinico acido glutarico forte riscaldamento forte riscaldamento + 2 anidride succinica + 2 anidride glutarica 57
58 iduzione Gli acidi carbossilici sono difficili da ridurre: NaB 4 riduce solo aldeidi e chetoni 2 /cat riduce legami =, aldeidi e chetoni LiAl 4 riduce aldeidi e chetoni ed è il solo reagente sufficientemente forte per ridurre gli acidi carbossilici ad alcoli 1. NaB Pt 1) LA 2) 3 + B 2 6 diglima 58
59 iduzione 1. Anche gli esteri sono ridotti da LA ad alcoli primari 2. Le ammidi si riducono ad ammine. 3. I nitrili si riducono ad ammine. 1. LiAl N 1. LiAl N N 1. LiAl N 2 59
60 Meccanismo della iduzione 1. ' Al 3 Li + Li + intermedio tetraedrico ' Al 3 Al 2 Li + Li + + Al N Al 3 Li + 3. N: Al 3 Li + =N: 2 N Al 3 Al 3 Li + Al 3 Al 3 Li + N N : 2 Al 3 Al 3 Li + LiAl 3 + =N 2 N =N Al 3 2 N Al 3 Al Al N Al Li + 60
61 iduzione con DIBA 1. Acidi, esteri e nitrili vengono ridotti ad aldeidi usando 1 equivalente di idruro di isobutilalluminio a Se si usano 2 equivalenti si ottiene l alcool. ' esano, 70 Al[ 2 ( 3 ) 2 ] 2 Al [ 2 ( 3 ) 2 ] 2 ' + + Al() 3 + isobutano Al[ 2 ( 3 ) 2 ] 2 N: =N Al[ 2 ( 3 ) 2 ] 2 benzene,
62 Addizione dei reattivi di Grignard 1. Esteri danno alcoli 3 ( danno alcoli 2 ) 2. Nitrili danno chetoni. N 'MgX 1) 'MgBr 2) 3 + ' 3 + N - MgBr + N 3 + ' ' 62
63 Addizione degli organolitio e dialchilcuprati 1. Gli organolitio sono più forti dei reattivi di Grignard 2. on tutti i derivati si ottengono chetoni 3. eagiscono anche con gli anioni carbossilato: 'Li Li + Li + 'Li Li ' 4. I chetoni si possono preprare anche dagli alchilcuprati e i cloruri degli acidi l 1. 2 ' 2 u Li ' 63
64 Disidratazione di Ammidi primarie a Nitrili Un ammide primaria viene disidratata in un nitrile per azione di un agente che lega fortemente l acqua o la distrugge, 2 S 4, P 2 5, Pl 3, Sl 2. N =N P P N P P N + P P P P N + 4 P 2 7 idratata 64
65 Trasposizione di ofmann Un ammide primaria viene trasformata in un ammina primaria con 1 atomo di in meno. N 2 ammide 1 Br 2 Na N 2 ammina 1 N N== isocianato Br Br N= N N = acido carbammico N Br N Br migrazione di N = N
66 Acido arbonico e Derivati acido carbonico acido formico l acido cloroformico l l l alchil idrogenocarbonato dialchil idrogenocarbonato alchil cloroformiato fosgene N 2 N 2 2 N N 2 acido carbammico alchil carbammati o uretani urea 66
Acidi carbossilici e derivati
 Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Acidi carbossilici e derivati Acidi carbossilici Il gruppo funzionale di questa classe di sostanze è il carbossile: Il gruppo carbossilico è composto formalmente da un gruppo carbonilico legato ad un gruppo
Gli Acidi Carbossilici ed i loro Derivati
 Gli Acidi arbossilici ed i loro Derivati Acido carbossilico X Alogenuro acilico Anidride ' ' N 2 N Estere Ammide Nitrile Nomenclatura degli Acidi arbossilici 3 3 2 3 2 1 Acido propanoico 3 2 2 5 4 3 2
Gli Acidi arbossilici ed i loro Derivati Acido carbossilico X Alogenuro acilico Anidride ' ' N 2 N Estere Ammide Nitrile Nomenclatura degli Acidi arbossilici 3 3 2 3 2 1 Acido propanoico 3 2 2 5 4 3 2
Reattività degli acidi carbossilici e loro derivati. La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica
 Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Reattività degli acidi carbossilici e loro derivati La reazione caratteristica di questi composti è la Sostituzione Nucleofila Acilica δ - δ + Nu - Y Il carbonio carbonilico è elettrofilo, in grado di
Composti Carbossilici. Reattività
 omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
omposti arbossilici eattività omposti carbossilici N ' ' Ammide N' 2 Estere ' ' Anidride () 2 X Alogenuro acilico X I composti carbossilici hanno la caratteristica comune di possedere un gruppo carbonilico
Acidi Carbossilici CH 3. Caratterizzati dalla presenza di un gruppo carbossilico. Acido etanoico (Acido Acetico) Acido metanoico (Acido Formico)
 Acidi Carbossilici Caratterizzati dalla presenza di un gruppo carbossilico CH 3 H Acido etanoico (Acido Acetico) Acido metanoico (Acido Formico) Struttura del gruppo carbossilico δ- CH 3 δ+ Il legame è
Acidi Carbossilici Caratterizzati dalla presenza di un gruppo carbossilico CH 3 H Acido etanoico (Acido Acetico) Acido metanoico (Acido Formico) Struttura del gruppo carbossilico δ- CH 3 δ+ Il legame è
Acidi carbossilici e derivati Composti organici che contengono legami doppi C=O e legami singoli C-eteroatomo (oppure il gruppo CN)
 himica rganica Acidi carbossilici e derivati omposti organici che contengono legami doppi = e legami singoli -eteroatomo (oppure il gruppo N) H Acido carbossilico X Alogenuro acilico Anidride ' N Estere
himica rganica Acidi carbossilici e derivati omposti organici che contengono legami doppi = e legami singoli -eteroatomo (oppure il gruppo N) H Acido carbossilico X Alogenuro acilico Anidride ' N Estere
Composti Carbossilici. Acidi Carbossilici
 Composti Carbossilici Acidi Carbossilici ACIDI CARBSSILICI Gli acidi carbossilici sono caratterizzati dalla presenza del gruppo carbonilico legato ad un gruppo idrossilico R C Il gruppo carbossilico viene
Composti Carbossilici Acidi Carbossilici ACIDI CARBSSILICI Gli acidi carbossilici sono caratterizzati dalla presenza del gruppo carbonilico legato ad un gruppo idrossilico R C Il gruppo carbossilico viene
I composti acilici sono tutti quei composti che contengono il gruppo:
 omposti acilici I composti acilici sono tutti quei composti che contengono il gruppo: X in cui, contrariamente a quello che si ha nei composti carbonilici, X è un atomo o gruppo più elettronegativo di.
omposti acilici I composti acilici sono tutti quei composti che contengono il gruppo: X in cui, contrariamente a quello che si ha nei composti carbonilici, X è un atomo o gruppo più elettronegativo di.
Addizioni nucleofile. Addizioni a C=O
 Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Addizioni nucleofile Addizioni a C= Substrato Un composto che possiede un atomo di carbonio elettron-deficiente legato con un legame π (che si possa rompere facilmente) ad un atomo più elettronegativo
Capitolo 8 Acidi Carbossilici e Derivati
 Chimica rganica Scienze della Terra, dell Ambiente e del Territorio Capitolo 8 Acidi Carbossilici e Derivati rganic Chemistry, 5 th Edition L. G. Wade, Jr. Prentice Hall rganic Chemistry, 3 rd Edition
Chimica rganica Scienze della Terra, dell Ambiente e del Territorio Capitolo 8 Acidi Carbossilici e Derivati rganic Chemistry, 5 th Edition L. G. Wade, Jr. Prentice Hall rganic Chemistry, 3 rd Edition
Capitolo 13 Acidi Carbossilici e Derivati
 himica rganica Informazione Scientifica sul Farmaco apitolo 13 Acidi arbossilici e Derivati rganic hemistry, 5 th Edition L. G. Wade, Jr. Prentice Hall rganic hemistry, 3 rd Edition Paula Y. Bruice, Prentice
himica rganica Informazione Scientifica sul Farmaco apitolo 13 Acidi arbossilici e Derivati rganic hemistry, 5 th Edition L. G. Wade, Jr. Prentice Hall rganic hemistry, 3 rd Edition Paula Y. Bruice, Prentice
Composti carbonilici Acidi carbossilici
 Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Composti carbonilici Acidi carbossilici Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli
Composti carbonilici. Chimica Organica II
 Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
Composti carbonilici Il gruppo carbonilico è formato da un carbonio legato tramite un doppio legame ad un ossigeno. Probabilmente è il gruppo funzionale più importante. Le proprietà del gruppo carbonilico
ACIDI CARBOSSILICI. ac. formico ac. acetico ac. benzoico
 ACIDI CARBOSSILICI ac. formico ac. acetico ac. benzoico Nomenclatura Nomenclatura acido malonico Acidi bicarbossilici a catena alifatica Proprietà fisiche I primi termini della serie sono liquidi incolori
ACIDI CARBOSSILICI ac. formico ac. acetico ac. benzoico Nomenclatura Nomenclatura acido malonico Acidi bicarbossilici a catena alifatica Proprietà fisiche I primi termini della serie sono liquidi incolori
Acidi carbossilici: nomenclatura. alcano -> acido alcanoico
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Si trovano generalmente come dimeri ciclici a causa dei legami a idrogeno
 Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici: nomenclatura alcano -> acido alcanoico Acidi carbossilici: proprietà Il gruppo carbossilico ha caratteristiche comuni ai chetoni (C=O) e agli alcoli (OH) Si trovano generalmente come
Acidi carbossilici. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Acidi carbossilici Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Acidi carbossilici Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Sostituzione nucleofila Addizione a gruppi carbonilici Addizione a doppi legami attivati
 himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
himica rganica II Sintesi di legami - Nella costruzione di molecole organiche complesse, gli stadi critici sono spesso quelli che comportano la formazione di legami carboni- carbonio. I legami - possono
Esteri degli acidi carbossilici
 Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
Esteri degli acidi carbossilici Sono sostanze neutre facilmente idrolizzabili in ambiente acido e basico. Stato fisico Il punto di fusione degli esteri è inferiore a quello degli acidi aventi uguale P.M.
Composti Carbossilici. Derivati Carbossilici
 omposti arbossilici Derivati arbossilici Derivati degli Acidi I derivati degli acidi carbossilici hanno attaccato al gruppo carbonilico anziché l'idrossile (-) altri gruppi elettron attrattori come: -N
omposti arbossilici Derivati arbossilici Derivati degli Acidi I derivati degli acidi carbossilici hanno attaccato al gruppo carbonilico anziché l'idrossile (-) altri gruppi elettron attrattori come: -N
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI
 REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
Acido maleico anidride maleica acido ftalico andidride ftalica
 Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
Le anidridi si ottengono per disidratazione da due molecole di acido (la reazione è particolarmente facile per ottenere anidridi cicliche) Acido maleico anidride maleica acido ftalico andidride ftalica
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI
 REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
REAZIONI DI ADDIZIONE-ELIMINAZIONE DI ALDEIDI E CHETONI L azoto nucleofilo dell ammina attacca il carbonio elettrofilo del chetone Come potremmo rendere questa reazione più facile? Emiamminale La velocità
Reazioni degli alcoli
 Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
Reazioni degli alcoli Indice: 1) Sintesi degli alcossidi. 2 2) Sintesi di Williamson degli eteri. 2 ) Trasformazione degli alcoli in alogenuri alchilici 4) Sintesi degli esteri. 6 5) Trasformazione degli
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1
 CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
CHIMICA DEGLI IONI ENOLATO ED ENOLI LEZIONE 1 ACIDITÀ Ragionare sulla base coniugata: quanto più la base coniugata è stabilizzata (è debole) tanto più l'acido sarà forte. ASPETTI CHE DETERMINANO LA STABILITA
Composti Carbonilici
 omposti arbonilici 1 Introduzione Due grandi classi di composti contengono il gruppo carbonilico: 1. omposti che hanno solo atomi di carbonio e di idrogeno legati al carbonile: aldeidi e chetoni. aldeidi
omposti arbonilici 1 Introduzione Due grandi classi di composti contengono il gruppo carbonilico: 1. omposti che hanno solo atomi di carbonio e di idrogeno legati al carbonile: aldeidi e chetoni. aldeidi
Chimica organica Chimica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi: H, O, N, P,
 himica organica himica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi:,, N, P, S, alogeni. Le molecole organiche presentano particolari raggruppamenti
himica organica himica dei composti del carbonio. Nelle molecole organiche oltre al carbonio sono presenti pochi altri elementi:,, N, P, S, alogeni. Le molecole organiche presentano particolari raggruppamenti
Acido citrico. Nome IUPAC: Acido 3-carbossi-3-idrossi-1,5-pentandioico
 Acidi carbossilici Dove si trovano? 2 Acido citrico L'acido citrico è uno degli acidi più diffusi negli organismi vegetali ed è un prodotto metabolico di tutti quelli aerobici. Il succo di limone ne contiene
Acidi carbossilici Dove si trovano? 2 Acido citrico L'acido citrico è uno degli acidi più diffusi negli organismi vegetali ed è un prodotto metabolico di tutti quelli aerobici. Il succo di limone ne contiene
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Gruppi funzionali. aldeidi
 Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
Gruppi funzionali alcoli aldeidi chetoni Acidi carbossilici ' eteri ' esteri fenoli In grassetto il gruppo funzionale che definisce il carattere del composto 1 2 Gruppi funzionali: arrangiamento di pochi
IDENTIFICAZIONE DEGLI ACIDI CARBOSSILICI
 IDENTIFICAZIONE DEGLI ACIDI CARBOSSILICI Acidi carbossilici Stato fisico alifatici il primo termine degli ac. carbossilici alifatici è l'acido formico, che avendo un p.e. di 100,5 C, è liquido a temperatura
IDENTIFICAZIONE DEGLI ACIDI CARBOSSILICI Acidi carbossilici Stato fisico alifatici il primo termine degli ac. carbossilici alifatici è l'acido formico, che avendo un p.e. di 100,5 C, è liquido a temperatura
REGISTRO DELLE LEZIONI 2005/2006. Tipologia. Addì Tipologia. Addì Tipologia
 Presentazione del corso, libri di testo esami e propedeuticità La struttura elettronica dell'atomo, gli orbitali, tipi di legami, regola dell'ottetto Ibridizzazione strutture di Lewis, carica formale,
Presentazione del corso, libri di testo esami e propedeuticità La struttura elettronica dell'atomo, gli orbitali, tipi di legami, regola dell'ottetto Ibridizzazione strutture di Lewis, carica formale,
Aldeidi e chetoni. 1) Rottura α 2) Rottura i. Più pronunciate nei chetoni. 3) Rottura β con trasposizione di H in γ (McLafferty)
 Aldeidi e chetoni Hanno potenziale di ionizzazione inferiore a quello degli alcooli dunque lo ione molecolare è più intenso e più facilmente osservabile anche in aldeidi e chetoni superiori. 1) Rottura
Aldeidi e chetoni Hanno potenziale di ionizzazione inferiore a quello degli alcooli dunque lo ione molecolare è più intenso e più facilmente osservabile anche in aldeidi e chetoni superiori. 1) Rottura
Aldeidi e chetoni. Struttura e proprietà Nomenclatura e nomi comuni Fonti Reazioni Principali aldeidi e chetoni
 Aldeidi e chetoni Struttura e proprietà Nomenclatura e nomi comuni Fonti Reazioni Principali aldeidi e chetoni Aldeidi e chetoni Aldeidi e chetoni Aldeidi e chetoni Il legame = è costituito da un legame
Aldeidi e chetoni Struttura e proprietà Nomenclatura e nomi comuni Fonti Reazioni Principali aldeidi e chetoni Aldeidi e chetoni Aldeidi e chetoni Aldeidi e chetoni Il legame = è costituito da un legame
23 Le diverse classi di composti organici
 23 Le diverse classi di composti organici 23.1 I gruppi funzionali I gruppi funzionali sono atomi o gruppi di atomi che determinano le proprietà dei composti organici a cui sono legati, facendo assumere
23 Le diverse classi di composti organici 23.1 I gruppi funzionali I gruppi funzionali sono atomi o gruppi di atomi che determinano le proprietà dei composti organici a cui sono legati, facendo assumere
Capitolo 24 Dai gruppi funzionali ai polimeri
 Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Reazioni degli epossidi
 12-04-2016 Reazioni degli epossidi Apertura dell anello acido-catalizzata, esempi Struttura intermedio: 3 forme limiti di risonanza H H a a O O b b H O CH 3 CH 3 CH 3 H H H H Struttura ibrido intermedio
12-04-2016 Reazioni degli epossidi Apertura dell anello acido-catalizzata, esempi Struttura intermedio: 3 forme limiti di risonanza H H a a O O b b H O CH 3 CH 3 CH 3 H H H H Struttura ibrido intermedio
Gli alcoli vengono classificati come primari, secondari e terziari in base alla natura del carbonio che lega il gruppo ossidrilico
 Gli alcoli vengono classificati come primari, secondari e terziari in base alla natura del carbonio che lega il gruppo ossidrilico Legami idrogeno. Il legame carbonio-ossigeno è un legame polare, con una
Gli alcoli vengono classificati come primari, secondari e terziari in base alla natura del carbonio che lega il gruppo ossidrilico Legami idrogeno. Il legame carbonio-ossigeno è un legame polare, con una
Ammine : caratteristiche strutturali
 Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Esercitazione n Reazioni e meccanismi di acidi carbossilici e derivati.
 Esercitazione n. 16 Reazioni e meccanismi di acidi carbossilici e derivati. 1. Scrivere i prodotti (specificandone il nome) che si ottengono quando l'acido butanoico viene fatto reagire con ciascuno dei
Esercitazione n. 16 Reazioni e meccanismi di acidi carbossilici e derivati. 1. Scrivere i prodotti (specificandone il nome) che si ottengono quando l'acido butanoico viene fatto reagire con ciascuno dei
Capitolo 8 Alcoli e Fenoli
 Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
Introduzione alla biochimica AO 11/14
 Introduzione alla biochimica AO 11/14 Il Gruppo Carbonilico 1. E uno dei gruppi funzionali più importanti 2. Sp2, legame polarizzato 1. Ossigeno elettronegativo: effetto induttivo 2. Effetto di risonanza
Introduzione alla biochimica AO 11/14 Il Gruppo Carbonilico 1. E uno dei gruppi funzionali più importanti 2. Sp2, legame polarizzato 1. Ossigeno elettronegativo: effetto induttivo 2. Effetto di risonanza
Aldeidi e Chetoni. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Aldeidi e Chetoni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Aldeidi e Chetoni Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate
Unità Didattica 10. I composti carbonilici. Struttura, nomenclatura e reattività
 I composti caratterizzati dal gruppo carbonilico sono le aldeidi ed i chetoni Il gruppo funzionale è il doppio legame C=O Il carbonile ha geometria planare (il carbonio è sp 2 ) Unità Didattica 10 I composti
I composti caratterizzati dal gruppo carbonilico sono le aldeidi ed i chetoni Il gruppo funzionale è il doppio legame C=O Il carbonile ha geometria planare (il carbonio è sp 2 ) Unità Didattica 10 I composti
Mg-C. Δel = 1.3 C.I. = 34%
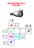 Mg-C Δel = 1.3 C.I. = 34% COMPOSTI ORGANOMETALLICI Sono composti che contengono un legame C-Metallo (R-M) dove R è un residuo organico e M un metallo monovalente (Na, Li) o bivalente (Mg). In genere il
Mg-C Δel = 1.3 C.I. = 34% COMPOSTI ORGANOMETALLICI Sono composti che contengono un legame C-Metallo (R-M) dove R è un residuo organico e M un metallo monovalente (Na, Li) o bivalente (Mg). In genere il
CHIMICA ORGANICA. Gli esteri
 1 E8-ESTERI CHIMICA RGANICA ESTERI Formula generale R C R' Desinenza -ato Gli esteri I composti organici di questa classe presentano una struttura che deriva da quella degli acidi carbossilici in cui,
1 E8-ESTERI CHIMICA RGANICA ESTERI Formula generale R C R' Desinenza -ato Gli esteri I composti organici di questa classe presentano una struttura che deriva da quella degli acidi carbossilici in cui,
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
Composti carbonilici: reazioni al carbonio in posizione a
 Composti carbonilici: reazioni al carbonio in posizione a Addizione nucleofila a composti carbonilici a,b-insaturi Nelle molecole contenenti carbonili coniugati con doppi legami sono presenti due siti
Composti carbonilici: reazioni al carbonio in posizione a Addizione nucleofila a composti carbonilici a,b-insaturi Nelle molecole contenenti carbonili coniugati con doppi legami sono presenti due siti
Alcoli, eteri, tioli, solfuri
 Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Alcoli, eteri, tioli, solfuri Alcoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Metanolo Sintesi industriale Tossico per l uomo (
Nomenclatura e nomi comuni Struttura e proprietà Fonti Reazioni Derivati degli acidi carbossilici
 Nomenclatura e nomi comuni Struttura e proprietà Fonti Reazioni Derivati degli acidi carbossilici Sono dei composti che hanno come gruppo funzionale il carbossile costituito da un carbonile e un gruppo
Nomenclatura e nomi comuni Struttura e proprietà Fonti Reazioni Derivati degli acidi carbossilici Sono dei composti che hanno come gruppo funzionale il carbossile costituito da un carbonile e un gruppo
La condensazione di Claisen
 La condensazione di Claisen Oltre alle aldeidi e chetoni anche gli esteri possono generare enolati e funzionare da elettrofili.. Quando un estere viene trattato con una base avviene una trasformazione
La condensazione di Claisen Oltre alle aldeidi e chetoni anche gli esteri possono generare enolati e funzionare da elettrofili.. Quando un estere viene trattato con una base avviene una trasformazione
Alcoli, fenoli ed eteri
 Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
Alcoli, fenoli ed eteri Alcoli e fenoli Alcoli: gruppo ossidrilico legato ad un carbonio saturo Fenoli: gruppo ossidrilico legato ad un anello aromatico Metanolo Sintesi industriale Tossico per l uomo
G. Licini, Università di Padova. La riproduzione a fini commerciali è vietata
 L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
L addizione coniugata In un sistema carbonilico α,β-insaturo dove avverà l attacco di un nucleofilo? Al carbonio carbonilico o al doppio legame? Il sistema ha due centri elettrofili: il carbonio carbonilico
Enoli e Enolati. Reazioni di sostituzione nucleofila al carbonio a
 Enoli e Enolati Reazioni di sostituzione nucleofila al carbonio a Idrogeni in α ad un carbonile Perché vi è una reattività al carbonio in posizione a ad un carbonile? Perché solo gli idrogeni α sono acidi
Enoli e Enolati Reazioni di sostituzione nucleofila al carbonio a Idrogeni in α ad un carbonile Perché vi è una reattività al carbonio in posizione a ad un carbonile? Perché solo gli idrogeni α sono acidi
SOLUBILITÀ E SUE RELAZIONI CON LA STRUTTURA CHIMICA. Prof. Antonio Lavecchia
 SOLUBILITÀ E SUE RELAZIONI CON LA STRUTTURA CHIMICA Prof. Antonio Lavecchia Meccanismo di dissoluzione Acido stearico Esano legami H forze di Van der Waals glucosio Temperatura Concentrazione Temperatura
SOLUBILITÀ E SUE RELAZIONI CON LA STRUTTURA CHIMICA Prof. Antonio Lavecchia Meccanismo di dissoluzione Acido stearico Esano legami H forze di Van der Waals glucosio Temperatura Concentrazione Temperatura
Ammine. Francesca Anna Scaramuzzo, PhD
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Ammine Francesca Anna Scaramuzzo, PhD Dipartimento di Scienze di Base e Applicate per
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Nomenclatura e nomi comuni Struttura e proprietà Fonti Reazioni Derivati degli acidi carbossilici
 Acidi carbossilici e derivati Nomenclatura e nomi comuni Struttura e proprietà Fonti Reazioni Derivati degli acidi carbossilici Acidi carbossilici Acidi carbossilici Composti carbonilici Gli acidi carbossilici
Acidi carbossilici e derivati Nomenclatura e nomi comuni Struttura e proprietà Fonti Reazioni Derivati degli acidi carbossilici Acidi carbossilici Acidi carbossilici Composti carbonilici Gli acidi carbossilici
Corso di Laurea Triennale in Biotecnologie, AA 2016/17, Esame di Chimica Organica, Nominativo.Matricola
 Corso di Laurea Triennale in Biotecnologie, AA 2016/17, Esame di Chimica Organica, 19-06-2017 Nominativo.Matricola Esercizio 1a. Il cis-2-pentene viene trattato con Br 2 in diclorometano. a) Descrivere
Corso di Laurea Triennale in Biotecnologie, AA 2016/17, Esame di Chimica Organica, 19-06-2017 Nominativo.Matricola Esercizio 1a. Il cis-2-pentene viene trattato con Br 2 in diclorometano. a) Descrivere
Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri)
 CHIMICA ACIDO BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri) Che altra reazione può avvenire al centro carbonilico
CHIMICA ACIDO BASE DI COMPOSTI CARBONILICI Produzione di enolati: deprotonazione al carbonio in alfa a un gruppo carbonilico (aldeidi, chetoni, esteri) Che altra reazione può avvenire al centro carbonilico
Lezione: aldeidi e chetoni
 Lezione: aldeidi e chetoni Il gruppo funzionale carbonilico Nomenclatura Proprietà fisiche Principali reazioni eazioni con N eazioni con alcoli eazioni con tioli eazioni con ammine Tautomeria cheto-enolica
Lezione: aldeidi e chetoni Il gruppo funzionale carbonilico Nomenclatura Proprietà fisiche Principali reazioni eazioni con N eazioni con alcoli eazioni con tioli eazioni con ammine Tautomeria cheto-enolica
Alcoli ed eteri Composti organici che contengono legami singoli C-O
 Alcoli ed eteri Composti organici che contengono legami singoli C-O Chimica Organica CH 3 CH 2 CH 3 CH 2 O CH 2 CH 3 Alcol etilico etanolo Etere etilico dietiletere Fenolo idrossibenzene Nomenclatura degli
Alcoli ed eteri Composti organici che contengono legami singoli C-O Chimica Organica CH 3 CH 2 CH 3 CH 2 O CH 2 CH 3 Alcol etilico etanolo Etere etilico dietiletere Fenolo idrossibenzene Nomenclatura degli
ALDEIDI E CHETONI. Struttura e proprietà. Il gruppo carbonilico. Reattività dei composti carbonilici IL GRUPPO CARBONILICO C O R C
 Struttura e proprietà ALDEIDI E ETNI ALDEIDI E ETNI NTENGN IL GUPP ABNILI Molti altri composti presentano questo gruppo: Acili, acidi, esteri, ammidi, carboidrati, proteine Il gruppo carbonilico E il più
Struttura e proprietà ALDEIDI E ETNI ALDEIDI E ETNI NTENGN IL GUPP ABNILI Molti altri composti presentano questo gruppo: Acili, acidi, esteri, ammidi, carboidrati, proteine Il gruppo carbonilico E il più
Forze intermolecolari
 Forze intermolecolari Sono le forze che si instaurano tra le molecole di un composto e ne determinano lo stato di aggregazione (gas, liquido, solido) interazioni dipolo-dipolo attrazioni di van der Waals
Forze intermolecolari Sono le forze che si instaurano tra le molecole di un composto e ne determinano lo stato di aggregazione (gas, liquido, solido) interazioni dipolo-dipolo attrazioni di van der Waals
Ammine N R N R R R-NH 2. Gruppo funzionale: NH 2. Gruppo amminico. Ammine terziarie. Ammine primarie. Ammine secondarie
 Ammine Gruppo funzionale: N 2 Gruppo amminico -N 2 Ammine primarie N N Ammine terziarie Ammine secondarie Ammine Nomi comuni Le ammine semplici vengono generalmente designate con nomi comuni, accettati
Ammine Gruppo funzionale: N 2 Gruppo amminico -N 2 Ammine primarie N N Ammine terziarie Ammine secondarie Ammine Nomi comuni Le ammine semplici vengono generalmente designate con nomi comuni, accettati
Aromaticità. Addizione elettrofila alcheni
 Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
Aromaticità Le molecole sono aromatiche se sono soddisfatte le seguenti condizioni: La molecola è ciclica La molecola è interamente coniugata La molecola è planare (atomi di carbonio con ibridazione sp
PIRIDINA N coinvolto nel ciclo non partecipa all aromaticità con i suoi elettroni N: coppia di non legame all esterno dell anello comportamento
 PIRIDINE LEZIONE 6 PIRIDINA N coinvolto nel ciclo non partecipa all aromaticità con i suoi elettroni N: coppia di non legame all esterno dell anello comportamento basico (pka=5.2) Nucleo della piridina
PIRIDINE LEZIONE 6 PIRIDINA N coinvolto nel ciclo non partecipa all aromaticità con i suoi elettroni N: coppia di non legame all esterno dell anello comportamento basico (pka=5.2) Nucleo della piridina
Ammine R N + H. ammina terziaria ammina secondaria ammina primaria sale di ammonio quaternario
 AMMINE Ammine Le ammine possono essere considerate dei derivati dell ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alchilici o arilici. Il simbolo generale per una ammina
AMMINE Ammine Le ammine possono essere considerate dei derivati dell ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti con gruppi alchilici o arilici. Il simbolo generale per una ammina
Esercitazione n. 3 - Nomenclatura (II)
 Esercitazione n. 3 - omenclatura (II) 1. iascuna delle seguenti strutture è monofunzionale. Indicare in ciascun caso il gruppo funzionale (aggiungendo 1, 2 o 3 quando appropriato), specificandone la desinenza
Esercitazione n. 3 - omenclatura (II) 1. iascuna delle seguenti strutture è monofunzionale. Indicare in ciascun caso il gruppo funzionale (aggiungendo 1, 2 o 3 quando appropriato), specificandone la desinenza
