Teoria dei Quanti. Emanuele Biolcati. 20 aprile Emanuele Biolcati 1
|
|
|
- Bianca Lolli
- 5 anni fa
- Visualizzazioni
Transcript
1 Teoria dei Quanti Emanuele Biolcati 20 aprile 2018 Emanuele Biolcati 1
2 Ricordo delle discussioni con Bohr [... ] che ci condussero quasi ad uno stato di disperazione; e quando al termine della discussione me ne andavo solo a fare una passeggiata nel parco vicino continuavo sempre a ripropormi il problema: è possibile che la natura sia così assurda come ci appariva in quegli esperimenti atomici? W. Heisenberg Emanuele Biolcati 2
3 Premessa 1 Quantità di moto e momento Si definisce quantità di moto il prodotto della massa per la velocità di un corpo: p = m v e, per oggetti che ruotano a distanza r dal centro, il momento della quantità di moto come: M p = r p = r m v Sono entrambi grandezze vettoriali, ma per la nostra trattazione, non ci interessano direzione e verso. Emanuele Biolcati 3
4 Premessa 2 Continuo Una grandezza è continua se assume tutti i valori possibili da un valore minimo ad un valore massimo. Es. premendo l acceleratore con il piede, porto l auto da 20 km/h a 30 km/h passando per tutti gli infiniti valori intermedi: ma anche 21,1 20,2 e pure 20,11 20,12 e così via senza salti. Discreto Una grandezza è discreta se può assumere solo multipli interi di un certo valore. Es. la quantità di uova nelle ricette può essere 1 o 2 o 3, non 1,1 o 2,34 uova. Emanuele Biolcati 4
5 Prima fase: dal continuo al discreto Emanuele Biolcati 5
6 Il padre della teoria: Niels Bohr ( ) Nel 1922 vince il Premio Nobel per la Fisica Gli dedicano un elemento chimico (Bohrio), un cratere lunare, un asteroide, francobolli, banconote danesi Tiene un ferro di cavallo in ufficio perché dicono che porti fortuna a chi non ci crede. Tenta di scalare le pareti esterne di banche in piena notte Si fa accompagnare al cinema perché non capisce i complotti nei film western Emanuele Biolcati 6
7 Le contraddizioni della Fisica Classica Abbiamo visto che intorno al 1899 comparivano alcune contraddizioni non spiegabili dalla Fisica del tempo: 1 invarianza della velocità della luce 2 discontinuità degli spettri di emissione 3 effetto fotoelettrico 4 radiazione del corpo nero 5 modello nucleare dell atomo La prima portò alla nascita della Teoria della Relatività Ristretta, dagli altri quattro prese vita la Teoria dei Quanti (spesso chiamata Fisica o Meccanica Quantistica). Seguiremo le tappe storiche in ordine cronologico dal 1900 al 1927 indicando per ognuna il fisico che diede il maggior contributo. Emanuele Biolcati 7
8 1900: Plank Max Plank, non in giovane età e per questo non riconoscerà mai la sua teoria sebbene sia definito il padre della Teoria dei Quanti, propone una spiegazione alla controversa radiazione del corpo nero. Plank ipotizza che l energia all interno di un corpo nero (si pensi ad un forno con un piccolo foro) si distribuisca in un numero definito di parti uguali. Avanza quindi l ipotesi, puramente per far tornare i conti, che l energia in un corpo nero (e solo lì!) possa essere non continua, ma discreta, secondo la formula: Equazione di Plank E n = n h f con n = 0, 1, 2,... dove f è la frequenza e h una costante universale che per far funzionare la formula deve essere posta h = 6, J s. Per il corpo nero, si parla di energia quantizzata intendola formata da quanti di energia ovvero pacchetti finiti di onde elettromagnetiche. Emanuele Biolcati 8
9 1905: Einstein Sulla scia della proposta di Plank, Einstein tenta di spiegare l effetto fotoelettrico Ipotizza che non solo l energia di un corpo nero, ma qualsiasi radiazione elettromagnetica sia in realtà composta da quanti di energia (detti fotoni) si torna ad una interpretazione corpuscolare della luce. Ogni fotone possiede un energia pari a: Equazione di Einstein E = hf Tale supposizione era a dir poco insostenibile (Millikan). Emanuele Biolcati 9
10 1911: Bohr E continuando nella direzione di considerare (follemente!) che la Natura sia discreta, Niels Bohr propone una spiegazione per la stabilità dell atomo: se l energia può essere discreta (quantizzata), forse può esserlo anche il momento della quantità di moto. Equazione di Bohr r m v = n h 2π con n = 1, 2, 3... In altre parole, gli elettroni in un atomo possono occupare solo alcune orbite permesse, le cui dimensioni sono multipli della costante di Plank. Questo giustifica con risultati sperimentali molto accurati gli spettri a righe: l elettrone che salta da un orbita all altra emette energia quantizzata. Emanuele Biolcati 10
11 Un ingegnosa combinazione di classico e moderno Assiomi di Bohr: 1 elettroni compiono orbite circolari 2 quantizzazione del momento angolare 3 emissione/assorbimento dovuti a salti quantici Modello atomico di Bohr (1913) - struttura planetaria classica - stabilità atomica: gli elettroni possono occupare solo alcune orbite - gli spettri discreti derivano dai salti quantici N.B. modello quantizzato, ma non quantistico: nessun aspetto probabilistico o ondulatorio Emanuele Biolcati 11
12 Qualche conto (facoltativo) Assioma 1: orbita circolare, quindi forza centripeta equivale la forza elettrostatica (Z=1): m e v 2 r = 1 4πɛ 0 e 2 r 2 Assioma 2: quantizzazione del momento angolare dell elettrone, ovvero soltanto valori multipli della costante di Plank: L = m e vr = n h 2π (n = 1, 2, 3...) Elevando al quadrato e sottraendo membro a membro si ottiene... Raggio quantiz. (orbite permesse) r n = ɛ 0h 2 n 2 πm e e 2 da cui il raggio di Bohr: r 1 = ɛ 0h 2 πm e e 2 = 0, m Emanuele Biolcati 12
13 Ancora conti (facoltativo) Sostituendo r n nella formula dell energia dell elettrone si ottiene: Livelli energetici discreti E n = e4 m e 8ɛ 2 0 h2 1 n 2 Da cui il livello fondamentale: E 1 = e4 m e 8ɛ 2 = 13, 6 ev 0h2 Questo è il caso dello stato più stabile del sistema, cioé quello per cui è massima l energia necessaria per liberare l elettrone. N. Bohr Emanuele Biolcati 13
14 E la conferma sperimentale (facoltativo) Assioma 3: l energia emessa nel salto dall orbita (stato) n 2 all orbita (stato) n 1 è: ( E 2 E 1 = e4 m e 1 8ɛ 2 0 h2 n 2 1 ) 1 n 2 2 Supponendo che corrisponda ad un unico fotone emesso, esso avrà frequenza ν = E 2 E 1 h ( = e4 m e 1 8ɛ 2 0 h3 n 2 1 ) 1 n 2 2 Il valore teorico della costante è 1, m. Sperimentalmente la formula di Rydberg (Balmer) è: ( 1 ν = c R m 2 1 ) 1 m 2 2 dove R, costante empirica, moltiplicata per c equivale a 1, m. Emanuele Biolcati 14
15 1924: Pauli Il modello di Bohr è in realtà più complesso e prevede altre caratteristiche quantizzate dell atomo. Ciò portò a definire i numeri quantici. Il numero n definisce il livello energetico (quale orbita). Mentre gli altri numeri (l, m, s) tengono conto della forma delle orbite degli elettroni, dell orientamento spaziale e del loro momento magnetico (spin). Il modello viene completato dal Principio di Esclusione di Pauli In ogni sistema di elettroni, nessun elettrone possiede medesimi numeri quantici Emanuele Biolcati 15
16 La Fisica spiega alla Chimica Si trova così una giustificazione teorica per la configurazione elettronica e quindi la struttura della Tavola Periodica degli Elementi nota dal 1869! Emanuele Biolcati 16
17 La regina delle applicazioni È dunque possibile: colpire un atomo con una certa radiazione in modo che un elettrone salti in un altra orbita diventando eccitato; tale eccitazione non è stabile, l elettrone torna all orbita di partenza emettendo una radiazione con la stessa frequenza di quella ricevuta. Se collochiamo tutto ciò all interno di una cavità risonante (due specchi allineati e contrapposti) riusciamo ad amplificare enormemente la radiazione di partenza, ottenendo il: Light Amplification by Stimulated Emission of Radiation (LASER) Emissione di luce monocromatica (una sola frequenza), altamente concentrata e coerente (molto intensa e precisa). Applicazioni: incidere, saldare, tagliare metalli; operazioni chirurgiche; masterizzare CD e DVD; trasmettere informazioni mediante fibre ottiche; misurare distanze piccolissime; etc. Emanuele Biolcati 17
18 1922: Effetto Compton Dodici anni dopo l azzardata ipotesi di Einstein, Artur H. Compton scopre l effetto più convincente della corpuscolarità della luce. un fascio di raggi X di lunghezza d onda λ i è scagliato contro una sottilissima lamina di grafite; si rileva la lunghezza d onda λ f e l angolo di uscita ϑ dopo l interazione. Ci si aspetta che λ f = λ i, perché un onda mantiene le sue caratteristiche dopo l interazione (si pensi al fenomeno della rifrazione). Invece: Diffusione Compton λ f λ i = h (1 cos ϑ) m 0 c perfettamente spiegabile con la teoria dell urto di particelle, come se fossero palline da tennis (relativistiche)! Emanuele Biolcati 18
19 Conclusione Partendo da alcuni problemi della Fisica Classica, si avanzano tre ipotesi interconnesse, fondate sull assunto che la Natura sia discreta: 1 energia elettromagnetica è quantizzata dentro un corpo nero spiegate la catastrofe ultra violetta e la radiazione di corpo nero 2 energia elettromagnetica è sempre quantizzata, la luce è una particella (fotone) spiegato l effetto fotoelettrico 3 momento angolare degli elettroni attorno agli atomi è quantizzato (orbite permesse, numeri quantici) spiegata la stabilità dell atomo e gli spettri a righe Anche accettando una Natura discreta, rimane un grande dilemma: la luce è un onda elettromagnetica (Maxwell-Hertz) o un fotone (Plank-Einstein-Compton)? Emanuele Biolcati 19
20 Seconda fase: dalla realtà alla probabilità e alla complementarità Emanuele Biolcati 20
21 1924: De Broglie Luis De Broglie azzarda un ipotesi ancor più folle di quella Bohr: se la luce, da sempre considerata un onda, ha le caratteristiche di una particella allora le particelle (es. elettroni) avranno le caratteristiche delle onde. Equazione di De Broglie λ = h p Associa ad una particella (elettrone) una lunghezza d onda. Non è chiaro cosa questo significhi, perché l onda in questione NON ha alcun significato fisico. Emanuele Biolcati 21
22 1926: Schroedinger Schroedinger definisce matematicamente la funzione d onda per una particella ψ. Attenzione, questa continua a NON avere un significato fisico. Mentre ha un significato fisico la: ψ 2 = densità di probabilità Cosa significa? Premettendo che tale concetto non è ancor chiaro oggi dopo 91 anni di studi, cerchiamo di darne un idea: è la probabilità che la particella si trovi in un certo punto nello spazio e in un certo istante; le variabili di ψ sono molte: tutte le coordinate spaziali più il tempo e i coefficienti non sono reali, ma complessi. Emanuele Biolcati 22
23 Da orbite a orbitali La funzione d onda compare in una delle più importanti equazioni della Fisica Moderna, pilastro della Meccanica Ondulatoria: Equazione di Schroedinger i ψ t = Hψ Le soluzioni di tale equazioni permettono di: spiegare le diverse intensità delle righe degli spettri di emissione; spiegare legami e comportamenti di atomi e molecole. Ma è necessario abbandonare il concetto di orbita a favore del concetto di orbitale inteso come nube di probabilità. Emanuele Biolcati 23
24 Scatola e realtà Attenzione: non è la probabilità conosciuta finora! Pensiamo ad una scatola con degli atomi all interno. Classicamente ogni atomo può trovarsi o a sinistra o a destra, non esiste una terza possibilità (tertium non datur). Teoria dei Quanti Esistono altre possibilità che sono stranamente delle mescolanze delle due prime possibilità. Finché non effettuiamo una misura, l atomo NON ha una posizione, NON è in qualche luogo, NON esiste. È come se Dio non avesse disegnato la realtà con una linea pesante, ma si fosse limitato a un tratteggio lieve. C. Rovelli Emanuele Biolcati 24
25 Il gatto di Schroedinger Si rinchiuda un gatto in una scatola d acciaio insieme alla seguente macchina infernale: una minuscola porzione di sostanza radioattiva, così poca che in un ora forse uno dei suoi atomi si disintegrerà o forse no, con stessa probabilità; se l evento si verifica, un martelletto rompe una fiala con del cianuro. Dopo un ora, il gatto è allo stesso tempo vivo e morto, perché essendoci la stessa probabilità, esso si trova in una sovrapposizione di stati complementari. Emanuele Biolcati 25
26 1927: Heisenberg Per sconvolgere ulteriormente il quadro di insieme, Werner Heisenberg propose il celebre Principio di Indeterminazione Vi sono coppie di grandezze per cui tanto più cerchiamo di conoscerne una, quanto più perdiamo informazioni sull altra. Questo equivale a dire che il prodotto delle incertezze (es. x) sulle due grandezze non può mai scendere al di sotto di un certo valore limite. Le coppie di grandezze sono due ed entrambe hanno come limite la costante di Plank: Posizione/quantità di moto x p > h 2π Energia/tempo E t > h 2π Emanuele Biolcati 26
27 Ancora esperimenti mentali Emanuele Biolcati 27
28 Conseguenze fisiche Posizione/quantità di moto non è possibile localizzare una particella nello spazio; non esiste più una traiettoria; non si parla di orbita, ma di orbitale. Energia/tempo per tempi molto brevi, si può creare energia dal nulla; possono nascere coppie particella/antiparticella; il vuoto non è vuoto, ma pieno di particelle virtuali (mare di Dirac). Emanuele Biolcati 28
29 Conseguenze filosofiche Possono essere riassunte principalmente in tre argomenti di fondo che Heisenberg usa nel confronto con Kant (Fisica e filosofia, 1958): 1 il principio di identità; 2 il rapporto di causa-effetto; 3 l interazione inevitabile tra soggetto osservante e oggetto osservato. Emerge dunque una drastica rivalutazione della soggettività nell indagine naturale che, lungi dall inibire ogni pretesa scientifica, propone un nuovo - e, per certi, versi meno ingenuo - modo di porci di fronte alla realtà. Esiste una diffusa consapevolezza che la fisica contemporanea abbia prodotto un importante revisione nella concezione che l uomo ha dell universo e dei rapporti che ad esso lo legano. Si è detto anche che tale revisione incide alla base il destino e la libertà dell uomo, incrinando le tradizionali concezioni circa la capacità di esercitare un controlo su di essi. F.S.C Northop Emanuele Biolcati 29
30 Entanglement Per coppie di particelle entangled, quando effettuo una misura su una, istantaneamente definisco una proprietà dell altra distante anche molti kilometri. Paradosso EPR (critica di Einstein alla Teoria dei Quanti). Il teletrasporto è finalmente possibile (?). Equazione di Dirac (i/ m)ψ = 0 Erroneamente viene associata all entanglement e chiamata equazione dell amore, ma in realtà è una variante relativistica dell equazione di Schroedinger da cui deriva l ipotesi del mare di Dirac. Emanuele Biolcati 30
31 1927: Bohr Principio di Complementarità Quella corpuscolare e quella ondulatoria sono due immagini complementari della stessa realtà. Detto in altre parole, la luce è sia un onda che una particella, così come l elettrone e le altre particelle subatomiche. Tale duplice aspetto non può essere osservato contemporaneamente mediante un singolo esperimento e, di fatto, la realtà non è né l uno né l altro, ma una sovrapposizione di entrambi, per quanto incompatibili. Einstein non accettò mai la Teoria dei Quanti, ma Bohr smontò ogni obiezione mossa dal fisico tedesco: Einstein: Dio non gioca a dadi con l Universo Bohr: Smetti di dire a Dio quello che deve fare! Emanuele Biolcati 31
32 Verifiche sperimentali e applicazioni Come ha potuto sopravvivere fino ad oggi una teoria tanto scriteriata? Verifiche sperimentali: la Teoria dei Quanti si è rivelata la più precisa delle teorie fisiche mai elaborate, perché capace di prevedere risultati di esperimenti con esattezza fino a 20 cifre decimali. Applicazioni diffuse: la fisica dello stato solido si basa interamente sulla fisica atomica e da essa discendono tutti i componenti elettronici; computer, smartphone, LED, risonanze magnetiche (RMN) non esisterebbero senza questa teoria! Applicazioni future (o fantastiche): il teletrasporto (basato sull entaglement quantistico). Nuova Fisica: il Modello Standard e la Fisica subatomica (quarks, neutrini, antimateria) discende dalla Teoria dei Quanti e continua ad ottenere conferme (es. scoperta del Bosone di Higgs 2012). Emanuele Biolcati 32
33 Conclusione Probabilità ogni particella elementare è una specie di onda (De Broglie) NON fisica, ma legata alla probabilità (Schroedinger) solo effettuando una misura si trasforma il probabile in concreto, prima di ciò rimane uno stato di mescolanza non esiste la traiettoria, perché nessuna particella è in un punto dello spazio orbitale atomico Indeterminazione (Heisenberg) Posizione/Quantità di moto non definite contemporaneamente Energia/tempo non definite contemporaneamente violato ogni principio di conservazione di massa ed energia creazione continua di particelle Complementarità (Bohr) la luce è sia un onda che una particella e nessuno dei due; così come l elettrone e tutte le altre particelle. Emanuele Biolcati 33
34 Oltre la fisica Emanuele Biolcati 34
35 In Matematica La matematica della Teoria dei Quanti non è così avanzata e autonoma come quella sviluppata dalla Teoria della Relatività, ad ogni modo: si rivela un buon rifugio dalle avversità (Heisenberg) intese come difficoltà ad interpretare/accettare i risultati della Teoria; consente una vasta applicazione dei numeri complessi e delle matrici. Nel 1931, contribuisce alla demolizione delle certezze logico-scientifiche una scoperta matematica analoga al Principio di Inderterminazione di Heisenberg per la Fisica: Teorema di Incompletezza di Goedel In ogni formalizzazione coerente della matematica è possibile costruire una proposizione sintatticamente corretta che NON può essere né dimostrata né confutata all interno dello stesso sistema. Emanuele Biolcati 35
36 In Filosofia Come già è stato anticipato parlando di Teoria della Relatività, la Critica alla Ragion Pura di Kant riceve lo scossone finale dalla Teoria dei Quanti poché: si perde il concetto di causalità (Principio di Indeterminazione); si perde il significato di traiettoria e di conseguenza il valore dello spazio, non solo non assoluto, ma non più definito; la misura che effettua lo sperimentatore diventa parte integrante della realtà, senza di essa la Natura NON si presenta in uno stato definito; varia la concezione della sostanza kantiana, perché sono violati i principi di conservazione della massa e dell energia. Non sarà mai possibile con la pura ragione pervenire a qualche verità assoluta. W. Heisenberg Emanuele Biolcati 36
37 In Letteratura Non si riscontrano diretti e diffusi collegamenti tra la Teoria dei Quanti e romanzi o racconti o drammi teatrali 1. È tuttavia evidente come il Novecento letterario sia pervaso dalla crisi della realtà e dall incertezza, in parte alimentate anche dal Principio di Indeterminazione. Alcuni esempi: Pirandello e la disintegrazione della realtà univoca (Così è se vi pare); Gadda e Quer Pasticciaccio brutto de via Merulana nella sua incertezza; Joyce, Woolf, Svevo e Melvill nella crisi e negazione dell io; McEwan in più romanzi dialoga con la Fisica Moderna, in particolare in Solar dove il protagonista è un fisico vincitore del Nobel. 1 Eccezione per Copenhagen, opera teatrale costituita da un ipotetico dialogo tra Bohr e Heisenberg sull evoluzione delle armi nucleari. Emanuele Biolcati 37
38 Bibliografia: W. Heisenberg, Fisica e filosofia, Il Saggiatore (2016) C. Rovelli, Sette brevi lezioni di Fisica, Adelphi (2015) R.A.A. Berenguer, Mondo quantistico, Hachette (2015) J.M. Jauch, Sulla realtà dei quanti, Adelphi (2001) E. Schroedinger, Che cos è la vita?, Adelphi, (1995) R. Gilmore, Alice nel paese dei quanti, Raffaello Cortina, (1996) Emanuele Biolcati 38
39 Il compito non è tanto di vedere ciò che nessun altro ha ancora visto; ma pensare ciò che nessun altro ha ancora pensato, riguardo a quello che chiunque vede. E. Schroedinger Emanuele Biolcati 39
Lezione simulata: il modello atomico di Bohr
 : il modello atomico di Bohr Emanuele Biolcati Prova orale concorso docenti classe A020 18 agosto 2016 Emanuele Biolcati 1 Sommario Introduzione 1 Introduzione Contesto e finalità Modalità di lezione e
: il modello atomico di Bohr Emanuele Biolcati Prova orale concorso docenti classe A020 18 agosto 2016 Emanuele Biolcati 1 Sommario Introduzione 1 Introduzione Contesto e finalità Modalità di lezione e
Il modello di Bohr. Lezioni d'autore di Giorgio Benedetti
 Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Il modello di Bohr Lezioni d'autore di Giorgio Benedetti VIDEO Gli spettri di emissione Nel 1859 il fisico G.R. Kirchoff scoprì che ogni elemento chimico presenta uno spettro di emissione caratteristico,
Introduzione alla meccanica quantistica. Vincenzo Barone
 Accademia delle Scienze di Torino 9 novembre 2017 Introduzione alla meccanica quantistica Vincenzo Barone barone@to.infn.it Parte I: Le basi della meccanica quantistica (questioni didattiche) Parte II:
Accademia delle Scienze di Torino 9 novembre 2017 Introduzione alla meccanica quantistica Vincenzo Barone barone@to.infn.it Parte I: Le basi della meccanica quantistica (questioni didattiche) Parte II:
1 3 STRUTTURA ATOMICA
 1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
1 3 STRUTTURA ATOMICA COME SI SPIEGA LA STRUTTURA DELL ATOMO? Secondo il modello atomico di Rutherford e sulla base della fisica classica, gli elettroni dovrebbero collassare sul nucleo per effetto delle
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. L atomo di Bohr 3. Il modello atomico
Incontriamo la Fisica: la Meccanica Quantistica. Stefano Spagocci, GACB
 Incontriamo la Fisica: la Meccanica Quantistica Stefano Spagocci, GACB Newton e Laplace Secondo la concezione di Newton e Laplace, specificate le condizioni iniziali (posizioni e velocità), il moto di
Incontriamo la Fisica: la Meccanica Quantistica Stefano Spagocci, GACB Newton e Laplace Secondo la concezione di Newton e Laplace, specificate le condizioni iniziali (posizioni e velocità), il moto di
Teoria Atomica Moderna. Chimica generale ed Inorganica: Chimica Generale. sorgenti di emissione di luce. E = hν. νλ = c. E = mc 2
 sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
sorgenti di emissione di luce E = hν νλ = c E = mc 2 FIGURA 9-9 Spettro atomico, o a righe, dell elio Spettri Atomici: emissione, assorbimento FIGURA 9-10 La serie di Balmer per gli atomi di idrogeno
Capitolo 8 La struttura dell atomo
 Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
Capitolo 8 La struttura dell atomo 1. La doppia natura della luce 2. La «luce» degli atomi 3. L atomo di Bohr 4. La doppia natura dell elettrone 5. L elettrone e la meccanica quantistica 6. L equazione
catastrofe ultravioletta
 Fisica moderna Radiazione termica La radiazione termica è l insieme di onde elettromagnetiche che ogni corpo emette per effetto della sua temperatura Un corpo nero è un corpo che assorbe completamente
Fisica moderna Radiazione termica La radiazione termica è l insieme di onde elettromagnetiche che ogni corpo emette per effetto della sua temperatura Un corpo nero è un corpo che assorbe completamente
Generalità delle onde elettromagnetiche
 Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Generalità delle onde elettromagnetiche Ampiezza massima: E max (B max ) Lunghezza d onda: (m) E max (B max ) Periodo: (s) Frequenza: = 1 (s-1 ) Numero d onda: = 1 (m-1 ) = v Velocità della luce nel vuoto
Atomo. Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale)
 Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
Atomo Evoluzione del modello: Modello di Rutherford Modello di Bohr Modello quantomeccanico (attuale) 1 Modello di Rutherford: limiti Secondo il modello planetario di Rutherford gli elettroni orbitano
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA
 LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
LE ONDE E I FONDAMENTI DELLA TEORIA QUANTISTICA I PROBLEMI DEL MODELLO PLANETARIO F Secondo Rutherford l elettrone si muoverebbe sulla sua orbita in equilibrio tra la forza elettrica di attrazione del
La struttura dell atomo
 La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
La Teoria Atomica La struttura dell atomo 10-10 m 10-14 m Proprietà delle tre particelle subatomiche fondamentali Carica Massa Nome (simbolo) relativa assoluta (C) relativa (uma)* Assoluta (g) Posizione
Teoria Atomica di Dalton
 Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Teoria Atomica di Dalton Il concetto moderno della materia si origina nel 1806 con la teoria atomica di John Dalton: Ogni elementoè composto di atomi. Gli atomi di un dato elemento sono uguali. Gli atomi
Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton)
 Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Atomi 16 Si arrivò a dimostrare l esistenza di una forma elementare della materia (atomo) solo nel 1803 (John Dalton) 17 Teoria atomica di Dalton Si basa sui seguenti postulati: 1. La materia è formata
Unità 2. La teoria quantistica
 Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
Unità 2 La teoria quantistica L'effetto fotoelettrico Nel 1902 il fisico P. Lenard studiò l'effetto fotoelettrico. Esso è l'emissione di elettroni da parte di un metallo su cui incide un'onda elettromagnetica.
LA RIVOLUZIONE QUANTISTICA
 LA RIVOLUZIONE QUANTISTICA Franco Prati Università dell Insubria - Como NINDA URUK Il pane dei Sumeri Ricerca scientifica ed epistemologia 5 dicembre 2012 Congresso Internazionale dei Fisici in onore di
LA RIVOLUZIONE QUANTISTICA Franco Prati Università dell Insubria - Como NINDA URUK Il pane dei Sumeri Ricerca scientifica ed epistemologia 5 dicembre 2012 Congresso Internazionale dei Fisici in onore di
STRUTTURA ATOMICA. Per lo studio della struttura dell atomo ci si avvale della Spettroscopia.
 STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
STRUTTURA ATOMICA Il modello planetario dell atomo secondo Rutherford si appoggia sulla meccanica classica. Il modello non può essere corretto visto che per descrivere il comportamento delle particelle
La teoria atomistica
 La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
La teoria atomistica Joseph John Thomson Fisico britannico È noto per aver scoperto nel 1897 la particella di carica negativa: l'elettrone Ebbe come studente Rutherford Vinse il Nobel per la fisica nel
Modelli atomici Modello atomico di Rutheford Per t s d u i diare la t s rutt ttura t a omica Ruth th f or (
 Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
Modello atomico di Rutheford Per studiare la struttura tt atomica Rutherford (1871-1937) 1937) nel 1910 bombardòb una lamina d oro con particelle a (cioè atomi di elio) Rutherford suppose che gli atomi
the power of ten Prof.ssa Patrizia Gallucci
 https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
https://www.youtube.com/watch?v=5ckd0apswe8 the power of ten Prof.ssa Patrizia Gallucci ESPERIMENTO DI RUTHEFORD Dopo l esperimento Rutheford ipotizzò un atomo con un nucleo centrale,formato da neutroni
La nascita della fisica moderna. (un racconto di inizio 900)
 La nascita della fisica moderna (un racconto di inizio 900) Sviluppo storico della fisica tra fine 800 e il 1927 Fisica sperimentale fine 800 Fisica teorica fine 800 1900 1905 1911 1913 1916 1924 1925-1927
La nascita della fisica moderna (un racconto di inizio 900) Sviluppo storico della fisica tra fine 800 e il 1927 Fisica sperimentale fine 800 Fisica teorica fine 800 1900 1905 1911 1913 1916 1924 1925-1927
L atomo di Bohr. Argomenti. Al tempo di Bohr. Spettri atomici 19/03/2010
 Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Argomenti Spettri atomici Modelli atomici Effetto Zeeman Equazione di Schrödinger L atomo di Bohr Numeri quantici Atomi con più elettroni Al tempo di Bohr Lo spettroscopio è uno strumento utilizzato per
Lezioni di Meccanica Quantistica
 Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Luigi E. Picasso Lezioni di Meccanica Quantistica seconda edizione Edizioni ETS www.edizioniets.com Copyright 2015 EDIZIONI ETS Piazza Carrara, 16-19, I-56126 Pisa info@edizioniets.com www.edizioniets.com
Quadro di Riferimento della II prova di Fisica dell esame di Stato per i Licei Scientifici
 Quadro di Riferimento della II prova di Fisica dell esame di Stato per i Licei Scientifici Il presente documento individua le conoscenze, abilità e competenze che lo studente dovrà aver acquisito al termine
Quadro di Riferimento della II prova di Fisica dell esame di Stato per i Licei Scientifici Il presente documento individua le conoscenze, abilità e competenze che lo studente dovrà aver acquisito al termine
L atomo di Bohr e i raggi X
 L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
L atomo di Bohr e i raggi X Corsi laboratorio per le scuole superiori gennaio 017 Prof. Federico Boscherini Dipartimento di Fisica e Astronomia Università di Bologna federico.boscherini@unibo.it www.unibo.it/docenti/federico.boscherini
Modello atomico ad orbitali e numeri quantici
 Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
Modello atomico ad orbitali e numeri quantici Il modello atomico di Bohr permette di scrivere correttamente la configurazione elettronica di un atomo ma ha dei limiti che sono stati superati con l introduzione
Fisica Moderna e contemporanea
 Fisica Moderna e contemporanea SSIS Puglia Prof. Luigi Schiavulli luigi.schiavulli@ba.infn.it Dipartimento Interateneo di Fisica Michelangelo Merlin 02/02/2006 1 Sommario Quadro riassuntivo sulla Fisica
Fisica Moderna e contemporanea SSIS Puglia Prof. Luigi Schiavulli luigi.schiavulli@ba.infn.it Dipartimento Interateneo di Fisica Michelangelo Merlin 02/02/2006 1 Sommario Quadro riassuntivo sulla Fisica
Sulla nascita di questo libro. Introduzione 1
 Indice Sulla nascita di questo libro V Introduzione 1 1 Luce e materia 7 Che cos è veramente la luce? 7 Ma qui che cosa oscilla? 9 Che cosa sono la frequenza e la lunghezza d onda della luce? 11 Che cos
Indice Sulla nascita di questo libro V Introduzione 1 1 Luce e materia 7 Che cos è veramente la luce? 7 Ma qui che cosa oscilla? 9 Che cosa sono la frequenza e la lunghezza d onda della luce? 11 Che cos
Struttura della materia
 Struttura della materia 1. L elettrone 2. Effetto Compton 3. Struttura dell atomo XIV - 0 Rapporto carica/massa dell elettrone Esperimento di Thomson: raggi catodici. Fascio non deflesso: Quando B=0: con
Struttura della materia 1. L elettrone 2. Effetto Compton 3. Struttura dell atomo XIV - 0 Rapporto carica/massa dell elettrone Esperimento di Thomson: raggi catodici. Fascio non deflesso: Quando B=0: con
Il metodo scientifico
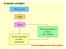 Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Il metodo scientifico Osservazioni Legge Teoria Teoria controllata con altri esperimenti Teoria modificata in base alle verifiche Gli stadi fondamentali del metodo scientifico 1 Leggi ponderali Legge della
Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica
 ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
ATOMO Democrito IV secolo A.C. Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811) Volumi uguali di gas diversi
GLI ORBITALI ATOMICI
 GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
GLI ORBITALI ATOMICI Orbitali atomici e loro rappresentazione Le funzioni d onda Ψ n che derivano dalla risoluzione dell equazione d onda e descrivono il moto degli elettroni nell atomo si dicono orbitali
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti interi
Enrico Silva - diritti riservati - Non è permessa, fra l altro, l inclusione anche parziale in altre opere senza il consenso scritto dell autore
 Indeterminazione Finora si sono considerate le proprietà ondulatorie, lavorando sulla fase di una (per ora non meglio specificata) funzione. Si sono ricavate o ipotizzate relazioni per: - lunghezza d onda
Indeterminazione Finora si sono considerate le proprietà ondulatorie, lavorando sulla fase di una (per ora non meglio specificata) funzione. Si sono ricavate o ipotizzate relazioni per: - lunghezza d onda
ATOMO. Legge della conservazione della massa Legge delle proporzioni definite Dalton
 Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
Democrito IV secolo A.C. ATOMO Lavoisier Proust Legge della conservazione della massa Legge delle proporzioni definite Dalton (1808) Teoria atomica Gay-Lussac volumi di gas reagiscono secondo rapporti
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO
 La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La teoria atomica moderna: il modello planetario L ELETTRONE SI MUOVE LUNGO UN ORBITA INTORNO AL NUCLEO La luce La LUCE è una forma di energia detta radiazione elettromagnetica che si propaga nello spazio
La struttura della materia
 La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
La struttura della materia IL CORPO NERO In fisica, i corpi solidi o liquidi emettono radiazioni elettromagnetiche, a qualsiasi temperatura. Il corpo nero, invece, è un oggetto ideale che assorbe tutta
L'effetto Compton (1923)
 L'effetto Compton (1923) Conferma la natura quantizzata della radiazione elettromagnetica (raggi X) Conferma la natura corpuscolare dei quanti di radiazione che si comportano come particelle dotate di
L'effetto Compton (1923) Conferma la natura quantizzata della radiazione elettromagnetica (raggi X) Conferma la natura corpuscolare dei quanti di radiazione che si comportano come particelle dotate di
STRUTTURA DELL'ATOMO
 STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
STRUTTURA DELL'ATOMO IDROGENO 1 H ELIO He 1 2 4 Modello planetario di Rutherford -protoni e neutroni costituiscono il nucleo in cui è concentrata tutta la massa - gli elettroni ruotano attorno al nucleo
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA. (Plank Einstein)
 L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
L ATOMO SECONDO LA MECCANICA ONDULATORIA IL DUALISMO ONDA-PARTICELLA POSTULATO DI DE BROGLIÈ Se alla luce, che è un fenomeno ondulatorio, sono associate anche le caratteristiche corpuscolari della materia
Rappresentazione dell atomo. Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano.
 Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Rappresentazione dell atomo Rutherford (1911) : modello planetario con il nucleo al centro e gli elettroni che ruotano. Informazioni importanti circa la dimensione dell atomo e la distribuzione della massa
Crisi della Fisica Classica & Fisica Quantistica
 Crisi della Fisica Classica & Fisica Quantistica Guido Montagna Dipartimento di Fisica, Università di Pavia & INFN, Sezione di Pavia February 11, 2018 G. Montagna, Università di Pavia & INFN (Dipartimento
Crisi della Fisica Classica & Fisica Quantistica Guido Montagna Dipartimento di Fisica, Università di Pavia & INFN, Sezione di Pavia February 11, 2018 G. Montagna, Università di Pavia & INFN (Dipartimento
Le Caratteristiche della Luce
 7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
7. L Atomo Le Caratteristiche della Luce Quanti e Fotoni Spettri Atomici e Livelli Energetici L Atomo di Bohr I Modelli dell Atomo - Orbitali atomici - I numeri quantici e gli orbitali atomici - Lo spin
Introduzione alla Meccanica Quantistica (MQ):
 Introduzione alla Meccanica Quantistica (MQ): 1 MECCANICA QUANTISTICA ELETTRONI MATERIA MOLECOLE ATOMI NUCLEI La nostra attuale comprensione della struttura atomica e molecolare si basa sui principi della
Introduzione alla Meccanica Quantistica (MQ): 1 MECCANICA QUANTISTICA ELETTRONI MATERIA MOLECOLE ATOMI NUCLEI La nostra attuale comprensione della struttura atomica e molecolare si basa sui principi della
LUCE E ONDE ELETTROMAGNETICHE
 LUCE E ONDE ELETTROMAGNETICHE QUASI TUTTO QUELLO CHE SAPPIAMO SULLA STRUTTURA DELL ATOMO DERIVA DALL ANALISI DELLA LUCE EMESSA O ASSORBITA DALLE SOSTANZE CHI FU IL PRIMO AD ACCORGERSI CHE I SINGOLI ELEMENTI
LUCE E ONDE ELETTROMAGNETICHE QUASI TUTTO QUELLO CHE SAPPIAMO SULLA STRUTTURA DELL ATOMO DERIVA DALL ANALISI DELLA LUCE EMESSA O ASSORBITA DALLE SOSTANZE CHI FU IL PRIMO AD ACCORGERSI CHE I SINGOLI ELEMENTI
Crisi della Fisica Classica & Fisica Quantistica
 Crisi della Fisica Classica & Fisica Quantistica Guido Montagna Dipartimento di Fisica, Università di Pavia & INFN, Sezione di Pavia February 8, 2018 G. Montagna, Università di Pavia & INFN (Dipartimento
Crisi della Fisica Classica & Fisica Quantistica Guido Montagna Dipartimento di Fisica, Università di Pavia & INFN, Sezione di Pavia February 8, 2018 G. Montagna, Università di Pavia & INFN (Dipartimento
4.Semplificare e modellizzare con strumenti matematici e disciplinari situazioni reali al fine della risoluzione di semplici problemi
 MODULO : CONTINUITA 12 ore COMPETENZE: 1.Osservare, identificare ed esplorare fenomeni; 2.Formulare ipotesi esplicative utilizzando modelli, analogie e leggi 3.Costruire il linguaggio della fisica classica
MODULO : CONTINUITA 12 ore COMPETENZE: 1.Osservare, identificare ed esplorare fenomeni; 2.Formulare ipotesi esplicative utilizzando modelli, analogie e leggi 3.Costruire il linguaggio della fisica classica
Risultato: ELABORAZIONE della MECCANICA QUANTISTICA e sua applicazione sistematica ai nuovi fenomeni
 Tra la fine del XIX e inizio del XX secolo una serie di fenomeni non trovano interpretazione adeguata, basata su fisica classica (meccanica, elettromagnetismo, ottica e termodinamica) Essi risultarono
Tra la fine del XIX e inizio del XX secolo una serie di fenomeni non trovano interpretazione adeguata, basata su fisica classica (meccanica, elettromagnetismo, ottica e termodinamica) Essi risultarono
CORSO DI LAUREA IN OTTICA E OPTOMETRIA
 CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
CORSO DI LAUREA IN OTTICA E OPTOMETRIA Anno Accademico 007-008 CORSO di FISCA ED APPLICAZIONE DEI LASERS Questionario del Primo appello della Sessione Estiva NOME: COGNOME: MATRICOLA: VOTO: /30 COSTANTI
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a , I semestre! Programma del corso di FISICA SUPERIORE! Docente: MAURO PAPINUTTO!
 Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a. 2013-14, I semestre Programma del corso di FISICA SUPERIORE Docente: MAURO PAPINUTTO Dipartimento di Fisica Phone: +39 06 4991 4376 Universita`
Laurea Magistrale di INGEGNERIA ELETTRONICA (LM-29) a.a. 2013-14, I semestre Programma del corso di FISICA SUPERIORE Docente: MAURO PAPINUTTO Dipartimento di Fisica Phone: +39 06 4991 4376 Universita`
Struttura Elettronica degli Atomi Meccanica quantistica
 Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Prof. A. Martinelli Struttura Elettronica degli Atomi Meccanica quantistica Dipartimento di Farmacia 1 Il comportamento ondulatorio della materia 2 1 Il comportamento ondulatorio della materia La diffrazione
Università Primo Levi
 Università Primo Levi Primo Levi 2013 Le forze fondamentali e la fisica dei quanta INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
Università Primo Levi Primo Levi 2013 Le forze fondamentali e la fisica dei quanta INAF Osservatorio Astronomico di Bologna via Ranzani, 1 40127 - Bologna - Italia Tel, 051-2095721 Fax, 051-2095700 http://www.bo.astro.it/~bedogni/primolevi
Lezione n. 13. Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo. di idrogeno. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
Chimica Fisica Biotecnologie sanitarie Lezione n. 13 Radiazione elettromagnetica Il modello di Bohr Lo spettro dell atomo di idrogeno Antonino Polimeno 1 Radiazione elettromagnetica (1) - Rappresentazione
DOMANDE PER CAPIRE LA FISICA
 INTRODUZIONE Questo libro ha lo scopo di introdurre in modo semplice alcuni interessantissimi argomenti di fisica moderna, che tengono molto impegnati gli scienziati di tutto il mondo e affascinano gli
INTRODUZIONE Questo libro ha lo scopo di introdurre in modo semplice alcuni interessantissimi argomenti di fisica moderna, che tengono molto impegnati gli scienziati di tutto il mondo e affascinano gli
Comune ordine di riempimento degli orbitali di un atomo
 Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Comune ordine di riempimento degli orbitali di un atomo Le energie relative sono diverse per differenti elementi ma si possono notare le seguenti caratteristiche: (1) La maggior differenza di energia si
Programma della I parte
 Programma della I parte Cenni alla meccanica quantistica: il modello dell atomo Dall atomo ai cristalli: statistica di Fermi-Dirac, il modello a bande di energia, popolazione delle bande, livello di Fermi
Programma della I parte Cenni alla meccanica quantistica: il modello dell atomo Dall atomo ai cristalli: statistica di Fermi-Dirac, il modello a bande di energia, popolazione delle bande, livello di Fermi
P. Sapia Università della Calabria. a.a. 2009/10
 FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
FISICA PER I BENI CULTURALI Ii MATERIA E INTERAZIONE CON LA RADIAZIONE P. Sapia Università della Calabria a.a. 2009/10 Interazioni fondamentali Gravitazionale Debolmente attrattiva, tra tutte le particelle
Lezione n. 19. L equazione. di Schrodinger L atomo. di idrogeno Orbitali atomici. 02/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 19 L equazione di Schrodinger L atomo di idrogeno Orbitali atomici 02/03/2008 Antonino Polimeno 1 Dai modelli primitivi alla meccanica quantistica
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE
 LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
LA STRUTTURA DEGLI ATOMI GLI SPETTRI ATOMICI DI EMISSIONE LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LA RADIAZIONE ELETTROMAGNETICA LO SPETTRO ELETTROMAGNETICO LA QUANTIZZAZIONE DELL
Problemi con l'atomo. Significato delle righe spettrali. Modello dell'atomo
 Problemi con l'atomo Significato delle righe spettrali Modello dell'atomo Righe spettrali della luce emissione e assorbimento Posizione delle righe spettrali Dipende dall'elemento considerato Per l'idrogeno
Problemi con l'atomo Significato delle righe spettrali Modello dell'atomo Righe spettrali della luce emissione e assorbimento Posizione delle righe spettrali Dipende dall'elemento considerato Per l'idrogeno
FISICA QUANTISTICA LIMITI AL MODELLO ATOMICO DI RUTHERFORD. e - Per spiegare la disposizione degli elettroni nell atomo (STRUTTURA ELETTRONICA)
 LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
LIMITI AL MODELLO ATOMICO DI RUTHERFORD e - + nucleo In base alle leggi della FISICA CLASSICA, una particella carica dotata di un movimento circolare libera energia. Di conseguenza, gli elettroni che,
Corso di CHIMICA LEZIONE 2
 Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
Corso di CHIMICA LEZIONE 2 MODELLO ATOMICO DI THOMSON 1904 L atomo è formato da una sfera carica positivamente in cui gli elettroni con carica negativa, distribuiti uniformemente all interno, neutralizzano
mvr = n h e 2 r = m v 2 e m r v = La configurazione elettronica r = e 2 m v 2 (1) Quantizzazione del momento angolare (2) 4 πε.
 La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
La configurazione elettronica Modello atomico di Bohr-Sommerfeld (1913) Legge fondamentale della meccanica classica F = m a. F Coulomb = 1 4 πε. q q ' F r centrifuga = m v r ε =8.85*10-1 Fm-1 (costante
ATOMO. Avogadro (1811) Volumi uguali di gas diversi contengono un ugual numero di MOLECOLE (N A =6,022*10 23 )
 ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
ATOMO Democrito IV secolo A.C. (atomos = indivisibile) Lavoisier (1770) Legge della conservazione della massa in una trasf. chimica es. C + O 2 CO 2 Dalton (1808) Teoria atomica E=mc 2 Avogadro (1811)
Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L.
 Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L. Lozzi Testi degli esercizi svolti in aula Corpo Nero 1. Il corpo
Università degli Studi dell Aquila Corso di Laurea in Scienze e Tecnologie Chimiche e dei Materiali Corso di Fisica della Materia Prof. L. Lozzi Testi degli esercizi svolti in aula Corpo Nero 1. Il corpo
LICEO SCIENTIFICO STATALE "G.B.QUADRI" VICENZA DOCUMENTO DEL CONSIGLIO DI CLASSE (Regolamento, art.5; O. M. 38 art.6) Anno scolastico
 LICEO SCIENTIFICO STATALE "G.B.QUADRI" VICENZA DOCUMENTO DEL CONSIGLIO DI CLASSE (Regolamento, art.5; O. M. 38 art.6) Anno scolastico 2017-2018 RELAZIONE FINALE DEL DOCENTE All. A Classe: 5ESC Indirizzo:
LICEO SCIENTIFICO STATALE "G.B.QUADRI" VICENZA DOCUMENTO DEL CONSIGLIO DI CLASSE (Regolamento, art.5; O. M. 38 art.6) Anno scolastico 2017-2018 RELAZIONE FINALE DEL DOCENTE All. A Classe: 5ESC Indirizzo:
inadeguatezza della fisica classica aspetti corpuscolari della radiazione aspetti ondulatori della materia cenni di meccanica quantistica
 breve introduzione alla fisica moderna inadeguatezza della fisica classica aspetti corpuscolari della radiazione aspetti ondulatori della materia cenni di meccanica quantistica 1 La Fisica Classica alla
breve introduzione alla fisica moderna inadeguatezza della fisica classica aspetti corpuscolari della radiazione aspetti ondulatori della materia cenni di meccanica quantistica 1 La Fisica Classica alla
Appunti di Meccanica Quantistica prima parte
 Appunti di Meccanica Quantistica prima parte Paolo Cavallo 4 marzo 2004 Sommario Le idee principali della Meccanica Quantistica sono presentate in maniera elementare nel contesto dell ultimo anno della
Appunti di Meccanica Quantistica prima parte Paolo Cavallo 4 marzo 2004 Sommario Le idee principali della Meccanica Quantistica sono presentate in maniera elementare nel contesto dell ultimo anno della
La struttura degli atomi
 1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
1 La struttura degli atomi pg. 298 27-28 31-37 43 47 51-53 55-57 61-62 67(a/h) 68(a/i) La struttura degli atomi e gli andamenti periodici pg.332 1-7 11-15 17-18 27-30 37 40-42 51 Solvay conference, 1927
Interferenza di elettroni e! Principio di Indeterminazione
 Interferenza di elettroni e! Principio di Indeterminazione Paolo Pendenza Corso PAS, 10 luglio 2014 Anche nelle scienze non si possono scoprire nuove terre se non si è pronti a lasciarsi indietro il porto
Interferenza di elettroni e! Principio di Indeterminazione Paolo Pendenza Corso PAS, 10 luglio 2014 Anche nelle scienze non si possono scoprire nuove terre se non si è pronti a lasciarsi indietro il porto
Verifica del Principio di Indeterminazione di Heisenberg. x v x cost
 Verifica del Principio di Indeterminazione di Heisenberg x v x cost Il Principio di Indeterminazione di Heisenberg e uno dei principi su cui si fonda la Meccanica Quantistica (MQ) La MQ e la teoria che
Verifica del Principio di Indeterminazione di Heisenberg x v x cost Il Principio di Indeterminazione di Heisenberg e uno dei principi su cui si fonda la Meccanica Quantistica (MQ) La MQ e la teoria che
LASER PRINCIPI FISICI
 Corso di Tecnologie Speciali I LASER PRINCIPI FISICI Università degli Studi di Napoli Federico II Dipartimento di Ingegneria Chimica, dei Materiali e della Produzione Industriale LASER Light Amplification
Corso di Tecnologie Speciali I LASER PRINCIPI FISICI Università degli Studi di Napoli Federico II Dipartimento di Ingegneria Chimica, dei Materiali e della Produzione Industriale LASER Light Amplification
INDICE 1. LA CRISI DELLA FISICA CLASSICA
 INDICE 1. LA CRISI DELLA FISICA CLASSICA 1.1 Modelli atomici... 1 1.2 Il problema delle dimensioni atomiche e del collasso per irraggiamento 4 1.3 Difficoltà connesse con i calori specifici... 7 1.4 L
INDICE 1. LA CRISI DELLA FISICA CLASSICA 1.1 Modelli atomici... 1 1.2 Il problema delle dimensioni atomiche e del collasso per irraggiamento 4 1.3 Difficoltà connesse con i calori specifici... 7 1.4 L
Quarta unità didattica. Disposizione degli elettroni nell atomo
 Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
Quarta unità didattica Disposizione degli elettroni nell atomo Modello atomico di Bohr 1913 L' atomo di Borh consiste in un nucleo di carica positiva al quale ruotano intorno gli elettroni di carica negativa
La Natura della Luce: dalle Scoperte alle Applicazioni
 La Natura della Luce: dalle Scoperte alle Applicazioni Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 27 Maggio 2013 Sommario L ottica geometrica
La Natura della Luce: dalle Scoperte alle Applicazioni Luca Salasnich Dipartimento di Fisica e Astronomia Galileo Galilei, Università di Padova, Italy Padova, 27 Maggio 2013 Sommario L ottica geometrica
n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]
![n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm] n l c = velocità di propagazione nel vuoto = m/s l = lunghezza d onda [cm]](/thumbs/92/108343390.jpg) Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
Tavola Mendeleev Quando gli elementi vengono riportati secondo un ordine di peso atomico crescente, le proprietà degli elementi si ripetono ad intervalli regolari c l n n l c = velocità di propagazione
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno:
 La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
La Teoria dell Atomo di Bohr Modello di Bohr dell atomo di idrogeno: Vedi documento Atomo di Bohr.pdf sul materiale didattico per la derivazione di queste equazioni Livelli Energetici dell Atomo di Idrogeno
A Cosa serve l'ottica?
 A Cosa serve l'ottica? Chiara Vitelli Master Class di Ottica 6 Marzo 2012 Che cos'è l'ottica? Dal mouse wireless al lettore blue ray, gran parte della tecnologia che condiziona la nostra vita si basa sull'ottica.
A Cosa serve l'ottica? Chiara Vitelli Master Class di Ottica 6 Marzo 2012 Che cos'è l'ottica? Dal mouse wireless al lettore blue ray, gran parte della tecnologia che condiziona la nostra vita si basa sull'ottica.
Unità Didattica 3. L atomo di idrogeno
 Diapositiva 1 Unità Didattica 3 L atomo di idrogeno Questa unità contiene informazioni sull atomo di idrogeno, i modelli di Tomson, Ruterford e Bor, l esperimento di Frank-Hertz e infine la formula di
Diapositiva 1 Unità Didattica 3 L atomo di idrogeno Questa unità contiene informazioni sull atomo di idrogeno, i modelli di Tomson, Ruterford e Bor, l esperimento di Frank-Hertz e infine la formula di
Natura ondulatoria della luce. Natura corpuscolare della luce
 Natura ondulatoria della luce Data 1803 Autore Thomas Young Esperimento Un fascio di luce solare viene fatto passare da un foro e davanti a questo foro vi è un pannello con due fenditure verticali (coperte
Natura ondulatoria della luce Data 1803 Autore Thomas Young Esperimento Un fascio di luce solare viene fatto passare da un foro e davanti a questo foro vi è un pannello con due fenditure verticali (coperte
La Crisi della Fisica Classica
 La Crisi della Fisica Classica F. Borgonovi (Dipartimento di Matematica e Fisica) Interdisciplinary Laboratories for Advanced Materials Physics (i-lamp) Department of Mathematics and Physics, Catholic
La Crisi della Fisica Classica F. Borgonovi (Dipartimento di Matematica e Fisica) Interdisciplinary Laboratories for Advanced Materials Physics (i-lamp) Department of Mathematics and Physics, Catholic
Come si può definire la chimica? Quella scienza che studia la composizione, la struttura e le trasformazioni della materia. Cosa si intende per
 Come si può definire la chimica? Quella scienza che studia la composizione, la struttura e le trasformazioni della materia. Cosa si intende per materia?? Uno dei primi interrogativi che gli scienziati
Come si può definire la chimica? Quella scienza che studia la composizione, la struttura e le trasformazioni della materia. Cosa si intende per materia?? Uno dei primi interrogativi che gli scienziati
LE ORIGINI DELLA TEORIA QUANTISTICA
 LE ORIGINI DELLA TEORIA QUANTISTICA LEZIONE N.3 DUALISMO ONDA-PARTICELLA L. Palumbo - Fisica Moderna - 2017-18 1 Legge di Wien (1893) T λ Μ = b L. Palumbo - Fisica Moderna - 2017-18 2 POSTULATO DI PLANCK
LE ORIGINI DELLA TEORIA QUANTISTICA LEZIONE N.3 DUALISMO ONDA-PARTICELLA L. Palumbo - Fisica Moderna - 2017-18 1 Legge di Wien (1893) T λ Μ = b L. Palumbo - Fisica Moderna - 2017-18 2 POSTULATO DI PLANCK
Il modello atomico fino all Ottocento
 Il modello atomico fino all Ottocento Fino a quasi tutto l Ottocento gli atomi vennero considerati, secondo il modello atomico di Dalton, come porzioni di materia indivisibili Il modello, di diretta derivazione
Il modello atomico fino all Ottocento Fino a quasi tutto l Ottocento gli atomi vennero considerati, secondo il modello atomico di Dalton, come porzioni di materia indivisibili Il modello, di diretta derivazione
PROGRAMMAZIONE 5G_ LICEO SCIENTIFICO A.S PROGRAMMAZIONE 5G_LICEO SCIENTIFICO A.S
 PROGRAMMAZIONE 5G_LICEO SCIENTIFICO CONOSCENZE ABILITA COMPETENZE Tutte le tematiche successive -Applicare le relazioni appropriate alla risoluzione dei problemi. Il campo elettrico (richiami e integrazioni)
PROGRAMMAZIONE 5G_LICEO SCIENTIFICO CONOSCENZE ABILITA COMPETENZE Tutte le tematiche successive -Applicare le relazioni appropriate alla risoluzione dei problemi. Il campo elettrico (richiami e integrazioni)
LA CRISI DELLA FISICA CLASSICA III a PARTE
 LA CRISI DELLA FISICA CLASSICA III a PARTE Prof. V.Lubicz Dualità onda-particella - Esperimenti ideali di interferenza con pallottole, onde ed elettroni - Principio di indeterminazione La Meccanica Quantistica
LA CRISI DELLA FISICA CLASSICA III a PARTE Prof. V.Lubicz Dualità onda-particella - Esperimenti ideali di interferenza con pallottole, onde ed elettroni - Principio di indeterminazione La Meccanica Quantistica
La Matematica del Mondo dei Quanti
 La Matematica del Mondo dei Quanti Gerardo Morsella Dipartimento di Matematica Scienza Orienta 2017 Università di Roma Tor Vergata 13 febbraio 2017 Gerardo Morsella (Mat) La Matematica del Mondo dei Quanti
La Matematica del Mondo dei Quanti Gerardo Morsella Dipartimento di Matematica Scienza Orienta 2017 Università di Roma Tor Vergata 13 febbraio 2017 Gerardo Morsella (Mat) La Matematica del Mondo dei Quanti
COMPORTAMENTO DUALISTICO della MATERIA
 COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
COMPORTAMENTO DUALISTICO della MATERIA Come la luce anche la materia assume comportamento dualistico. Equazione di De Broglie: λ = h/mv Per oggetti macroscopici la lunghezza d onda è così piccola da non
Carlo Cosmelli. La visione del mondo della Relatività e della Meccanica Quantistica. Settimana 4. Lezione 4.1 La Meccanica Quantistica Gli inizi
 La visione del mondo della Relatività e della Meccanica Quantistica Settimana 4 Lezione 4.1 La Meccanica Quantistica Gli inizi Carlo Cosmelli 1 Anno 1900: fatti che non tornano, che non si spiegano Il
La visione del mondo della Relatività e della Meccanica Quantistica Settimana 4 Lezione 4.1 La Meccanica Quantistica Gli inizi Carlo Cosmelli 1 Anno 1900: fatti che non tornano, che non si spiegano Il
ATOMI E PARTICELLE SUBATOMICHE
 ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
ATOMI E PARTICELLE SUBATOMICHE ELETTRICITÀ DELL ATOMO ESISTONO DUE TIPI DI CARICHE ELETTRICHE, DENOMINATE CONVENZIONALMENTE NEGATIVA E POSITIVA CARICHE DI SEGNO UGUALE SI RESPINGONO, MENTRE CARICHE DI
L atomo. Il neutrone ha una massa 1839 volte superiore a quella dell elettrone. 3. Le particelle fondamentali dell atomo
 L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
L atomo 3. Le particelle fondamentali dell atomo Gli atomi sono formati da tre particelle fondamentali: l elettrone con carica negativa; il protone con carica positiva; il neutrone privo di carica. Il
3. Struttura dell atomo
 Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
Di cosa parleremo L organizzazione interna delle particelle che costituiscono gli atomi è stata oggetto di studio per lungo tempo e le ipotesi sulla struttura atomica si sono evolute nel tempo in base
LA CRISI DELLA FISICA CLASSICA
 LA CRISI DELLA FISICA CLASSICA I a Parte: - Comportamento corpuscolare della luce II a Parte: - Il modello atomico - Comportamento ondulatorio della materia III a Parte: - Dualità onda-particella: esperimento
LA CRISI DELLA FISICA CLASSICA I a Parte: - Comportamento corpuscolare della luce II a Parte: - Il modello atomico - Comportamento ondulatorio della materia III a Parte: - Dualità onda-particella: esperimento
