La termochimica. Energia in movimento
|
|
|
- Tiziano Fusco
- 5 anni fa
- Visualizzazioni
Transcript
1 La termochimica Energia in movimento
2 Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie in gioco. Sistema termodinamico: porzione dell universo che sia oggetto di studio dal punto di vista termodinamico. Esso è costituito da un numero di particelle molto grande (es. 1 mole di gas). Studio del comportamento del sistema attraverso proprietà MACROSCOPICHE che risultano dal concorso delle proprietà microscopiche delle singole particelle. 2
3 Sistema termodinamico Possiamo perciò descrivere il nostro sistema attraverso la misurazione di alcune proprietà macroscopiche, che dipendono dallo stato in cui si trova il sistema. Queste proprietà si chiamano variabili (o grandezze) di stato. Temperatura (T) come manifestazione macroscopica dell energia cinetica media delle molecole di un gas. Pressione (P) come manifestazione macroscopica degli urti tra le molecole di un gas e le pareti del recipiente.
4 Variabili in un sistema termodinamico Variabili chimiche: servono per rappresentare la composizione del sistema (es. n. di moli, frazioni molari, concentrazioni molari). Variabili fisiche: P, T, V. Proprietà intensive ed estensive Le proprietà macroscopiche di un sistema che non dipendono dalla quantità di materia (massa del sistema) sono dette INTENSIVE. T, P, densità, viscosità Le proprietà che dipendono dalla massa del sistema sono dette ESTENSIVE. V, m, Q Lo stato di un sistema termodinamico Si può dire che un sistema si trova in EQUILIBRIO TERMODINAMICO quando i valori di tutte le variabili che lo descrivono NON cambiano nel tempo. Viceversa, se i valori cambiano nel tempo, il sistema subisce una 4 TRASFORMAZIONE DI STATO.
5 Sistema termodinamico Un sistema può essere aperto: scambia con l ambiente sia energia sia materia chiuso: scambia con l ambiente solo energia e non materia isolato: non scambia con l ambiente né energia né materia. Aperto Chiuso Isolato 5
6 Trasformazioni di stato TRASFORMAZIONI REVERSIBILI: sono rappresentabili in un diagramma di stato. Le trasformazioni reversibili sono ideali e possono essere approssimate nella realtà solo da processi infinitamente lenti (trasformazioni quasi statiche) che avvengono per effetto di gradienti infinitesimali. Le trasformazioni reali, che avvengono in tempi finiti sono IRREVERSIBILI. TRASFORMAZIONI IRREVERSIBILI: non sono rappresentabili in un diagramma di stato. 6
7 1 principio della termodinamica La variazione, positiva o negativa, dell energia di un qualunque sistema chiuso, durante una trasformazione, è uguale all energia di qualsiasi tipo che il sistema riceve dall ambiente o che cede ad esso. Se il sistema è isolato, la variazione dell energia è nulla. Per una trasformazione finita, E= E F -E I = Q + L lavoro calore Per una trasformazione infinitesima, de = δ Q + δl 7
8 Primo principio della termodinamica Convenzione sui segni di Q e L Se il sistema cede calore all ambiente, allora il segno è negativo, così come è negativo il segno del lavoro che il sistema compie sull ambiente. Sono pertanto positivi il segni del lavoro che l ambiente compie sul sistema e del calore che viene ceduto al sistema. L energia interna (E) è una FUNZIONE DI STATO, mentre il lavoro e il calore non lo sono.quindi il valore di E non dipende dal percorso seguito durante la trasformazione, ma solo dallo stato INIZIALE e dal quello FINALE. I valori di Q e L invece dipendono da come avviene la trasformazione. 8
9 Funzione di stato Altezza Energia interna E Nel 1 principio della termodinamica sono contenute 3 idee: il principio di conservazione dell energia equivalenza calore-lavoro l esistenza di una funzione di stato energia interna. 9
10 L energia contenuta all interno del sistema termodinamico è detta energia interna E. L energia interna di un gas dipende solo da T. Durante una trasformazione di stato in sistemi aperti e chiusi ci possono essere trasferimenti di energia. I trasferimenti di energia tra un sistema ed il suo intorno (ambiente) possono avvenire sotto forma di calore (Q) o di lavoro (L). Q e L sono mezzi differenti mediante i quali una quantità di energia può essere scambiata. Il calore rappresenta l energia trasferita in seguito ad una differenza di temperatura, mentre per quanto riguarda il lavoro (meccanico, elettrico, magnetico) si prende in considerazione solo il lavoro meccanico coinvolto nella compressione ed espansione di un gas. 10
11 Lavoro meccanico di espansione P I, V I P F, V F dx δl = F dx F = P A δl = F dx = PAdx δl = - PdV L = -P V L L L = VF V I PdV V F nrt = dv VI V VF = nrt ln V I 11
12 Lavoro meccanico 1) Espansione isoterma a K 2) Trasformazione a P cost ( P = P I ), poi trasformazione a V cost (V= V F ) 3) Trasformazione a V cost (V = V I ), poi trasformazione a P cost (P = P F ) P I.. F V P I. Il lavoro meccanico (rappresentato dall area sottesa alla curva relativa alla trasformazione considerata) dipende quindi dal tipo di trasformazione che il sistema compie. L è massimo nelle trasformazioni reversibili (L irr < L rev ). Nelle trasformazioni con P e = 0, L=0; inoltre, se il sistema è isolato, cioè si ha un espansione adiabatica libera, Q = 0, quindi E f = E i, e pertanto E= F V P I.. F V
13 Il calore scambiato 1) Volume costante, solo lavoro meccanico, δl = -PdV ma dv = 0 de = δq v oppure E = Q v 2) Pressione costante, solo lavoro meccanico, d(pv) = PdV δq p = de + PdV = de + d(pv) = d(e+pv) e definiamo H = E + PV come ENTALPIA che si rappresenta con H. δq p = dh Per un gas ideale è E = E(T) e PV = nrt H = H(T) 13
14 Per una trasformazione finita, H = E + (PV) H = E + P V = Q P Q p = E + (PV) = E + P V = Q v + P V Capacità termiche Possiamo definire CAPACITÀ TERMICA MEDIA il rapporto: mentre, C = Q T lim T 0 Q T = δq dt = C CAPACITÀ TERMICA, grandezza estensiva, J K -1, cal K -1 14
15 Calore specifico Dividendo la capacità termica per la massa del corpo si ottiene il CALORE SPECIFICO, grandezza intensiva, J g -1 K -1, cal g -1 K -1 Dividendo la capacità termica per il numero di moli si ottiene il CALORE MOLARE, grandezza intensiva, J mol -1 K -1, cal mol -1 K -1 Occorre specificare bene il modo in cui vengono misurate queste grandezze, perché Q dipende dal tipo di trasformazione. Se manteniamo V costante, misuriamo Q V e quindi esprimiamo C V C V Q = δ dt V = E T V Se invece operiamo a P costante, misuriamo Q P e quindi esprimiamo C P C P Q = δ dt P = H T P 15
16 Termochimica Il Calore di reazione è definito come l effetto termico che accompagna una data reazione chimica. La maggior parte delle reazioni chimiche sono condotte a T e P costanti, per cui il calore ad esse associato è rappresentato dalla variazione di entalpia H. Reazioni endotermiche: calore di reazione positivo. Reazione esotermiche: calore di reazione negativo. Come misuriamo il calore di reazione? Gli strumenti utilizzati si chiamano CALORIMETRI. Dobbiamo però precisare se la reazione avviene a volume costante o pressione costante. 16
17 Termochimica Termochimica: studia il CALORE associato alle reazioni chimiche Volume costante Q v = E E: energia interna Pressione costante Q p = H H: entalpia Sono funzioni di stato: dipendono soltanto dagli stati iniziale e finale del sistema (tipo e quantità di reagenti e prodotti; condizioni di reazione) a A + b B +... l L + m M + Q p = H = (lh L + m H M + ) - (a H A + bh B + ) = ν i H i Q V = E = (le L + m E M + ) - (a E A + be B + ) = ν i E i H i, E i : entalpia molare ed energia interna molare del componente i ν i : coefficiente stechiometrico del componente i (segno + se è un prodotto, segno - se è un reagente) 17
18 Per una reazione chimica: H = E + P V Se i reagenti e i prodotti sono solidi o liquidi, in genere sarà: V 0 H = E Se invece alla reazione partecipano dei gas, quindi: P V = n RT dove n = n F - n I Q P = Q V + n RT 18
19 Equazioni termochimiche: Equazione stechiometrica, insieme all indicazione del calore di reazione, delle condizioni di temperatura e pressione nelle quali la reazione è stata osservata e dello stato fisico in cui si trova ciascun reagente e prodotto: C (s,gr) + O 2(g) CO 2(g) H (25 C, 1atm) = KJ/mol H 2(g) + 1 / 2 O 2(g) H 2 O (g) H (25 C, 1atm) = KJ/mol H 2(g) + 1 / 2 O 2(g) H 2 O (l) H (25 C, 1atm) = KJ/mol Occorre perciò specificare: l unità di misura con cui è espresso il calore; il numero di moli di tutte le sostanze; lo stato di aggregazione di ogni sostanza; la temperatura e la pressione a cui la reazione è condotta. 19
20 Equazioni termochimiche Per uniformare i dati calorimetrici è necessario stabilire uno stato di riferimento detto stato standard: Gas gas ideale alla pressione di 1 atm. Liquidi liquido puro alla pressione di 1 atm. Solidi solido puro alla pressione di 1 atm. Se il solido presenta più forme cristalline, si considera la forma cristallina stabile alla temperatura considerata e a P = 1 atm. Per i solidi polimorfi (allotropi) è importante precisare anche la forma (es. S α, C grafite). Nota: la temperatura non compare nella definizione di stato standard; in genere, i dati sono tabulati alla temperatura di 25 C. Quando ci si riferisce allo stato standard si scrive H o H. 20
21 Entalpie standard di reazione Si definisce variazione di entalpia standard di una reazione ( H ) l effetto termico che accompagna la reazione quando sia i prodotti sia i reagenti si trovano nel loro stato standard e reagiscono secondo i rapporti molari indicati nell equazione, a T e P costanti. I valori della variazione di entalpia standard di una reazione sono solitamente riportati a 25 C. H 2 (g) + ½ O 2 (g) H 2 O (g) H (25 C) = - 242,0 KJ Le reazioni esotermiche, caratterizzate da sviluppo di calore, presentano H <0. Le reazioni endotermiche, caratterizzate da assorbimento di calore, presentano H >0. L entalpia di reazione dipende dalla pressione, dalla temperatura e dallo stato in cui trovano reagenti e prodotti. a A + b B +... l L + m M + H REAZ = (l H L + m H M + ) - (a H A + b H B + ) =ν i H i H i : entalpia molare standard del componente i 21
22 Entalpie molari standard di formazione H f Reazione di formazione di un composto: reazione in cui il composto considerato si forma dagli elementi costituenti. Variazione di entalpia molare standard di formazione ( H f ): entalpia standard della reazione che porta alla formazione di 1 mole del composto considerato a partire dagli elementi che lo compongono. Assumiamo, per convenzione, che sia NULLA l entalpia standard di formazione di tutti gli elementi, nella loro forma più stabile. Quindi per gli elementi nel loro stato standard H f = H f = 0 a tutte le temperature. Per la reazione: S (s, α ) + O 2(g) SO 2(g) H o f = kj/mol H ma H o f (SO2,g) H o o f (SO2,g) = (O2,g) = H = H o o (SO2,g) H o (S,s, α ) (SO2,g) [ ] o o H + H = 0 (O2,g) (S,s, α ) = 22
23 1 / 2 H 2(g) + 1 / 2 Cl 2(g) HCl (g) H f, HCl = H f, HCl - ( 1 / 2 H H / 2 H Cl 2 ) = H f, HCl = H f, HCl = KJ/mol C (s,gr) + O 2(g) CO 2(g) H 2(g) + 1 / 2 O 2(g) H 2 O (g) H f(25 C) = KJ/mol H f(25 C) = KJ/mol 1 / 2 H 2(g) + 1 / 2 Cl 2(g) HCl (g) H f(25 C) = KJ/mol 23
24 Entalpie standard di combustione Reazione di combustione: reazione di un elemento o di un composto con ossigeno (con formazione di H 2 O e CO 2 ). CH + 2O CO + 4 (g) 2(g) 2(g) 2H O Misurando, con un calorimetro, il calore di combustione, cioè l effetto termico che accompagna la reazione di combustione, si determinano sperimentalmente i valori di H comb. Questi valori possono essere utili per il calcolo di H f per reazioni che non possono essere studiate direttamente (attraverso la legge di Hess). Variazione di entalpia molare standard di combustione ( H comb ): entalpia standard della reazione di combustione di 1 mole dell elemento o del composto considerato. C (s,gr) + O 2(g) CO 2(g) 2 (l) H comb (25 C) = -394 KJ/mol H 2(g) + 1 / 2 O 2(g) H 2 O (l) H comb (25 C) = -286 KJ/mol CH 4(g) + 2 O 2(g) 2 H 2 O (l) + CO 2(g) H comb (25 C) = -891 KJ/mol 24
25 La legge di Hess In una reazione chimica l effetto termico a pressione costante è indipendente dagli stati intermedi attraverso i quali la reazione passa (o si immagina che passi), ma dipende solo dagli stati iniziali e da quelli finali. H I-A I A H I-F F B H B-F L entalpia è una funzione di stato ed è per questo che l entalpia complessiva di una reazione è la somma delle entalpie dei vari stadi in cui la reazione può essere scomposta. H A-B H I-F = H I-A + H A-B + H B-F 25
La termochimica. Energia in movimento
 La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
La termochimica Energia in movimento Sistema termodinamico La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
TERMODINAMICA 28/10/2015 SISTEMA TERMODINAMICO
 TERMODINAMICA Studia quale è la forza propulsiva delle reazioni chimiche valutando le proprietà macroscopiche di un sistema. Si può in tale modo sapere se una reazione procede spontaneamente. Si occupa
TERMODINAMICA Studia quale è la forza propulsiva delle reazioni chimiche valutando le proprietà macroscopiche di un sistema. Si può in tale modo sapere se una reazione procede spontaneamente. Si occupa
Termochimica. La termochimica si occupa dell effetto termico associato alle reazioni chimiche. E i = energia interna molare H i = entalpia molare
 Termochimica La termochimica si occupa dell effetto termico associato alle reazioni chimiche. + +... + +... E i energia interna molare H i entalpia molare ( + +...) ( + +...) ν ( + +...) ( + +...) ν 1
Termochimica La termochimica si occupa dell effetto termico associato alle reazioni chimiche. + +... + +... E i energia interna molare H i entalpia molare ( + +...) ( + +...) ν ( + +...) ( + +...) ν 1
Termodinamica: studio dei trasferimenti di energia
 Termodinamica: studio dei trasferimenti di energia Termodinamica chimica: 1. variazione di energia associata ad una trasformazione 2. spontaneità di una trasformazione Si basa su tre principi (leggi) e
Termodinamica: studio dei trasferimenti di energia Termodinamica chimica: 1. variazione di energia associata ad una trasformazione 2. spontaneità di una trasformazione Si basa su tre principi (leggi) e
Definizioni: sistema ambiente sistema isolato sistema chiuso sistema adiabatico stato di un sistema. Termodinamica
 Definizioni: Termodinamica sistema ambiente sistema isolato sistema chiuso sistema adiabatico stato di un sistema Proprietà macroscopiche di un sistema intensive: sono indipendenti dalla massa del sistema
Definizioni: Termodinamica sistema ambiente sistema isolato sistema chiuso sistema adiabatico stato di un sistema Proprietà macroscopiche di un sistema intensive: sono indipendenti dalla massa del sistema
TERMODINAMICA E TERMOCHIMICA
 TERMODINAMICA E TERMOCHIMICA La TERMODINAMICA è una scienza chimico-fisica che studia le trasformazioni dell energia. La TERMOCHIMICA è una particolare branca della termodinamica che valuta quantitativamente
TERMODINAMICA E TERMOCHIMICA La TERMODINAMICA è una scienza chimico-fisica che studia le trasformazioni dell energia. La TERMOCHIMICA è una particolare branca della termodinamica che valuta quantitativamente
Il I principio della termodinamica. Calore, lavoro ed energia interna
 Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Il I principio della termodinamica Calore, lavoro ed energia interna Riassunto Sistemi termodinamici Un sistema termodinamico è una porzione di materia descritto da funzioni di stato che ne caratterizzano
Sistemi termodinamici. I sistemi aperti e chiusi possono essere adiabatici quando non è consentito lo scambio di calore
 Sistemi termodinamici Sistema: regione dello spazio oggetto delle nostre indagini. Ambiente: tutto ciò che circonda un sistema. Universo: sistema + ambiente Sistema aperto: sistema che consente scambi
Sistemi termodinamici Sistema: regione dello spazio oggetto delle nostre indagini. Ambiente: tutto ciò che circonda un sistema. Universo: sistema + ambiente Sistema aperto: sistema che consente scambi
Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire.
 Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire. Molte reazioni procedono in modo incompleto; è importante quindi determinare
Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire. Molte reazioni procedono in modo incompleto; è importante quindi determinare
Energia e trasformazioni spontanee
 Energia e trasformazioni spontanee Durante le trasformazioni (sia chimiche che fisiche) la materia acquista o cede energia. La termodinamica è quella scienza che studia le variazioni di energia in una
Energia e trasformazioni spontanee Durante le trasformazioni (sia chimiche che fisiche) la materia acquista o cede energia. La termodinamica è quella scienza che studia le variazioni di energia in una
Termochimica. Tutte le trasformazioni della materia, chimiche e fisiche, sono accompagnate da variazioni di energia.
 Termochimica Tutte le trasformazioni della materia, chimiche e fisiche, sono accompagnate da variazioni di energia. Per osservare e misurare variazioni di energia dobbiamo definire: sistema: porzione di
Termochimica Tutte le trasformazioni della materia, chimiche e fisiche, sono accompagnate da variazioni di energia. Per osservare e misurare variazioni di energia dobbiamo definire: sistema: porzione di
TERMODINAMICA E TERMOCHIMICA
 TERMODINAMICA E TERMOCHIMICA Termodinamica E la scienza delle relazioni tra calore ed altre forme di energia; determina quali processi chimici e fisici sono spontanei; non prende in considerazione la variabile
TERMODINAMICA E TERMOCHIMICA Termodinamica E la scienza delle relazioni tra calore ed altre forme di energia; determina quali processi chimici e fisici sono spontanei; non prende in considerazione la variabile
Termodinamica e Termochimica
 Termodinamica e Termochimica Mattia Natali 25 luglio 2011 Indice 1 Termochimica 1 1.1 Energia, sistemi, calore.................................... 1 1.2 Misure del calore.......................................
Termodinamica e Termochimica Mattia Natali 25 luglio 2011 Indice 1 Termochimica 1 1.1 Energia, sistemi, calore.................................... 1 1.2 Misure del calore.......................................
TERMODINAMICA. Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico
 TERMODINAMICA Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico Essa si basa sullo sviluppo di tre leggi che non sono derivate matematicamente,
TERMODINAMICA Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico Essa si basa sullo sviluppo di tre leggi che non sono derivate matematicamente,
Termodinamica. studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro.
 Termodinamica studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro. La termodinamica parte da osservazioni sperimentali e quindi si esprime
Termodinamica studia le modificazioni subite da un sistema a seguitodel trasferimento di energia sotto forma di calore e lavoro. La termodinamica parte da osservazioni sperimentali e quindi si esprime
Capitolo 16 L energia si trasferisce
 Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Capitolo 16 L energia si trasferisce 1. L «ABC» dei trasferimenti energetici 2. Le reazioni scambiano energia con l ambiente 3. Durante le reazioni varia l energia chimica del sistema 4. L energia chimica
Il primo principio della termodinamica Argomenti
 Il primo principio della termodinamica Termodinamica (generalità) 1 principio della termodinamica Argomenti Definizione di sistema termodinamico Funzioni di stato (generalità) Esercizi Obiettivi Conoscere
Il primo principio della termodinamica Termodinamica (generalità) 1 principio della termodinamica Argomenti Definizione di sistema termodinamico Funzioni di stato (generalità) Esercizi Obiettivi Conoscere
Termodinamica. Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico
 Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
relazioni tra il calore e le altre forme di energia.
 Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
TERMODINAMICA. Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico
 TERMODINAMICA TERMODINAMICA Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico Essa si basa sullo sviluppo di tre leggi che non sono derivate
TERMODINAMICA TERMODINAMICA Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico Essa si basa sullo sviluppo di tre leggi che non sono derivate
Corso di Fisica Tecnica Ambientale. Introduzione alla Termodinamica: terminologia
 Introduzione alla Termodinamica: terminologia Termodinamica La Termodinamica è la scienza che studia le modificazioni subite da un sistema in conseguenza del trasferimento di energia principalmente sotto
Introduzione alla Termodinamica: terminologia Termodinamica La Termodinamica è la scienza che studia le modificazioni subite da un sistema in conseguenza del trasferimento di energia principalmente sotto
SCIENZA DEI MATERIALI. Chimica Fisica. VI Lezione. Dr. Fabio Mavelli. Dipartimento di Chimica Università degli Studi di Bari
 SCIENZA DEI MATERIALI Chimica Fisica VI Lezione Dr. Fabio Mavelli Dipartimento di Chimica Università degli Studi di Bari Energia Libera di Helmholtz F 2 Definiamo la funzione di stato Energia Libera di
SCIENZA DEI MATERIALI Chimica Fisica VI Lezione Dr. Fabio Mavelli Dipartimento di Chimica Università degli Studi di Bari Energia Libera di Helmholtz F 2 Definiamo la funzione di stato Energia Libera di
Termodinamica chimica
 I processi naturali hanno un verso spontaneo di evoluzione (es. gas si espandono, caduta dei gravi nell aria, una palla che rotola su di un piano inclinato) E possibile condurre i processi opposti solo
I processi naturali hanno un verso spontaneo di evoluzione (es. gas si espandono, caduta dei gravi nell aria, una palla che rotola su di un piano inclinato) E possibile condurre i processi opposti solo
TERMODINAMICA. Scienza che studia le relazioni tra il calore e le altre forme di i energia coinvolte in un processo fisico o chimico
 TERMODINAMICA Scienza che studia le relazioni tra il calore e le altre forme di i energia coinvolte in un processo fisico o chimico Essa si basa sullo sviluppo di tre leggi che non sono derivate matematicamente,
TERMODINAMICA Scienza che studia le relazioni tra il calore e le altre forme di i energia coinvolte in un processo fisico o chimico Essa si basa sullo sviluppo di tre leggi che non sono derivate matematicamente,
SISTEMA TERMODINAMICO STATO TERMODINAMICO
 SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
Termodinamica classica
 Termodinamica classica sistema termodinamico: insieme di corpi di cui si studiano le proprieta fisiche macroscopiche e le loro variazioni nel tempo ambiente termodinamico: insieme dei corpi con cui il
Termodinamica classica sistema termodinamico: insieme di corpi di cui si studiano le proprieta fisiche macroscopiche e le loro variazioni nel tempo ambiente termodinamico: insieme dei corpi con cui il
TERMODINAMICA. Studia le trasformazioni dei sistemi in relazione agli scambi di calore e lavoro. GENERALITÀ SUI SISTEMI TERMODINAMICI
 TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
Esercitazione 8. Soluzione Il rendimento di una macchina di Carnot in funzione delle temperature è: η = 1 T 2 T 1 = = 60%
 Esercitazione 8 Esercizio 1 - Macchina di arnot Una macchina di arnot assorbe una certa quantità di calore Q 1 da una sorgente a temperatura T 1 e cede calore Q 2 ad una seconda sorgente a temperatura
Esercitazione 8 Esercizio 1 - Macchina di arnot Una macchina di arnot assorbe una certa quantità di calore Q 1 da una sorgente a temperatura T 1 e cede calore Q 2 ad una seconda sorgente a temperatura
Lezione n. 5. Entalpia. a volume costante a pressione costante Calorimetria differenziale Reazione esotermiche ed endotermiche Legge di Hess
 himica Fisica - himica e Tecnologia Farmaceutiche Lezione n. 5 Entalpia alorimetria a volume costante alorimetria a pressione costante alorimetria differenziale Reazione esotermiche ed endotermiche Legge
himica Fisica - himica e Tecnologia Farmaceutiche Lezione n. 5 Entalpia alorimetria a volume costante alorimetria a pressione costante alorimetria differenziale Reazione esotermiche ed endotermiche Legge
Lezione n. 4. Lavoro e calore Misura di lavoro e calore Energia interna. 04/03/2008 Antonino Polimeno 1
 Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 4 Lavoro e calore Misura di lavoro e calore Energia interna 04/03/2008 Antonino Polimeno 1 Sommario (1) - Un sistema termodinamico è una porzione
Chimica Fisica - Chimica e Tecnologia Farmaceutiche Lezione n. 4 Lavoro e calore Misura di lavoro e calore Energia interna 04/03/2008 Antonino Polimeno 1 Sommario (1) - Un sistema termodinamico è una porzione
TERMODINAMICA CHIMICA
 TERMODINAMICA CHIMICA Si definisce FUNZIONE DI STATO una variabile il cui valore dipende solo dallo stato iniziale e finale del sistema e non dal cammino percorso nella trasformazione effettuata Sono funzioni
TERMODINAMICA CHIMICA Si definisce FUNZIONE DI STATO una variabile il cui valore dipende solo dallo stato iniziale e finale del sistema e non dal cammino percorso nella trasformazione effettuata Sono funzioni
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Termodinamica. qualunque reazione può essere studiata t trascurando completamente t il modo in cui essa evolve dai reagenti ai prodotti.
 Termodinamica Calore e lavoro sono modi diversi con cui l energia si può manifestare durante una reazione chimica: La Termodinamica studia le relazioni esistenti tra CALORE, LAVORO e ENERGIA in una qualsiasi
Termodinamica Calore e lavoro sono modi diversi con cui l energia si può manifestare durante una reazione chimica: La Termodinamica studia le relazioni esistenti tra CALORE, LAVORO e ENERGIA in una qualsiasi
Termodinamica I. Primo Principio della Termodinamica
 Termodinamica I Primo Principio della Termodinamica Termodinamica La termodinamica si interessa delle trasformazioni energe6che che si verificano nei processi chimico- fisici. Non possiamo però predire
Termodinamica I Primo Principio della Termodinamica Termodinamica La termodinamica si interessa delle trasformazioni energe6che che si verificano nei processi chimico- fisici. Non possiamo però predire
Entalpia. L'entalpia è una funzione di stato ed è una grandezza estensiva. dh=du+pdv+vdp --> du+pdv = dh - Vdp
 Entalpia Si definisce entalpia la grandezza H ( 1 H = U + pv L'entalpia è una funzione di stato ed è una grandezza estensiva. Differenziando la (1) si ha dh=du+pdv+vdp --> du+pdv = dh - Vdp In una generica
Entalpia Si definisce entalpia la grandezza H ( 1 H = U + pv L'entalpia è una funzione di stato ed è una grandezza estensiva. Differenziando la (1) si ha dh=du+pdv+vdp --> du+pdv = dh - Vdp In una generica
Il fine è quello di individuare reazioni energeticamente convenienti
 Introduzione Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire. Molte reazioni procedono in modo incompleto e raggiungono uno
Introduzione Un problema di grande interesse è la possibilità di prevedere se due o più sostanze poste a contatto sono in grado di reagire. Molte reazioni procedono in modo incompleto e raggiungono uno
SISTEMA TERMODINAMICO STATO TERMODINAMICO
 SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
SISTEMA TERMODINAMICO Sistema macroscopico (gas, liquido, solido) chimicamente definito, composto da un grande numero di atomi o molecole. In una mole di sostanza: N 6,02 10 23 Isolato: non scambia né
Termochimica : studio della variazione di entalpia nelle reazioni chimiche
 Termochimica : studio della variazione di entalpia nelle reazioni chimiche generalmente le reazioni chimiche avvengono con scambio di calore tra sistema e ambiente in condizioni di P costante a P costante,
Termochimica : studio della variazione di entalpia nelle reazioni chimiche generalmente le reazioni chimiche avvengono con scambio di calore tra sistema e ambiente in condizioni di P costante a P costante,
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
Calore, lavoro e trasformazioni termodinamiche (1)
 Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
Calore, lavoro e trasformazioni termodinamiche (1) Attraverso scambi di calore un sistema scambia energia con l ambiente. Tuttavia si scambia energia anche quando le forze (esterne e interne al sistema)
BIOLOGIA A. A CHIMICA
 Laurea triennale in BIOLOGIA A. A. 03-4 4 CHIMICA Lezioni di Chimica Fisica rof. Antonio Toffoletti Conversione di una grandezza tra unità di misura differenti Uno scienziato ha misurato la pressione atmosferica
Laurea triennale in BIOLOGIA A. A. 03-4 4 CHIMICA Lezioni di Chimica Fisica rof. Antonio Toffoletti Conversione di una grandezza tra unità di misura differenti Uno scienziato ha misurato la pressione atmosferica
Energia e reazioni chimiche. Cap , 19-21, 27-30, 47-48, 50, 59-62
 2016-2017 CCS Biologia CCS Scienze Geologiche 1 Energia e reazioni chimiche Cap 5. 7-13, 19-21, 27-30, 47-48, 50, 59-62 2009 Brooks/Cole - Cengage Energia & Chimica 2 ENERGIA è la capacità di compiere
2016-2017 CCS Biologia CCS Scienze Geologiche 1 Energia e reazioni chimiche Cap 5. 7-13, 19-21, 27-30, 47-48, 50, 59-62 2009 Brooks/Cole - Cengage Energia & Chimica 2 ENERGIA è la capacità di compiere
TERMODINAMICA I PRINCIPIO DELLA TERMODINAMICA DU = Q - W
 TERMODINAMICA Scambi di CALORE e LAVORO tra: SISTEMA AMBIENTE UNIVERSO APERTO SCAMBIA ENERGIA E MATERIA SISTEMA CHIUSO SCAMBIA ENERGIA, NON MATERIA ISOLATO NON SCAMBIA ENERGIA NE MATERIA ENERGIA INTERNA
TERMODINAMICA Scambi di CALORE e LAVORO tra: SISTEMA AMBIENTE UNIVERSO APERTO SCAMBIA ENERGIA E MATERIA SISTEMA CHIUSO SCAMBIA ENERGIA, NON MATERIA ISOLATO NON SCAMBIA ENERGIA NE MATERIA ENERGIA INTERNA
Programma: a che punto siamo? Sistema, equilibrio e fase Tre concetti fondamentali. Definizione di sistema in termodinamica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che punto siamo? Lezioni 19-20 2010 Sistema, equilibrio e fase Tre concetti fondamentali Definizione di sistema
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Programma: a che punto siamo? Lezioni 19-20 2010 Sistema, equilibrio e fase Tre concetti fondamentali Definizione di sistema
Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 19-20 2009 Programma: a che punto siamo? Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Lezioni 19-20 2009 Programma: a che punto siamo? Sistema, equilibrio e fase Tre concetti fondamentali Sistema: la parte del
Bilancio di energia: il Primo Principio della Termodinamica. Termodinamica dell Ingegneria Chimica
 Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Dinamica delle reazioni chimiche (attenzione: mancano i disegni)
 Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Chimica Generale ed Inorganica: Programma del Corso
 Chimica Generale ed Inorganica: Programma del Corso Gli atomi I legami chimici Forma e struttura delle molecole Le proprietà dei gas Liquidi e solidi Termodinamica Equilibri fisici Equilibri chimici Equilibri
Chimica Generale ed Inorganica: Programma del Corso Gli atomi I legami chimici Forma e struttura delle molecole Le proprietà dei gas Liquidi e solidi Termodinamica Equilibri fisici Equilibri chimici Equilibri
Limiti del criterio della variazione entropia
 Limiti del criterio della variazione entropia S universo = S sistema + S ambiente > 0 (nei processi irreversibili) S universo = S sistema + S ambiente = 0 (nei processi reversibili) Dalla valutazione di
Limiti del criterio della variazione entropia S universo = S sistema + S ambiente > 0 (nei processi irreversibili) S universo = S sistema + S ambiente = 0 (nei processi reversibili) Dalla valutazione di
Termochimica : studio della variazione di entalpia nelle reazioni chimiche e nelle transizioni di fase
 Termochimica : studio della variazione di entalpia nelle reazioni chimiche e nelle transizioni di fase generalmente questi processi chimici e avvengono con scambio di calore tra sistema e ambiente in condizioni
Termochimica : studio della variazione di entalpia nelle reazioni chimiche e nelle transizioni di fase generalmente questi processi chimici e avvengono con scambio di calore tra sistema e ambiente in condizioni
Dalle soluzioni alla chimica del carbonio
 Dalle soluzioni alla chimica del carbonio Capitolo 9 Energia e velocità delle reazioni chimiche Unità 27 Energia di sistemi chimici 9.1 Energia di legame ed energia chimica 9.2 Primo principio della termodinamica
Dalle soluzioni alla chimica del carbonio Capitolo 9 Energia e velocità delle reazioni chimiche Unità 27 Energia di sistemi chimici 9.1 Energia di legame ed energia chimica 9.2 Primo principio della termodinamica
PCl5 (g) <====> PCl3(g) + Cl2(g)
 ESERCITAZIONE 10 DISSOCIAZIONE TERMICA Alcuni gas si decompongono per effetto del riscaldamento in altre sostanze, che possono essere tutte o solo in parte gassose. Ad esempio: PCl5 (g) PCl3(g)
ESERCITAZIONE 10 DISSOCIAZIONE TERMICA Alcuni gas si decompongono per effetto del riscaldamento in altre sostanze, che possono essere tutte o solo in parte gassose. Ad esempio: PCl5 (g) PCl3(g)
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
TERMODINAMICA. CONVENZIONE STORICA Q > 0 assorbito dal sistema W>0 fatto dal sistema Q < 0 ceduto dal sistema W<0 fatto sul sistema
 TERMODINAMICA Scambi di CALORE e LAVORO tra: SISTEMA AMBIENTE UNIVERSO kaperto SCAMBIA ENERGIA E MATERIA SISTEMA CHIUSO SCAMBIA ENERGIA, NON MATERIA m ISOLATO NON SCAMBIA ENERGIA NE MATERIA ENERGIA INTERNA
TERMODINAMICA Scambi di CALORE e LAVORO tra: SISTEMA AMBIENTE UNIVERSO kaperto SCAMBIA ENERGIA E MATERIA SISTEMA CHIUSO SCAMBIA ENERGIA, NON MATERIA m ISOLATO NON SCAMBIA ENERGIA NE MATERIA ENERGIA INTERNA
Lezione Generalità e definizioni (Seconda parte)
 Lezione Generalità e definizioni (Seconda parte) Trasformazioni quasi statiche Trasformazioni cicliche Trasformazioni reversibili Lavoro di variazione di volume Lavoro di variazione di volume per trasformazioni
Lezione Generalità e definizioni (Seconda parte) Trasformazioni quasi statiche Trasformazioni cicliche Trasformazioni reversibili Lavoro di variazione di volume Lavoro di variazione di volume per trasformazioni
TERMODINAMICA Per lo studio scientifico di un problema occorre separare idealmente una regione di spazio limitata ( sistema ) da tutto ciò che la
 ERMODINAMICA Per lo studio scientifico di un problema occorre separare idealmente una regione di spazio limitata ( sistema ) da tutto ciò che la circonda e può influenzarne il comportamento ( ambiente
ERMODINAMICA Per lo studio scientifico di un problema occorre separare idealmente una regione di spazio limitata ( sistema ) da tutto ciò che la circonda e può influenzarne il comportamento ( ambiente
GAS IDEALI E MACCHINE TERMICHE. G. Pugliese 1
 GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
GAS IDEALI E MACCHINE TERMICHE G. Pugliese 1 Proprietà dei gas 1. Non hanno forma né volume proprio 2. Sono facilmente comprimibili 3. Le variabili termodinamiche più appropriate a descrivere lo stato
Definiamo Entalpia la funzione: DH = DU + PDV. Variando lo stato del sistema possiamo misurare la variazione di entalpia: DU = Q - PDV.
 Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
C- CALORE / LAVORO / PRIMO PRINCIPIO
 C- CALORE / LAVORO / PRIMO PRINCIPIO SISTEMA TERMODINAMICO SISTEMA IL CUI COMPORTAMENTO PUO' ESSERE DETERMINATO E DESCRITTO PER MEZZO DI POCHE GRANDEZZE GLOBALI (PRESSIONE, TEMPERATURA, ECC.), SENZA CONOSCERE
C- CALORE / LAVORO / PRIMO PRINCIPIO SISTEMA TERMODINAMICO SISTEMA IL CUI COMPORTAMENTO PUO' ESSERE DETERMINATO E DESCRITTO PER MEZZO DI POCHE GRANDEZZE GLOBALI (PRESSIONE, TEMPERATURA, ECC.), SENZA CONOSCERE
Semplice introduzione ai principi della termodinamica. prof. Carlucci Vincenzo ITIS Einstein Potenza
 Semplice introduzione ai principi della termodinamica prof. Carlucci Vincenzo ITIS Einstein Potenza 1 Quando la scienza studia determinati problemi, la prima operazione da compiere è quella di individuare
Semplice introduzione ai principi della termodinamica prof. Carlucci Vincenzo ITIS Einstein Potenza 1 Quando la scienza studia determinati problemi, la prima operazione da compiere è quella di individuare
2) Primo principio della Termodinamica
 2) Primo principio della Termodinamica Antefatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica
2) Primo principio della Termodinamica Antefatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale Energia() = energia cinetica
Il secondo principio della termodinamica
 Il secondo principio della termodinamica 1 Il secondo principio Il primo principio della termodinamica introduce la funzione energia interna, U, che ci permette di dire se una certa trasformazione è possibile:
Il secondo principio della termodinamica 1 Il secondo principio Il primo principio della termodinamica introduce la funzione energia interna, U, che ci permette di dire se una certa trasformazione è possibile:
TERMODINAMICA CHIMICA
 http://www. TERMODINAMICA CHIMICA SCOPI DELLA TERMODINAMICA CHIMICA In genere le reazioni chimiche avvengono con sviluppo o con assorbimento di calore: per esempio,la combustione è un tipo di reazione
http://www. TERMODINAMICA CHIMICA SCOPI DELLA TERMODINAMICA CHIMICA In genere le reazioni chimiche avvengono con sviluppo o con assorbimento di calore: per esempio,la combustione è un tipo di reazione
Primo Principio della termodinamica
 Primo Principio della termodinamica 1 FORME DI ENERGIA Esistono diverse forme di energia In un sistema la somma di tutte le forme di energia è detta energia totale E del sistema. La Termodinamica studia
Primo Principio della termodinamica 1 FORME DI ENERGIA Esistono diverse forme di energia In un sistema la somma di tutte le forme di energia è detta energia totale E del sistema. La Termodinamica studia
GLI STATI DI AGGREGAZIONE DELLA MATERIA. Lo stato gassoso
 GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
GLI STATI DI AGGREGAZIONE DELLA MATERIA Lo stato gassoso Classificazione della materia MATERIA Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (volume e forma propri) LIQUIDO
TERMOCHIMICA. Studio del calore in gioco in una reazione chimica. Le reazioni chimiche possono coinvolgere scambi di energia
 TERMOCHIMICA Studio del calore in gioco in una reazione chimica Le reazioni chimiche possono coinvolgere scambi di energia Le forme energetiche coinvolte abitualmente negli scambi di energia sono il calore
TERMOCHIMICA Studio del calore in gioco in una reazione chimica Le reazioni chimiche possono coinvolgere scambi di energia Le forme energetiche coinvolte abitualmente negli scambi di energia sono il calore
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
L entropia. Marina Cobal - Dipt.di Fisica - Universita' di Udine 1
 L entropia Universita' di Udine 1 L entropia secondo Clausius Prendiamo un ciclo reversibile qualunque ricopriamolo con una rete di adiabatiche i trattini del ciclo li sostituiamo con trattini di isoterme
L entropia Universita' di Udine 1 L entropia secondo Clausius Prendiamo un ciclo reversibile qualunque ricopriamolo con una rete di adiabatiche i trattini del ciclo li sostituiamo con trattini di isoterme
Fisica per scienze ed ingegneria
 Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
Serway, Jewett Fisica per scienze ed ingegneria Capitolo 20 Fino a circa il 1850 su riteneva che la meccanica e la termodinamica fossero due scienze completamente distinte. La legge di conservazione dell
Richiami di termodinamica [1-21]
![Richiami di termodinamica [1-21] Richiami di termodinamica [1-21]](/thumbs/88/115086285.jpg) Politecnico di Milano Facoltà di Ingegneria Industriale Corso di Laurea in Ingegneria Aerospaziale Insegnamento di Propulsione Aerospaziale Anno accademico 2011/12 Capitolo 3 sezione a Richiami di termodinamica
Politecnico di Milano Facoltà di Ingegneria Industriale Corso di Laurea in Ingegneria Aerospaziale Insegnamento di Propulsione Aerospaziale Anno accademico 2011/12 Capitolo 3 sezione a Richiami di termodinamica
Chimica Fisica. Libro di testo P.W. Atkins, Chimica Fisica, Ed. Zanichelli
 Chimica Fisica Corso di laurea in Chimica e Tecnologia Farmaceutiche Anno Accademico 2015-2016 Prof. Giovanna Fronzoni Dipartimento di Scienze Chimiche e Farmaceutiche (edificio C11) e-mail: fronzoni@units.it
Chimica Fisica Corso di laurea in Chimica e Tecnologia Farmaceutiche Anno Accademico 2015-2016 Prof. Giovanna Fronzoni Dipartimento di Scienze Chimiche e Farmaceutiche (edificio C11) e-mail: fronzoni@units.it
Stati di aggregazione della materia. dal microscopico al macroscopico: struttura. interazioni GASSOSO. proprietà SOLIDO LIQUIDO
 Stati di aggregazione della materia GASSOSO dal microscopico al macroscopico: struttura interazioni proprietà SOLIDO LIQUIDO Lo stato gassoso È uno dei tre stati di aggregazione della materia, caratterizzato
Stati di aggregazione della materia GASSOSO dal microscopico al macroscopico: struttura interazioni proprietà SOLIDO LIQUIDO Lo stato gassoso È uno dei tre stati di aggregazione della materia, caratterizzato
 La costante (p 0 0 /273) la si riesprime come n R dove R è una costante universale il cui valore dipende solo dalle unità di misura usate: R8.31 Joule/(K mole) e n è il numero di moli L equazione di stato
La costante (p 0 0 /273) la si riesprime come n R dove R è una costante universale il cui valore dipende solo dalle unità di misura usate: R8.31 Joule/(K mole) e n è il numero di moli L equazione di stato
TERMODINAMICA CHIMICA E SPONTANEITA DELLE REAZIONI
 TERMODINAMICA CHIMICA E SPONTANEITA DELLE 9.A PRE-REQUISITI 9.B PRE-TEST 9.C OBIETTIVI 9.4 IL SECONDO PRINCIPIO DELLA TERMODINAMICA E L ENTROPIA - VALUTAZIONE DELLA SPONTANEITA DI UNA REAZIONE 9.V VERIFICA
TERMODINAMICA CHIMICA E SPONTANEITA DELLE 9.A PRE-REQUISITI 9.B PRE-TEST 9.C OBIETTIVI 9.4 IL SECONDO PRINCIPIO DELLA TERMODINAMICA E L ENTROPIA - VALUTAZIONE DELLA SPONTANEITA DI UNA REAZIONE 9.V VERIFICA
Bilancio di energia: il Primo Principio della Termodinamica. Principi di Ingegneria Chimica Ambientale
 Bilancio di energia: il Primo Principio della Termodinamica Principi di Ingegneria Chimica Ambientale 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria,
Bilancio di energia: il Primo Principio della Termodinamica Principi di Ingegneria Chimica Ambientale 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria,
Lez 14 16/11/2016. Lezioni in didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617
 Lez 14 16/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Esperienza di Joule E. Fiandrini Fis. Sper. e 2 Esperienza di Joule
Lez 14 16/11/2016 Lezioni in http://www.fisgeo.unipg.it/~fiandrin/ didattica_fisica/did_fis1617/ E. Fiandrini Fis Sper e Appl Did 1617 1 Esperienza di Joule E. Fiandrini Fis. Sper. e 2 Esperienza di Joule
FISICA. Termodinamica PRIMO PRINCIPIO DELLA TERMODINAMICA. Autore: prof. Pappalardo Vincenzo. docente di Matematica e Fisica
 FISICA Termodinamica PRIMO PRINCIPIO DELLA TERMODINAMICA Autore: prof. Pappalardo Vincenzo docente di Matematica e Fisica La termodinamica si occupa principalmente degli scambi energetici fra un sistema
FISICA Termodinamica PRIMO PRINCIPIO DELLA TERMODINAMICA Autore: prof. Pappalardo Vincenzo docente di Matematica e Fisica La termodinamica si occupa principalmente degli scambi energetici fra un sistema
ESERCIZIO 1 Q = 6991, kj
 ESERCIZIO 1 A 25 C, l entalpia standard di idrogenazione del cicloesene a cicloesano: C 6 H 10 (l) + H 2 (g) C 6 H 12 (l) vale -93,83 kj mol -1, mentre l entalpia standard di combustione del cicloesene
ESERCIZIO 1 A 25 C, l entalpia standard di idrogenazione del cicloesene a cicloesano: C 6 H 10 (l) + H 2 (g) C 6 H 12 (l) vale -93,83 kj mol -1, mentre l entalpia standard di combustione del cicloesene
Termodinamica. Francesco Lai. Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari
 Termodinamica Francesco Lai Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari Solubilità La solubilità di una sostanza (farmaco) ad
Termodinamica Francesco Lai Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari Solubilità La solubilità di una sostanza (farmaco) ad
Chimica Fisica. Libro di testo consigliato P.W. Atkins, Chimica Fisica, Ed. Zanichelli
 Chimica Fisica Corso di laurea in Chimica e Tecnologia Farmaceutiche Anno Accademico 2017/2018 Prof. Giovanna Fronzoni Dipartimento di Scienze Chimiche e Farmaceutiche (edificio C11) e-mail: fronzoni@units.it
Chimica Fisica Corso di laurea in Chimica e Tecnologia Farmaceutiche Anno Accademico 2017/2018 Prof. Giovanna Fronzoni Dipartimento di Scienze Chimiche e Farmaceutiche (edificio C11) e-mail: fronzoni@units.it
INTRODUZIONE ALLA TERMODINAMICA. Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta
 INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
INTRODUZIONE ALLA TERMODINAMICA Supponiamo di voler studiare il comportamento di una determinata quantità di gas contenuta in un recipiente, ad esempio 5g di ossigeno. Dato l elevato numero di molecole
Energia e Sviluppo Sostenibile
 Termodinamica Applicata: Introduzione A. Servida - servida@unige.it Introduzione alla Termodinamica (1) La meccanica analizza solo una parte del principio di conservazione dell'energia: la conservazione
Termodinamica Applicata: Introduzione A. Servida - servida@unige.it Introduzione alla Termodinamica (1) La meccanica analizza solo una parte del principio di conservazione dell'energia: la conservazione
Lezione Generalità e definizioni
 Lezione Generalità e definizioni Sistemi termodinamici Equilibrio termodinamico e Proprietà Trasformazioni calore lavoro Il corso ha la finalità di dare allo studente le conoscenze di base della fisica
Lezione Generalità e definizioni Sistemi termodinamici Equilibrio termodinamico e Proprietà Trasformazioni calore lavoro Il corso ha la finalità di dare allo studente le conoscenze di base della fisica
Giorgio Sartor. Termodinamica. La termodinamica. Studia l energia coinvolta nelle trasformazioni.
 Giorgio Sartor Termodinamica Copyright 2001-2010 by Giorgio Sartor. All rights reserved. Versione 1.1.2 jan 2010 La termodinamica Studia l energia coinvolta nelle trasformazioni. Ha a che fare con le trasformazioni
Giorgio Sartor Termodinamica Copyright 2001-2010 by Giorgio Sartor. All rights reserved. Versione 1.1.2 jan 2010 La termodinamica Studia l energia coinvolta nelle trasformazioni. Ha a che fare con le trasformazioni
SECONDO PRINCIPIO DELLA TERMODINAMICA
 SECONDO PRINCIPIO DELLA TERMODINAMICA Il 1 principio non è in grado di escludere il passaggio di calore da un corpo più freddo ad uno più caldo; richiede soltanto che le quantità di calore scambiate siano
SECONDO PRINCIPIO DELLA TERMODINAMICA Il 1 principio non è in grado di escludere il passaggio di calore da un corpo più freddo ad uno più caldo; richiede soltanto che le quantità di calore scambiate siano
termodinamica: 2. il Primo Principio
 termodinamica: 2. il Primo Principio 28 Primo Principio della Termodinamica Antefatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale
termodinamica: 2. il Primo Principio 28 Primo Principio della Termodinamica Antefatto: conservazione dell energia dalla descrizione molecolare (secondo la meccanica classica/quantistica) del sistema materiale
PRIMI ELEMENTI DI TERMODINAMICA. La termodinamica studia le leggi con cui i sistemi scambiano (cedono e ricevono) energia con l ambiente.
 PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
Spesso le reazioni chimiche sono accompagnate da. Le reazioni che sviluppano calore sono dette reazioni esotermiche
 Spesso le reazioni chimiche sono accompagnate da sviluppo o assorbimento di calore. Le reazioni che sviluppano calore sono dette reazioni esotermiche Le reazioni che assorbono calore sono dette reazioni
Spesso le reazioni chimiche sono accompagnate da sviluppo o assorbimento di calore. Le reazioni che sviluppano calore sono dette reazioni esotermiche Le reazioni che assorbono calore sono dette reazioni
CorsI di Laurea in Ingegneria Aereospaziale-Meccanica-Energetica. FONDAMENTI DI CHIMICA Docente: Cristian Gambarotti. Esercitazione del 03/11/2010
 CorsI di aurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CIMICA Docente: Cristian Gambarotti Esercitazione del // Argomenti della lezione avoro, Calore, Energia Interna, Entalpia relativi
CorsI di aurea in Ingegneria Aereospaziale-Meccanica-Energetica FONDAMENTI DI CIMICA Docente: Cristian Gambarotti Esercitazione del // Argomenti della lezione avoro, Calore, Energia Interna, Entalpia relativi
CONVENZIONE SUI SEGNI
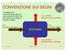 CONVENZIONE SUI SEGNI Si stabilisce una convenzione sui segni sia per gli scambi di calore che per il lavoro che il sistema compie o subisce L>0: LAVORO COMPIUTO DAL SISTEMA Q>0: CALORE ASSORBITO SISTEMA
CONVENZIONE SUI SEGNI Si stabilisce una convenzione sui segni sia per gli scambi di calore che per il lavoro che il sistema compie o subisce L>0: LAVORO COMPIUTO DAL SISTEMA Q>0: CALORE ASSORBITO SISTEMA
Controllo dei Processi. Modellistica - Parte 2
 Università di Roma La Sapienza A.A. 2004/05 Controllo dei Processi Modellistica - Parte 2 Prof. Leonardo Lanari DIS, Università di Roma La Sapienza Principi di conservazione: conservazione dell energia
Università di Roma La Sapienza A.A. 2004/05 Controllo dei Processi Modellistica - Parte 2 Prof. Leonardo Lanari DIS, Università di Roma La Sapienza Principi di conservazione: conservazione dell energia
Principi della Termodinamica
 Principi della Termodinamica Dr. Daniele Toffoli Dipartimento di Scienze Chimiche e Farmaceutiche, UniTS Dr. Daniele Toffoli (DSCF, UniTS) Intro 1 / 20 Introduzione 1 Introduzione 2 Sistemi termodinamici
Principi della Termodinamica Dr. Daniele Toffoli Dipartimento di Scienze Chimiche e Farmaceutiche, UniTS Dr. Daniele Toffoli (DSCF, UniTS) Intro 1 / 20 Introduzione 1 Introduzione 2 Sistemi termodinamici
