Trombosi Venosa Superficiale: nuova indicazione per Fondaparinux Trattamento della Trombosi Venosa Superficiale (TVS)
|
|
|
- Gianleone Forti
- 7 anni fa
- Visualizzazioni
Transcript
1 Trombosi Venosa Superficiale: nuova indicazione per Fondaparinux Trattamento della Trombosi Venosa Superficiale (TVS) "Si sottolinea l importanza di segnalare tutte le sospette reazioni avverse ad un medicinale/vaccino. Agli Operatori Sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sito web dell AIFA: Depositato presso AIFA-Ufficio informazione medico scientifica ai sensi degli artt del D. Lvo 219/06 in data 17/10/2013 Depositato presso AIFA-Ufficio informazione medico scientifica ai sensi degli artt del D. Lvo 219/06 in data xx/xx/2013 Codice Zinc ITA/FDS/0030/13 Codice Zinc ITA/FDS/0000/13
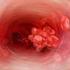
2 Introduzione TVS è una patologia frequente, sempre sintomatica e non benigna 1 Esiste una mancanza evidence-based sul trattamento della TVS isolata 1 Lo studio CALISTO è stato disegnato per determinare il rischio/beneficio di trattamento esteso con Fondaparinux della TVS sintomatica isolata alle gambe 1. Decousus et al. Curr Opin Pulm Med 2003
3 TVS: una malattia molto frequente, più frequente di TVP/EP Prevalenza di TVP/EP o TVS in pazienti afferenti ai MMG TEV uomini % TEV donne TVS uomini 2 0 TEV TVS TVS Female 2 Di Minno et al. J Thromb Haemost 2005;3:
4 TVS e TEV sono strettamente correlati Una pregressa TVS è un fattore di rischio indipendente per TVP/EP 3 Molti dei fattori di rischio sono comuni come la trombofilia 4 Frequenza di una TVP concomitante: 15% 1 (systemic duplex ultrasonography) Frequenza di una EP concomitante: 5% 1 Sintomatica: tra il 0.5 e il 4% 1 3.Heit et al. Thromb Haemost 2001; 4. de Moerlose et al. Thromb Haemost 1998; 1. Decousus et al. Curr Opin Pulm Med 2003;
5 Il trattamento della TVS non è ben definito 1 Trattamento non farmacologico: calze elastiche 1 Trattamento Farmacologico 1 FANS: topici e sistemici 1 Eparina non frazionata (UFH) 1 EBPM: dose e durata? 1 1. Decousus et al. Curr Opin Pulm Med 2003;
6 Linee Guida ACCP Treatment of SVT For patients with spontaneous superficial vein thrombosis, we suggest prophylactic or intermediate doses of LMWH (Grade 2B) or intermediate doses of UFH (Grade 2B) for at least 4 weeks. We suggest that as an alternative to 4 weeks of LMWH or UFH, VKA (target INR, 2.5; range, 2.0 to 3.0) can be overlapped with 5 days of UFH and LMWH and continued for 4 weeks (Grade 2C). We suggest that oral nonsteroidal antiinflammatory drugs should not be used in addition to anticoagulation (Grade 2B). We recommend medical treatment with anticoagulants over surgical treatment (Grade 1B). 5 Remark: It is likely that less extensive superficial vein thrombosis (ie, where the affected venous segment is short in length or further from the saphenofemoral junction) does not require treatment with anticoagulants. It is reasonable to use oral or topical nonsteriodal antiinflammatory drugs for symptom control in such cases. 5. Kearon et al. Chest 2008;133;
7 Linee Guida ACCP 2012 Trattamento della TVS > 5cm Suggerimento : Dose profilattica di fondaparinux o LMWH per 45 gg vs no anticoagulazione (Grado 2B) Patients who place a high value on avoiding the inconvenience or cost of anticoagulation and a low value on avoiding infrequent symptomatic VTE are likely to decline anticoagulation Suggerimento : Se trattati con anticoagulante, fondaparinux 2.5 mg al giorno vs dose profilattica di LMWH (Grado 2C) 6 6. Kearon et al. Chest 2012;141(suppl 2):419S-494S.
8 Trattamento della TVS ACCP 2008 ACCP 2012 Spontaneous SVT* Treatment Prophylactic or intermediate doses of LMWH for at least 4 weeks Intermediate doses of UFH for at least 4 weeks VKA (INR 2.0 to 3.0) overlapped with 5 days of UFH and LMWH and continued for 4 weeks Medical treatment with anticoagulants over surgical treatment Grade 2B 2B 2C 1B SVT 5 cm If treated with anticoagulation Treatment Prophylactic dose of fondaparinux or LMWH for 45 days fondaparinux 2.5 mg daily over a prophylactic dose of LMWH Rappresentazione tabellare da testo *Likely that less extensive SVT (i.e. where the affected venous segment is short in length or further from the saphenofemoral junction) does not require treatment with anticoagulants Grade 2B 2C 5. Kearon et al. Chest 2008;133; Kearon et al. Chest 2012;141(suppl 2):419S-494S.
9 Pochi studi con antitrombotici nella TVS (n < 1500) Titon et al. 7 Belcaro et al. 8 Marchiori et al. 9 Lozano and STENOX 11 VESALIO 12 Almazan 10 Design Rando Open (n=117) Rando Open (n=444) Rando Open (n=60) Rando Open (n=84) Rando Double- Blind vs Placebo (n=427) Rando Double- Blind (n=164) Treatment Nadroparin vs Naproxen UFH + VKA vs Nadroparin + VKA Low dose UFH vs High dose UFH Enoxaparin vs Surgery Enoxaparin (low or high dose) vs Tenoxicam vs Placebo Low dose nadroparin vs high dose nadroparin Durata del trattamento 6 giorni 3 mesi 30 giorni 4 settimane 8-12 giorni 4 settimane Durata del follow-up 8 mesi 3 mesi 6 mesi 6 mesi 12 settimane 12 settimane Rappresentazione tabellare da testo 7. Ann Cardiol Angeiol 1994;43:160-6; 8. Angiology 1999;50:523-9; 9. Haematologica 2002;87:523 7; 10. Vasc Endovasc Surg 2003;37:415-20; 11. Arch Intern Med 2003;163: ; 12. J Thromb Haemost 2005;3:1152-7
10 La durata ideale del trattamento non è nota Il trattamento < 30gg è troppo corto Estensione della TVS o TEV nadroparin basso dosaggio (n=81) nadroparin alto dosaggio (n=83) Giorno 30 (fine trattamento) 5 (6.2%) 2 (2.4%) Giorno 90 (fine del follow-up) 7 (8.6%) 6 (7.2%) Circa il 50% degli eventi avviene dopo la sospensione del trattamento 12 Rappresentazione tabellare da testo 12. Prandoni et al. J Thromb Haemost 2005;3:1152-7
11 Studio Internazionale, Multicentrico, Randomizzato, in Doppio Cieco, vs Placebo, a Gruppi Paralleli, di Fase III per valutare l Efficacia e la Sicurezza di Fondaparinux (2.5mg s.c.) nel Trattamento del Paziente con Tromboflebite Superficiale Isolata Sintomatica Acuta degli Arti Inferiori
12 Caratteristiche dello studio Doppio cieco verso Placebo Randomizzato Multicentrico in Europa 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
13 Obiettivi Obiettivo primario: dimostrare la superiore efficacia di Fondaparinux 2.5 mg die vs placebo su TVS sintomatica e/o morte per tutte le cause Obiettivo primario di sicurezza: valutare la sicurezza di Fondaparinux 2.5 mg die vs placebo sul sanguinamento maggiore e la morte in pazienti con TVS isolata agli arti inferiori 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
14 Disegno dello studio Calze a compressione elastica, paracetamolo e FANS topici sono permessi per ogni paziente Rappresentazione grafica da testo 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
15 Endpoint primario di efficacia TEV e/o morte per ogni causa a 45 giorni TEV definito come endpoint composito di: EP sintomatico TVP sintomatico Recidiva ricorrente di TVS Estensione sintomatica di TVS Tutti gli eventi sono stati confermati da test oggettivi e sono stati aggiudicati da un comitato centrale indipendente 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
16 Pazienti, criteri di inclusione Ospedalizzati e non ospedalizzati Età 18 anni TVS sintomatica isolata di almeno 5 cm Confermata tramite CUS I pazienti sono rappresentativi di quelli incontrati nella normale pratica clinica Maggioranza donne Prevalentemente obesi Maggior parte con vene varicose TVS che coinvolge la grande safena 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
17 CALISTO Centri di Reclutamento Tra Marzo 2007 e Maggio 2009, 3002 pazienti sono stati arruolati in 171 centri di 17 paesi (Russia, Hungary, Germany, Ukraine, France, Greece, Latvia, Slovakia, Italy, Spain, Bulgaria, Poland, Czech Republic, Estonia, Netherlands, Switzerland, Israel) 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
18 Endpoint primario di efficacia (Giorno 47) Complicanze Tromboemboliche Sintomatiche/Morte (%) % n=13 RRR 85.2% (95% CI= 73.7 to 91.7) p<0.001 Fondaparinux 2.5 mg 5.9% n=88 Placebo Rappresentazione grafica da testo Endpoint Primario di Efficacia: TVP-EP sintomatico, Estensione di TVS iniziale, TVS ricorrente, morte per tutte le cause 101 (3.4%) pazienti sviluppato 1 evento 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
19 Endpoint di Sicurezza (Giorno 47) Fondaparinux N=1499 Placebo N=1488 Sanguinamento maggiore o morte 3 (0.2%) 2 (0.1%) Sanguinamento maggiore 1 (0.1%) 1 (0.1%) Morte per sanguinamento 0 0 Sanguinamento non maggiore clinicamente rilevante 5 (0.3%) 8 (0.5%) Sanguinamento minore 9 (0.6%) 6 (0.4%) Sanguinamento totale 15 (1%) 14 (0.9%) Non si sono verificati casi di Trombocitopenia eparino-indotta nel gruppo trattato con fondaparinux 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
20 Endpoint secondari di efficacia (Giorno 47) Eventi sintomatici (%) p=0.03 0% n=0 EP 0.3% n=5 RRR 83.4% p< % n=3 TVP 1.2% n=18 RRR 92.2% p< % n=4 3.4% n=51 Estensione TVS Morte: Fondaparinux=2 (cancro); Placebo =1 (scompenso cardiaco) TVPprossimale sintomatica: Fondaparinux=1; Placebo=10 Alcuni pazienti sono andati incontro a due outcome RRR 79.2% p< % n=5 1.6% n=24 TVS ricorrente Rappresentazione grafica da testo 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
21 TVP/EP sintomatiche (Giorno 47) TVP/EP Simptomatiche (%) % n=3 0 EP 3 TVP Fondaparinux 2.5 mg RRR 85.0% (95% CI= 49.7 to 95.5) p< % n=20 5 EP 18 TVP Placebo Rappresentazione grafica da testo TVP sintomatico prossimale: Fondaparinux=1; Placebo= H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
22 Estensione o Ricorrenza di TVS (Giorno 47) Estensione o Ricorrenza di TVS (%) % n=9 Fondaparinux 2.5 mg RRR 87.7% p< % n=73 Placebo Rappresentazione grafica da testo 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
23 Risultati di Efficacia (Giorno 77) Complicanze Tromboemboliche/ Morte (%) % n=18 RRR 80.9% p< % n=94 0 Fondaparinux 2.5 mg Placebo 112 (3.7%) pazienti andati incontro 1 evento Rappresentazione grafica da testo 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
24 Endpoint Secondari (Giorno 77) Eventi sintomatici (%) p= % n=0 EP 0.4% n=6 RRR 79.0% p= % n=4 TVP RRR 90.8% p< % n=19 0.3% n=5 3.6% n=54 RRR 69.3% p= % n=8 1.7% n=26 Estensione TVS Ricorrenza TVS Rappresentazione grafica da testo Alcuni pazienti sono andati incontro a due eventi Morte: Fondaparinux=2 (cancro; Placebo (scompenso cardiaco) =1 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
25 TVP o EP Sintomatiche (Giorno 77) TVP/EP Sintomatiche (%) % n=4 0 EP 4 TVP Fondaparinux 2.5 mg RRR 81.8% p< % n=22 6 EP 19 TVP Placebo Alcuni pazienti sono andati incontro a EP*TVP TVP Sintomatico prossimale: Fondaparinux=2; Placebo=11 Rappresentazione grafica da testo 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
26 Probabilità del Endpoint Primario di Efficacia fino al Giorno 77 Rischio cumulato (%) Giorni No. Ata rischio Giorno 10 Giorno 30 Giorno 47 Giorno 75±2 Placebo Fondaparinux H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
27 Efficacia per sottogruppi L efficacia del trattamento è costante in tutti i sottogruppi esaminati 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
28 Trattamento Chirurgico (Giorno 77) 7 RRR 75% p<0.001 Chirurgia (%) % n=15 4.1% n= Fondaparinux 2.5 mg Placebo 70 legature (Fondaparinux=12; Placebo=58) Rappresentazione grafica da testo 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
29 Number Needed to Treat Complicanze tromboemboliche sintomatiche/morte Giorno 47 TVP/EP Sintomatiche Rappresentazione grafica da testo 13. H. Decoucus et al. Fondaparinux for the treatment of Superficial-Vein Thrombosis in the Legs. NEJM ;
30 Conclusioni In conclusione, pazienti con Trombosi Venosa Superficiale sintomatica isolata degli arti inferiori sono ad elevato rischio di complicanze tromboemboliche sintomatiche. Fondaparinux somministrato alla dose di 2.5 mg una volta al giorno per 45 giorni è efficace e largamente utilizzabile per il trattamento di tali pazienti
31 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. Arixtra 1,5 mg/0,3 ml soluzione iniettabile, siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA. Ogni siringa preriempita (0,3 ml) contiene 1,5 mg di fondaparinux sodico. Eccipienti con effetti noti: contiene meno di 1 mmol di sodio (23 mg) per dose, e di conseguenza, esso è essenzialmente privo di sodio. Per l elenco completo degli eccipienti, vedere paragrafo FORMA FARMACEUTICA. Soluzione iniettabile. La soluzione è un liquido trasparente e incolore. 4. INFORMAZIONI CLINICHE. 4.1 Indicazioni terapeutiche. Prevenzione di Episodi Tromboembolici Venosi (TEV) negli adulti sottoposti a chirurgia ortopedica maggiore degli arti inferiori quali frattura dell anca, chirurgia maggiore del ginocchio o chirurgia sostitutiva dell anca. Prevenzione degli Episodi Tromboembolici Venosi (TEV) negli adulti sottoposti a chirurgia addominale considerati ad alto rischio di complicanze tromboemboliche, quali pazienti sottoposti a chirurgia addominale per patologie tumorali (vedere paragrafo 5.1). Prevenzione degli Episodi Tromboembolici Venosi (TEV) in adulti di pertinenza medica considerati ad alto rischio di TEV e che sono immobilizzati a causa di una patologia acuta quale insuffi cienza cardiaca e/o disturbi respiratori acuti e/o infezioni o patologie infi ammatorie acute.trattamento di adulti con trombosi venosa superfi ciale sintomatica spontanea acuta degli arti inferiori in assenza di trombosi venosa profonda concomitante (vedere paragrafi 4.2 e 5.1). 4.2 Posologia e modo di somministrazione. Posologia. Pazienti sottoposti a chirurgia ortopedica maggiore o addominale. La dose raccomandata di fondaparinux è 2,5 mg somministrata una volta al giorno dopo l intervento chirurgico tramite iniezione sottocutanea. La dose iniziale deve essere somministrata 6 ore dopo la fi ne dell intervento chirurgico, una volta che è stata assicurata l emostasi. Il trattamento deve essere continuato fi nché non diminuisce il rischio di tromboembolismo venoso, di solito fi nché il paziente non riprende la deambulazione, almeno 5-9 giorni dopo l intervento chirurgico. L esperienza dimostra che nei pazienti sottoposti a chirurgia per frattura d anca il rischio di TEV persiste oltre 9 giorni dopo l intervento chirurgico. In questi pazienti l uso di una profi lassi prolungata con fondaparinux dovrebbe essere presa in considerazione fi no a ulteriori 24 giorni (vedere paragrafo 5.1). Pazienti di pertinenza medica che sono ad alto rischio di complicanze tromboemboliche sulla base di una valutazione di rischio individuale. La dose raccomandata di fondaparinux è di 2,5 mg una volta al giorno somministrata tramite iniezione sottocutanea. Nei pazienti di pertinenza medica è stato clinicamente studiato un trattamento della durata di 6-14 giorni (vedere paragrafo 5.1). Trattamento della trombosi venosa superfi ciale. La dose di fondaparinux raccomandata è pari a 2,5 mg al giorno, somministrata con iniezione sottocutanea. I pazienti eleggibili al trattamento con fondaparinux 2,5 mg devono manifestare una trombosi venosa superfi ciale spontanea, acuta, sintomatica ed isolata degli arti inferiori, di lunghezza pari ad almeno 5 cm e documentata da indagine ultrasonografi ca o da altri esami obiettivi. Il trattamento deve essere iniziato appena possibile subito dopo la diagnosi e dopo l esclusione di Trombosi Venosa Profonda (TVP) concomitante o di trombosi venosa superfi ciale entro 3 cm dalla giunzione safeno-femorale. Il trattamento deve essere continuato per un minimo di 30 giorni e fi no ad un massimo di 45 giorni nei pazienti ad elevato rischio di complicanze tromboemboliche (vedere paragrafi 4.4 e 5.1). Ai pazienti si dovrebbe raccomandare l autoiniezione del prodotto quando a giudizio del medico essi vogliano farlo e ne siano in grado. I medici devono fornire chiare istruzioni per l autoiniezione. Pazienti che devono sottoporsi a intervento chirurgico o ad altre procedure invasive. Nei pazienti con trombosi venosa superfi ciale che devono sottoporsi a intervento chirurgico o ad altre procedure invasive, fondaparinux, laddove possibile, non deve essere somministrato durante le 24 ore precedenti all intervento chirurgico. Il trattamento con fondaparinux può ricominciare dopo almeno 6 ore dall intervento chirurgico sempre che sia stata ottenuta l emostasi. Categorie particolari di pazienti. Nei pazienti sottoposti ad intervento chirurgico, il tempo di somministrazione della prima iniezione di fondaparinux richiede un rigido rispetto nei pazienti di età 75 anni e/o di peso <50 kg e/o con insuffi cienza renale con una clearance della creatinina compresa tra 20 e 50 ml/min. La prima somministrazione di fondaparinux deve essere fatta non prima di 6 ore dopo la fi ne dell intervento chirurgico. L iniezione non deve essere somministrata senza che sia stata stabilita l emostasi (vedere paragrafo 4.4). Insuffi cienza renale Prevenzione del TEV - Fondaparinux non deve essere usato in pazienti con clearance della creatinina <20 ml/min (vedere paragrafo 4.3). Nei pazienti con clearance della creatinina compresa tra 20 e 50 ml/min la dose deve essere ridotta a 1,5 mg al giorno (vedere paragrafi 4.4 e 5.2). Nei pazienti con insuffi cienza renale lieve non è richiesta alcuna riduzione del dosaggio (clearance della creatinina >50 ml/min). Trattamento della trombosi venosa superfi ciale Fondaparinux non deve essere usato nei pazienti con clearance della creatinina <20 ml/min (vedere paragrafo 4.3). La dose deve essere ridotta a 1,5 mg al giorno nei pazienti con clearance della creatinina compresa tra 20 e 50 ml/min (vedere paragrafi 4.4 e 5.2). Nei pazienti con insuffi cienza renale lieve non è richiesta alcuna riduzione del dosaggio (clearance della creatinina >50 ml/min). La sicurezza e l effi cacia dell 1,5 mg non è stata studiata (vedere paragrafo 4.4). Insuffi cienza epatica Prevenzione del TEV - Non è necessario alcun aggiustamento della dose nei pazienti con insuffi cienza epatica di grado lieve o moderato. Nei pazienti con insuffi cienza epatica grave, fondaparinux deve essere usato con cautela poiché non è stato studiato in questo gruppo di pazienti (vedere paragrafi 4.4 e 5.2). Trattamento della trombosi venosa superfi ciale La sicurezza e l effi cacia di fondaparinux non sono state studiate nei pazienti con insuffi cienza epatica grave, di conseguenza l uso di fondaparinux non è raccomandato in questi pazienti (vedere paragrafo 4.4). Popolazione pediatrica - L uso di fondaparinux non è raccomandato nei bambini al di sotto di 17 anni a causa della mancanza di dati sulla sicurezza ed effi cacia. Basso peso corporeo Prevenzione del TEV - I pazienti con peso corporeo <50 kg hanno un aumentato rischio di sanguinamento. L eliminazione di fondaparinux diminuisce con il peso. Fondaparinux deve essere usato con cautela in questi pazienti (vedere paragrafo 4.4). Trattamento della trombosi venosa superfi ciale - Nei pazienti di peso corporeo inferiore a 50 kg non sono state studiate la sicurezza e l effi cacia di fondaparinux, di conseguenza fondaparinux non è raccomandato per l uso in questi pazienti (vedere paragrafo 4.4). Modo di somministrazione. Fondaparinux è da somministrarsi tramite iniezione sottocutanea profonda, con il paziente in posizione supina. Il sito di iniezione si deve alternare tra il lato sinistro e destro anterolaterale e tra il lato sinistro e destro posterolaterale della parete addominale. Per evitare la perdita di medicinale quando si usa la siringa preriempita non espellere le bolle d aria dalla siringa prima dell iniezione. L intera lunghezza dell ago deve essere inserita perpendicolarmente in una plica cutanea tenuta tra pollice e indice; la plica cutanea deve essere mantenuta per tutta la durata dell iniezione. Per ulteriori istruzioni sull impiego e lo smaltimento vedere paragrafo Controindicazioni. - Ipersensibilità nota al principio attivo o a uno qualsiasi degli eccipienti elencati al paragrafo sanguinamenti in atto, clinicamente signifi cativi - endocardite batterica acuta - grave insuffi cienza renale defi nita come clearance della creatinina <20 ml/min. 4.4 Avvertenze speciali e precauzioni d impiego. Fondaparinux è destinato solo all uso sottocutaneo. Da non somministrare per via intramuscolare. Emorragie. Fondaparinux deve essere usato con cautela nei pazienti che hanno un aumentato rischio di emorragie, come quelli con disordini emorragici congeniti o acquisiti (per esempio conta piastrinica <50.000/mm 3 ), patologia gastrointestinale ulcerativa in fase attiva ed emorragia intracranica recente o poco dopo chirurgia cerebrale, spinale od oftalmica e in gruppi di pazienti speciali come indicato di seguito. Per la prevenzione del TEV - Agenti che possono aumentare il rischio di emorragia non devono essere somministrati in concomitanza a fondaparinux. Tali sostanze comprendono desirudina, agenti fi brinolitici, antagonisti del recettore GP IIb/IIIa, eparina, eparinoidi o Eparine a Basso Peso Molecolare (EBPM). Se richiesta, una terapia concomitante con
32 antagonisti della vitamina K deve essere somministrata secondo le indicazioni del paragrafo 4.5. Altri farmaci antiaggreganti piastrinici (acido acetilsalicilico, dipiridamolo, sulfi npirazone, ticlopidina o clopidogrel) e FANS devono essere usati con cautela. Se la co-somministrazione è essenziale, è necessario uno stretto monitoraggio. Per il trattamento della trombosi venosa superfi ciale Fondaparinux deve essere usato con cautela nei pazienti cui sono somministrati contemporaneamente altri medicinali che aumentano il rischio di emorragia. Pazienti con trombosi venosa superfi ciale. Prima di iniziare il trattamento con fondaparinux deve essere confermata la presenza di trombosi venosa superfi ciale a distanza maggiore di 3 cm dalla giunzione safeno-femorale e deve essere esclusa la presenza di TVP mediante ultrasonografi a per compressione (CUS) o altre metodiche obiettive. Non ci sono dati relativi all uso di fondaparinux 2,5 mg nei pazienti con trombosi venosa superfi ciale associata a TVP concomitante o con trombosi venosa superfi ciale entro 3 cm dalla giunzione safeno-femorale (vedere paragrafi 4.2 e 5.1). La sicurezza e l effi cacia di fondaparinux 2,5 mg non sono state studiate nei seguenti gruppi: pazienti con trombosi venosa superfi ciale dopo terapia sclerosante o come conseguenza di una linea endovenosa, pazienti con una storia di trombosi venosa superfi ciale nei precedenti 3 mesi, pazienti con una storia di malattia venosa tromboembolica nei precedenti 6 mesi, o pazienti con un tumore attivo (vedere paragrafi 4.2 e 5.1). Anestesia spinale/epidurale. Nei pazienti sottoposti a chirurgia ortopedica maggiore, con l uso concomitante di fondaparinux e anestesie spinali/epidurali o punture spinali non può essere esclusa la comparsa di ematomi epidurali o spinali che possono dare luogo a paralisi prolungate o permanenti. Il rischio di questi rari eventi può aumentare con l uso post-operatorio di cateteri epidurali permanenti o con l uso concomitante di altri farmaci che agiscono sull emostasi. Pazienti anziani. La popolazione anziana ha un aumentato rischio di sanguinamento. Dato che la funzionalità renale generalmente diminuisce con l età, i pazienti anziani possono mostrare una ridotta eliminazione e una aumentata esposizione a fondaparinux (vedere paragrafo 5.2). Fondaparinux deve essere usato con cautela nei pazienti anziani (vedere paragrafo 4.2). Basso peso corporeo. Prevenzione del TEV - I pazienti con peso corporeo <50 kg hanno un aumentato rischio di sanguinamento. L eliminazione di fondaparinux diminuisce con il peso. Fondaparinux deve essere usato con cautela in questi pazienti (vedere paragrafo 4.2). Trattamento della trombosi venosa superfi ciale Non ci sono dati clinici a disposizione per l uso di fondaparinux per il trattamento della trombosi venosa superfi ciale in pazienti con peso corporeo inferiore a 50 kg. Di conseguenza, fondaparinux non è raccomandato per il trattamento della trombosi venosa superfi ciale in questi pazienti (vedere paragrafo 4.2). Insuffi cienza renale. Prevenzione del TEV - È noto che fondaparinux viene escreto principalmente dai reni. I pazienti con clearance della creatinina <50 ml/min hanno un aumentato rischio di sanguinamento e TEV e devono essere trattati con cautela (vedere paragrafi 4.2, 4.3 e 5.2). Ci sono dati clinici limitati a disposizione per i pazienti con clearance della creatinina inferiore a 30 ml/min. Trattamento della trombosi venosa superfi ciale Fondaparinux non deve essere usato in pazienti con clearance della creatinina <20 ml/min (vedere paragrafo 4.3). La dose deve essere ridotta a 1,5 mg una volta al giorno nei pazienti con clearance della creatinina compresa nel range tra 20 e 50 ml/min (vedere paragrafi 4.2 e 5.2). La sicurezza e l effi cacia del dosaggio di 1,5 mg non sono state studiate. Insuffi cienza epatica grave. Prevenzione del TEV - Non è necessario alcun aggiustamento della dose di fondaparinux. Tuttavia l uso di fondaparinux in pazienti con insuffi cienza epatica grave deve essere considerato con cautela a causa di un aumentato rischio di sanguinamento dovuto alla carenza dei fattori della coagulazione nei pazienti con insuffi cienza epatica grave (vedere paragrafo 4.2). Trattamento della trombosi venosa superfi ciale Non ci sono dati clinici disponibili per l uso di fondaparinux per il trattamento della trombosi venosa superfi ciale nei pazienti con insuffi cienza epatica grave. Di conseguenza, fondaparinux non è raccomandato per il trattamento della trombosi venosa superfi ciale in questi pazienti (vedere paragrafo 4.2). Pazienti con trombocitopenia indotta da eparina. Fondaparinux deve essere utilizzato con cautela in pazienti con anamnesi di Trombocitopenia Indotta da Eparina (HIT). L effi cacia e la sicurezza di fondaparinux nei pazienti con HIT tipo II non sono state studiate in modo formale. Fondaparinux non si lega al fattore 4 della coagulazione e non ha reazione crociata con il plasma di pazienti con HIT di Tipo II. Tuttavia, sono state ricevute rare segnalazioni spontanee di HIT in pazienti trattati con fondaparinux. A tutt oggi non è stata stabilita un associazione causale tra il trattamento con fondaparinux e l insorgenza della HIT. Allergia al lattice. Il copri-ago della siringa preriempita contiene lattice di gomma naturale secco che può provocare reazioni allergiche in soggetti sensibili al lattice. 4.5 Interazioni con altri medicinali ed altre forme d interazione. La somministrazione concomitante di fondaparinux e di sostanze che possono accrescere il rischio di emorragia aumenta il rischio di sanguinamento (vedere paragrafo 4.4). Anticoagulanti orali (warfarin), inibitori piastrinici (acido acetilsalicilico), FANS (piroxicam) e digossina non hanno interagito con la farmacocinetica di fondaparinux. La dose di fondaparinux (10 mg) negli studi di interazione era più alta della dose raccomandata per le attuali indicazioni. Fondaparinux non infl uenza né l attività INR di warfarin, né il tempo di sanguinamento sotto trattamento con acido acetilsalicilico o piroxicam, né la farmacocinetica della digossina allo steady state. Prosecuzione del trattamento con un altro farmaco anticoagulante. Se la prosecuzione del trattamento deve essere iniziata con una eparina o con una EBPM, come regola generale la prima iniezione deve essere somministrata 1 giorno dopo l ultima iniezione di fondaparinux. Se è richiesta la prosecuzione del trattamento con un antagonista della vitamina K, il trattamento con fondaparinux deve essere continuato fi nché non viene raggiunto il valore stabilito di INR. 4.6 Fertilità, gravidanza ed allattamento. Gravidanza. Non esistono dati suffi cienti provenienti dall uso di fondaparinux in gravidanza. Gli studi sull animale sono insuffi cienti per quanto riguarda gli effetti su gravidanza, sviluppo embrionale/fetale, parto e sviluppo post-natale a causa dell esposizione limitata. Fondaparinux non deve essere prescritto a donne gravide a meno che non sia strettamente necessario. Allattamento al seno. Fondaparinux è escreto nel latte del ratto ma non è noto se fondaparinux venga escreto nel latte umano. L allattamento al seno non è consigliato durante il trattamento con fondaparinux. L assorbimento orale da parte del bambino è comunque improbabile. Fertilità. Non ci sono dati disponibili sull effetto di fondaparinux sulla fertilità umana. Gli studi sull animale non hanno mostrato alcun effetto sulla fertilità. 4.7 Effetti sulla capacità di guidare veicoli e sull uso di macchinari. Non sono stati effettuati studi sulla capacità di guidare veicoli e sull uso di macchinari. 4.8 Effetti indesiderati. Le reazioni avverse gravi più comunemente riportate con fondaparinux sono complicanze emorragiche (in vari siti che includono rari casi di sanguinamenti intracranici/intracerebrali e retroperitoneali) ed anemia. Fondaparinux deve essere usato con cautela nei pazienti che hanno un aumentato rischio di emorragia (vedere paragrafo 4.4). La sicurezza di fondaparinux 2,5 mg è stata valutata su 3,595 pazienti sottoposti a chirurgia ortopedica maggiore degli arti inferiori trattati fi no a 9 giorni, in 327 pazienti sottoposti a chirurgia per frattura d anca trattati per 3 settimane successive a una profi lassi iniziale di 1 settimana, in 1,407 pazienti sottoposti a chirurgia addominale trattati fi no a 9 giorni, e in 425 pazienti di pertinenza medica (non sottoposti a trattamenti chirurgici) a rischio di complicanze tromboemboliche trattati fi no a 14 giorni. Le reazioni avverse segnalate dagli sperimentatori come almeno possibilmente correlate con fondaparinux sono presentate all interno di ciascun gruppo di frequenza (molto comuni 1/10; comuni: 1/100, <1/10; non comuni: 1/1.000, <1/100; raro: 1/10.000, <1/1.000; molto raro: <1/10.000) e classifi cate per organo in ordine decrescente di gravità; tali reazioni avverse devono essere interpretate nel contesto chirurgico e medico. Organi/Apparati Classificazione MedDRA Infezioni ed infestazioni Patologie del sistema emolinfopoietico Reazioni avverse in pazienti sottoposti a chirurgia ortopedica maggiore degli arti inferiori e/o chirurgia addominale Rari: infezione della ferita chirurgica Comuni: emorragia post-operatoria, anemia Non comuni: sanguinamento (epistassi, gastrointestinale, emottisi, ematuria, ematomi) trombocitopenia, porpora, trombocitemia, anomalie piastriniche, alterazioni della coagulazione Reazioni avverse in pazienti di pertinenza medica (non sottoposti a trattamenti chirurgici) Comuni: sanguinamento (ematomi, ematuria, emottisi, sanguinamento gengivale) Non comuni: anemia
33 Disturbi del sistema immunitario Disturbi del metabolismo e della nutrizione Patologie del sistema nervoso Patologie vascolari Patologie respiratorie, toraciche e mediastiniche Patologie gastrointestinali Patologie epatobiliari Patologie della cute e del tessuto sottocutaneo Patologie sistemiche e condizioni relative alla sede di somministrazione Rari: reazioni allergiche (inclusi casi molto rari di angioedema, reazioni anafi lattoidi/anafi lattiche) Rari: ipopotassiemia Rari: ansia, sonnolenza, vertigini, capogiri, cefalea, confusione Rari: ipotensione Rari: dispnea, tosse Non comuni: nausea, vomito Rari: dolore addominale, dispepsia, gastrite, stipsi, diarrea Non comuni: aumento degli enzimi epatici, alterazione della funzionalità epatica Rari: bilirubinemia Non comuni: rash, prurito Non comuni: edema, edema periferico, febbre, secrezione della ferita Rari: dolore toracico, affaticamento, vampate di calore, dolore alle gambe, edema genitale, arrossamenti, sincope Non comuni: dispnea Non comuni: dolore toracico In altri studi o nel corso dell esperienza post-marketing, sono stati segnalati rari casi di sanguinamenti intracranici/intracerebrali e retroperitoneali. Segnalazione delle reazioni avverse sospette. La segnalazione delle reazioni avverse sospette che si verifi cano dopo l autorizzazione del medicinale è importante. Essa permette un monitoraggio continuo del rapporto benefi cio/rischio del medicinale. Agli operatori sanitari è richiesto di segnalare qualsiasi reazione avversa sospetta tramite il sistema nazionale di segnalazione riportato nell'allegato V. 4.9 Sovradosaggio. Dosi di fondaparinux superiori al regime raccomandato possono portare ad un aumentato rischio di sanguinamento. Non vi sono antidoti noti al fondaparinux. Il sovradosaggio associato a complicanze emorragiche deve comportare l interruzione del trattamento e la ricerca della causa primaria. Deve essere preso in considerazione l avvio di una terapia appropriata quali emostasi chirurgica, trasfusione di sangue, trasfusione di plasma fresco, plasmaferesi. 5. PROPRIETÀ FARMACOLOGICHE. 5.1 Proprietà farmacodinamiche. Categoria farmacoterapeutica: agenti antitrombotici. Codice ATC: B01AX05. Effetti farmacodinamici. Fondaparinux è un inibitore sintetico e selettivo del Fattore X attivato (Xa). L attività antitrombotica di fondaparinux è il risultato dell inibizione selettiva del Fattore Xa mediata dall antitrombina III (ATIII). Tramite il legame selettivo con ATIII, fondaparinux potenzia (circa 300 volte) la neutralizzazione naturale del fattore Xa tramite ATIII. La neutralizzazione del Fattore Xa interrompe la cascata della coagulazione ematica e inibisce sia la formazione di trombina che lo sviluppo del trombo. Fondaparinux non inattiva la trombina (Fattore II attivato) e non ha effetto sulle piastrine. Alla dose di 2,5 mg, fondaparinux non infl uenza i test di routine della coagulazione quali il Tempo di tromboplastina parziale attivata (aptt), il tempo di coagulazione attivata (ACT) o il tempo di protrombina (PT)/International Normalised Ratio (INR) nel plasma né il tempo di sanguinamento o l attività fi brinolitica. Tuttavia, sono state ricevute solo rare segnalazioni di prolungamento dell aptt. Fondaparinux non reagisce in modo crociato con il siero di pazienti con trombocitopenia indotta da eparina. Studi clinici. Prevenzione del tromboembolismo venoso (TEV) in pazienti sottoposti a chirurgia ortopedica maggiore degli arti inferiori trattati fino a 9 giorni: il piano clinico di fondaparinux è stato disegnato per dimostrare l effi cacia di fondaparinux nella prevenzione degli eventi tromboembolici venosi (TEV), cioè trombosi venosa profonda prossimale e distale (TVP) ed embolia polmonare (EP) in pazienti sottoposti a chirurgia ortopedica maggiore degli arti inferiori quali frattura dell anca, chirurgia maggiore del ginocchio o chirurgia sostitutiva dell anca. Negli studi clinici controllati di fase II e III sono stati studiati oltre pazienti (frattura dell anca , sostituzione dell anca - 5,829, chirurgia maggiore del ginocchio ). Fondaparinux 2,5 mg in monosomministrazione giornaliera iniziata 6-8 ore dopo l intervento chirurgico è stato confrontato con enoxaparina 40 mg in monosomministrazione giornaliera iniziata 12 ore prima dell intervento chirurgico, o 30 mg due volte al giorno iniziata ore dopo l intervento chirurgico. In un analisi aggregata di tali studi, il regime di dose raccomandato di fondaparinux versus enoxaparina è stato associato a una diminuzione signifi cativa (54%-95% IC, 44%; 63%) nell incidenza di TEV valutata fi no all 11 giorno dopo l intervento chirurgico, indipendentemente dal tipo di intervento effettuato. La maggioranza degli eventi end-point è stata diagnosticata con una venografi a prefi ssata e risultò composta principalmente da TVP distale, ma anche l incidenza di TVP prossimale risultò signifi cativamente ridotta. L incidenza di TEV sintomatico, inclusa EP, non risultò signifi cativamente diversa tra i gruppi di trattamento. Negli studi versus enoxaparina 40 mg in monosomministrazione giornaliera iniziata 12 ore prima dell intervento chirurgico, sanguinamenti gravi sono stati osservati nel 2,8% dei pazienti trattati con fondaparinux alla dose raccomandata in confronto a 2,6% con enoxaparina. Prevenzione del tromboembolismo venoso (TEV) in pazienti sottoposti a chirurgia per frattura d anca trattati fino a 24 giorni successivi a una profilassi iniziale di 1 settimana: in uno studio clinico randomizzato in doppio cieco, 737 pazienti sono stati trattati con fondaparinux 2,5 mg in monosomministrazione giornaliera per 7±1 giorni dopo chirurgia per frattura d anca. Alla fi ne di questo periodo, 656 pazienti sono stati randomizzati per ricevere fondaparinux 2,5 mg in monosomministrazione giornaliera o placebo per ulteriori 21±2 giorni. Fondaparinux ha dato una riduzione signifi cativa dell incidenza globale del TEV in confronto a placebo [3 pazienti (1,4%) vs 77 pazienti (35%), rispettivamente]. La maggioranza (70/80) degli episodi di TEV riportati erano casi di TVP asintomatica rilevati fl ebografi camente. Fondaparinux ha dato anche una riduzione signifi cativa dell incidenza del TEV sintomatico (TVP e/o EP) [1 (0,3%) vs 9 (2,7%) pazienti, rispettivamente] comprese 2 EP fatali riportate nel gruppo placebo. I sanguinamenti gravi, tutti in sede di intervento chirurgico e nessuno fatale, sono stati osservati in 8 pazienti (2,4%) trattati con fondaparinux 2,5 mg in confronto a 2 (0,6%) con placebo. Prevenzione degli Episodi Tromboembolici Venosi (TEV) in pazienti sottoposti a chirurgia addominale considerati ad alto rischio di complicazioni tromboemboliche, quali pazienti sottoposti a chirurgia addominale per patologie tumorali: in uno studio clinico in doppio cieco, 2,927 pazienti sono stati randomizzati per ricevere fondaparinux 2,5 mg una volta al giorno o dalteparina 5000 UI una volta al giorno, mediante una iniezione pre-operatoria di 2500 UI ed una prima iniezione post-operatoria di 2500 UI, per 7+2 giorni. I siti principali dell intervento chirurgico sono stati colon-rettali, gastrici, epatici, colecistectomia o altri interventi biliari. Il sessantanove percento dei pazienti sono stati sottoposti a chirurgia oncologica. I pazienti sottoposti ad interventi chirurgici urologici (esclusi quelli sul rene) o ginecologici, a chirurgia laparoscopica o vascolare non sono stati inclusi nello studio. In questo studio, l incidenza di TEV totali è stata del 4,6% (47/1,027) con fondaparinux, in confronto al 6,1% (62/1.021) con dalteparina: riduzione odd ratio (95%CI)= -25,8% (-49,7%, 9,5%). La
34 differenza nella frequenza di TEV totali tra i gruppi di trattamento, che non è stata statisticamente signifi cativa, era principalmente dovuta alla riduzione di TVP distale. L incidenza di TVP sintomatica è risultata simile tra i due gruppi di trattamento: 6 pazienti (0,4%) nel gruppo di fondaparinux verso 5 pazienti (0,3%) nel gruppo di dalteparina. Nell ampio sottogruppo di pazienti sottoposti a chirurgia per patologie tumorali (69% della popolazione dei pazienti), la frequenza di TEV è stata del 4,7% nel gruppo di fondaparinux, in confronto al 7,7% del gruppo di dalteparina. Sanguinamenti gravi sono stati osservati nel 3,4% dei pazienti trattati con fondaparinux e nel 2,4% del gruppo trattato con dalteparina. Prevenzione degli Episodi Tromboembolici Venosi (TEV) in pazienti di pertinenza medica ad alto rischio di complicanze tromboemboliche a causa di una ridotta mobilità nel corso di patologie acute: In uno studio clinico randomizzato in doppio cieco, 839 pazienti sono stati trattati da 6 a 14 giorni con fondaparinux 2,5 mg una volta al giorno o con placebo. In questo studio sono stati inclusi pazienti di pertinenza medica in fase acuta, con età 60 anni, per i quali si prevedeva che fossero allettati per almeno quattro giorni, e ospedalizzati per insuffi cienza cardiaca congestizia classe III/IV NYHA e/o patologia respiratoria acuta e/o patologia acuta infettiva o infi ammatoria. Fondaparinux in confronto a placebo ha ridotto signifi cativamente l incidenza complessiva di TEV [18 pazienti (5,6%) vs 34 pazienti (10,5%), rispettivamente]. La maggioranza degli eventi sono stati TVP distale asintomatica. Fondaparinux ha anche ridotto signifi cativamente l incidenza di EP considerata fatale [0 pazienti (0,0%) vs 5 pazienti (1,2%), rispettivamente]. Sanguinamenti gravi sono stati osservati in 1 paziente (0,2%) di ciascun gruppo. Trattamento di pazienti con trombosi venosa superficiale acuta sintomatica spontanea senza Trombosi Venosa Profonda concomitante (TVP). Uno studio clinico randomizzato, in doppio cieco (CALISTO) ha incluso 3002 pazienti con trombosi venosa superfi ciale spontanea, acuta, sintomatica ed isolata agli arti inferiori, di lunghezza pari ad almeno 5 cm, confermata da ultrasonografi a per compressione (CUS). I pazienti non erano inclusi se avevano TVP concomitante o una trombosi venosa superfi ciale entro 3 cm dalla giunzione safeno-femorale. I pazienti erano esclusi se avevano insuffi cienza epatica grave, insuffi cienza renale grave (clearance della creatinina <30 ml/min), basso peso corporeo (<50 kg), tumore attivo, EP sintomatica o una storia recente di TVP/EP (<6 mesi) o trombosi venosa superfi ciale (<90 giorni), o trombosi venosa superfi ciale associata a terapia sclerosante o a complicanze di una linea endovenosa, oppure se ad elevato rischio di sanguinamento. I pazienti venivano randomizzati a ricevere fondaparinux 2,5 mg una volta al giorno o placebo per 45 giorni in aggiunta a calze elastiche, analgesici e/o farmaci antinfi ammatori non steroidei (FANS) per uso topico. Il follow-up è continuato fi no al Giorno 77. La popolazione dello studio era per il 64% femmina, con un età mediana di 58 anni, il 4,4% aveva la clearance della creatinina <50 ml/min. L outcome primario di effi cacia, un outcome composito di EP sintomatica, TVP sintomatica, estensione di trombosi venosa superfi ciale sintomatica, ricorrenza di trombosi venosa superfi ciale sintomatica, o Morte al Giorno 47, era signifi cativamente ridotto dal 5,9% nei pazienti del gruppo placebo allo 0,9% in quelli che ricevevano fondaparinux 2,5 mg (riduzione del rischio relativo: 85,2%; 95% IC, 73,7% a 91,7% [p<0,001]). Anche l incidenza di ciascuna componente tromboembolica dell outcome primario era signifi cativamente ridotta nei pazienti del gruppo fondaparinux come di seguito descritto: EP sintomatica [0 (0%) vs 5 (0,3%) (p=0,031)], TVP sintomatica [3 (0,2%) vs 18 (1,2%); riduzione del rischio relativo 83,4% (p<0,001)], estensione della trombosi venosa superfi ciale sintomatica [4 (0,3%) vs 51 (3,4%); riduzione del rischio relativo 92,2% (p<0,001)], ricorrenza della trombosi venosa superfi ciale sintomatica [5 (0,3%) vs 24 (1,6%); riduzione del rischio relativo 79,2% (p<0,001)]. I tassi di mortalità erano bassi e simili tra i gruppi di trattamento con 2 (0,1%) morti nel gruppo fondaparinux versus 1 (0,1%) morte nel gruppo placebo. L effi cacia è stata mantenuta fi no al Giorno 77 ed era consistente in tutti i sottogruppi predefi niti inclusi i pazienti con vene varicose ed i pazienti con trombosi venosa superfi ciale localizzata sotto al ginocchio. I sanguinamenti maggiori durante il trattamento si sono verifi cati in 1 (0,1%) paziente in trattamento con fondaparinux ed in 1 (0,1%) paziente in trattamento con placebo. Sanguinamenti clinicamente rilevanti non maggiori si sono verifi cati in 5 (0,3%) pazienti in trattamento con fondaparinux ed in 8 (0,5%) pazienti in placebo. 5.2 Proprietà farmacocinetiche. Assorbimento. Dopo somministrazione sottocutanea, fondaparinux viene completamente e rapidamente assorbito (biodisponibilità assoluta del 100%). In seguito a una singola iniezione sottocutanea di fondaparinux 2,5 mg a soggetti giovani sani, il picco della concentrazione plasmatica (C max media=0,34 mg/l) si ottiene 2 ore dopo la somministrazione. Le concentrazioni plasmatiche pari alla metà dei valori medi di C max vengono raggiunte 25 minuti dopo la somministrazione. Nei soggetti anziani sani la farmacocinetica di fondaparinux è lineare in un range di dosi da 2 a 8 mg per via sottocutanea. Dopo una dose singola giornaliera lo steady state dei livelli plasmatici si ottiene da 3 a 4 giorni dopo, con un aumento di C max e AUC di 1,3 volte. La media (CV%) dei parametri stimati di fondaparinux allo steady state in pazienti sottoposti a chirurgia sostitutiva dell anca che hanno ricevuto fondaparinux 2,5 mg una volta al giorno sono: C max (mg/l) - 0,39 (31%), T max (h) - 2,8 (18%) e C min (mg/l) - 0,14 (56%). Nei pazienti con frattura dell anca, associata all età avanzata, le concentrazioni plasmatiche di fondaparinux allo steady state sono: C max (mg/l) - 0,50 (32%), C min (mg/l) - 0,19 (58%). Distribuzione. Il volume di distribuzione di fondaparinux è limitato (7-11 litri). In vitro, fondaparinux è altamente e specifi camente legato alla proteina antitrombina con un legame dose-dipendente dalla concentrazione plasmatica (da 98,6% a 97,0% in un intervallo di concentrazioni da 0,5 a 2 mg/l). Fondaparinux non si lega signifi cativamente ad altre proteine plasmatiche, compreso il fattore piastrinico 4 (PF4). Dato che fondaparinux non si lega signifi cativamente alle proteine del plasma salvo che a ATIII, non è attesa nessuna interazione con altri farmaci mediante lo spostamento del legame proteico. Biotrasformazione. Sebbene non completamente valutato, non c è evidenza del metabolismo di fondaparinux e in particolare di formazione di metaboliti attivi. Fondaparinux non inibisce in vitro il sistema CYP450 (CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1 o CYP3A4). Pertanto non si ritiene che fondaparinux interagisca in vivo con altri farmaci tramite l inibizione del metabolismo mediato da CYP. Eliminazione. L emivita di eliminazione (t ½ ) è di circa 17 ore nei soggetti sani giovani e di circa 21 ore nei soggetti sani anziani. Fondaparinux è escreto dal 64 al 77% dai reni come composto immodifi cato. Categorie particolari di pazienti: Popolazione pediatrica - Fondaparinux non è stato studiato in questa classe di pazienti per la prevenzione di TEV o per il trattamento della trombosi venosa superfi ciale. Pazienti anziani - La funzione renale può diminuire con l età e pertanto la capacità di eliminazione di fondaparinux può essere ridotta nell anziano. In pazienti di età >75 anni sottoposti a intervento chirurgico, la clearance plasmatica stimata è risultata da 1,2 a 1,4 volte più bassa rispetto ai pazienti con età <65 anni. Insuffi cienza renale - Confrontata con pazienti con funzioni renali normali (clearance della creatinina >80 ml/min), la clearance plasmatica è da 1,2 a 1,4 volte più bassa nei pazienti con insuffi cienza renale lieve (clearance della creatinina da 50 a 80 ml/min) e in media 2 volte più bassa in pazienti con insuffi cienza renale moderata (clearance della creatinina da 30 a 50 ml/min). Nell insuffi cienza renale grave (clearance della creatinina <30 ml/min), la clearance plasmatica è approssimativamente 5 volte più bassa rispetto ai pazienti con funzione renale normale. I relativi valori terminali di emivita sono stati 29 h nei pazienti con insuffi cienza renale moderata e 72 h in quelli con insuffi cienza renale grave. Sesso - Non è stata riscontrata alcuna differenza tra i sessi dopo aggiustamento in base al peso corporeo. Razza - Le differenze farmacocinetiche dovute alla razza non sono state studiate in maniera prospettica. Tuttavia, studi effettuati su soggetti sani asiatici (giapponesi) non hanno rivelato un profi lo farmacocinetico diverso in confronto ai soggetti sani caucasici. Similmente, nessuna differenza della clearance plasmatica è stata osservata tra pazienti neri e caucasici sottoposti a interventi ortopedici. Peso corporeo - La clearance plasmatica di fondaparinux aumenta con il peso corporeo (9% di aumento ogni 10 kg). Insuffi cienza epatica - A seguito di una singola dose per via sottocutanea di fondaparinux in soggetti con insuffi cienza epatica moderata (Categoria B dell indice Child-Pugh), la C max totale (e cioè, sia legata che libera) e l AUC erano diminuite del 22% e del 39%, rispettivamente, in confronto con soggetti con funzionalità epatica normale. Le minori concentrazioni plasmatiche di fondaparinux sono state attribuite alla riduzione del legame con l ATIII, a sua volta dipendente dalle minori concentrazioni plasmatiche di ATIII in soggetti con insuffi cienza epatica che, quindi, ha come risultato un incremento nella clearance renale di fondaparinux. In conseguenza di ciò, ci si attende che le concentrazioni libere di fondaparinux rimangano invariate in pazienti con insuffi cienza epatica di grado lieve o moderato e, pertanto, in base alla farmacocinetica non è necessario alcun aggiustamento della dose. 5.3 Dati preclinici di sicurezza. I dati non clinici non rivelano rischi particolari per l uomo sulla base di studi convenzionali di farmacologia di sicurezza, tossicità a dosi ripetute egenotossicità. Gli studi sull animale sono insuffi cienti per quanto riguarda effetti di tossicità sulla riproduzione a causa dell esposizione limitata. 6. INFORMAZIONI FARMACEUTICHE. 6.1 Elenco degli eccipienti. Sodio cloruro. Acqua per preparazioni iniettabili. Acido cloridrico. Sodio idrossido. 6.2 Incompatibilità. In assenza di studi di compatibilità, questo farmaco non deve essere miscelato con altri medicinali.
Indicazione Esclusiva TVS ( AIFA Gazzetta Ufficiale )
 Indicazione Esclusiva TVS ( AIFA Gazzetta Ufficiale ) ARIXTRA (Fondaparinux) nuove indicazioni Determina terapeutiche AIFA nella n. 711/2013( trombosi venosa Gazzetta superficiale Ufficiale dal n. 5195
Indicazione Esclusiva TVS ( AIFA Gazzetta Ufficiale ) ARIXTRA (Fondaparinux) nuove indicazioni Determina terapeutiche AIFA nella n. 711/2013( trombosi venosa Gazzetta superficiale Ufficiale dal n. 5195
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. Arixtra 1,5 mg/0,3 ml soluzione iniettabile, siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA. Ogni siringa
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. Arixtra 1,5 mg/0,3 ml soluzione iniettabile, siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA. Ogni siringa
PROFILASSI ANTITROMBOTICA IN CHIRURGIA GENERALE
 CHIRURGIA GENERALE MAGGIORE (tutti gli interventi di durata > 30 minuti o di chirurgia addominale) TIPO DI PATOLOGIA TIPO DI CHIRURGIA MIRE (tutti gli interventi di durata < 30 minuti, esclusa la chirurgia
CHIRURGIA GENERALE MAGGIORE (tutti gli interventi di durata > 30 minuti o di chirurgia addominale) TIPO DI PATOLOGIA TIPO DI CHIRURGIA MIRE (tutti gli interventi di durata < 30 minuti, esclusa la chirurgia
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Arixtra 1,5 mg/0,3 ml soluzione iniettabile, siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Arixtra 1,5 mg/0,3 ml soluzione iniettabile, siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni
Vasculopatie venose. Dr. Giovanni Papa Coordinatore FIMMG FORMAZIONE LAZIO
 Vasculopatie venose Dr. Giovanni Papa Coordinatore FIMMG FORMAZIONE LAZIO CASO CLINICO Manfredi, 63 anni Anamnesi patologica remota: Ipertensione arteriosa Dislipidemia Insufficienza venosa di grado lieve
Vasculopatie venose Dr. Giovanni Papa Coordinatore FIMMG FORMAZIONE LAZIO CASO CLINICO Manfredi, 63 anni Anamnesi patologica remota: Ipertensione arteriosa Dislipidemia Insufficienza venosa di grado lieve
I protocolli di prevenzione e trattamento delle TVP. Walter Ageno Dipartimento di Medicina Clinica Università degli Studi dell Insubria Varese
 I protocolli di prevenzione e trattamento delle TVP Walter Ageno Dipartimento di Medicina Clinica Università degli Studi dell Insubria Varese Rischio di TVP in assenza di profilassi in diversi gruppi di
I protocolli di prevenzione e trattamento delle TVP Walter Ageno Dipartimento di Medicina Clinica Università degli Studi dell Insubria Varese Rischio di TVP in assenza di profilassi in diversi gruppi di
CIRO FALASCONI LA TVS ED IL RISCHIO TROMBOEMBOLICO: COME TRATTARLA. Relazione svolta in assenza di conflitto di interessi
 LA TVS ED IL RISCHIO TROMBOEMBOLICO: COME TRATTARLA Relazione svolta in assenza di conflitto di interessi TROMBOSI VENOSA SUPERFICIALE prova Trombosi a carico di una vena del distretto venoso superficiale
LA TVS ED IL RISCHIO TROMBOEMBOLICO: COME TRATTARLA Relazione svolta in assenza di conflitto di interessi TROMBOSI VENOSA SUPERFICIALE prova Trombosi a carico di una vena del distretto venoso superficiale
FONDAPARINUX ( )
 FONDAPARINUX (30-05-2007) Specialità: Arixtra (Glaxosmithkline) Forma farmaceutica: 10 siringhe 2,5 mg/0,5 ml - Prezzo: euro 67.45 10 siringhe 5 mg / 0,4 ml - Prezzo: euro 138.04 10 siringhe 7,5 mg / 0,6
FONDAPARINUX (30-05-2007) Specialità: Arixtra (Glaxosmithkline) Forma farmaceutica: 10 siringhe 2,5 mg/0,5 ml - Prezzo: euro 67.45 10 siringhe 5 mg / 0,4 ml - Prezzo: euro 138.04 10 siringhe 7,5 mg / 0,6
Il trattamento della trombosi venosa profonda
 Il trattamento della trombosi venosa profonda Fiumicino, 19 dicembre 2015 www.cos.it/mediter Trombosi Venosa Profonda (DVT) [NOACs Anticoagulant therapy for venous thromboembolism] Glossario DVT (Deep
Il trattamento della trombosi venosa profonda Fiumicino, 19 dicembre 2015 www.cos.it/mediter Trombosi Venosa Profonda (DVT) [NOACs Anticoagulant therapy for venous thromboembolism] Glossario DVT (Deep
Terapia del tromboembolismo venoso: il ruolo di dabigatran
 APPROFONDIMENTI, 17 luglio 2015 Terapia del tromboembolismo venoso: il ruolo di dabigatran A cura di Raffaella Benedetti e Davide Imberti SOMMARIO Il trattamento del tromboembolismo venoso (TEV) sino a
APPROFONDIMENTI, 17 luglio 2015 Terapia del tromboembolismo venoso: il ruolo di dabigatran A cura di Raffaella Benedetti e Davide Imberti SOMMARIO Il trattamento del tromboembolismo venoso (TEV) sino a
PREVENZIONE DEL TROMBOEMBOLISMO VENOSO NEI PAZIENTI INTERNISTICI
 Pag 1 di 10 1. SCOPO E CAMPO DI APPLICAZIONE... 3 2. PERSONALE INTERESSATO... 3 3. PAROLE CHIAVE... 3 4. PROCEDURA OPERATIVA... 3 4.1 PREMESSA... 3 4.2 PROFILASSI MECCANICA... 4 4.2.1 Controindicazioni
Pag 1 di 10 1. SCOPO E CAMPO DI APPLICAZIONE... 3 2. PERSONALE INTERESSATO... 3 3. PAROLE CHIAVE... 3 4. PROCEDURA OPERATIVA... 3 4.1 PREMESSA... 3 4.2 PROFILASSI MECCANICA... 4 4.2.1 Controindicazioni
Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali. Meccanismo di azione e interazioni farmacologiche
 A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
A06 Maria Antonietta Lepore Indagini sperimentali sui nuovi anticoagulanti orali Meccanismo di azione e interazioni farmacologiche Copyright MMXV Aracne editrice int.le S.r.l. www.aracneeditrice.it info@aracneeditrice.it
Scheda di dosaggio. Pfizer PFE Switzerland GmbH Schärenmoosstrasse 99 Casella postale 8052 Zürich
 Riferimenti: 1. Fragmin (Dalteparina sodica). Nuove informazioni specialistiche: www.swissmedicinfo.ch. 2. Rasmussen MS et al. Prolonged prophylaxis with dalteparin to prevent late thromboembolic complications
Riferimenti: 1. Fragmin (Dalteparina sodica). Nuove informazioni specialistiche: www.swissmedicinfo.ch. 2. Rasmussen MS et al. Prolonged prophylaxis with dalteparin to prevent late thromboembolic complications
INTRODUZIONE E CONTESTO CLINICO DI UTILIZZO APPROPRIATO
 INTRODUZIONE E CONTESTO CLINICO DI UTILIZZO APPROPRIATO Gli effetti anticoagulanti di Pradaxa sono importanti e salvavita per alcuni pazienti, ma ci sono situazioni in cui e necessario inattivare rapidamente
INTRODUZIONE E CONTESTO CLINICO DI UTILIZZO APPROPRIATO Gli effetti anticoagulanti di Pradaxa sono importanti e salvavita per alcuni pazienti, ma ci sono situazioni in cui e necessario inattivare rapidamente
PP.DS.07 AUTORIZZAZIONI REDATTO VERIFICATO APPROVATO. PP.DS.07 Rev. 2 : 22/11/2011 Pag. 1/9. USL 3 PISTOIA Zona di Pistoia P.O.
 Pag. 1/9 REV DATA AUTORIZZAZIONI REDATTO VERIFICATO APPROVATO 2 22/11/2011 Referente Gruppo di Lavoro sulla Coagulazione Referente Sistema Qualità Direttore Pag. 2/9 INDICE 1. Oggetto... 3 2. Scopo...
Pag. 1/9 REV DATA AUTORIZZAZIONI REDATTO VERIFICATO APPROVATO 2 22/11/2011 Referente Gruppo di Lavoro sulla Coagulazione Referente Sistema Qualità Direttore Pag. 2/9 INDICE 1. Oggetto... 3 2. Scopo...
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA)
 Dublin 12 Luglio 2017 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) Arixtra (fondaparinux sodico) siringhe pre-riempite - carenza di fornitura a seguito di sospensione
Dublin 12 Luglio 2017 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA ITALIANA DEL FARMACO (AIFA) Arixtra (fondaparinux sodico) siringhe pre-riempite - carenza di fornitura a seguito di sospensione
UOC RISK MANAGEMENT DIRETTORE DOTT. VITTORIO AMEDEO CICOGNA
 UOC RISK MANAGEMENT DIRETTORE DOTT. VITTORIO AMEDEO CICOGNA LINEE DI INDIRIZZO PER LA PROFILASSI DELLA TROMBOSI VENOSA PROFONDA (TVP) AZIENDA USL ROMA 6 - ERRATA CORRIGE 06/03/2018 A seguito di una verifica
UOC RISK MANAGEMENT DIRETTORE DOTT. VITTORIO AMEDEO CICOGNA LINEE DI INDIRIZZO PER LA PROFILASSI DELLA TROMBOSI VENOSA PROFONDA (TVP) AZIENDA USL ROMA 6 - ERRATA CORRIGE 06/03/2018 A seguito di una verifica
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Maggio 2013 Nuove importanti restrizioni all uso di Protelos/Osseor (ranelato di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ESAPENT 1000 mg Capsule molli ESAPENT 500 mg Capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ESAPENT 1000 mg capsule
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Protamina Meda 50 mg/5 ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una fiala contiene Principio Attivo:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Protamina Meda 50 mg/5 ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una fiala contiene Principio Attivo:
4.2 Indicazioni per l utilizzazione specificando le specie di destinazione
 1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Melovem 5 mg/ml soluzione iniettabile per bovini e suini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene: Principio attivo: Meloxicam 5 mg Eccipiente(i):
1. DENOMINAZIONE DEL MEDICINALE VETERINARIO Melovem 5 mg/ml soluzione iniettabile per bovini e suini 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni ml contiene: Principio attivo: Meloxicam 5 mg Eccipiente(i):
Università di Bologna
 Cremona, 4 Marzo2016 A chi e quale NAO Prof. Gualtiero Palareti Malattie Cardiovascolari Università di Bologna From Blondon & Bounameaux, Circulation 2015 Initial Long-Term Extended From Kearon et al.,
Cremona, 4 Marzo2016 A chi e quale NAO Prof. Gualtiero Palareti Malattie Cardiovascolari Università di Bologna From Blondon & Bounameaux, Circulation 2015 Initial Long-Term Extended From Kearon et al.,
La profilassi antitrombotica nel trattamento del paziente varicoso
 Azienda Ospedaliera Fatebenefratelli U.D.S. di Chirurgia Vascolare Responsabile: F Prestipino La profilassi antitrombotica nel trattamento del paziente varicoso A Pinto, Auditorium Angelicum 19 maggio
Azienda Ospedaliera Fatebenefratelli U.D.S. di Chirurgia Vascolare Responsabile: F Prestipino La profilassi antitrombotica nel trattamento del paziente varicoso A Pinto, Auditorium Angelicum 19 maggio
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Pradaxa 75 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula rigida contiene 75 mg di dabigatran
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 1. DENOMINAZIONE DEL MEDICINALE Pradaxa 75 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula rigida contiene 75 mg di dabigatran
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE PYRALVEX 0,5% + 0,1% Soluzione gengivale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 10 ml contengono : Principi attivi - Estratto
EMBOLIA POLMONARE: COMPLICANZE AT10. CHEST 2016;149(2):
 EMBOLIA POLMONARE: COMPLICANZE AT10. CHEST 2016;149(2):315-352 From: 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism The Task Force for the Diagnosis and Management of Acute
EMBOLIA POLMONARE: COMPLICANZE AT10. CHEST 2016;149(2):315-352 From: 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism The Task Force for the Diagnosis and Management of Acute
Scuola di Specializzazione in Medicina Interna. Direttore: Prof. Paolo Martelletti
 Scuola di Specializzazione in Medicina Interna Direttore: Prof. Paolo Martelletti TERAPIA ANTICOAGULANTE: COME MUOVERSI? Dott. M. Luciani Dott. V. Spuntarelli Pagina 2 ANTICOAGULANTI DISPONIBILI EPARINA
Scuola di Specializzazione in Medicina Interna Direttore: Prof. Paolo Martelletti TERAPIA ANTICOAGULANTE: COME MUOVERSI? Dott. M. Luciani Dott. V. Spuntarelli Pagina 2 ANTICOAGULANTI DISPONIBILI EPARINA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE Ebastina Teva 10 mg compresse orodispersibili Ebastina Teva 20 mg compresse orodispersibili 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA
Allegato III. Modifiche ai paragrafi pertinenti delle Informazioni sul Prodotto
 Allegato III Modifiche ai paragrafi pertinenti delle Informazioni sul Prodotto Nota: Le presenti modifiche ai paragrafi pertinenti delle informazioni sul prodotto sono l esito della procedura di referral.
Allegato III Modifiche ai paragrafi pertinenti delle Informazioni sul Prodotto Nota: Le presenti modifiche ai paragrafi pertinenti delle informazioni sul prodotto sono l esito della procedura di referral.
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ALLERGODIL 0,5 mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Azelastina cloridrato 0,05% (0,5 mg/ml).
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ALLERGODIL 0,5 mg/ml collirio, soluzione 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Azelastina cloridrato 0,05% (0,5 mg/ml).
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE TRIATOP 1% shampoo 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di shampoo contiene: Principio attivo Ketoconazolo 10
Linee guida nell uso delle eparine a basso PM LMWH (low molecular weight heparin)
 Linee guida nell uso delle eparine a basso PM LMWH (low molecular weight heparin) In commercio: Clexane (Enoxaparina) Fragmin (Deltaparina) Fraxiparina, Seleparina, Seledie (Nadroparina) Clivarina (Reviparina)
Linee guida nell uso delle eparine a basso PM LMWH (low molecular weight heparin) In commercio: Clexane (Enoxaparina) Fragmin (Deltaparina) Fraxiparina, Seleparina, Seledie (Nadroparina) Clivarina (Reviparina)
Guida per il medico prescrittore. LIXIANA (edoxaban)
 Guida per il medico prescrittore LIXIANA (edoxaban) SINTESI QUESTA GUIDA È CONCEPITA SPECIFICAMENTE PER I MEDICI PRESCRITTORI IN RELAZIONE ALL USO DI LIXIANA (EDOXABAN) E CONTIENE INFORMAZIONI SUI SEGUENTI
Guida per il medico prescrittore LIXIANA (edoxaban) SINTESI QUESTA GUIDA È CONCEPITA SPECIFICAMENTE PER I MEDICI PRESCRITTORI IN RELAZIONE ALL USO DI LIXIANA (EDOXABAN) E CONTIENE INFORMAZIONI SUI SEGUENTI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OLEVIA 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una capsula molle contiene 1000 mg di Acidi omega-3
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON L AGENZIA EUROPEA DEI MEDICINALI (EMA) E L AGENZIA ITALIANA DEL FARMACO (AIFA) Agosto 2012 Comunicazione diretta agli operatori sanitari sull associazione tra
BRIDGING ANTICOAGULATION
 BRIDGING ANTICOAGULATION dr. Esmeralda Filippucci Sezione di Medicina Interna e Vascolare/Stroke Unit Università di Perugia BRIDGING ANTICOAGULATION DIMENSIONE DEL PROBLEMA QUALI PAZIENTI? QUALE INTERVENTO?
BRIDGING ANTICOAGULATION dr. Esmeralda Filippucci Sezione di Medicina Interna e Vascolare/Stroke Unit Università di Perugia BRIDGING ANTICOAGULATION DIMENSIONE DEL PROBLEMA QUALI PAZIENTI? QUALE INTERVENTO?
XXIX Congresso Nazionale FCSA Bologna ottobre 2018 STUDIO GIASONE
 XXIX Congresso Nazionale FCSA Bologna 22-23 ottobre 2018 STUDIO GIASONE Prof. Gualtiero Palareti Malattie Cardiovascolari, Università di Bologna Fondazione «Arianna Anticoagulazione», Bologna 2016 In patients
XXIX Congresso Nazionale FCSA Bologna 22-23 ottobre 2018 STUDIO GIASONE Prof. Gualtiero Palareti Malattie Cardiovascolari, Università di Bologna Fondazione «Arianna Anticoagulazione», Bologna 2016 In patients
La Patologia Venosa: Non Solo Varici. Venerdi 23 ottobre 2015 Abano Terme (PD)
 La Patologia Venosa: Non Solo Varici Venerdi 23 ottobre 2015 Abano Terme (PD) NUOVI ANTICOAGULANTI ORALI: QUANDO E COME PRESCRIVERLI Dr. Alberto Cogo Unità Medicina Vascolare e Piede Diabetico Casa di
La Patologia Venosa: Non Solo Varici Venerdi 23 ottobre 2015 Abano Terme (PD) NUOVI ANTICOAGULANTI ORALI: QUANDO E COME PRESCRIVERLI Dr. Alberto Cogo Unità Medicina Vascolare e Piede Diabetico Casa di
Università degli studi di Genova Facoltà di Medicina e Chirurgia Corso di Laurea in Medicina e Chirurgia
 Università degli studi di Genova Facoltà di Medicina e Chirurgia Corso di Laurea in Medicina e Chirurgia Relatori: Chiar.ma Prof.ssa Antonietta Piana Chiar.mo Dott. Andrea Stimamiglio Candidata: Oliveri
Università degli studi di Genova Facoltà di Medicina e Chirurgia Corso di Laurea in Medicina e Chirurgia Relatori: Chiar.ma Prof.ssa Antonietta Piana Chiar.mo Dott. Andrea Stimamiglio Candidata: Oliveri
APPROPPRIATEZZA PRESCRITTIVA DELLE EPARINE A BASSO PESO MOLECOLARE E FONDAPARINUX
 Dott Domenico Tartaglia: Resp.DPC ASL AV - Dott Saverio Genua: Segretario SIMG AV APPROPPRIATEZZA PRESCRITTIVA DELLE EPARINE A BASSO PESO MOLECOLARE E FONDAPARINUX La prescrizione di eparine a basso peso
Dott Domenico Tartaglia: Resp.DPC ASL AV - Dott Saverio Genua: Segretario SIMG AV APPROPPRIATEZZA PRESCRITTIVA DELLE EPARINE A BASSO PESO MOLECOLARE E FONDAPARINUX La prescrizione di eparine a basso peso
La prevenzione della trombosi venosa profonda. Andreas Kunze
 La prevenzione della trombosi venosa profonda Andreas Kunze 25.000 persone in Inghilterra muoiono ogni anno per embolia polmonare, superando quelle morte per causa di incidente stradale, AIDS e tumore
La prevenzione della trombosi venosa profonda Andreas Kunze 25.000 persone in Inghilterra muoiono ogni anno per embolia polmonare, superando quelle morte per causa di incidente stradale, AIDS e tumore
Malattia Tromboembolica Venosa: sviluppo di un team infermieristico per la gestione del paziente in trattamento antitrombotico
 XXIV CONGRESSO NAZIONALE SISET Malattia Tromboembolica Venosa: sviluppo di un team infermieristico per la gestione del paziente in trattamento antitrombotico LUCIA BASSO ABANO TERME 12 NOVEMBRE 2016 L
XXIV CONGRESSO NAZIONALE SISET Malattia Tromboembolica Venosa: sviluppo di un team infermieristico per la gestione del paziente in trattamento antitrombotico LUCIA BASSO ABANO TERME 12 NOVEMBRE 2016 L
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE AUREOMICINA 1 % Crema Oftalmica Tubo 3,5 g 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di crema oftalmica contiene:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE AUREOMICINA 1 % Crema Oftalmica Tubo 3,5 g 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Un grammo di crema oftalmica contiene:
Sintesi generale della valutazione scientifica di Kytril e denominazioni associate (vedere Allegato I)
 ALLEGATO II CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, DELL ETICHETTATURA E DEL FOGLIO ILLUSTRATIVO PRESENTATI DALL AGENZIA EUROPEA PER I MEDICINALI
ALLEGATO II CONCLUSIONI SCIENTIFICHE E MOTIVI DELLA MODIFICA DEL RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, DELL ETICHETTATURA E DEL FOGLIO ILLUSTRATIVO PRESENTATI DALL AGENZIA EUROPEA PER I MEDICINALI
TRADUZIONE DIAGRAMMI DI FLUSSO DI : QUICK REFERENCE GUIDE
 TRADUZIONE DIAGRAMMI DI FLUSSO DI : QUICK REFERENCE GUIDE ISSUE DATE : JANUARY 2010 VEUS THROMBOEMBOLISM: REDUCING THE RISK Reducing the risk of venous thromboembolism (deep vein thrombosis and pulmonary
TRADUZIONE DIAGRAMMI DI FLUSSO DI : QUICK REFERENCE GUIDE ISSUE DATE : JANUARY 2010 VEUS THROMBOEMBOLISM: REDUCING THE RISK Reducing the risk of venous thromboembolism (deep vein thrombosis and pulmonary
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE LIDO-HYAL A 25 U.I. e LIDO-HYAL B 175 U.I. soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA IN PRINCIPI ATTIVI
Alessandro Squizzato
 La terapia anticoagulante old and new : gestione perioperatoria e degli eventi emorragici Varese 18 dicembre 2014 Gestione perioperatoria dei nuovi anticoagulanti (NOACs NOACs) Alessandro Squizzato Centro
La terapia anticoagulante old and new : gestione perioperatoria e degli eventi emorragici Varese 18 dicembre 2014 Gestione perioperatoria dei nuovi anticoagulanti (NOACs NOACs) Alessandro Squizzato Centro
TEV: terapia. Dott. Luca Paris. Ospedale S.Paolo, Savona. Ematologia, sez.utim E.O.
 TEV: terapia Dott. Luca Paris Ospedale S.Paolo, Savona Divisione Medicina Interna 1 ed Ematologia, sez.utim E.O. Il sottoscritto Dott. Luca Paris dichiara che negli ultimi due anni ha avuto i seguenti
TEV: terapia Dott. Luca Paris Ospedale S.Paolo, Savona Divisione Medicina Interna 1 ed Ematologia, sez.utim E.O. Il sottoscritto Dott. Luca Paris dichiara che negli ultimi due anni ha avuto i seguenti
Eparine a basso peso molecolare (Ebpm)
 OSSERVATORIO PER IL BUON USO DEL FARMACO 3 Indicazioni per l uso appropriato delle Eparine a basso peso molecolare (Ebpm) Le EBPM e il Fondaparinux sono stati approvati inizialmente per la prevenzione
OSSERVATORIO PER IL BUON USO DEL FARMACO 3 Indicazioni per l uso appropriato delle Eparine a basso peso molecolare (Ebpm) Le EBPM e il Fondaparinux sono stati approvati inizialmente per la prevenzione
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Inhixa 2.000 UI RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Classe A / RR Prezzo al pubblico al netto degli sconti di legge: 2 siringhe preriempite 4,47 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Inhixa 2.000 UI RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Classe A / RR Prezzo al pubblico al netto degli sconti di legge: 2 siringhe preriempite 4,47 10
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori sanitari è
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori sanitari è
Francesco Marongiu UOC di Medicina Interna ed Emocoagulopatie Università di Cagliari,
 I farmaci parenterali nella terapia del TEV Francesco Marongiu UOC di Medicina Interna ed Emocoagulopatie Università di Cagliari, marongiu@medicina.unica.it ENF Mucopolisaccarde solfatato PM: 15.000 (range:
I farmaci parenterali nella terapia del TEV Francesco Marongiu UOC di Medicina Interna ed Emocoagulopatie Università di Cagliari, marongiu@medicina.unica.it ENF Mucopolisaccarde solfatato PM: 15.000 (range:
Percorso ECD Trombosi Venosa Profonda (Ceva)
 Percorso ECD Trombosi Venosa Profonda (Ceva) l uso delle EBPM/TAO e recentemente di NAO/DOAC permette di trattare a domicilio la TVP con sicurezza, grazie all interazione tra MMG e struttura ospedaliera.
Percorso ECD Trombosi Venosa Profonda (Ceva) l uso delle EBPM/TAO e recentemente di NAO/DOAC permette di trattare a domicilio la TVP con sicurezza, grazie all interazione tra MMG e struttura ospedaliera.
Sinossi Studio MAS TITOLO DELLO STUDIO CODICE DELLO STUDIO
 Sinossi Studio MAS TITOLO DELLO STUDIO CODICE DELLO STUDIO SPONSOR BACKGROUND E RAZIONALE Misura dei livelli di anticoagulazione in pazienti con fibrillazione atriale in trattamento con farmaci anticoagulanti
Sinossi Studio MAS TITOLO DELLO STUDIO CODICE DELLO STUDIO SPONSOR BACKGROUND E RAZIONALE Misura dei livelli di anticoagulazione in pazienti con fibrillazione atriale in trattamento con farmaci anticoagulanti
Allegato III. Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Le sezioni relative delle Caratteristiche del Prodotto e Foglio Illustrativo
Allegato III Modifiche ai paragrafi rilevanti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Le sezioni relative delle Caratteristiche del Prodotto e Foglio Illustrativo
Heit JA et al. J Thromb Trombolys 2016; 41: 3-14
 Heit JA et al. J Thromb Trombolys 2016; 41: 3-14 Cohen AT et al. Thromb Haemost 2007;98:756-764 Dentali F et al. Thromb Haemost 2016;115:399-405 n /1000.000 abitanti Trend temporale Femmine Maschi Dentali
Heit JA et al. J Thromb Trombolys 2016; 41: 3-14 Cohen AT et al. Thromb Haemost 2007;98:756-764 Dentali F et al. Thromb Haemost 2016;115:399-405 n /1000.000 abitanti Trend temporale Femmine Maschi Dentali
VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini. Ketoprofene
 VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini (Ketoprofene) Il ketoprofene è un antinfiammatorio non steroideo, dotato di una forte attività antinfiammatoria, antalgica ed antipiretica.
VET-KETOFEN, 100 mg/ml Soluzione iniettabile per bovini, cavalli e suini (Ketoprofene) Il ketoprofene è un antinfiammatorio non steroideo, dotato di una forte attività antinfiammatoria, antalgica ed antipiretica.
Cosa sono i NAO? Angelica Moretti. Medicina d Urgenza Universitaria Direttore Prof. F. Carmassi Azienda Ospedaliero Universitaria Pisana
 Cosa sono i NAO? Angelica Moretti Medicina d Urgenza Universitaria Direttore Prof. F. Carmassi Azienda Ospedaliero Universitaria Pisana La sottoscritta Angelica Moretti ai sensi dell art. 3.3 sul Conflitto
Cosa sono i NAO? Angelica Moretti Medicina d Urgenza Universitaria Direttore Prof. F. Carmassi Azienda Ospedaliero Universitaria Pisana La sottoscritta Angelica Moretti ai sensi dell art. 3.3 sul Conflitto
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE REKORD B12 polvere e solvente per sospensione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Il tappo contiene: Principi attivi:
NUOVI FARMACI E RISCHIO DI ERRORE: L ESEMPIO DEI NUOVI ANTICOAGULANTI ORALI
 LECCO 12-11-2016 NUOVI FARMACI E RISCHIO DI ERRORE: L ESEMPIO DEI NUOVI ANTICOAGULANTI ORALI Claudia Carzaniga ASST MONZA - H. San Gerardo Presidente G.It.I.C. PERCORSO DELLA RELAZIONE NUOVI ANTICOAGULANTI
LECCO 12-11-2016 NUOVI FARMACI E RISCHIO DI ERRORE: L ESEMPIO DEI NUOVI ANTICOAGULANTI ORALI Claudia Carzaniga ASST MONZA - H. San Gerardo Presidente G.It.I.C. PERCORSO DELLA RELAZIONE NUOVI ANTICOAGULANTI
1. Quali dei seguenti fattori influenza l assorbimento di un farmaco?
 QUESTIONARIO 1. Quali dei seguenti fattori influenza l assorbimento di un farmaco? 1. la sua solubilità 2. la sua concentrazione 3. l estensione della superficie disponibile per il suo assorbimento 4.
QUESTIONARIO 1. Quali dei seguenti fattori influenza l assorbimento di un farmaco? 1. la sua solubilità 2. la sua concentrazione 3. l estensione della superficie disponibile per il suo assorbimento 4.
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA)
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITA REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Comunicazione diretta agli operatori sanitari relativa a reazioni avverse gravi conseguenti
Terapia a lungo termine della trombosi venosa profonda e dell embolia polmonare
 Terapia a lungo termine della trombosi venosa profonda e dell embolia polmonare Angelo Santoliquido U.O. Angiologia Fondazione Policlinico Universitario A. Gemelli Università Cattolica del Sacro Cuore
Terapia a lungo termine della trombosi venosa profonda e dell embolia polmonare Angelo Santoliquido U.O. Angiologia Fondazione Policlinico Universitario A. Gemelli Università Cattolica del Sacro Cuore
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO. Per l elenco completo degli eccipienti, vedere paragrafo 6.1
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IBUSTRIN 200 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene: principio attivo: Indobufene 200
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IBUSTRIN 200 mg compresse 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni compressa contiene: principio attivo: Indobufene 200
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti
 Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
Traduzione non ufficiale del foglietto illustrativo tedesco Informazioni per l uso: Informazioni per gli utenti Medivitan iv siringa preriempita 5mg, 1mg, 1,05mg soluzione iniettabile Principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema vaginale ECOMESOL 50 mg ovuli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema vaginale: 100 g
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema vaginale ECOMESOL 50 mg ovuli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema vaginale: 100 g
XXIV CONGRESSO NAZIONALE FCSA. Bologna, novembre 2013
 XXIV CONGRESSO NAZIONALE FCSA Bologna, 7-8-9 novembre 2013 EPARINE A BASSO PESO MOLECOLARE E FONDAPARINUX: QUANDO SI DOVREBBERO USARE E QUANDO NON SI POSSONO USARE Luigi Ria U.O.C. di Medicina Interna
XXIV CONGRESSO NAZIONALE FCSA Bologna, 7-8-9 novembre 2013 EPARINE A BASSO PESO MOLECOLARE E FONDAPARINUX: QUANDO SI DOVREBBERO USARE E QUANDO NON SI POSSONO USARE Luigi Ria U.O.C. di Medicina Interna
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OMEGA 3 DOC Generici 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula molle contiene 1000 mg di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE OMEGA 3 DOC Generici 1000 mg capsule molli 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula molle contiene 1000 mg di
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA' MEDICINALE OLBETAM 250 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene: acipimox 250 mg
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DELLA SPECIALITA' MEDICINALE OLBETAM 250 mg capsule rigide 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula contiene: acipimox 250 mg
11 a Conferenza Nazionale GIMBE SSN: uno per tutti, tutti per uno Bologna, 4 marzo 2016
 11 a Conferenza Nazionale GIMBE SSN: uno per tutti, tutti per uno Bologna, 4 marzo 2016 MALATTIA TROMBOEMBOLICA: un audit multiprofessionale per identificare aree di inappropriatezza Laura Cadorin, Marcello
11 a Conferenza Nazionale GIMBE SSN: uno per tutti, tutti per uno Bologna, 4 marzo 2016 MALATTIA TROMBOEMBOLICA: un audit multiprofessionale per identificare aree di inappropriatezza Laura Cadorin, Marcello
Allegato II. Conclusioni scientifiche
 Allegato II Conclusioni scientifiche 13 Conclusioni scientifiche Haldol, che contiene il principio attivo aloperidolo, è un antipsicotico appartenente al gruppo del butirrofenone. È un potente antagonista
Allegato II Conclusioni scientifiche 13 Conclusioni scientifiche Haldol, che contiene il principio attivo aloperidolo, è un antipsicotico appartenente al gruppo del butirrofenone. È un potente antagonista
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
ALLEGATO I RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1 Medicinale sottoposto a monitoraggio addizionale. Ciò permetterà la rapida identificazione di nuove informazioni sulla sicurezza. Agli operatori
Pagina 1 di 5 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. MOLAXOLE polvere per soluzione orale
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MOLAXOLE polvere per soluzione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni bustina contiene i seguenti principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE MOLAXOLE polvere per soluzione orale 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni bustina contiene i seguenti principi attivi:
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE CLEXANE 2.000 UI (20 mg)/0,2 ml soluzione iniettabile CLEXANE 4.000 UI (40 mg)/0,4 ml soluzione iniettabile CLEXANE T 6.000
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE CLEXANE 2.000 UI (20 mg)/0,2 ml soluzione iniettabile CLEXANE 4.000 UI (40 mg)/0,4 ml soluzione iniettabile CLEXANE T 6.000
Principio attivo: Econazolo nitrato g 1,00
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema ECOMESOL 1% soluzione cutanea 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema: 100 g di crema
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE ECOMESOL 1% crema ECOMESOL 1% soluzione cutanea 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA ECOMESOL 1% crema: 100 g di crema
CLASSIFICAZIONE DEL RISCHIO TROMBOEMBOEMBOLICO
 CLASSIFICAZIONE DEL RISCHIO TROMBOEMBOEMBOLICO BASSO RISCHIO - Chirurgia generale e ginecologica maggiore in paziente di età < 40 anni senza altri fattori di rischio. - Chirurgia generale e ginecologica
CLASSIFICAZIONE DEL RISCHIO TROMBOEMBOEMBOLICO BASSO RISCHIO - Chirurgia generale e ginecologica maggiore in paziente di età < 40 anni senza altri fattori di rischio. - Chirurgia generale e ginecologica
Presentazione delle schede di valutazione rischio TEV aziendali
 Presentazione delle schede di valutazione rischio TEV aziendali Dr. Alessandro Aiello ANGIOLOGIA A.S.P. Catania Corso di formazione ECM Prevenzione del tromboembolismo venoso e utilizzo della relativa
Presentazione delle schede di valutazione rischio TEV aziendali Dr. Alessandro Aiello ANGIOLOGIA A.S.P. Catania Corso di formazione ECM Prevenzione del tromboembolismo venoso e utilizzo della relativa
COD FISC. E PARTITA IVA : Sede legale: Via Nizza SALERNO. Prot Nocera li 20 ottobre 2015
 COD FISC. E PARTITA IVA : 04701800650 Sede legale: Via Nizza 146 84124 SALERNO Telef. 089/693647 Fax 089/251629 FUNZIONE COORDINAMENTO ASSISTENZA FARMACEUTICA Piazza dei Martiri,4 84087 Vallo della Lucania
COD FISC. E PARTITA IVA : 04701800650 Sede legale: Via Nizza 146 84124 SALERNO Telef. 089/693647 Fax 089/251629 FUNZIONE COORDINAMENTO ASSISTENZA FARMACEUTICA Piazza dei Martiri,4 84087 Vallo della Lucania
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. Arixtra 1,5 mg/0,3 ml soluzione iniettabile, siringa preriempita. 2.
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. Arixtra 1,5 mg/0,3 ml soluzione iniettabile, siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA. Ogni siringa
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. Arixtra 1,5 mg/0,3 ml soluzione iniettabile, siringa preriempita. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA. Ogni siringa
Fisiopatologia, diagnosi e terapia dll della malattia tromboembolica
 Fisiopatologia, diagnosi e terapia dll della malattia tromboembolica bli Asti 16 Giugno 2007 Ordine Provinciale dei medici Dr NUTI Claudio.- S.I.M.G. Asti Dr Gianluca Vergano MMG Asti Caso Clinico 1 Signora
Fisiopatologia, diagnosi e terapia dll della malattia tromboembolica bli Asti 16 Giugno 2007 Ordine Provinciale dei medici Dr NUTI Claudio.- S.I.M.G. Asti Dr Gianluca Vergano MMG Asti Caso Clinico 1 Signora
Il significato degli esami di coagulazione. Walter Ageno
 Il significato degli esami di coagulazione Walter Ageno Principali caratteristiche dei nuovi anticoagulanti Via orale di somministrazione Ampia finestra terapeutica Farmacocinetica e farmacodinamica prevedibili
Il significato degli esami di coagulazione Walter Ageno Principali caratteristiche dei nuovi anticoagulanti Via orale di somministrazione Ampia finestra terapeutica Farmacocinetica e farmacodinamica prevedibili
Utilizzo degli anticoagulanti orali non vitamina K dipendenti (Nuovi. Antiacoagulanti Orali-NAO) nella malattia tromboembolica venosa
 Utilizzo degli anticoagulanti orali non vitamina K dipendenti (Nuovi Antiacoagulanti Orali-NAO) nella malattia tromboembolica venosa C.Mazzone, G.Sola Nei mesi scorsi al rivaroxaban (Xarelto) si sono successivamente
Utilizzo degli anticoagulanti orali non vitamina K dipendenti (Nuovi Antiacoagulanti Orali-NAO) nella malattia tromboembolica venosa C.Mazzone, G.Sola Nei mesi scorsi al rivaroxaban (Xarelto) si sono successivamente
Prot. n Frosinone, 14/08/2019 FARMAINFORMA. Informazione sui Farmaci e la Farmacovigilanza II Numero Speciale Agosto 2019
 Prot. n. 77012 Frosinone, 14/08/2019 FARMAINFORMA Informazione sui Farmaci e la Farmacovigilanza II Numero Speciale Agosto 2019 EPARINE A BASSO PESO MOLECOLARE (EBPM) e FONDAPARINUX (FPX) APPROPRIATEZZA
Prot. n. 77012 Frosinone, 14/08/2019 FARMAINFORMA Informazione sui Farmaci e la Farmacovigilanza II Numero Speciale Agosto 2019 EPARINE A BASSO PESO MOLECOLARE (EBPM) e FONDAPARINUX (FPX) APPROPRIATEZZA
ALLEGATO III RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, ETICHETTATURA E FOGLIO ILLUSTRATIVO
 ALLEGATO III RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, ETICHETTATURA E FOGLIO ILLUSTRATIVO 41 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 42 1. DENOMINAZIONE DEL MEDICINALE 10.000 UI/ml (100 mg/ml)
ALLEGATO III RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO, ETICHETTATURA E FOGLIO ILLUSTRATIVO 41 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 42 1. DENOMINAZIONE DEL MEDICINALE 10.000 UI/ml (100 mg/ml)
Recenti novità sull impiego pediatrico di paracetamolo all insegna dell appropriatezza
 Recenti novità sull impiego pediatrico di paracetamolo all insegna dell appropriatezza Fonte: de Martino, M, Chiarugi A. Recent advances in pediatric use of oral paracetamol in fever and pain management.
Recenti novità sull impiego pediatrico di paracetamolo all insegna dell appropriatezza Fonte: de Martino, M, Chiarugi A. Recent advances in pediatric use of oral paracetamol in fever and pain management.
Linee guida sulla gestione di terapie preoperatorie antiaggreganti ed anticoagulanti
 Linee guida sulla gestione di terapie preoperatorie antiaggreganti ed anticoagulanti Marco Moia Centro Emofilia e Trombosi A. Bianchi Bonomi Fondazione IRCCS Ca Granda Ospedale Maggiore Policlinico di
Linee guida sulla gestione di terapie preoperatorie antiaggreganti ed anticoagulanti Marco Moia Centro Emofilia e Trombosi A. Bianchi Bonomi Fondazione IRCCS Ca Granda Ospedale Maggiore Policlinico di
Allegato III. Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo
 Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Allegato III Emendamenti ai paragrafi pertinenti del Riassunto delle Caratteristiche del Prodotto e del Foglio Illustrativo Nota: Il Riassunto delle caratteristiche del prodotto, l'etichettatura e il foglio
Blocco Neurassiale e profilassi antitrombotica
 Autore: Dott. Dario Chiacchio Responsabile UOS Anestesia e Analgesia Ostetrico-Ginecologica UOC Anestesia e Rianimazione per il Dipartimento Materno Infantile Direttore: Prof. Gennaro Savoia Blocco Neurassiale
Autore: Dott. Dario Chiacchio Responsabile UOS Anestesia e Analgesia Ostetrico-Ginecologica UOC Anestesia e Rianimazione per il Dipartimento Materno Infantile Direttore: Prof. Gennaro Savoia Blocco Neurassiale
Trombofilia, trombosi venose superficiali e trombosi venose profonde
 Fiumicino, 19 dicembre 2015 Parte seconda Trombofilia, trombosi venose superficiali e trombosi venose profonde www.cos.it/mediter Anatomia del sistema venoso degli arti inferiori Trombosi venosa superficiale
Fiumicino, 19 dicembre 2015 Parte seconda Trombofilia, trombosi venose superficiali e trombosi venose profonde www.cos.it/mediter Anatomia del sistema venoso degli arti inferiori Trombosi venosa superficiale
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IMOVAX POLIO sospensione iniettabile Vaccino della poliomielite (inattivato) 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE IMOVAX POLIO sospensione iniettabile Vaccino della poliomielite (inattivato) 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Una
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE. CLEXANE T UI (300 mg)/3 ml soluzione iniettabile
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE CLEXANE T 30.000 UI (300 mg)/3 ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 30.000 UI (300 mg)/3 ml Un
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE CLEXANE T 30.000 UI (300 mg)/3 ml soluzione iniettabile 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA 30.000 UI (300 mg)/3 ml Un
Allegato II. Conclusioni scientifiche
 Allegato II Conclusioni scientifiche 33 Conclusioni scientifiche Enoxaparina sodica è un eparina a basso peso molecolare commercializzata con la denominazione commerciale Lovenox e denominazioni associate.
Allegato II Conclusioni scientifiche 33 Conclusioni scientifiche Enoxaparina sodica è un eparina a basso peso molecolare commercializzata con la denominazione commerciale Lovenox e denominazioni associate.
150 mg capsule rigide Riassunto delle Caratteristiche del Prodotto
 150 mg capsule rigide Riassunto delle Caratteristiche del Prodotto 1. DENOMINAZIONE DEL MEDICINALE Pradaxa 150 mg capsule rigide. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula rigida contiene
150 mg capsule rigide Riassunto delle Caratteristiche del Prodotto 1. DENOMINAZIONE DEL MEDICINALE Pradaxa 150 mg capsule rigide. 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA Ogni capsula rigida contiene
AIFA - Agenzia Italiana del Farmaco
 NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
NOTA INFORMATIVA IMPORTANTE CONCORDATA CON LE AUTORITÀ REGOLATORIE EUROPEE E L AGENZIA ITALIANA DEL FARMACO (AIFA) Luglio 2013 Restrizione della popolazione target e limitazione della durata del trattamento
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO
 RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO 1. DENOMINAZIONE DEL MEDICINALE DITANRIX Adulti Sospensione iniettabile per uso intramuscolare 2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA una dose da 0,5 ml
