Certi Car Graf Certificazione Cartaria, Cartotecnica, Grafica
|
|
|
- Assunta Piccolo
- 7 anni fa
- Visualizzazioni
Transcript
1
2
3 ISBn Edizioni by Istituto Italiano Edizioni Atlas erti ar Graf ertificazione artaria, artotecnica, Grafica La casa editrice ATLAS opera con il Sistema Qualità conforme alla nuova norma UNI EN ISO certificato da ISQ ERTIARGRAF. Direzione editoriale ROBERTO InVERnII Progetto grafico e videoimpaginazione MARIO MuOLLO DisegniVAVASSORI & VAVASSORI, Bonate Sotto (Bg); KROMA s.n.c. Mozzo (Bg); IL grifone (PV) Stampa ASTELLI BOLIS, EnATE SOTTO (Bg) Ideazione e preparazione dei disegni PAOLO PISTARà REFEREnzE FOTOgRAFIhE opyrigt Paolo Pistarà per le foto delle pagine 556 (fig. 7), 559 (fig. 15), 567 (fig. 1), 568 (fig. 1), 569 (figg. 1, 2), 587 (fig. 12), 600 (figg. 3a, 3b). himica Omnia, Ecos (rivista Eni), genius, Leybold, nasa, E.S.A., Research (rivista Bayer), IBM, hochst Oggi, AgipReview, Perkin Elmer, Laboratorio 2000, Enel, Basf, Archivio Atlas. Franco Valoti per le rimanenti foto di laboratorio e dei modelli molecolari. Le illustrazioni o riproduzioni di prodotti commerciali utilizzate in questo libro hanno un valore esclusivamente didattico. Per eventuali e comunque non volute omissioni o per gli aventi diritto tutelati dalla legge, l Editore dichiara la propria disponibilità. L Editore si impegna a mantenere invariato il contenuto di questo volume, secondo le norme vigenti. Il presente volume è conforme alle disposizioni ministeriali in merito alle caratteristiche tecniche e tecnologiche dei libri di testo. Ogni riproduzione del presente volume è vietata. Le fotocopie per uso personale del lettore possono essere effettuate nei limiti del 15% di ciascun volume/fascicolo di periodico dietro pagamento alla SIAE del compenso previsto dall art. 68, commi 4 e 5, della legge 22 aprile 1941 n Le fotocopie effettuate per finalità di carattere professionale, economico o commerciale o comunque per uso diverso da quello personale possono essere effettuate a seguito di specifica autorizzazione rilasciata da LEARedi, entro Licenze e Autorizzazioni per le Riproduzioni Editoriali, orso di Porta Romana 108, Milano, autorizzazioni@clearedi.org e sito web Istituto Italiano Edizioni Atlas Via rescenzi, Bergamo Tel. 035/ Fax 035/ II
4 P resentazione Principi di chimica moderna, in tre tomi, nasce dall esigenza di adeguare l insegnamento della chimica agli obiettivi emersi dalle indicazioni ministeriali, sia sul piano didattico che su quello dei contenuti. Il testo non si limita a proporre le conoscenze di base della chimica, ma fornisce anche, attraverso l acquisizione del ragionamento scientifico, gli elementi necessari a promuovere lo spirito critico. In questo lavoro, pertanto, il primo obiettivo è stato quello di rivedere ogni argomento della chimica, in modo da migliorare la logica della sua presentazione, la comprensibilità del suo sviluppo e la facilità con cui può essere assimilato. Questo fine ha fortemente influenzato l approccio pedagogico, la scelta e l ordinamento degli argomenti e il livello della presentazione. Il testo ha come finalità generale l inquadramento dei fenomeni chimici, partendo ove è possibile dall esperienza quotidiana degli studenti, per tendere ad un opera di razionalizzazione delle esperienze e delle conoscenze. I contenuti di Principi di chimica moderna fanno sempre riferimento all aspetto macroscopico dei fenomeni e ad esperienze della vita quotidiana. Per fornire un modello interpretativo dei fenomeni chimici, si è fatto costante ricorso al modello particellare della materia. gli studenti devono saper correlare una reazione chimica (aspetto macroscopico) alle formule chimiche dei componenti (aspetto simbolico) e alla rappresentazione mediante particelle, atomi, molecole e ioni (aspetto microscopico). iò costituisce lo spunto per porsi domande e per avvicinarsi ad un corretto metodo d indagine (sperimentale induttivo). Sia l apprendimento dei contenuti che la padronanza di un metodo di ricerca risultano positivi anche per quegli studenti che non dovessero continuare lo studio di questa disciplina. Particolare attenzione è stata dedicata alla scelta del linguaggio che si presenta semplice e chiaro, per facilitare la lettura del testo e l apprendimento dei concetti sviluppati. un ricco apparato iconografico, all interno del quale spiccano le numerose fotografie di esperienze di laboratorio, conferisce ai contenuti una veste di concretezza e trasmette agli studenti il carattere sperimentale della chimica. Struttura dell opera. Tomo Il Tomo sviluppa, in particolare, gli argomenti della chimica organica e delle biomolecole. Per tener conto delle nuove indicazioni ministeriali, è stata affrontata anche la biochimica. Per lo studio della biochimica, che rappresenta un punto d incontro tra chimica e biologia, si è posto l accento su quelle situazioni della vita quotidiana che possono coinvolgere i giovani. La trattazione di questa branca della chimica è stata sviluppata e illustrata in una forma concisa e comprensibile, con l obiettivo di renderla realmente accessibile agli studenti. I temi sono sviluppati in modo da favorire una comprensione pratica delle cause che determinano le trasformazioni chimiche e non una assimilazione dei contenuti in modo mnemonico. L organizzazione globale della materia è tale da condurre velocemente lo studente dai concetti di chimica organica ai processi biochimici. Questo percorso didattico ha portato ad introdurre le conoscenze necessarie per affrontare in modo sistematico i temi relativi alle biotecnologie e alla chimica alimentare. nel testo sono stati inoltre affrontati argomenti di attualità quali la chimica nucleare, la chimica ambientale con le problematiche relative all inquinamento e alle tecnologie che si interessano della riqualificazione dell ambiente e di un corretto smaltimento dei rifiuti. Particolare attenzione è stata riservata anche alle problematiche energetiche. Ogni capitolo presenta obiettivi di competenza, procede con lo sviluppo dei contenuti e termina con una verifica di apprendimento, test a scelta multipla e problemi, che permette di controllare le conoscenze e le abilità. gli esercizi di competenza, che completano le prove di verifica, valutano la capacità di utilizzare in modo funzionale le conoscenze e le abilità per risolvere nuove proposte. III
5 I problemi svolti, collocati dopo la trattazione teorica dei concetti, presentano una strategia che fornisce agli studenti un metodo di ragionamento per la risoluzione degli esercizi. gli esercizi di autoverifica servono per un controllo immediato della comprensione dei concetti acquisiti. I quesiti proposti nella guida allo studio sono funzionali alla comprensione dei concetti sviluppati. L attività di laboratorio, inserita nel testo, si presenta come un mezzo insostituibile per imparare ad eseguire una indagine scientifica. Le schede di approfondimento sviluppano la trattazione di alcuni argomenti fondamentali come un opzione didattica ulteriore, secondo la programmazione di ogni docente, in particolare in quegli indirizzi scolastici dove è maggiore il monte orario riservato alla disciplina. Il testo è inoltre arricchito da mappe concettuali funzionali alla sintesi dei concetti affrontati; inserti per approfondire aspetti della chimica nella realtà di ogni giorno; tabelle, grafici e diagrammi, per acquisire gli strumenti propri della ricerca scientifica; glossario/glossary, dove vengono riportati i termini chiave della chimica in italiano e in inglese; applying concepts, una serie di prove per avviare gli studenti alla comprensione di brevi testi scientifici e alla applicazione dei concetti appresi; esercizi in lingua inglese. oerentemente con la parte sperimentale presente nel testo, viene proposto, come sussidio didattico, un manuale on line Laboratorio di himica, dello stesso autore, per potenziare con nuove esperienze di facile realizzazione le conoscenze degli studenti. Tutte le esperienze vanno realizzate con le dovute precauzioni e alla presenza dell Insegnante. L autore sarà grato agli Insegnanti che vorranno segnalare eventuali imprecisioni ma anche dare suggerimenti per migliorare l opera. Paolo Pistarà MAtERiALi per il DoEntE Materiali didattici per l insegnante Dopo un capitolo di didattica e programmazione, la guida propone Soluzioni delle verifiche del testo Risposte alle domande di verifica del Laboratorio (testo base) Prove di verifica per ogni capitolo e soluzioni Risposte alle domande di verifica delle esperienze del Laboratorio di himica on line Materiali in lingua inglese IV
6 Struttura del corso PROBLEMI SVOLTI con STRATEGIA per acquisire un metodo di risoluzione dei problemi GUIDA ALLO STUDIO i quesiti proposti sono una guida alla comprensione dei concetti sviluppati I PROTAGONISTI DELLA IMIA permettono di ripercorrere la storia della chimica OMPETENZE articolate per ogni apitolo Gli APPROFONDIMENTI accompagnano, come ulteriori materiali di studio, alcuni argomenti fondamentali AUTOVERIFIE per un controllo immediato della comprensione dei concetti acquisiti Le MAPPE ONETTUALI per la comprensione delle relazioni tra i concetti chiave di uno o più capitoli La rubrica FOUS tratta le applicazioni della chimica nella vita di tutti i giorni ESERIZI per accertare le conoscenze e le abilità acquisite Gli esercizi di OMPETENZA DI FINE APITOLO sviluppano le capacità di utilizzare in modo funzionale le conoscenze e le abilità GLOSSARIO E GLOSSARY (in lingua inglese) per rafforzare le conoscenze linguistiche degli studenti V
7 Il libro sul web Materiali on LinE e per la LiM Ad integrazione e completamento del corso base, sono disponibili altri materiali sulla Libreria web, accessibile mediante un collegamento diretto dalla home page del sito dell Atlas (www. edatlas.it). Dopo esserti registrato, puoi entrare nel sito e, nella parte riservata agli studenti, trovare materiale on line e per la Lavagna Interattiva Mutimediale (LIM) Laboratorio di chimica. Dopo una introduzione all attività di laboratorio vengono proposte 47 esperienze su tutti i contenuti fondamentali del corso di chimica. Materiali multimediali e interattivi, legati a particolari argomenti proposti nel testo. Lezioni in PowerPoint Test riassuntivi per il potenziamento Test di verifica interattivi Test proposti per l accesso alle facoltà universitarie suddivisi per capitoli Materiali di approfondimento per ampliare le conoscenze disciplinari Primi approcci alla chimica organica Per quanto riguarda specificamente i materiali da utilizzare con la Lavagna interattiva Multimediale (LiM) sono proposti in rete i disegni presentati nei vari capitoli del testo base. nell area riservata ai Docenti è proposta una guida didattica che offre indicazioni su metodologie e strumenti didattici, verifiche di apprendimento, soluzioni di tutti i test e dei problemi posti, soluzioni delle prove di laboratorio. VI
8 Indice generale Materiali on line apitolo 22 himica organica alcani, alcheni, alchini La chimica organica è la chimica del carbonio gli idrocarburi gli alcani La nomenclatura dei gruppi alchilici Isomeria di struttura La nomenclatura degli alcani Isomeria conformazionale Proprietà fisiche degli alcani Le reazioni chimiche degli alcani 512 Approfondimento Meccanismo di sostituzione radicalica degli alcani Impiego e diffusione degli alcani I cicloalcani gli alcheni Isomeria geometrica cis-trans 518 Mappa concettuale Gli isomeri Proprietà e usi degli alcheni 520 Approfondimento Addizione elettrofila al doppio legame I dieni butadiene gli alchini 523 Approfondimento Forme geometriche delle molecole e ibridazione 525 materiale multimediale e interattivo orbitali ibridi VERifihE 529 VERifihE Di ompetenza 531 test di verifica interattivi test di Accesso Alle facoltà universitarie apitolo 23 omposti aromatici omposti aromatici Struttura e legami del benzene nomenclatura dei composti aromatici Proprietà fisiche e usi degli idrocarburi aromatici Proprietà chimiche degli idrocarburi aromatici 537 Approfondimento Meccanismo della sostituzione elettrofila aromatica 538 Modello a orbitali del benzene 540 Focus Il petrolio e i suoi derivati 541 I motori a combustione interna 543 VERifihE 544 VERifihE Di ompetenza 545 test di verifica interattivi test di Accesso Alle facoltà universitarie apitolo 24 i gruppi funzionali I gruppi funzionali Alogenuri alchilici Proprietà fisiche e usi degli alogenuri alchilici Proprietà chimiche degli alogenuri alchilici 549 Approfondimento Meccanismo di una reazione di sostituzione nucleofila S n Meccanismo di una reazione di sostituzione nucleofila S n materiale multimediale e interattivo sostituzione nucleofila 5. Alcoli Proprietà fisiche degli alcoli Proprietà chimiche degli alcoli gli alcoli più importanti Fenoli Eteri Aldeidi e chetoni Proprietà fisiche delle aldeidi e dei chetoni Proprietà chimiche delle aldeidi e dei chetoni 564 Mappa concettuale Derivati dell etilene e del propilene 566 Laboratorio Esperienza 1. Riconoscimento delle aldeidi con il reattivo di Fehling 567 Esperienza 2. Riconoscimento delle aldeidi con il reattivo di Tollens 568 Esperienza 3. Riconoscimento delle aldeidi e dei chetoni con la 2,4-dinitrofenilidrazina 569 VERifihE 570 VERifihE Di ompetenza 572 test di verifica interattivi test di Accesso Alle facoltà universitarie VII
9 indie generale apitolo 25 i gruppi funzionali Acidi carbossilici Proprietà fisiche degli acidi carbossilici Proprietà chimiche degli acidi carbossilici I derivati degli acidi carbossilici 578 materiale multimediale e interattivo modelli molecolari in 3d Approfondimento Meccanismo di reazione degli acidi carbossilici Il sapone e i detergenti Ammine I composti eterociclici Polimeri Polimerizzazione di addizione Polimerizzazione di condensazione Polimeri di uso comune 592 Focus Il segreto del ragno di Primo Levi 593 VERifihE 595 VERifihE Di ompetenza 597 test di verifica interattivi test di Accesso Alle facoltà universitarie VERifihE 635 VERifihE Di ompetenza 637 Glossario/Glossary 638 Applying concepts 639 test di verifica interattivi test di Accesso Alle facoltà universitarie apitolo 27 Le basi della biochimica La cellula La bioenergetica cellulare il ruolo dell ATP gli enzimi 648 Approfondimento Determinare i valori sperimentali di K M e V max oenzimi 654 VERifihE 658 VERifihE Di ompetenza 659 test di verifica interattivi test di Accesso Alle facoltà universitarie apitolo 26 Le biomolecole Le biomolecole Le sostanze otticamente attive Isomeria ottica arboidrati Monosaccaridi Disaccaridi Polisaccaridi Amminoacidi Le proteine Acidi nucleici e nucleotidi La struttura del DnA Il codice genetico La sintesi proteica gli enzimi Le vitamine I lipidi glicerofosfolipidi (o fosfolipidi) gli steroidi 630 Focus I mille volti del colesterolo 633 Steroidi anabolizzanti e atletica 634 apitolo 28 La biochimica 660 Il metabolismo cellulare 661 ARboiDRAti 1. Il metabolismo dei carboidrati La glicogenolisi La glicogenesi (glicogeno sintesi) La glicolisi 665 Approfondimento La glicolisi in dettaglio Via del pentoso fosfato (o shunt dell esoso monofosfato) Il ciclo di Krebs (o ciclo dell acido citrico) atena di trasporto degli elettroni e fosforilazione ossidativa gluconeogenesi 676 LipiDi 9. I lipidi fonte di energia Biosintesi degli acidi grassi (o lipogenesi) Biosintesi dei trigliceridi e dei fosfolipidi 680 Mappa concettuale Biosintesi dei trigliceridi e della lecitina 681 VIII
10 indie generale 12. atabolismo dei trigliceridi Biosintesi del colesterolo Sintesi dei corpi chetonici 687 AMMinoAiDi 15. Metabolismo degli amminoacidi 688 Focus Biosintesi delle prostaglandine ed effetto dell aspirina 694 Mappa concettuale Vie metaboliche principali 695 VERifihE 696 VERifihE Di ompetenza 698 Glossario/Glossary orrosione da piogge acide Inquinamento delle acque Depurazione delle acque 721 Focus on la microspia 14 a caccia di sostanze attive Il problema energetico e le nuove strategie Le energie rinnovabili Lo smaltimento dei rifiuti 733 VERifihE 737 Applying concepts 738 Glossario/Glossary 739 test di verifica interattivi test di Accesso Alle facoltà universitarie apitolo 29 La chimica nucleare nuclei atomici stabili e nuclei atomici instabili Reazioni nucleari e decadimento radioattivo Tempo di dimezzamento Energia nucleare Fissione nucleare Fusione nucleare Scorie radioattive Rivelazione della radioattività e sua misura Isotopi radioattivi preparati artificialmente Datazione di materiali organici 710 Approfondimenti la conversione fotovoltaica della luce in elettricità Addolcimento di un AcquA dura l effetto serra ha molte cause test di verifica interattivi test di Accesso Alle facoltà universitarie apitolo 31 genetica e biotecnologie genetica e biotecnologie L ingegneria genetica nella produzione agricola gli animali transgenici Le biotecnologie nei processi industriali 745 Focus Polimeri biodegradabili 746 materiale multimediale e interattivo processi nucleari VERifihE 711 test di verifica interattivi test di Accesso Alle facoltà universitarie apitolo 30 himica ambientale ed energia 712 I costituenti dell atmosfera Il particolato PM Il ciclo del carbonio e dell ossigeno L effetto serra Il ciclo dell azoto 717 apitolo 32 himica e alimentazione 747 Alimentazione una scelta consapevole 748 Alimentazione equilibrata 749 omposizione e apporto calorico degli alimenti 750 TABELLA 1 Valore calorico di alcuni alimenti per 100 g di prodotto 750 ome costruire una dieta 751 ome leggere un etichetta 752 TAVOLA PERIODIA DEgLI ELEMEnTI InDIE AnALITIO A1 A2-A3-A4 IX
11 himica organica alcani, alcheni, alchini ombustibili, prodotti farmaceutici, solventi e altri composti sono importanti derivati del petrolio ompetenze Distinguere gli idrocarburi in base al legame covalente (singolo, doppio, triplo) presente in una molecola. Scrivere gli isomeri di struttura di due composti con la stessa formula molecolare. Assegnare il nome IUPA ad un idrocarburo, data la sua formula. Scrivere la formula di struttura di un idrocarburo, dato il nome IUPA. Distinguere la conformazione eclissata di una molecola da quella sfalsata. Riconoscere se un composto presenta isomeria cis-trans. Mettere in relazione la struttura e le proprietà fisiche e chimiche degli idrocarburi. Scrivere le reazioni chimiche degli idrocarburi. Analizzare il meccanismo delle reazioni chimiche degli idrocarburi.
12 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI Guida allo studio Perché la chimica organica è chiamata la chimica del carbonio? Quali sono le principali classi di composti organici derivati dalla materia vivente? Per sintesi, quali prodotti organici si possono preparare? 1 la chimica organica è la chimica del carbonio Il chimico svedese Jacob Berzelius ( ), all inizio dell 800, distingueva le sostanze chimiche in inorganiche, quelle appartenenti al mondo non vivente (il marmo, il ferro, l acqua), ed organiche, quelle prodotte dal mondo vegetale ed animale (proteine, carboidrati, lipidi e acidi nucleici). Questo criterio di classificazione delle sostanze venne messo in crisi nel 1828 dal chimico tedesco Friedrich Wöhler ( ). Questi preparò l urea N 2 O N 2 per riscaldamento del cianato di ammonio N 4 ON, un composto di origine minerale, secondo la reazione omposto organio di sintesi N 4 ON N 2 O N 2 Essendo l urea una sostanza organica presente nell urina, un prodotto del metabolismo animale, Wöhler con il suo esperimento dimostrò che era possibile sintetizzare un composto organico partendo da uno inorganico. om è possibile, allora, distinguere le sostanze organiche da quelle inorganiche? Il legno, se scaldato in provetta o in capsula di porcellana, si decompone lasciando un residuo carbonioso ed emettendo un odore caratteristico; il saccarosio trattato con acido solforico carbonizza; appoggiando sulla fiamma di una candela una capsula di porcellana, si deposita del nerofumo (carbonio). Il legno, lo zucchero, la cera della candela sono sostanze che contengono carbonio e vengono classificate come sostanze organiche. Tutti i composti organici contengono atomi di carbonio. Anche se molti composti organici sono stati isolati dalla materia vivente, un numero ancora maggiore è stato preparato per sintesi di laboratorio. Tra questi ultimi si possono ricordare i prodotti farmaceutici, i coloranti, le fibre sintetiche, i detersivi e le gomme sintetiche. L analisi elementare dimostra che la maggior parte dei composti organici è formata, oltre che dal carbonio, da idrogeno, ossigeno e azoto. In un numero limitato di composti si trovano gli alogeni, il fosforo e lo zolfo. Gli altri elementi sono presenti raramente; il ferro, ad esempio, è presente nell emoglobina. a OO O O 1 omposti organii della materia vivente 2 OO O OO O 2 O O O O O 2 OO acido acetil salicilico b c 1. Prodotti organici di sintesi (a) e della materia vivente (b, c). acido citrico glucosio 503
13 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI Guida allo studio In quali serie di composti vengono suddivisi gli idrocarburi? Mappa concettuale 2 gli idrocarburi I composti organici che contengono carbonio e idrogeno prendono il nome di idrocarburi. Essi sono i costituenti dei gas naturali e dei prodotti petroliferi. Trovano impiego come combustibili e anche come materia prima per la sintesi di molti prodotti commerciali. In base alla loro struttura, gli idrocarburi vengono suddivisi in due serie alifatici (alcani, alcheni, alchini, aliciclici) e aromatici (benzene, toluene, xilene, ecc). Quelli alifatici, tranne i cicloalcani e i cicloalcheni, hanno strutture lineari in cui gli atomi di carbonio formano delle catene, mentre quelli aromatici hanno strutture ad anello. ALIFATII GLI IDROARBURI AROMATII Alcani Alcheni Alchini Aliciclici icloalcani icloalcheni 3 gli alcani MODELLO DELLA MOLEOLA DEL METANO 2 Gli alcani sono detti idrocarburi saturi perché i legami carbonio-carbonio di questi composti sono tutti legami singoli. Il metano è il più semplice degli alcani ed ha formula molecolare 4. La sua molecola ha la struttura di un tetraedro, con il carbonio al centro ed ai vertici quattro atomi di idrogeno ad esso legati con angoli di 109,5 (figura 2). L etano ( 2 6 ) ed il propano ( 3 8 ) sono alcani rispettivamente con due e tre atomi di carbonio (figure 3 e 4). La formula generale degli alcani soddisfa la relazione n 2n + 2 dove, indicando con n il numero degli atomi di carbonio, quello degli idrogeni risulta il doppio più due. 504
14 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI Modello della molecola dell etano. 4. Modello della molecola del propano. 5. Modello della molecola del butano. Negli alcani ogni atomo di carbonio mostra ibridazione sp 3 (gli atomi di carbonio sono tetraedrici). Vedi pagina 525. Il butano, che è il quarto termine della serie, ha quattro atomi di carbonio (n = 4), per cui gli atomi di idrogeno saranno due volte quattro più due, cioè dieci (figura 5). La formula molecolare del butano è, pertanto, I modelli molecolari, che danno una disposizione tridimensionale di una molecola, evidenziano che intorno agli atomi di carbonio di un alcano si formano angoli che fanno assumere alla catena un andamento a zig-zag. iò è una conseguenza della disposizione tetraedrica del carbonio negli alcani. Infatti, secondo la teoria VSEPR, ogni atomo di carbonio con quattro legami covalenti singoli presenta disposizione tetraedrica. I composti della serie degli alcani terminano con il suffisso -ano. Fatta eccezione per i primi quattro termini, dal quinto in poi il nome dell alcano presenta un prefisso, che fa riferimento alla numerazione greca, e specifica il numero degli atomi di carbonio. Il composto 5 12 corrisponde al pentano (penta = cinque), 6 14 all esano (esa = sei) e così via. TABELLA 1. NOMI DI ALANI Formula Nome Formula Nome 4 metano undecano 2 6 etano dodecano Guida allo studio propano butano tridecano tetradecano Descrivi i legami covalenti negli alcani. Elenca e scrivi le formule dei primi termini degli alcani. he cosa s intende per formula molecolare e per formula di struttura? Un alcano e un gruppo alchilico in che cosa differiscono? pentano esano eptano ottano nonano decano pentadecano esadecano eptadecano octadecano nonadecano eicosano 505
15 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI Formula molecolare e formula di struttura La formula molecolare di una sostanza indica il tipo ed il numero di atomi presenti nella molecola. La formula di struttura rappresenta su un piano la sequenza con cui gli atomi sono legati in una molecola. Ad esempio, per scrivere la formula di struttura del butano, la cui formula molecolare è 4 10, si scrivono prima i quattro atomi di carbonio in catena continua catena continua Poiché ogni atomo di carbonio può formare quattro legami covalenti, gli atomi di carbonio terminali possono legarsi con tre atomi di idrogeno, mentre ogni atomo di carbonio interno alla catena può legarsi con due atomi di idrogeno. La formula di struttura del butano sarà perciò TABELLA 2. TRE DIFFERENTI FORMULE PER RAPPRESENTARE GLI ALANI Le formule di struttura di questo tipo risultano ingombranti e lunghe da scrivere. Si preferisce, pertanto, utilizzare formule di struttura condensate che, nell esempio del butano, possono essere così rappresentate 2 2 oppure 2 2 (a) (b) Nome Formula molecolare Formula di struttura Formule di struttura condensate Metano 4 Etano 2 6 Propano Butano Pentano
16 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI Nella formula (a) vengono evidenziati solo i legami tra gli atomi di carbonio, mentre gli atomi di idrogeno vengono associati al carbonio corrispondente. Anche nella formula (b), che risulta ancora più condensata, è evidente la connessione dei quattro atomi di carbonio in catena e degli atomi di idrogeno corrispondenti. Negli alcani ogni termine della serie differisce da quello successivo per un gruppo 2. 4 la nomenclatura dei gruppi alchilici I gruppi alchilici si distinguono in primari (n-), secondari (sec-) o terziari (terz-) a seconda che il carbonio che ha perso l idrogeno sia legato ad uno, due o tre atomi di carbonio. 2 gruppo primario (n-) gruppo secondario (sec-) gruppo terziario (terz-) Se immaginiamo di allontanare da una molecola di un alcano uno dei suoi atomi di idrogeno, ciò che rimane prende il nome di gruppo alchilico. Il nome di un gruppo alchilico deriva dal corrispondente alcano cambiando il suffisso -ano con il suffisso -ile. Per esempio, se si allontana dal metano, 4, un atomo di idrogeno si forma il gruppo metile. La lineetta rappresenta il punto di attacco per altri atomi o gruppi. In maniera analoga, rimuovendo un atomo di idrogeno da ogni alcano si ottengono gruppi alchilici, come si può vedere in Tabella 3. TABELLA 3. alcano 4 metano etano 2 propano Gruppo alchilico metile 2 etile 2 2 propile 2 2 butano o 2 n-butile sec-butile isobutano 2 isobutile terz-butile Negli alcani a catena ramificata i gruppi alchilici legati alla catena principale vengono considerati sostituenti. Il composto 2, per esempio, si può considerare derivato da un composto con una catena continua di atomi di carbonio 2 2 per sostituzione di un atomo di idrogeno del secondo atomo di carbonio di sinistra con un 2 2 alcano a catena ramificata 507
17 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI Guida allo studio he cosa s intende per isomeri di struttura? Fai due esempi di isomeri di struttura. 5 isomeria di struttura Le formule molecolari del metano 4, dell etano 2 6, del propano 3 8, presentano una sola formula di struttura. Invece al 4 10 corrispondono due formule di struttura una contiene gli atomi di carbonio in catena continua (lineare), l altra in catena ramificata. A queste due strutture corrispondono due composti, il n-butano e l isobutano 2 2 n-butano isobutano T.eb. = 0 T.eb. = 12 Sono detti isomeri di struttura quei composti che hanno la stessa formula molecolare ma struttura differente. Quindi il n-butano e l isobutano sono isomeri di struttura perché costituiti dello stesso numero e tipo di atomi, ma legati in una sequenza diversa. Alla formula molecolare 5 12 corrispondono tre isomeri di struttura n-pentano isopentano T.eb. = + 36 T.eb. = + 28 neopentano T.eb. = + 9,5 Per ogni formula molecolare, gli isomeri di struttura presentano le stesse proprietà chimiche ma proprietà fisiche differenti, come la temperatura di fusione e quella di ebollizione. 6 la nomenclatura degli alcani Per la denominazione dei composti organici ramificati, la nomenclatura IUPA segue un metodo sistematico. Si numera la catena continua più lunga in modo che l atomo di carbonio della catena, a cui è legato il gruppo alchilico, abbia il numero più basso. Il nome del gruppo alchilico in catena è preceduto dal numero del carbonio a cui è legato. Il composto Guida allo studio Esponi le regole IUPA di nomenclatura degli idrocarburi ramificati. avendo la catena continua più lunga a quattro atomi di carbonio è un butano. Poiché un atomo di idrogeno del secondo atomo di carbonio è sostituito da un metile, il nome del composto sarà 2-metilbutano. Se è presente più di un gruppo alchilico dello stesso tipo, cioè due o più sostituenti identici, se ne tiene conto con i prefissi (di- per due, tri- per tre, tetra- per quattro, ecc.). 508
18 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI onsideriamo il composto Avendo una catena lineare a cinque atomi di carbonio, il composto è un pentano. Dei tre gruppi metilici (trimetil), due sono sul secondo atomo di carbonio ed il terzo sul quarto. Il suo nome sarà pertanto 2,2,4-trimetilpentano. Nella nomenclatura di un composto, i numeri sono separati da virgole e uniti al nome del composto da un trattino. Se sulla catena sono presenti due o più sostituenti diversi, questi si elencano in ordine alfabetico. I prefissi come di o tri non contano nell alfabetizzazione dei sostituenti, e neppure i prefissi in corsivo come n-, sec- e terz-. Per esempio, sec-butile è considerato come butile. Regole per la nomenclatura degli alcani a. Si individua la catena continua più lunga di atomi di carbonio e si assegna il nome dell idrocarburo corrispondente. b. Si numera la catena, partendo da una estremità, in modo che l atomo di carbonio della catena, a cui è legato il primo gruppo alchilico sostituente, abbia il numero più basso. c. Si usa il nome appropriato di ciascun gruppo alchilico, specificando la sua posizione sulla catena principale con un numero. d. Se è presente più di un gruppo alchilico dello stesso tipo, si fa precedere l appropriato prefisso (di-, tri-, tetra-, e così via) al nome del gruppo alchilico. e. Se ci sono due sostituenti sullo stesso atomo di carbonio, si assegna a entrambi lo stesso numero, utilizzando le lineette per separare i diversi prefissi e le virgole per separare i numeri. f. Se nella catena sono presenti due o più sostituenti diversi, questi vengono elencati in ordine alfabetico, trascurando i prefissi. problema svolto 1 Assegna il nome al composto rappresentato dalla seguente formula di struttura. metile Soluzione a. La catena continua più lunga è a sei atomi di carbonio, per cui corrisponde ad un esano. b. I sostituenti sono tre gruppi metilici posizionati rispettivamente due sull atomo di carbonio-2 e uno sull atomo di carbonio-4. a. Il nome del composto è 2,2,4 - trimetilesano 509
19 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI problema svolto 2 Scrivi la struttura per il 4,terz-butil-2,5-dimetil eptano. Soluzione Il nome eptano indica che vi sono sette atomi di carbonio nella catena continua. Nella formula del composto è presente un gruppo terz-butil sul quarto atomo di carbonio, e due gruppi metilici, uno sul secondo e l altro sul quinto Si completa la struttura aggiungendo gli atomi di idrogeno. 2 2 terz-butil autoverifia 1. Assegna il nome al composto rappresentato dalla seguente formula di struttura Assegna il nome al composto rappresentato dalla seguente formula di struttura Scrivi la struttura per il 3-etil-2-metilesano. 7 isomeria conformazionale 6 Nella molecola dell etano, i due atomi di carbonio possono ruotare, uno rispetto all altro, intorno al legame semplice che li unisce (figura 6). iò dà origine a differenti orientamenti degli atomi di idrogeno di un carbonio rispetto agli atomi di idrogeno dell altro, per cui la molecola presenta più di una conformazione. Per conformazioni di una molecola s intendono i differenti assestamenti nello spazio dei suoi atomi, come conseguenza della libera rotazione attorno ai legami semplici. 510
20 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI MODELLO DELLA FORMA ELISSATA MODELLO DELLA FORMA SFALSATA a b 7. (a) Modello della forma eclissata della molecola dell etano guardando lungo il legame, gli atomi di idrogeno risultano sovrapposti per cui se ne vedono solo tre invece di sei; (b) modello della forma sfalsata della molecola dell etano si vedono tutti e sei gli atomi di idrogeno. 8. onformazioni della molecola dell etano in seguito alla rotazione del legame. Guida allo studio In che cosa si distingue la forma eclissata dell etano da quella sfalsata? Se i legami degli atomi di idrogeno di un carbonio, guardando la molecola dell etano da una estremità lungo i legami, risultano allineati con quelli dell altro carbonio, per cui si vedono solo tre legami, la conformazione della molecola è detta eclissata (figura 7a). Se invece i legami degli atomi di idrogeno di un atomo di carbonio risultano ruotati di 60 rispetto a quelli dell altro, per cui si vedono tutti e sei i legami, la conformazione è detta sfalsata (figura 7b). La molecola può passare da una conformazione all altra in seguito alla rotazione intorno al legame carbonio-carbonio. A temperatura ambiente, la forma sfalsata è la più stabile, perché con più bassa energia; gli elettroni dei legami carbonio-idrogeno sui due atomi di carbonio sono il più lontano possibile. 8 proprietà fisiche degli alcani Nel legame la coppia di elettroni è ugualmente condivisa, ed in i due atomi hanno valori di elettronegatività molto simili. onsiderata la simmetria con cui questi legami si presentano, le molecole degli alcani sono non polari. Questo spiega perché queste molecole sono insolubili in acqua, solvente polare, e solubili in solventi non polari, come etere e tetracloruro di carbonio. Le molecole degli alcani sono soggette alle forze di London che crescono con la complessità molecolare, in quanto aumenta la superficie di contatto tra le molecole. iò spiega l innalzamento di temperatura di ebollizione al crescere della catena. I primi quattro termini della serie sono gassosi, dal 5 a 15 liquidi; quelli con più elevato numero di atomi di carbonio sono solidi. I composti a catena ramificata possiedono temperature di ebollizione inferiori, a parità di atomi di carbonio, ai corrispondenti composti a catena lineare, in quanto, mostrandosi più compatti, le forze intermolecolari di London sono più deboli. Ad esempio, il n-butano ha una temperatura di ebollizione di 0 e l isobutano di
21 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI 9 TABELLA 4. PROPRIETÀ FISIE DI ALUNI ALANI Nome Formula t.f. c t.eb. c densità (a 20 c) metano etano ,5 propano n-butano ( 2 ) n-pentano ( 2 ) ,626 n-esano ( 2 ) ,659 n-eptano ( 2 ) 5 90,5 98 0,684 isobutano ( ) isopentano ( ) ,620 neopentano ( ) ,5 9. Particolare della centrale di spinta del gasdotto transmediterraneo. 9 le reazioni chimiche degli alcani Per l alcano che ha n atomi di carbonio, la reazione esotermica è la seguente 3n +1 n 2n +2 + O 2 n O 2 + (n + 1) 2 O 2 Gli alcani prendono anche il nome di paraffine (dal latino parum affinis), che significa poco affini, perché sono composti caratterizzati da bassa reattività; infatti il legame semplice carbonio-carbonio, in condizioni ordinarie, è molto resistente agli agenti chimici (acidi, permanganato di potassio, alcali). Tuttavia possono combinarsi con l ossigeno, quando la reazione è innescata con una fiamma o una scintilla, oppure con cloro o bromo in presenza di luce ultravioletta. ombustione Le reazioni con l ossigeno sono le combustioni sviluppano grandi quantità di energia e danno come prodotto di reazione diossido di carbonio ed acqua. La combustione del metano è così rappresentata 4(g) + 2 O 2(g) O 2(g) O (g) D = 802 kj/mol di metano Guida allo studio Spiega le proprietà fisiche degli alcani. Spiega le reazioni chimiche degli alcani. Per gli alcani liquidi, utilizzati come carburanti, il potere calorifico raggiunge valori dell ordine di kj/kg. La combustione del metano con l ossigeno, se le due sostanze sono nel rapporto di 1 volume di metano con 2 volumi di ossigeno, diventa pericolosa perché si crea una miscela esplosiva. In ambienti chiusi, quando l ossigeno si presenta in difetto, la reazione produce monossido di carbonio che, combinandosi con l emoglobina del sangue, non permette a questa sostanza di svolgere la sua funzione di trasporto dell ossigeno, per cui si ha la morte per asfissia. 512
22 Reazione di sostituzione (radicalica) apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI Gli alcani reagiscono con gli alogeni producendo derivati clorurati usati come solventi. 4 + l 2 l + l metano cloro clorometano È una reazione in cui un atomo di idrogeno è sostituito da un atomo di cloro (reazione di sostituzione). La reazione, oltre a dare un composto monosostituito, può continuare per dare composti più ricchi in cloro come 2 l 2 (diclorometano), l 3 (triclorometano), l 4 (tetraclorometano). meccanismo di sostituzione radicalica degli alcani La reazione di alogenazione del metano procede con un meccanismo radicalico e avviene in diversi stadi. 1 stadio In presenza di raggi ultravioletti (UV), la molecola del cloro viene scissa in due atomi di cloro che mantengono ciascuno un elettrone spaiato, cioè si formano due radicali. l. 2 stadio l l 2 l. Approfondimento Il radicale. l, non raggiungendo la configurazione ad ottetto, si presenta molto reattivo e con il metano forma il radicale metile l. + l luce UV 3 stadio Il radicale metile reagisce con una molecola di cloro per dare il prodotto di reazione ed il radicale. l.. + l 2 l +. l Gli stadi 2 e 3, con un meccanismo a catena, si ripetono fino al consumo dei reagenti. Fine della Reazione La reazione termina quando i radicali vengono a mancare nel sistema perché entrano in combinazione tra loro.. +. l. +. l l l Il meccanismo di reazione proposto è di sostituzione radicalica, in quanto un atomo di cloro ha preso il posto di un atomo di idrogeno. a 10 b 10. (a) e (b) Simulazione della REAZIONE DI ALOGENAZIONE DI UN ALANO in (a) i reagenti (metano e cloro); in (b) i prodotti di reazione (clorometano e cloruro di idrogeno). 513
23 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI Guida allo studio Quali sono gli impieghi degli alcani? In che cosa consistono i cicloalcani? Fai qualche esempio di cicloalcano? impiego e diffusione degli alcani Il gas naturale è costituito per il 90-99% da metano; gli altri idrocarburi presenti sono l etano, il propano e il butano. Questo gas ha un elevato potere calorifico (37656 kj/m 3 ) ed è il combustibile meno inquinante, considerata l elevata purezza con cui viene commercializzato. Il metano costituisce il gas di città. Il metano, benché difficile da liquefare (la sua temperatura di ebollizione è di 164 alla pressione di 1 atm), viene trasformato allo stato liquido e trasportato in speciali navi cisterna ad una pressione leggermente superiore a quella di 1 atm. Quando il gas naturale liquefatto (Gnl) arriva in un rigassificatore viene convertito nello stato gassoso. Il metano, allo stato gassoso, viene anche trasportato dal luogo di estrazione ai paesi consumatori mediante metanodotti, che possono essere di superficie o sottomarini. Il propano ed il butano, che possono essere liquefatti con facilità (T.eb. del propano 42 ; T.eb. del butano 0 ), vengono messi in commercio allo stato liquido, in bombole di acciaio, ad una pressione di 7,5 atm il propano e di 3 atm il butano, a 20 ; costituiscono il GPL (Gas di Petrolio Liquefatti) che viene impiegato come combustibile nelle auto e nelle abitazioni che non vengono raggiunte dal gas metano. Quando si apre la valvola della bombola, il gas liquido passa allo stato gassoso, ed è possibile il suo utilizzo come combustibile. Una miscela di alcani con una lunghezza di catena compresa tra 5 e 10 costituisce la benzina, mentre le miscele di alcani solidi con lunghezza di catena superiore a 18 sono dette paraffine. Il petrolio è la principale fonte degli alcani. a b 11. (a) Posa in opera di condotta sottomarina per il trasporto di gas. (b) Una moderna raffineria con impianti di stoccaggio. 514
24 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI La struttura non è planare, ma presenta una conformazione a sedia. MODELLO DELLA MOLEOLA DEL ILOESANO 11 i cicloalcani I cicloalcani sono idrocarburi che presentano una struttura ad anello. Derivano dagli alcani per chiusura delle due estremità della catena lineare con espulsione di due atomi d idrogeno. La formula generale di questa serie è n 2n. A tre atomi di carbonio corrisponde il ciclopropano 3 6, a quattro il ciclobutano 4 8, a cinque il ciclopentano 5 10, a sei il cicloesano I primi due termini della serie presentano una struttura quasi planare ed una notevole instabilità chimica; queste caratteristiche sono una conseguenza della tensione a cui si trovano le molecole che possiedono angoli di legame lontani dal valore 109,5, caratteristico degli alcani. Nel ciclopropano si hanno angoli di 60 e nel ciclobutano di 90. Il cicloesano è una molecola molto stabile, possedendo una struttura non planare con angoli di legame vicini a quelli teorici (figura 12). La conformazione a sedia del cicloesano è la più stabile fra le strutture che il composto può assumere. Il cicloesano ha una notevole importanza industriale perché costituisce il punto di partenza per la preparazione del nylon. ILOALANI a ciclopropano rappresentato come d rappresentato come 2 cicloesano b ciclobutano rappresentato come e. 2 2 rappresentato come 2 metilciclobutano c rappresentato come f. rappresentato come 2 2 ciclopentano ,2-dimetilciclopentano 515
25 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI MODELLO DELLA MOLEOLA DELL ETENE 12 gli alcheni Gli alcheni sono idrocarburi non saturi le cui molecole possiedono almeno un doppio legame =. Gli alcheni non ciclici hanno formula generale n 2n, cioè hanno due atomi di idrogeno in meno rispetto agli alcani corrispondenti. Il primo termine della serie, l etene, 2 4, ha due atomi di carbonio, il secondo termine, il propene, 3 6, ha tre atomi di carbonio, il terzo termine della serie, il butene, 4 8, ha quattro atomi di carbonio. I termini etilene, propilene, butilene appartengono alla nomenclatura tradizionale, e vengono ancora mantenuti nella pratica industriale MODELLO DELLA MOLEOLA DEL PROPENE i legami covalenti negli alcheni La molecola dell etilene o etene, 2 4, il primo termine della serie degli alcheni, presenta un doppio legame carbonio-carbonio 2 = 2. La molecola è planare, per cui i sei atomi giacciono su un piano, e gli angoli di legame sono vicini a 120. Il doppio legame negli alcheni consiste di un legame sigma s e di un legame pi greco π. Inoltre la lunghezza di legame carbonio-carbonio è di 134 pm. 1 pm = 1 x m 134 pm In Tabella 5 sono riportati il nome, la formula molecolare e la formula di struttura condensata di alcuni alcheni. TABELLA 5. Gli atomi di carbonio del doppio legame negli alcheni mostrano ibridazione sp 2. Vedi pagina 527. Nome Formula molecolare Formula di struttura condensata Etene = 2 (Etilene) Propene = (Propilene) butene = butene 4 8 = metil-1-butene = metil-2-butene 5 10 = Guida allo studio Quali caratteristiche presenta un idrocarburo non saturo come l etene? Fai qualche esempio di alchene e scrivi la formula di struttura condensata corrispondente. Descrivi i legami covalenti negli alcheni. 516
26 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI Regole per la nomenclatura iupa degli alcheni a. Si individua la catena più lunga di atomi di che include il doppio legame. b. Si numerano gli atomi di della catena base partendo dall estremità più vicina al doppio legame, la cui posizione viene indicata dal numero del primo carbonio impegnato nel doppio legame. onsideriamo il composto c. Per la nomenclatura della catena continua si cambia il suffisso -ano dell alcano corrispondente in -ene. La catena più lunga ha cinque atomi di carbonio e il doppio legame parte dal carbonio-2; così il composto è un derivato del 2-pentene. d. Si indicano con i relativi numeri le posizioni dei gruppi alchilici legati alla catena principale. Poiché il gruppo metile è sul carbonio-3, il nome completo del composto è 3-metil-2-pentene e. Se il doppio legame è equidistante dalle due estremità, si numera la catena a partire dall estremità più vicina al primo sostituente. Ad esempio, il composto corrisponde al 2-metil-3-esene. autoverifia 4. Assegna il nome al composto rappresentato dalla seguente formula di struttura. 2 2 = 5. Assegna il nome al composto rappresentato dalla seguente formula di struttura. = 2 6. Assegna il nome al composto rappresentato dalla seguente formula di struttura. 2 = 2 7. Scrivi le formule corrispondenti ai seguenti composti. a. 2,3-dimetil-1-butene b. 2-metil-2-butene 517
27 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI Guida allo studio Spiega in che cosa consiste l isomeria cis-trans negli alcheni. he cosa sono gli stereoisomeri? 13 isomeria geometrica cis-trans Nelle molecole lineari due atomi di carbonio, che sono legati tra di loro con un legame singolo, possono ruotare liberamente l uno rispetto all altro (figura 6 di p. 510). Invece, il doppio legame degli alcheni è rigido, cioè la rotazione di un atomo di carbonio rispetto all altro non può avvenire. Analizziamo quali sono le conseguenze di questa proprietà degli alcheni. La molecola 1,2-dicloroetene, l = l è un composto bisostituito dell etene, cioè un composto in cui i due atomi di carbonio del doppio legame presentano due sostituenti diversi dall idrogeno. I due atomi di cloro possono trovarsi dalla stessa parte del doppio legame o da parte opposta. l l l l cis-1, 2 dicloroetene trans1, 2-dicloroetene T.f. = 80 T.f. = 50 T.eb. = + 60 T.eb. = + 47 polare non polare l = l Il composto che presenta entrambi i sostituenti dalla stessa parte del doppio legame è detto isomero cis, quello invece che presenta i due sostituenti da parte opposta rispetto al doppio legame è detto isomero trans. Le molecole in cui gli atomi e i gruppi atomici sono connessi con la stessa sequenza ma differiscono per il loro diverso orientamento nello spazio sono dette stereoisomeri. Gli isomeri cis-trans sono stereoisomeri che presentano proprietà fisiche differenti, come la temperatura di fusione e quella di ebollizione, mentre le proprietà chimiche sono pressoché uguali. Per il fatto che presentano temperature di ebollizione differenti, possono essere separati mediante distillazione. Pur essendo il legame l polare per la differenza di elettronegatività che esiste tra i due atomi, i due dipòli nella forma trans si trovano sullo stesso asse ma con verso opposto, per cui la molecola risulta non polare. Se il composto è biologicamente attivo, come in un farmaco, gli isomeri cis-trans hanno effetti differenti. Gli stereoisomeri saranno ripresi e approfonditi nel capitolo
28 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI problema svolto 3 Dalle seguenti molecole a. 2-butene b. 1,1-dicloroetene scrivi la formula di struttura di ciascuna di esse; rappresenta la configurazione disponendo, se è possibiloe, i gruppi legati agli atomi di carbonio del doppio legame in differenti modi. Soluzione a. La formula di struttura del 2-butene è = A questa formula corrispondono due conformazioni (stereoisomeri) = = cis 2-butene trans 2-butene b. La formula di struttura del 1,1-dicloroetene è l 2 = 2 Ad un atomo di carbonio sono legati due atomi identici, per cui l isomeria cis-trans non è possibile. Esiste una sola configurazione l = l autoverifia 8. Scrivi la formula di struttura del propene. Questa molecola presenta isomeria cis-trans? Mappa concettuale GLI ISOMERI stessa formula molecolare diverso ordine con cui gli atomi sono legati stessa sequenza degli atomi ma con diverso orientamento nello spazio ISOMERI DI STRUTTURA STEREOISOMERI 519
29 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI Guida allo studio Quali sono le proprietà fisiche degli alcheni? Qual è il loro uso? Quali sono le reazioni caratteristiche degli alcheni? Fai una un esempio di reazione di addizione assonetto per la raccolta differenziata in polietilene. 14 proprietà e usi degli alcheni Gli alcheni sono composti non polari e, quindi, hanno una bassa solubilità in acqua. Sono, invece, solubili in solventi organici. Fino a quattro atomi di carbonio questi idrocarburi si presentano, a temperatura ambiente, allo stato gassoso. La temperatura degli alcheni cresce con l aumentare degli atomi di carbonio. I composti a catena ramificata hanno temperature di ebollizione inferiori rispetto a quelli a catena lineare, a parità di atomi di carbonio. Gli alcheni, come l etilene, il propilene e i butileni, si ottengono dagli alcani per cracking (vedi pagina 541). L etilene, il termine più importante della serie, serve per la produzione di glicol etilenico (il liquido dei radiatori delle auto), di alcool etilico, di alogenuri alchilici e di polimeri, come il polietilene (figura 15). Gli alcheni, per la presenza di un doppio legame, si presentano più reattivi degli alcani. Le reazioni caratteristiche degli alcheni sono le reazioni di addizione al doppio legame e le reazioni di polimerizzazione. In una reazione di addizione due molecole si combinano per dare luogo ad un solo prodotto. Esempi di reazioni di addizione al doppio legame vengono riportati qui di seguito. addizione di idrogeno catalizzatore propene propano on l idrogenazione degli alcheni si ottiene il corrispondente alcano. Mediante questo processo, i doppi legami presenti negli oli vegetali vengono idrogenati e si ha formazione di solidi, le margarine. addizione di aqua ioni O O etene O alcool etilico Questa reazione ha notevole importanza industriale perché dall etene si può preparare l alcool etilico che viene usato come solvente. addizione di idraidi Le reazioni di polimerizzazione sono trattate a pag l 2 2 l 2 l etene Il cloruro di etile è un solvente organico per grassi. cloruro di etile o cloroetano 520
30 Approfondimento addizione elettrofila al doppio legame apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI Il meccanismo delle reazioni al doppio legame è di addizione elettrofila. Un elettrofilo è una specie chimica carica positivamente, come lo ione +, o le molecole polari degli idracidi ( l) o gli alogeni (Br Br), oppure una specie che ha una lacuna elettronica come All 3, cioè un acido di Lewis. In una addizione elettrofila il legame pi greco (π) degli alcheni, che si presenta energeticamente debole, attacca con facilità un elettrofilo. addizione di l all etene L addizione di l all etene porta alla formazione di cloroetano secondo la reazione Etere (solvente) l 2 l 25 etene cloruro di etile (o cloroetano) La molecola l è polarizzata, come conseguenza della maggiore elettronegatività del cloro rispetto all idrogeno. La reazione avviene in due passaggi. Inizia con l attacco dello ione + da parte della coppia di elettroni π dell alchene con formazione di un nuovo legame s. Il secondo atomo di carbonio dell etene, avendo perso gli elettroni π condivisi, rimane con una carica positiva. δ + δ l l passaggio lento carbocatione perché si verifica la rottura di legami chimici Il prodotto intermedio che si forma è chiamato carbocatione e si presenta molto reattivo. Nel secondo passaggio, lo ione l dona una coppia di elettoni all atomo di carbonio positivo formando un legame l l 2 l passaggio veloce cloroetano Questo meccanismo implica nel passaggio lento l attacco di uno ione positivo (un elettrofilo) da parte del legame π, per cui è detto di addizione elettrofila. addizione di Br ad un alchene asimmetrico onsideriamo l addizione di Br al propene, = 2, un alchene asimmetrico rispetto al doppio legame. 521
31 apitolo 22. IMIA ORGANIA ALANI, ALENI, ALINI a questo carbonio sono legati due = 2 a questo carbonio sono legati un ed un gruppo alchilico Il propene potrebbe dare due prodotti di reazione 2 + Br 2 propene Br 2-bromopropano (bromuro di isopropile) 2 + Br x 2 propene Br 1-bromopropano (bromuro di n-propile) Sperimentalmente, si ottiene solo il 2-bromopropano. In maniera analoga, il 2-metilpropene con Br potrebbe dare due prodotti di reazione 2 + Br 2 2-metilpropene Br 2-bromo-2-metilpropano (bromuro di terz-butile) 2 + Br x 2 2-metilpropene Br 1-bromo-2-metilpropano (bromuro di isobutile) Dei due prodotti, sperimentalmente, si ottiene solo il 2-bromo-2-metilpropano. Per spiegare questi ed altri risultati sperimentali, il chimico russo Vladimir Markovnikov ( ), nel 1869 formulò la seguente regola Quando un alchene di struttura asimmetrica si combina con un acido alogenidrico, l idrogeno si attacca al carbonio del doppio legame che è legato al maggior numero di atomi di idrogeno, mentre l alogeno si lega al carbonio del doppio legame più povero di idrogeno. addizione di Br ad un alchene asimmetrico in presenza di perossidi L addizione di Br ad un alchene asimmetrico in presenza di perossidi dà un prodotto opposto alla regola di Markovnikov. perossidi 2 = 2 + Br Br butene bromuro 1-bromobutano di idrogeno In presenza di perossidi, l addizione del bromuro di idrogeno all alchene procede con un meccanismo di tipo radicalico che porta ad un prodotto anti- Markovnikov. 522
32 apitolo 22 ONOSENZE ABILITÀ GLI ALANI 1 Quale dei seguenti composti è un alcano? a b c. 6 6 d Tra i seguenti composti individua l etano a b. 4 c. 2 6 d Negli alcani si definiscono isomeri di struttura i composti che a. hanno la stessa formula molecolare ma differiscono nella disposizione degli atomi di carbonio b. differiscono nella massa molecolare c. differiscono nella disposizione degli atomi di carbonio d. hanno la stessa formula molecolare e identica temperatura di ebollizione Verifiche 3 Dai il nome IUPA del composto rappresentato dalla formula di struttura Rappresenta un isomero del composto n-butano Rappresenta tre differenti composti isomeri che hanno la formula Dai il nome IUPA del composto rappresentato dalla formula di struttura Scrivi la formula di struttura del 4-terz-butil-2,6-dimetileptano. 6 Scrivi la formula di struttura del metilcicloesano. 7 Scrivi la formula di struttura dell 1,3-dimetil-ciclopentano. 8 Dai il nome IUPA del composto rappresentato dalla formula di struttura ISOMERI DI STRUTTURA Structural isomers have a. identical molecular formula b. identical molecular formula, but different structural formula c. different chemical properties d. identical physical properties PROPRIETÀ FISIE DEGLI ALANI 13 Gli alcani sono composti a. ionici, con densità inferiore all acqua b. covalenti, con densità superiore all acqua c. solubili in acqua d. covalenti, con densità inferiore all acqua 14 Quale delle seguenti affermazioni è FALSA? a. La temperatura di ebollizione degli alcani cresce con la massa molecolare b. Poiché gli alcani sono sostanze non polari, le forze intermolecolari sono forze di London c. A parità di massa molecolare le molecole più compatte (cioè a catena ramificata) presentano temperature di ebollizione più basse delle molecole a catena lineare d. Gli alcani sono solubili in acqua 15 Quale dei seguenti composti ha la temperatura di ebollizione più alta? a. n 6 14 b. n Petrol is a liquid because its molecules are subject to a. dipole-dipole forces b. London forces c. ion-dipole bonds d. hydrogen bonds 529
33 apitolo 22 ONOSENZE ABILITÀ Verifiche 17 Gli alcani sono composti caratterizzati da a. elevata conducibilità elettrica b. ottima solubilità in acqua c. ottima solubilità in solventi non polari d. elevata temperatura di ebollizione 18 Quale composto presenta la più alta temperatura di ebollizione? a. 3 8 b c d Quale dei seguenti composti presenta la temperatura di ebollizione più bassa? a b. 2 ( ) c. ( ) 2 20 Answer the following statements. In the structural formula of an alkane TRUE FALSE a. the carbon atoms bond through simple bonds b. the carbon atoms always form a linear chain c. the carbon atoms always form a cyclic structure d. the carbon atoms always form a branched structure e. only carbon and hydrogen atoms are present LE REAZIONI IMIE DEGLI ALANI 21 Individua la risposta NON corretta. Gli alcani sono composti che a. bruciano con l ossigeno dell aria per dare O 2 e 2 O b. bruciano con l ossigeno in modo spontaneo c. danno reazioni di sostituzione radicalica d. reagiscono con cloro o bromo in presenza di luce ultravioletta 22 Which of the following reactions is NOT typical of alkanes? a. ombustion b. Reduction-oxidation c. Radical substitution d. Electrophilic addition 23 Nella reazione tra il metano e il cloro, in presenza di luce UV, qual è il prodotto che NON si ottiene? a. l b. 2 l c. 2 l 2 d. l 3 e. l 4 GLI ALENI 24 Quale formula rappresenta un alchene? a. 2 2 b. 3 8 c. 4 8 d Dai il nome del seguente composto insaturo. 26 Scrivi la struttura di a. 3-metilcicloesene b. 2-metil-1-butene 27 Scrivi la struttura di 4-metil-2-pentene = 28 Dai il nome ai seguenti composti. a. 2 = 2 b. 2 = 2 L ISOMERIA IS-TRANS NEGLI ALENI 29 Quale dei seguenti due composti presenta isomeria cis-trans? a. Br = b. l = Br Br l Br Dai una spiegazione della risposta. 30 Quale di questi alcheni NON presenta isomeria cistrans? a. = b. l = l c. 2 = 2 d. 2 = 31 Quale dei seguenti composti NON presenta isomeria cis-trans? a. = 2 b. = l c. 2 = l 530
IBRIDAZIONE DEL CARBONIO NEGLI ALCANI PREMESSA: COSA SONO GLI ORBITALI IBRIDI.
 ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
ALCANI Gli alcani sono composti organici costituiti solamente da carbonio e idrogeno (per questo motivo appartengono alla più ampia classe degli idrocarburi), aventi formula bruta C n H (2n + 2). Gli alcani
Approccio alla CHIMICA ORGANICA. Chimica organica: gli idrocarburi I gruppi funzionali. Paolo Pistarà, Principi di chimica moderna - Tomo A ATLAS
 Approccio alla IMIA ORGANIA himica organica: gli idrocarburi I gruppi funzionali IMIA ORGANIA: GLI IDROARBURI ompetenze Distinguere gli idrocarburi in base al legame covalente (singolo, doppio, triplo)
Approccio alla IMIA ORGANIA himica organica: gli idrocarburi I gruppi funzionali IMIA ORGANIA: GLI IDROARBURI ompetenze Distinguere gli idrocarburi in base al legame covalente (singolo, doppio, triplo)
PERCHE STUDIARE LA CHIMICA ORGANICA?
 CIMICA ORGANICA CE COSA E LA CIMICA ORGANICA? La chimica organica è dedicata alla descrizione della struttura, delle proprietà e delle funzioni dei composti del carbonio (C). PERCE STUDIARE LA CIMICA ORGANICA?
CIMICA ORGANICA CE COSA E LA CIMICA ORGANICA? La chimica organica è dedicata alla descrizione della struttura, delle proprietà e delle funzioni dei composti del carbonio (C). PERCE STUDIARE LA CIMICA ORGANICA?
Alcani e cicloalcani. Nomenclatura e nomi comuni Struttura e proprietà Reazioni
 Alcani e cicloalcani Nomenclatura e nomi comuni Struttura e proprietà Reazioni Alcani Gli orbitali atomici hanno forme ben definite. Gli orbitali S sono sferici con gli e - confinati in una regione sferica
Alcani e cicloalcani Nomenclatura e nomi comuni Struttura e proprietà Reazioni Alcani Gli orbitali atomici hanno forme ben definite. Gli orbitali S sono sferici con gli e - confinati in una regione sferica
CHIMICA ORGANICA. Gli alcheni
 1 2-ALENI IMIA ORGANIA ALENI Formula generale n 2n Desinenza -ene Gli alcheni La prima classe di idrocarburi insaturi è quella degli alcheni, detti anche olefine, che presentano lungo la catena uno o più
1 2-ALENI IMIA ORGANIA ALENI Formula generale n 2n Desinenza -ene Gli alcheni La prima classe di idrocarburi insaturi è quella degli alcheni, detti anche olefine, che presentano lungo la catena uno o più
IDROCARBURI. Alcani Alcheni Alchini C-C C=C C C
 IDROCARBURI Alcani Alcheni Alchini C-C C=C C C Nomenclatura Degli idrocarburi saturi (Alcani) CH 4 Metano C 2 H 6 Etano C n H 2n+2 Si dicono alchilici quei gruppi che contengono un idrogeno in meno del
IDROCARBURI Alcani Alcheni Alchini C-C C=C C C Nomenclatura Degli idrocarburi saturi (Alcani) CH 4 Metano C 2 H 6 Etano C n H 2n+2 Si dicono alchilici quei gruppi che contengono un idrogeno in meno del
Teoria degli orbitali. Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale.
 Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
Teoria degli orbitali Lo spazio intorno al nucleo in cui è possibile trovare con la massima probabilità gli elettroni viene chiamato orbitale. orbitale nucleo STPA-Chimica Organica 1 L orbitale 1s Gli
IDROCARBURI I ALCANI ANALISI CONFORMAZIONALE
 IDROCARBURI I ALCANI NOMENCLATURA ANALISI CONFORMAZIONALE REAZIONI GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI:
IDROCARBURI I ALCANI NOMENCLATURA ANALISI CONFORMAZIONALE REAZIONI GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI:
Gruppi funzionali Un gruppo funzionale è un atomo o un gruppo di atomi con proprietà chimiche e fisiche tipiche. E
 Gruppi funzionali Gruppi funzionali La reattività chimica di ogni molecola organica, indipendentemente dalle sue dimensioni o dalla sua complessità, è determinata dai gruppi funzionali che essa contiene
Gruppi funzionali Gruppi funzionali La reattività chimica di ogni molecola organica, indipendentemente dalle sue dimensioni o dalla sua complessità, è determinata dai gruppi funzionali che essa contiene
CHIMICA ORGANICA CHIMICA DEL CARBONIO
 CHIMICA ORGANICA CHIMICA DEL CARBONIO Fino al 1828 con il termine organico si indicavano le sostanze prodotte dagli organismi viventi, mentre si classificavano come inorganiche tutte le altre Dopo il 1828
CHIMICA ORGANICA CHIMICA DEL CARBONIO Fino al 1828 con il termine organico si indicavano le sostanze prodotte dagli organismi viventi, mentre si classificavano come inorganiche tutte le altre Dopo il 1828
Alcani. Es. CH 3 CH 2 CH 2 CH 3
 Alcani Gli alcani sono i composti organici più semplici costituiti solo da atomi di e di (Idrocarburi); Sono composti saturi poiché ogni atomo di carbonio è legato al numero massimo possibile (4) di altri
Alcani Gli alcani sono i composti organici più semplici costituiti solo da atomi di e di (Idrocarburi); Sono composti saturi poiché ogni atomo di carbonio è legato al numero massimo possibile (4) di altri
I composti organici. Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H)
 I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
I composti organici Gli idrocarburi: composti binari, ovvero costituiti solo da due elementi. Carbonio (C) e idrogeno (H) Gli idrocarburi Gli Alcani Costituiti da uno o più atomi di carbonio legati tra
- il DNA, la molecola che contiene l informazione genetica, - le proteine dei nostro organismo ( proteine dei muscoli, della pelle, gli enzimi),
 La chimica organica è la chimica dei composti del carbonio, che sono i mattoni con cui sono costruiti tutti i corpi viventi della terra. Questi composti comprendono ad esempio - il DNA, la molecola che
La chimica organica è la chimica dei composti del carbonio, che sono i mattoni con cui sono costruiti tutti i corpi viventi della terra. Questi composti comprendono ad esempio - il DNA, la molecola che
La chimica organica è la chimica dei composti contenenti carbonio
 Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Classificazione degli idrocarburi
 Classificazione degli idrocarburi ALCANI Alcani: idrocarburi saturi contenenti solo legami semplici carbonio-carbonio (tutti i carboni sono ibridati sp3). Modelli molecolari di etano, propano e butano.
Classificazione degli idrocarburi ALCANI Alcani: idrocarburi saturi contenenti solo legami semplici carbonio-carbonio (tutti i carboni sono ibridati sp3). Modelli molecolari di etano, propano e butano.
Introduzione alla chimica organica. Daniele Dondi
 Introduzione alla chimica organica Daniele Dondi dondi@unipv.it Il carbonio nelle sue ibridazioni sp 3 sp 2 sp Il carbonio è un elemento fondamentale per la chimica organica. La stabilità del legame -
Introduzione alla chimica organica Daniele Dondi dondi@unipv.it Il carbonio nelle sue ibridazioni sp 3 sp 2 sp Il carbonio è un elemento fondamentale per la chimica organica. La stabilità del legame -
I composti organici. Il carbonio e i composti organici
 I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
I composti organici Il carbonio e i composti organici COSA SONO I COMPOSTI ORGANICI? I composti organici sono composti in cui uno o più atomi di carbonio (C) sono uniti tramite un legame covalente ad atomi
Introduzione alla chimica organica. Daniele Dondi
 Introduzione alla chimica organica Daniele Dondi dondi@unipv.it 1 enni sulla nascita della chimica organica Analisi elementari tramite combustione WÖLER (metà 1800) sintetizza l urea KLBE sintetizza l
Introduzione alla chimica organica Daniele Dondi dondi@unipv.it 1 enni sulla nascita della chimica organica Analisi elementari tramite combustione WÖLER (metà 1800) sintetizza l urea KLBE sintetizza l
LA CHIMICA DEL CARBONIO
 LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
LA CHIMICA DEL CARBONIO E QUELLA PARTE DELLA CHIMICA CHE STUDIA IL CARBONIO E TUTTI I SUOI DERIVATI. I COMPOSTI DEL CARBONIO POSSONO ESSERE NATURALI (PROTEINE, ACIDI NUCLEICI, LIPIDI E CARBOIDRATI) O ESSERE
Idrocarburi Al A ifatici Ar A oma m tici
 GLI IDROCARBURI Gli idrocarburi sono i più semplici composti del carbonio con l'idrogeno. Sono le molecole di base della chimica organica poiché, oltre ad essere molto numerosi, tutti gli altri composti
GLI IDROCARBURI Gli idrocarburi sono i più semplici composti del carbonio con l'idrogeno. Sono le molecole di base della chimica organica poiché, oltre ad essere molto numerosi, tutti gli altri composti
Capitolo 2 Alcani e Cicloalcani
 himica Organica Informazione Scientifica sul Farmaco apitolo 2 Alcani e icloalcani Organic hemistry, 5 th Edition L. G. Wade, Jr. Prentice all Organic hemistry, 3 rd Edition 1 Paula Y. Bruice, Prentice
himica Organica Informazione Scientifica sul Farmaco apitolo 2 Alcani e icloalcani Organic hemistry, 5 th Edition L. G. Wade, Jr. Prentice all Organic hemistry, 3 rd Edition 1 Paula Y. Bruice, Prentice
IDROCARBURI: classificazione
 ALCANI 1 IDROCARBURI: classificazione 2 ALCANI Formula bruta: C n H 2n+2 1 C CH 4 2 C C 2 H 6 3 C C 3 H 8 4 C C 4 H 10 3 ALCANI: ibridazione Orbitali s, p e sp 3 z orbitale 2s y x z z z orbitali 2p y x
ALCANI 1 IDROCARBURI: classificazione 2 ALCANI Formula bruta: C n H 2n+2 1 C CH 4 2 C C 2 H 6 3 C C 3 H 8 4 C C 4 H 10 3 ALCANI: ibridazione Orbitali s, p e sp 3 z orbitale 2s y x z z z orbitali 2p y x
Appunti di Chimica Organica Elementi per CdL Ostetricia CHIMICA ORGANICA. Appunti di Lezione. Elementi per il corso di Laurea In Ostetricia
 Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Appunti di himica Organica Elementi per dl Ostetricia IMIA ORGANIA Appunti di Lezione Elementi per il corso di Laurea In Ostetricia Autore: Roberto Zanrè A.A. 2009/2010 1 Appunti di himica Organica Elementi
Chimica Organica. Studio dei composti del CARBONIO
 Chimica Organica Studio dei composti del CARBONIO 1 Contengono C, H e possono contenere N, O, S Carbonio legato covalentemente ad un metallo Tutti gli elementi possibili Composti organici 2 Perché si formano
Chimica Organica Studio dei composti del CARBONIO 1 Contengono C, H e possono contenere N, O, S Carbonio legato covalentemente ad un metallo Tutti gli elementi possibili Composti organici 2 Perché si formano
Isomeria Costituzionale. Isomeria Conformazionale
 Isomeria ostituzionale Isomeri ostituzionali: omposti con uguale formula molecolare ma con un diverso ordine con cui sono legati gli atomi tra loro. Isomeria onformazionale onformazione: ciascuna disposizione
Isomeria ostituzionale Isomeri ostituzionali: omposti con uguale formula molecolare ma con un diverso ordine con cui sono legati gli atomi tra loro. Isomeria onformazionale onformazione: ciascuna disposizione
CHIMICA II (CHIMICA ORGANICA)
 CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
CHIMICA II (CHIMICA ORGANICA) Prof. Gennaro Piccialli Prof. Aldo Galeone Prof. Giorgia Oliviero Testo Consigliato: gruppo 1 (matricole A-E) gruppo 2 (matricole F-O) gruppo 3 (matricole P-Z) Introduzione
GLI ALCANI. Michele Kodrič
 GLI ALCANI Michee Kodrič DEGLI ALCANI VEDREMO: (CARATTERISTICE (NOMENCLATURA (FORMULAZIONE (COMPOSTI PRINCIPALI (REATTIVITA (OTTENIMENTO (ISOMERIA DI CATENA (GRUPPI ALCILICI 1 CARATTERISTICE DEGLI ALCANI
GLI ALCANI Michee Kodrič DEGLI ALCANI VEDREMO: (CARATTERISTICE (NOMENCLATURA (FORMULAZIONE (COMPOSTI PRINCIPALI (REATTIVITA (OTTENIMENTO (ISOMERIA DI CATENA (GRUPPI ALCILICI 1 CARATTERISTICE DEGLI ALCANI
CHIMICA ORGANICA Gli alcani e i cicloalcani
 1 C1-ALCANI E CICLOALCANI CHIMICA ORGANICA Gli alcani e i cicloalcani ALCANI Formula generale C n H 2n+2 Desinenza -ano Gli alcani Gli alcani, detti anche paraffine, appartengono alla classe degli idrocarburi
1 C1-ALCANI E CICLOALCANI CHIMICA ORGANICA Gli alcani e i cicloalcani ALCANI Formula generale C n H 2n+2 Desinenza -ano Gli alcani Gli alcani, detti anche paraffine, appartengono alla classe degli idrocarburi
LA CHIMICA ORGANICA IBRIDAZIONE
 LA CHIMICA ORGANICA Detta anche LA CHIMICA DEL CARBONIO (C) perché Il C gioca un ruolo fondamentale in tutte le molecole organiche (cioè appartenenti o derivanti da esseri viventi). Possiamo spiegarlo
LA CHIMICA ORGANICA Detta anche LA CHIMICA DEL CARBONIO (C) perché Il C gioca un ruolo fondamentale in tutte le molecole organiche (cioè appartenenti o derivanti da esseri viventi). Possiamo spiegarlo
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Nome degli alcheni a catena lineare
 Gli alcheni sono idrocarboni insaturi. insaturi (almeno un doppio legame) idrocarboni (solo e ) n 2n 1-Esene 6 12 opyright 1999, Michael J. Wovkulich. All rights reserved. Nome degli alcheni a catena lineare
Gli alcheni sono idrocarboni insaturi. insaturi (almeno un doppio legame) idrocarboni (solo e ) n 2n 1-Esene 6 12 opyright 1999, Michael J. Wovkulich. All rights reserved. Nome degli alcheni a catena lineare
Alcheni: struttura e reattività
 Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Sandro Campestrini Dipartimento di Chimica Organica, Via Marzolo 1
 Sandro Campestrini Dipartimento di Chimica Organica, Via Marzolo 1 E-mail: sandro.campestrini@unipd.it Phone: 049-8275289 http://www.chfi.unipd.it/home/s.campestrini Testo consigliato: FONDAMENTI di CHIMICA
Sandro Campestrini Dipartimento di Chimica Organica, Via Marzolo 1 E-mail: sandro.campestrini@unipd.it Phone: 049-8275289 http://www.chfi.unipd.it/home/s.campestrini Testo consigliato: FONDAMENTI di CHIMICA
Alcheni: : struttura e reattività. Alcheni. Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n. H 2n. Alcheni in biologia
 Alcheni: : struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
Alcheni: : struttura e reattività Alcheni Gli alcheni sono detti anche olefine e sono idrocarburi insaturi C n H 2n Alcheni in biologia ormone delle piante che induce la maturazione dei frutti costituente
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA)
 La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
La chimica della vita: i composti organici. CARBOIDRATI LIPIDI PROTEINE ACIDI NUCLEICI (DNA, RNA) IL CARBONIO E un non metallo, appartiene al IV gruppo ed al II periodo. Possiede 4 elettroni esterni per
Introduzione alla Chimica Organica. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Introduzione alla Chimica Organica Copyright The McGraw-ill Companies, Inc. Permission required for reproduction or display. 1 Elementi Comuni nei Composti Organici 2 Classificazione degli idrocarburi
Introduzione alla Chimica Organica Copyright The McGraw-ill Companies, Inc. Permission required for reproduction or display. 1 Elementi Comuni nei Composti Organici 2 Classificazione degli idrocarburi
Idrocarburi Saturi. Reazioni
 Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Idrocarburi Saturi Reazioni Fonti ed usi Gli alcani lineari, ramificati e ciclici si ottengono principalmente dalla lavorazione (frazionamento, cracking, etc.), del petrolio. Fonti ed usi Gli alcani, soprattutto
Chimica Organica. In passato, i composti chimici erano suddivisi in due grandi gruppi,
 Chimica Organica In passato, i composti chimici erano suddivisi in due grandi gruppi, inorganici e organici, in base alla loro origine. La chimica organica diveniva così la chimica dei composti del carbonio.
Chimica Organica In passato, i composti chimici erano suddivisi in due grandi gruppi, inorganici e organici, in base alla loro origine. La chimica organica diveniva così la chimica dei composti del carbonio.
Capitolo 23 Dal carbonio agli idrocarburi
 Capitolo 23 Dal carbonio agli idrocarburi 1. I composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani 3. L isomeria 4. La nomenclatura degli idrocarburi saturi 5. Proprietà fisiche e chimiche
Capitolo 23 Dal carbonio agli idrocarburi 1. I composti organici 2. Gli idrocarburi saturi: alcani e cicloalcani 3. L isomeria 4. La nomenclatura degli idrocarburi saturi 5. Proprietà fisiche e chimiche
Gli idrocarburi sono composti organici, che contengono soltanto atomi di carbonio e di idrogeno. Gli atomi di carbonio (C) sono legati tra loro a
 Gli idrocarburi sono composti organici, che contengono soltanto atomi di carbonio e di idrogeno. Gli atomi di carbonio (C) sono legati tra loro a formare lo scheletro della molecola, mentre gli atomi di
Gli idrocarburi sono composti organici, che contengono soltanto atomi di carbonio e di idrogeno. Gli atomi di carbonio (C) sono legati tra loro a formare lo scheletro della molecola, mentre gli atomi di
Verifiche dei Capitoli - Tomo C
 Soluzioni Verifiche dei Capitoli - Tomo C Per ogni Capitolo sono presentate le soluzioni delle Verifiche, delle Autoverifiche, delle Competenze e dei quesiti proposti nelle schede di Laboratorio. VERIFICHE
Soluzioni Verifiche dei Capitoli - Tomo C Per ogni Capitolo sono presentate le soluzioni delle Verifiche, delle Autoverifiche, delle Competenze e dei quesiti proposti nelle schede di Laboratorio. VERIFICHE
Alcheni: struttura e proprietà
 Chimica Organica Informazione Scientifica sul Farmaco Alcheni: struttura e proprietà Organic Chemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: struttura degli alcheni nomenclatura proprietà fisiche
Chimica Organica Informazione Scientifica sul Farmaco Alcheni: struttura e proprietà Organic Chemistry, 5 th Edition L. G. Wade, Jr. In questa lezione: struttura degli alcheni nomenclatura proprietà fisiche
Nomenclatura. Gli idrocarburi alifatici
 Gli idrocarburi alifatici Gli idrocarburi sono i composti organici più semplici, sono infatti costituiti solo da carbonio e idrogeno (da cui il nome, appunto, di idro-carburi). Pur essendo relativamente
Gli idrocarburi alifatici Gli idrocarburi sono i composti organici più semplici, sono infatti costituiti solo da carbonio e idrogeno (da cui il nome, appunto, di idro-carburi). Pur essendo relativamente
Alchini. Suffisso: -ino. d. H 3 CCH 2 CC CH
 Alchini Suffisso: -ino Indicare la posizione del triplo legame con il numero che lo contraddistingue nella catena. La numerazione comincia sempre dall estremità più prossima al triplo legame. 3 3 2 2 2
Alchini Suffisso: -ino Indicare la posizione del triplo legame con il numero che lo contraddistingue nella catena. La numerazione comincia sempre dall estremità più prossima al triplo legame. 3 3 2 2 2
PIANO DI LAVORO ANNUALE
 PIANO DI LAVORO ANNUALE Classe 3B A.S. 2013-14 Disciplina: Chimica Organica Docente: prof. Laura M. Iannone Ore settimanali: 4 Libro di testo: Percorsi di Chimica Organica, di Paolo De Maria ed. Zanichelli.
PIANO DI LAVORO ANNUALE Classe 3B A.S. 2013-14 Disciplina: Chimica Organica Docente: prof. Laura M. Iannone Ore settimanali: 4 Libro di testo: Percorsi di Chimica Organica, di Paolo De Maria ed. Zanichelli.
Idrocarburi Saturi. Cicloalcani
 Idrocarburi Saturi Cicloalcani Cicloalcani I cicloalcani sono idrocarburi i cui atomi di carbonio sono uniti per formare un anello In natura sono presenti cicloalcani con dimensioni dell anello che vanno
Idrocarburi Saturi Cicloalcani Cicloalcani I cicloalcani sono idrocarburi i cui atomi di carbonio sono uniti per formare un anello In natura sono presenti cicloalcani con dimensioni dell anello che vanno
Indice generale 1. Introduzione alla biochimica 2. Acqua, ph, acidi, basi, sali, tamponi
 Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
LA CHIMICA DELLA VITA
 LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
LA CHIMICA DELLA VITA L elemento presente in tutte le molecole caratteristiche degli esseri viventi è IL CARBONIO Il carbonio ha numero atomico 6 (Z=6). Ha valenza 4: ai suoi atomi mancano 4 elettroni
Prof.ssa Stacca Prof.ssa Stacca
 La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
La bassa differenza di elettronegatività tra C e H fa sì che i legami presenti negli alcani siano legami covalenti quasi omopolari; di conseguenza gli alcani sono composti apolari. La bassa differenza
Reazioni degli alcani
 Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
Reazioni degli alcani I legami degli alcani sono semplici, covalenti e non polari per questo sono composti praticamente inerti.(parum affinis ) Reagiscono solo con ossigeno (ossidoriduzioni) e con gli
CHIMICA ORGANICA. 2 a D. Novembre Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14. Ponte Felcino Perugia.
 CHIMICA ORGANICA 2 a D Novembre 2014 Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14 Ponte Felcino Perugia Manuela Casasoli IL CARBONIO La chimica organica studia i composti organici in cui il
CHIMICA ORGANICA 2 a D Novembre 2014 Scuola Secondaria di Primo Grado «Bonazzi Lilli» IC PG 14 Ponte Felcino Perugia Manuela Casasoli IL CARBONIO La chimica organica studia i composti organici in cui il
Modulo di Biochimica 3 CFU (30 ore) Orario delle Lezioni: 1 semestre (settembre-dicembre) Lunedì 14-17
 Corso di laurea in ingegneria Biomedica A.A. 2017/2018 Modulo di Biochimica 3 CFU (30 ore) Orario delle Lezioni: 1 semestre (settembre-dicembre) Lunedì 14-17 Dott.ssa Morena Arba PhD. morena.arba@unica.it
Corso di laurea in ingegneria Biomedica A.A. 2017/2018 Modulo di Biochimica 3 CFU (30 ore) Orario delle Lezioni: 1 semestre (settembre-dicembre) Lunedì 14-17 Dott.ssa Morena Arba PhD. morena.arba@unica.it
Gli idrocarburi e il petrolio
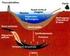 Gli idrocarburi e il petrolio Le proprietà degli atomi di carbonio di legarsi fra loro mediante legami semplici, doppi, tripli, formando catene stabili delle più diverse forme e lunghezze rende praticamente
Gli idrocarburi e il petrolio Le proprietà degli atomi di carbonio di legarsi fra loro mediante legami semplici, doppi, tripli, formando catene stabili delle più diverse forme e lunghezze rende praticamente
Diagramma di flusso degli idrocarburi
 Glialcanisonoidrocarburi saturi. saturi (solo legami semplici) idrocarburi (solo e ) n 2n+2 Esano 6 14 Diagramma di flusso degli idrocarburi Idrocarburi Saturi Insaturi Alcani Aciclici iclici atena lineare
Glialcanisonoidrocarburi saturi. saturi (solo legami semplici) idrocarburi (solo e ) n 2n+2 Esano 6 14 Diagramma di flusso degli idrocarburi Idrocarburi Saturi Insaturi Alcani Aciclici iclici atena lineare
TAVOLA PERIODICA DEGLI ELEMENTI
 TAVOLA PERIODIA DEGLI ELEMENTI Idrogeno = 1 legame Ossigeno = 2 legami O Azoto = 3 legami N arbonio = 4 legami Questi sono gli atomi che intervengono maggiormente nelle reazioni che tratteremo nella
TAVOLA PERIODIA DEGLI ELEMENTI Idrogeno = 1 legame Ossigeno = 2 legami O Azoto = 3 legami N arbonio = 4 legami Questi sono gli atomi che intervengono maggiormente nelle reazioni che tratteremo nella
Stampa Preventivo. A.S Pagina 1 di 8
 Stampa Preventivo A.S. 2009-2010 Pagina 1 di 8 Insegnante POLESEL Classe 4LTS ART Materia chimica organica e biochimica preventivo consuntivo 106 0 titolo modulo 1. Idrocarburi 2. Composti ossigenati 3.
Stampa Preventivo A.S. 2009-2010 Pagina 1 di 8 Insegnante POLESEL Classe 4LTS ART Materia chimica organica e biochimica preventivo consuntivo 106 0 titolo modulo 1. Idrocarburi 2. Composti ossigenati 3.
Chimica Organica. Breve storia della chimica organica
 Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Nomi e formule dei principali composti organici
 Il numero davvero sterminato dei e la necessità quindi di doverli distinguere ciascuno con la propria formula e il proprio nome, ha costretto i chimici (attraverso un apposito organismo, la IUPAC) a mettere
Il numero davvero sterminato dei e la necessità quindi di doverli distinguere ciascuno con la propria formula e il proprio nome, ha costretto i chimici (attraverso un apposito organismo, la IUPAC) a mettere
Nomi e formule dei principali composti organici
 Nomi e formule dei principali composti organici Il numero davvero sterminato dei composti organici e la necessità quindi di doverli distinguere ciascuno con la propria formula e il proprio nome, ha costretto
Nomi e formule dei principali composti organici Il numero davvero sterminato dei composti organici e la necessità quindi di doverli distinguere ciascuno con la propria formula e il proprio nome, ha costretto
ALIFATICI AROMATICI (Areni) POLIENI BENZENE e derivati CICLOALCHENI CICLOALCANI ALCHINI
 CIMICA ORGANICA IDROCARBURI Gli idrocarburi sono composti che contengono solo atomi di e C e, a seconda del tipo di legami chimici presenti nella molecola, possono essere suddivisi secondo il seguente
CIMICA ORGANICA IDROCARBURI Gli idrocarburi sono composti che contengono solo atomi di e C e, a seconda del tipo di legami chimici presenti nella molecola, possono essere suddivisi secondo il seguente
Alchini (C n H 2n-2 ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio doppi.
 himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
himica rganica Alcheni Idrocarburi ( x y ) Alifatici Aromatici Alcani ( n 2n+2 ) Alcheni ( n 2n ) Alchini ( n 2n-2 ) icloalcani ( n 2n ) Alcheni: idrocarburi insaturi con uno o più legami carbonio-carbonio
Ulteriori Contenuti digitali integrativi sono disponibili sul sito della Casa Editrice
 Ulteriori ontenuti digitali integrativi sono disponibili sul sito della asa Editrice www.edatlas.it Questo volume è disponibile anche in versione digitale. Per scaricarla: 1. prendi nota del codice stampato
Ulteriori ontenuti digitali integrativi sono disponibili sul sito della asa Editrice www.edatlas.it Questo volume è disponibile anche in versione digitale. Per scaricarla: 1. prendi nota del codice stampato
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA
 INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
INTRODUZIONE ALLO STUDIO DELLA CHIMICA ORGANICA ai primi dell 800 Il chimico svedese Jacob Berzelius (1779-1848) indicava le sostanze con il termine organico se ottenute dagli organismi viventi (animali
Capitolo 24 Dai gruppi funzionali ai polimeri
 Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Capitolo 24 Dai gruppi funzionali ai polimeri 1. I gruppi funzionali 2. Alcoli, fenoli ed eteri 3. Le reazioni di alcoli e fenoli 4. Alcoli e fenoli di particolare interesse 5. Aldeidi e chetoni 6. Gli
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 10 Le basi della biochimica 3 Sommario 1. Le molecole biologiche si dividono in quattro classi 2. I carboidrati sono il «carburante»
Conformazione degli alcani
 onformazione degli alcani La conformazione di un alcano si riferisce alla disposizione tridimensionale degli atomi che risulta dalla rotazione attorno al legame -. Nonostante in una molecola possano esservi
onformazione degli alcani La conformazione di un alcano si riferisce alla disposizione tridimensionale degli atomi che risulta dalla rotazione attorno al legame -. Nonostante in una molecola possano esservi
Capitolo 8 Alcoli e Fenoli
 Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
Chimica Organica Informazione Scientifica sul Farmaco Capitolo 8 Alcoli e Fenoli Organic Chemistry, 5 th Edition L. G. Wade, Jr. Struttura degli Alcoli Alcoli: Il gruppo funzionale è l ossidrile (), legato
3. Indicare quale (o quali) delle seguenti coppie di formule strutturali rappresenta la stessa molecola:
 . Indicare quale (o quali) delle seguenti coppie di formule strutturali rappresenta la stessa molecola: l a) NO b) l l l c) l l 4. Quali tra i seguenti scheletri di atomi di carbonio non rappresentano
. Indicare quale (o quali) delle seguenti coppie di formule strutturali rappresenta la stessa molecola: l a) NO b) l l l c) l l 4. Quali tra i seguenti scheletri di atomi di carbonio non rappresentano
I.T.I.S. VOLTA - Perugia A. S. 2011/2012 CLASSE 3 a sez. AC MATERIA: Chimica Organica Bio-Org. delle Fermentazione e Lab.
 I.T.I.S. VOLTA - Perugia A. S. 2011/2012 CLASSE 3 a sez. AC MATERIA: Chimica Organica Bio-Org. delle Fermentazione e Lab. (Esercizi da svolgere durante il periodo estivo) Strumento da utilizzare: libro
I.T.I.S. VOLTA - Perugia A. S. 2011/2012 CLASSE 3 a sez. AC MATERIA: Chimica Organica Bio-Org. delle Fermentazione e Lab. (Esercizi da svolgere durante il periodo estivo) Strumento da utilizzare: libro
Chimica Organica. Definizione. La chimica organica è la chimica dei composti contenenti carbonio
 Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
Chimica Organica Definizione La chimica organica è la chimica dei composti contenenti carbonio I carbonati, il biossido di carbonio e i cianuri metallici sono un eccezione in quanto vengono classificati
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
Stereochimica di alcani e cicloalcani
 di alcani e cicloalcani Conformazioni, conformeri Due conformazioni dell etano. Le conformazioni sono arrangiamenti diversi di atomi che interconvertono per rotazione attorno al legame C-C. Rappresentazione
di alcani e cicloalcani Conformazioni, conformeri Due conformazioni dell etano. Le conformazioni sono arrangiamenti diversi di atomi che interconvertono per rotazione attorno al legame C-C. Rappresentazione
PIANO DELLE UDA Terzo Anno
 ITIS ENRICO MEDI PIANO DI STUDIO DELLA DISCIPLINA Chimica organica (indirizzo biotecnologie ambientali) PIANO DELLE UDA Terzo Anno UDA COMPETENZE UDA ABILITÀ UDA CONOSCENZE UDA UDA N. 1 Rappresentare una
ITIS ENRICO MEDI PIANO DI STUDIO DELLA DISCIPLINA Chimica organica (indirizzo biotecnologie ambientali) PIANO DELLE UDA Terzo Anno UDA COMPETENZE UDA ABILITÀ UDA CONOSCENZE UDA UDA N. 1 Rappresentare una
Stereochimica di alcani e cicloalcani. Stereochimica. Conformazioni, conformeri
 di alcani e cicloalcani Conformazioni, conformeri Due conformazioni dell etano. I differenti conformeri si interconvertono per rotazione attorno al legame C-C. 1 Rappresentazione a cavalletto e proiezione
di alcani e cicloalcani Conformazioni, conformeri Due conformazioni dell etano. I differenti conformeri si interconvertono per rotazione attorno al legame C-C. 1 Rappresentazione a cavalletto e proiezione
1. COS È LA CHIMICA ORGANICA?
 Università degli Studi di Bari Dipartimento di Farmacia Scienze del Farmaco Corso di Laurea in Tecniche Erboristiche A.A. 2013-2014 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del
Università degli Studi di Bari Dipartimento di Farmacia Scienze del Farmaco Corso di Laurea in Tecniche Erboristiche A.A. 2013-2014 Chimica Organica Prof. Giuseppe Gerardo Carbonara Finalità. Scopo del
Cos è la chimica organica
 Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
Cos è la chimica organica La prima definizione di chimica organica si deve al chimico svedese Jacob Berzelius nel 1807: la chimica organica è la scienza che studia i comportamenti chimici e fisici dei
LE MOLECOLE BIOLOGICHE
 LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
Proprietà fisiche di Alcani e Cicloalcani
 Proprietà fisiche di Alcani e Cicloalcani PUNTI DI EBOLLIZIONE DEGLI ALCANI sono regolati dalla entità delle forze di attrazione intermolecolari gli alcani sono composti non polari per cui non entrano
Proprietà fisiche di Alcani e Cicloalcani PUNTI DI EBOLLIZIONE DEGLI ALCANI sono regolati dalla entità delle forze di attrazione intermolecolari gli alcani sono composti non polari per cui non entrano
CHIMICA ORGANICA. Gli alchini
 1 C3-ALCHINI CHIMICA ORGANICA ALCHINI Formula generale C n n 2 Desinenza -ino Gli alchini Gli alchini sono caratterizzati dalla presenza di uno o più tripli legami carboniocarbonio e sono anch essi classificati
1 C3-ALCHINI CHIMICA ORGANICA ALCHINI Formula generale C n n 2 Desinenza -ino Gli alchini Gli alchini sono caratterizzati dalla presenza di uno o più tripli legami carboniocarbonio e sono anch essi classificati
LE MOLECOLE DELLA VITA
 LE MOLECOLE DELLA VITA LE CELLULE SONO COSTITUITE DA ACQUA E BIOMOLECOLE Una biomolecola è un composto chimico che riveste un ruolo importante negli esseri viventi. Le molecole biologiche possono essere
LE MOLECOLE DELLA VITA LE CELLULE SONO COSTITUITE DA ACQUA E BIOMOLECOLE Una biomolecola è un composto chimico che riveste un ruolo importante negli esseri viventi. Le molecole biologiche possono essere
CHIMICA ORGANICA. Gli idrocarburi aromatici
 1 D-IDROCARBURI AROMATICI CHIMICA ORGANICA IDROCARBURI AROMATICI Formula generale C n H n Desinenza -benzene Gli idrocarburi aromatici Gli idrocarburi aromatici (areni o alchilbenzeni) sono caratterizzati
1 D-IDROCARBURI AROMATICI CHIMICA ORGANICA IDROCARBURI AROMATICI Formula generale C n H n Desinenza -benzene Gli idrocarburi aromatici Gli idrocarburi aromatici (areni o alchilbenzeni) sono caratterizzati
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Ammine : caratteristiche strutturali
 Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
Ammine : caratteristiche strutturali Le ammine sono composti formalmente derivanti dall ammoniaca in cui uno o più atomi di idrogeno sono stati sostituiti da gruppi alchilici Come per l ammonica l azoto
IDROCARBURI INSATURI: GLI ALCHENI HANNO ALMENO UN DOPPIO LEGAME NELLA STRUTTURA NOMENCLATURA: RADICE COME NEGLI IDROCARBURI, DESINENZA -ENE
 IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
IDRCARBURI INSATURI: GLI ALCENI ANN ALMEN UN DPPI LEGAME NELLA STRUTTURA NMENCLATURA: RADICE CME NEGLI IDRCARBURI, DESINENZA -ENE butano 2-butene o but-2-ene Esempi di nomenclatura degli alcheni Esempi
Sommario. 1 Materia ed energia 2. 3 Composti chimici Composizione chimica Atomi, ioni e la tavola. periodica 52
 Sommario Prefazione xii 1 Materia ed energia 2 1.1 LA MATERIA E LE SUE CLASSIFICAZIONI 4 Composizione della materia 4 Rappresentazioni della materia 10 Stati della materia 12 1.2 TRASFORMAZIONI CHIMICHE
Sommario Prefazione xii 1 Materia ed energia 2 1.1 LA MATERIA E LE SUE CLASSIFICAZIONI 4 Composizione della materia 4 Rappresentazioni della materia 10 Stati della materia 12 1.2 TRASFORMAZIONI CHIMICHE
CHIMICA ORGANICA - CLASSE 3 - RISPOSTE
 CHIMICA ORGANICA - CLASSE 3 - RISPOSTE Prof: Anna Rosa MASTELLARI. Specializzazione di CHIMICA Testo: CHIMICA ORGANICA, BIORGANICA E LABORATORIO ALCANI E CICLOALCANI (Capitolo 2) 1. Assegnare la nomenclatura
CHIMICA ORGANICA - CLASSE 3 - RISPOSTE Prof: Anna Rosa MASTELLARI. Specializzazione di CHIMICA Testo: CHIMICA ORGANICA, BIORGANICA E LABORATORIO ALCANI E CICLOALCANI (Capitolo 2) 1. Assegnare la nomenclatura
CARBOIDRATI SEMPLICI
 CARBOIDRATI Dal greco glucos =dolce Glucidi Zuccheri Sostanze formate acqua e carbonio Hanno forma molecolare (CH₂O)n 1 CARBOIDRATI SEMPLICI Monosaccaridi, una sola unità di poliidrossi aldeide o di poliidrossi
CARBOIDRATI Dal greco glucos =dolce Glucidi Zuccheri Sostanze formate acqua e carbonio Hanno forma molecolare (CH₂O)n 1 CARBOIDRATI SEMPLICI Monosaccaridi, una sola unità di poliidrossi aldeide o di poliidrossi
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
Problemi 1 PROPEDEUTICITÀ
 Problemi 1 PROPEDEUTICITÀ Da manifesto degli studi del corso per sostenere l esame di Chimica Biologica bisogna aver superato: Citologia e Istologia Chimica Organica (Chimica generale) Non vale questa
Problemi 1 PROPEDEUTICITÀ Da manifesto degli studi del corso per sostenere l esame di Chimica Biologica bisogna aver superato: Citologia e Istologia Chimica Organica (Chimica generale) Non vale questa
IDROCARBURI ALIFATICI
 CHIMICA ORGANICA (Lezioni in classe prof. Adriano Muschiato) Nel 1828 il chimico tedesco Friedrich Wöhler per la prima volta riesce a sintetizzare da reagenti inorganici l UREA: Nel sud della Germania
CHIMICA ORGANICA (Lezioni in classe prof. Adriano Muschiato) Nel 1828 il chimico tedesco Friedrich Wöhler per la prima volta riesce a sintetizzare da reagenti inorganici l UREA: Nel sud della Germania
REAZIONI DEGLI ALCHENI
 REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
REAZIONI DEGLI ALCHENI La reazione caratteristica degli alcheni è l addizione al C=C Idroalogenazione Idratazione (acido-catalizzata) Alogenazione Ossidrilazione (ossidazione) Idrogenazione (riduzione)
LIPIDI. I lipidi sono suddivisi in due gruppi principali.
 LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
Reazioni Stereospecifiche e Stereoselettive
 Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Reazioni Stereospecifiche e Stereoselettive La stereospecificità in chimica è la proprietà di una stessa reazione di generare stereoisomeri diversi partendo da stereoisomeri diversi. Si differenzia dalla
Idrocarburi insaturi. Alcheni
 Idrocarburi insaturi Alcheni Idrocarburi insaturi Un idrocarburo si dice insaturo quando possiede un numero di atomi di idrogeno minore al numero massimo possibile per un dato numero di atomi di carbonio.
Idrocarburi insaturi Alcheni Idrocarburi insaturi Un idrocarburo si dice insaturo quando possiede un numero di atomi di idrogeno minore al numero massimo possibile per un dato numero di atomi di carbonio.
Idrocarburi aromatici. Idrocarburi. Idrocarburi
 Lezioni di himica Generale Elementi chimica organica Prof. Roberto Sebastiano Idrocarburi 1 Molecole costituite solo da atomi di carbonio e idrogeno Idrocarburi alifatici Idrocarburi saturi, solo legami
Lezioni di himica Generale Elementi chimica organica Prof. Roberto Sebastiano Idrocarburi 1 Molecole costituite solo da atomi di carbonio e idrogeno Idrocarburi alifatici Idrocarburi saturi, solo legami
APPENDICE I. Proprietà critiche, fattori acentrici e costanti di Rackett di alcune sostanze. ω Z RA. Pc atm. Sostanza Formula Tc C.
 APPENDICE I Proprietà critiche, fattori acentrici e costanti di ackett di alcune sostanze Sostanza Formula Tc C Pc atm Vc cm 3 /mol ω Z A Normal paraffine Metano CH4-82.6 45.30 99 0.011 0.2892 Etano C2H6
APPENDICE I Proprietà critiche, fattori acentrici e costanti di ackett di alcune sostanze Sostanza Formula Tc C Pc atm Vc cm 3 /mol ω Z A Normal paraffine Metano CH4-82.6 45.30 99 0.011 0.2892 Etano C2H6
