MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA
|
|
|
- Muzio Murgia
- 8 anni fa
- Visualizzazioni
Transcript
1 MURST - PROVA AMMISSIONE 2000 CL IN MEDICINA E CHIRURGIA PROVA DI AMMISSIONE AL CORSO DI LAUREA IN MEDICINA E CHIRURGIA 21) La legge di Henry, che stabilisce una relazione tra pressione gassosa e solubilità dei gas nei liquidi, è una legge ideale, che viene seguita abbastanza esattamente solo dai gas di bassa solubilità; i gas molto solubili presentano invece notevoli deviazioni dalla legge, deviazioni che peraltro tendono a diminuire al crescere della temperatura. Quale delle seguenti affermazioni può essere dedotta dalla lettura del brano? A) Un gas poco solubile in un liquido presenta notevoli deviazioni dalla legge di Henry B) La solubilità dei gas nei liquidi cresce al crescere della temperatura C) Quanto più il gas è solubile nel liquido, tanto maggiori sono le deviazioni dalla legge di Henry D) Quanto più è bassa la temperatura, tanto più basse sono le deviazioni dalla legge di Henry E) La legge di Herny è in realtà un enunciato dell equazione di stato dei gas ideali La risposta corretta è la C. 22) Gli idrossidi sono composti ionici, che contengono OH - non solo in soluzione ma già allo stato cristallino; la dissoluzione determina il distacco del catione dallo ione OH - ; nella soluzione acquosa di un idrossido metallico esistono quindi ioni metallici, ed è invariabilmente presente l ossidrile, che costituisce la vera base, cioè la sostanza capace di legare un protone con formazione di acqua. Quale delle seguenti affermazioni NON può essere dedotta dalla lettura del brano? A) Lo ione ossidrile in soluzione acquosa si comporta da base B) Gli idrossidi metallici sono formati da ioni già allo stato solido C) La soluzione acquosa di un idrossido metallico non contiene ioni H 3 O + D) La soluzione acquosa di un idrossido metallico è basica per la presenza dello ione ossidrile E) All atto della dissoluzione in acqua di un idrossido metallico gli ioni del metallo si distaccano dagli ioni ossidrile La risposta corretta è la C. 23) L acetil coenzima A, derivato dal glucosio 6-fosfato tramite la glicolisi e la successiva decarbossilazione ossidativa del piruvato, entra nel ciclo dell acido citrico per essere ossidato; il trasporto di elettroni e la fosforilazione ossidativa conseguenti allo svolgersi del ciclo dell acido citrico producono energia sotto forma di ATP; anche gli acidi grassi prodotti dall idrolisi dei trigliceridi producono acetil-coenzima A. Quale delle seguenti affermazioni NON può essere dedotta dalla lettura del brano? A) Nel ciclo dell acido citrico si realizza l ossidazione dell acetil-coenzima A B) I trigliceridi vengono ossidati ad acidi grassi con formazione di ATP C) L acetil-coenzima A deriva tanto dalla glicolisi che dall ossidazione degli acidi grassi D) La decarbossilazione ossidativa del piruvato non è l unica via metabolica capace di formare acetil-coenzima A E) Durante lo svolgersi del ciclo dell acido citrico si ha formazione di ATP La risposta corretta è la B.
2 24) Quale delle seguenti caratteristiche è comune al benzene e all etene? A) La scarsa reattività B) La struttura tetraedrica C) La capacità di dare facilmente reazioni di addizione D) Ibridazione sp 2 E) Ibridazione sp Per ibridazione degli orbitali si intende la combinazione di orbitali atomici s e p per dare nuovi orbitali ibridi con proprietà ( energia, direzione, ) diverse da quelli di partenza. Dalla combinazione di un orbitale s e due orbitali p si ottengono tre orbitali ibridi equivalenti sp 2. Questi orbitali puntano verso i vertici di un triangolo equilatero e formano tra di loro angoli di 120. L ibridazione sp 2 è caratteristica degli atomi di carbonio che formano doppi legami. L etene (C 2 H 4 ) è un alchene: idrocarburi caratterizzati dalla presenza di un doppio legame carboniocarbonio. Le reazioni caratteristiche di questi composti sono le reazioni di addizione. L etene è una molecola piana e gli angoli di legame -C-C- sono di 121, mentre quelli del legame H-C- sono di 118. Tale struttura è spiegata adeguatamente da un ibridazione di tipo sp 2. Il benzene (C 6 H 6 ) è il capostipite dei composti aromatici: composti caratterizzati dalla tendenza a dare reazioni di sostituzione, come i composti saturi; piuttosto che reazioni di addizione tipiche dei composti insaturi. Il fatto che gli angoli di legame tra gli atomi di carbonio nell anello benzenico siano a 120 suggerisce che gli atomi di carbonio abbiano un ibridazione sp 2. La risposta corretta è quindi la D. 25) Quale dei seguenti composti possiede nella molecola più atomi di ossigeno? A) Glicole B) Alcool terziario monofunzionale C) Alcool primario monofunzionale D) Dialdeide E) Diidrossichetone I glicoli sono composti contenenti due ossidrili alcolici (-OH), sono detti anche dioli. Gli alcoli monofunzionali, terziari o primari, sono caratterizzati dalla presenza di un solo ossidrile OH. Le dialdeidi sono composti caratterizzati da due gruppi carbonilici (C=O). I diidrossichetoni sono composti che presentano un carbonio carbonilico e due ossidrili alcolici. La risposta esatta è quindi la E. 27) Solo una delle seguenti affermazioni è errata: quale? A) Lo ione fluoruro è la base coniugata di HF B) HCOOH è l acido coniugato della base formiato C) Lo ione solfato è la base coniugata dell acido solforico D) Lo ione carbonato è la base coniugata dello ione idrogeno carbonato E) L acqua è la base coniugata dello ione idronio Si consideri una reazione tra un acido ed una base: HA + B A - + BH + Acido1 base2 base1 acido2 Nella reazione HA/ A - costituiscono una coppia coniugata acido-base in cui HA è l acido e A - è la sua base coniugata. B/ BH + sono una coppia coniugata acido-base in cui B è la base e BH + il suo acido coniugato. Alla luce di quanto detto analizziamo le risposte: 1
3 HF/F - ; HCOOH/HCOO - ; HCO 3 - / CO 3 2- ; H 2 O/OH - sono tutte coppie coniugate acido-base, quindi corrette. L associazione proposta in C, invece, è errata perché lo ione solfato è la base coniugata dello ione idrogeno solfato e non dell acido solforico. L a risposta da selezionare è quindi la C. 28) Quale delle seguenti sostanze è un omopolimero (cioè formato da monomeri uguali tra loro)? A) DNA B) Glicogeno C) Emoglobina D) RNA E) Albumina Polimeri= molecole costituite dall unione di un gran numero di unità semplici dette monomeri. Se tutti i monomeri sono uguali si ha un omopolimero; se sono diversi si ha un eteropolimero. Il DNA e l RNA sono eteropolimeri in quanto costituiti da nucleotidi che differiscono tra loro a seconda della base azotata che contengono. L albumina e l emoglobina sono eteropolimeri in quanto costituiti da amminoacidi diversi. Il glicogeno, invece, è un omopolimero in quanto formato da unità di glucosio. La risposta corretta è quindi la B 29) Il legame covalente è polarizzato quando: A) Si stabilisce tra atomi uguali B) Richiede la compartecipazione di due coppie elettroniche C) Si stabilisce tra atomi con differente elettronegatività D) Richiede la compartecipazione di tre coppie elettroniche E) Si stabilisce tra ioni Il legame covalente è quello che si ottiene per COMPARTECIPAZIONE di elettroni tra atomi che presentano un orbitale spaiato. Se tale compartecipazione di elettroni avviene tra atomi uguali, gli elettroni saranno equamente distribuiti tra i due atomi. Qualora, invece, avvenga tra atomi con diversa capacità di acquistare elettroni ( cioè con diversa elettronegatività), la coppia elettronica, nel tempo, risulterà maggiormente spostata verso l atomo più elettronegativo. In tal modo il centro delle cariche positive differirà dal centro della cariche negative. In questo caso il legame covalente si dice polarizzato. La risposta esatta è quindi la C 30) Il valore massimo del numero di ossidazione del cloro è: A) +1 B) -1 C) 0 D) +7 E) +3 Per numero di ossidazione si intende l ipotetica carica che l atomo assumerebbe se gli elettroni di valenza fossero tutti attribuiti all atomo più elettronegativo. Per elettronegatività si intende la capacità di un atomo di acquistare elettroni. 2
4 Per il cloro il numero di ossidazione varia a seconda della molecola che esaminiamo. Consideriamo diversi composti: HCl; Cl 2 ; HClO; HClO 2 ; HClO 3 ; HClO 4 Per attribuire il numero di ossidazione bisogna seguire alcune regole: a) la somma algebrica dei numeri di ossidazione in una molecola è pari a zero; b) il numero di ossidazione di un elemento non combinato è uguale a zero; c) l idrogeno in genere ha un numero di ossidazione pari a +1 d) L ossigeno, in genere, ha un numero di ossidazione pari a -2, nei perossidi -1 e) Gli elementi possono avere al massimo il numero di ossidazione pari al gruppo di appartenenza. Nei composti esaminati, quindi, nell ordine, in numero di ossidazione del cloro sarà: -1; 0; +1; +3; +5; +7 Il cloro si trova al settimo gruppo della tavola periodica, e quindi avrà 7 come massimo numero di ossidazione. La risposta esatta è perciò la D 31) Il cicloesano: A) Presenta carattere aromatico B) E costituito da 6 atomi di C e 6 atomi di H C) Ha struttura non planare D) Possiede atomi di C ibridati sp E) Dà facilmente reazioni di addizione Il cicloesano è un idrocarburo ciclico con sei atomi di carbonio legati tra di loro a formare un esagono. Ogni atomo di carbonio è legato ad altri due atomi di carbonio e a due atomi di idrogeno. Tutti e quattro i legami dei vari atomi di carbonio sono sigma, avendo essi ibridizzazione sp 3. Questo comporta l esclusione della risposta B e della D. L aromaticità (A) è esclusa dal fatto che tutti e quattro i legami sono covalenti, senza elettroni delocalizzati. Non avendo doppi legami possiamo escludere reazioni di addizione (E) e quindi l unica risposta corretta e la C, visto che l ibridazione sp 3 porta ogni carbonio al centro di un tetraedro in cui i vertici sono rappresentati dai quattro legami. Infatti la struttura spaziale del cicloesano può essere rappresentata come una sedia o come una barca; quest ultima e una struttura meno stabile rispetto alla prima. 32) L acetone e il propanale: A) Sono antipodi ottici B) Hanno entrambi forte carattere acido C) Hanno entrambi forte carattere basico D) Possiedono entrambi un gruppo carbonilico E) Sono epimeri L acetone è un chetone (dimetilchetone), mentre il propanale e un aldeide. Caratteristica delle aldeidi e dei chetoni è quella di avere un gruppo carbonilico (carbonio e ossigeno uniti da un doppio legame), altamente reattivo perché polarizzato. La risposta D è quindi quella corretta. Per quanto concerne le risposte A e E, ci troveremmo di fronte ad un tipo di isomeria che con questi composti non può avvenire (presenza di un doppio legame del carbonile) mentre nelle risposte B e C non sono corrette in quanto le due molecole non hanno né un netto carattere acido né un netto carattere basico. 33) Un atomo di Carbonio viene definito secondario quando: A) E il secondo di una catena carboniosa B) E legato ad altri due atomi di carbonio 3
5 C) E ibridato sp 2 D) Fa parte della molecola di una ammina secondaria E) Presenta due valenze invece di quattro Il carbonio può formare quattro legami, e nel metano, per esempio, esso è legato a quattro atomi di idrogeno. Se un atomo di carbonio prende il posto di un idrogeno, diciamo che il carbonio centrale ha un sostituente, ed è un carbonio primario. Se invece gli idrogeni sostituiti sono due, il carbonio diventa bisostituito, essendo legato a due idrogeni e a due atomi di carbonio; in questo caso possiamo parlare di Carbonio secondario, e quindi la risposta corretta è la B. Se consideriamo la risposta A, dobbiamo tenere presente che il secondo carbonio di una catena carboniosa può essere secondario, terziario o quaternario; dipende da quali sono i suoi sostituenti. L ibridazione sp2 non ci fornisce notizie sui sostituenti ma solo sul fatto che esiste un doppio legame. Le risposte D ed E sono completamente errate, poiché non forniscono dati sui sostituenti. 34) L attività ottica è dovuta alla presenza nella molecola di: A) Almeno un atomo di C asimmetrico B) Un doppio legame C) Due gruppi funzionali diversi D) Un triplo legame E) Una struttura ciclica L attività ottica è una proprietà di alcune sostanze di far ruotare la luce polarizzata, cioè emessa in un solo piano, quando immessa in un polarimetro. Un esempio di attività ottica può essere fatto con gli enantiomeri, composti che hanno la stessa formula bruta ma diversa disposizione degli atomi nello spazio; essi sono uno l immagine speculare dell altro, ma le due molecole non sono sovrapponibili. Per avere un fenomeno del genere bisogna assolutamente che almeno un atomo di carbonio abbia quattro sostituenti diversi. Un carbonio che ha legati quattro gruppi diversi lo si chiama chirale o asimmetrico ; la risposta corretta e quindi la A. Se consideriamo la risposta B e D, la presenza di un doppio legame porta ad avere due o tre legami con lo stesso atomo, e quindi non e rispettata la asimmetria. Così anche la risposta C, che non ci indica se gli altri due sostituenti sono uguali o diversi. La struttura ciclica (E) normalmente indica almeno due legami con atomi uguali. 35) Quale dei seguenti metodi può funzionare, nell equilibrio tra sostanze gassose A + B C + D, per ridurre la quantità del prodotto C? A) Aggiungere A B) Diminuire A C) Aggiungere B D) Aumentare la pressione E) Diminuire la pressione Per rispondere a questa domanda dobbiamo fare riferimento al principio di Le Chatelier: In ogni sistema in equilibrio chimico l alterazione di uno dei fattori dell equilibrio fa spostare lo stesso in condizioni tali da tendere a restaurare le condizioni iniziali. Praticamente questo principio ci dice che se una reazione e all equilibrio, se c è qualcosa che tende a perturbarlo esso risponde facendo variare le velocità di reazione, diretta e inversa. In questo caso per poter ridurre la quantità del prodotto C dobbiamo o aumentare la concentrazione del prodotto D, o diminuire la concentrazione dei reagenti A e B. Tra le risposte quindi l unica corretta e la B. Se consideriamo la risposta A e C, avremmo un aumento della concentrazione dei prodotti, mentre una variazione della pressione 4
6 (risposte D e E) non sortisce alcun effetto sull equilibrio visto che sia i reagenti che i prodotti sono in fase gassosa. Per le reazioni in cui compaiono specie allo stato gassoso, se la reazione decorre con diminuzione del numero di molecole, la formazione del prodotto sarà favorita da un aumento della pressione. Se la reazione, invece, decorre con un aumento del numero di molecole, la reazione diretta sarà favorita da una diminuzione della pressione. 36) Il numero di massa di un atomo è 27; il numero atomico è 13; i neutroni contenuti nel nucleo sono: A) 20 B) 13 C) 8 D) 14 E) 40 Il numero di massa rappresenta la somma del numero di protoni più il numero dei neutroni. Il numero atomico corrisponde al numero di protoni, che in un atomo neutro coincide con il numero degli elettroni. Se il numero di massa di questo atomo è 13, vorrà dire che esso contiene 13 protoni. Essendo il numero di massa uguale a 27, vorrà dire che il numero dei neutroni sarà uguale al numero di massa meno il numero atomico, e cioè = 14. La risposta corretta è quindi la D. 37) La differenza tra gli isotopi 18 e 16 dell ossigeno consiste nel fatto che: A) Il primo possiede due protoni in più B) Il primo possiede due protoni in meno C) Il primo possiede due neutroni in più D) Il secondo possiede due neutroni in più E) Il primo possiede due elettroni in più Il numero di massa rappresenta la somma del numero di protoni più il numero dei neutroni. Il numero atomico corrisponde al numero di protoni, che in un atomo neutro coincide con il numero degli elettroni. L isotopo si differenzia da un elemento per aver stesso numero atomico ma diverso numero di massa, cioè per avere un diverso numero di neutroni. Gli isotopi 18 e 16 dell ossigeno, quindi, differiranno nel numero dei neutroni, avendone il primo due di più. La risposta esatta è quindi la C. Le altre risposte non sono corrette perché fanno variare protoni ed elettroni, mentre nella risposta D e contemplato un numero di neutroni in più per il secondo isotopo. 38) Il numero di ossidazione dell ossigeno nell acqua ossigenata (H 2 O 2 ) è: A) -2 B) 0 C) -1 D) +1/2 E) 1/2 Il numero di ossidazione di un elemento o di un composto rappresenta, idealmente, la carica elettrica che esso verrebbe ad acquistare se i legami del composto fossero tutti ionizzati. L ossigeno nella maggior parte dei composti ha numero di ossidazione -2, tranne negli ossidi di fluoro in cui perde i suoi elettroni e nei perossidi; nel perossido di idrogeno (acqua ossigenata), ogni 5
7 ossigeno è legato ad un altro ossigeno e ad un idrogeno (H-O-O-H). Nel calcolo del numero di ossidazione dobbiamo ionizzare il legame O-H e quindi l ossigeno avrà numero di ossidazione -1 (risposta C). Le risposte D e E indicano un numero di ossidazione non esistente, mentre la risposta A indica il numero di ossidazione dell ossigeno in tutte le altre molecole. La risposta B indica il numero di ossidazione di un elemento allo stato fondamentale. 39) In genere un composto inorganico a carattere riducente contiene: A) Numerosi atomi di ossigeno B) Uno o più elementi a numero di ossidazione piuttosto elevato C) Uno o più elementi a numero di ossidazione piuttosto basso D) Carattere acido E) Carattere basico In una reazione di ossidoriduzione, ci devono essere due elementi, uno che si ossida e uno che si riduce ed il numero di elettroni scambiati in una reazione deve essere uguale a quelli scambiati nell altra. Un elemento che si riduce vuol dire che diminuisce il suo numero di ossidazione acquistando elettroni, che vengono ceduti dall altro elemento che si ossida, perdendoli. L elemento che si ossida, quindi, perdendo elettroni sarà l elemento riducente dell altro, che acquistando elettroni si riduce. Un buon agente riducente quindi deve essere un elemento che tende facilmente ad ossidarsi, e quindi deve avere un numero di ossidazione piuttosto basso (risposta C). Se l elemento ha numero di ossidazione alto (risposta B), esso tenderà a perdere elettroni e quindi a ridursi, diventando l agente ossidante. Il carattere acido o basico di un elemento (risposte D e E) non coinvolge il potere redox di esso. 40) Il numero massimo di elettroni che può essere contenuto in totale nei primi 3 livelli elettronici è: A) 18 B) 28 C) 10 D) 30 E) 26 I livelli energetici sono indicati dal primo numero quantico, n, che ci indica l energia dell orbitale. Per n = 3, avremo che il secondo numero quantico, l, il quale indica la forma dell orbitale, potrà avere valori di 0, 1 e 2. Per l=0 avremo orbitali di tipo s, per l=1 avremo orbitali di tipo p mentre per l=2 avremo orbitali di tipo d. Il numero massimo di elettroni contenuti quindi è: Nel primo livello solo orbitali s quindi 2 elettroni; Nel secondo livello orbitali s e p quindi = 8 elettroni Nel terzo livello orbitali s, p e d quindi = 18 elettroni In totale avremo = 28 elettroni, risposta B. 6
GIOCHI DELLA CHIMICA
 GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
GIOCHI DELLA CHIMICA FASE D ISTITUTO (TRIENNIO) 21 marzo 2016 La prova è costituita da 50 quesiti. ALUNNO CLASSE Scrivi la risposta a ciascuna domanda nel foglio risposte allegato. 1. Quale dei seguenti
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Acidi e basi. HCl H + + Cl - (acido cloridrico) NaOH Na + + OH - (idrossido di sodio; soda caustica)
 Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
Acidi e basi Per capire che cosa sono un acido e una base dal punto di vista chimico, bisogna riferirsi ad alcune proprietà chimiche dell'acqua. L'acqua, sia solida (ghiaccio), liquida o gassosa (vapore
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
isomeria di struttura isomeria di posizione isomeria di catena stereoisomeria isomeria di conformazione isomeria di configurazione 'isomeria ottica
 ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
Trasformazioni materia
 REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
REAZIONI CHIMICHE Trasformazioni materia Trasformazioni fisiche (reversibili) Trasformazioni chimiche (irreversibili) È una trasformazione che non produce nuove sostanze È una trasformazione che produce
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI Idrocarburi ciclici contenenti un sistema di elettroni delocalizzati su tutto il perimetro dell anello BENZENE C 6 H 6 sp 2 angoli 120 coplanarità struttura simmetrica ad esagono
IDROCARBURI AROMATICI Idrocarburi ciclici contenenti un sistema di elettroni delocalizzati su tutto il perimetro dell anello BENZENE C 6 H 6 sp 2 angoli 120 coplanarità struttura simmetrica ad esagono
Capitolo 7. Le soluzioni
 Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Capitolo 7 Le soluzioni Come visto prima, mescolando tra loro sostanze pure esse danno origine a miscele di sostanze o semplicemente miscele. Una miscela può essere omogenea ( detta anche soluzione) o
Dalla Chimica Generale
 RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]
![Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ] Cosa misura il ph: la concentrazione di ioni H +, che si scrive [H + ]. La definizione di ph è: ph = -log 10 [H + ]](/thumbs/34/16945364.jpg) La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
La molecola d acqua è un dipolo perché l atomo di ossigeno è molto elettronegativo ed attira più vicini a sé gli elettroni di legame. Questo, unito alla forma della molecola, produce un accumulo di carica
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY
 DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
DEFINIZIONE ACIDO/BASE SECONDO BRONSTED-LOWRY Una reazione acido/base coinvolge un trasferimento di protone: l'acido è il donatore di protone e la base è l'accettore del protone. Questa definizione spiega
CHIMICA ORGANICA. Gli alcoli
 1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
1 E1-ALCOLI CIMICA OGANICA ALCOLI Formula generale Desinenza -olo Gli alcoli Gli alcoli sono, dopo gli idrocarburi, i composti organici più comuni, che è possibile considerare come derivati dagli alcani
Equilibri di precipitazione
 Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Equilibri di precipitazione Molte sostanze solide sono caratterizzate da una scarsa solubilità in acqua (ad es. tutti i carbonati e gli idrossidi degli elementi del II gruppo) AgCl (a differenza di NaCl)
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Organic Chemistry. 4 th Edition Paula Yurkanis Bruice. Delocalizzazione degli elettroni e risonanza
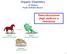 Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05
 I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
I TEST DI CHIMICA - INGEGNERIA DELL INFORMAZIONE AA 04/05 COGNOME E NOME: 1. Br 1 si è trasformato in Br +3 in una reazione in cui lo ione bromuro: A) ha acquistato 3 elettroni B) ha ceduto 4 elettroni
Le Biomolecole I parte. Lezioni d'autore di Giorgio Benedetti
 Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Le Biomolecole I parte Lezioni d'autore di Giorgio Benedetti LE BIOMOLECOLE Le biomolecole, presenti in tutti gli esseri viventi, sono molecole composte principalmente da carbonio, idrogeno, azoto e ossigeno.
Chimica. Ingegneria Meccanica, Elettrica e Civile Simulazione d'esame
 Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
Viene qui riportata la prova scritta di simulazione dell'esame di Chimica (per meccanici, elettrici e civili) proposta agli studenti alla fine di ogni tutoraggio di Chimica. Si allega inoltre un estratto
CO 2 aq l anidride carbonica disciolta, reagendo con l'acqua, forma acido carbonico secondo la reazione:
 DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
DUREZZA DELLE ACQUE. Quando si parla di durezza di un acqua ci si riferisce fondamentalmente alla quantità di ioni calcio e di ioni magnesio disciolti in un certo volume di tale acqua. Ad eccezione delle
PROVA STRUTTURATA DI CHIMICA ORGANICA
 1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
1. Una delle seguenti definizioni di gruppo funzionale è errata. Quale? "In chimica organica, i gruppi funzionali sono gruppi di atomi presenti in ogni molecola A. dai quali dipendono le caratteristiche
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici
 I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
I composti organici della vita: carboidrati, lipidi, proteine e acidi nucleici La seta della tela di ragno è un insieme di macromolecole, dette proteine. Sono le caratteristiche fisico-chimiche di queste
10) Se ad una soluzione aumentiamo la temperatura cosa succede? Dire quale delle seguenti affermazioni è corretta.
 Associazione di Promozione Sociale Lesina (FG) Cognome e Nome Sede: Via Principe di Piemonte, 93-71010 - Lesina (FG) - C.F. 93034730718 Tel. 0882.992808 E-mail: mail@antoniotucci.net - www.agora.lesina.org
Associazione di Promozione Sociale Lesina (FG) Cognome e Nome Sede: Via Principe di Piemonte, 93-71010 - Lesina (FG) - C.F. 93034730718 Tel. 0882.992808 E-mail: mail@antoniotucci.net - www.agora.lesina.org
MPT Capitolo 12 Redox. Le ossidoriduzioni. Obiettivo. Definizioni di ossidazione e di riduzione
 1 Le ossidoriduzioni Obiettivo In questo capitolo svilupperemo i concetti fondamentali delle reazioni di ossido-riduzione. Si tratta di conoscenze fondamentali sia per la vita comune, sia, per molti di
1 Le ossidoriduzioni Obiettivo In questo capitolo svilupperemo i concetti fondamentali delle reazioni di ossido-riduzione. Si tratta di conoscenze fondamentali sia per la vita comune, sia, per molti di
Dissociazione elettrolitica
 Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
Dissociazione elettrolitica Le sostanze ioniche si solubilizzano liberando ioni in soluzione. La dissociazione elettrolitica è il processo con cui un solvente separa ioni di carica opposta e si lega ad
ENERGIA NELLE REAZIONI CHIMICHE
 ENERGIA NELLE REAZIONI CHIMICHE Nelle trasformazioni chimiche e fisiche della materia avvengono modifiche nelle interazioni tra le particelle che comportano sempre variazioni di energia "C è un fatto,
ENERGIA NELLE REAZIONI CHIMICHE Nelle trasformazioni chimiche e fisiche della materia avvengono modifiche nelle interazioni tra le particelle che comportano sempre variazioni di energia "C è un fatto,
STEREOISOMERIA carbonio ibridizzato sp3 è legato a quattro atomi o gruppi tutti diversi fra loro
 STEREOISOMERIA i sono oggetti che sono sovrapponibili alla loro immagine speculare: tutti gli oggetti di forma piana, ad esempio. osì, se prendo un alchene e lo confronto con la sua immagine allo specchio:
STEREOISOMERIA i sono oggetti che sono sovrapponibili alla loro immagine speculare: tutti gli oggetti di forma piana, ad esempio. osì, se prendo un alchene e lo confronto con la sua immagine allo specchio:
Dipendenza della Solubilità dalla temperatura
 SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
SOLUBILIZZAZIONE Simile scioglie il simile: le molecole di sostanze diverse si mescolano intimamente nelle miscele se possiedono forze intermolecolari simili (soluzioni ideali). Anche se le forze intermolecolari
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
Poniamo il carbonio al centro, tre idrogeni sono legati al carbonio direttamente e uno attraverso l ossigeno
 Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività
 LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
La Vita è una Reazione Chimica
 La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
La Vita è una Reazione Chimica Acqua Oro Zucchero Il numero atomico, il numero di massa e gli isotopi numero atomico (Z) = numero di protoni nel nucleo numero di massa (A) = numero di protoni + numero
Appunti di Chimica Le reazioni chimiche reattività reazione chimica equazione chimica bilanciare
 Appunti di Chimica Le reazioni chimiche Premesse... 1 Tipi di reazioni chimiche... 2 Reazioni di ossido-riduzione... 2 Reazioni di formazione... 2 Numero di ossidazione nei composti binari di tipo salino...
Appunti di Chimica Le reazioni chimiche Premesse... 1 Tipi di reazioni chimiche... 2 Reazioni di ossido-riduzione... 2 Reazioni di formazione... 2 Numero di ossidazione nei composti binari di tipo salino...
RICHIAMI DI TERMOCHIMICA
 CAPITOLO 5 RICHIAMI DI TERMOCHIMICA ARIA TEORICA DI COMBUSTIONE Una reazione di combustione risulta completa se il combustibile ha ossigeno sufficiente per ossidarsi completamente. Si ha combustione completa
CAPITOLO 5 RICHIAMI DI TERMOCHIMICA ARIA TEORICA DI COMBUSTIONE Una reazione di combustione risulta completa se il combustibile ha ossigeno sufficiente per ossidarsi completamente. Si ha combustione completa
a 25 C da cui si ricava che:
 Equilibrio di autoionizzazione dell acqua Come già osservato l acqua presenta caratteristiche anfotere, potendosi comportare tanto da acido (con una sostanza meno acida che si comporta da base) quanto
Equilibrio di autoionizzazione dell acqua Come già osservato l acqua presenta caratteristiche anfotere, potendosi comportare tanto da acido (con una sostanza meno acida che si comporta da base) quanto
Termodinamica. Sistema termodinamico. Piano di Clapeyron. Sistema termodinamico. Esempio. Cosa è la termodinamica? TERMODINAMICA
 Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
Termodinamica TERMODINAMICA Cosa è la termodinamica? La termodinamica studia la conversione del calore in lavoro meccanico Prof Crosetto Silvio 2 Prof Crosetto Silvio Il motore dell automobile trasforma
DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto:
 Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
Richiami di Chimica DENSITA La densità è una grandezza fisica che indica la massa, di una sostanza o di un corpo, contenuta nell unità di volume; è data dal rapporto: d = massa / volume unità di misura
LE FUNZIONI A DUE VARIABILI
 Capitolo I LE FUNZIONI A DUE VARIABILI In questo primo capitolo introduciamo alcune definizioni di base delle funzioni reali a due variabili reali. Nel seguito R denoterà l insieme dei numeri reali mentre
Capitolo I LE FUNZIONI A DUE VARIABILI In questo primo capitolo introduciamo alcune definizioni di base delle funzioni reali a due variabili reali. Nel seguito R denoterà l insieme dei numeri reali mentre
IDROCARBURI AROMATICI. Scaricato da Sunhope.it
 IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
IDROCARBURI AROMATICI BENZENE E il capostipite degli idrocarburi aromatici. Osservazioni sperimentali: Formula bruta C 6 6 elevato grado di insaturazione (4) I 6 atomi di C sono legati a formare un anello
Prova di ammissione al corso di laurea in Medicina e Chirurgia 2013
 Francesco Ranaldi Chimica organica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni
Francesco Ranaldi Chimica organica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni
Definiamo Entalpia la funzione: DH = DU + PDV. Variando lo stato del sistema possiamo misurare la variazione di entalpia: DU = Q - PDV.
 Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
Problemi Una mole di molecole di gas ideale a 292 K e 3 atm si espandono da 8 a 20 L e a una pressione finale di 1,20 atm seguendo 2 percorsi differenti. Il percorso A è un espansione isotermica e reversibile;
LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI PROTEINE. sono ACIDI NUCLEICI. molecole complesse = POLIMERI. formate dall'unione di
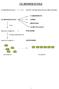 LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
LE BIOMOLECOLE LE BIOMOLECOLE DETTE ANCHE MOLECOLE ORGANICHE; CARBOIDRATI LE BIOMOLECOLE sono LIPIDI PROTEINE ACIDI NUCLEICI molecole complesse = POLIMERI formate dall'unione di molecole semplici = MONOMERI
Simulazione test di ingresso Ingegneria Industriale Viterbo. Quesiti di Logica, Chimica e Fisica. Logica
 Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come si conclude questa serie di numeri? 9, 16, 25, 36,... A) 47 B) 49 C) 48 D) 45 L2 - Quale
Simulazione test di ingresso Ingegneria Industriale Viterbo Quesiti di Logica, Chimica e Fisica Logica L1 - Come si conclude questa serie di numeri? 9, 16, 25, 36,... A) 47 B) 49 C) 48 D) 45 L2 - Quale
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG 27/4/2006 Cuore come dipolo elettrico Il cuore considerato come un generatore elettrico complesso, in cui sono presenti
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG 27/4/2006 Cuore come dipolo elettrico Il cuore considerato come un generatore elettrico complesso, in cui sono presenti
LABORATORIO DI CHIMICA GENERALE E INORGANICA
 UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
UNIVERSITA DEGLI STUDI DI MILANO Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea Triennale in Chimica CORSO DI: LABORATORIO DI CHIMICA GENERALE E INORGANICA Docente: Dr. Alessandro Caselli
Elettricità e magnetismo
 E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
E1 Cos'è l'elettricità La carica elettrica è una proprietà delle particelle elementari (protoni e elettroni) che formano l'atomo. I protoni hanno carica elettrica positiva. Gli elettroni hanno carica elettrica
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca
 INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
INTERVENTO DI CLAUDIA RICCARDI PLASMAPROMETEO - Dipartimento di Fisica Università degli Studi di Milano - Bicocca La ricerca come strumento per lo sviluppo aziendale: sinergia tra università e industria
V= R*I. LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro.
 LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
LEGGE DI OHM Dopo aver illustrato le principali grandezze elettriche è necessario analizzare i legami che vi sono tra di loro. PREMESSA: Anche intuitivamente dovrebbe a questo punto essere ormai chiaro
Perché il logaritmo è così importante?
 Esempio 1. Perché il logaritmo è così importante? (concentrazione di ioni di idrogeno in una soluzione, il ph) Un sistema solido o liquido, costituito da due o più componenti, (sale disciolto nell'acqua),
Esempio 1. Perché il logaritmo è così importante? (concentrazione di ioni di idrogeno in una soluzione, il ph) Un sistema solido o liquido, costituito da due o più componenti, (sale disciolto nell'acqua),
... corso di chimica elettrochimica 1
 ... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
... corso di chimica elettrochimica 1 CONTENUTI reazioni elettrochimiche pile e celle elettrolitiche potenziale d elettrodo e forza elettromotrice equazione di Nernst elettrolisi leggi di Faraday batterie
Formule di Struttura delle Molecole Organiche
 Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
SDD - Seconde Equilibrio e ph. Equilibrio e ph. Obiettivo
 1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
1 Obiettivo Capire che cosa è il ph, apprendere le leggi fondamentali che lo controllano e capire qualitativamente le applicazioni delle soluzioni tampone. Prerequisiti Il concetto di equilibrio (che comunque
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Gli alcool, i composti carbonilici e gli acidi carbossilici
 Gli alcool, i composti carbonilici e gli acidi carbossilici Con questa unità didattica inizieremo a prendere in considerazione dei composti della chimica organica caratterizzati dal contenere oltre ai
Gli alcool, i composti carbonilici e gli acidi carbossilici Con questa unità didattica inizieremo a prendere in considerazione dei composti della chimica organica caratterizzati dal contenere oltre ai
Celle a combustibile Fuel cells (FC)
 Celle a combustibile Fuel cells (FC) Celle a combustibile Sono dispositivi di conversione elettrochimica ad alto rendimento energetico. Esse trasformano in potenza elettrica l energia chimica contenuta
Celle a combustibile Fuel cells (FC) Celle a combustibile Sono dispositivi di conversione elettrochimica ad alto rendimento energetico. Esse trasformano in potenza elettrica l energia chimica contenuta
Elettrolita forte = specie chimica che in soluzione si dissocia completamente (l equilibrio di dissociazione è completamente spostato verso destra)
 A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
A.A. 2005/2006 Laurea triennale in Chimica Esercitazioni di stechiometria - Corso di Chimica Generale ed inorganica C ARGOMENTO 6: Equilibri in soluzione: equilibri acido/base, idrolisi e tamponi (6 h)
f(x) = 1 x. Il dominio di questa funzione è il sottoinsieme proprio di R dato da
 Data una funzione reale f di variabile reale x, definita su un sottoinsieme proprio D f di R (con questo voglio dire che il dominio di f è un sottoinsieme di R che non coincide con tutto R), ci si chiede
Data una funzione reale f di variabile reale x, definita su un sottoinsieme proprio D f di R (con questo voglio dire che il dominio di f è un sottoinsieme di R che non coincide con tutto R), ci si chiede
di questi il SECONDO PRINCIPIO ΔU sistema isolato= 0
 L entropia e il secondo principio della termodinamica La maggior parte delle reazioni esotermiche risulta spontanea ma esistono numerose eccezioni. In laboratorio, ad esempio, si osserva come la dissoluzione
L entropia e il secondo principio della termodinamica La maggior parte delle reazioni esotermiche risulta spontanea ma esistono numerose eccezioni. In laboratorio, ad esempio, si osserva come la dissoluzione
CORRENTE E TENSIONE ELETTRICA LA CORRENTE ELETTRICA
 CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
CORRENTE E TENSIONE ELETTRICA La conoscenza delle grandezze elettriche fondamentali (corrente e tensione) è indispensabile per definire lo stato di un circuito elettrico. LA CORRENTE ELETTRICA DEFINIZIONE:
VSEPR Polarità Ibridizzazione
 VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
Le equazioni. Diapositive riassemblate e rielaborate da prof. Antonio Manca da materiali offerti dalla rete.
 Le equazioni Diapositive riassemblate e rielaborate da prof. Antonio Manca da materiali offerti dalla rete. Definizione e caratteristiche Chiamiamo equazione l uguaglianza tra due espressioni algebriche,
Le equazioni Diapositive riassemblate e rielaborate da prof. Antonio Manca da materiali offerti dalla rete. Definizione e caratteristiche Chiamiamo equazione l uguaglianza tra due espressioni algebriche,
Il concetto di valore medio in generale
 Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
SPC e distribuzione normale con Access
 SPC e distribuzione normale con Access In questo articolo esamineremo una applicazione Access per il calcolo e la rappresentazione grafica della distribuzione normale, collegata con tabelle di Clienti,
SPC e distribuzione normale con Access In questo articolo esamineremo una applicazione Access per il calcolo e la rappresentazione grafica della distribuzione normale, collegata con tabelle di Clienti,
1. Distribuzioni campionarie
 Università degli Studi di Basilicata Facoltà di Economia Corso di Laurea in Economia Aziendale - a.a. 2012/2013 lezioni di statistica del 3 e 6 giugno 2013 - di Massimo Cristallo - 1. Distribuzioni campionarie
Università degli Studi di Basilicata Facoltà di Economia Corso di Laurea in Economia Aziendale - a.a. 2012/2013 lezioni di statistica del 3 e 6 giugno 2013 - di Massimo Cristallo - 1. Distribuzioni campionarie
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
Slide Cerbara parte1 5. Le distribuzioni teoriche
 Slide Cerbara parte1 5 Le distribuzioni teoriche I fenomeni biologici, demografici, sociali ed economici, che sono il principale oggetto della statistica, non sono retti da leggi matematiche. Però dalle
Slide Cerbara parte1 5 Le distribuzioni teoriche I fenomeni biologici, demografici, sociali ed economici, che sono il principale oggetto della statistica, non sono retti da leggi matematiche. Però dalle
Complementi di Termologia. I parte
 Prof. Michele Giugliano (Dicembre 2) Complementi di Termologia. I parte N.. - Calorimetria. Il calore è una forma di energia, quindi la sua unità di misura, nel sistema SI, è il joule (J), tuttavia si
Prof. Michele Giugliano (Dicembre 2) Complementi di Termologia. I parte N.. - Calorimetria. Il calore è una forma di energia, quindi la sua unità di misura, nel sistema SI, è il joule (J), tuttavia si
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
LE SOLUZIONI 1.molarità
 LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
LE SOLUZIONI 1.molarità Per mole (n) si intende una quantità espressa in grammi di sostanza che contiene N particelle, N atomi di un elemento o N molecole di un composto dove N corrisponde al numero di
Siamo così arrivati all aritmetica modulare, ma anche a individuare alcuni aspetti di come funziona l aritmetica del calcolatore come vedremo.
 DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
Gas perfetti e sue variabili
 Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
Gas perfetti e sue variabili Un gas è detto perfetto quando: 1. è lontano dal punto di condensazione, e quindi è molto rarefatto 2. su di esso non agiscono forze esterne 3. gli urti tra le molecole del
Il magnetismo nella materia
 Le orbite degli elettroni in atomo di idrogeno Forma spaziale degli Orbitali elettronici di atomo di idrogeno Un solido Il magnetismo nella materia ferrimagnetismo Dr. Daniele Di Gioacchino Istituto Nazionale
Le orbite degli elettroni in atomo di idrogeno Forma spaziale degli Orbitali elettronici di atomo di idrogeno Un solido Il magnetismo nella materia ferrimagnetismo Dr. Daniele Di Gioacchino Istituto Nazionale
Quando un composto ionico viene immesso in acqua si dissocia formando uno ione negativo ed uno positivo.
 I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3.
 Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
Atomi e molecole Ipotesi di Dalton (primi dell 800) 1. Un elemento Ä formato da particelle indivisibili chiamate atomi. 2. Gli atomi di uno specifico elemento hanno proprietå identiche. 3. Gli atomi dei
SISTEMA BINARIO DI DUE LIQUIDI VOLATILI TOTALMENTE MISCIBILI che seguono Raoult
 SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
SISTEM INRIO DI DUE IQUIDI OTII MENTE MISCIII che seguono Raoult Consideriamo due liquidi e totalmente miscibili di composizione χ e χ presenti in un contenitore ad una certa temperatura T=T 1. o strato
MISURE DI POTERE CALORIFICO E COMPOSIZIONE
 MISURE DI POTERE CALORIFICO E COMPOSIZIONE Potere calorifico dei combustibili: bomba calorimetrica e calorimetro di Junkers Composizione: gascromatografia Composizione dei gas combusti: o Sonda λ o Strumenti
MISURE DI POTERE CALORIFICO E COMPOSIZIONE Potere calorifico dei combustibili: bomba calorimetrica e calorimetro di Junkers Composizione: gascromatografia Composizione dei gas combusti: o Sonda λ o Strumenti
Chimica generale. Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari.
 Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
Chimica generale Corsi di laurea in - Tecnologie alimentari per la ristorazione - Viticoltura ed enologia - Tecnologie agroalimentari. PARTE 5-2 1 ACIDI E BASI 2 1-Definizioni di acido e di base 1-1 Teoria
BIOLOGIA GENERALE. Alessandro Massolo Dip. Biologia Animale e Genetica c/o Prof. F. Dessì-Fulgheri (Via Romana 17) massolo@unifi.
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE Facoltà di Scienze della Formazione Scienze della Formazione Primaria Alessandro Massolo Dip. Biologia Animale
TEST BIOLOGIA 1 ANNO ABEI Da inviare a connesso@alice.it entro e non oltre il 6 novembre 2015
 1) I batteri sono organismi: a- bicellulari b- monocellulari c- pluricellulari 2) I virus: a- possono riprodursi solo nell acqua b- possono riprodursi solo sulla superficie di una cellula c- possono riprodursi
1) I batteri sono organismi: a- bicellulari b- monocellulari c- pluricellulari 2) I virus: a- possono riprodursi solo nell acqua b- possono riprodursi solo sulla superficie di una cellula c- possono riprodursi
Metalli in medicina. L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il
 Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Metalli in medicina L utilizzo dei metalli in medicina ha radici ben antiche. Il ferro ed il rame, per esempio, erano utilizzati nella Grecia antica. Già da secoli il Hg 2+ era utilizzato nel trattamento
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3. Idrolisi salina Soluzioni tampone Titolazioni acido-base
 Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Corso di Chimica e Propedeutica Biochimica La chimica degli acidi e delle basi 3 Idrolisi salina Soluzioni tampone Titolazioni acido-base 1 Equilibri idrolitici La soluzione acquosa di un sale ottenuto
Serie completa di Modelli Molecolari per la Chimica Organica
 EdiSES Istruzioni per l utilizzo dei modelli molecolari Serie completa di Modelli Molecolari per la Chimica Organica allegati ai seguenti volumi: Chimica Organica - Paula Y. Bruice Elementi di Chimica
EdiSES Istruzioni per l utilizzo dei modelli molecolari Serie completa di Modelli Molecolari per la Chimica Organica allegati ai seguenti volumi: Chimica Organica - Paula Y. Bruice Elementi di Chimica
COMPOSTI DI COORDINAZIONE (complessi)
 Gli ioni dei metalli di transizione nei sistemi biologici non si presentano come acquoioni [M(H 2 O) n ] x+ ma come. COMPOSTI DI COORDINAZIONE (complessi) derivano dall interazione (coordinazione) tra
Gli ioni dei metalli di transizione nei sistemi biologici non si presentano come acquoioni [M(H 2 O) n ] x+ ma come. COMPOSTI DI COORDINAZIONE (complessi) derivano dall interazione (coordinazione) tra
CONDUTTORI, CAPACITA' E DIELETTRICI
 CONDUTTORI, CAPACITA' E DIELETTRICI Capacità di un conduttore isolato Se trasferiamo una carica elettrica su di un conduttore isolato questa si distribuisce sulla superficie in modo che il conduttore sia
CONDUTTORI, CAPACITA' E DIELETTRICI Capacità di un conduttore isolato Se trasferiamo una carica elettrica su di un conduttore isolato questa si distribuisce sulla superficie in modo che il conduttore sia
Esercitazione relativa al capitolo 14 I MONOPOLI E LA CONCORRENZA IMPERFETTA
 Esercitazione relativa al capitolo 14 I MONOPOLI E LA CONCORRENZA IMPERFETTA Esistono quattro principali tipi di strutture di mercato: concorrenza perfetta, monopolio, concorrenza monopolistica e oligopolio.
Esercitazione relativa al capitolo 14 I MONOPOLI E LA CONCORRENZA IMPERFETTA Esistono quattro principali tipi di strutture di mercato: concorrenza perfetta, monopolio, concorrenza monopolistica e oligopolio.
