Poniamo il carbonio al centro, tre idrogeni sono legati al carbonio direttamente e uno attraverso l ossigeno
|
|
|
- Florindo Martino
- 8 anni fa
- Visualizzazioni
Transcript
1 Strutture di Lewis E un metodo semplice per ottenere le formule di struttura di composti covalenti nota la formula molecolare, la configurazione elettronica del livello di valenza degli atomi e la connettività di questi. Conoscere la connettività di una molecola significa sapere quali coppie di atomi sono legati tra loro. Esistono diversi criteri per scrivere le strutture di Lewis, quello utilizzato in questa esercitazione è basato sul definire un insieme di elettroni del livello di valenza per la molecola, che vengono ridistribuiti in accordo con la regola dell ottetto, tenendo conto delle numerose eccezioni. Es. Scrivere la formula di Lewis del metanolo, C 3, prevederne la struttura secondo la teoria VSEPR. 1) Determinare il numero totale di valenza della molecola, sommando il numero di elettroni di valenza di ciascun atomo. Se la molecola ha carica negativa o positiva si aggiungono o si sottraggono tanti elettroni quanto vale la carica in valore assoluto. Configurazione elettronica del livello di valenza di ciascun atomo: C: [e] 2s 2 2p 2 4e - : [e] 2s 2 2p 4 6e - :1s 1 4x1e - Tot.14e - di valenza della molecola 2) Definire la connettività degli atomi. Non esiste una regola certa per definire la connettività nota la formula molecolare, è necessario acquisire una certa familiarità con i composti chimici e le loro strutture. Frequentemente esiste un atomo centrale al quale tutti gli altri sono connessi, gli atomi di idrogeno sono spesso posti in periferia rispetto all atomo centrale, al quale sono collegati direttamente o indirettamente (ad esempio tramite un non metallo, l ossigeno o l azoto etc.). A volte la formula molecolare contiene informazioni su come si può scomporre la molecola in sottogruppi. Come in questo caso: C 3 : la molecola è composta dal gruppo metilico, C 3 e un gruppo ossidrile, Poniamo il carbonio al centro, tre idrogeni sono legati al carbonio direttamente e uno attraverso l ossigeno 3) Si pone una coppia di elettroni di legame per ciascuna coppia di elettroni legati tra loro, prendendoli dall insieme degli elettroni di valenza della molecola.
2 Così sono utilizzati 10 dei 14 e - di valenza della molecola 4)Gli elettroni rimanenti: si dispongono gli elettroni a coppie su ciascun atomo cominciando da quelli periferici con lo scopo di completare l ottetto (8 elettroni per ciascun atomo siano essi condivisi o di non legame). Attenzione all eccezioni: a)l idrogeno può disporre di un solo doppietto elettronico di legame (raggiunge la configurazione elettronica più stabile con 2 elettroni). b)atomi del secondo periodo detti elettron poveri raggiungono la configurazione elettronica più stabile con 4 o 6 elettroni (es.be, B) c)alcuni non metalli dei periodi superiori al secondo (es. S,P in SF 4,SF 6,PCl 5 ) possono disporre in certe condizioni di più di 8 elettroni nel loro livello di valenza della molecola, si parla in questo caso di ottetto espanso (fino a 10 o 12 ). Questo perché atomi di questi periodi possono disporre degli orbitali d in cui possono collocare questi elettroni. I non metalli del secondo periodo non possono far questo perché non dispongono di tali orbitali. In questo caso: ci sono 4 elettroni da distribuire come doppietti di non legame. Iniziando dagli atomi più periferici, gli idrogeni hanno già raggiunto la loro configurazione più stabile, mentre l ossigeno ha solo 4 elettroni di legame. Gli elettroni rimanenti andranno a costituire i due doppietti di non legame dell ossigeno. 5)A questo punto della costruzione rimangono tre possibilità: a) Tutti gli atomi soddisfano la regola dell ottetto con qualsiasi eccezione ammessa: la formula di Lewis è pronta a meno delle cariche formali. b) Non bastano gli elettroni che abbiamo a disposizione per completare gli ottetti di tutti gli atomi. Bisogna formare dei legami multipli per condivisione di doppietti di non legame. c) Dopo aver completato gli ottetti di tutti gli atomi, sono ancora disponibili elettroni. In questo caso gli elettroni in eccesso vengono attribuiti all atomo centrale come doppietti di non legame, il quale con una certa probabilità disporrà di un ottetto espanso. 6) La carica formale: non ha alcun significato fisico, non è una carica formale, ha significato solo in una specifica rappresentazione di Lewis. La carica formale serve per tener conto della differente distribuzione di elettroni quando si passa dagli atomi isolati alla struttura costruita, in cui gli elettroni non sono più solamente localizzati sugli atomi ma anche condivisi. Il calcolo della carica formale si fa attribuendo a ciascun atomo nella struttura metà degli elettroni di legame più tutti quelli di non legame. Quindi la carica formale di ogni atomo si ottiene facendo la differenza tra il numero di elettroni che l atomo aveva nel livello di valenza quando era isolato e il numero di elettroni che ha nella molecola secondo l attribuzione appena definita.
3 Carica formale= L V s + 2 Con V= e - di valenza dell atomo, S= n tot. di e - presenti come coppie solitarie, L= n tot. di e - presenti come coppie di legame. C.F. (C)= 4 (e - di valenza)- 4 ( e - impiegati nei legami)=0 C.F.()= 6(e - di valenza)- 2 ( e - impiegati nei legami)-4 (e - coppie di e - solitarie)=0 C.F.()=1(e - di valenza) - 1 ( e - impiegati nei legami)=0 Quando la carica formale è zero, per convenzione non si segnala nella formula di struttura. 7) Previsione della geometria molecolare Si applica la teoria della repulsione delle coppie elettroniche di valenza (VSEPR-Valence Shell Electron Pair Repulsion ) secondo cui la geometria della molecola in prossimità di ciascun atomo è quella che minimizza la repulsione tra le coppie elettroniche sia di legame che di non legame. Se si stabilisce il numero di coppie elettroniche attorno all atomo centrale si può determinare come gli atomi periferici si dispongano intorno ad esso. Attenzione; in questa trattazione i legami doppi sono considerati come legami singoli, quindi si conta una sola coppia di elettroni, per questo spesso è più chiaro parlare di gruppi di cariche. In tabella sono riportate le tipologie di geometrie che corrispondono al numero (o raggruppamenti) di coppie elettroniche. Nel metanolo, l atomo centrale, il carbonio è circondato da quattro coppie di elettroni, la simmetria intorno ad esso è tetraedrica, leggermente distorta perché le coppie di elettroni di legame attorno al carbonio non sono identiche (il carbonio è legato a 3 idrogeni e un ossigeno). In questa figura si è adottata la notazione stereochimica, per mettere in evidenza la geometria tetraedrica che l atomo centrale impone alla molecola. Mettendo nel piano del foglio gli atomi, C,, gli altri due risulteranno essere sporgenti da essi verso l osservatore (cuneo continuo) o in opposizione ad esso (cuneo tratteggiato)
4 8) orbitali ibridi La simmetria dell atomo di carbonio del metano è tetraedrica, quindi il carbonio utilizza gli orbitali sp 3 per fare i quattro legami direzionati lungo i vertici di un tetraedro. Es. Scrivere la struttura di Lewis dell ammoniaca (N 3 ), prevederne la struttura secondo la teoria VSEPR. Determinare il numero totale di valenza della molecola N: [e] 2s 2 sp 3 5e - di valenza : 1s 1 3x1e - di valenza Tot.8 e - di valenza o 4 coppie di elettroni Definire la connettività degli atomi: atomo centrale N (solitamente -ma non è una regolal atomo centrale è il meno elettronegativo o è quello che può formare il maggior numero di legami). Si pone una coppia di elettroni di legame per ciascuna coppia di elettroni legati tra loro. Si sono utilizzati 6 e -, sono ancora disponibili 2 e -. Si dispongono i rimanenti elettroni a coppie su ciascun atomo, cominciando da quelli periferici con lo scopo di completarne l ottetto. Gli idrogeni, hanno già raggiunto la loro configurazione più stabile, il doppietto va sull azoto, che così raggiunge l ottetto. La carica formale per ogni atomo della molecola è zero Formula di struttura di Lewis: non fornisce indicazioni sulla geometria spaziale della molecola o delle coppie elettroniche, ma solo sulla topologia della molecola (quale atomo è legato con un altro), sul tipo di legame tra atomo e atomo ( semplice,doppio, triplo) e sull eventuale presenza di coppie non condivise. Previsione della geometria delle coppie di elettroni (VSEPR) Nell ammonica, l atomo centrale, l azoto è circondato da quattro gruppi di cariche (3 coppie di legame e una coppia non condivisa), per minimizzare la repulsione la geometria intorno all azoto è tetraedrica distorta a causa della coppia di elettroni di non legame che esercita una repulsione maggiore di quelle di legame. L angolo di legame N è circa 107, inferiore all angolo del tetraedro regolare, 109,5.
5 La simmetria intorno all atomo di azoto è tetraedrica, l azoto utilizza orbitali sp 3 : tre orbitali sp 3 sono utilizzati per formare i legami con l idrogeno e uno per la coppia di elettroni non condivisa. La geometria di una molecola è determinata dalla posizione degli atomi che la costituiscono. La geometria dell ammoniaca è definita dalla posizione nello spazio dell atomo di azoto e dei tre atomi di idrogeno, ed è piramidale. Quindi per l ammoniaca, la geometria delle coppie (tetraedrica) non coincide con la geometria molecolare (piramidale), queste due figure geometriche si somigliano ma non sono identiche. Valutazione della polarità della molecola dell ammoniaca. Individuata la struttura spaziale della molecola è possibile stabilire se si tratta di una molecola polare o apolare. Una molecola è polare quando la distribuzione delle cariche elettroniche è tale per cui il momento di dipolo elettrico complessivo µ della molecola è diverso da zero. L azoto è più elettronegativo dell idrogeno, nei legami N- gli elettroni di legame sono spostati verso l azoto, è possibile individuare un momento di dipolo per ciascun legame N-. I vettori sono orientati dall idrogeno all azoto, cioè dalla carica positiva a quella negativa ( i testi di fisica adottano la convenzione opposta). Bisogna considerare anche il momento di dipolo tra l azoto e la coppia di elettroni non condivisa, diretto da N verso il lobo. La somma vettoriale di tutti i momenti di dipolo è diversa da zero, la molecola di N 3 è polare.
6 ES. Scrivere la struttura di Lewis dell acqua( 2 ), prevederne la struttura secondo la teoria VSEPR. 1s 1 2e - : [e]2s 2 2p 4 6e - Tot.8e - -- così sono impegnati 4e - su 8e - di valenza complessivi della molecola. Gli hanno raggiunto la configurazione più stabile, quindi i 4 rimanenti si distribuisco sull ossigeno come coppie di elettroni non condivisi. La carica formale per ogni atomo della molecola è zero. Previsione della geometria molecolare secondo la teoria VSEPR Nella molecola dell acqua, l atomo centrale, l ossigeno è circondato da quattro coppie di elettroni, 2 di legame e due di non legame, per minimizzare la repulsione la geometria intorno all ossigeno è tetraedrica distorta a causa delle coppia di elettroni di non legame L angolo di legame N è circa 104, inferiore all angolo del tetraedro regolare, 109,5. La simmetria intorno all atomo di ossigeno è tetraedrica, l ossigeno utilizza orbitali sp 3, due orbitali sp 3 sono utilizzati per formare i legami con l idrogeno e due per la coppie di elettroni non condivisi. Geometria delle coppie: tetraedrica distorta Geometria della molecola: angolare Il momento di dipolo complessivo è diverso da zero. ES. Scrivere la struttura di Lewis dell anidride carbonica (C 2 ), prevederne la struttura secondo la teoria VSEPR. C: [e] 2s 2 2p 2 4e - : [e]2s 2 2p 4 2x6e - 16e - di valenza -C- sono impegnati 4e -, si dispongono i doppietti di elettroni rimasti, iniziando dagli atomi più periferici, 3 coppie di e - per ogni ossigeno,
7 Si controlla l ottetto di ogni atomo: gli ossigeni hanno raggiunto l ottetto, mentre il carbonio ha solo 4e -, la struttura non è corretta. gni ossigeno può condividere una coppia di elettroni in modo tale che anche il carbonio raggiunga l ottetto. C La carica formale per ogni atomo della molecola è zero L atomo centrale della molecola di anidride carbonica, il carbonio, è circondato da due gruppi di elettroni di legame (per la determinazione della geometria dell atomo centrale secondo la teoria VSEPR i legami doppi sono considerati come quelli semplici) quindi per minimizzare la repulsione tra i due gruppi di elettroni la configurazione del carbonio è lineare. La geometria delle coppie elettroniche coincide con la geometria della molecola (non ci sono coppie di elettroni non condivisi). Il carbonio nell anidride carbonica utilizza orbitali ibridi sp: due orbitali ibridi sp vengono utilizzati per formare i due legami sigma (δ), due orbitali p per la formazione dei legami pigreco (π) (il legame doppio è formato da un legame δ e uno π). L anidride carbonica è apolare, in quanto il momento di dipolo complessivo della molecola è nullo. ES. Scrivere la struttura di Lewis del cloruro di berillio (BeCl 2 ), prevederne la struttura secondo la teoria VSEPR. Be: [e] 2s 2 2e - Cl: [Ne] 3s 2 3p 5 2x7e - =14e - Tot.=16e - Atomo centrale = Be (è il meno elettronegativo) sono utilizzati 4 e - ne sono disponibili ancora 12 e - Si dispongo gli elettroni rimanenti come coppie di elettroni di non legame cominciando dagli atomi periferici con lo scopo di completare l ottetto tenendo conto delle eccezioni. In questo caso il berillio fa parte del secondo periodo elettron poveri per cui raggiungono l ottetto con 4 o 6 elettroni(il boro). Ponendo le tre coppie di elettroni non condivisi su ogni cloro, si utilizzano i 16 elettroni complessivi di valenza della molecola. Per i due atomi di cloro è rispettata la regola dell ottetto, e anche per il berillio nella sua eccezione. La carica formale per ogni atomo della molecola è zero. L atomo centrale della molecola del cloruro di berillio, il berillio è circondato da due gruppi di elettroni di legame, per minimizzare la repulsione la configurazione del berillio è lineare.
8 La geometria delle coppie elettroniche coincide con la geometria della molecola (non ci sono coppie di elettroni non condivisi sull atomo centrale). Il berillio nella molecola del cloruro di berillio utilizza orbitali ibridi sp che vengono utilizzati per formare i due legami sigma con il cloro Formule di risonanza di Lewis Quando una molecola può essere rappresentata da più formule di Lewis, che hanno la stessa posizione degli atomi, ma differente distribuzione degli elettroni, si dice che la struttura è meglio rappresentata come insieme di formule di risonanza o formule limite. Questo perché in certe molecole gli elettroni di legame si possono distribuire tra più atomi (elettroni delocalizzati), generando strutture di una certa simmetria. Questa proprietà non si può descrivere con una sola formula di Lewis in cui le coppie di elettroni sono localizzate (quelle di non legame su un atomo, quelle di legame tra i due atomi coinvolti nel legame). Molecole con elettroni delocalizzati sono meglio descritte da più di una formula di Lewis, ciascuna delle quali contribuisce solo parzialmente alla descrizione. Per stabilire quale peso ha ciascuna formula limite, si fa riferimento alla carica parziale, la struttura con il maggior peso sarà quella con minore differenza di carica formale tra i suoi atomi. ES. Scrivere la struttura di Lewis del monossido di azoto (N), prevederne la struttura secondo la teoria VSEPR. N:[e] 2s 2 2p 3 5e - 4 :[e] 2s 2 2p 6e - Tot. 11e - N N- sono utilizzati 2 e - ne sono disponibili ancora 9. Si dispongono i rimanenti elettroni a coppie su ciascun atomo, cominciando da quelli periferici con lo scopo di completarne l ottetto. L ossigeno ha raggiunto l ottetto con 8 elettroni, l azoto rimane con 7 elettroni. Calcolo della carica formale: C.F.(N)= =0 C.F.()=6-2-4=0 Geometria molecolare =lineare ( le molecole biatomiche possono essere solo lineari). L azoto utilizza orbitali ibridi sp. Un orbitale sp è utilizzato per il legame δ, l altro per il doppietto di elettroni non condiviso; un orbitale p per la formazione del legame π (il
9 legame doppio N- è formato da un legame δ e uno π) e l altro orbitale p per l elettrone spaiato. ES. Scrivere la struttura di Lewis del biossido di azoto (N 2 ), prevederne la struttura secondo la teoria VSEPR. N:[e] 2s 2 2p 3 5e - :[e] 2s 2 2p 4 6e - x2 Tot. 17 e - sono utilizzati 4 e - ne sono disponibili ancora 13 e -. Si dispongono i rimanenti e lettroni a coppie su ciascun atomo, cominciando da quelli periferici con lo scopo di completarne l ottetto. N Gli ossigeni hanno raggiunto l ottetto, mentre l azoto ha solo 5 elettroni, si può far condividere una coppia di elettroni da un atomo di ossigeno. Calcolo della carica formale C.F.(N)= 5-3-1=+1 C.F. ( )=6-1-4=-1 C.F. ( )=6-2-4= 0 E possibile scrivere una struttura identica a questa se è l altro ossigeno a condividere una coppia di elettroni. Le due formule differiscono solamente per la distribuzione degli elettroni, sono dette formule di risonanza. Si dice che la struttura del biossido di azoto è descritta da un insieme di formule di risonanza. E possibile anche scrivere
10 Le formule di risonanza descrivono i seguenti dati sperimentali: i legami N- sono di uguale lunghezza e la carica negativa è divisa tra i due atomi di ossigeno. L atomo centrale del biossido di azoto, l azoto, è circondato da tre gruppi di elettroni, due di legame più un elettone spaiato,la geometria elettronica è trigonale planare, con angoli maggiori di 120 (trigonale distorta) poiché la repulsione esercitata dall elettrone spaiato è minore rispetto ad una coppia di elettroni. La geometria della molecola è angolare: L azoto nel biossido di azoto utilizza orbitali ibridi sp 2. Due orbitali sp 2 vengono utilizzati per formare due legami sigma con l ossigeno e uno per l elettrone spaiato, l orbitale p dell azoto viene utilizzato per la formazione del legame π. ES. Scrivere la struttura di Lewis dell acido fosforico ( 3 P 4 ), prevederne la struttura secondo la teoria VSEPR. P:[Ne] 3s 3p 2 3-5e :[e] 2s 2 2p 4 6e - x4 : 1s 1 1e - x3 Tot. 32e - Connettività degli atomi: Gli acidi sono caratterizzati da gruppi legati all atomo centrale, l atomo centrale è il fosforo.
11 P sono utilizzati 14 e - ne sono disponibili ancora 18. Si dispongono i rimanenti elettroni a coppie su ciascun atomo, cominciando da quelli periferici con lo scopo di completarne l ottetto. Tutti gli atomi hanno raggiunto l ottetto. P Calcolo della carica formale (-1) (+1) P C.F.(P)= 5-4=+1 C.F. ( )=6-1-6=-1 C.F. ( )=6-2-4= 0 Ma il fosforo appartiene al terzo periodo della tavola periodica, fa parte di quelli elementi che possono utilizzare gli orbitali d per disporre gli elettroni e ottenere una maggiore stabilità (ottetto espanso). Se si fa condividere una coppia di elettroni dall ossigeno che ha tre coppie di elettroni non condivisi :
12 (-1) (+1) P C.F.(P)= 5-5=0 C.F. ( )=6-2-4= 0 P In questa struttura non c è separazione di carica. Nell acido fosforico, il fosforo è circondato da quattro coppie di elettroni, la simmetria intorno ad esso è tetraedrica. Il fosforo nell acido fosforico utilizza orbitali sp 3 per fare i quattro legami δ e un orbitale d per il legame π, i quattro legami sono direzionati lungo i vertici di un tetraedro. La geometria delle coppie elettroniche coincide con la geometria della molecola. La geometria dei gruppi è angolare. P Si può spiegare considerando l ossigeno come atomo centrale di R con R= 2 P 3, l ossigeno è circondato da quattro raggruppamenti di elettroni (due di legame e due di non legame), la geometria dell atomo centrale è tetraedrica, in cui due orbitali sp 3 sono occupati dalle coppie di non legame, quindi la disposizione di R è angolare. R ES. Scrivere la struttura di Lewis dell acido borico ( 3 B 3 ), prevederne la struttura secondo la teoria VSEPR.
13 B:[e] 2s 2 2p 1 3e - :[e] 2s 2 2p 4 6e - x3 : 1s 1 1e - x3 Tot. 24e - Connettività degli atomi: si tratta di un acido, quindi i gruppi sono legati all atomo centrale, l atomo centrale è il boro. B Sono utilizzati 12 e -, ne sono disponibili ancora 12. Si dispongono i rimanenti elettroni a coppie su ciascun atomo, cominciando da quelli periferici con lo scopo di completarne l ottetto. B Tutti gli atomi hanno raggiunto la loro configurazione più stabile, ricordandosi che il boro fa parte del secondo periodo elettron poveri per cui raggiunge l ottetto con 6 elettroni (il berillio con quattro). La carica formale per ogni atomo della molecola è zero. L atomo centrale è circondato da tre gruppi di elettroni, ha simmetria B trigonale planare. Il boro utilizza i tre orbitali sp2 per i tre legami δ, l orbitale p è vuoto. Come per 3 P 4, la geometria dei gruppi è angolare ES. Scrivere la struttura di Lewis dello ione clorito (Cl 2 - ), prevederne la struttura secondo la teoria VSEPR
14 Cl:[Ne] 3s 2 3p 5 7e - :[e] 2s 2 2p 4 6e - x2 1 carica negative 1e - Tot.20e - Connettività degli atomi: il cloro è l atomo centrale (meno elettronegativo) sono utilizzati 4 e -, ne sono disponibili ancora 16. Si dispongono i rimanenti elettroni a coppie su ciascun atomo, cominciando da quelli periferici con lo scopo di completarne l ottetto. Cl atomi hanno raggiunto l ottetto. Dal calcolo della carica formale: sono utilizzati i 16 e - di valenza complessivi della molecola e tutti gli La somma delle cariche formali è uguale alla carica complessiva della molecola, in questo caso è -1. Il cloro appartiene al terzo periodo, potrebbe essere un caso di ottetto espanso. Se un ossigeno condivide una coppia di elettroni, la formula sarà: Si ottiene una struttura con minor separazione di carica. Le formule principali formule di risonanza sono: ppure:
15 Il cloro è circondato da quattro gruppi di elettroni (due di legame e due di non legame): simmetria tetraedrica delle coppie di elettroni, la geometria molecolare è angolare. Il cloro utilizza orbitali sp 3. Due orbitali sp 3 per i legami δ con gli ossigeni, due per le coppie di elettroni solitarie, mentre l orbitale d è Cl utilizzato per la formazione del legame π. (-1) ES. Scrivere la struttura di Lewis dell idrossilammina (N 2 ), prevederne la struttura secondo la teoria VSEPR N:[e] 2s 2 2p 3 5e - :[e] 2s 2 2p 4 6e - :1s 1 1e - x3 Tot.14e - Connettività degli atomi: N è l atomo centrale a cui sono legati due e un gruppo N sono utilizzati 8 e -, ne sono disponibili ancora 6 e -. Si dispongono i rimanenti elettroni a coppie su ciascun atomo, cominciando da quelli periferici con lo scopo di completarne l ottetto N sono utilizzati i 16 e - di valenza della molecola e tutti gli atomi hanno raggiunto l ottetto. La carica formale per ogni atomo della molecola è zero. L atomo centrale è circondato da quattro gruppi di elettroni, ha simmetria tetraedrica. L azoto utilizza tre orbitali sp 3 per i tre legami δ, uno per la coppia di elettroni di non legame. La geometria della molecola è trigonale piramidale. N
16
GEOMETRIA MOLECOLARE
 GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
GEOMETRIA MOLECOLARE Le molecole hanno geometrie spaziali ben definite caratterizzate da distanze di legame ed angoli di legame. Questi possono essere determinati sperimentalmente (es. raggi X). Si vede
Formule di Struttura delle Molecole Organiche
 Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
Formule di Struttura delle Molecole Organiche Costituzione L ordine in cui gli atomi di una molecola sono connessi è chiamata costituzione o connettività. La costituzione di una molecola deve essere determinata
VSEPR Polarità Ibridizzazione
 VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
VSEPR Polarità Ibridizzazione VSEPR VSEPR = Valance-Shell electron-pair repulsion Principio fondamentale: ciascun gruppo di elettroni di valenza attorno ad un atomo centrale è situato il più lontano possibile
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE. un atomo compie all atto di formazione di un composto al fine di formare un maggior
 CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
CHIMICA ORGANICA: IBRIDAZIONE & RISONANZA IBRIDIZZAZIONE L ibridizzazione o ibridazione è una ricombinazione dei propri orbitali atomici che un atomo compie all atto di formazione di un composto al fine
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA
 LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
LA MOLE : UN UNITA DI MISURA FONDAMENTALE PER LA CHIMICA Poiché è impossibile contare o pesare gli atomi o le molecole che formano una qualsiasi sostanza chimica, si ricorre alla grandezza detta quantità
Dalla Chimica Generale
 RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
RISNANZA RISNANZA Vi sono molecole le cui proprietà non sono ben spiegate da una singola struttura di Lewis che tenga conto cioé delle proprietà osservate (contenuto energetico, lunghezza dei legami, comportamento
Com è fatto l atomo ATOMO. UNA VOLTA si pensava che l atomo fosse indivisibile. OGGI si pensa che l atomo è costituito da tre particelle
 STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
STRUTTURA ATOMO Com è fatto l atomo ATOMO UNA VOLTA si pensava che l atomo fosse indivisibile OGGI si pensa che l atomo è costituito da tre particelle PROTONI particelle con carica elettrica positiva e
Teoria VSEPR Geometria molecolare
 Teoria VSEPR Geometria molecolare la teoria VSEPR la forma delle molecole Massima distanza possibile! Teoria della repulsione delle coppie di elettroni di valenza VSEPR Struttura delle molecole Le regioni
Teoria VSEPR Geometria molecolare la teoria VSEPR la forma delle molecole Massima distanza possibile! Teoria della repulsione delle coppie di elettroni di valenza VSEPR Struttura delle molecole Le regioni
La teoria del legame di valenza
 La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente
La teoria del legame di valenza La teoria di Lewis (postulata prima dell'avvento della meccanica quantistica) considera gli elettroni di valenza degli atomi che formano legami, ma prescinde totalmente
 LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
LEGAME CHIMICO In natura solo i gas nobili si ritrovano allo stato monoatomico. Gli altri atomi tendono a legarsi spontaneamente fra di loro per formare delle MOLECOLE, raggiungendo una condizione di MAGGIORE
I semiconduttori Semiconduttori intrinseci
 I semiconduttori Semiconduttori intrinseci I semiconduttori naturali usati per la produzione di dispositivi elettronici sono stati per molti anni il silicio e il germanio. Il germanio è andato, con il
I semiconduttori Semiconduttori intrinseci I semiconduttori naturali usati per la produzione di dispositivi elettronici sono stati per molti anni il silicio e il germanio. Il germanio è andato, con il
4 3 4 = 4 x 10 2 + 3 x 10 1 + 4 x 10 0 aaa 10 2 10 1 10 0
 Rappresentazione dei numeri I numeri che siamo abituati ad utilizzare sono espressi utilizzando il sistema di numerazione decimale, che si chiama così perché utilizza 0 cifre (0,,2,3,4,5,6,7,8,9). Si dice
Rappresentazione dei numeri I numeri che siamo abituati ad utilizzare sono espressi utilizzando il sistema di numerazione decimale, che si chiama così perché utilizza 0 cifre (0,,2,3,4,5,6,7,8,9). Si dice
È importante quindi conoscere le proprietà chimiche dell acqua. Le reazioni acido base sono particolari esempi di equilibrio chimico in fase acquosa
 Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
Premessa Le nozioni di acido e di base non sono concetti assoluti ma sono relativi al mezzo in cui tale sostanze sono sciolte. L acqua è il solvente per eccellenza, scelto per studiare le caratteristiche
PROTEINE. sono COMPOSTI ORGANICI QUATERNARI
 PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
PROTEINE sono COMPOSTI ORGANICI QUATERNARI Unione di elementi chimici diversi Il composto chimico principale è il C (carbonio) Sono quattro gli elementi chimici principali che formano le proteine : C (carbonio),
Organic Chemistry. 4 th Edition Paula Yurkanis Bruice. Delocalizzazione degli elettroni e risonanza
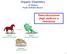 Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
Organic Chemistry 4 th Edition Paula Yurkanis Bruice Delocalizzazione degli elettroni e risonanza 1 Elettroni Localizzati contro elettroni delocalizzati localized electrons localized electrons delocalized
13. Campi vettoriali
 13. Campi vettoriali 1 Il campo di velocità di un fluido Il concetto di campo in fisica non è limitato ai fenomeni elettrici. In generale il valore di una grandezza fisica assegnato per ogni punto dello
13. Campi vettoriali 1 Il campo di velocità di un fluido Il concetto di campo in fisica non è limitato ai fenomeni elettrici. In generale il valore di una grandezza fisica assegnato per ogni punto dello
L EQUILIBRIO UNIVERSALE dalla meccanica celeste alla fisica nucleare
 L EQUILIBRIO UNIVERSALE dalla meccanica celeste alla fisica nucleare Cap.4 giroscopio, magnetismo e forza di Lorentz teoria del giroscopio Abbiamo finora preso in considerazione le condizionidi equilibrio
L EQUILIBRIO UNIVERSALE dalla meccanica celeste alla fisica nucleare Cap.4 giroscopio, magnetismo e forza di Lorentz teoria del giroscopio Abbiamo finora preso in considerazione le condizionidi equilibrio
GIROSCOPIO. Scopo dell esperienza: Teoria fisica. Verificare la relazione: ω p = bmg/iω
 GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
GIROSCOPIO Scopo dell esperienza: Verificare la relazione: ω p = bmg/iω dove ω p è la velocità angolare di precessione, ω è la velocità angolare di rotazione, I il momento principale d inerzia assiale,
E naturale chiedersi alcune cose sulla media campionaria x n
 Supponiamo che un fabbricante stia introducendo un nuovo tipo di batteria per un automobile elettrica. La durata osservata x i delle i-esima batteria è la realizzazione (valore assunto) di una variabile
Supponiamo che un fabbricante stia introducendo un nuovo tipo di batteria per un automobile elettrica. La durata osservata x i delle i-esima batteria è la realizzazione (valore assunto) di una variabile
Appunti sulla Macchina di Turing. Macchina di Turing
 Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
Macchina di Turing Una macchina di Turing è costituita dai seguenti elementi (vedi fig. 1): a) una unità di memoria, detta memoria esterna, consistente in un nastro illimitato in entrambi i sensi e suddiviso
GEOMETRIA DELLE MASSE
 1 DISPENSA N 2 GEOMETRIA DELLE MASSE Si prende in considerazione un sistema piano, ossia giacente nel pian x-y. Un insieme di masse posizionato nel piano X-Y, rappresentato da punti individuati dalle loro
1 DISPENSA N 2 GEOMETRIA DELLE MASSE Si prende in considerazione un sistema piano, ossia giacente nel pian x-y. Un insieme di masse posizionato nel piano X-Y, rappresentato da punti individuati dalle loro
materia atomi miscugli omogenei e eterogenei sostanze elementari composti
 Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
Elementi e Composti materia miscugli omogenei e eterogenei sostanze elementari composti atomi Gli atomi sono, per convenzione, le unità costituenti le sostanze Le sostanze possono essere costituite da
ESAME DI STATO DI LICEO SCIENTIFICO CORSO SPERIMENTALE P.N.I. 2004
 ESAME DI STAT DI LICE SCIENTIFIC CRS SPERIMENTALE P.N.I. 004 Il candidato risolva uno dei due problemi e 5 dei 0 quesiti in cui si articola il questionario. PRBLEMA Sia la curva d equazione: ke ove k e
ESAME DI STAT DI LICE SCIENTIFIC CRS SPERIMENTALE P.N.I. 004 Il candidato risolva uno dei due problemi e 5 dei 0 quesiti in cui si articola il questionario. PRBLEMA Sia la curva d equazione: ke ove k e
Determinazione della composizione elementare dello ione molecolare. Metodo dell abbondanza isotopica. Misure di massa esatta
 Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
Determinazione della composizione elementare dello ione molecolare Metodo dell abbondanza isotopica Misure di massa esatta PREMESSA: ISOTOPI PICCHI ISOTOPICI Il picco dello ione molecolare è spesso accompagnato
1. PRIME PROPRIETÀ 2
 RELAZIONI 1. Prime proprietà Il significato comune del concetto di relazione è facilmente intuibile: due elementi sono in relazione se c è un legame tra loro descritto da una certa proprietà; ad esempio,
RELAZIONI 1. Prime proprietà Il significato comune del concetto di relazione è facilmente intuibile: due elementi sono in relazione se c è un legame tra loro descritto da una certa proprietà; ad esempio,
LA MATERIA Suggerimenti didattici e schede
 LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
LA MATERIA Suggerimenti didattici e schede Iniziamo il percorso chiedendo a un bambino di consegnarci alcune cose: una gomma, una penna, un capello. Domandiamo a un altro di consegnarci una gioia, una
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici. Capitolo 10
 Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Il legame chimico II: la geometria molecolare e l ibridizzazione degli orbitali atomici Capitolo 10 Legame tra un derivato del Buckyball e il sito dell HIV-Protease Repulsione delle coppie di elettroni
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA. Angela Chambery Lezione 2
 Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Corso di Laurea in Farmacia Insegnamento di CHIMICA BIOLOGICA Angela Chambery Lezione 2 Versatilità del carbonio nel formare legami covalenti La chimica degli organismi viventi è organizzata intorno al
Consideriamo due polinomi
 Capitolo 3 Il luogo delle radici Consideriamo due polinomi N(z) = (z z 1 )(z z 2 )... (z z m ) D(z) = (z p 1 )(z p 2 )... (z p n ) della variabile complessa z con m < n. Nelle problematiche connesse al
Capitolo 3 Il luogo delle radici Consideriamo due polinomi N(z) = (z z 1 )(z z 2 )... (z z m ) D(z) = (z p 1 )(z p 2 )... (z p n ) della variabile complessa z con m < n. Nelle problematiche connesse al
Rappresentazione delle informazioni
 Rappresentazione delle informazioni Abbiamo informazioni (numeri, caratteri, immagini, suoni, video... ) che vogliamo rappresentare (e poter elaborare) in un calcolatore. Per motivi tecnologici un calcolatore
Rappresentazione delle informazioni Abbiamo informazioni (numeri, caratteri, immagini, suoni, video... ) che vogliamo rappresentare (e poter elaborare) in un calcolatore. Per motivi tecnologici un calcolatore
Alessandro Pellegrini
 Esercitazione sulle Rappresentazioni Numeriche Esistono 1 tipi di persone al mondo: quelli che conoscono il codice binario e quelli che non lo conoscono Alessandro Pellegrini Cosa studiare prima Conversione
Esercitazione sulle Rappresentazioni Numeriche Esistono 1 tipi di persone al mondo: quelli che conoscono il codice binario e quelli che non lo conoscono Alessandro Pellegrini Cosa studiare prima Conversione
PROBABILITÀ - SCHEDA N. 2 LE VARIABILI ALEATORIE
 Matematica e statistica: dai dati ai modelli alle scelte www.dima.unige/pls_statistica Responsabili scientifici M.P. Rogantin e E. Sasso (Dipartimento di Matematica Università di Genova) PROBABILITÀ -
Matematica e statistica: dai dati ai modelli alle scelte www.dima.unige/pls_statistica Responsabili scientifici M.P. Rogantin e E. Sasso (Dipartimento di Matematica Università di Genova) PROBABILITÀ -
LE FUNZIONI A DUE VARIABILI
 Capitolo I LE FUNZIONI A DUE VARIABILI In questo primo capitolo introduciamo alcune definizioni di base delle funzioni reali a due variabili reali. Nel seguito R denoterà l insieme dei numeri reali mentre
Capitolo I LE FUNZIONI A DUE VARIABILI In questo primo capitolo introduciamo alcune definizioni di base delle funzioni reali a due variabili reali. Nel seguito R denoterà l insieme dei numeri reali mentre
Luigi Piroddi piroddi@elet.polimi.it
 Automazione industriale dispense del corso 10. Reti di Petri: analisi strutturale Luigi Piroddi piroddi@elet.polimi.it Analisi strutturale Un alternativa all analisi esaustiva basata sul grafo di raggiungibilità,
Automazione industriale dispense del corso 10. Reti di Petri: analisi strutturale Luigi Piroddi piroddi@elet.polimi.it Analisi strutturale Un alternativa all analisi esaustiva basata sul grafo di raggiungibilità,
Il concetto di valore medio in generale
 Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
Il concetto di valore medio in generale Nella statistica descrittiva si distinguono solitamente due tipi di medie: - le medie analitiche, che soddisfano ad una condizione di invarianza e si calcolano tenendo
Gli orbitali: modello atomico probabilistico
 1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
1 Approfondimento 2.1 Gli orbitali: modello atomico probabilistico Modello atomico planetario (o a gusci): gli elettroni ruotano intorno al nucleo percorrendo orbite prefissate. Il modello atomico planetario
Matematica in laboratorio
 Unità 1 Attività guidate Attività 1 Foglio elettronico Divisibilità tra numeri naturali Costruisci un foglio di lavoro per determinare se a è divisibile per b, essendo a e b due numeri naturali, con a
Unità 1 Attività guidate Attività 1 Foglio elettronico Divisibilità tra numeri naturali Costruisci un foglio di lavoro per determinare se a è divisibile per b, essendo a e b due numeri naturali, con a
Siamo così arrivati all aritmetica modulare, ma anche a individuare alcuni aspetti di come funziona l aritmetica del calcolatore come vedremo.
 DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
DALLE PESATE ALL ARITMETICA FINITA IN BASE 2 Si è trovato, partendo da un problema concreto, che con la base 2, utilizzando alcune potenze della base, operando con solo addizioni, posso ottenere tutti
isomeria di struttura isomeria di posizione isomeria di catena stereoisomeria isomeria di conformazione isomeria di configurazione 'isomeria ottica
 ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
ISOMERIA L'isomeria di struttura è connessa al diverso modo in cui gli atomi di due o più composti si legano tra loro in sequenza. Ci sono due forme: isomeria di posizione e isomeria di catena. La stereoisomeria
CALCOLO COMBINATORIO
 CALCOLO COMBINATORIO 1 Modi di formare gruppi di k oggetti presi da n dati 11 disposizioni semplici, permutazioni Dati n oggetti distinti a 1,, a n si chiamano disposizioni semplici di questi oggetti,
CALCOLO COMBINATORIO 1 Modi di formare gruppi di k oggetti presi da n dati 11 disposizioni semplici, permutazioni Dati n oggetti distinti a 1,, a n si chiamano disposizioni semplici di questi oggetti,
Il Legame Chimico e la Struttura Molecolare
 A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
A.A.2016 2017 CCS-Biologia CCS-Scienze Geologiche 1 Il Legame Chimico e la Struttura Molecolare Energia di interazione di due atomi di idrogeno Cap 8. 1-7, 9, 10(a/b), 17-20, 27-28, 31-33, 37-40, 52, 93-96
13 La temperatura - 8. Il gas perfetto
 La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
La mole e l equazione del gas perfetto Tutto ciò che vediamo intorno a noi è composto di piccolissimi grani, che chiamiamo «molecole». Per esempio, il ghiaccio, l acqua liquida e il vapore acqueo sono
Legame covalente polare
 Legame covalente polare Nel caso di legame covalente omeopolare (H 2 o Cl 2 ) gli elettroni di legame sono equamente condivisi. Quando invece il legame è covalente eteropolare (HCl) gli elettroni di legame
Legame covalente polare Nel caso di legame covalente omeopolare (H 2 o Cl 2 ) gli elettroni di legame sono equamente condivisi. Quando invece il legame è covalente eteropolare (HCl) gli elettroni di legame
Grandezze scalari e vettoriali
 Grandezze scalari e vettoriali 01 - Grandezze scalari e grandezze vettoriali. Le grandezze fisiche, gli oggetti di cui si occupa la fisica, sono grandezze misurabili. Altri enti che non sono misurabili
Grandezze scalari e vettoriali 01 - Grandezze scalari e grandezze vettoriali. Le grandezze fisiche, gli oggetti di cui si occupa la fisica, sono grandezze misurabili. Altri enti che non sono misurabili
( x) ( x) 0. Equazioni irrazionali
 Equazioni irrazionali Definizione: si definisce equazione irrazionale un equazione in cui compaiono uno o più radicali contenenti l incognita. Esempio 7 Ricordiamo quanto visto sulle condizioni di esistenza
Equazioni irrazionali Definizione: si definisce equazione irrazionale un equazione in cui compaiono uno o più radicali contenenti l incognita. Esempio 7 Ricordiamo quanto visto sulle condizioni di esistenza
Le proprietà periodiche degli elementi LA LEZIONE
 Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Le proprietà periodiche degli elementi LA LEZIONE Le proprietà degli elementi mostrano delle tendenze che possono essere predette usando il sistema periodico ed essere spiegate e comprese analizzando la
Per studio di funzione intendiamo un insieme di procedure che hanno lo scopo di analizzare le proprietà di una funzione f ( x) R R
 Studio di funzione Per studio di funzione intendiamo un insieme di procedure che hanno lo scopo di analizzare le proprietà di una funzione f ( x) R R : allo scopo di determinarne le caratteristiche principali.
Studio di funzione Per studio di funzione intendiamo un insieme di procedure che hanno lo scopo di analizzare le proprietà di una funzione f ( x) R R : allo scopo di determinarne le caratteristiche principali.
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
Usando il pendolo reversibile di Kater
 Usando il pendolo reversibile di Kater Scopo dell esperienza è la misurazione dell accelerazione di gravità g attraverso il periodo di oscillazione di un pendolo reversibile L accelerazione di gravità
Usando il pendolo reversibile di Kater Scopo dell esperienza è la misurazione dell accelerazione di gravità g attraverso il periodo di oscillazione di un pendolo reversibile L accelerazione di gravità
Psicometria (8 CFU) Corso di Laurea triennale STANDARDIZZAZIONE
 Psicometria (8 CFU) Corso di Laurea triennale Un punteggio all interno di una distribuzione è in realtà privo di significato se preso da solo. Sapere che un soggetto ha ottenuto un punteggio x=52 in una
Psicometria (8 CFU) Corso di Laurea triennale Un punteggio all interno di una distribuzione è in realtà privo di significato se preso da solo. Sapere che un soggetto ha ottenuto un punteggio x=52 in una
Q 1 = +3 10-5 C carica numero 1 Q 2 = +4 10-5 C carica numero 2 forza esercitata tra le cariche distanza tra le cariche, incognita
 Problema n 1 A quale distanza, una dall'altra bisogna porre nel vuoto due cariche (Q 1 =3 10-5 C e Q 2 =4 10-5 C) perché esse esercitino una sull'altra la forza di 200 N? Q 1 = +3 10-5 C carica numero
Problema n 1 A quale distanza, una dall'altra bisogna porre nel vuoto due cariche (Q 1 =3 10-5 C e Q 2 =4 10-5 C) perché esse esercitino una sull'altra la forza di 200 N? Q 1 = +3 10-5 C carica numero
Dimensione di uno Spazio vettoriale
 Capitolo 4 Dimensione di uno Spazio vettoriale 4.1 Introduzione Dedichiamo questo capitolo ad un concetto fondamentale in algebra lineare: la dimensione di uno spazio vettoriale. Daremo una definizione
Capitolo 4 Dimensione di uno Spazio vettoriale 4.1 Introduzione Dedichiamo questo capitolo ad un concetto fondamentale in algebra lineare: la dimensione di uno spazio vettoriale. Daremo una definizione
LEZIONE 7. Esercizio 7.1. Quale delle seguenti funzioni è decrescente in ( 3, 0) e ha derivata prima in 3 che vale 0? x 3 3 + x2. 2, x3 +2x +3.
 7 LEZIONE 7 Esercizio 7.1. Quale delle seguenti funzioni è decrescente in ( 3, 0) e ha derivata prima in 3 che vale 0? x 3 3 + x2 2 6x, x3 +2x 2 6x, 3x + x2 2, x3 +2x +3. Le derivate sono rispettivamente,
7 LEZIONE 7 Esercizio 7.1. Quale delle seguenti funzioni è decrescente in ( 3, 0) e ha derivata prima in 3 che vale 0? x 3 3 + x2 2 6x, x3 +2x 2 6x, 3x + x2 2, x3 +2x +3. Le derivate sono rispettivamente,
Epoca k Rata Rk Capitale Ck interessi Ik residuo Dk Ek 0 S 0 1 C1 Ik=i*S Dk=S-C1. n 0 S
 L AMMORTAMENTO Gli ammortamenti sono un altra apllicazione delle rendite. Il prestito è un operazione finanziaria caratterizzata da un flusso di cassa positivo (mi prendo i soldi in prestito) seguito da
L AMMORTAMENTO Gli ammortamenti sono un altra apllicazione delle rendite. Il prestito è un operazione finanziaria caratterizzata da un flusso di cassa positivo (mi prendo i soldi in prestito) seguito da
Geometria molecolare
 Geometria molecolare Le molecole possono essere rappresentate disponendo gli atomi in posizioni definite nello spazio in modo da costruire una figura geometrica Il modo più semplice per assegnare la geometria
Geometria molecolare Le molecole possono essere rappresentate disponendo gli atomi in posizioni definite nello spazio in modo da costruire una figura geometrica Il modo più semplice per assegnare la geometria
ESEMPIO 1: eseguire il complemento a 10 di 765
 COMPLEMENTO A 10 DI UN NUMERO DECIMALE Sia dato un numero N 10 in base 10 di n cifre. Il complemento a 10 di tale numero (N ) si ottiene sottraendo il numero stesso a 10 n. ESEMPIO 1: eseguire il complemento
COMPLEMENTO A 10 DI UN NUMERO DECIMALE Sia dato un numero N 10 in base 10 di n cifre. Il complemento a 10 di tale numero (N ) si ottiene sottraendo il numero stesso a 10 n. ESEMPIO 1: eseguire il complemento
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG
 a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG 27/4/2006 Cuore come dipolo elettrico Il cuore considerato come un generatore elettrico complesso, in cui sono presenti
a.a. 2005/2006 Laurea Specialistica in Fisica Corso di Fisica Medica 1 Utilizzo ECG 27/4/2006 Cuore come dipolo elettrico Il cuore considerato come un generatore elettrico complesso, in cui sono presenti
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B
 Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
Laura Beata Classe 4 B Concorso Sperimento Anch io Silvia Valesano Classe 4 B RELAZINI DI LABRATRI (Italiano) Titolo: : Cosa mangiamo veramente? Scopo: 1. Scoprire in quali alimenti ci sono o non ci sono
I sistemi di numerazione
 I sistemi di numerazione 01-INFORMAZIONE E SUA RAPPRESENTAZIONE Sia dato un insieme finito di caratteri distinti, che chiameremo alfabeto. Utilizzando anche ripetutamente caratteri di un alfabeto, si possono
I sistemi di numerazione 01-INFORMAZIONE E SUA RAPPRESENTAZIONE Sia dato un insieme finito di caratteri distinti, che chiameremo alfabeto. Utilizzando anche ripetutamente caratteri di un alfabeto, si possono
3 GRAFICI DI FUNZIONI
 3 GRAFICI DI FUNZIONI Particolari sottoinsiemi di R che noi studieremo sono i grafici di funzioni. Il grafico di una funzione f (se non è specificato il dominio di definizione) è dato da {(x, y) : x dom
3 GRAFICI DI FUNZIONI Particolari sottoinsiemi di R che noi studieremo sono i grafici di funzioni. Il grafico di una funzione f (se non è specificato il dominio di definizione) è dato da {(x, y) : x dom
Tipi di reazioni. Reazioni chimiche. Di dissociazione. Di sintesi. Di semplice scambio. Di doppio scambio. Reazioni complesse
 Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
Tipi di reazioni Le reazioni chimiche vengono tradizionalmente classificate a seconda del tipo di trasformazione subita dai reagenti: Reazioni chimiche possono essere Di dissociazione Una sostanza subisce
DOMINIO E LIMITI. Esercizio 3 Studiare gli insiemi di livello della funzione f, nei seguenti casi: 1) f(x,y) = y2 x 2 + y 2.
 FUNZIONI DI DUE VARIABILI 1 DOMINIO E LIMITI Domini e disequazioni in due variabili. Insiemi di livello. Elementi di topologia (insiemi aperti, chiusi, limitati, convessi, connessi per archi; punti di
FUNZIONI DI DUE VARIABILI 1 DOMINIO E LIMITI Domini e disequazioni in due variabili. Insiemi di livello. Elementi di topologia (insiemi aperti, chiusi, limitati, convessi, connessi per archi; punti di
Relazioni statistiche: regressione e correlazione
 Relazioni statistiche: regressione e correlazione È detto studio della connessione lo studio si occupa della ricerca di relazioni fra due variabili statistiche o fra una mutabile e una variabile statistica
Relazioni statistiche: regressione e correlazione È detto studio della connessione lo studio si occupa della ricerca di relazioni fra due variabili statistiche o fra una mutabile e una variabile statistica
Classificazione della materia: Sostanze pure e miscugli
 Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
Classificazione della materia: Sostanze pure e miscugli la composizione e quindi le proprietà intensive sono le stesse in ogni parte del sistema La composizione e le proprietà intensive variano da una
RAPPRESENTAZIONE BINARIA DEI NUMERI. Andrea Bobbio Anno Accademico 1996-1997
 1 RAPPRESENTAZIONE BINARIA DEI NUMERI Andrea Bobbio Anno Accademico 1996-1997 Numeri Binari 2 Sistemi di Numerazione Il valore di un numero può essere espresso con diverse rappresentazioni. non posizionali:
1 RAPPRESENTAZIONE BINARIA DEI NUMERI Andrea Bobbio Anno Accademico 1996-1997 Numeri Binari 2 Sistemi di Numerazione Il valore di un numero può essere espresso con diverse rappresentazioni. non posizionali:
La distribuzione Normale. La distribuzione Normale
 La Distribuzione Normale o Gaussiana è la distribuzione più importante ed utilizzata in tutta la statistica La curva delle frequenze della distribuzione Normale ha una forma caratteristica, simile ad una
La Distribuzione Normale o Gaussiana è la distribuzione più importante ed utilizzata in tutta la statistica La curva delle frequenze della distribuzione Normale ha una forma caratteristica, simile ad una
Ottimizazione vincolata
 Ottimizazione vincolata Ricordiamo alcuni risultati provati nella scheda sulla Teoria di Dini per una funzione F : R N+M R M di classe C 1 con (x 0, y 0 ) F 1 (a), a = (a 1,, a M ), punto in cui vale l
Ottimizazione vincolata Ricordiamo alcuni risultati provati nella scheda sulla Teoria di Dini per una funzione F : R N+M R M di classe C 1 con (x 0, y 0 ) F 1 (a), a = (a 1,, a M ), punto in cui vale l
I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo
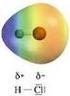 La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
La polarità I legami covalenti eteronucleari spostano la carica del legame sull atomo più elettronegativo L elettronegatività è il parametro di riferimento utilizzato per valutare il trasferimento di carica
ESERCIZI DI ALGEBRA LINEARE E GEOMETRIA
 ESERCIZI DI ALGEBRA LINEARE E GEOMETRIA Francesco Bottacin Padova, 24 febbraio 2012 Capitolo 1 Algebra Lineare 1.1 Spazi e sottospazi vettoriali Esercizio 1.1. Sia U il sottospazio di R 4 generato dai
ESERCIZI DI ALGEBRA LINEARE E GEOMETRIA Francesco Bottacin Padova, 24 febbraio 2012 Capitolo 1 Algebra Lineare 1.1 Spazi e sottospazi vettoriali Esercizio 1.1. Sia U il sottospazio di R 4 generato dai
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He. 2) L'acqua è:
 1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
1)Quale tra i seguenti elementi è un gas nobile? a. Si b. Mo c. Ge d. He 2) L'acqua è: a. una sostanza elementare b. un composto chimico c. una miscela omogenea d. una soluzione 3) Quale dei seguenti elementi
Le funzioni continue. A. Pisani Liceo Classico Dante Alighieri A.S. 2002-03. A. Pisani, appunti di Matematica 1
 Le funzioni continue A. Pisani Liceo Classico Dante Alighieri A.S. -3 A. Pisani, appunti di Matematica 1 Nota bene Questi appunti sono da intendere come guida allo studio e come riassunto di quanto illustrato
Le funzioni continue A. Pisani Liceo Classico Dante Alighieri A.S. -3 A. Pisani, appunti di Matematica 1 Nota bene Questi appunti sono da intendere come guida allo studio e come riassunto di quanto illustrato
Informatica Generale 02 - Rappresentazione numeri razionali
 Informatica Generale 02 - Rappresentazione numeri razionali Cosa vedremo: Rappresentazione binaria dei numeri razionali Rappresentazione in virgola fissa Rappresentazione in virgola mobile La rappresentazione
Informatica Generale 02 - Rappresentazione numeri razionali Cosa vedremo: Rappresentazione binaria dei numeri razionali Rappresentazione in virgola fissa Rappresentazione in virgola mobile La rappresentazione
MATEMATICA DEL DISCRETO elementi di teoria dei grafi. anno acc. 2009/2010
 elementi di teoria dei grafi anno acc. 2009/2010 Grafi semplici Un grafo semplice G è una coppia ordinata (V(G), L(G)), ove V(G) è un insieme finito e non vuoto di elementi detti vertici o nodi di G, mentre
elementi di teoria dei grafi anno acc. 2009/2010 Grafi semplici Un grafo semplice G è una coppia ordinata (V(G), L(G)), ove V(G) è un insieme finito e non vuoto di elementi detti vertici o nodi di G, mentre
Logica Numerica Approfondimento 1. Minimo Comune Multiplo e Massimo Comun Divisore. Il concetto di multiplo e di divisore. Il Minimo Comune Multiplo
 Logica Numerica Approfondimento E. Barbuto Minimo Comune Multiplo e Massimo Comun Divisore Il concetto di multiplo e di divisore Considerato un numero intero n, se esso viene moltiplicato per un numero
Logica Numerica Approfondimento E. Barbuto Minimo Comune Multiplo e Massimo Comun Divisore Il concetto di multiplo e di divisore Considerato un numero intero n, se esso viene moltiplicato per un numero
MODELLI ATOMICI. Modello Atomico di Dalton
 MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
MODELLI ATOMICI Gli atomi sono i piccoli mattoni che compongono la materia. Circa 2500 anni fa, il filosofo DEMOCRITO credeva che tutta la materia fosse costituita da piccole particelle che chiamò atomi.
Grandezze scalari e vettoriali
 Grandezze scalari e vettoriali Esempio vettore spostamento: Esistono due tipi di grandezze fisiche. a) Grandezze scalari specificate da un valore numerico (positivo negativo o nullo) e (nel caso di grandezze
Grandezze scalari e vettoriali Esempio vettore spostamento: Esistono due tipi di grandezze fisiche. a) Grandezze scalari specificate da un valore numerico (positivo negativo o nullo) e (nel caso di grandezze
Un gioco con tre dadi
 Un gioco con tre dadi Livello scolare: biennio Abilità interessate Costruire lo spazio degli eventi in casi semplici e determinarne la cardinalità. Valutare la probabilità in diversi contesti problematici.
Un gioco con tre dadi Livello scolare: biennio Abilità interessate Costruire lo spazio degli eventi in casi semplici e determinarne la cardinalità. Valutare la probabilità in diversi contesti problematici.
Basi di matematica per il corso di micro
 Basi di matematica per il corso di micro Microeconomia (anno accademico 2006-2007) Lezione del 21 Marzo 2007 Marianna Belloc 1 Le funzioni 1.1 Definizione Una funzione è una regola che descrive una relazione
Basi di matematica per il corso di micro Microeconomia (anno accademico 2006-2007) Lezione del 21 Marzo 2007 Marianna Belloc 1 Le funzioni 1.1 Definizione Una funzione è una regola che descrive una relazione
Matematica generale CTF
 Successioni numeriche 19 agosto 2015 Definizione di successione Monotonìa e limitatezza Forme indeterminate Successioni infinitesime Comportamento asintotico Criterio del rapporto per le successioni Definizione
Successioni numeriche 19 agosto 2015 Definizione di successione Monotonìa e limitatezza Forme indeterminate Successioni infinitesime Comportamento asintotico Criterio del rapporto per le successioni Definizione
Prof. Silvio Reato Valcavasia Ricerche. Il piano cartesiano
 Il piano cartesiano Per la rappresentazione di grafici su di un piano si utilizza un sistema di riferimento cartesiano. Su questo piano si rappresentano due rette orientate (con delle frecce all estremità
Il piano cartesiano Per la rappresentazione di grafici su di un piano si utilizza un sistema di riferimento cartesiano. Su questo piano si rappresentano due rette orientate (con delle frecce all estremità
La spirale iperbolica: Fu descritta per la prima volta da Pierre Varignon (1654-1722). L equazione, espressa in coordinate polari, è del tipo:
 Esistono delle forme geometriche che sono in grado, per complessi fattori psicologici non del tutto chiariti, di comunicarci un senso d equilibrio, di gradimento e di benessere. Tra queste analizzeremo
Esistono delle forme geometriche che sono in grado, per complessi fattori psicologici non del tutto chiariti, di comunicarci un senso d equilibrio, di gradimento e di benessere. Tra queste analizzeremo
RETI DI TELECOMUNICAZIONE
 RETI DI TELECOMUNICAZIONE SISTEMI M/G/1 e M/D/1 Sistemi M/G/1 Nei sistemi M/G/1: i clienti arrivano secondo un processo di Poisson con parametro λ i tempi di servizio hanno una distribuzione generale della
RETI DI TELECOMUNICAZIONE SISTEMI M/G/1 e M/D/1 Sistemi M/G/1 Nei sistemi M/G/1: i clienti arrivano secondo un processo di Poisson con parametro λ i tempi di servizio hanno una distribuzione generale della
IGiochidiArchimede-SoluzioniBiennio 22 novembre 2006
 PROGETTO OLIMPII I MTEMTI U.M.I. UNIONE MTEMTI ITLIN SUOL NORMLE SUPERIORE IGiochidirchimede-Soluzioniiennio novembre 006 Griglia delle risposte corrette Problema Risposta corretta E 4 5 6 7 8 9 E 0 Problema
PROGETTO OLIMPII I MTEMTI U.M.I. UNIONE MTEMTI ITLIN SUOL NORMLE SUPERIORE IGiochidirchimede-Soluzioniiennio novembre 006 Griglia delle risposte corrette Problema Risposta corretta E 4 5 6 7 8 9 E 0 Problema
Forze come grandezze vettoriali
 Forze come grandezze vettoriali L. Paolucci 23 novembre 2010 Sommario Esercizi e problemi risolti. Per la classe prima. Anno Scolastico 2010/11 Parte 1 / versione 2 Si ricordi che la risultante di due
Forze come grandezze vettoriali L. Paolucci 23 novembre 2010 Sommario Esercizi e problemi risolti. Per la classe prima. Anno Scolastico 2010/11 Parte 1 / versione 2 Si ricordi che la risultante di due
Sommario delle lezioni Legami chimici
 Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Sommario delle lezioni 8 9-10 Legami chimici Legami chimici Complessità molecolare I legami chimici possono portare alla formazione di molecole particolarmente complesse Acqua Glucosio Emoglobina H 2
Minicorso Regole di Disegno Meccanico
 Parte 3 Minicorso Regole di Disegno Meccanico di Andrea Saviano Tolleranze dimensionali di lavorazione Accoppiamenti mobili, stabili e incerti Giochi e interferenze Posizione della zona di tolleranza e
Parte 3 Minicorso Regole di Disegno Meccanico di Andrea Saviano Tolleranze dimensionali di lavorazione Accoppiamenti mobili, stabili e incerti Giochi e interferenze Posizione della zona di tolleranza e
Termodinamica: legge zero e temperatura
 Termodinamica: legge zero e temperatura Affrontiamo ora lo studio della termodinamica che prende in esame l analisi dell energia termica dei sistemi e di come tale energia possa essere scambiata, assorbita
Termodinamica: legge zero e temperatura Affrontiamo ora lo studio della termodinamica che prende in esame l analisi dell energia termica dei sistemi e di come tale energia possa essere scambiata, assorbita
Cenni sul calcolo combinatorio
 Cenni sul calcolo combinatorio Disposizioni semplici Le disposizioni semplici di n elementi distinti di classe k con kn sono tutti i gruppi di k elementi scelti fra gli n, che differiscono per almeno un
Cenni sul calcolo combinatorio Disposizioni semplici Le disposizioni semplici di n elementi distinti di classe k con kn sono tutti i gruppi di k elementi scelti fra gli n, che differiscono per almeno un
24 : 3 = 8 con resto 0 26 : 4 = 6 con resto 2
 Dati due numeri naturali a e b, diremo che a è divisibile per b se la divisione a : b è esatta, cioè con resto 0. In questo caso diremo anche che b è un divisore di a. 24 : 3 = 8 con resto 0 26 : 4 = 6
Dati due numeri naturali a e b, diremo che a è divisibile per b se la divisione a : b è esatta, cioè con resto 0. In questo caso diremo anche che b è un divisore di a. 24 : 3 = 8 con resto 0 26 : 4 = 6
Per lo svolgimento del corso risulta particolarmente utile considerare l insieme
 1. L insieme R. Per lo svolgimento del corso risulta particolarmente utile considerare l insieme R = R {, + }, detto anche retta reale estesa, che si ottiene aggiungendo all insieme dei numeri reali R
1. L insieme R. Per lo svolgimento del corso risulta particolarmente utile considerare l insieme R = R {, + }, detto anche retta reale estesa, che si ottiene aggiungendo all insieme dei numeri reali R
CORSO DI LAUREA IN INGEGNERIA.
 CORSO DI LAUREA IN INGEGNERIA. FOGLIO DI ESERCIZI 4 GEOMETRIA E ALGEBRA LINEARE 2010/11 Esercizio 4.1 (2.2). Determinare l equazione parametrica e Cartesiana della retta dello spazio (a) Passante per i
CORSO DI LAUREA IN INGEGNERIA. FOGLIO DI ESERCIZI 4 GEOMETRIA E ALGEBRA LINEARE 2010/11 Esercizio 4.1 (2.2). Determinare l equazione parametrica e Cartesiana della retta dello spazio (a) Passante per i
APPUNTI DI MATEMATICA ALGEBRA \ INSIEMISTICA \ TEORIA DEGLI INSIEMI (1)
 ALGEBRA \ INSIEMISTICA \ TEORIA DEGLI INSIEMI (1) Un insieme è una collezione di oggetti. Il concetto di insieme è un concetto primitivo. Deve esistere un criterio chiaro, preciso, non ambiguo, inequivocabile,
ALGEBRA \ INSIEMISTICA \ TEORIA DEGLI INSIEMI (1) Un insieme è una collezione di oggetti. Il concetto di insieme è un concetto primitivo. Deve esistere un criterio chiaro, preciso, non ambiguo, inequivocabile,
LA CORRELAZIONE LINEARE
 LA CORRELAZIONE LINEARE La correlazione indica la tendenza che hanno due variabili (X e Y) a variare insieme, ovvero, a covariare. Ad esempio, si può supporre che vi sia una relazione tra l insoddisfazione
LA CORRELAZIONE LINEARE La correlazione indica la tendenza che hanno due variabili (X e Y) a variare insieme, ovvero, a covariare. Ad esempio, si può supporre che vi sia una relazione tra l insoddisfazione
SISTEMI DI NUMERAZIONE E CODICI
 SISTEMI DI NUMERAZIONE E CODICI Il Sistema di Numerazione Decimale Il sistema decimale o sistema di numerazione a base dieci usa dieci cifre, dette cifre decimali, da O a 9. Il sistema decimale è un sistema
SISTEMI DI NUMERAZIONE E CODICI Il Sistema di Numerazione Decimale Il sistema decimale o sistema di numerazione a base dieci usa dieci cifre, dette cifre decimali, da O a 9. Il sistema decimale è un sistema
LA CORRENTE ELETTRICA
 L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
L CORRENTE ELETTRIC H P h Prima che si raggiunga l equilibrio c è un intervallo di tempo dove il livello del fluido non è uguale. Il verso del movimento del fluido va dal vaso a livello maggiore () verso
u 1 u k che rappresenta formalmente la somma degli infiniti numeri (14.1), ordinati al crescere del loro indice. I numeri u k
 Capitolo 4 Serie numeriche 4. Serie convergenti, divergenti, indeterminate Data una successione di numeri reali si chiama serie ad essa relativa il simbolo u +... + u +... u, u 2,..., u,..., (4.) oppure
Capitolo 4 Serie numeriche 4. Serie convergenti, divergenti, indeterminate Data una successione di numeri reali si chiama serie ad essa relativa il simbolo u +... + u +... u, u 2,..., u,..., (4.) oppure
INTEGRALI DEFINITI. Tale superficie viene detta trapezoide e la misura della sua area si ottiene utilizzando il calcolo di un integrale definito.
 INTEGRALI DEFINITI Sia nel campo scientifico che in quello tecnico si presentano spesso situazioni per affrontare le quali è necessario ricorrere al calcolo dell integrale definito. Vi sono infatti svariati
INTEGRALI DEFINITI Sia nel campo scientifico che in quello tecnico si presentano spesso situazioni per affrontare le quali è necessario ricorrere al calcolo dell integrale definito. Vi sono infatti svariati
Quando un composto ionico viene immesso in acqua si dissocia formando uno ione negativo ed uno positivo.
 I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
I composti chimici Il legame chimico Un atomo raggiunge la stabilità quando i suoi livelli energetici sono completi. Solamente i gas nobili hanno questa caratteristica mentre gli altri atomi no, per cui
La struttura di ioni e molecole
 La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
La struttura di ioni e molecole Inizialmente: consideriamo atomi che non danno espansione dell ottetto e non ci interessiamo della geometria delle molecole Alcune regole per individuare la posizione degli
