Lo sviluppo dei farmaci biologici e biosimilari e l innovazione nei processi produttivi biotecnologici. Francesco Scaglione, MD, PhD
|
|
|
- Gilda Costanzo
- 4 anni fa
- Visualizzazioni
Transcript
1 Lo sviluppo dei farmaci biologici e biosimilari e l innovazione nei processi produttivi biotecnologici Francesco Scaglione, MD, PhD Department of Oncology and Hemato-oncology Postgradute School of clinical pharmacology University of Milan Head of Clinical Pharmacology Unit Niguarda Ca Granda- Hospital Milan,Italy
2 Alcon (C,S) Amgen (C,S) Astellas Pharma (C,S) Astra-zeneca (C,S) Bayer (C, S) GlaxoSmithKline(C,S) Hospira (S) Janssen.(C,S) Johnson & Johnson ( C) Merck (C,S) Novartis (S) Pfizer (R,C,S) Pharmafin (C) Pierre Fabre (C,R) Roche (S) Sanofi-Aventis (R,S ) Teva (S) Disclosures C = Consultation/Advisory; S = Speaker; R = Research Contract/Grant.
3 Come si produce un farmaco biotecnologico? E un processo complesso che avviene attraverso una sequenza di fasi comuni: - Definizione e sviluppo di una cellula ospite - Creazione di una banca cellulare - Fermentazione - Purificazione della proteina - Analisi qualitativa - Formulazione del prodotto - Conservazione European Medicines Agency. Files accessed October 12, Wojciechowski et al. In: Process Scale Bioseparations for the Biopharmaceutical Industry. 2007:508
4 Caratteristiche dei farmaci biotecnologici Le autorità regolatorie richiedono ai produttori di dimostrare: Controllo sul processo di produzione Capacità di produrre lotti consistenti tra loro Capacità di riprodurre lotti che rispondano alle specifiche del prodotto stabilite attraverso una dettagliata caratterizzazione. Qualsiasi cambio nel processo di produzione deve essere notificato e bisogna dimostrare l dentità del prodotto European Medicines Agency. Note for guidance on biotechnological/biological products subject to changes in their manufacturing process. 2005
5 Comparability assessment for biologics La variabilità da lotto a lotto è intrinseca per i prodotti biologici, nessun lotto è completamente identico a un altro Il processo di produzione cambia con la possibilità di migliorare il profilo di qualità La versione precedente e successiva al cambiamento del medicinale deve essere dimostrata comparabile attraverso un esercizio di comparabilità in linea con le raccomandazioni fornite nella linea guida EMA I produttori e i regolatori devono valutare l'impatto dei cambiamenti di processo - anche nel caso di biologici complessi
6 Schiestl M. et al, Nat Biotech, April 2011 Schneider C., Ann Rheum Dis March 2013 Vol 72 No 3 Manufacturing process changes are common for all biologics Rituximab assessment history available at EMA website 6
7 One process, one product Insulina Gh Filgrastim Eritropoetina MABs Figure adapted from Mellstedt et al. Ann Oncol. 2008;19:411.
8 Cellule di Ovaio di Hamster Cinese transfettate con il gene Umano
9 MAB:Processo multicellulare
10 Sviluppo di una cellula ospite La capacità di produrre e selezionare una linea cellulare animale ad elevata produzione è la chiave per iniziare lo sviluppo di un bioprocesso. Le cellule di ovaio di criceto cinese (CHO) sono diventate le cellule di mammifero standard impiegate nella produzione di proteine ricombinanti. Vantaggi delle CHO: Ben caratterizzate Facilmente transfettabili Possibilità di selezionare cloni ad elevata produzione Crescita rapida Elevata produzione proteica Stabilità dell espressione genica a lungo termine European Medicines Agency. Files accessed October 12, 2014 Wojciechowski et al. In: Process Scale Bioseparations for the Biopharmaceutical Industry. 2007:508..
11 Sviluppo di una cellula ospite - Identificazione della sequenza di DNA umano codificante per la proteina desiderata - Isolamento della sequenza di DNA e clonaggio in un vettore (plasmide) selezionato - Inserimento del vettore contenente il gene di interesse (trasfezione) nella cellula ospite che produrrà la proteina (una cellula batterica o eucariotica idonea) - L'esatta sequenza di DNA e il tipo di cellula ospite utilizzati influiranno sulle caratteristiche del prodotto European Medicines Agency. Files accessed October 12, 2014 Wojciechowski et al. In: Process Scale Bioseparations for the Biopharmaceutical Industry. 2007:508.
12 Expression vector (plasmid) Cell banking system Components of the Manufacturing Process Master Cell Bank (MCB) Working Cell Bank (WCB) End of Production Cells (EOP) Drug substance manufacturing and release Drug product formulation and release
13 Master Cell Bank (MCB) Linea cellulare ricombinante nella quale il gene che codifica per la proteina da isolare è stato stabilmente introdotto nel genoma delle cellule La stabilità e l integrità del gene costituiscono fattori critici (Polymerase Chain Reaction, sequenziamento, etc.) La MCB viene conservata congelata a -70 C (singolo vial) per preservarla da proliferazione incontrollata, mutazione o morte. Ogni vial costituisce l inoculo iniziale per produrre la Working Cell Bank (WCB). European Medicines Agency. Files accessed October 12, 2014 Wojciechowski et al. In: Process Scale Bioseparations for the Biopharmaceutical Industry. 2007:508.
14 Working Cell Bank (WCB) La Working Cell Bank costituisce una sottocoltura estratta da una MCB comune Da un vial di MCB possono essere ottenute diverse colture di WCB che vengono quindi congelate a -70 C Ogni vial di WCB viene utilizzato per produrre un lotto di prodotto ricombinante. MCB MCB sub-cultivation (enrichment) WCBs European Medicines Agency. Files accessed October 12, 2014 Wojciechowski et al. In: Process Scale Bioseparations for the Biopharmaceutical Industry. 2007:508.
15 Modalità di coltura e fermentazione Le colture di cellule animali crescono normalmente in bioreattori formati da recipienti in acciaio inossidabile provvisti di mescolatore. La capacità dei bioreattori è cresciuta progressivamente negli ultimi 20 anni con capacità che arrivano oggi a 20000L. European Medicines Agency. Files accessed October 12, 2014 Wojciechowski et al. In: Process Scale Bioseparations for the Biopharmaceutical Industry. 2007:508..
16 Characterization of Cell Banks (cont.) Test MCB WCB EPC Sterility (bacterial & fungal cont) X X X X X X Mycoplasma (cultivable/noncultivable) Adventitious virus X X Species-Specific X Retrovirus X X
17 Downstream Processing Upstream cell culture & fermentation Isolation/Capture of protein Purification Drug substance Formulation Drug Product
18 Schema riassuntivo del processo produttivo European Medicines Agency. Files accessed October 12, 2014.
19 Caratterizazione Del Prodotto Sicurezza Il prodotto medicinale per iniezione finale deve essere sterile Entro i limiti specificati per endotossine L'immunogenicità deve essere controllata e monitorata Purezza e caratterizzazione Le impurità correlate al prodotto e al processo e le sostanze correlate al prodotto devono essere entro i limiti specificati Identità Unico per proteine di interesse, particolarmente rilevante per proteine strettamente correlate prodotte nella stessa struttura
20 Fingerprinting mabs: orthogonal analytical/biologic methods to assess structure/function relationships 1. FDA. Guidance downloads: Biosimilars An Update. [Accessed June 2015].
21 Fonti di sostanze rilasciabili nel prodotto Siringhe / siringhe preriempite, ampolle, fiale, flaconi Sacche IV Borse di stoccaggio per prodotti intermedi Chiusure (tappi a vite, tappi di gomma) Liner per container (ad es. Rivestimenti per tubi) Attrezzatura per il trattamento: serbatoi / bioreattori in acciaio inossidabile tubi guarnizioni, valvole, anelli filtri resine di purificazione
22 22
23 What Is a Biosimilar? Un biosimilare è una "copia" di un biofarmaco disponibile in commercio (prodotto di riferimento) che non è più protetto da un brevetto che ha: Sottoposto a rigorosa valutazione analitica e clinica, rispetto al suo prodotto di riferimento E Approvato da un'agenzia regolatoria in base a un percorso specifico per la valutazione biosimilare Un biosimilare è "molto simile" al suo prodotto di riferimento nelle caratteristiche fisico-chimiche, nell'efficacia e nella sicurezza. Dörner T, et al. Ann Rheum Dis. 2016;75(6):
24 Biosimilars Are Not Seconda-Generazione (o Biobetter) Strutturalmente diverso dal biofarmaco con licenza originale Destinato a migliorare le prestazioni preservando il meccanismo di azione Esempi Infliximab e adalimumab Filgrastim e pegfilgrastim Non considerato come biosimilare Farmaci Generici Farmaci a piccole molecole, meno complessi dei biosimilari Il processo di produzione è di diversi ordini di grandezza meno complesso Regolamentato in base a normative diverse Woodcock J, et al. Nat Rev Drug Discov. 2007;6(6):
25 Produzione dei biosimilari Processo complesso di produzione basato sulle stesse procedure produttive dei biologici originator Stessi standard di qualità
26 Tempistica dello sviluppo di un farmaco biosimilare 1-1,5 anni Fase I: sviluppo di un clone di cellule ospiti Fase II: preparazione banche cellulari 1-1,5 anni Fase III: Sviluppo del processo - Fermentazione - Purificazione Fase IV: Produzione su ampia scala Fase V: Test di comparabilità - Caratterizzazione analitica Studi non clinici - studi clinici 3,5-4,5 anni anni.modifica da Schneider et al
27 27
28 Workshop 1 Linee guida EMA Studi Preclinici Studi clinici farmacocinetica e farmacodinamica Studi clinici di non inferiorità
29 5.1. Pharmacokinetics (PK) = step 1 The comparison of the pharmacokinetic properties of the biosimilar product and the reference medicinal product forms normally the first step of a biosimilar mab development Study design The primary objective of the pharmacokinetic studies performed to support a MAA for a biosimilar is to show comparability in pharmacokinetics of the biosimilar with the reference medicinal product in a sufficiently sensitive and homogeneous population. Healthy volunteers are likely to have less variability in PK as targetmediated clearance may be less important than in patients. Hence, if feasible, a single dose study in healthy volunteers is recommended, which could provide important information on biosimilarity. From a pharmacokinetic perspective, a single dose cross-over study with full characterisation of the PK profile, including the late elimination phase, is preferable. A parallel group design may be necessary due to the long half-life of mabs and the potential influence of immunogenicity. 29
30 Pharmacokinetic Reference Range FDA and EMA Requirements for Bioequivalence 125% 100% 80% Product A Bioequivalent Reference Drug Product B Not Bioequivalent Product A is bioequivalent to the reference drug; its 90% confidence interval of the AUC falls within 80% to 125% of the reference drug Product B is not bioequivalent to the reference drug; its 90% confidence interval of the AUC falls outside of 80% to 125% of the reference drug
31 Pharmacokinetics in humans of SB-3 compared to Herceptin EMA Assessment report Ontruzant 14 September 2017 EMA/CHMP/9855/
32 Summary statistics of PK parameters No subjects had positive results for ADAs at any time point after single intravenous infusion of SB3, EU trastuzumab, or US trastuzumab
33 Statistical Comparison of Secondary PK Parameters EMA Assessment report Ontruzant 14 September 2017 EMA/CHMP/9855/2018
34 Impact of Anti-drug antibodies (ADA) on PK parameters In the study SB3-G31-BC, within the PK population, one subject in the SB3 treatment group and no subject in the Herceptin treatment group were reported to have an ADA positive result up to Cycle 9. One subject had a positive result of ADA at Cycle 5 pre-dose and negative results at other time points. The serum trough concentration at Cycle 5 was relatively low at μg/ml but within the range of to μg/ml of the cycle. The trough concentrations (46.35 and μg/ml for Cycle 7 and Cycle 8, respectively) in the later cycles were similar to other subjects (ranging from to μg/ml and from to μg/ml for Cycle 7 and Cycle 8, respectively). Due to the low incidence of positive ADA results, the impact of the presence of ADA up to Cycle 9 on the PK cannot be compared.
35 Mean (± SD) serum concentrations of CT-P6 and US-licensed Herceptin versus time (hours)
36 Analysis of AUC0-last different biosimilar and Herceptin RATIO 90% Cl of ratio SB3/EU Herceptin ;1.034 PF /EU- Herceptin ;98.69 CT-P6/Herceptin ; EMA assessment report of Ontruzant, Trazimera,Herzuma
37 Pharmacokinetic Reference Range RATIO 90% Cl of ratio FDA and EMA Requirements for Bioequivalence SB3/EU Herceptin AUC last ;1.034 PF /EU- Herceptin ;98.69 CT-P6/Herceptin ; % 100% Reference Drug 80% SB-3 Bioequivalent PF Bioequivalent CT-P6 Bioequivalent
38 Bio-Creep Relative BA Interchangeable Not Interchangeable % 50 Relative BA 0 Biosimilar 1 innovator Biosimilar 2
39
40
Carlo Pini
 Carlo Pini (carlo.pini@iss.it) Centro Nazionale per la Ricerca e la Valutazione dei prodotti Immuno-biologici Istituto Superiore di Sanità Roma Delegato Italiano nominato dall AIFA al Biologics Working
Carlo Pini (carlo.pini@iss.it) Centro Nazionale per la Ricerca e la Valutazione dei prodotti Immuno-biologici Istituto Superiore di Sanità Roma Delegato Italiano nominato dall AIFA al Biologics Working
Biosimilari in Reumatologia
 Biosimilari in Reumatologia Carlomaurizio Montecucco Unità di Reumatologia Università di Pavia IRCCS Policlinico S. Matteo Agenti biologici approvati per l artrite reumatoide Biosimilare 2015 Infliximab
Biosimilari in Reumatologia Carlomaurizio Montecucco Unità di Reumatologia Università di Pavia IRCCS Policlinico S. Matteo Agenti biologici approvati per l artrite reumatoide Biosimilare 2015 Infliximab
Franco Silvestris UNIVERSITÀ DEGLI STUDI DI BARI
 UNIVERSITÀ DEGLI STUDI DI BARI Dipartimento di Scienze Biomediche e Oncologia Umana Sezione di Medicina Interna e Oncologia Clinica U.O.C. Oncologia Medica Universitaria Direttore: Franco Silvestris Franco
UNIVERSITÀ DEGLI STUDI DI BARI Dipartimento di Scienze Biomediche e Oncologia Umana Sezione di Medicina Interna e Oncologia Clinica U.O.C. Oncologia Medica Universitaria Direttore: Franco Silvestris Franco
Farmaci generici e biosimilari: certezze e dubbi Alessandro Mugelli Università di Firenze
 Farmaci generici e biosimilari: certezze e dubbi Alessandro Mugelli Università di Firenze Generici e prescrizione I dubbi, a volte i pregiudizi, che hanno accompagnato la loro introduzione in Italia
Farmaci generici e biosimilari: certezze e dubbi Alessandro Mugelli Università di Firenze Generici e prescrizione I dubbi, a volte i pregiudizi, che hanno accompagnato la loro introduzione in Italia
Centro Ricerca Interdipartimentale Farmacogenetica Farmacogenomica
 Armando A. Genazzani Università del Piemonte Orientale genazzani@pharm.unipmn.it 347.9829981 Centro Ricerca Interdipartimentale Farmacogenetica Farmacogenomica Conflict of interest disclosure on biosimilars
Armando A. Genazzani Università del Piemonte Orientale genazzani@pharm.unipmn.it 347.9829981 Centro Ricerca Interdipartimentale Farmacogenetica Farmacogenomica Conflict of interest disclosure on biosimilars
Farmaci di sintesi tradizionale Farmaci Biotecnologici Generici e Biosimilari
 Farmaci di sintesi tradizionale Farmaci Biotecnologici Generici e Biosimilari Farmaco di sintesi tradizionale ( small chemical entity ): definizione e caratteristiche È generalmente una molecola di piccole
Farmaci di sintesi tradizionale Farmaci Biotecnologici Generici e Biosimilari Farmaco di sintesi tradizionale ( small chemical entity ): definizione e caratteristiche È generalmente una molecola di piccole
I BIOSIMILARI TRA PROFILI BREVETTUALI E REGOLATORI 30 OTTOBRE 2015 PARMA MARINA MAURO
 I BIOSIMILARI TRA PROFILI BREVETTUALI E REGOLATORI 30 OTTOBRE 2015 PARMA MARINA MAURO INTRODUZIONE I farmaci I farmaci generici Bioequivalenza I farmaci generici equivalenti I farmaci biologici Biosimilarità
I BIOSIMILARI TRA PROFILI BREVETTUALI E REGOLATORI 30 OTTOBRE 2015 PARMA MARINA MAURO INTRODUZIONE I farmaci I farmaci generici Bioequivalenza I farmaci generici equivalenti I farmaci biologici Biosimilarità
Bioequivalenti e biosimilari: aspetti regolatori e loro impatto sull appropriatezza prescrittiva
 Bioequivalenti e biosimilari: aspetti regolatori e loro impatto sull appropriatezza prescrittiva Pierluigi Navarra Istituto di Farmacologia Facoltà di Medicina e Chirurgia Università Cattolica - Roma Analisi
Bioequivalenti e biosimilari: aspetti regolatori e loro impatto sull appropriatezza prescrittiva Pierluigi Navarra Istituto di Farmacologia Facoltà di Medicina e Chirurgia Università Cattolica - Roma Analisi
EMA ed esercizio di comparabilità: il metodologo. Michela Cinquini Istituto di Ricerche Farmacologiche Mario Negri IRCCS - Milano
 EMA ed esercizio di comparabilità: il metodologo Michela Cinquini Istituto di Ricerche Farmacologiche Mario Negri IRCCS - Milano EMA e definizione di BIOSIMILARE EMA. http://www.ema.europa.eu/../wc500176768.pdf
EMA ed esercizio di comparabilità: il metodologo Michela Cinquini Istituto di Ricerche Farmacologiche Mario Negri IRCCS - Milano EMA e definizione di BIOSIMILARE EMA. http://www.ema.europa.eu/../wc500176768.pdf
I biosimilari fra presente e futuro
 ANALISI DELLA PRESCRIZIONE FARMACEUTICA IN ITALIA presentazione del Rapporto Nazionale OsMed 2010 7 luglio 2011 aula Pocchiari I biosimilari fra presente e futuro Anna Maria Marata Lucia Magnano Che cos
ANALISI DELLA PRESCRIZIONE FARMACEUTICA IN ITALIA presentazione del Rapporto Nazionale OsMed 2010 7 luglio 2011 aula Pocchiari I biosimilari fra presente e futuro Anna Maria Marata Lucia Magnano Che cos
Sostituzione / Switch /associazioni
 Sostituzione / Switch /associazioni terapeutiche Vito Lorusso SIMILARE O EQUIVALENTE? BIOSIMILARI DEFINITI DA EMEA MOLECOLE SIMILI A UN FARMACO BIOLOGICO DI RIFERIMENTO CONFRONTABILI IN TERMINI DI QUALITÀ,
Sostituzione / Switch /associazioni terapeutiche Vito Lorusso SIMILARE O EQUIVALENTE? BIOSIMILARI DEFINITI DA EMEA MOLECOLE SIMILI A UN FARMACO BIOLOGICO DI RIFERIMENTO CONFRONTABILI IN TERMINI DI QUALITÀ,
Farmaci equivalenti: aspetti farmacologici
 Farmaci equivalenti: aspetti farmacologici Prof. Alberto Corsini Università degli Studi di Milano Definizione di medicinale generico/equivalente Un medicinale che ha la stessa composizione qualitativa
Farmaci equivalenti: aspetti farmacologici Prof. Alberto Corsini Università degli Studi di Milano Definizione di medicinale generico/equivalente Un medicinale che ha la stessa composizione qualitativa
EMA ed esercizio di comparabilità: il punto di vista clinico. Valter Torri IRCCS Istituto Mario Negri Milano
 EMA ed esercizio di comparabilità: il punto di vista clinico Valter Torri IRCCS Istituto Mario Negri Milano EMA 2012: i punti essenziali 1. The guiding principle is to demonstrate similar clinical efficacy
EMA ed esercizio di comparabilità: il punto di vista clinico Valter Torri IRCCS Istituto Mario Negri Milano EMA 2012: i punti essenziali 1. The guiding principle is to demonstrate similar clinical efficacy
UN INQUADRAMENTO. Armando Genazzani
 I BIOSIMILARI: UN INQUADRAMENTO Armando Genazzani Il processo produttivo di un farmaco biologico è complesso Differenze in diverse parti del processo Gene umano Vettore DNA Trasferimento in cellula ospite
I BIOSIMILARI: UN INQUADRAMENTO Armando Genazzani Il processo produttivo di un farmaco biologico è complesso Differenze in diverse parti del processo Gene umano Vettore DNA Trasferimento in cellula ospite
Diabete e biosimilari dell insulina: evidenze cliniche
 Diabete e biosimilari dell insulina: evidenze cliniche Francesco Rossi I progressi in farmacologia: le biotecnologie 1 La crescita dell industria biotech in Italia Anche in Italia, l industria biotecnologica
Diabete e biosimilari dell insulina: evidenze cliniche Francesco Rossi I progressi in farmacologia: le biotecnologie 1 La crescita dell industria biotech in Italia Anche in Italia, l industria biotecnologica
FARMACI BIOLOGICI vs FARMACI BIOEQUIVALENTI
 FARMACI BIOLOGICI vs FARMACI BIOEQUIVALENTI nelle Malattie Infiammatorie Croniche Intestinali Dr.ssa Valentina CASINI ASST Bergamo EST Bolognini Seriate (BG) FARMACO BIOLOGICO FARMACO BIOSIMILARE DI COSA
FARMACI BIOLOGICI vs FARMACI BIOEQUIVALENTI nelle Malattie Infiammatorie Croniche Intestinali Dr.ssa Valentina CASINI ASST Bergamo EST Bolognini Seriate (BG) FARMACO BIOLOGICO FARMACO BIOSIMILARE DI COSA
SCHEDA FARMACO BIOSIMILARE
 SCHEDA FARMACO BIOSIMILARE (a cura del Coordinamento HTA) Farmaco biosimilare Nome commerciale (ditta, data di approvazione EMA) Farmaco biologico di riferimento (ditta) CT-P10 (RITUXIMAB) Truxima Ditta:
SCHEDA FARMACO BIOSIMILARE (a cura del Coordinamento HTA) Farmaco biosimilare Nome commerciale (ditta, data di approvazione EMA) Farmaco biologico di riferimento (ditta) CT-P10 (RITUXIMAB) Truxima Ditta:
ALESSANDRO NOBILI LUCA PASINA EVIDENZE CLINICHE DI BIOSIMILARITA
 Evento formativo sulla promozione d uso dei farmaci a brevetto scaduto in particolare nel campo dei farmaci biotecnologici ALESSANDRO NOBILI LUCA PASINA EVIDENZE CLINICHE DI BIOSIMILARITA Milano, 25 Marzo
Evento formativo sulla promozione d uso dei farmaci a brevetto scaduto in particolare nel campo dei farmaci biotecnologici ALESSANDRO NOBILI LUCA PASINA EVIDENZE CLINICHE DI BIOSIMILARITA Milano, 25 Marzo
DELIBERAZIONE N. 20/5 DEL
 Oggetto: Direttive alle Aziende Sanitarie per l espletamento delle gare per l approvvigionamento di farmaci ed emoderivati relativamente ai farmaci biosimilari. L Assessore dell Igiene e Sanità e dell
Oggetto: Direttive alle Aziende Sanitarie per l espletamento delle gare per l approvvigionamento di farmaci ed emoderivati relativamente ai farmaci biosimilari. L Assessore dell Igiene e Sanità e dell
UNIVERSITA' DEGLI STUDI DELLA BASILICATA DIPARTIMENTO DI SCIENZE
 Insegnamento: Biotecnologie genetiche Corso di studio: Anno di Corso: Periodo didattico: Tipologia: Totale Crediti: Tipo Esame: Valutazione: Lingua di insegnamento: Laurea in Biotecnologie (L2) III I semestre
Insegnamento: Biotecnologie genetiche Corso di studio: Anno di Corso: Periodo didattico: Tipologia: Totale Crediti: Tipo Esame: Valutazione: Lingua di insegnamento: Laurea in Biotecnologie (L2) III I semestre
STRUTTURA DEL DOSSIER (Allegato 1 del Decreto del Presidente dell'istituto superiore di sanità del 26 aprile 2002)
 STRUTTURA DEL DOSSIER (Allegato 1 del Decreto del Presidente dell'istituto superiore di sanità del 26 aprile 2002) Indirizzo La domanda, così come ogni altra corrispondenza successiva, dovrà essere inviata
STRUTTURA DEL DOSSIER (Allegato 1 del Decreto del Presidente dell'istituto superiore di sanità del 26 aprile 2002) Indirizzo La domanda, così come ogni altra corrispondenza successiva, dovrà essere inviata
Evento formativo sulla promozione d uso dei farmaci a brevetto scaduto in particolare nel campo dei farmaci biotecnologici
 Evento formativo sulla promozione d uso dei farmaci a brevetto scaduto in particolare nel campo dei farmaci biotecnologici ALESSANDRO NOBILI LUCA PASINA EVIDENZE CLINICHE DI BIOSIMILARITA 1 2 Il Ruolo
Evento formativo sulla promozione d uso dei farmaci a brevetto scaduto in particolare nel campo dei farmaci biotecnologici ALESSANDRO NOBILI LUCA PASINA EVIDENZE CLINICHE DI BIOSIMILARITA 1 2 Il Ruolo
Relatore: Dott.ssa Elisabetta Pasi - Servizio Assistenza Territoriale, Direzione Generale Sanità e Politiche Sociali- Regione Emilia-Romagna
 Le decisioni pratiche tra normative, linee guida e raccomandazioni, il position paper di AIFA, l intercambiabilità e la sostituibilità di originator e biosimilari Relatore: Dott.ssa Elisabetta Pasi - Servizio
Le decisioni pratiche tra normative, linee guida e raccomandazioni, il position paper di AIFA, l intercambiabilità e la sostituibilità di originator e biosimilari Relatore: Dott.ssa Elisabetta Pasi - Servizio
Quanto la selezione delle pazienti e la scelta dell endpoint primario possono influenzare i risultati? Lo studio CEREBEL
 Quanto la selezione delle pazienti e la scelta dell endpoint primario possono influenzare i risultati? Lo studio CEREBEL Massimo Di Maio Unità Sperimentazioni Cliniche Istituto Nazionale Tumori Fondazione
Quanto la selezione delle pazienti e la scelta dell endpoint primario possono influenzare i risultati? Lo studio CEREBEL Massimo Di Maio Unità Sperimentazioni Cliniche Istituto Nazionale Tumori Fondazione
Centro Ricerca Interdipartimentale Farmacogenetica Farmacogenomica
 Armando A. Genazzani Università del Piemonte Orientale genazzani@pharm.unipmn.it 347.9829981 Centro Ricerca Interdipartimentale Farmacogenetica Farmacogenomica Principi generali del comparability exercise
Armando A. Genazzani Università del Piemonte Orientale genazzani@pharm.unipmn.it 347.9829981 Centro Ricerca Interdipartimentale Farmacogenetica Farmacogenomica Principi generali del comparability exercise
Follow-up e programmi di screening: Raccomandazioni europee e questioni aperte. Carlo Senore
 Follow-up e programmi di screening: Raccomandazioni europee e questioni aperte Carlo Senore Abbiamo un approccio standardizzato e condiviso? NO Adenoma a basso rischio Adenoma a rischio intermedio Adenoma
Follow-up e programmi di screening: Raccomandazioni europee e questioni aperte Carlo Senore Abbiamo un approccio standardizzato e condiviso? NO Adenoma a basso rischio Adenoma a rischio intermedio Adenoma
MEDICINALI BIOEQUIVALENTI E BIOSIMILARI. Dipartimento Farmaceutico Interaziendale Azienda Ospedaliero Universitaria di Ferrara
 MEDICINALI BIOEQUIVALENTI E BIOSIMILARI Dipartimento Farmaceutico Interaziendale Azienda Ospedaliero Universitaria di Ferrara FARMACO GENERICO e EQUIVALENTE Con la Legge 28/12/1995 art. 130 comma 3, il
MEDICINALI BIOEQUIVALENTI E BIOSIMILARI Dipartimento Farmaceutico Interaziendale Azienda Ospedaliero Universitaria di Ferrara FARMACO GENERICO e EQUIVALENTE Con la Legge 28/12/1995 art. 130 comma 3, il
GENERICI E BIOSIMILARI A CONFRONTO: PROBLEMATICHE FARMACOLOGICHE E REGOLATORIE
 XXXI CONGRESSO NAZIONALE SIFO CAGLIARI 6-8 OTTOBRE 2010 GENERICI E BIOSIMILARI A CONFRONTO: PROBLEMATICHE FARMACOLOGICHE E REGOLATORIE DOTT.ssa ENRICA MARIA PROLI DOTT.ssa ELENA JACOBONI COSA SONO I FARMACI
XXXI CONGRESSO NAZIONALE SIFO CAGLIARI 6-8 OTTOBRE 2010 GENERICI E BIOSIMILARI A CONFRONTO: PROBLEMATICHE FARMACOLOGICHE E REGOLATORIE DOTT.ssa ENRICA MARIA PROLI DOTT.ssa ELENA JACOBONI COSA SONO I FARMACI
È opportuno introdurre una chiara indicazione sull etichettatura del farmaco per assicurare un informazione trasparente sul medicinale utilizzato.
 I biosimilari La posizione delle Aziende farmaceutiche Executive summary I farmaci biosimilari usati in modo appropriato possono essere uno strumento per liberare risorse da allocare per un rapido e universale
I biosimilari La posizione delle Aziende farmaceutiche Executive summary I farmaci biosimilari usati in modo appropriato possono essere uno strumento per liberare risorse da allocare per un rapido e universale
Biosimilari: Opportunità o Cautela?
 XVII Congresso Nazionale CIPOMO NH Hotel V. Vittorio Veneto,Roma Biosimilari: Opportunità o Cautela? Francesco Di Costanzo SC Oncologia Medica Azienda Ospedaliro Universitaria Careggi Firenze Roma,20-22
XVII Congresso Nazionale CIPOMO NH Hotel V. Vittorio Veneto,Roma Biosimilari: Opportunità o Cautela? Francesco Di Costanzo SC Oncologia Medica Azienda Ospedaliro Universitaria Careggi Firenze Roma,20-22
L esperienza clinica con il biosimilare in Italia. Paolo Lionetti
 L esperienza clinica con il biosimilare in Italia Paolo Lionetti EMA Recommendation for infliximab biosimilars Remsima and Inflectra are biosimilar to infliximab Same non-proprietary name Randomized controlled
L esperienza clinica con il biosimilare in Italia Paolo Lionetti EMA Recommendation for infliximab biosimilars Remsima and Inflectra are biosimilar to infliximab Same non-proprietary name Randomized controlled
I FARMACI ANTICOAGULANTI
 I FARMACI ANTICOAGULANTI ORIANA PAOLETTI Laboratorio Analisi Chimico-Cliniche E Microbiologiche CENTRO EMOSTASI E TROMBOSI Istituti Ospitalieri di Cremona FARMACI ANTICOAGULANTI J.W. Eikelboom, Circulation
I FARMACI ANTICOAGULANTI ORIANA PAOLETTI Laboratorio Analisi Chimico-Cliniche E Microbiologiche CENTRO EMOSTASI E TROMBOSI Istituti Ospitalieri di Cremona FARMACI ANTICOAGULANTI J.W. Eikelboom, Circulation
Michela Franzin. Servizio di Farmacia. IRCCS Ospedale San Raffaele
 Michela Franzin Servizio di Farmacia IRCCS Ospedale San Raffaele La quota di mercato dei farmaci biologici con brevetto in scadenza tra il 2015 ed il 2020 è rilevante Potenziale risparmio derivante dalla
Michela Franzin Servizio di Farmacia IRCCS Ospedale San Raffaele La quota di mercato dei farmaci biologici con brevetto in scadenza tra il 2015 ed il 2020 è rilevante Potenziale risparmio derivante dalla
CLASSICHE GENETICA BIOTECNOLOGIE MODERNE BIOLOGIA CELLULARE TECNOLOGIA DEL DNA RICOMBINANTE INGEGNERIA GENETICA
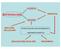 CLASSICHE BIOTECNOLOGIE GENETICA MODERNE BIOLOGIA CELLULARE TECNOLOGIA DEL DNA RICOMBINANTE INGEGNERIA GENETICA BIOLOGIA MOLECOLARE BIOCHIMICA CREAZIONE A FINI MEDICI DI MICRO-ORGANISMI GENETICAMENTE MODIFICATI
CLASSICHE BIOTECNOLOGIE GENETICA MODERNE BIOLOGIA CELLULARE TECNOLOGIA DEL DNA RICOMBINANTE INGEGNERIA GENETICA BIOLOGIA MOLECOLARE BIOCHIMICA CREAZIONE A FINI MEDICI DI MICRO-ORGANISMI GENETICAMENTE MODIFICATI
I BIOSIMILARI LA POSIZIONE DELLE AZIENDE FARMACEUTICHE
 I BIOSIMILARI LA POSIZIONE DELLE AZIENDE FARMACEUTICHE EXECUTIVE SUMMARY Con oltre 7.000 farmaci in fase avanzata di sviluppo per diverse malattie, l innovazione farmacologica offrirà a breve molte nuove
I BIOSIMILARI LA POSIZIONE DELLE AZIENDE FARMACEUTICHE EXECUTIVE SUMMARY Con oltre 7.000 farmaci in fase avanzata di sviluppo per diverse malattie, l innovazione farmacologica offrirà a breve molte nuove
ALESSANDRO NOBILI LUCA PASINA EVIDENZE CLINICHE DI BIOSIMILARITA
 Evento formativo sulla promozione d uso dei farmaci a brevetto scaduto in particolare nel campo dei farmaci biotecnologici ALESSANDRO NOBILI LUCA PASINA EVIDENZE CLINICHE DI BIOSIMILARITA Il Ruolo del
Evento formativo sulla promozione d uso dei farmaci a brevetto scaduto in particolare nel campo dei farmaci biotecnologici ALESSANDRO NOBILI LUCA PASINA EVIDENZE CLINICHE DI BIOSIMILARITA Il Ruolo del
Farmaci originator, biosimilari e Antitrust
 I biosimilari, il rispetto delle regole e la competition Francesco Mazza Direttore della Direzione Legale, Fiscale e Compliance Milano, 30 maggio 2017 Il valore industriale della farmaceutica in Italia
I biosimilari, il rispetto delle regole e la competition Francesco Mazza Direttore della Direzione Legale, Fiscale e Compliance Milano, 30 maggio 2017 Il valore industriale della farmaceutica in Italia
Qualità dei medicinali biologici e biotecnologici:
 Qualità dei medicinali biologici e biotecnologici: Prospettive ed evoluzione del concetto di comparabilità e biosimilarità ( generici biotecnologici ) Carlo Pini, Istituto Superiore di Sanità Istituto
Qualità dei medicinali biologici e biotecnologici: Prospettive ed evoluzione del concetto di comparabilità e biosimilarità ( generici biotecnologici ) Carlo Pini, Istituto Superiore di Sanità Istituto
Biosimilari, bioequivalenti e farmaci a brevetto scaduto: impiego in oncologia medica. Indicazioni, raccomandazioni ed efficacia
 Monza 22 novembre 2014 Biosimilari, bioequivalenti e farmaci a brevetto scaduto: impiego in oncologia medica. Indicazioni, raccomandazioni ed efficacia D. Cortinovis S.C. Oncologia Medica H S. Gerardo
Monza 22 novembre 2014 Biosimilari, bioequivalenti e farmaci a brevetto scaduto: impiego in oncologia medica. Indicazioni, raccomandazioni ed efficacia D. Cortinovis S.C. Oncologia Medica H S. Gerardo
BIOSIMILARI IN ONCOLOGIA UNA PROSPETTIVA PER IL FUTURO 23 Gennaio 2018
 1 Il Punto di vista del Farmacista Dott. Vito Ladisa Direttore sc Farmacia Fondazione IRCCS Istituto Nazionale Tumori Milano 2 SOSTENIBILITA SSN INNOVAZIONE 3 Will Pharmacists Fuel Biosimilars? Biosimilars
1 Il Punto di vista del Farmacista Dott. Vito Ladisa Direttore sc Farmacia Fondazione IRCCS Istituto Nazionale Tumori Milano 2 SOSTENIBILITA SSN INNOVAZIONE 3 Will Pharmacists Fuel Biosimilars? Biosimilars
A COSA SERVE il CLONAGGIO del DNA?? COME FUNZIONA il CLONAGGIO del DNA? COME FUNZIONA il CLONAGGIO del DNA?
 A COSA SERVE il CLONAGGIO del DNA?? CREARE COPIE IDENTICHE (= CLONI) DI UN FRAMMENTO DI DNA DIFFERENZE con la PCR: è una reazione in vivo sfrutta l apparato di replicazione del DNA della cellula ospite
A COSA SERVE il CLONAGGIO del DNA?? CREARE COPIE IDENTICHE (= CLONI) DI UN FRAMMENTO DI DNA DIFFERENZE con la PCR: è una reazione in vivo sfrutta l apparato di replicazione del DNA della cellula ospite
Corso di Laurea Magistrale in Farmacia
 Universita degli Studi di Milano Corso di Laurea Magistrale in Farmacia Medicinali Generici Dott. Vittorino Ravelli Orange Book La sostituibilità secondo l Orange Book Vittorino Ravelli Cos è l Orange
Universita degli Studi di Milano Corso di Laurea Magistrale in Farmacia Medicinali Generici Dott. Vittorino Ravelli Orange Book La sostituibilità secondo l Orange Book Vittorino Ravelli Cos è l Orange
Originator e biosimilari: interscambiabilità, sostituibilità e aspetti normativi
 Originator e biosimilari: interscambiabilità, sostituibilità e aspetti normativi Giambattista Bonanno Sezione di Farmacologia e Tossicologia Dipartimento di Farmacia Scuola di Scienze Mediche e Farmaceutiche
Originator e biosimilari: interscambiabilità, sostituibilità e aspetti normativi Giambattista Bonanno Sezione di Farmacologia e Tossicologia Dipartimento di Farmacia Scuola di Scienze Mediche e Farmaceutiche
REGOLAZIONE DELL ESPRESSIONE GENICA. Controllo trascrizionale in E. coli. Esempio: Lac operon
 REGOLAZIONE DELL ESPRESSIONE GENICA Controllo trascrizionale in E. coli Esempio: Lac operon Nel genoma di un batterio ci sono circa 4000 geni Nel genoma umano ci sono circa 25000 geni. Espressione costitutiva:
REGOLAZIONE DELL ESPRESSIONE GENICA Controllo trascrizionale in E. coli Esempio: Lac operon Nel genoma di un batterio ci sono circa 4000 geni Nel genoma umano ci sono circa 25000 geni. Espressione costitutiva:
Sfide ed opportunità per il settore farmaceutico Rimini, 10 Giugno Riccardo Palmisano. Vice Presidente Esecutivo Assobiotec
 Quali opportunità dalle biotecnologie per il futuro dell'industria farmaceutica? Sfide ed opportunità per il settore farmaceutico Rimini, 10 Giugno 2011 Riccardo Palmisano Vice Presidente Esecutivo Assobiotec
Quali opportunità dalle biotecnologie per il futuro dell'industria farmaceutica? Sfide ed opportunità per il settore farmaceutico Rimini, 10 Giugno 2011 Riccardo Palmisano Vice Presidente Esecutivo Assobiotec
Centro Ricerca Interdipartimentale Farmacogenetica Farmacogenomica
 Armando A. Genazzani Università del Piemonte Orientale genazzani@pharm.unipmn.it 347.9829981 Centro Ricerca Interdipartimentale Farmacogenetica Farmacogenomica Siamo partiti da questo La Repubblica 24
Armando A. Genazzani Università del Piemonte Orientale genazzani@pharm.unipmn.it 347.9829981 Centro Ricerca Interdipartimentale Farmacogenetica Farmacogenomica Siamo partiti da questo La Repubblica 24
1. Medicinali di terapia cellulare somatica e medicinali di ingegneria tissutale
 Allegato 1 1. Medicinali di terapia cellulare somatica e medicinali di ingegneria tissutale La sostanza attiva del medicinale è rappresentata da cellule e/o tessuti prodotti dall ingegneria cellulare o
Allegato 1 1. Medicinali di terapia cellulare somatica e medicinali di ingegneria tissutale La sostanza attiva del medicinale è rappresentata da cellule e/o tessuti prodotti dall ingegneria cellulare o
Armando Genazzani Dipartimento di Scienze del Farmaco Università del Piemonte Orientale V EDIZIONE MASTER
 Armando Genazzani Dipartimento di Scienze del Farmaco Università del Piemonte Orientale V EDIZIONE MASTER DISCIPLINE REGOLATORIE MARKET ACCESS IN AMBITO FARMACEUTICO E BIOTECNOLOGICO Drug & Food Biotechnology
Armando Genazzani Dipartimento di Scienze del Farmaco Università del Piemonte Orientale V EDIZIONE MASTER DISCIPLINE REGOLATORIE MARKET ACCESS IN AMBITO FARMACEUTICO E BIOTECNOLOGICO Drug & Food Biotechnology
Quali Problematiche? Emilio Bria. III Sessione Biosimilari Da Anticorpi Monoclonali: Le Evidenze Derivanti Da Studi Randomizzati
 III Sessione Biosimilari Da Anticorpi Monoclonali: Le Evidenze Derivanti Da Studi Randomizzati Quali Problematiche? Emilio Bria U.O.C. di Oncologia Medica d.u. Azienda Ospedaliera Universitaria Integrata
III Sessione Biosimilari Da Anticorpi Monoclonali: Le Evidenze Derivanti Da Studi Randomizzati Quali Problematiche? Emilio Bria U.O.C. di Oncologia Medica d.u. Azienda Ospedaliera Universitaria Integrata
Sicurezza del Registro di mala2a di Gaucher: una vera storia clinica di oltre 20 anni
 Sicurezza del Registro di mala2a di Gaucher: una vera storia clinica di oltre 20 anni Maria Domenica Cappellini Professore Ordinario di Medicina Interna Fondazione IRCCS Ca Granda - Ospedale Maggiore Policlinico,
Sicurezza del Registro di mala2a di Gaucher: una vera storia clinica di oltre 20 anni Maria Domenica Cappellini Professore Ordinario di Medicina Interna Fondazione IRCCS Ca Granda - Ospedale Maggiore Policlinico,
Farmaci biosimilari e comparabilità: problematiche emergenti nell utilizzo dei farmaci biosimilari
 Farmaci biosimilari e comparabilità: problematiche emergenti nell utilizzo dei farmaci biosimilari Carlo Pini (carlo.pini@iss.it) Annarita Meneguz (annamene@iss.it) Istituto Superiore di Sanità, Roma Istituto
Farmaci biosimilari e comparabilità: problematiche emergenti nell utilizzo dei farmaci biosimilari Carlo Pini (carlo.pini@iss.it) Annarita Meneguz (annamene@iss.it) Istituto Superiore di Sanità, Roma Istituto
Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie per l innovazione di processi e prodotti A.A. 2011/12
 Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie per l innovazione di processi e prodotti A.A. 2011/12 Titolo insegnamento: Biotecnologie delle fermentazioni (Prof. Luigi Palmieri) integrato
Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie per l innovazione di processi e prodotti A.A. 2011/12 Titolo insegnamento: Biotecnologie delle fermentazioni (Prof. Luigi Palmieri) integrato
27febbraio 2019 Incontro del Gruppo di lavoro sui BIOFILM. Società dei Naturalisti in Napoli, via mezzocannone 8 Ore 9.30
 27febbraio 2019 Incontro del Gruppo di lavoro sui BIOFILM Società dei Naturalisti in Napoli, via mezzocannone 8 Ore 9.30 UNIVERSITA Federico II Dipartimento di Scienze Chimiche gruppo di lavoro Componenti:
27febbraio 2019 Incontro del Gruppo di lavoro sui BIOFILM Società dei Naturalisti in Napoli, via mezzocannone 8 Ore 9.30 UNIVERSITA Federico II Dipartimento di Scienze Chimiche gruppo di lavoro Componenti:
Dichiarazione di trasparenza/interessi*
 Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun modo l AIFA Interessi nell industria farmaceutica NO Attualmente Precedenti
Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun modo l AIFA Interessi nell industria farmaceutica NO Attualmente Precedenti
PROGRAMMA DI RICERCA ANALISI DI BUDGET-IMPACT SUI FARMACI INNOVATIVI
 PROGRAMMA DI RICERCA ANALISI DI BUDGET-IMPACT SUI FARMACI INNOVATIVI Introduzione Il numero di farmaci innovativi in fase di sviluppo o di approvazione regolatoria sta rapidamente aumentando. Da un lato
PROGRAMMA DI RICERCA ANALISI DI BUDGET-IMPACT SUI FARMACI INNOVATIVI Introduzione Il numero di farmaci innovativi in fase di sviluppo o di approvazione regolatoria sta rapidamente aumentando. Da un lato
Trasparenza nei rapporti tra aziende e SSN Best Practices di una strategia win-win tra aziende ed istituzioni
 Trasparenza nei rapporti tra aziende e SSN Best Practices di una strategia win-win tra aziende ed istituzioni Valentino Confalone VP e General Manager Gilead Sciences Bologna, 2 Aprile 2019 Background
Trasparenza nei rapporti tra aziende e SSN Best Practices di una strategia win-win tra aziende ed istituzioni Valentino Confalone VP e General Manager Gilead Sciences Bologna, 2 Aprile 2019 Background
Caratteristiche delle preparazioni farmaceutiche degli equivalenti: aspetti farmacologici e legislativi internazionali e nazionali. Francesca Mattioli
 FARMACO DI MARCA O EQUIVALENTE? Qualità, efficacia e responsabilità nell'attività prescrittiva Caratteristiche delle preparazioni farmaceutiche degli equivalenti: aspetti farmacologici e legislativi internazionali
FARMACO DI MARCA O EQUIVALENTE? Qualità, efficacia e responsabilità nell'attività prescrittiva Caratteristiche delle preparazioni farmaceutiche degli equivalenti: aspetti farmacologici e legislativi internazionali
La gestione degli archivi di tessuto (biobanking blocchetti in paraffina) L. Annaratone
 La gestione degli archivi di tessuto (biobanking blocchetti in paraffina) L. Annaratone Conservazione materiale Ministero della Sanità CIRCOLARE N 61 del 19 dicembre 1986 OGGETTO: Periodo di conservazione
La gestione degli archivi di tessuto (biobanking blocchetti in paraffina) L. Annaratone Conservazione materiale Ministero della Sanità CIRCOLARE N 61 del 19 dicembre 1986 OGGETTO: Periodo di conservazione
Utilizzo e valutazione dell'offerta pubblica e privata di servizi radiotelevisivi nel 2017
 Utilizzo e valutazione dell'offerta pubblica e privata di servizi radiotelevisivi nel 2017 Rapporto finale Benjamin Fretwurst, Céline Murri, Thomas Friemel, Heinz Bonfadelli Panoramica grafica 3 Fretwurst/Murri/Friemel/Bonfadelli
Utilizzo e valutazione dell'offerta pubblica e privata di servizi radiotelevisivi nel 2017 Rapporto finale Benjamin Fretwurst, Céline Murri, Thomas Friemel, Heinz Bonfadelli Panoramica grafica 3 Fretwurst/Murri/Friemel/Bonfadelli
Escherichia coli. Applicazioni biotecnologie con microrganismi procarioti. Una delle speci batteriche più biotecnologica è senza dubbio
 Applicazioni biotecnologie con microrganismi procarioti Escherichia coli, Bacillus subtilis con altri batteri appartenenti ai generi Pseudomonas, Rhizobium, Lactobacillus possono essere usati: - piani
Applicazioni biotecnologie con microrganismi procarioti Escherichia coli, Bacillus subtilis con altri batteri appartenenti ai generi Pseudomonas, Rhizobium, Lactobacillus possono essere usati: - piani
ASPETTI STATISTICI. Master Universitario di II Livello Ricerca e Sviluppo Pre-Clinico e Clinico del Farmaco Modulo 4 Sviluppo Clinico dei Farmaci
 Master Universitario di II Livello Ricerca e Sviluppo Pre-Clinico e Clinico del Farmaco Modulo 4 Sviluppo Clinico dei Farmaci ASPETTI STATISTICI Docente: Prof. Antonio MARZO e-mail: antoniop.marzo@libero.it
Master Universitario di II Livello Ricerca e Sviluppo Pre-Clinico e Clinico del Farmaco Modulo 4 Sviluppo Clinico dei Farmaci ASPETTI STATISTICI Docente: Prof. Antonio MARZO e-mail: antoniop.marzo@libero.it
CALENDARIO FORMAZIONE 2019
 CALENDARIO FORMAZIONE 2019 Quality Efficiency Innovation CLINICAL RESEARCH AND COMPLIANCE 19 marzo GDPR e la ricerca scientifica Dalla natura giuridica dei dati all impatto sulla struttura organizzativa
CALENDARIO FORMAZIONE 2019 Quality Efficiency Innovation CLINICAL RESEARCH AND COMPLIANCE 19 marzo GDPR e la ricerca scientifica Dalla natura giuridica dei dati all impatto sulla struttura organizzativa
Corso di Laurea triennale in Biotecnologie Piano farmaceutico
 Università degli Studi di Padova Dipartimento di Scienze del Farmaco Corso di Laurea triennale in Biotecnologie Piano farmaceutico 10 maggio 2018 AA 2018-2019 Patrizia Polverino de Laureto Impatto delle
Università degli Studi di Padova Dipartimento di Scienze del Farmaco Corso di Laurea triennale in Biotecnologie Piano farmaceutico 10 maggio 2018 AA 2018-2019 Patrizia Polverino de Laureto Impatto delle
Farmaci equivalenti: dalla bioequivalenza all equivalenza clinica
 Farmaci equivalenti: dalla bioequivalenza all equivalenza clinica Prof. Alberto Corsini Università degli Studi di Milano Domus De Maria (CA) 5-10 ottobre 2015 Farmaci generici Aspetti biofarmaceutici Farmacologia
Farmaci equivalenti: dalla bioequivalenza all equivalenza clinica Prof. Alberto Corsini Università degli Studi di Milano Domus De Maria (CA) 5-10 ottobre 2015 Farmaci generici Aspetti biofarmaceutici Farmacologia
Modalità di approvazione dei nuovi farmaci in Europa. Regulatory Policies Lab Mario Negri Institute for Pharmacological Research
 Modalità di approvazione dei nuovi farmaci in Europa Regulatory Policies Lab Mario Negri Institute for Pharmacological Research Indice Che cosa si valuta Struttura dei dossier per al commercio dei medicinali
Modalità di approvazione dei nuovi farmaci in Europa Regulatory Policies Lab Mario Negri Institute for Pharmacological Research Indice Che cosa si valuta Struttura dei dossier per al commercio dei medicinali
Cosa esiste in Italia
 1 Accesso alle sperimentazioni cliniche Cosa esiste in Italia Paolo Marche paolo.marche @uniroma1.it Qualche dato di contesto 16 Rapporto nazionale sulla Sperimentazione Clinica dei medicinali in Italia
1 Accesso alle sperimentazioni cliniche Cosa esiste in Italia Paolo Marche paolo.marche @uniroma1.it Qualche dato di contesto 16 Rapporto nazionale sulla Sperimentazione Clinica dei medicinali in Italia
EFFICACIA E SOSTENIBILITA DELLA TERAPIA INSULINICA CON BIOSIMILARI
 EFFICACIA E OTENIBILITA DELLA TERAPIA INULINICA CON BIOIMILARI C. Baggiore OC Diabetologia e Malatt. Metab. Che cos è un biosimilare? Il termine biosimilare rappresenta per lo più una designazione normativa
EFFICACIA E OTENIBILITA DELLA TERAPIA INULINICA CON BIOIMILARI C. Baggiore OC Diabetologia e Malatt. Metab. Che cos è un biosimilare? Il termine biosimilare rappresenta per lo più una designazione normativa
ISTITUTO SUPERIORE DI SANITA'
 ISTITUTO SUPERIORE DI SANITA' DECRETO 26 aprile 2002 (Gazzetta Ufficiale serie generale del 7 maggio 2002, pagine 68-73) Accertamento della composizione e innocuità dei farmaci di nuova istituzione prima
ISTITUTO SUPERIORE DI SANITA' DECRETO 26 aprile 2002 (Gazzetta Ufficiale serie generale del 7 maggio 2002, pagine 68-73) Accertamento della composizione e innocuità dei farmaci di nuova istituzione prima
Hexyon nuova efficienza esavalente
 Hexyon nuova efficienza esavalente Premio «Galeno» Milano, 25 Novembre 2015 Marco Ercolani, MD Direzione Medica e Scientifica L unica azienda europea dedicata esclusivamente ai vaccini con l esperienza
Hexyon nuova efficienza esavalente Premio «Galeno» Milano, 25 Novembre 2015 Marco Ercolani, MD Direzione Medica e Scientifica L unica azienda europea dedicata esclusivamente ai vaccini con l esperienza
Corso di Laurea triennale in Biotecnologie Piano farmaceutico
 Università degli Studi di Padova Dipartimento di Scienze del Farmaco Corso di Laurea triennale in Biotecnologie Piano farmaceutico 7 aprile 2017 Edificio Botta AULA F, I PIANO AA 2017-2018 Patrizia Polverino
Università degli Studi di Padova Dipartimento di Scienze del Farmaco Corso di Laurea triennale in Biotecnologie Piano farmaceutico 7 aprile 2017 Edificio Botta AULA F, I PIANO AA 2017-2018 Patrizia Polverino
RACCOMANDAZIONI ROR SUI FARMACI ONCOLOGICI Fausto Roila Oncologia Medica, Perugia
 RACCOMANDAZIONI ROR SUI FARMACI ONCOLOGICI 2018 Fausto Roila Oncologia Medica, Perugia NUOVI FARMACI ANTITUMORALI - Aumento della OS spesso modesto - Beneficio con endpoint surrogati (spesso poco correlati
RACCOMANDAZIONI ROR SUI FARMACI ONCOLOGICI 2018 Fausto Roila Oncologia Medica, Perugia NUOVI FARMACI ANTITUMORALI - Aumento della OS spesso modesto - Beneficio con endpoint surrogati (spesso poco correlati
Brevettabilità dei biomarcatori
 Brevettabilità dei biomarcatori Workshop Netval22 Ottobre 2018 Anne-Cécile Trillat actrillat@desimonepartners.com Italian, French and European Patent Attorney Pharmaceuticals - Life Sciences Biotechnology
Brevettabilità dei biomarcatori Workshop Netval22 Ottobre 2018 Anne-Cécile Trillat actrillat@desimonepartners.com Italian, French and European Patent Attorney Pharmaceuticals - Life Sciences Biotechnology
Linee guida AIFA e SIF per l uso dei Biosimilari
 Linee guida AIFA e SIF per l uso dei Biosimilari Prof. Giovambattista De Sarro Dipartimento di Scienze della Salute Università degli Studi Magna Graecia di Catanzaro Dichiarazione di trasparenza/interessi*
Linee guida AIFA e SIF per l uso dei Biosimilari Prof. Giovambattista De Sarro Dipartimento di Scienze della Salute Università degli Studi Magna Graecia di Catanzaro Dichiarazione di trasparenza/interessi*
Sintesi delle conoscenze scientifiche sull efficacia comparativa di EPO in pazienti con anemia da malattia renale cronica
 Sintesi delle conoscenze scientifiche sull efficacia comparativa di EPO in pazienti con anemia da malattia renale cronica Laura Amato Rosella Saulle Zuzana Mitrova 1. Revisione della letteratura P Adulti
Sintesi delle conoscenze scientifiche sull efficacia comparativa di EPO in pazienti con anemia da malattia renale cronica Laura Amato Rosella Saulle Zuzana Mitrova 1. Revisione della letteratura P Adulti
Contract: MEST-CT FOLDAMERS
 Marie Curie Host Fellowships for Early Stage Research Training (EST) Design, Synthesis, Structural Characterization and Biological Evaluation of New Peptidomimetics with a Defined Secondary Structure Contract:
Marie Curie Host Fellowships for Early Stage Research Training (EST) Design, Synthesis, Structural Characterization and Biological Evaluation of New Peptidomimetics with a Defined Secondary Structure Contract:
Il ruolo della EBM nel miglioramento della qualita della ricerca
 Il ruolo della EBM nel miglioramento della qualita della ricerca Alessandro Liberati Centro Cochrane italiano XIII Riunione Annuale Network Cochrane italiano Workshop Napoli, 4 Novembre 2008 Contenuto
Il ruolo della EBM nel miglioramento della qualita della ricerca Alessandro Liberati Centro Cochrane italiano XIII Riunione Annuale Network Cochrane italiano Workshop Napoli, 4 Novembre 2008 Contenuto
Ministero della Salute Direzione Generale della Ricerca Scientifica e Tecnologica Bando Giovani Ricercatori - 2007 FULL PROJECT FORM
 ALLEGATO 2 FULL PROJECT FORM FORM 1 FORM 1 General information about the project PROJECT SCIENTIFIC COORDINATOR TITLE OF THE PROJECT (max 90 characters) TOTAL BUDGET OF THE PROJECT FUNDING REQUIRED TO
ALLEGATO 2 FULL PROJECT FORM FORM 1 FORM 1 General information about the project PROJECT SCIENTIFIC COORDINATOR TITLE OF THE PROJECT (max 90 characters) TOTAL BUDGET OF THE PROJECT FUNDING REQUIRED TO
BV e trapianto nel linfoma di Hodgkin (LH)
 BV e trapianto nel linfoma di Hodgkin (LH) Luca Castagna Istituto Clinico Humanitas, Rozzano Institut Paoli Calmettes, Marsiglia Udine, 22/1/2016 Indicazioni BV 1. In seguito a trapianto autologo di cellule
BV e trapianto nel linfoma di Hodgkin (LH) Luca Castagna Istituto Clinico Humanitas, Rozzano Institut Paoli Calmettes, Marsiglia Udine, 22/1/2016 Indicazioni BV 1. In seguito a trapianto autologo di cellule
AUDIZIONE DEL 14/3/2019
 AUDIZIONE DEL 14/3/2019 ATTO DEL GOVERNO N. 72 RIASSETTO E RIFORMA DELLA NORMATIVA IN MATERIA DI SPERIMENTAZIONE CLINICA DEI MEDICINALI AD USO UMANO Relatore: Armando Santoro Humanitas Cancer Center Humanitas
AUDIZIONE DEL 14/3/2019 ATTO DEL GOVERNO N. 72 RIASSETTO E RIFORMA DELLA NORMATIVA IN MATERIA DI SPERIMENTAZIONE CLINICA DEI MEDICINALI AD USO UMANO Relatore: Armando Santoro Humanitas Cancer Center Humanitas
no. MEC Rev. 00 Dated
 TECHNICAL REPORT RAPPORTO TECNICO no. MEC 08155.00 Rev. 00 Dated 2008-11-01 This technical report may only be quoted in full. Any use for advertising purposes must be granted in writing. This report is
TECHNICAL REPORT RAPPORTO TECNICO no. MEC 08155.00 Rev. 00 Dated 2008-11-01 This technical report may only be quoted in full. Any use for advertising purposes must be granted in writing. This report is
Position Paper sui farmaci biosimilari della Società Italiana di Farmacia Ospedaliera e dei Servizi Farmaceutici delle Aziende Sanitarie (SIFO)
 Position Paper sui farmaci biosimilari della Società Italiana di Farmacia Ospedaliera e dei Servizi Farmaceutici delle Aziende Sanitarie (SIFO) SIFO Società Italiana di Farmacia Ospedaliera e dei Servizi
Position Paper sui farmaci biosimilari della Società Italiana di Farmacia Ospedaliera e dei Servizi Farmaceutici delle Aziende Sanitarie (SIFO) SIFO Società Italiana di Farmacia Ospedaliera e dei Servizi
S. Bernasconi. Clinica Pediatrica. Università di Parma.
 S. Bernasconi Clinica Pediatrica Università di Parma sbernasconi@ao.pr.it Cianfarani 2008 2001 2003 Per poter accedere al trattamento con GH in individui nati SGA è necessario rispondere ai seguenti criteri:
S. Bernasconi Clinica Pediatrica Università di Parma sbernasconi@ao.pr.it Cianfarani 2008 2001 2003 Per poter accedere al trattamento con GH in individui nati SGA è necessario rispondere ai seguenti criteri:
Registrazione Partecipanti Introduzione al Corso L azienda farmaceutica: organizzazione e funzioni G. Breghi
 09.02.18 9.00 9.30 9.30 10.00 Università degli Studi di Siena Dipartimento di Biotecnologie, Chimica e Farmacia Master di II Livello in Tecnologie Farmaceutiche Industriali X Edizione A.A. 2017-2018 Unità
09.02.18 9.00 9.30 9.30 10.00 Università degli Studi di Siena Dipartimento di Biotecnologie, Chimica e Farmacia Master di II Livello in Tecnologie Farmaceutiche Industriali X Edizione A.A. 2017-2018 Unità
Andrea Ungar, MD, PhD, FESC
 Cosa abbiamo imparato dagli studi SUP ed EGSYS-follow-up? Andrea Ungar, MD, PhD, FESC Syncope Unit Hypertension Centre Cardiologia e Medicina Geriatrica SINCOPE 2 0 1 1 Dipartimento del Cuore e dei Vasi
Cosa abbiamo imparato dagli studi SUP ed EGSYS-follow-up? Andrea Ungar, MD, PhD, FESC Syncope Unit Hypertension Centre Cardiologia e Medicina Geriatrica SINCOPE 2 0 1 1 Dipartimento del Cuore e dei Vasi
Il farmaco generico, ormai ridefinito farmaco equivalente, è considerato essenzialmente simile al medicinale già in commercio (farmaco originatore)
 1 Il farmaco generico, ormai ridefinito farmaco equivalente, è considerato essenzialmente simile al medicinale già in commercio (farmaco originatore) dal punto di vista qualitativo e quantitativo ma con
1 Il farmaco generico, ormai ridefinito farmaco equivalente, è considerato essenzialmente simile al medicinale già in commercio (farmaco originatore) dal punto di vista qualitativo e quantitativo ma con
BIOSIMILARI IN ONCOLOGIA UNA PROSPETTIVA PER IL FUTURO
 BIOSIMILARI IN ONCOLOGIA UNA PROSPETTIVA PER IL FUTURO 23 Gennaio 2018 Dr Giuseppe Procopio Oncologia Medica Genitourinaria Istituto Nazionale dei Tumori di Milano minima complessità strutturale ottenuti
BIOSIMILARI IN ONCOLOGIA UNA PROSPETTIVA PER IL FUTURO 23 Gennaio 2018 Dr Giuseppe Procopio Oncologia Medica Genitourinaria Istituto Nazionale dei Tumori di Milano minima complessità strutturale ottenuti
MODULO XI - Introduzione ad Health Technology Assessment, Valutazione economica e Budget Impact Analysis (6-7 aprile 2018)
 UNIVERSITA' DEGLI STUDI DEL PIEMONTE ORIENTALE "AMEDEO AVOGADRO" DIPARTIMENTO DI SCIENZE DEL FARMACO MASTER UNIVERSITARIO DI II LIVELLO - ANNO ACCADEMICO 2017-2018 Discipline Regolatorie e Market Access
UNIVERSITA' DEGLI STUDI DEL PIEMONTE ORIENTALE "AMEDEO AVOGADRO" DIPARTIMENTO DI SCIENZE DEL FARMACO MASTER UNIVERSITARIO DI II LIVELLO - ANNO ACCADEMICO 2017-2018 Discipline Regolatorie e Market Access
L c r c i r oco c nser e v r azi z on o e e d eg e li o voci c ti Dott.ssa a S il i v l ia i a Be B rn r ar a d r i
 La crioconservazione degli ovociti Dott.ssa Silvia Bernardi GynePro Medical Group Bologna, Italy www.gynepro.it 80 s Human Oocyte Cryopreservation After the early reports (Chen 1986 Lancet) this field
La crioconservazione degli ovociti Dott.ssa Silvia Bernardi GynePro Medical Group Bologna, Italy www.gynepro.it 80 s Human Oocyte Cryopreservation After the early reports (Chen 1986 Lancet) this field
Le differenti manifestazioni cliniche della Sindrome di Tourette negli adulti
 Le differenti manifestazioni cliniche della Sindrome di Tourette negli adulti Massimo Pasquini diapartimento di neuroscience umane Sapienza Università di Roma Roma 20-04 - 2017 Sommario qnon abbiamo dati
Le differenti manifestazioni cliniche della Sindrome di Tourette negli adulti Massimo Pasquini diapartimento di neuroscience umane Sapienza Università di Roma Roma 20-04 - 2017 Sommario qnon abbiamo dati
Convegno Qualità Microbiologica dei Cosmetici: Aspetti Tecnici e Normativi Milano, 15 maggio Lucia Bonadonna Istituto Superiore di Sanità
 Convegno Qualità Microbiologica dei Cosmetici: Aspetti Tecnici e Normativi Milano, 15 maggio 2015 Lucia Bonadonna Istituto Superiore di Sanità REGOLAMENTO (CE) n. 1223/2009 DEL PARLAMENTO EUROPEO E DEL
Convegno Qualità Microbiologica dei Cosmetici: Aspetti Tecnici e Normativi Milano, 15 maggio 2015 Lucia Bonadonna Istituto Superiore di Sanità REGOLAMENTO (CE) n. 1223/2009 DEL PARLAMENTO EUROPEO E DEL
Le linee guida europee in tema di prodotti ricombinanti e anticorpi monoclonali
 Le linee guida europee in tema di prodotti ricombinanti e anticorpi monoclonali Carlo Pini Centro Nazionale per la Ricerca e la Valutazione dei Prodotti Immunobiologici Delegato Biologics Working Party
Le linee guida europee in tema di prodotti ricombinanti e anticorpi monoclonali Carlo Pini Centro Nazionale per la Ricerca e la Valutazione dei Prodotti Immunobiologici Delegato Biologics Working Party
Bergamo 9 Ottobre. M.Scanziani Mfg Director Hospira S.p.A.
 Bergamo 9 Ottobre M.Scanziani Mfg Director Hospira S.p.A. Hospira Società Mondiale in specialità farmaceutiche e sistemi infusionali. Leader di mercato mondiale in: Farmaci generici iniettabili Sistemi
Bergamo 9 Ottobre M.Scanziani Mfg Director Hospira S.p.A. Hospira Società Mondiale in specialità farmaceutiche e sistemi infusionali. Leader di mercato mondiale in: Farmaci generici iniettabili Sistemi
Biosimilari: farmacologia, aspetti normativi e regolatori
 Biosimilari: farmacologia, aspetti normativi e regolatori Gianluca Trifirò Dpt. Scienze Biomediche, Odontoiatriche e Immagini Morfologiche e Funzionali, Università di Messina Dpt. Medical Informatics,
Biosimilari: farmacologia, aspetti normativi e regolatori Gianluca Trifirò Dpt. Scienze Biomediche, Odontoiatriche e Immagini Morfologiche e Funzionali, Università di Messina Dpt. Medical Informatics,
Case study Glasgow, Scotland. Brian Patterson - Head of Strategy and Projects
 Case study Glasgow, Scotland Brian Patterson - Head of Strategy and Projects Case study Glasgow, Scotland Social Economy what do we mean? Size of the sector and why is it important for Scotland What is
Case study Glasgow, Scotland Brian Patterson - Head of Strategy and Projects Case study Glasgow, Scotland Social Economy what do we mean? Size of the sector and why is it important for Scotland What is
08/04/2013. Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun modo l AIFA
 Ispezioni FV: situazione attuale, cosa sta cambiando? Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun modo l AIFA Nunzio Guido
Ispezioni FV: situazione attuale, cosa sta cambiando? Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun modo l AIFA Nunzio Guido
EFFETTI DEL FUNDING E DELLE SPONSORSHIP SULL ETICITÀ DELLA RICERCA. Gianluigi Vendemiale
 EFFETTI DEL FUNDING E DELLE SPONSORSHIP SULL ETICITÀ DELLA RICERCA Gianluigi Vendemiale Disclosures Bristol-Myers-Squibb Pfizer Merck, Sharp & Dohme Sanofi Aventis Astrazeneca Guidotti Menarini Angelini
EFFETTI DEL FUNDING E DELLE SPONSORSHIP SULL ETICITÀ DELLA RICERCA Gianluigi Vendemiale Disclosures Bristol-Myers-Squibb Pfizer Merck, Sharp & Dohme Sanofi Aventis Astrazeneca Guidotti Menarini Angelini
Farmaco biosimilare. Farmaco Equivalente. Commercializzato alla scadenza del brevetto del farmaco biologico di riferimento. Revers and Furczon, 2010
 Farmaco Equivalente Commercializzato alla scadenza del brevetto del farmaco naturale o di sintesi Farmaco biosimilare Commercializzato alla scadenza del brevetto del farmaco biologico di riferimento 2
Farmaco Equivalente Commercializzato alla scadenza del brevetto del farmaco naturale o di sintesi Farmaco biosimilare Commercializzato alla scadenza del brevetto del farmaco biologico di riferimento 2
Dichiarazione di Conflitto di Interessi
 Dichiarazione di Conflitto di Interessi Honorarium as a speaker in Scientific Events Sigma-Tau Lilly/Boheringer Ingelheim Abbott AstraZeneca BMS Takeda Janssen Eli-Lilly Sanofi-Aventis Menarini Diag MSD
Dichiarazione di Conflitto di Interessi Honorarium as a speaker in Scientific Events Sigma-Tau Lilly/Boheringer Ingelheim Abbott AstraZeneca BMS Takeda Janssen Eli-Lilly Sanofi-Aventis Menarini Diag MSD
