Spettroscopia Ultravioletta/Visibile
|
|
|
- Arnoldo Martini
- 6 anni fa
- Visualizzazioni
Transcript
1 Spettroscopia Ultravioletta/Visibile
2 Spettro elettromagnetico La radiazione elettromagnetica è caratterizzata da due grandezze λ e ν c (velocità della luce) = λ ν Intervallo di tutte le possibili radiazioni elettromagnetiche. Ad un onda elettromagnetica è associato un preciso valore di E = h x ν E (kj/mol) cm Raggi gamma Raggi X UV IR Microonde Onde radio Spettro visibile Ultravioletto Visibile nm VIOLETTO ROSSO nm UV: Transizioni elettroniche Lontano ( nm) Vis: Transizioni elettroniche ( nm) Vicino ( nm)
3 Principi di Spettroscopia UV/Visibile Transizioni elettroniche Il campo e.m. alternato causa un oscillazione degli elettroni di legame attorno allo loro posizione di equilibrio. Quando la frequenza della radiazione assume un energia corrispondente alla DE di due livelli energetici propri della molecola si ha un forte scambio di energia ed un salto elettronico. DE = hn = hc E UV/Vis stato elettronico fondamentale stato elettronico eccitato Ogni transizione richiede un energia determinata (quantizzata) ed è quindi provocata da una radiazione UV/Vis di lunghezza d onda ben definita.
4 Transizioni elettroniche E s* p* livelli di antilegame p s livelli di legame nm E, n
5 Transizioni elettroniche E s* p* Ogni transizione richiede un energia determinata (quantizzata) ed è quindi provocata da una radiazione UV/Vis di lunghezza d onda ben definita. p s La lunghezza d onda necessaria alle diverse transizioni è tanto maggiore quanto minore è il dislivello di energia nm E, n
6 Transizioni elettroniche E s* p* p s s* nm p p* nm s nm E, n
7 Transizioni elettroniche E s* p* n livelli di antilegame livelli di non legame p s livelli di legame nm E, n
8 Transizioni elettroniche E s* p* n n s* nm livelli di non legame p s n p* nm nm E, n
9 MISURA DELL ASSORBIMENTO UV-VIS
10 Spettrofotometro UV/Vis Spettrometro a doppio raggio: l assorbimento dovuto ad una cella di riferimento (solo solvente) viene sottratto all assorbimento della cella contenente il campione.
11 MISURA DELL ASSORBIMENTO La sorgente di energia ed i materiali con cui sono costruiti il mezzo disperdente ed il rivelatore devono essere appropriati per l intervallo di lunghezze d onda analizzate Per le misure UV le celle ed i componenti ottici sono costruiti in quarzo e devono essere trasparenti alle radiazioni utilizzate Nella pratica quotidiana di laboratorio gli spettri UV o VIS vengono determinati in soluzione; come solventi vengono generalmente scelti etanolo, esano, acqua o diossano I solventi impiegati devono essere otticamente puri e il più possibile trasparenti alla radiazione; generalmente, per le transizioni di media intensità (e = ) la concentrazione del soluto è dell ordine di 10-4 moli/l, mentre sarà ovviamente più alta se si vogliono osservare transizioni di più bassa intensità
12 MISURA DELL ASSORBIMENTO Solvente Limite di trasparenza (nm) H 2 O 195 n-esano 201 Etanolo 95% 205 Se possibile, impiegare solventi non polari, in quanto interazioni forti fra solventi polari e soluti comportano la perdita della struttura fine e quindi una perdita di informazione utile. La lunghezza d onda a cui avviene la transizione è influenzata in maniera marcata dal solvente nel quale la lettura viene effettuata.
13 EFFETTO DEL SOLVENTE L effetto della solvatazione dipende dalla polarità del solvente, dal tipo di cromoforo e infine dal tipo di transizione Transizioni p p* Nello stato eccitato separazione di carica polarizzazione della molecola stabilizzazione per interazione dipolo-dipolo In solventi polari energia assorb. (nm) DE = hn d++ stato elettronico eccitato d+ d- - d- stato elettronico fondamentale LUMO HOMO Nello stato eccitato, varia la distribuzione totale di carica, aumenta la polarizzazione della molecola e di conseguenza aumenta la sua stabilizzazione per interazione dipolo-dipolo con il solvente. Lo stato eccitato viene stabilizzata in misura maggiore rispetto allo stato fondamentale da un solvente polare, questo determina una diminuzione dell energia necessaria per fare avvenire la transizione
14 EFFETTO DEL SOLVENTE L effetto della solvatazione dipende dalla polarità del solvente, dal tipo di cromoforo e infine dal tipo di transizione Transizioni n p* Nello stato fondamentale stabilizzazione per interazione dipolo-dipolo In solventi polari protici energia assorb. (nm) p* DE = hn n d+ stato elettronico eccitato d+ d- d- LUMO HOMO stato elettronico fondamentale Essendo di tipo radicalico ed interessando soprattutto l eteroatomo non aumentano la polarizzazione della molecola nello stato eccitato. Lo stato fondamentale è più stabilizzato perché i doppietti liberi formano legami idrogeno col solvente meglio che nello stato eccitato (doppietti perturbati). Il passaggio da solventi non polari a solventi protici sposta l assorbimento a λ minori.
15 MISURA DELL ASSORBIMENTO Solvente Limite di trasparenza (nm) Alcani perfluorati Pentano Esano Cicloesano Trasparenti fino al lontano UV Fino a 195 Acetonitrile Fino a 200 Etere etilico Fino a 210 CH 2 Cl 2 CHCl 3 CCl 4 Benzene(*) Toluene THF (*) cancerogeno Oltre 280
16 MISURA DELL ASSORBIMENTO Cellette Zona dello spettro Quarzo nm Vetro o plastica nm Le migliori cellette hanno finestre che sono normali alla direzione del raggio incidente al fine di minimizzare gli errori dovuti a perdite durante la riflessione L efficienza di una celletta dipende drasticamente dal modo in cui viene usata e conservata Impronte digitali, grasso o altri depositi alterano marcatamente le caratteristiche di trasmissione Dopo lavaggio, non devono mai essere seccate per riscaldamento il che provocherebbe una alterazione del cammino ottico
17 APPLICAZIONI DELLA SPETTROFOTOMETRIA UV Ampia applicabilità Numerose specie inorganiche, organiche e biochimiche assorbono radiazione visibile o ultravioletta anche successivamente a conversione chimica Alta sensibilità I limiti di rilevabilità tipici per analisi spettrofotometriche variano da 10-4 a 10-7 M Selettività da moderata ad alta Se si individua una alla quale solo l analita assorbe le separazioni preliminari non sono più necessarie Buona accuratezza Gli errori relativi in concentrazioni vanno dall 1 al 5% Facilità e convenienza I metodi sono prontamente automatizzabili
18 Spettrofotometria UV ANALISI QUALITATIVA ANALISI QUANTITATIVA
19 Spettrofotometria UV ANALISI QUALITATIVA Lo spettro di assorbimento molecolare ottenuto nell UV dipende dalla struttura elettronica della molecola che assorbe. In generale gli spettri UV/Visibile non sono particolarmente adatti all analisi qualitativa poiché in genere sono poco dettagliati rispetto a IR e NMR e quindi possono essere poco usati per l identificazione delle molecole. Questo tipo di spettri sono utili per escludere la presenza di particolari strutture (come doppi legami coniugati o anelli benzenici) nella molecola in esame. Alcune informazioni relative alla struttura del composto in esame possono comunque essere dedotte dall analisi di uno spettro UV/Vis.
20 e = assorbanza specifica di una soluzione a concentrazione molare unitaria, ad una certa. e = A/C Spettri UV-Visibile e Le bande di assorbimento UV/Vis sono caratterizzate da: lunghezza d onda del massimo di assorbimento ( max ); coefficiente di estinzione molare e. max Poiché i valori di e dei cromofori più comuni variano tra 10 e 10 5, in alcuni casi è preferibile utilizzare una scala logaritmica (log e). Lunghezza d onda in nm ( )
21
22
23
24
25
26
27
28 Caratteristiche delle transizioni più comuni Transizione Legame Nome max (nm) e s s* p p* (non coniugati) p p* (aromatici e coniugati) p p* (aromatici) C-H, C-C, C-X C=C, C=X C=C, C=X C=C, C=X - < 160 elevata L assorbimento E (etilenica) a molto 180 basse 230 (s s* n s*) di idrocarburi ed alcoli permette di impiegarli come K (di solventi coniugazione) in UV/Vis > 10 4 B (benzenoide) ~ n s* C-X R (radicalica) ~ Assorbimento a più alte al diminuire dell elettronegatività di X; nei derivati C-X, per X = O ~180, N ~190, S ~215, Cl 173, Br 208, I 259. n p* C=X R (radicalica) ~ ~ 10 2
29 Cromofori e auxocromi Cromofori: gruppi di atomi nella molecola (>C=O, >C=C<, fenile, ecc.), responsabili dell assorbimento di radiazione UV/Vis. e Auxocromi (cromofori ausiliari): gruppi che presentano un piccolo assorbimento UV, ma che causano effetti significativi sull assorbimento (sia λ max che ε) dei cromofori a cui sono legati. I gruppi auxocromi sono atomi che hanno uno o più doppietti liberi (es. -OH, -OR, -NR 2, -SH, -SR, - Alogeno). Uno spettro UV può avere più di una banda perché: Lunghezza d onda in nm ( ) contiene più di un cromoforo un solo cromoforo può generare più di una transizione
30
31 ASSORBIMENTO DA PARTE DI COMPOSTI ORGANICI Cromofori Gruppi funzionali organici insaturi che assorbono nella regione UV o Visibile (i.e. C=O; -C=C-; Ph) Posizione e intensità del picco possono servire come guida grossolana alla identificazione (attenzione all effetto del solvente) La coniugazione tra due (o più) cromofori tende a provocare spostamenti verso più elevate dei massimi di picco NO 2 NO 2 NO 2 NO 2 O 2 N NO 2 OH OH OH Aumenta coniugazione Intensità cromoforo
32 Cromofori e auxocromi La posizione del massimo di assorbimento di ogni cromoforo dipende sia dalla struttura del resto della molecola sia dall ambiente in cui questa si trova: Effetto BATOCROMICO (o red shift) è lo spostamento a lunghezze d onda MAGGIORI di lambda max. Questo effetto è causato dalla presenza vicino al gruppo cromoforo di particolari gruppi funzionali (batocromi). Un esempio è costituito da un doppio legame in alfa ad un gruppo carbossilico, la delocalizzazione degli elettroni π determina una diminuzione dei dislivelli energetici fra orbitali (ΔE più piccolo lambda maggiori) e batocromico max
33 Cromofori e auxocromi La posizione del massimo di assorbimento di ogni cromoforo dipende sia dalla struttura del resto della molecola sia dall ambiente in cui questa si trova: Effetto IPSOCROMO (o blue shift) è lo spostamento a lunghezze d onda MINORI di lambda max, causato da gruppi ipsocromi. Per esempio in ambiente acido l anilina si protona (ione anilinio), il doppietto elettronico di non legame dell N partecipa quindi in misura minore alla delocalizzazione con il sistema π dell anello aromatico. Al crescere dell acidità lo spettro mostra quindi uno spostamento verso lambda minori. (ΔE più grande lambda minori) e ipsocromico batocromico
34 Effetto del ph sull assorbimento aromatico OH O - ione fenato Mappa del potenziale elettrostatico base 270 nm (e 1.450) 287 nm (e 2.600) NH 2 NH 3 + ione anilinio H nm (e 1.430) 254 nm (e 160)
35 Il valore di e dipende da quattro fattori: 1. Probabilità della transizione elettronica; 2. Variazione del momento di dipolo che essa comporta; 3. Natura del solvente 4. Tipi di sostituenti. Cromofori e auxocromi Effetto ipercromico. Aumenta il valore di ε sia a causa dell'aumentata probabilità di transizione, sia a causa dell'aumento della superficie del cromoforo. Effetto ipocromico. Consiste nell'abbassamento del valore di ε dovuto a cause opposte alle precedenti. e ipercromico e max ipocromico
36 Cromofori comuni: alcheni p p* max 165 nm e p* p E La presenza di gruppi alchilici sul doppio legame fa spostare il massimo di assorbimento a λ più alte.
37 Coniugazione Quando due o più cromofori sono presenti nella stessa molecola e sono separati tra loro da un solo legame semplice prendono il nome di cromofori coniugati: la loro caratteristica è la sovrapposizione degli orbitali π su porzioni più estese della molecola che includono anche i legami semplici intercalati tra i due legami doppi. In questo caso l assorbimento avviene a lunghezze d onda più elevate (minore energia) e con maggiore intensità. La coniugazione abbassa l energia della transizione p p*
38 Alcheni coniugati es. 1,3-butadiene antileganti p p* max 217 nm E e leganti
39 Alcheni coniugati CH 2 E H 2 C CH 2 CH 2 H 2 C H 2 C p* p max 175 e Coniugazione più estesa: assorbimento a lunghezze d onda maggiori assorbimento più intenso
40 Vitamina A e b-carotene I polieni con più di 8 doppi legami coniugati presentano un fortissimo massimo di assorbimento nella regione visibile. CH CH 3 CH 3 3 H 3 C H 3 C OH CH 3 CH 3 CH 3 H 3 C max 325 nm e CH 3 max 460 nm CH 3 CH 3 CH 3 CH 3 CH 3 e doppi legami 11 doppi legami
41 ASSORBIMENTO DA PARTE DI COMPOSTI ORGANICI Se aumenta la possibilità di spostamento elettronico diminuisce l energia necessaria per l eccitazione con il conseguente aumento del valore di verso la regione del visibile. Infatti, i sistemi altamente coniugati sono colorati. OH HO O O - - O3 S N N COO - O 2 N Nero Eriocromo T Fenolftaleina Il salto energetico da un orbitale di legame ad uno di antilegame è minore nel sistema coniugato dato che il livello energetico dell orbitale occupato con più alta energia (HOMO) aumenta e quello dell orbitale non occupato (LUMO) diminuisce
42 Cromofori comuni: composti carbonilici n p* max 290 nm e < 30 proibita p p* max 170 nm e 100 permessa p* n p E
43 Cromofori carbonilici 1 Composto struttura λ max nm (solvente) Acetaldeide 293 (esano) 12 H 3 C O CH O Acetone H C 279 (esano) 15 3 C ε Acetone C H 3 CH 3 O C 264 (acqua) Butenale H 2 C CH 3 O CH CH 207 (etanolo) (E)-pent-3-en-2-one O CH C H 3 C CH CH (etanolo)
44 Regole di Woodward-Fieser per i dieni Valore di base per sistema: aciclico trans 217 nm omoanulare 253 nm eteroanulare 214 nm Sommare per: gruppo alchilico o residuo di anello 5 nm ulteriore doppio legame coniugato 30 nm doppio legame esociclico 5 nm gruppo auxocromo: -O-CO-R 0 nm -OR 6 nm -SR 30 nm -Cl, -Br 5 nm -N(R) 2 60 nm
45 Calcolo del max per dieni coniugati valore base residui alchilici doppio legame esociclico valore base residui alchilici Osservato :
46 Esercitazioni Valore base 214 doppio leg. esociclico 5 4 residui alchilici 20 * Totale 239 HOOC Sperimentale 238 Acido abietico
47 Regole di Woodward-Fieser per i carbonili coniugati Valori di base (in nm) per: anelli a 6 termini 215 anelli a 5 termini 202 C=C-C(X)=O X = H 207 X = R 215 X = OH 193 X = OR 193 Sommare per: Ulteriore doppio legame coniugato 30 doppio legame esociclico 5 Gruppo alchilico o residuo di anello a 10 b 12 g d 18
48 Calcolo della max per composti carbonilici a b-insaturi CH 3 O valore base 215 ulteriore doppio leg residui alchilici g d osservato 281 nm, e
49 Esercitazioni H 3 C H HO O O Valore base 215 Ulteriore doppio leg residuo OR in g 17 H C CH 3 1 residuo alch. in d 18 Totale 280 Sperimentale (EtOH) 284
50 Calcolo della max per composti carbonilici a b-insaturi valore base 215 CH 3CH3 ulteriore doppio leg. 30 H 3 C O 2 residui alchilici a b 22 3 residui alchilici g d 54 CH 3 CH 3 CH osservato 278 nm, e = 4.500
51 log e Cromofori aromatici E e ~ K e ~ Bande di assorbimento: da medie a forti; presentano una struttura fine caratteristica. B e ~ 250 R>300 Sostituenti: fanno spostare a più alte la banda a 256 nm; influenzano notevolmente l intensità di assorbimento.
52 Cromofori aromatici Composto struttura max (nm) e Benzene Toluene CH Clorobenzene Anisolo Cl OCH auxocromi Stirene CH O Acetofenone CH estensione coniugazione Nitrobenzene O N + O
53 Effetto dei sostituenti sull assorbimento aromatico La banda a 256 nm è sensibile alla densità elettronica dell anello O OH H 3 C O H 3 C O Fenolo =270 nm e= 1450 Anisolo =287 nm e= 2600 Fenilacetato =258 nm e= 250 Densità elettronica λ max ε
54 Spettrofotometria UV ANALISI QUANTITATIVA Esiste una relazione di proporzionalità diretta fra la concentrazione di una specie in soluzione e l assorbimento di una radiazione ad una data lunghezza d onda (legge di Beer). Perché la legge di Beer possa essere sfruttata per l analisi quantitativa devono essere rispettate due condizioni: 1. La specie in soluzione deve assorbire in modo rilevabile nell intervallo spettrale dello strumento (in pratica deve possedere un cromoforo) 2. La relazione tra assorbanza (A) e lunghezza d onda (l) di assorbimento deve essere lineare.
55 Analisi Quantitativa I 0 I campione Trasmittanza T = I I 0 Assorbanza A = log I I 0 = log T 1
56 Legge di Lambert-Beer La legge di Beer per radiazioni sostanzialmente monocromatiche assume la forma: A = e c l e coefficiente di estinzione molare c concentrazione molare (moli/l) l lunghezza della cella (cm) e = M A c l M peso molecolare c concentrazione in grammi per litro (g/l) l lunghezza della cella (cm)
57 Legge di Lambert-Beer Nell analisi farmaceutica: A = A (1%, 1 cm) c l A (1%, 1cm) assorbanza di una soluzione 1% p/v (1g/100ml) in una cella di 1 cm c concentrazione del campione in g/100ml l lunghezza della cella (cm)
58 Legge di Lambert-Beer A 1,4 1,2 1,0 0,8 0,6 0,4 0,2 A = e c l inclinazione = e 0, conc (moli/l) La legge di Lambert-Beer è applicabile solo a soluzioni diluite; nelle soluzioni concentrate le particelle si influenzano a vicenda perturbando la propria distribuzione di carica e alterando l assorbimento della radiazione, con il risultato che la proporzionalità tra A e C non è più lineare.
59 Legge di Lambert-Beer A 1,4 1,2 1,0 0,8 0,6 0,4 0,2 0,0 C 2 C 3 C 4 C conc (moli/l)
60 Legge di Lambert-Beer A 1,4 1,2 1,0 0,8 0,6 0,4 0,2 A misurata C x 0, C x conc (moli/l)
Schema a blocchi di uno spettrofluorimetro
 MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
10.9 ANALISI QUALITATIVA. 10.9.1 Fattori che influenzano la posizione di l max
 2 10.9 ANALISI QUALITATIVA 26 Ovviamente le transizioni proibite dalle regole di selezione non danno luogo ad assorbimento o comunque danno bande di bassissima intensità. 27 Nella figura non compaiono
2 10.9 ANALISI QUALITATIVA 26 Ovviamente le transizioni proibite dalle regole di selezione non danno luogo ad assorbimento o comunque danno bande di bassissima intensità. 27 Nella figura non compaiono
Spettroscopia UV/Visibile. Visibile
 Spettroscopia UV/Visibile Visibile È una tecnica spettroscopica di assorbimento che sfrutta le radiazioni con λ tra 190 e 400 nm. L assorbimento di tali radiazioni da parte delle molecole provoca a delle
Spettroscopia UV/Visibile Visibile È una tecnica spettroscopica di assorbimento che sfrutta le radiazioni con λ tra 190 e 400 nm. L assorbimento di tali radiazioni da parte delle molecole provoca a delle
S P E T T R O S C O P I A. Dispense di Chimica Fisica per Biotecnologie Dr.ssa Rosa Terracciano
 S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
S P E T T R O S C O P I A SPETTROSCOPIA I PARTE Cenni generali di spettroscopia: La radiazione elettromagnetica e i parametri che la caratterizzano Le regioni dello spettro elettromagnetico Interazioni
L ONDA ELETTROMAGNETICA UNITA DI MISURA E DEFINIZIONI. ν ν. λ =
 IR: Teoria Campo elettrico L ONDA ELETTROMAGNETICA Lunghezza d onda Direzione di propagazione Campo magnetico Lunghezza d onda (cm) Numero d onda (cm -1 ) UNITA DI MISURA E DEFINIZIONI c λ = ν ν ν = =
IR: Teoria Campo elettrico L ONDA ELETTROMAGNETICA Lunghezza d onda Direzione di propagazione Campo magnetico Lunghezza d onda (cm) Numero d onda (cm -1 ) UNITA DI MISURA E DEFINIZIONI c λ = ν ν ν = =
Spettroscopia UV-visibile (parte 1)
 (parte 1) Orbitali atomici Orbitali molecolari Transizioni elettroniche Regole di selezione Cromoforo Spettrofotometro Legge Lambert-Beer La Spettroscopia Uv-visibile studia gli spettri di assorbimento
(parte 1) Orbitali atomici Orbitali molecolari Transizioni elettroniche Regole di selezione Cromoforo Spettrofotometro Legge Lambert-Beer La Spettroscopia Uv-visibile studia gli spettri di assorbimento
Spettroscopia molecolare: interazioni luce-materia
 Spettroscopia molecolare: interazioni luce-materia Nella spettroscopia molecolare il campione è irradiato con luce avente λ nell UV, nel visibile o nell infrarosso. Le molecole di cui è costituito il campione
Spettroscopia molecolare: interazioni luce-materia Nella spettroscopia molecolare il campione è irradiato con luce avente λ nell UV, nel visibile o nell infrarosso. Le molecole di cui è costituito il campione
SPETTROFOTOMETRIA UV/VIS
 SPETTROFOTOMETRIA UV/VIS TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tutte quelle tecniche basate sull interazione tra la materia e le radiazioni elettromagnetiche. La luce, il calore ed
SPETTROFOTOMETRIA UV/VIS TECNICHE SPETTROSCOPICHE Le tecniche spettroscopiche sono tutte quelle tecniche basate sull interazione tra la materia e le radiazioni elettromagnetiche. La luce, il calore ed
Corso di insegnamento Biochimica e Biotecnologie degli Alimenti. Spettrofotometria. Lezione n. XXII-30.05.14
 Corso di insegnamento Biochimica e Biotecnologie degli Alimenti Spettrofotometria Lezione n. XXII-30.05.14 RADIAZIONI ELETTROMAGNETICHE Le radiazioni elettromagnetiche possono essere rappresentate sia
Corso di insegnamento Biochimica e Biotecnologie degli Alimenti Spettrofotometria Lezione n. XXII-30.05.14 RADIAZIONI ELETTROMAGNETICHE Le radiazioni elettromagnetiche possono essere rappresentate sia
REGOLE DELLA RISONANZA
 REGOLE DELLA RISONANZA 1. Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di C con cinque valenze 2. La posizione dei nuclei DEVE
REGOLE DELLA RISONANZA 1. Tutte le strutture canoniche di risonanza devono essere strutturedi Lewis corrette per esempio, nessuna può avere atomi di C con cinque valenze 2. La posizione dei nuclei DEVE
CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO. Fig. 4
 CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO Fig. 4 1 E PERCE BANDE E NON RIGE? E 3 Nell pratica : E 2 E 1 E 0 4000 600 cm -1 4000 600 cm -1 Tra 2 livelli vibrazionali puliti Sottolivelli rotazionali 2
CLASSIFICAZIONE DELLE BANDE DI ASSORBIMENTO Fig. 4 1 E PERCE BANDE E NON RIGE? E 3 Nell pratica : E 2 E 1 E 0 4000 600 cm -1 4000 600 cm -1 Tra 2 livelli vibrazionali puliti Sottolivelli rotazionali 2
ISTITUTO D ISTRUZIONE SUPERIORE AMEDEO AVOGADRO PROGRAMMA SVOLTO
 ISTITUTO D ISTRUZIONE SUPERIORE AMEDEO AVOGADRO PROGRAMMA SVOLTO DISCIPLINA Analisi chimica elaborazione dati e laboratorio CLASSE IV SEZ. A indirizzo CHIMICA ANNO SCOLASTICO 2014-2015 INSEGNANTI Prof.ssa
ISTITUTO D ISTRUZIONE SUPERIORE AMEDEO AVOGADRO PROGRAMMA SVOLTO DISCIPLINA Analisi chimica elaborazione dati e laboratorio CLASSE IV SEZ. A indirizzo CHIMICA ANNO SCOLASTICO 2014-2015 INSEGNANTI Prof.ssa
INTRODUZIONE ALLA SPETTROMETRIA
 INTRODUZIONE ALLA SPETTROMETRIA La misurazione dell assorbimento e dell emissione di radiazione da parte della materia è chiamata spettrometria. Gli strumenti specifici usati nella spettrometria sono chiamati
INTRODUZIONE ALLA SPETTROMETRIA La misurazione dell assorbimento e dell emissione di radiazione da parte della materia è chiamata spettrometria. Gli strumenti specifici usati nella spettrometria sono chiamati
SPETTROSCOPIA UV/visibile
 UNIVERSITA DEGLI STUDI DI CATANIA DIP SCIENZE DEL FARMACO CORSO DI LAUREA MAGISTRALE IN CHIMICA E TECNOLOGIA FARMACEUTICHE Laboratorio di Analisi dei Farmaci 1 LAF-1 8 CFU Corso M-Z SPETTROSCOPIA UV/visibile
UNIVERSITA DEGLI STUDI DI CATANIA DIP SCIENZE DEL FARMACO CORSO DI LAUREA MAGISTRALE IN CHIMICA E TECNOLOGIA FARMACEUTICHE Laboratorio di Analisi dei Farmaci 1 LAF-1 8 CFU Corso M-Z SPETTROSCOPIA UV/visibile
Fenomeni quantistici
 Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Fenomeni quantistici 1. Radiazione di corpo nero Leggi di Wien e di Stefan-Boltzman Equipartizione dell energia classica Correzione quantistica di Planck 2. Effetto fotoelettrico XIII - 0 Radiazione da
Teorie Acido-Base. valutazione degli acidi
 Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
Teorie Acido-Base valutazione degli acidi Teoria di Brønsted-Lowry Acidi donano ioni H + Basi accettano ioni H + CH 3 C 2 H + H 2 CH 3 C 2 + H 3 + acido acetico CH 3 NH 2 + H 2 CH 3 NH 3+ + H metilammina
FORMULARIO DI CHIMICA
 ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
ARGOMENTO Grandezze chimiche fondamentali: 1. Numero di Avogadro 2. Mole 3. Massa Molare 4. Densità 5. Volume molare di un gas Modi di esprimere la concentrazione: 1. Molare M 2. Parti per milione ppm
Ottica geometrica. Propagazione per raggi luminosi (pennello di luce molto sottile)
 Ottica geometrica Propagazione per raggi luminosi (pennello di luce molto sottile) All interno di un mezzo omogeneo la propagazione e rettilinea: i raggi luminosi sono pertanto rappresentati da tratti
Ottica geometrica Propagazione per raggi luminosi (pennello di luce molto sottile) All interno di un mezzo omogeneo la propagazione e rettilinea: i raggi luminosi sono pertanto rappresentati da tratti
Corso di Laboratorio di Biofotonica
 SAIENZA Università di Roma Laurea magistrale in Ingegneria delle Nanotecnologie A.A. 2015-2016 Corso di Laboratorio di Biofotonica rof. Francesco Michelotti SAIENZA Università di Roma Facoltà di Ingegneria
SAIENZA Università di Roma Laurea magistrale in Ingegneria delle Nanotecnologie A.A. 2015-2016 Corso di Laboratorio di Biofotonica rof. Francesco Michelotti SAIENZA Università di Roma Facoltà di Ingegneria
Luce e Vita (Luce è Vita) LUCE: FONTE ENERGETICA E PORTATRICE DI INFORMAZIONI
 Luce e Vita (Luce è Vita) LUCE: FONTE ENERGETICA E PORTATRICE DI INFORMAZIONI Luce : Fonte di Energia Fotosintesi Sviluppo e mantenimento della vita sulla Terra 6CO 2 + 6H 2 O + 60 fotoni ----> C 6 H 12
Luce e Vita (Luce è Vita) LUCE: FONTE ENERGETICA E PORTATRICE DI INFORMAZIONI Luce : Fonte di Energia Fotosintesi Sviluppo e mantenimento della vita sulla Terra 6CO 2 + 6H 2 O + 60 fotoni ----> C 6 H 12
MICHELSON. Interferometro. A.Guarrera, Liceo Galilei CT
 L INTERFEROMETRO DI MICHELSON 1 A.Guarrera, Liceo Galilei CT L interferometria è un metodo di misura molto preciso e molto sensibile che permette di determinare, ad esempio, variazioni di lunghezza, densità
L INTERFEROMETRO DI MICHELSON 1 A.Guarrera, Liceo Galilei CT L interferometria è un metodo di misura molto preciso e molto sensibile che permette di determinare, ad esempio, variazioni di lunghezza, densità
INTERAZIONI DELLE RADIAZIONI CON LA MATERIA
 M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
M. Marengo INTERAZIONI DELLE RADIAZIONI CON LA MATERIA Servizio di Fisica Sanitaria Ospedale Policlinico S.Orsola - Malpighi, Bologna mario.marengo@unibo.it Si definiscono radiazioni ionizzanti tutte le
FORZA DI ACIDI E BASI HA + :B HB + + A
 FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
Analisi FTIR di leganti organici
 Analisi FTIR di leganti organici Lo spettro IR Radiazione Infrarossa Parte dello spettro elettromagnetico compreso tra le regioni del visibile e delle microonde 0,8 µm (12500 cm -1 ) to 50 µm (200 cm -1
Analisi FTIR di leganti organici Lo spettro IR Radiazione Infrarossa Parte dello spettro elettromagnetico compreso tra le regioni del visibile e delle microonde 0,8 µm (12500 cm -1 ) to 50 µm (200 cm -1
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
Power meter Misure di potenza assoluta Misure di potenza relativa. Misure di potenza. F. Poli. 10 aprile F. Poli Misure di potenza
 Misure di potenza F. Poli 10 aprile 2008 Outline Power meter 1 Power meter 2 3 Misure di potenza Misure di potenza = base della metrologia in fibra ottica. Misure di potenza 1 assoluta: necessarie in relazione
Misure di potenza F. Poli 10 aprile 2008 Outline Power meter 1 Power meter 2 3 Misure di potenza Misure di potenza = base della metrologia in fibra ottica. Misure di potenza 1 assoluta: necessarie in relazione
CHIMICA ORGANICA. Gli idrocarburi aromatici
 1 D-IDROCARBURI AROMATICI CHIMICA ORGANICA IDROCARBURI AROMATICI Formula generale C n H n Desinenza -benzene Gli idrocarburi aromatici Gli idrocarburi aromatici (areni o alchilbenzeni) sono caratterizzati
1 D-IDROCARBURI AROMATICI CHIMICA ORGANICA IDROCARBURI AROMATICI Formula generale C n H n Desinenza -benzene Gli idrocarburi aromatici Gli idrocarburi aromatici (areni o alchilbenzeni) sono caratterizzati
I gruppi funzionali: GLI ALCOLI, FENOLI E TIOLI
 I gruppi funzionali: GLI ALCOLI, FENOLI E TIOLI La struttura Un alcol può essere considerato come un idrocarburo (alifatico o aromatico) a cui è stato sostituito un gruppo (ossidrile) Il nome deriva dalla
I gruppi funzionali: GLI ALCOLI, FENOLI E TIOLI La struttura Un alcol può essere considerato come un idrocarburo (alifatico o aromatico) a cui è stato sostituito un gruppo (ossidrile) Il nome deriva dalla
Le unità fondamentali SI. Corrente elettrica
 ESERITAZIONE 1 1 Le unità fondamentali SI Grandezza fisica Massa Lunghezza Tempo Temperatura orrente elettrica Quantità di sostanza Intensità luminosa Nome dell unità chilogrammo metro secondo Kelvin ampere
ESERITAZIONE 1 1 Le unità fondamentali SI Grandezza fisica Massa Lunghezza Tempo Temperatura orrente elettrica Quantità di sostanza Intensità luminosa Nome dell unità chilogrammo metro secondo Kelvin ampere
SPETTROSCOPIA DI ASSORBIMENTO ATOMICO
 SPETTROSCOPIA DI ASSORBIMENTO ATOMICO L applicazione della spettroscopia UV-Vis ai singoli atomi piuttosto che alle molecole complesse è detta Spettroscopia di Assorbimento Atomico. L assorbimento di un
SPETTROSCOPIA DI ASSORBIMENTO ATOMICO L applicazione della spettroscopia UV-Vis ai singoli atomi piuttosto che alle molecole complesse è detta Spettroscopia di Assorbimento Atomico. L assorbimento di un
Fondamenti di spettrofotometria. Spettroscopia UV/Vis
 Fondamenti di spettrofotometria Spettroscopia UV/Vis Spettroscopia Definizione: Lo studio della struttura e della dinamica della materia (in biologia delle molecole) attraverso l analisi dell interazione
Fondamenti di spettrofotometria Spettroscopia UV/Vis Spettroscopia Definizione: Lo studio della struttura e della dinamica della materia (in biologia delle molecole) attraverso l analisi dell interazione
Spettroscopia IR e MS Esercizi. Corso Metodi Fisici in Chimica Organica Prof. Renzo LUISI Uniba. vietata la vendita
 Spettroscopia IR e MS Esercizi 1) I II III IV 725 1378 3000-2800 1465 Nessun assorbimento sopra 3000 cm -1-1 : probabile composto saturo. Picchi tra 2800 e 3000 cm -1-1 : frequenze di stretching caratteristiche
Spettroscopia IR e MS Esercizi 1) I II III IV 725 1378 3000-2800 1465 Nessun assorbimento sopra 3000 cm -1-1 : probabile composto saturo. Picchi tra 2800 e 3000 cm -1-1 : frequenze di stretching caratteristiche
LEZIONE 4. Le soluzioni
 LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
LEZIONE 4 Le soluzioni Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il componente delle
vi dipende dalla composizione del mezzo che attraversa
 LA SPETTROSCOPIA Le tecniche spettroscopiche si basano sull assorbimento o sulla emissione di una radiazione elettromagnetica da parte di un atomo o di una molecola La radiazione elettromagnetica è una
LA SPETTROSCOPIA Le tecniche spettroscopiche si basano sull assorbimento o sulla emissione di una radiazione elettromagnetica da parte di un atomo o di una molecola La radiazione elettromagnetica è una
Spettrofotometria UV/Visibile
 Spettrofotometria UV/Visibile Assorbimento atomico Ogni sostanza ha un caratteristico spettro di assorbimento, che dipende in certa misura anche dallo stato di aggregazione (solido, liquido o gas), ma
Spettrofotometria UV/Visibile Assorbimento atomico Ogni sostanza ha un caratteristico spettro di assorbimento, che dipende in certa misura anche dallo stato di aggregazione (solido, liquido o gas), ma
 positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
positiva, endotermico (la soluzione si raffredda) negativa, esotermico (la soluzione si scalda). DH sol = E ret + E solv concentrazione Molare Esempio: Preparare mezzo litro (0,5 l) di soluzione acquosa
9065X Chimica. Modello esame svolto. Esempio di compito scritto di Chimica. Politecnico di Torino CeTeM
 svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
svolto Esempio di compito scritto di Chimica 1 - La configurazione elettronica: [Ar]3d 6 4s 0 rappresenta lo ione: 1) Mn 2+ 2) Ni 2+ 3) Fe 3+ 4) Co 3+ 5) Cu 2+ 2 - Un gas reale mantenuto sempre al di sopra
Determinazione di parametri cinetici di una reazione di dissociazione mediante spettroscopia UV-visibile
 Determinazione di parametri cinetici di una reazione di dissociazione mediante spettroscopia UV-visibile Obiettivo dell'esperienza è la determinazione di parametri cinetici per la reazione di decomposizione
Determinazione di parametri cinetici di una reazione di dissociazione mediante spettroscopia UV-visibile Obiettivo dell'esperienza è la determinazione di parametri cinetici per la reazione di decomposizione
L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer
 L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer Un atomo di carbonio con almeno due sostituenti identici e la sua immagine speculare sono sovrapponibili e quindi eguali atomo1.c3d Un atomo
L Atomo di Carbonio Tetraedrico e la Rappresentazione di Fischer Un atomo di carbonio con almeno due sostituenti identici e la sua immagine speculare sono sovrapponibili e quindi eguali atomo1.c3d Un atomo
Spettroscopia Raman. Trasmissione-assorbimento
 Spettroscopia Raman Quando una radiazione monocromatica di frequenza n o e incidente ad un sistema molecolare la luce viene: assorbita se ha energia pari ad una possibile transizione ad un livello energetico
Spettroscopia Raman Quando una radiazione monocromatica di frequenza n o e incidente ad un sistema molecolare la luce viene: assorbita se ha energia pari ad una possibile transizione ad un livello energetico
ALCOLI, ETERI, TIOLI. Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3
 ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
ALCOLI, ETERI, TIOLI Alcool: molecola contenente un gruppo -OH legato ad un carbonio sp 3 Etere: composto contenente un atomo di ossigeno legato a due carboni sp 3 Tiolo: molecola contenente un gruppo
APPUNTI DI METODI FISICI IN CHIMICA ORGANICA
 APPUNTI DI METODI FISICI IN CHIMICA ORGANICA C. Santi LAUREA SPECILISTICA IN CHIMICA E TECNOLOGIA DEL FARMACO UNIVERSITA DEGLI STUDI DI PERUGIA http://metodi.chimfarm.unipg.it CAPITOLO 1 Principi di Spettroscopia
APPUNTI DI METODI FISICI IN CHIMICA ORGANICA C. Santi LAUREA SPECILISTICA IN CHIMICA E TECNOLOGIA DEL FARMACO UNIVERSITA DEGLI STUDI DI PERUGIA http://metodi.chimfarm.unipg.it CAPITOLO 1 Principi di Spettroscopia
ione molecolare poco intenso ma visibile frammentazioni di tutti i legami C-C: serie di picchi separati di 14 u.m.a. (C n
 Alcani ione molecolare poco intenso ma visibile frammentazioni di tutti i legami C-C: serie di picchi separati di 14 u.m.a. (C n H 2n+1, m/z 43, 57, 71, 85, 99 ), con intensità massima per i cationi a
Alcani ione molecolare poco intenso ma visibile frammentazioni di tutti i legami C-C: serie di picchi separati di 14 u.m.a. (C n H 2n+1, m/z 43, 57, 71, 85, 99 ), con intensità massima per i cationi a
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
La legge di Lambert-Beer
 La legge di Lambert-Beer In questa esperienza determinerete la concentrazione di una soluzione incognita di permanganato di potassio per via spettrofotometrica. Generalita La spettroscopia si occupa dell
La legge di Lambert-Beer In questa esperienza determinerete la concentrazione di una soluzione incognita di permanganato di potassio per via spettrofotometrica. Generalita La spettroscopia si occupa dell
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE
 Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
pressione esercitata dalle molecole di gas in equilibrio con Si consideri una soluzione di B in A. Per una soluzione ideale
 PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
PROPRIETA COLLIGATIVE Proprietà che dipendono solo dal numero di particelle presenti in soluzione 1. TENSIONE DI VAPORE 2. INNALZAMENTO EBULLIOSCOPICO 3. ABBASSAMENTO CRIOSCOPICO 4. PRESSIONE OSMOTICA
IDROCARBURI AROMATICI
 IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
IDROCARBURI AROMATICI IL BENZENE E una sostanza chimica liquida e incolore dal caratteristico odore aromatico pungente. A temperatura ambiente volatilizza assai facilmente. La maggior parte del benzene
CAMPIONAMENTO fondamentale analisi campionamento omogenei stessa composizione variazione l abilità persona variabilità metodo analitico realtà
 CAMPIONAMENTO Un momento fondamentale di una analisi è rappresentato dal campionamento, generalmente si pensa che i campioni da analizzare siano omogenei e che abbiano in ogni punto la stessa composizione,
CAMPIONAMENTO Un momento fondamentale di una analisi è rappresentato dal campionamento, generalmente si pensa che i campioni da analizzare siano omogenei e che abbiano in ogni punto la stessa composizione,
Roberta Pierattelli. Metalli in Biologia. Qualche richiamo di chimica generale e inorganica
 Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
Roberta Pierattelli Metalli in Biologia Qualche richiamo di chimica generale e inorganica Le proprietà periodiche n =1 n =2 n =3 n =4 n =5 n =6 n =7 Il numero del gruppo corrisponde alla somma degli elettroni
LA LUCE. Perché vediamo gli oggetti Che cos è la luce La propagazione della luce La riflessione La rifrazione
 LA LUCE Perché vediamo gli oggetti Che cos è la luce La propagazione della luce La riflessione La rifrazione Perché vediamo gli oggetti? Perché vediamo gli oggetti? Noi vediamo gli oggetti perché da essi
LA LUCE Perché vediamo gli oggetti Che cos è la luce La propagazione della luce La riflessione La rifrazione Perché vediamo gli oggetti? Perché vediamo gli oggetti? Noi vediamo gli oggetti perché da essi
IDROCARBURI I ALCANI ANALISI CONFORMAZIONALE
 IDROCARBURI I ALCANI NOMENCLATURA ANALISI CONFORMAZIONALE REAZIONI GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI:
IDROCARBURI I ALCANI NOMENCLATURA ANALISI CONFORMAZIONALE REAZIONI GLI IDROCARBURI CONTENGONO SOLO CARBONIO ED IDROGENO VENGONO DISTINTI IN TRE CLASSI 1. SATURI: SOLO LEGAMI SEMPLICI C-C SE SATURI ED ACICLICI:
SPETTROSCOPIA INFRAROSSA
 SPETTROSCOPIA INFRAROSSA Metodi fisici in chimica organica spettroscopia IR Vibrazioni molecolari 400-4000 4000 cm -1 Spettri molto complessi anche per molecole semplici:! Riconoscimento sostanze incognite
SPETTROSCOPIA INFRAROSSA Metodi fisici in chimica organica spettroscopia IR Vibrazioni molecolari 400-4000 4000 cm -1 Spettri molto complessi anche per molecole semplici:! Riconoscimento sostanze incognite
ESERCITAZIONI FISICA PER FARMACIA A.A. 2012/2013 ELETTROMAGNETISMO - OTTICA
 ESERCITAZIONI FISICA PER FARMACIA A.A. 2012/2013 ELETTROMAGNETISMO - OTTICA Esercizio 1 Due cariche q 1 e q 2 sono sull asse x, una nell origine e l altra nel punto x = 1 m. Si trovi il campo elettrico
ESERCITAZIONI FISICA PER FARMACIA A.A. 2012/2013 ELETTROMAGNETISMO - OTTICA Esercizio 1 Due cariche q 1 e q 2 sono sull asse x, una nell origine e l altra nel punto x = 1 m. Si trovi il campo elettrico
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Laser in medicina 28/2/2004
 Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Laser in medicina 28/2/2004 Laser Sviluppo moderne tecniche di comunicazione fasci molto intensi di onde radio coerenti in bande di frequenza molto
Dipartimento di Fisica a.a. 2004/2005 Fisica Medica 2 Laser in medicina 28/2/2004 Laser Sviluppo moderne tecniche di comunicazione fasci molto intensi di onde radio coerenti in bande di frequenza molto
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: H 2 O 2(aq) + MnO 4
 Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 2(aq) + Mn 4 -(aq) 2(g) + Mn 2(s) + - (aq) + 2 (l). Calcolare il volume di 2 (g), misurato a 1.0 atm e 25
Problema n.1 Bilanciare la seguente reazione redox utilizzando il metodo ionico elettronico: 2 2(aq) + Mn 4 -(aq) 2(g) + Mn 2(s) + - (aq) + 2 (l). Calcolare il volume di 2 (g), misurato a 1.0 atm e 25
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Ultima verifica pentamestre. 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!
 Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Ultima verifica pentamestre 1)definizione di miscuglio, soluzione, composto, elemento, molecola ( definizione importantissima!!!!!!!!) 2) gruppi dal IV al VIII 3) differenza tra massa atomica e massa atomica
Spettrofotometria. Le onde luminose consistono in campi magnetici e campi elettrici oscillanti, fra loro perpendicolari.
 Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
Spettrofotometria. Con questo termine si intende l utilizzo della luce nella misura delle concentrazioni chimiche. Per affrontare questo argomento dovremo conoscere: Natura e proprietà della luce. Cosa
CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq) + H 2 O (l)
 2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
2. Titolazione di un acido debole con una base forte : CH 3 COOH (aq) + NaOH (aq) (a cura di Giuliano Moretti) La titolazione è descritta dalla seguente reazione CH 3 COOH (aq) + OH - (aq) CH 3 COO - (aq)
MISURA DELLA [Ca 2+ ] INTRACELLULARE IN VIVO
![MISURA DELLA [Ca 2+ ] INTRACELLULARE IN VIVO MISURA DELLA [Ca 2+ ] INTRACELLULARE IN VIVO](/thumbs/48/23964432.jpg) MISURA DELLA [Ca 2+ ] INTRACELLULARE IN VIVO Per misurare la [Ca 2+ ] intracellulare ([Ca 2+ ] i ) si usano molecole fluorescenti:queste, colpite da un raggio di luce di una certa λ, emettono luce con
MISURA DELLA [Ca 2+ ] INTRACELLULARE IN VIVO Per misurare la [Ca 2+ ] intracellulare ([Ca 2+ ] i ) si usano molecole fluorescenti:queste, colpite da un raggio di luce di una certa λ, emettono luce con
UNITA DIDATTICA P A1.01
 Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Titolo: Grandezze fisiche fondamentali e derivate, unità di misura. Conversioni di unità di misura e notazione scientifica. Codice: A1-P-Tec-Gra Campo di indagine della chimica. Il Sistema Internazionale
Il modello strutturale dell atomo
 Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
Il modello strutturale dell atomo Gli atomi sono costituiti dal nucleo e dagli elettroni Proprietà dell atomo dipendono dal nucleo (fisica nucleare) e dagli elettroni (chimica). Il nucleo contiene protoni
CHIMICA ORGANICA. Gli alchini
 1 C3-ALCHINI CHIMICA ORGANICA ALCHINI Formula generale C n n 2 Desinenza -ino Gli alchini Gli alchini sono caratterizzati dalla presenza di uno o più tripli legami carboniocarbonio e sono anch essi classificati
1 C3-ALCHINI CHIMICA ORGANICA ALCHINI Formula generale C n n 2 Desinenza -ino Gli alchini Gli alchini sono caratterizzati dalla presenza di uno o più tripli legami carboniocarbonio e sono anch essi classificati
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO
 I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
I LEGAMI CHIMICI E LA REGOLA DELL OTTETTO REGOLA DELL OTTETTO: Tutti gli atomi si legano, cedono, acquistano o condividono elettroni per raggiungere un livello esterno pieno di otto (o due) elettroni.
Tecnologia Meccanica. Controlli non distruttivi
 1 In riferimento alla UNI EN 473 sono citabili le sei tecniche ispettive che maggiormente vengono impiegate in campo industriale: 1. (VT) Ispezione visiva 2. (PT) Liquidi penetranti 3. (ET) Correnti parassite
1 In riferimento alla UNI EN 473 sono citabili le sei tecniche ispettive che maggiormente vengono impiegate in campo industriale: 1. (VT) Ispezione visiva 2. (PT) Liquidi penetranti 3. (ET) Correnti parassite
SPETTROSCOPIA MOLECOLARE
 SPETTROSCOPIA MOLECOLARE La spettroscopia molecolare studia l assorbimento o l emissione delle radiazioni elettromagnetiche da parte delle molecole. Il dato sperimentale che si ottiene, chiamato rispettivamente
SPETTROSCOPIA MOLECOLARE La spettroscopia molecolare studia l assorbimento o l emissione delle radiazioni elettromagnetiche da parte delle molecole. Il dato sperimentale che si ottiene, chiamato rispettivamente
Introduzione ai fenomeni di polarizzazione. Lezioni d'autore di Claudio Cigognetti
 Introduzione ai fenomeni di polarizzazione Lezioni d'autore di Claudio Cigognetti VIDEO POLARIZZAZIONE IN UN IPAD, RICAPITOLANDO Impiegando occhiali aventi lenti polaroid e un display a cristalli liquidi
Introduzione ai fenomeni di polarizzazione Lezioni d'autore di Claudio Cigognetti VIDEO POLARIZZAZIONE IN UN IPAD, RICAPITOLANDO Impiegando occhiali aventi lenti polaroid e un display a cristalli liquidi
Metodologie informatiche per la chimica
 Metodologie informatiche per la chimica Dr. Sergio Brutti Metodologie di analisi dei dati Strumenti di misura Uno strumento di misura e un dispositivo destinato a essere utilizzato per eseguire una misura,
Metodologie informatiche per la chimica Dr. Sergio Brutti Metodologie di analisi dei dati Strumenti di misura Uno strumento di misura e un dispositivo destinato a essere utilizzato per eseguire una misura,
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
SOLUZIONI. Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto).
 SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
SOLUZIONI Soluzione diluita: è costituita da un liquido (solvente) in cui è disciolta una piccola quantità di un altra sostanza (soluto). Concentrazione di una soluzione: Molarità: Frazione molare: 1 SOLUZIONI
Cifre significative delle misure di grandezze fisiche
 Cifre significative delle misure di grandezze fisiche Si definiscono grandezze fisiche tutte quelle entità con cui vengono descritti i fenomeni fisici e che sono suscettibili di una definizione quantitativa,
Cifre significative delle misure di grandezze fisiche Si definiscono grandezze fisiche tutte quelle entità con cui vengono descritti i fenomeni fisici e che sono suscettibili di una definizione quantitativa,
DOSAGGIO ACIDI NUCLEICI
 DOSAGGIO ACIDI NUCLEICI l Cuvetta contenente il campione di proteina a concentrazione C Sorgente I 0 I 1 I 0 Rivelatore Quando si fa passare una luce di una particolare lunghezza d onda d
DOSAGGIO ACIDI NUCLEICI l Cuvetta contenente il campione di proteina a concentrazione C Sorgente I 0 I 1 I 0 Rivelatore Quando si fa passare una luce di una particolare lunghezza d onda d
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro.
 Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Le proprietà colligative delle soluzioni Sappiamo dall esperienza quotidiana che una soluzione ha caratteristiche diverse dal solvente puro. Molte delle sue proprietà, come il sapore, il colore, l odore,
Spettroscopia. Reticolo di diffrazione Spettrometro a reticolo Spettroscopia Raman
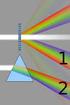 Spettroscopia Reticolo di diffrazione Spettrometro a reticolo Spettroscopia Raman Di nuovo l'esperimento di Young delle due fenditure Onda piana incidente Se la larghezza d delle fenditure tende a zero:
Spettroscopia Reticolo di diffrazione Spettrometro a reticolo Spettroscopia Raman Di nuovo l'esperimento di Young delle due fenditure Onda piana incidente Se la larghezza d delle fenditure tende a zero:
Esperienza n 3: Determinazione del grado di acidità dell aceto commerciale
 Esperienza n : Determinazione del grado di acidità dell aceto commerciale Obiettivo: determinare il grado di acidità di un aceto commerciale tramite titolazione con una soluzione di NaOH a titolo noto
Esperienza n : Determinazione del grado di acidità dell aceto commerciale Obiettivo: determinare il grado di acidità di un aceto commerciale tramite titolazione con una soluzione di NaOH a titolo noto
- lipidi strutturali, costituenti fondamentali delle membrane cellulari ed intracellulari (fosfolipidi, glicolipidi e colesterolo)
 I lipidi, o grassi, costituiscono un gruppo eterogeneo di sostanze accomunate dalla proprietà fisica della insolubilità nei solventi polari (es. acqua) (idrofobicità) e dalla solubilità nei soventi organici
I lipidi, o grassi, costituiscono un gruppo eterogeneo di sostanze accomunate dalla proprietà fisica della insolubilità nei solventi polari (es. acqua) (idrofobicità) e dalla solubilità nei soventi organici
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 10 Il sistema periodico 1. L energia di legame 2. I gas nobili e le regole dell ottetto 3. Il
sono le unità monomeriche che costituiscono le proteine hanno tutti una struttura comune
 AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
AMINO ACIDI sono le unità monomeriche che costituiscono le proteine sono 20 hanno tutti una struttura comune sono asimmetrici La carica di un amino acido dipende dal ph Classificazione amino acidi Glicina
Misure di ph e titolazione acidobase con metodo potenziometrico
 - Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
- Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico
 gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
gruppo amminico Gli aminoacidi polimerizzano durante la sintesi delle proteine mediante la formazione di legami peptidici. gruppo carbossilico Il legame peptidico si ha quando il gruppo carbossilico (-
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
DPI per la protezione da radiazione laser. Radiazione LASER
 DPI per la protezione da radiazione laser Alessandra Tomaselli - Università di Pavia (alessandra.tomaselli@uipv.it) 1 Radiazione LASER Radiazione elettromagnetica coerente λ da 180 nm a 1 mm Trasporto
DPI per la protezione da radiazione laser Alessandra Tomaselli - Università di Pavia (alessandra.tomaselli@uipv.it) 1 Radiazione LASER Radiazione elettromagnetica coerente λ da 180 nm a 1 mm Trasporto
ESERCIZI sulle SOLUZIONI
 ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
ESERCIZI sulle SOLUZIONI 1. Calcola la molarità delle seguenti soluzioni acquose, per le quali è data la massa di soluto disciolta in 200 cm 3 di soluzione: a) 20 g di NaCl; b) 20 g di HCl; c) 20 g di
LIPIDI. I lipidi sono suddivisi in due gruppi principali.
 LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
LIPIDI I lipidi sono una classe eterogenea di composti organici, raggruppati sulla base della loro solubilità. Sono insolubili in acqua, ma solubili nei solventi organici non polari, quali l etere dietilico,
Pericolosità sismica Svizzera. Quando, dove e con quale frequenza si verificano determinate scosse in Svizzera?
 Pericolosità sismica Svizzera Quando, dove e con quale frequenza si verificano determinate scosse in Svizzera? Modello di pericolosità sismica 2015 I terremoti sono i pericoli naturali dal potenziale di
Pericolosità sismica Svizzera Quando, dove e con quale frequenza si verificano determinate scosse in Svizzera? Modello di pericolosità sismica 2015 I terremoti sono i pericoli naturali dal potenziale di
Struttura elettronica e tavola periodica
 Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Struttura elettronica e tavola periodica La tavola è suddivisa nei blocchi s, p, d e f Eccezioni: 1) Elio (He) il quale pur appartenendo al blocco s, compare in quello p. Possiede uno strato di valenza
Unità di misura di lunghezza usate in astronomia
 Unità di misura di lunghezza usate in astronomia In astronomia si usano unità di lunghezza un po diverse da quelle che abbiamo finora utilizzato; ciò è dovuto alle enormi distanze che separano gli oggetti
Unità di misura di lunghezza usate in astronomia In astronomia si usano unità di lunghezza un po diverse da quelle che abbiamo finora utilizzato; ciò è dovuto alle enormi distanze che separano gli oggetti
DETERMINAZIONE DEL pk a DI UN INDICATORE DA MISURE SPETTROFOTOMETRICHE
 DETERMINAZIONE DEL pk a DI UN INDICATORE DA MISURE SPETTROFOTOMETRICHE Con il nome di indicatori di ph vengono denominate delle sostanze in grado di assumere diverse colorazioni a seconda della concentrazione
DETERMINAZIONE DEL pk a DI UN INDICATORE DA MISURE SPETTROFOTOMETRICHE Con il nome di indicatori di ph vengono denominate delle sostanze in grado di assumere diverse colorazioni a seconda della concentrazione
ESERCIZI SUL ph 3 0,002 0,2 13. 2. Completa la seguente tabella relativa a acidi o basi deboli.
 ESERCIZI SUL ph Livello difficoltà 1 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2. Completa la seguente tabella relativa a acidi o basi
ESERCIZI SUL ph Livello difficoltà 1 1. Completa la tabella relativa a soluzioni di acidi o basi forti. 1 11 ph poh [H + ] [OH - ] 3 0,002 0,2 13 2 2. Completa la seguente tabella relativa a acidi o basi
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale.
 Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
Lipidi: funzioni. Strutturale. Riserva energetica. Segnale. Lipidi:classificazione. Saponificabili Non saponificabili Semplici Complessi Prostaglandine Steroidi Cere Trigliceridi Fosfogliceridi Sfingolipidi
LA FOTOSINTESI: conversione di energia luminosa in energia chimica
 LA FOTOSINTESI: conversione di energia luminosa in energia chimica Fonte principale di carboidrati Via principale di fissazione del carbonio Fonte di ossigeno dell atmosfera La FOTOSINTESI consiste di
LA FOTOSINTESI: conversione di energia luminosa in energia chimica Fonte principale di carboidrati Via principale di fissazione del carbonio Fonte di ossigeno dell atmosfera La FOTOSINTESI consiste di
Classificazione della materia 3 STATI DI AGGREGAZIONE
 Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
Classificazione della materia MATERIA spazio massa Composizione Struttura Proprietà Trasformazioni 3 STATI DI AGGREGAZIONE SOLIDO (Volume e forma propri) LIQUIDO (Volume definito e forma indefinita) GASSOSO
La Teoria dei Quanti e la Struttura Elettronica degli Atomi. Capitolo 7
 La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
La Teoria dei Quanti e la Struttura Elettronica degli Atomi Capitolo 7 Proprietà delle Onde Lunghezza d onda (λ) E la distanza tra due punti identici su due onde successive. Ampiezza è la distanza verticale
Modelli atomici. Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle.
 Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Modelli atomici Teoria atomica Dalton (1803) La materia non è continua, ma costituita da particelle. Presupposti 1. Legge di Lavoisier della conservazione della massa: in una reazione chimica nulla si
Caratterizzazione comparativa dei contenitori per latte fresco
 Caratterizzazione comparativa dei contenitori per latte fresco Maurizio Boccacci Mariani Francesco Maria Bucarelli Convegno Nazionale I microinquinanti chimici e la sicurezza alimentare Ascoli Piceno 6
Caratterizzazione comparativa dei contenitori per latte fresco Maurizio Boccacci Mariani Francesco Maria Bucarelli Convegno Nazionale I microinquinanti chimici e la sicurezza alimentare Ascoli Piceno 6
Esercitazioni di statistica
 Esercitazioni di statistica Misure di associazione: Indipendenza assoluta e in media Stefania Spina Universitá di Napoli Federico II stefania.spina@unina.it 22 ottobre 2014 Stefania Spina Esercitazioni
Esercitazioni di statistica Misure di associazione: Indipendenza assoluta e in media Stefania Spina Universitá di Napoli Federico II stefania.spina@unina.it 22 ottobre 2014 Stefania Spina Esercitazioni
informatica di base per le discipline umanistiche
 informatica di base per le discipline umanistiche vito pirrelli Istituto di Linguistica Computazionale CNR Pisa Dipartimento di linguistica Università di Pavia sesta lezione: la dinamica del testo vito
informatica di base per le discipline umanistiche vito pirrelli Istituto di Linguistica Computazionale CNR Pisa Dipartimento di linguistica Università di Pavia sesta lezione: la dinamica del testo vito
ALIFATICI AROMATICI (Areni) POLIENI BENZENE e derivati CICLOALCHENI CICLOALCANI ALCHINI
 CIMICA ORGANICA IDROCARBURI Gli idrocarburi sono composti che contengono solo atomi di e C e, a seconda del tipo di legami chimici presenti nella molecola, possono essere suddivisi secondo il seguente
CIMICA ORGANICA IDROCARBURI Gli idrocarburi sono composti che contengono solo atomi di e C e, a seconda del tipo di legami chimici presenti nella molecola, possono essere suddivisi secondo il seguente
AMPICILLINA SODICA PREPARAZIONE INIETTABILE. Ampicillina sodica polvere sterile per preparazioni iniettabili
 1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
1 0 1 0 1 0 1 0 1 001/FU Aprile 00 Commenti entro il Settembre 00 NOTA: Armonizzata con la versione revisionata della B.P. La monografia è stata completamente revisionata per armonizzarla con le corrispondenti
