Testi Consigliati: Farmacocinetica e Farmacodinamica. Giovanni Greco, Loghia.
|
|
|
- Ricardo Mori
- 6 anni fa
- Visualizzazioni
Transcript
1 Prof. Antonio Randazzo Corso di: Fondamenti di Chimica Fitoterapeutica. Basi molecolari dellʼazione dei principi attivi estratti da piante. Testi Consigliati: Farmacocinetica e Farmacodinamica. Giovanni Greco, Loghia.
2 Parte Generale Farmacocinetica La farmacocinetica studia l assorbimento, la distribuzione, il metabolismo e l escrezione dei farmaci. Farmacodinamica La farmacodinamica si occupa dello studio delle interazioni che si hanno tra il farmaco ed il recettore.
3 FARMACOCINETICA La farmacocinetica studia come un farmaco è assorbito, distribuito, metabolizzato, ed escreto (ADME) dal corpo.
4 Schema ADME Assorbimento Serie di processi che consentono il passaggio del farmaco nel circolo ematico. Distribuzione. Serie di fenomeni che sono alla base del trasferimento del farmaco tra i vari compartimenti che costituiscono l organismo. Metabolismo. Biotrasformazione dei farmaci. Normalmente porta alla trasformazione in sostanze più polari aumentandone l escrezione. (Fegato). Escrezione. Eliminazione fisica del farmaco dall organismo. A carico soprattutto del rene.
5 Rapido viaggio con il farmaco nell organismo. Esempio farmaco somministrato per via orale deve: Essere idrosolubile, per sciogliersi nei liquidi presenti nel tubo gastrointestinale; Liposolubile, per attraversare le membrane cellulari passando dal tratto GI al sangue; Tuttavia, i farmaci molto lipofili possono essere sequestrati dai tessuti adiposi, mentre quelli polari sono facilmente escreti dal rene; Resistere agli acidi dello stomaco; Resistere ad una batteria di enzimi che attaccheranno la sua struttura; Inoltre, i farmaci anionici si legano facilmente alle proteine plasmatiche, mentre quelli cationici si possono legare agli acidi nucleici: solo la concentrazione plasmatica libera del farmaco è una misura cruciale della sua attività.
6 Rapido viaggio con il farmaco nell organismo (II). Sarà necessario un ulteriore passaggio attraverso le membrane cellulari perché il farmaco dal sangue si sposti ai tessuti (distribuzione). Per un farmaco che deve agire a livello del sistema nervoso centrale (CNS) esiste una ulteriore barriera chiamata Barriera Emato-Encefalica (BEE). I vasi sanguigni che irrorano il CNS sono circondati da uno strato continuo di cellule endoteliali strettamente connesse, il che significa che il farmaco deve attraversare queste strato lipofilo per raggiungere ilcns. La BEE rappresenta una barriera contro sostanze di natura polare. Conclusione: in genere solo una piccola percentuale del farmaco somministrato raggiunge il suo obiettivo (target).
7 Farmaci e membrane cellulari I processi di assorbimento, distribuzione, metabolismo ed escrezione sono tutti influenzati dalla capacità del farmaco di attraversare le membrane cellulari. caratteristiche chimico- Tale capacità è naturalmente in relazione alle fisiche del farmaco. Come è fatta una membrana cellulare:
8 Come è fatta una membrana cellulare: Lipofilo Citosol idrofilo Extracellulare idrofilo
9 Costituenti principali: Fosfolipidi PC fosfatidil colina PI fosfatidil inositolo PE fosfatidil etanolamina PA acido fosfatidico Colesterolo
10 Proprietà Chimico Fisiche importanti per l azione dei Farmaci Solubilità Comportamento acido-base Lipofilia Dimensione molecolare Stabilità chimica ed enzimatica A parte la dimensione molecolare, tutte le altre dipendono dalla presenza nella molecola dei vari gruppi funzionali
11 Principali gruppi funzionali
12 Stereochimica Stereoisomeria o isomeria configurazionale Stereisomeri: Stessa formula molecolare, stessa formula di struttura ma diversa disposizione nello spazio di atomi; e senza alcuna tendenza ad interconvertirsi l uno nell altro
13 Solubilità in acqua e Lipofilia Per diffondere attraverso una cellula un farmaco deve avere un grado di idrofilia per stare in soluzione nei liquidi acquosi intra ed extra-cellulari e un grado di lipofilia sufficiente a permettergli di distribuirsi in un ambiente lipidico. Extracellulare idrofilo Citosol idrofilo Lipofilo Il grado di idro-lipofilia di un farmaco è misurato dal rapporto tra le concentrazioni in fase acqusa e oleosa definito:coefficiente di Ripartizione (P). P=[Fase Oleosa]/[Fase Acquosa] F.Oleosa: n-ottanolo Sost. + idrofila 0<P<1 P>1 + lipofila logp > 0 lipofila; logp < 0 idrofila.
14 Solubilità in acqua e Lipofilia Quindi idrofilo significa affine all acqua. Siccome il simile scioglie il proprio simile le sostanze che si scioglieranno bene in acqua sono sostanze polari. Viceversa idrofobo o lipofilo significa affine all olio cioè alla fase apolare. Vediamo quali sono le interazioni che facilitano lo scioglimento in acqua e quali quelle che facilitano lo scioglimento in olio. Extracellulare idrofilo Citosol idrofilo Lipofilo
15 Principali interazioni inter-molecolari: Di tipo POLARE: Solubilità in acqua e Lipofilia 1) Legame ad H rinforzato dalla carica: R-NH :OH2 RCOO H 2 O 2) Legame dipolare. Legame ad idrogeno. RX-H ---- :OH 2 Di tipo APOLARE: 1) Legami di Van der Waals. 2) Interazioni idrofobiche. (natura entropica)
16 Coefficiente di Ripartizione Il logp aumenta col n. di atomi di C, H, Cl, Br, I e diminuisce col n. di funzioni idrofile che formano legami ad idrogeno (es. OH, NH 2, C=O, NO 2, SO 2 ) e/o ionici (COO -, NH 3+, SO 3- ) Il logp può essere calcolato con programmi appositi, i valori predetti sono indicati come clogp (logp calcolato). Per piccole molecole i clogp in genere sono abbastanza corretti.
17 Coefficiente di Ripartizione La costante per un C alifatico è 0.195, aromatico OH alifatico: RCOOR : Calcolate logp della sulfanilammide. In genere i programmi tengono conto anche delle interazioni intramolecolari: Es. acido orto (clogp=1.87) e para salicilico (clogp=1.37).
18 Farmaci con proprietà acido/basiche K a : Per un acido, abilità a donare protoni Per una base, abilità del suo acido coniugato a donare protoni pk a misura la forza di un acido: pk a < 2: acido forte in acqua pka 4-6: acido debole in acqua; base coniugata molto debole pk a 8-10: acido molto debole; base coniugata debole pk a >12: acido debolissimo; base forte in acqua
19 Equilibrio Acido-Base CO 2 H CO 2 - O H 2 O O + H 3 O+ O CH 3 O CH 3 Ac Acetilsalicilico Acido Base Coniugata HO H CH 3 Cl - + NH CH 2 3 H H 2 O HO H NHCH 3 H CH + H 3 O + 3 Pseudoefedrina HCl Acido Base Coniugata
20 Farmaci con caratteristiche acide (basiche) deboli HA + H + A Un farmaco con caratteristiche di acido debole (base) può trovarsi sia nella forma carica (A - ) che neutra (HA). La presenza o meno di una carica elettrica su una molecola fa cambiare drammaticamente le sue proprietà chimico-fisiche (es. solubilità). La specie carica A - è molto più solubile in acqua e meno solubile in fase lipidica. La percentuale di forma carica e non carica dipende dal ph dell ambiente in cui si trova il farmaco secondo la seguente relazione: log[a - ]/[HA]=pH pk a (Equazione di Henderson-Hasselbalch) [A - ]/[HA]= 10pH pka ph < pk a ph > pk a predomina forma indissociata HA (lipofila) predomina la dissociata A - (idrofila).
21 [A - ]/[HA]= 10pH pka ph < pk a ph > pk a predomina forma indissociata HA (lipofila) predomina la dissociata A - (idrofila). Analogamente: [BH + ]/[B]= 10 pka ph = 10 poh-pkb ph < pk a ph > pk a predomina forma protonata BH + (idrofila) predomina la base libera B (lipofila)
22 Solubilità di acidi e basi deboli in funzione del ph
23 ph ed attraversamento membrane HA + H + A Solo la quota non ionizzata potrà entrare la fase lipidica ed attraversare le membrane. Come detto, tale quota dipende dalla differenza tra pk a e ph soluzione:
24 Assorbimento Farmaci Acidi log ([base coniugata]/[acido]) = ph - pk a Esempi: Qual è il rapporto tra forma dissociata ed indissociata di aspirina (pk a = 3.5) nello stomaco a ph = 1.0? Qual è il rapporto tra forma dissociata ed indissociata di aspirina (pk a = 3.5) nell intestino a ph = 8.0? Dove sarà assorbita meglio?
25 Assorbimento Farmaci Acidi Farmaco acido "A" Assorbimento favorito nello Stomaco Membrana lipidica HA Sangue HA ph = 1-2 Stomaco H 3 O + + A -
26 Assorbimento Farmaci Acidi Farmaco Acido "A" Assorbito poco nell intestino Membrana lipidica HA Sangue HA ph = 8-9 Intestino H 2 O + A -
27 Assorbimento farmaci basici Equazione di Henderson-Hasselbach (per le basi): log ([acido coniugato]/[base]) = poh - pk b pk b >poh ben assorbito. Esempi: Qual è il rapporto tra forma dissociata ed indissociata di efedrina (pk b = 4.1) nell intestino a ph = 9.0? Qual è il rapporto tra forma dissociata ed indissociata di efedrina (pk b = 4.1) nello stomaco a ph = 1.0? Dove sarà assorbita meglio?
28 Assorbimento Farmaci Basici Farmaco Basico "B" Assorbito poco nello stomaco Membrana lipidica Sangue B ph = 1-2 BH + Stomaco H 3 O + + B
Farmacocinetica. Lo studio di questi quattro processi viene definito come FARMACOCINETICA del farmaco
 Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
Farmacocinetica Affinché un farmaco possa raggiungere il sito d azione ad una concentrazione sufficiente per esercitare il proprio effetto terapeutico specifico deve generalmente essere: assorbito dal
Fondamenti di Chimica Farmaceutica. Farmacocinetica
 Fondamenti di Chimica Farmaceutica Farmacocinetica Farmacocinetica Il farmaco somministrato arriva al sito di azione (farmacocinetica) quindi interagisce con il bersaglio e determina l azione farmacologica
Fondamenti di Chimica Farmaceutica Farmacocinetica Farmacocinetica Il farmaco somministrato arriva al sito di azione (farmacocinetica) quindi interagisce con il bersaglio e determina l azione farmacologica
-DEFINIZIONE DI ACIDI E BASI-
 -DEFINIZIONE DI ACIDI E BASI- DEFINIZIONE DI ARRHENIUS ACIDO: rilascia ioni H + HCl H + + Cl - BASE: rilascia ioni OH - NaOH Na + + OH - DEFINIZIONE DI BRÖNSTED ACIDO: rilascia ioni H + BASE: lega ioni
-DEFINIZIONE DI ACIDI E BASI- DEFINIZIONE DI ARRHENIUS ACIDO: rilascia ioni H + HCl H + + Cl - BASE: rilascia ioni OH - NaOH Na + + OH - DEFINIZIONE DI BRÖNSTED ACIDO: rilascia ioni H + BASE: lega ioni
FARMACOCINETICA 1. Farmacologia generale FARMACOCINETICA FARMACOLOGIA FARMACODINAMICA
 FARMACOCINETICA 1 Farmacologia generale FARMACOCINETICA FARMACOLOGIA FARMACODINAMICA 1 ASSORBIMENTO DEI FARMACI cioè il processo per mezzo del quale un farmaco passa dal sito di somministrazione al plasma
FARMACOCINETICA 1 Farmacologia generale FARMACOCINETICA FARMACOLOGIA FARMACODINAMICA 1 ASSORBIMENTO DEI FARMACI cioè il processo per mezzo del quale un farmaco passa dal sito di somministrazione al plasma
ACIDI E BASI ORGANICI: pka e ph
 Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Soluzione ph NaOH, 0,1 M Candeggina domestica Ammoniaca domestica ACIDI E BASI ORGANICI: pka e ph Magnesia Borace Bicarbonato Acqua di mare, albume Sangue, lacrime Latte Saliva Pioggia Caffè Pomodori Vino
Teorie Acido-Base. Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH -
 Teorie Acido-Base Arrhenius: Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH - Broensted-Lowry: Gli acidi rilasciano H + Le basi accettano H + Lewis gli
Teorie Acido-Base Arrhenius: Gli acidi in acqua si dissociano e rilasciano H + Le basi in acqua si dissociano e rilasciano OH - Broensted-Lowry: Gli acidi rilasciano H + Le basi accettano H + Lewis gli
ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione
![ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione ESERCIZI ESERCIZI. 3) Una soluzione acquosa è sicuramente acida se: O + ] > 10-7 M O + ] > [OH - ] O + ] < [OH - ] d. [OH - ] < 10-7 M Soluzione](/thumbs/57/40353116.jpg) ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
ESERCIZI 1) Il prodotto ionico dell acqua (K w ) vale 10-14 : a. a qualunque temperatura b. solo per una soluzione acida c. solo per una soluzione basica d. solo a T = 25 C 2) Per l acqua pura risulta
1. Controllo dell equilibrio acido-base. Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona
 1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
1. Controllo dell equilibrio acido-base Carlo Capelli Fisiologia Facoltà di Scienze Motorie- Università di Verona Misura dell acidità di una soluzione Definizione di acido: qualsiasi sostanza chimica che
FORZA DI ACIDI E BASI HA + :B HB + + A
 FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
FORZA DI ACIDI E BASI n La forza di un acido è la misura della tendenza di una sostanza a cedere un protone. n La forza di una base è una misura dell'affinità di un composto ad accettare un protone. n
DISTRIBUZIONE DEFINIZIONE:
 DISTRIBUZIONE DEFINIZIONE: E il processo che implica il passaggio del farmaco dal compartimento plasmatico a quelli extraplasmatici (interstiziale e intracellulare) I Farmaci sono in genere molecole di
DISTRIBUZIONE DEFINIZIONE: E il processo che implica il passaggio del farmaco dal compartimento plasmatico a quelli extraplasmatici (interstiziale e intracellulare) I Farmaci sono in genere molecole di
Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà.
 TEORIE ACIDO-BASE Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà. Teoria di Arrhenius Arrhenius fu il primo a
TEORIE ACIDO-BASE Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà. Teoria di Arrhenius Arrhenius fu il primo a
ELIMINAZIONE DEI FARMACI. L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione.
 ELIMINAZIONE DEI FARMACI L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione. Possono essere escreti: il farmaco immodificato i suoi metaboliti Le principali vie di escrezione
ELIMINAZIONE DEI FARMACI L eliminazione di un farmaco avviene per escrezione e/o per biotrasformazione. Possono essere escreti: il farmaco immodificato i suoi metaboliti Le principali vie di escrezione
Assorbimento Cinetiche di assorbimento Biodisponibilità Volume di distribuzione Emivita L. 3
 Assorbimento Cinetiche di assorbimento Biodisponibilità Volume di distribuzione Emivita L. 3 Prof. Aldo Pinto ASSORBIMENTO Insieme di processi attivi e passivi che consente il passaggio di un farmaco dal
Assorbimento Cinetiche di assorbimento Biodisponibilità Volume di distribuzione Emivita L. 3 Prof. Aldo Pinto ASSORBIMENTO Insieme di processi attivi e passivi che consente il passaggio di un farmaco dal
Acidi e Basi. Capitolo 15
 Acidi e Basi Capitolo 15 Acidi Hanno un sapore agro. L aceto deve il suo sapore all acido acetico Gli agrumi contengono acido citrico. Provocano il cambio di colore nei coloranti vegetali. Reagiscono con
Acidi e Basi Capitolo 15 Acidi Hanno un sapore agro. L aceto deve il suo sapore all acido acetico Gli agrumi contengono acido citrico. Provocano il cambio di colore nei coloranti vegetali. Reagiscono con
legge dell azione di massa: all equilibrio K c = [C] c [D] d / [A] a [B] b = k 1 /k -1
![legge dell azione di massa: all equilibrio K c = [C] c [D] d / [A] a [B] b = k 1 /k -1 legge dell azione di massa: all equilibrio K c = [C] c [D] d / [A] a [B] b = k 1 /k -1](/thumbs/71/65830231.jpg) EQUILIBRIO CHIMICO 1 Consideriamo la reazione chimica seguente: CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O K c = [estere] [acqua] / [acido] [alcol] K c = costante di equilibrio legge dell azione di
EQUILIBRIO CHIMICO 1 Consideriamo la reazione chimica seguente: CH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 + H 2 O K c = [estere] [acqua] / [acido] [alcol] K c = costante di equilibrio legge dell azione di
Appunti di Stechiometria per Chimica
 Appunti di Stechiometria per Chimica Equilibri in soluzione acquosa Teoria degli acidi/basi secondo Brönsted-Lowry Acido una qualunque sostanza che è capace di donare uno ione idrogeno ad un altra sostanza
Appunti di Stechiometria per Chimica Equilibri in soluzione acquosa Teoria degli acidi/basi secondo Brönsted-Lowry Acido una qualunque sostanza che è capace di donare uno ione idrogeno ad un altra sostanza
Le MEMBRANE in biologia
 Le MEMBRANE in biologia Le membrana plasmatica Delimitazione delle cellule Genesi del potenziale elettrico trans-membrana Mantenimento delle differenze tra l ambiente intra ed extracellulare Trasferimento
Le MEMBRANE in biologia Le membrana plasmatica Delimitazione delle cellule Genesi del potenziale elettrico trans-membrana Mantenimento delle differenze tra l ambiente intra ed extracellulare Trasferimento
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Le MEMBRANE in biologia
 Le MEMBRANE in biologia Le membrana plasmatica Delimitazione delle cellule Genesi del potenziale elettrico trans-membrana Mantenimento delle differenze tra l ambiente intra ed extracellulare Trasferimento
Le MEMBRANE in biologia Le membrana plasmatica Delimitazione delle cellule Genesi del potenziale elettrico trans-membrana Mantenimento delle differenze tra l ambiente intra ed extracellulare Trasferimento
LEGGE di AZIONE di MASSA
 LEGGE di AZIONE di MASSA Lo stato di equilibrio di una reazione chimica è rappresentata dalla concentrazione di reagenti e prodotti tali da soddisfare una opportuna relazione matematica: a A + b B + c
LEGGE di AZIONE di MASSA Lo stato di equilibrio di una reazione chimica è rappresentata dalla concentrazione di reagenti e prodotti tali da soddisfare una opportuna relazione matematica: a A + b B + c
Chimica generale e inorganica Studia gli elementi e i composti inorganici
 Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Chimica generale e inorganica Studia gli elementi e i composti inorganici Chimica organica Studia i composti organici, cioè composti che contengono atomi di carbonio Biochimica È lo studio della chimica
Arrhenius. HCl H + + Cl - NaOH Na + + OH -
 Arrhenius Un acido è una sostanza che contiene H ed è in grado di cedere ioni H + e base è una sostanza che ha tendenza a cedere ioni OH - in acqua H 2 O HCl H + + Cl - H 2 O NaOH Na + + OH - Reazione
Arrhenius Un acido è una sostanza che contiene H ed è in grado di cedere ioni H + e base è una sostanza che ha tendenza a cedere ioni OH - in acqua H 2 O HCl H + + Cl - H 2 O NaOH Na + + OH - Reazione
 EQUILIBRI ACIDO-BASE Trattamento grafico Diagrammi Logaritmici Costruzione della matrice comune a tutti i diagrammi logaritmici: Per definizione, log [H 3 O + ] = ph e log [OH ] = ph 14, per cui log [H
EQUILIBRI ACIDO-BASE Trattamento grafico Diagrammi Logaritmici Costruzione della matrice comune a tutti i diagrammi logaritmici: Per definizione, log [H 3 O + ] = ph e log [OH ] = ph 14, per cui log [H
- lipidi strutturali, costituenti fondamentali delle membrane cellulari ed intracellulari (fosfolipidi, glicolipidi e colesterolo)
 I lipidi, o grassi, costituiscono un gruppo eterogeneo di sostanze accomunate dalla proprietà fisica della insolubilità nei solventi polari (es. acqua) (idrofobicità) e dalla solubilità nei soventi organici
I lipidi, o grassi, costituiscono un gruppo eterogeneo di sostanze accomunate dalla proprietà fisica della insolubilità nei solventi polari (es. acqua) (idrofobicità) e dalla solubilità nei soventi organici
Struttura degli amminoacidi
 AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE AMMINOACIDI, PEPTIDI E PROTEINE Le proteine sono macromolecole costituite dall unione di un grande numero di unità elementari: gli amminoacidi
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 17 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 17 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione
LIPIDI. I lipidi (la parola deriva dal greco lìpos, grasso) sono un gruppo di sostanze grasse presente in tutti gli organismi viventi.
 LIPIDI I lipidi (la parola deriva dal greco lìpos, grasso) sono un gruppo di sostanze grasse presente in tutti gli organismi viventi. I lipidi sono composti idrofobi perché non sono solubili in acqua ma
LIPIDI I lipidi (la parola deriva dal greco lìpos, grasso) sono un gruppo di sostanze grasse presente in tutti gli organismi viventi. I lipidi sono composti idrofobi perché non sono solubili in acqua ma
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 13 Le proprietà delle soluzioni 1. Perchè le sostanze si sciolgono? 2. La solubilità 3. La concentrazione
BIOCHIMICA BIOCHIMICA APPLICATA
 BIOCHIMICA BIOCHIMICA APPLICATA Corso di Laurea in Farmacia Prof. Ivano F. Santarelli Introduzione Testi consigliati -I principi di Biochimica di Lehninger. D.L.Nelson, M.M. Cox. Zanichelli -Biochimica
BIOCHIMICA BIOCHIMICA APPLICATA Corso di Laurea in Farmacia Prof. Ivano F. Santarelli Introduzione Testi consigliati -I principi di Biochimica di Lehninger. D.L.Nelson, M.M. Cox. Zanichelli -Biochimica
Le Quattro Funzioni principali di eliminazione nel rene: I -Ultrafiltrazione (capsula di Bowman) II -Diffusione (riassorbimento) III -Secrezione per:
 Escrezione I Farmaci previa o meno biotrasformazione (metabolismo) possono essere escreti dal rene (urine), dal fegato e intestino (bile e feci), dal polmone (aria espirata), ma anche col latte materno,
Escrezione I Farmaci previa o meno biotrasformazione (metabolismo) possono essere escreti dal rene (urine), dal fegato e intestino (bile e feci), dal polmone (aria espirata), ma anche col latte materno,
L acqua: struttura e proprietà La vita come noi la conosciamo ha luogo in ambiente acquoso*
 L acqua: struttura e proprietà La vita come noi la conosciamo ha luogo in ambiente acquoso* In biochimica l acqua è estremamente importante perché: La struttura e funzione delle molecole biologiche dipende
L acqua: struttura e proprietà La vita come noi la conosciamo ha luogo in ambiente acquoso* In biochimica l acqua è estremamente importante perché: La struttura e funzione delle molecole biologiche dipende
PROCESSI CHE INFLUENZANO L ASSORBIMENTO DEL PRINCIPIO ATTIVO 2 PARTE
 Tecnologia Socioeconomia Legislazione Farmaceutica 1 con laboratorio - CdLM CTF 12 cfu 1 semestre PROCESSI CHE INFLUENZANO L ASSORBIMENTO DEL PRINCIPIO ATTIVO 2 PARTE Docente: Prof.ssa Anna Maria Maccioni
Tecnologia Socioeconomia Legislazione Farmaceutica 1 con laboratorio - CdLM CTF 12 cfu 1 semestre PROCESSI CHE INFLUENZANO L ASSORBIMENTO DEL PRINCIPIO ATTIVO 2 PARTE Docente: Prof.ssa Anna Maria Maccioni
La via di somministrazione Orale
 La via di somministrazione Orale Francesco Lai Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari Fasi Principali vie di somministrazione
La via di somministrazione Orale Francesco Lai Tecnologia Farmaceutica Applicata Dipartimento di Scienze della Vita e dell Ambiente Università degli Studi di Cagliari Fasi Principali vie di somministrazione
Soluti in acqua. Elettroliti. Non elettroliti
 Soluti in acqua Elettroliti Forti Dissociazione Elettrolitica COMPLETA Soluto Deboli Dissociazione Elettrolitica NON COMPLETA Non elettroliti Dissociazione Elettrolitica NaCl (s) + acqua Na + (aq) + Cl
Soluti in acqua Elettroliti Forti Dissociazione Elettrolitica COMPLETA Soluto Deboli Dissociazione Elettrolitica NON COMPLETA Non elettroliti Dissociazione Elettrolitica NaCl (s) + acqua Na + (aq) + Cl
Teoria di Lewis. Un acido di Lewis è una specie chimica che può formare un legame covalente accettando una coppia di elettroni da un altra specie.
 Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Teoria di Lewis Spiega perché alcune reazioni hanno proprietà acidobase pur non avendo idrogeni. Nella teoria di Lewis le reazioni acido-base hanno come protagonista la messa in condivisione di una coppia
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 22 Acidi e basi si scambiano protoni 3 Sommario 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. La forza
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 22 Acidi e basi si scambiano protoni 3 Sommario 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. La forza
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE
 Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
SOLUZIONI derivate da: Acido debole/ sale (CH 3 COOH/CH 3 COONa) Base debole/ suo sale (NH 4 OH/NH 4 Cl)
 Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2
![Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2 Ionizzazione spontanea dell acqua: autoprotolisi o autoionizzazione dell acqua. [ H ] 2](/thumbs/57/40353351.jpg) Equilibri ionici in soluzione acquosa L acqua, anche se purissima, rivela una conducibilità elettrica piccola ma misurabile che indica la presenza di ioni. Una ridotta frazione di molecole di acqua è dissociata
Equilibri ionici in soluzione acquosa L acqua, anche se purissima, rivela una conducibilità elettrica piccola ma misurabile che indica la presenza di ioni. Una ridotta frazione di molecole di acqua è dissociata
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
 2NH3(g) Pa(Ag)=108 Pa(I)=127 pf(agi)=235 -> S(g/l) =S(m/l) pf = 9.2 10-9 235 =2162 10-9 = 2.16 10-6 (g/l) Effetto del ph Anche il ph può influenzare la solubilità di un sale poco solubile. E ciò
2NH3(g) Pa(Ag)=108 Pa(I)=127 pf(agi)=235 -> S(g/l) =S(m/l) pf = 9.2 10-9 235 =2162 10-9 = 2.16 10-6 (g/l) Effetto del ph Anche il ph può influenzare la solubilità di un sale poco solubile. E ciò
Soluzioni Acido Base Definizione di Brønsted
 acido + base sale + acqua Soluzioni Acido Base Definizione di Brønsted acido: sostanza capace di donare protoni* HCl + H 2 O Cl + H 3 O + * In soluzione, il protone esiste in forma idratata (H 3 O + )
acido + base sale + acqua Soluzioni Acido Base Definizione di Brønsted acido: sostanza capace di donare protoni* HCl + H 2 O Cl + H 3 O + * In soluzione, il protone esiste in forma idratata (H 3 O + )
Di cosa è fatta una cellula?
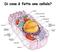 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O rappresentano il 96% della massa della cellula - Altri component frequenti
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O rappresentano il 96% della massa della cellula - Altri component frequenti
PON C4 "LE SCIENZE IN GARA!"
 PON C4 "LE SCIENZE IN GARA!" Approfondimenti di Chimica e Biologia: ph, poh, soluzioni tampone, acidi monoprotici e poliprotici, acido acetico, acetati, ammine, ammidi. prof. Ciro Formica Calcolo della
PON C4 "LE SCIENZE IN GARA!" Approfondimenti di Chimica e Biologia: ph, poh, soluzioni tampone, acidi monoprotici e poliprotici, acido acetico, acetati, ammine, ammidi. prof. Ciro Formica Calcolo della
L acqua. Ci devono essere delle forze che tengono saldamente insieme le molecole d acqua
 L acqua Comparata a molecole con caratteristiche atomiche simili e di grandezza comparabile, l acqua presenta alcune caratteristiche peculiari Comparando l idruro dell ossigeno con gli idruri degli elementi
L acqua Comparata a molecole con caratteristiche atomiche simili e di grandezza comparabile, l acqua presenta alcune caratteristiche peculiari Comparando l idruro dell ossigeno con gli idruri degli elementi
ACIDI e BASI: evoluzione del concetto
 ACIDI E BASI ACIDI e BASI: evoluzione del concetto Acidi e basi di Arrhenius Gli acidi sono composti che, in soluzione acquosa, si dissociano liberando ioni H +. Esempi: HCl, H 2 SO 4, HI, H 3 PO 4 Le
ACIDI E BASI ACIDI e BASI: evoluzione del concetto Acidi e basi di Arrhenius Gli acidi sono composti che, in soluzione acquosa, si dissociano liberando ioni H +. Esempi: HCl, H 2 SO 4, HI, H 3 PO 4 Le
L approccio al Concorso per Sedi Farmaceutiche dalla Preparazione all Esposizione CAPITOLO 12
 L approccio al Concorso per Sedi Farmaceutiche dalla Preparazione all Esposizione CAPITOLO 12 CAPITOLO 12 METABOLISMO DEI FARMACI Schema LADME Processi che determinano la farmacocinetica Vie di somministrazione
L approccio al Concorso per Sedi Farmaceutiche dalla Preparazione all Esposizione CAPITOLO 12 CAPITOLO 12 METABOLISMO DEI FARMACI Schema LADME Processi che determinano la farmacocinetica Vie di somministrazione
EQUILIBRI IN SOLUZIONE: SOSTANZE ACIDE E BASICHE
 EQUILIBRI IN SOLUZIONE: SOSTANZE ACIDE E BASICHE TEORIE ACIDO-BASE 1) Teoria di Arrhenius Arrhenius fu il primo a proporre una teoria acido-base a partire dal comportamento di queste sostanze in acqua.
EQUILIBRI IN SOLUZIONE: SOSTANZE ACIDE E BASICHE TEORIE ACIDO-BASE 1) Teoria di Arrhenius Arrhenius fu il primo a proporre una teoria acido-base a partire dal comportamento di queste sostanze in acqua.
Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
I lipidi. Semplici Complessi
 Lipidi I lipidi I lipidi sono sostanze non polari (idrofobiche) solubili in solven8 organici. Mol8 dei lipidi che compongono le membrane biologiche sono anfipa8ci, hanno una parte polare ed una apolare
Lipidi I lipidi I lipidi sono sostanze non polari (idrofobiche) solubili in solven8 organici. Mol8 dei lipidi che compongono le membrane biologiche sono anfipa8ci, hanno una parte polare ed una apolare
L idrolisi salina. Vi sono sali che sciolti in acqua, impartiscono alla soluzione una reazione acida o basica.
 L idrolisi salina Abbiamo imparato che i sali sono solidi ionici che si comportano in soluzione come elettroliti forti. Sappiamo anche che i sali possono venire considerati come sostanze neutre che si
L idrolisi salina Abbiamo imparato che i sali sono solidi ionici che si comportano in soluzione come elettroliti forti. Sappiamo anche che i sali possono venire considerati come sostanze neutre che si
HX X + H + MOH M + + OH -
 ACIDI E BASI LA TEORIA DI ARRHENIUS La prima vera teoria sulla natura degli acidi e delle basi appartiene a Svante Arrhenius, chimico svedese di fine 800 premio Nobel ACIDO Specie chimica che, in soluzione
ACIDI E BASI LA TEORIA DI ARRHENIUS La prima vera teoria sulla natura degli acidi e delle basi appartiene a Svante Arrhenius, chimico svedese di fine 800 premio Nobel ACIDO Specie chimica che, in soluzione
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa.
 La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
La chimica della vita si basa sui composti del carbonio e dipende da reazioni chimiche che avvengono in soluzione acquosa. Le cellule contengono 4 famiglie principali di piccole molecole organiche: Amminoacidi
Topiche (locali) Sistemiche
 Assorbimento 1. I farmaci sono in genere molecole piccole e diffondono attraverso le membrane in stato non carico; 2. Molti Farmaci sono acidi o basi deboli oppure anfoteri, quindi il ph del liquido o
Assorbimento 1. I farmaci sono in genere molecole piccole e diffondono attraverso le membrane in stato non carico; 2. Molti Farmaci sono acidi o basi deboli oppure anfoteri, quindi il ph del liquido o
Equilibri ionici in soluzione. M. Pasquali
 Equilibri ionici in soluzione Misura sperimentale del W Conducibilità dell acqua a T18 C χ.84*10 8 Ω 1 cm 1 Sono noti λ o 15 Ω 1 cm 2 ; λ o 174 Ω 1 cm 2 ; Λ 489 Ω 1 cm 2 Si consideri l elettrolita H 2
Equilibri ionici in soluzione Misura sperimentale del W Conducibilità dell acqua a T18 C χ.84*10 8 Ω 1 cm 1 Sono noti λ o 15 Ω 1 cm 2 ; λ o 174 Ω 1 cm 2 ; Λ 489 Ω 1 cm 2 Si consideri l elettrolita H 2
Utilizzazione dei dati di monitoraggio biologico
 Utilizzazione dei dati di monitoraggio biologico a livello individuale: valutazione del livello di di esposizione in in funzione dei valori di di riferimento e dei valori limite biologici health based
Utilizzazione dei dati di monitoraggio biologico a livello individuale: valutazione del livello di di esposizione in in funzione dei valori di di riferimento e dei valori limite biologici health based
L equilibrio dell acqua
 L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
Caratteristiche delle membrane biologiche
 Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Membrane Biologiche Caratteristiche delle membrane biologiche 1. Le membrane sono strutture a foglio che formano setti di separazione tra compartimenti con composizione diversa tra loro. 2. Sono costituite
Tamponi Biologici. AO/Febbraio 2016
 Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
Tamponi Biologici AO/Febbraio 2016 Le soluzioni tampone Le soluzioni tampone contengono una coppia acido-base coniugata in cui le concentrazioni di acido e di base, entrambi non forti, sono circa dello
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
ph e indicatori acido-base
 ph e indicatori acido-base La dissociazione ionica dell acqua H 2 O + H 2 O OH - + H 3 O + acido base base acido coniugata coniugato 2 H 2 O (l) OH - (aq) + H 3 O + (aq) Il numero di molecole di acqua
ph e indicatori acido-base La dissociazione ionica dell acqua H 2 O + H 2 O OH - + H 3 O + acido base base acido coniugata coniugato 2 H 2 O (l) OH - (aq) + H 3 O + (aq) Il numero di molecole di acqua
PROPRIETÀ TIPICHE DEI LIQUIDI
 STATO LIQUIDO PROPRIETÀ TIPICHE DEI LIQUIDI - hanno volume ma non forma propria - hanno maggiore densità rispetto ai gas - sono incomprimibili - hanno capacità di fluire (forze di Van der Waals) EQUILIBRIO
STATO LIQUIDO PROPRIETÀ TIPICHE DEI LIQUIDI - hanno volume ma non forma propria - hanno maggiore densità rispetto ai gas - sono incomprimibili - hanno capacità di fluire (forze di Van der Waals) EQUILIBRIO
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
L ACQUA. E il mezzo in cui avvengono le maggiori reazioni. Tutte le molecole biologiche assumono forma e
 L ACQUA E il mezzo in cui avvengono le maggiori reazioni biochimiche Tutte le molecole biologiche assumono forma e funzione in base alle proprietà chimiche e fisiche delle molecole di H 2 O che le circondano
L ACQUA E il mezzo in cui avvengono le maggiori reazioni biochimiche Tutte le molecole biologiche assumono forma e funzione in base alle proprietà chimiche e fisiche delle molecole di H 2 O che le circondano
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
FOCUS SU EQUILIBRI ACIDO-BASE
 1 Ci sono varie definizioni di acidi e basi, tra le quali meritano di essere ricordate quella di Bronsted e quella di Lewis. Per i nostri fini pratici, ovvero gli esercizi, ci basta però ricordare le definizioni
1 Ci sono varie definizioni di acidi e basi, tra le quali meritano di essere ricordate quella di Bronsted e quella di Lewis. Per i nostri fini pratici, ovvero gli esercizi, ci basta però ricordare le definizioni
ACIDI e BASI. Teoria di Arrhenius. Un acido è una sostanza che, sciolta in acqua, provoca un aumento della concentrazione degli ioni H +.
 ACIDI e BASI Teoria di Arrhenius Arrhenius fu il primo a proporre una teoria acido-base a partire dal comportamento di queste sostanze in acqua. Un acido è una sostanza che, sciolta in acqua, provoca un
ACIDI e BASI Teoria di Arrhenius Arrhenius fu il primo a proporre una teoria acido-base a partire dal comportamento di queste sostanze in acqua. Un acido è una sostanza che, sciolta in acqua, provoca un
FARMACODINAMICA. La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci.
 FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
Acidi e basi ph, costanti di acidità e basicità Idrolisi, soluzioni tampone
 Acidi e basi ph, costanti di acidità e basicità Idrolisi, soluzioni tampone Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental
Acidi e basi ph, costanti di acidità e basicità Idrolisi, soluzioni tampone Dr. Gabriella Giulia Pulcini Ph.D. Student, Development of new approaches to teaching and learning Natural and Environmental
Misure di ph e titolazione acidobase con metodo potenziometrico
 - Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
- Laboratorio di Chimica 1 Misure di ph e titolazione acidobase con metodo potenziometrico PAS A.A. 2013-14 Obiettivi 2 Uso di un ph-metro per la misura del ph Titolazione acido-base: costruzione della
EQUILIBRIO CHIMICO REAZIONI A TERMINE REAZIONI DI EQUILIBRIO 04/11/2015. Reazione: A B
 REAZIONI A TERMINE Reazione: A B REAZIONI DI EQUILIBRIO EQUILIBRIO CHIMICO L'equilibrio chimico è la condizione dipendente dalla temperatura in cui le concentrazioni delle specie chimiche che partecipano
REAZIONI A TERMINE Reazione: A B REAZIONI DI EQUILIBRIO EQUILIBRIO CHIMICO L'equilibrio chimico è la condizione dipendente dalla temperatura in cui le concentrazioni delle specie chimiche che partecipano
Di cosa è fatta una cellula?
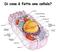 Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
Di cosa è fatta una cellula? Composizione delle cellule - L acqua (H 2 O) rappresenta il 70% del massa della cellula - C,H,N,O,P,S rappresentano il 99% della massa della cellula - Altri elementi più rari
Legame chimico: covalente polare Legame covalente polare
 Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Legame chimico: covalente polare Legame covalente polare Il passaggio dal legame covalente al legame ionico è il risultato di una distribuzione elettronica non simmetrica. Il simbolo δ (lettera greca delta
Proprietà delle Soluzioni
 Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
Proprietà delle Soluzioni Dissociazione Elettrolitica 2 In soluzione acquosa i composti ionici (sali, idrossidi) ed alcune sostanze polari (acidi) si dissociano in ioni Esempi: NaCl Na + + Cl HNO 3 H +
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA
 FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
FONDAMENTI ANATOMO-FISIOLOGICI DELL ATTIVITA PSICHICA Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Proteine. Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana)
 Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Proteine Enzimi Fattori di Trascrizione Proteine di Membrana (trasportatori, canale, recettori di membrana) Ormoni e Fattori di crescita Anticorpi Trasporto Trasporto (emoglobina, LDL, HDL.) Fenotipo Proteine
Soluzioni tampone. Francesca Montemurro
 Soluzioni tampone Francesca Montemurro DEFINIZIONE ACIDO BASE ü ARRENIUS: acido libera H + e la base OH -, era una definizione che andava bene per reazioni in soluzione acquosa ma non in ambiente gassoso.
Soluzioni tampone Francesca Montemurro DEFINIZIONE ACIDO BASE ü ARRENIUS: acido libera H + e la base OH -, era una definizione che andava bene per reazioni in soluzione acquosa ma non in ambiente gassoso.
Lipidi, grassi, membrane. Sommario Lipidi Doppi strati e loro strutture Membrane
 Sommario Lipidi Doppi strati e loro strutture Membrane Materiale didattico scaricabile da http://homepage.sns.it/tozzini/public_files composizione struttura funzioni carboidrati C O H monomeri oligomeri
Sommario Lipidi Doppi strati e loro strutture Membrane Materiale didattico scaricabile da http://homepage.sns.it/tozzini/public_files composizione struttura funzioni carboidrati C O H monomeri oligomeri
Farmaco libero. Assorbimento, Distribuzione, Biotrasformazione, Escrezione. Sito d azione Legato libero. Tessuti Libero legato. Circolazione sistemica
 Farmacocinetica Assorbimento, Distribuzione, Biotrasformazione, Escrezione Circolazione i sistemica Assorbimento Sito d azione Legato libero Farmaco libero Tessuti Libero legato Escrezione Legato Metaboliti
Farmacocinetica Assorbimento, Distribuzione, Biotrasformazione, Escrezione Circolazione i sistemica Assorbimento Sito d azione Legato libero Farmaco libero Tessuti Libero legato Escrezione Legato Metaboliti
SOLUZIONI TAMPONE SOLUZIONI TAMPONE
 SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
SOLUZIONI TAMPONE Le soluzioni tampone (o tamponi) sono costituite da: un acido debole e un suo sale (tampone acido) oppure una base debole e un suo sale (tampone basico) Una soluzione di un acido debole
LE MEMBRANE CELLULARI
 LE MEMBRANE CELLULARI Sono strutture sovramolecolari che racchiudono e delimitano l ambiente intracellulare e negli eucarioti anche gli organuli citoplasmatici. Hanno funzione di Protezione. Sostegno.
LE MEMBRANE CELLULARI Sono strutture sovramolecolari che racchiudono e delimitano l ambiente intracellulare e negli eucarioti anche gli organuli citoplasmatici. Hanno funzione di Protezione. Sostegno.
Corso di Farmacologia Lezione 4: Farmacocinetica (assorbimento, distribuzione)
 Corso di Farmacologia Lezione 4: Farmacocinetica (assorbimento, distribuzione) FARMACOCINETICA Studia i movimenti del farmaco nell organismo. Le varie fasi della cinetica di un farmaco sono: Assorbimento
Corso di Farmacologia Lezione 4: Farmacocinetica (assorbimento, distribuzione) FARMACOCINETICA Studia i movimenti del farmaco nell organismo. Le varie fasi della cinetica di un farmaco sono: Assorbimento
Amminoacidi (1) Acido 2-ammino propanoico (acido α-ammino propionico) α * NH 2 CH 3 COOH
 Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Amminoacidi (1) Presentano un gruppo amminico ( N 2 ) ed un gruppo carbossilico ( COO) nella stessa molecola C 3 N 2 C α * COO Acido 2-ammino propanoico (acido α-ammino propionico) STPA-Chimica Organica
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
FORZE INTERMOLECOLARI
 FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
FORZE INTERMOLECOLARI Le forze intermolecolari sono forze di attrazione che si stabiliscono tra le molecole che costituiscono una sostanza Determinano la tendenza delle molecole ad avvicinarsi. Per ogni
[ ] [ ][ H 3 [ A " -SOLUZIONI TAMPONE- [ ] OH " O + K A = A" K i = HA K W = [ H 3
![[ ] [ ][ H 3 [ A -SOLUZIONI TAMPONE- [ ] OH O + K A = A K i = HA K W = [ H 3 [ ] [ ][ H 3 [ A -SOLUZIONI TAMPONE- [ ] OH O + K A = A K i = HA K W = [ H 3](/thumbs/70/62259175.jpg) -SOLUZIONI TAMPONE- Quando abbiamo in soluzione un acido debole ed il suo sale con una base forte ci sono da considerare 3 equilibri in soluzione: 1. HA + H 2 O A - + H 3 2. A - + H 2 O HA + OH - 3. 2H
-SOLUZIONI TAMPONE- Quando abbiamo in soluzione un acido debole ed il suo sale con una base forte ci sono da considerare 3 equilibri in soluzione: 1. HA + H 2 O A - + H 3 2. A - + H 2 O HA + OH - 3. 2H
Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio
 Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il rene Escrezione cataboliti, farmaci, droghe Regolazione equilibrio idrico Regolazione osmolarità concentrazione elettroliti Regolazione equilibrio acido-base Regolazione Pressione Arteriosa Secrezione
Il potenziale di membrana a riposo
 Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
Il potenziale di membrana a riposo Per poter comprendere il potenziale di membrana a riposo dobbiamo considerare: i fluidi ricchi di sali presenti su entambe le facce della membrana; la membrana stessa;
L ACQUA : STRUTTURA E PROPRIETA
 L ACQUA : STRUTTURA E PROPRIETA 1. Sostanza più abbondante in tutti gli esseri viventi 2. Più del 70% del peso di tutti gli esseri viventi 3. Influenza la struttura e la proprietà di tutte le molecole
L ACQUA : STRUTTURA E PROPRIETA 1. Sostanza più abbondante in tutti gli esseri viventi 2. Più del 70% del peso di tutti gli esseri viventi 3. Influenza la struttura e la proprietà di tutte le molecole
Brady Senese Pignocchino Chimica.blu Zanichelli 2014 Soluzione degli esercizi Capitolo 22
 Brady Senese Pignocchino Chimica.blu Zanichelli 014 Soluzione degli esercizi Capitolo Esercizio Risposta PAG 515 ES 1 Basica, a causa dell idrolisi dell anione (base coniugata di un acido debole). PAG
Brady Senese Pignocchino Chimica.blu Zanichelli 014 Soluzione degli esercizi Capitolo Esercizio Risposta PAG 515 ES 1 Basica, a causa dell idrolisi dell anione (base coniugata di un acido debole). PAG
1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di
 Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
Unità 19 Acidi e basi si scambiano protoni 1. Le teorie sugli acidi e sulle basi 2. La ionizzazione dell acqua 3. Il ph 4. La forza degli acidi e delle basi 5. Come calcolare il ph di soluzioni acide e
STRUTTURA E FUNZIONI
 STRUTTURA E FUNZIONI Typical Cell Membrana plasmatica Chiamata anche membrana cellulare Circonda ogni cellula Separa il contenuto cellulare dal cio che la circonda Separa il LIC dal LEC Controlla il movimento
STRUTTURA E FUNZIONI Typical Cell Membrana plasmatica Chiamata anche membrana cellulare Circonda ogni cellula Separa il contenuto cellulare dal cio che la circonda Separa il LIC dal LEC Controlla il movimento
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
METABOLISMO CELLULARE Il funzionamento della cellula Le cellule sono veri e propri esseri viventi: sono capaci di alimentarsi, di crescere, di produrre nuove sostanze, di riprodursi, di espellere rifiuti
CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00
![CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00 CALCOLO DEL ph. ph = - log [1,0x10-3 ] = 3,00](/thumbs/68/59131328.jpg) CALCOLO DEL ph Calcolare il ph di una soluzione di HCl 1,0x10-3 M HCl acido forte che si dissocia completamente HCl H + + Cl - 1 mol di HCl produce 1 mol di H + ph = - log [1,0x10-3 ] = 3,00 Tipici acidi
CALCOLO DEL ph Calcolare il ph di una soluzione di HCl 1,0x10-3 M HCl acido forte che si dissocia completamente HCl H + + Cl - 1 mol di HCl produce 1 mol di H + ph = - log [1,0x10-3 ] = 3,00 Tipici acidi
1. Perché le sostanze si sciolgono?
 1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
1. Perché le sostanze si sciolgono? Le soluzioni sono miscugli omogenei i cui costituenti conservano le loro proprietà. Nelle soluzioni il solvente è il componente in maggiore quantità. Il soluto è il
LIPIDI E MEMBRANE BIOLOGICHE
 Cap.8 LIPIDI E MEMBRANE BIOLOGICE Definizione (la parola deriva dal greco lípos, grasso): MOLECOLE INSOLUBILI IN ACQUA SOLUBILI NEI SOLVENTI ORGANICI NON POLARI Molecole con struttura chimica e funzioni
Cap.8 LIPIDI E MEMBRANE BIOLOGICE Definizione (la parola deriva dal greco lípos, grasso): MOLECOLE INSOLUBILI IN ACQUA SOLUBILI NEI SOLVENTI ORGANICI NON POLARI Molecole con struttura chimica e funzioni
