CROMATOGRAFIA DI AFFINITA'
|
|
|
- Lino Benedetto Sasso
- 9 anni fa
- Visualizzazioni
Transcript
1 11 CROMATOGRAFIA DI AFFINITA' La purificazione tramite cromatografia d'affinità non si basa sulle differenze nelle proprietà fisiche delle molecole da separare, ma sfrutta le interazioni altamente specifiche delle molecole biologiche. Per questo la cromatografia d'affinità è in grado, almeno in teoria, di raggiungere una purificazione completa in una singola tappa, anche partendo da miscele complesse. Questa tecnica è stata sviluppata inizialmente per la purificazione degli enzimi ma, in seguito, è stata anche applicata ai nucleotidi, agli acidi nucleici, alle immunoglobuline, ai recettori di membrana e a cellule o frazioni di esse. Questa tecnica prevede che il composto da purificare si leghi reversibilmente ad un ligando specifico, immobilizzato su una matrice insolubile. Se, in condizioni sperimentali corrette, si introduce in una colonna contenente il ligando la miscela contenente il composto da purificare, solo quel composto si legherà alla colonna, mentre gli altri componenti, rimasti nella fase mobile, si potranno rimuovere con un semplice lavaggio. Il componente interessato sarà poi recuperato rimuovendolo dal ligando con un'opportuna eluizione. La tecnica è quasi esclusivamente preparativa e necessita di accurate conoscenze sulla struttura e sulla reattività della molecola da separare, tali da permettere la scelta di un giusto ligando. Il ligando utilizzato, che di solito è legato ad un braccio spaziatore per rendere più accessibile il legame con la proteina, deve avere le seguenti caratteristiche: - deve consentire una velocità di flusso adeguata; - il gruppo chimico che forma il legame covalente con la matrice o con il braccio spaziatore non deve essere coinvolto nel legame con la macromolecola da purificare. Questi gruppi sono generalmente amminici, carbossilici, tiolici, alcolici o fenolici; - deve essere attaccato alla matrice in modo da non interferire con la capacità di legare la macromolecola (in genere, si usano bracci spaziatori di lunghezza compresa tra 6 e 10 atomi di C; alcuni sono di natura idrofobica e altri di natura idrofila, e si è visto che le interazioni aspecifiche di questi bracci con le molecole da purificare sono spesso necessarie per una buona purificazione. Si usano 1,6-diaminoesano, acido 6- aminoesanoico e 1,4-bis(2,3-epossipropossi)butano.). Per attaccare il ligando alla matrice si procede in due tappe: dapprima si produce una attivazione della matrice (o del braccio spaziatore) mediante reagenti particolari che agiscono a livello dei gruppi ossidrili; in seguito si effettua l accoppiamento del legante desiderato alla matrice stessa. Un metodo molto usato per l attivazione della colonna consiste nel trattamento con bromuro di cianogeno a ph 11. Attivazione Accoppiamento H R N OH O C N R -NH O C N 2 Matrice + CNBr OH HBr O C N Estere cianato (molto reattivo) O C N N H R
2 12 Cromatografia di affinità (continuazione) La matrice ideale da utilizzare nella cromatografia di affinità deve possedere le seguenti caratteristiche: - contenere gruppi reattivi numerosi ed essere stabile nelle condizioni in cui avviene l attacco; - essere stabile nelle condizioni di interazione della macromolecola e nella successiva eluizione; - non adsorbire aspecificamente altre macromolecole - possedere buone capacità di flusso. In pratica si usano particelle uniformi, sferiche e rigide, solitamente costituite da derivati del destrano (Sephacryl S), dell'agarosio (Sepharose 4B e 6B, Bio-Gel A), gel di poliacrilammide (Bio-Gel P) e cellulosa. Sembra che in media solo una piccola porzione (1 5%) del ligando immobilizzato sia ben orientato e pienamente accessibile una volta attaccato alla matrice. Questo limita la capacità della tecnica. Si In commercio sono disponibili matrici già attivate con CNBr quali, ad esempio, il Sepharose 4B e 6B; sono disponibili anche il tiopropildestrano, il tiopropilagarosio e il tresile(2,2,2- trifluoroetansolfonil)destrano, che deriva da una reazione con divinilsulfone. E' possibile preparare un ligando che abbia una specificità assoluta o una selettività per un determinato gruppo chimico: ligandi gruppo-specifici utilizzati in cromatografia di affinità sono nucleotidi (ad es., il NAD), avidina, eparina, proteine A e G, concanavalina A, poli(a) e Cibacron Blue F3G-A. Adsorbimento ed eluizione. La procedura per la cromatografia di affinità è del tutto simile a quella usata nelle altre cromatografie liquide. La colonna cromatografica viene impaccata con la matrice a cui è legato il ligando; quindi viene equilibrata con un tampone che favorisce il massimo di interazione con la macromolecola da purificare. Una volta applicato il campione, la colonna viene lavata con lo stesso tampone (per allontanare i composti contaminanti legati aspecificamente) prima di operare l eluizione vera e propria, che può essere specifica o aspecifica. Nell eluizione aspecifica, la macromolecola può venire staccata dalla fase stazionaria cambiando il ph o la forza ionica: una variazione di ph provoca una dissociazione dei gruppi del ligando o della macromolecola coinvolti nel loro attacco; una variazione della forza ionica, non necessariamente accompagnata da una di ph, provoca anch'essa un'attenuazione del legame tra proteina e ligando; solitamente si usa a questo scopo NaCl o sali caotropici, o ancora guanidina e urea; si hanno però problemi di denaturazione della proteina. Anche la modificazione della temperatura provoca una eluizione aspecifica, in quanto la sua diminuzione tende a ridurre le interazioni idrofobiche. Nel caso di enzimi, l'eluizione specifica si ha per aggiunta di substrato o inibitori reversibili oppure per aggiunta di composti dotati di maggiore affinità per il ligando. La glicina in HCl a ph 2-3 è l'eluente di elezione ad esempio per rompere l'interazione antigene-anticorpo, in questo caso l'anticorpo viene denaturato reversibilmente. Un altro metodo di eluizione comporta l'aggiunta di ligando libero, ma questa soluzione può essere molto costosa e se il legame è piuttosto forte possono essere necessarie elevate concentrazioni di ligando libero. Il materiale così eluito conterrà anche gli agenti impiegati per l'eluizione che dovranno essere successivamente rimossi. I problemi più rilevanti derivanti da questo tipo di cromatografia riguardano la bassa capacità degli adsorbenti, il ruolo dei legami aspecifici, la scelta del gruppo chimico da legare (tra un ligando di maggiori dimensioni e uno di minori dimensioni è più opportuno scegliere quello di maggiori dimensioni) e la stabilità del legame ligando-matrice o ligando-braccio spaziatore, che è relativa e determina una progressiva perdita di ligando.
3 13 ESEMPI DELL USO DI COLONNE DI AFFINITA PER PURIFICARE PROTEINE DI FUSIONE: LA MALTOSE-BINDING PROTEIN COME TAG
4 14 ESEMPI DELL USO DI COLONNE DI AFFINITA PER PURIFICARE PROTEINE DI FUSIONE: FUSIONE CON UN INTEINA
5 15 CROMATOGRAFIA DI INTERAZIONE IDROFOBICA Questo tipo di cromatografia nasce dall'osservazione della formazione di legami aspecifici tra proteine e bracci spaziatori idrofobici delle colonne di affinità. Infatti, anche se la superficie esterna delle proteine solubili è primariamente idrofilica, non mancano aree idrofobiche (più o meno estese), che sono ricoperte da molecole di H 2 O organizzate in strutture piuttosto ordinate, simil-cristalline, dette clatrati. Questi clatrati possono venire disgregati, e le aree idrofobiche possono essere scoperte, in presenza di alte concentrazioni di sali (vedi tecniche di precipitazione frazionata delle proteine in solfato d ammonio). Quindi, modulando il livello di solvatazione delle proteine mediante un alta concentrazione di sali, Proteina con superficie poco polare H possiamo favorire l interazione delle aree idrofobiche Proteina con superficie polare superficiali delle proteine con fasi stazionarie costituite P da catene alifatiche ed aromatiche. In pratica, si carica la colonna con una miscela di proteine in condizioni di alta forza ionica (evitare però il salting-out!), favorendo il legame delle proteine ai H P gruppi funzionali idrofobici della resina. Poi si eluisce con un gradiente decrescente di forza ionica, che H consente il distacco graduale delle proteine stesse.(il procedimento è in qualche modo l inverso di quanto si fa nel caso della cromatografia a scambio ionico). In casi particolari, il distacco delle proteine dalla fase stazionaria idrofobica può essere ottenuto mediante H agenti quali alcoli o ammine alifatiche, oppure detergenti non ionici (Tween 20, Triton X-100). Il problema, in questi casi, è sempre il rischio di denaturazione della proteina. P Le resine per la cromatografia di interazione idrofobica sono spesso costituite da una matrice di agarosio cui sono attaccati gruppi alchilici (esile, ottile) o fenilici (ad es., la resina Phenyl Sepharose). Di solito, non è possibile decidere a priori quale particolare resina legherà con maggiore efficienza una data proteina occorre fare l esperimento. Comunque, come regola approssimativa, il legame sarà più forte per gruppi funzionali (alchilici o aromatici) più grandi. P H A scopi didascalici, si può associare la cromatografia di interazione idrofobica quella di affinità per coloranti, dove la fase stazionaria contiene grosse molecole di colo rante (ad es., il Cybacron Blue), dotate di gruppi ionici e anelli aromatici, che legano in modo relativamente Per la natura complementare delle cromatografie di scambio ionico e di interazione idrofobica, le due tecniche sono spesso utilizzate in sequenza in un protocollo di purificazione. Per esempio, dopo uno scambio ionico, una frazione proteica si trova tipicamente ad alta forza ionica - la condizione ideale per passare direttamente su una colonna di interazione idrofobica. Viceversa, frazioni provenienti da una colonna di interazione idrofobica, eluite a bassa forza ionica, possono essere facilmente usate per una successiva cromatografia a scambio ionico.
6 16 TAVOLA RIASSUNTIVA: TECNICHE CROMATOGRAFICHE COMUNEMENTE UTILIZZATE PER LA PURIFICAZIONE DI PROTEINE Tecnica Caratteristiche Note Scambio ionico Capacità: alta Risoluzione: media Resa: media La forza ionica del campione caricato deve essere bassa. Le frazioni presentano diversi valori di ph o di forza ionica. Di solito è usata nei primi passaggi di purificazione Scambio idrofobico Affinità Capacità: alta Risoluzione: media Resa: media Capacità: media Risoluzione: elevata Resa: medio-bassa Può essere utilizzata con campioni a forza ionica elevata, ad es. derivanti da precipitazione con ammonio solfato. Le frazioni presentano diversi valori di ph o forza ionica. Il comportamento della proteina non è prevedibile a priori. Limitata dalla disponibilità di ligandi immobilizzati. L eluizione può causare la denaturazione del campione. Di solito è utilizzata negli ultimi passaggi della purificazione. Esclusione (gelfiltrazione) Capacità: media Resa: bassa Di solito si usa come ultimo passaggio in un protocollo di purificazione. Può fornire informazioni sul peso molecolare della proteina. Può essere usata per dissalare i campioni proteici.
7 17 HPLC (HIGH PERFORMANCE LIQUID CHROMATOGRAPHY) (Per alcuni autori, la P di HPLC sta per pressure anziché performance). E un moderno tipo di cromatografia, caratterizzata da una eluizione ad alte pressioni, che consente la separazione di miscele molto complesse (soprattutto di molecole piccole: vitamine, amminoacidi, nucleotidi, peptidi, farmaci etc ) in pochi minuti. Impiega gli stessi principi della cromatografia classica (di scambio ionico, di esclusione, di adsorbimento...) ma garantisce, oltre ai tempi ridotti, una elevata risoluzione ed una elevata sensibilità. Le colonne per HPLC sono costose e facilmente degradate da impurità presenti nel campione e nei solventi, per cui si ricorre spesso ad una breve pre-colonna (o colonna di protezione) contenente la stessa fase stazionaria della colonna vera e propria. La precolonna, posta a monte della colonna, trattiene tutti quei materiali che adsorbono in maniera irreversibile, e può essere sostituita periodicamente. Le colonne per HPLC sono generalmente di acciaio inossidabile e sono capaci di sopportare pressioni fino a 500 atmosfere. Di solito si usano colonne lunghe cm e con diametro interno di 1-4 mm, anche se attualmente sono disponibili colonne capillari di diametro inferiore. Solvente Pompa Comput Iniettore Precolonna Rivelatore Le colonne presentano una rifinitura interna a specchio che consente una buona impaccatura e, alle estremità, setti perforati in acciaio inox o in teflon per trattenere il materiale in esse contenuto. Colonna Raccoglitore di frazioni o scarti Lo sviluppo dell HPLC è stata reso possibile dalla fabbricazione di sistemi di pompaggio capaci di fornire adeguate pressioni e dalla sintesi di matrici costituite da particelle piccole ed indeformabili. Le piccole dimensioni delle particelle sono fondamentali, perché consentono un equilibramento più rapido dei soluti tra fase stazionaria e fase mobile, (cioè riducono il parametro C nell equazione di van Deemter) abbassando l altezza del piatto teorico e quindi aumentando la risoluzione. La rigidità delle particelle è essenziale per resistere alle alte pressioni utilizzate. I materiali impiegati per la costituzione della matrice possono essere di diversi tipi, ma di gran lunga prevalenti sono i gel di silice: particelle microporose di silice (preferibilmente sferiche, diametro di 5-15 µ ) oppure sferette di vetro ricoperto da una pellicola di silice (diametro di 40 µ ; si parla di supporto pellicolare, meno costoso ma meno efficiente delle particelle microporose di silice). La silice può essere derivatizzata con gruppi funzionali diversi, a seconda del tipo di cromatografia che si vuole applicare. Particella di silice
8 18 HPLC (continuazione) Per quanto riguarda la fase mobile, tutti i solventi usati per HPLC devono essere particolarmente puri, poiché anche tracce di contaminanti alterano le caratteristiche della colonna e interferiscono con il sistema di rivelazione, in particolare quando si misura l'assorbanza al di sotto dei 200 nm. E' sempre opportuno inserire, a monte della pompa, un microfiltro. E' inoltre molto importante che tutti i solventi siano degassati prima dell'uso, per evitare la formazione di bolle nelle pompe, soprattutto quando si impiegano miscele di etanolo o metanolo in acqua. La presenza di bolle d'aria nel sistema altererebbe infatti il potere di risoluzione della colonna e interferirebbe con la registrazione dell'effluente. Le separazioni possono essere di tipo isocratico (composizione costante della fase mobile), ma molto più comuni sono quelle in gradiente. Il gradiente si effettua grazie ad un programmatore di gradiente, che nella maggior parte dei casi, impiega due pompe. Colonna Loo Rivelato Interfaccia Eluent Iniettor Pomp Pompe per HPLC - Il sistema di pompaggio è una delle parti più importanti in un apparato per HPLC. A causa del sottile diametro della colonna e delle dimensioni estremamente ridotte delle particelle della fase stazionaria, si ha un'elevatissima resistenza al flusso del solvente. Per questo motivo, se si vogliono ottenere velocità di flusso soddisfacenti, occorre esercitare un'elevata pressione. Principale caratteristica di un buon sistema di pompaggio è la capacità di erogare il solvente ad elevata pressione (fino ad oltre 300 atmosfere), con un flusso continuo e non pulsante (le eventuali pulsazioni sono nocive per la colonna). Le pompe moderne per HPLC sono tutte a portata costante, cioè mantengono una velocità costante di flusso indipendentemente da variazioni di permeabilità della colonna. Il flusso può arrivare ml/min (dipende dal sistema). Ovviamente i materiali di costituzione della pompa dovranno essere resistenti ad ogni solvente.
9 19 HPLC (continuazione) Un tipo di pompa molto usato è quello a doppio (o triplo) pistone reciprocante. Un pistone reciprocante è un piccolo pistone mosso da un motore, che si muove avanti e indietro all interno di un cilindro a tenuta. Muovendosi all indietro, il pistone aspira solvente, attraverso la valvola di entrata, dal contenitore della fase mobile; in seguito, muovendosi in avanti, il pistone spinge il solvente dal cilindro alla colonna, attraverso la valvola di uscita. La velocità del flusso può venire modulata largamente cambiando la velocità del pistone e/o il volume di liquido ( µl) aspirato ad ogni ciclo. Le pompe a multiplo pistone sono formate da due (o tre) unità pistone-cilindro che operano con una sfasatura di 90 (o 120) gradi: in pratica, mentre una delle pompe è in fase di aspirazione, l altra è in fase di spinta. Ne risulta un flusso smorzato, continuo, di solvente alla colonna. Camme Piston e Valvola di uscita Valvola di entrata CARICAMENTO Alla colonna Iniezione Scarichi Iniettori Gli iniettori di un sistema HPLC consentono di introdurre volumi variabili di campione entro il circuito che porta alla colonna in condizioni di alta pressione ed in maniera molto riproducibile. Si utilizzano a questo scopo delle particolari valvole di iniezione a sei porte, come quella rappresentata sotto. Nella fase di caricamento, il campione viene inserito con una siringa entro un loop (un tubino ad ansa) che può essere più o meno lungo a seconda dei volumi che devono venire caricati. Il caricamento del campione spiazza il liquido presente in precedenza nel loop, scaricandolo all esterno. Successivamente, nella fase di iniezione, la valvola viene girata, piazzando il loop carico all interno del circuito dove passa l eluente, cosicché il campione raggiunge rapidamente la testa della colonna. In alcuni sistemi di HPLC analitica, l iniettore di tipo manuale è sostituito da INIEZIONE un apparecchio per Alla colonna l iniezione automatica, che consente di analizzare un gran numero di campioni in serie (ad es., durante l intera notte) senza bisogno di interventi da parte dell operatore. Scarichi
10 20 CROMATOGRAFIA DI RIPARTIZIONE La cromatografia di ripartizione è di gran lunga la tecnica più impiegata in HPLC. In questo tipo di cromatografia la fase stazionaria (considerata liquida, ma legata covalentemente ad una matrice di silice tramite i gruppi Si-OH del supporto) e quella mobile hanno differente polarità ed i composti vengono più o meno trattenuti in funzione dei loro diversi coefficienti di distribuzione nelle due fasi. Esistono due tipi principali di cromatografia di ripartizione, che si differenziano per la relativa polarità della fase stazionaria e della fase mobile: la cromatografia di ripartizione in fase normale e la cromatografia di ripartizione in fase inversa. Nel primo caso, la fase stazionaria è polare e la fase mobile è non polare; i diversi componenti di una miscela vengono quindi eluiti in ordine di polarità crescente. Nel caso della cromatografia in fase inversa, la fase stazionaria è apolare, mentre quella mobile è relativamente polare. I primi composti ad essere eluiti saranno quelli più polari e successivamente quelli meno polari. Tecnica Esempi di fase stazionaria Esempi di fase mobile Fase normale Gruppi ciano -CN Gruppi amminici -NH 2 Dioli -CHOH-CH 2 OH Esano, toluene, cloroformio, CCl 4 Etc. Fase inversa Dimetilsilil =Si(CH 2 ) 2 Ottilsilil =Si-(CH 2 ) 7 -CH 3 Ottadecilsilil (detto anche C18) =Si-(CH 2 ) 17 -CH 3 Fenilsilil =Si-(C 6 H 4 )-OH Acqua, acetonitrile, metanolo, propanolo etc., soli o in miscela Per la cromatografia in fase inversa, sono ora impiegate delle colonne particolari che vengono chiamate microbore. Queste colonne contengono particelle con diametro molto ridotto e hanno quindi un'ottima risoluzione. Sono colonne analitiche, con bassissimi tempi di eluizione (dell'ordine di 1,5-6 minuti), che permettono quindi una breve permanenza in colonna. L'eluizione avviene in un volume molto piccolo, cioè in elevata concentrazione di molecole, e quindi la sensibilità dei rivelatori aumenta notevolmente. Siete pregati di non confondere la croma tografia in fase inversa con la cromatografia di scambio idrofobico vista prima. Nella cromatografia a scambio idrofobico la fase mobile è una soluzione acquosa e la proteina nativa si lega ai gruppi funzionali esposti dalla resina. Nella cromatografia a fase inversa si
11 21 APPLICAZIONI DELL HPLC HPLC preparativa. - Mediante l HPLC si possono isolare e purificare (fino ad alti gradi di purezza) composti delle nature più diverse. Ovviamente il successo di una HPLC preparativa, in cui un dato composto deve essere separato da una miscela di sostanze simili, dipende anche dalla scelta delle fasi stazionaria (colonne) e mobile (eluenti). Per quanto riguarda le macromolecole biologiche, l HPLC può servire alla purificazione di proteine quando si impieghino colonne di gel-filtrazione o colonne a scambio ionico, anche se le alte pressioni impiegate possono dare qualche problema di denaturazione (in pratica, si tratta di una FPLC a pressioni più elevate). Anche l uso della cromatografia di ripartizione, in particolare la fase inversa, è generalmente da evitare per gli effetti di denaturazione e di perdita dell attività biologica. L HPLC è più usata per la purificazione di oligopeptidi (ormoni etc.) che vengono preparati mediante cromatografia di ripartizione sia in fase diretta che in fase inversa, a seconda anche della composizione amminoacidica del peptide. Gli oligonucleotidi (in particolare, quelli sintetizzati chimicamente su fase solida) possono anch essi venire purificati per HPLC, sia usando colonne a scambio ionico sia, più spesso, cromatografia in fase inversa (con colonne tipo C18; gli oligonucleotidi interagiscono con la colonna grazie alle basi azotate). Vitamine idro- e lipo-solubili, steroidi, ormoni tiroidei ed altre piccole molecole biologiche dotate di anelli aromatici sono purificate in modo rapido e conveniente utilizzando la cromatografia in fase inversa. Tipicamente, i processi preparativi con HPLC richiedono alti volumi di caricamento ed alti flussi. HPLC analitica. Per uso analitico, l HPLC viene utilizzata per separare, identificare e quantificare sostanze presenti in una miscela o in un campione (ad es., l HPLC è molto usata nei laboratori antidoping). In questi casi I volumi da caricare sono generalmente piccoli, e comunque le quantità della sostanza d interesse possono essere molto ridotte, quindi è cruciale la sensibilità dell apparecchiatura, in particolare del rivelatore. Come per l FPLC, il rivelatore può essere costituito da un sistema spettrofotometrico (quasi tutte le molecole organiche assorbono tra 200 e 300 nm) oppure fluorimetrico (se il composto è fluorescente) o ancora elettrochimico (se il composto può interagire con un elettrodo apposito e dare reazioni di ossidoriduzione). In apparati analitici molto avanzati, il rivelatore può essere rappresentato da uno spettrometro di massa. Una volta scelto il rivelatore più appropriato per la particolare sostanza che si vuole analizzare, la separazione (= ottenere un bel picco con un tempo di ritenzione decente e distinto dagli altri) sarà ancora dipendente dalla scelta di colonna e di fase mobile e, in misura minore, dalla velocità di flusso. L identificazione di un composto sarà basata fondamentalmente sul suo tempo di ritenzione in un certo set di condizioni (confrontare il cromatogramma di un campione ignoto con quello della sostanza pura o di una miscela a composizione nota). La quantificazione si basa sulla misura dell area di un dato picco cromatografico (che è ovviamente proporzionale alla quantità totale di sostanza transitata davanti al rivelatore) e sul confronto con preparati contenenti quantità note del composto d interesse (retta di taratura).
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
TECNICHE CROMATOGRAFICHE Le tecniche cromatografiche permettono di separare gli analiti presenti in una miscela complessa. Tutti i sistemi cromatografici sono costituiti da una fase stazionaria, che puo
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta)
 Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
cromatografia Esplorando le proteine
 Cromatografia Flavia Frabetti Tecnici di laboratorio 2010/2011 Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per
Cromatografia Flavia Frabetti Tecnici di laboratorio 2010/2011 Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per
TIPI di CROMATOGRAFIA
 Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
Metodo di separazione che si basa sulla distribuzione degli analiti tra una fase mobile e una fase stazionaria. TIPI di CROMATOGRAFIA Eluizione degli analiti può avvenire: Capillarità Gravità Pressione
GENERALITA SULLA CROMATOGRAFIA
 GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
GENERALITA SULLA CROMATOGRAFIA COSA SONO LE TECNICHE CROMATOGRAFICHE? La cromatografia consiste nello sfruttare la diversa attitudine di ogni molecola o ione nel distribuirsi fra 2 fasi differenti. Una
2. LA PURIFICAZIONE DI PROTEINE:
 2. LA PURIFICAZIONE DI PROTEINE: LA CROMATOGRAFIA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) LA PURIFICAZIONE DI PROTEINE Purificare
2. LA PURIFICAZIONE DI PROTEINE: LA CROMATOGRAFIA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU-16 ore) Marco Scocchi ( BIO/10-11) LA PURIFICAZIONE DI PROTEINE Purificare
TECNICHE CROMATOGRAFICHE
 TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
TECNICHE CROMATOGRAFICHE ISOLAMENTO DI MOLECOLE BIOLOGICHE Distruzione delle cellule e dei tessuti che contengono le molecole biologiche di nostro interesse (proteine o acidi nucleici) -Tampone (ph) -Sali
fase stazionaria fase mobile
 Cromatografia Insieme di tecniche che hanno lo scopo di separare una miscela nei suoi componenti, per permetterne il riconoscimento qualitativo e quantitativo. Sono basate sulla distribuzione dei vari
Cromatografia Insieme di tecniche che hanno lo scopo di separare una miscela nei suoi componenti, per permetterne il riconoscimento qualitativo e quantitativo. Sono basate sulla distribuzione dei vari
ESTRAZIONE PURIFICAZIONE. Modificazione chimica ANALISI STRUMENTALE
 Procedura per l analisi quali/quantitativa. Analita puro Composto di riferimento Curva di calibrazione Singolo-Più punti Campione biologico ESTRAZIONE PURIFICAZIONE Modificazione chimica ANALISI STRUMENTALE
Procedura per l analisi quali/quantitativa. Analita puro Composto di riferimento Curva di calibrazione Singolo-Più punti Campione biologico ESTRAZIONE PURIFICAZIONE Modificazione chimica ANALISI STRUMENTALE
V R V t. Proteine ad alto peso molecolare. Proteine a peso molecolare intermedio. Proteine a basso peso molecolare. Kd + piccolo.
 V 0 Proteine ad alto peso molecolare Proteine a peso molecolare intermedio V R V t Proteine a basso peso molecolare Kd elevato Kd piccolo Esclusione molecolare o gelfiltrazione = Volume totale V T = V
V 0 Proteine ad alto peso molecolare Proteine a peso molecolare intermedio V R V t Proteine a basso peso molecolare Kd elevato Kd piccolo Esclusione molecolare o gelfiltrazione = Volume totale V T = V
TIPI DI CROMATOGRAFIE
 Corso di Chimica Analitica TIPI DI CROMATOGRAFIE Prof. Paola Gramatica Fasi in successione: 2) Separazione dei componenti la miscela Dopo l isolamento della miscela da analizzare, se ne devono separare
Corso di Chimica Analitica TIPI DI CROMATOGRAFIE Prof. Paola Gramatica Fasi in successione: 2) Separazione dei componenti la miscela Dopo l isolamento della miscela da analizzare, se ne devono separare
CROMATOGRAFIA DOTT. JOANNA IZABELA LACHOWICZ
 CROMATOGRAFIA DOTT. JOANNA IZABELA LACHOWICZ Soltanto 23% delle sostanze possono essere separate nella GC Usando liquidi possiamo aumentare uso della cromatografia TIPI DI CROMATOGRAFIA RIPARTIZIONE
CROMATOGRAFIA DOTT. JOANNA IZABELA LACHOWICZ Soltanto 23% delle sostanze possono essere separate nella GC Usando liquidi possiamo aumentare uso della cromatografia TIPI DI CROMATOGRAFIA RIPARTIZIONE
Introduzione alla Chimica Analitica
 Corso di Chimica Ambientale Introduzione alla Chimica Analitica Prof. Paola Gramatica http://dipbsf.uninsubria.it/qsar dipbsf.uninsubria.it/qsar/ Education paola.gramatica @ uninsubria.it Prof. Paola Gramatica
Corso di Chimica Ambientale Introduzione alla Chimica Analitica Prof. Paola Gramatica http://dipbsf.uninsubria.it/qsar dipbsf.uninsubria.it/qsar/ Education paola.gramatica @ uninsubria.it Prof. Paola Gramatica
MATERIALE DIDATTICO. A supporto sono rese disponibili le slides delle lezioni
 MATERIALE DIDATTICO 1.Metodologie Biochimiche. Bonaccorsi, Contestabile, Di Salvo. Casa Editrice Ambrosiana. Ed.2012 2.Biochimica Applicata. Stoppini, Bellotti. EdiSES, 2012 3. Sono utilizzabili alcuni
MATERIALE DIDATTICO 1.Metodologie Biochimiche. Bonaccorsi, Contestabile, Di Salvo. Casa Editrice Ambrosiana. Ed.2012 2.Biochimica Applicata. Stoppini, Bellotti. EdiSES, 2012 3. Sono utilizzabili alcuni
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento
 TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
TECNICHE DI SEPARAZIONE DELLE PROTEINE Le proteine sono purificate con procedure di frazionamento Eliminazione selettiva di tutti gli altri componenti della miscela alla fine resta soltanto la sostanza
CROMATOGRAFIA IONICA (IC)
 CROMATOGRAFIA IONICA (IC) CROMATOGRAFIA CROMATOGRAFIA IONICA RESINE A SCAMBIO IONICO Struttura Meccanismo di scambio STRUMENTAZIONE IC SOPPRESSORE A MEMBRANA PROTOCOLLO DI ANALISI CROMATOGRAFIA Analisi
CROMATOGRAFIA IONICA (IC) CROMATOGRAFIA CROMATOGRAFIA IONICA RESINE A SCAMBIO IONICO Struttura Meccanismo di scambio STRUMENTAZIONE IC SOPPRESSORE A MEMBRANA PROTOCOLLO DI ANALISI CROMATOGRAFIA Analisi
Esercitazione 4: determinazione della concentrazione di sodio e potassio nelle urine mediante spettroscopia di emissione in fiamma
 Esercitazione 4: determinazione della concentrazione di sodio e potassio nelle urine mediante spettroscopia di emissione in fiamma Apparato strumentale Sodio e potassio vengono determinati in campioni
Esercitazione 4: determinazione della concentrazione di sodio e potassio nelle urine mediante spettroscopia di emissione in fiamma Apparato strumentale Sodio e potassio vengono determinati in campioni
CROMATOGRAFIA. Tecniche di purificazione
 CROMATOGRAFIA Tecniche di purificazione La cromatografia è tra i metodi fisici più impiegati per la separazione e la purificazione dei composti organici. Principio base (valido per tutte le tecniche cromatografiche)
CROMATOGRAFIA Tecniche di purificazione La cromatografia è tra i metodi fisici più impiegati per la separazione e la purificazione dei composti organici. Principio base (valido per tutte le tecniche cromatografiche)
cromatografia Elettroforesi
 Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Cromatografia ed Elettroforesi Prof.ssa Flavia Frabetti Esplorando le proteine Un passaggio indispensabile negli studi di biochimica che necessitano di conoscere la sequenza aa di una proteina per potere
Estrazione con solventi. Dott.ssa Laura Casu Laurea in chimica e tecnologie farmaceutiche 9 crediti
 Estrazione con solventi Dott.ssa Laura Casu Laurea in chimica e tecnologie farmaceutiche 9 crediti Estrazione in Soxhlet Vantaggi: Estrazione in continuo Refrigerante Svantaggi: richiede molte ore (12/24)
Estrazione con solventi Dott.ssa Laura Casu Laurea in chimica e tecnologie farmaceutiche 9 crediti Estrazione in Soxhlet Vantaggi: Estrazione in continuo Refrigerante Svantaggi: richiede molte ore (12/24)
GASCROMATOGRAFIA INTRODUZIONE
 GASCROMATOGRAFIA INTRODUZIONE La Gascromatografia è una tecnica analitica utile per separare componenti o soluti di una miscela, sulla base delle quantità relative di ogni soluto, distribuite fra un carrier
GASCROMATOGRAFIA INTRODUZIONE La Gascromatografia è una tecnica analitica utile per separare componenti o soluti di una miscela, sulla base delle quantità relative di ogni soluto, distribuite fra un carrier
Solida. una fase fissa (o stazionaria) Liquida. una fase mobile che la attraversa con un flusso continuo e provoca la migrazione dei soluti.
 TECNICHE CROMATOGRAFICHE insieme di tecniche che permettono di separare i soluti contenuti in un miscuglio omogeneo in base alla loro diversa distribuzione fra due fasi immiscibili: una fase fissa (o stazionaria)
TECNICHE CROMATOGRAFICHE insieme di tecniche che permettono di separare i soluti contenuti in un miscuglio omogeneo in base alla loro diversa distribuzione fra due fasi immiscibili: una fase fissa (o stazionaria)
2. SISTEMA DI PURIFICAZIONE CROMATOGRAFICA A MEDIA PRESSIONE (Biotage).
 1. APPARECCHIO PER REAZIONI A MICROONDE (Cem). Apparecchio per reazioni a microonde con sistema di sfiato automatico delle sovrappressioni, che consente di condurre reazioni che superano i 300 psi (20
1. APPARECCHIO PER REAZIONI A MICROONDE (Cem). Apparecchio per reazioni a microonde con sistema di sfiato automatico delle sovrappressioni, che consente di condurre reazioni che superano i 300 psi (20
CROMATOGRAFIA (applicazioni per la purificazione delle proteine) Dott.ssa Silvia Castelli
 CROMATOGRAFIA (applicazioni per la purificazione delle proteine) Dott.ssa Silvia Castelli Cellule eucario+che Cellule ba.eriche mrna DNA Isolato e purificato retrotrascri.o PCR Clonaggio in un ve,ore
CROMATOGRAFIA (applicazioni per la purificazione delle proteine) Dott.ssa Silvia Castelli Cellule eucario+che Cellule ba.eriche mrna DNA Isolato e purificato retrotrascri.o PCR Clonaggio in un ve,ore
GASCROMATOGRAFIA (UNA TECNICA DI SEPARAZIONE)
 GASCROMATOGRAFIA (UNA TECNICA DI SEPARAZIONE) Cromatografo Registratore Cromatogramma GC 1 14/15 1 COLONNE GC (IMPACCATE) Fase Mobile (Gas di trasporto) Supporto Solido Fase Stazionaria Liquida GC 1 14/15
GASCROMATOGRAFIA (UNA TECNICA DI SEPARAZIONE) Cromatografo Registratore Cromatogramma GC 1 14/15 1 COLONNE GC (IMPACCATE) Fase Mobile (Gas di trasporto) Supporto Solido Fase Stazionaria Liquida GC 1 14/15
ESERCIZI 2. Spiegare il principio di.
 ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
ESERCIZI 2 Spiegare il principio di. Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione
CROMATOGRAFIA A SCAMBIO IONICO IEC
 CROMATOGRAFIA A SCAMBIO IONICO IEC * WCX SCX SAX WAX *La costante dielettrica, indicata con e, è una grandezza fisica che quantifica la propensione di una sostanza a contrastare il campo elettrico presente
CROMATOGRAFIA A SCAMBIO IONICO IEC * WCX SCX SAX WAX *La costante dielettrica, indicata con e, è una grandezza fisica che quantifica la propensione di una sostanza a contrastare il campo elettrico presente
La cromatografia di adsorbimento
 La cromatografia di adsorbimento Cromatografia: serie di tecniche di separazione per scopi analitici e preparativi Tutte le tecniche cromatografiche operano sul principio che i componenti di una miscela
La cromatografia di adsorbimento Cromatografia: serie di tecniche di separazione per scopi analitici e preparativi Tutte le tecniche cromatografiche operano sul principio che i componenti di una miscela
ISIS A PONTI Gallarate
 4 A TCB 1 IL CROMATOGRAMMA: E il tracciato che descrive l andamento del segnale del rivelatore in funzione del tempo o del volume di eluente a partire dall istante in cui la miscela viene introdotta nella
4 A TCB 1 IL CROMATOGRAMMA: E il tracciato che descrive l andamento del segnale del rivelatore in funzione del tempo o del volume di eluente a partire dall istante in cui la miscela viene introdotta nella
Gas-cromatografia. onna.
 Gas-cromatografia La fase mobile è un gas. Le sostanze da separare (liquidi, solidi, gas) devono essere portate ad una temperatura sufficiente a renderle gassose o comunque portarle allo stato di vapore.
Gas-cromatografia La fase mobile è un gas. Le sostanze da separare (liquidi, solidi, gas) devono essere portate ad una temperatura sufficiente a renderle gassose o comunque portarle allo stato di vapore.
CROMATOGRAFIA LIQUIDA AD ALTA PRESSIONE (HPLC)
 CROMATOGRAFIA LIQUIDA AD ALTA PRESSIONE (HPLC) DESCRIZIONE GENERALE DELLO STRUMENTO L HPLC (High Performance Liquid Chromatography) è uno strumento analitico derivato dalla cromatografia classica e si
CROMATOGRAFIA LIQUIDA AD ALTA PRESSIONE (HPLC) DESCRIZIONE GENERALE DELLO STRUMENTO L HPLC (High Performance Liquid Chromatography) è uno strumento analitico derivato dalla cromatografia classica e si
CROMATOGRAFIA. Definizioni
 CROMATOGRAFIA Definizioni La cromatografia è una tecnica che permette di separare ed analizzare (sia per scopi qualitativi che quantitativi) miscele incognite liquide o gassose. Tutte le tecniche cromatografiche
CROMATOGRAFIA Definizioni La cromatografia è una tecnica che permette di separare ed analizzare (sia per scopi qualitativi che quantitativi) miscele incognite liquide o gassose. Tutte le tecniche cromatografiche
ESTRAZIONE CON SOLVENTE
 ESTRAZIONE CON SOLVENTE TECNICA DI SEPARAZIONE BASATA SUL TRASFERIMENTO SELETTIVO DI UNO O PIÙ COMPONENTI DI UNA MISCELA SOLIDA, LIQUIDA O GASSOSA DA UN SOLVENTE AD UN ALTRO SOLVENTE IMMISCIBILE CON IL
ESTRAZIONE CON SOLVENTE TECNICA DI SEPARAZIONE BASATA SUL TRASFERIMENTO SELETTIVO DI UNO O PIÙ COMPONENTI DI UNA MISCELA SOLIDA, LIQUIDA O GASSOSA DA UN SOLVENTE AD UN ALTRO SOLVENTE IMMISCIBILE CON IL
Jay Phelan, Maria Cristina Pignocchino. Scopriamo la biologia
 Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Jay Phelan, Maria Cristina Pignocchino Scopriamo la biologia Capitolo 2 Le molecole della vita 3 1. Le classi delle biomolecole Le biomolecole sono composti organici formati da: catene di atomi di carbonio,
Cromatografia. cromatogramma
 Cromatografia Il termine cromatografia racchiude una serie di metodi analitici impiegati per separare e quantificare singolarmente i diversi componenti presenti in miscele di analiti anche molto complesse.
Cromatografia Il termine cromatografia racchiude una serie di metodi analitici impiegati per separare e quantificare singolarmente i diversi componenti presenti in miscele di analiti anche molto complesse.
CROMATOGRAFIA SU STRATO SOTTILE (TLC)
 CROMATOGRAFIA SU STRATO SOTTILE (TLC) La fase stazionaria riveste con uno strato sottile una lastrina di vetro o alluminio La lastrina viene disposta verticalmente in un recipiente chiuso ermeticamente
CROMATOGRAFIA SU STRATO SOTTILE (TLC) La fase stazionaria riveste con uno strato sottile una lastrina di vetro o alluminio La lastrina viene disposta verticalmente in un recipiente chiuso ermeticamente
Biocatalizzatori. Tecniche di immobilizzazione e applicazioni biotecnologiche di cellule ed enzimi
 Biocatalizzatori Tecniche di immobilizzazione e applicazioni biotecnologiche di cellule ed enzimi BIOCATALIZZATORI Cellule in coltura l organismo viene cresciuto nel terreno A le cellule vengono raccolte
Biocatalizzatori Tecniche di immobilizzazione e applicazioni biotecnologiche di cellule ed enzimi BIOCATALIZZATORI Cellule in coltura l organismo viene cresciuto nel terreno A le cellule vengono raccolte
Modulo 3. Lavorare con le proteine
 Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
Modulo 3 Lavorare con le proteine La purificazione delle proteine Il primo passaggio nello studio delle proprietà di una proteina è la sua purificazione: la sua estrazione dalla matrice biologica in cui
La fase stazionaria è generalmente immobilizzata su di una matrice inerte quale agarosio, cellulosa, destrano, poliacrilammide, silice.
 Cromatografia La cromatografia è una tecnica di migrazione differenziata mediante la quale si possono separare analiti affini presenti in una miscela In ogni tipo di cromatografia si identificano : Una
Cromatografia La cromatografia è una tecnica di migrazione differenziata mediante la quale si possono separare analiti affini presenti in una miscela In ogni tipo di cromatografia si identificano : Una
La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione.
 Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
Tecniche di analisi chimica Prof. Marcello Romagnoli Titolazione La titolazione è un metodo di analisi chimica per la misura della concentrazione di una data sostanza in soluzione. Una quantità nota del
Cromatografia ionica (IC)
 Cromatografia ionica (IC) Il principio di base della cromatografia ionica è lo scambio ionico su resine scambiatrici forti, che costituiscono la fase stazionaria con cui sono impaccate le colonne, in parziale
Cromatografia ionica (IC) Il principio di base della cromatografia ionica è lo scambio ionico su resine scambiatrici forti, che costituiscono la fase stazionaria con cui sono impaccate le colonne, in parziale
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta)
 Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
Cromatografia Dal greco chroma : colore, graphein : scrivere 1903 Mikhail Twsett (pigmenti vegetali su carta) E il termine generico che indica una serie di tecniche di separazione di molecole simili in
PURIFICAZIONE DELLE PROTEINE
 PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
PURIFICAZIONE DELLE PROTEINE 1 proteina da 10.000-20.000 proteine diverse (in una cellula, tessuto) Il grado finale di purezza che si vuole raggiungere dipende dagli scopi. Cosa si intende per proteina
La frazione lipidica TRIGLICERIDI
 Dott. Raffaele Marrone [email protected] La frazione lipidica TRIGLICERIDI 1 TRANSESTERIFICAZIONE reazione di sostituzione nucleofila GAS CROMATOGRAFIA La tecnica cromatografica consiste nello
Dott. Raffaele Marrone [email protected] La frazione lipidica TRIGLICERIDI 1 TRANSESTERIFICAZIONE reazione di sostituzione nucleofila GAS CROMATOGRAFIA La tecnica cromatografica consiste nello
H.P.L.C. High Performance Liquid Chromatography
 Lezione 16 14.12.2015 H.P.L.C. High Performance Liquid Chromatography cromatografia liquida fase mobile allo stato liquido strumento costituito da: 1) riserva di fase mobile 2) filtro 3) sistema di pompaggio
Lezione 16 14.12.2015 H.P.L.C. High Performance Liquid Chromatography cromatografia liquida fase mobile allo stato liquido strumento costituito da: 1) riserva di fase mobile 2) filtro 3) sistema di pompaggio
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Università Degli Studi di Cagliari Facoltà Farmacia Corso di laurea in Tossicologia. Corso di Analisi Chimico-Tossicologica.
 Università Degli Studi di Cagliari Facoltà Farmacia Corso di laurea in Tossicologia Corso di Analisi Chimico-Tossicologica Distillazione La distillazione La distillazione consiste nel vaporizzare un liquido
Università Degli Studi di Cagliari Facoltà Farmacia Corso di laurea in Tossicologia Corso di Analisi Chimico-Tossicologica Distillazione La distillazione La distillazione consiste nel vaporizzare un liquido
metodi poco sensibili, laboriosi, costosi, e indaginosi
 dosaggi ormonali L ANALISI CHIMICA fasi di isolamento, purificazione e concentrazione elaborate non sufficientemente sensibile per il dosaggio di tutti gli ormoni nel sangue metodi poco sensibili, laboriosi,
dosaggi ormonali L ANALISI CHIMICA fasi di isolamento, purificazione e concentrazione elaborate non sufficientemente sensibile per il dosaggio di tutti gli ormoni nel sangue metodi poco sensibili, laboriosi,
In laboratorio si devono osservare delle norme necessarie ad evitare incidenti che talvolta possono rivelarsi estremamente pericolosi.
 In laboratorio si devono osservare delle norme necessarie ad evitare incidenti che talvolta possono rivelarsi estremamente pericolosi. 1. E ovviamente vietato fumare. 2. Non distrarsi in nessun caso, nè
In laboratorio si devono osservare delle norme necessarie ad evitare incidenti che talvolta possono rivelarsi estremamente pericolosi. 1. E ovviamente vietato fumare. 2. Non distrarsi in nessun caso, nè
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
Le biomolecole si trovano negli organismi viventi
 Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
Le biomolecole si trovano negli organismi viventi I viventi sono formati per la maggior parte da acqua e molecole, chiamate biomolecole. Le biomolecole sono sostanze contenenti carbonio. I composti del
ESERCIZI GASCROMATOGRAFIA
 ESERCIZI GASCROMATOGRAFIA A SPUNTI DI RIFLESSIONE 1. Che cosa si intende per sililazione di un supporto a base di gel di silice e quali sono i vantaggi che derivano da tale trattamento? 2. Spiegare per
ESERCIZI GASCROMATOGRAFIA A SPUNTI DI RIFLESSIONE 1. Che cosa si intende per sililazione di un supporto a base di gel di silice e quali sono i vantaggi che derivano da tale trattamento? 2. Spiegare per
1a ESERCITAZIONE CLOROFILLA
 1 a a ESERCITAZIONE 1 430 460 645 662 CLOROFILLA CAROTENOIIDII 2 3 PARTE I - ESTRAZIONE E DOSAGGIO DELLE CLOROFILLE Obiettivo: estrarre i pigmenti fogliari e quantificare per via spettrofotometrica la
1 a a ESERCITAZIONE 1 430 460 645 662 CLOROFILLA CAROTENOIIDII 2 3 PARTE I - ESTRAZIONE E DOSAGGIO DELLE CLOROFILLE Obiettivo: estrarre i pigmenti fogliari e quantificare per via spettrofotometrica la
Proteine: struttura e funzione
 Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
Proteine: struttura e funzione Prof.ssa Flavia Frabetti PROTEINE dal greco al 1 posto costituiscono il 50% circa del peso secco della maggior parte degli organismi viventi composti quaternari (C, H, O,
LE MOLECOLE BIOLOGICHE
 LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
LE MOLECOLE BIOLOGICHE Le cellule contengono quattro famiglie principali di molecole organiche Zuccheri (monosaccaridi) - forniscono una fonte di energia - subunità dei polisaccaridi Amminoacidi - subunità
REGISTRO DELLE LEZIONI 2005/2006. Tipologia. Addì Tipologia. Addì Tipologia
 Presentazione del corso. Modalità di svolgimento della prova di esame. Introduzione all'analisi organica qualitativa. Analisi organica qualitativa: comportamento alla calcinazione. Saggio di Laissagne
Presentazione del corso. Modalità di svolgimento della prova di esame. Introduzione all'analisi organica qualitativa. Analisi organica qualitativa: comportamento alla calcinazione. Saggio di Laissagne
Tra nm Nucleotidi mono-fosfato
 Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
Un estratto proteico può contenere acidi nucleici, nucleotidi Posso verificare la loro presenza mediante la misura di uno spettro di assorbimento. Gli acidi nucleici e i nucleotidi assorbono nell UV, grazie
1. Cromatografia per gel-filtrazione
 1. Cromatografia per gel-filtrazione La gel filtrazione è un metodo cromatografico che separa le sostanze in base alle loro dimensioni molecolari. I materiali che costituiscono il supporto per la gel-filtrazione
1. Cromatografia per gel-filtrazione La gel filtrazione è un metodo cromatografico che separa le sostanze in base alle loro dimensioni molecolari. I materiali che costituiscono il supporto per la gel-filtrazione
Analisi quantitative
 Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Analisi quantitative Diversi metodi per la quantificazione delle proteine totali (reazioni generali delle proteine): 1. Dosaggio spettrofotometrico diretto 2. Metodi colorimetrici 1. Dosaggio spettrofotometrico
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
CROMATOGRAFIA E SPETTROMETRIA DI MASSA DI COMPOSTI ORGANICI
 DIPARTIMENTO DI SCIENZE CHIMICHE Corso di laurea magistrale in Chimica organica e bioorganica Anno accademico 2017/2018-1 anno CROMATOGRAFIA E SPETTROMETRIA DI MASSA DI COMPOSTI ORGANICI CHIM/06-6 CFU
DIPARTIMENTO DI SCIENZE CHIMICHE Corso di laurea magistrale in Chimica organica e bioorganica Anno accademico 2017/2018-1 anno CROMATOGRAFIA E SPETTROMETRIA DI MASSA DI COMPOSTI ORGANICI CHIM/06-6 CFU
Sostanze non volatili possono essere derivatizzate
 Gascromatografia Permette la separazione di sostanze gassose o gassificabili variando la temperatura. Sono sostanze a basso peso molecolare, di natura poco polare, assolutamente non ionica. Eventualmente
Gascromatografia Permette la separazione di sostanze gassose o gassificabili variando la temperatura. Sono sostanze a basso peso molecolare, di natura poco polare, assolutamente non ionica. Eventualmente
 Appunti di Tecniche avanzate per il controllo degli alimenti Parte 4 ZEPPA G. BELVISO S. Università degli Studi di Torino High Performance Liquid Chromatography (HPLC) L HPLC, oggi, è considerata la tecnica
Appunti di Tecniche avanzate per il controllo degli alimenti Parte 4 ZEPPA G. BELVISO S. Università degli Studi di Torino High Performance Liquid Chromatography (HPLC) L HPLC, oggi, è considerata la tecnica
Cosa determina l assorbanza di un cromoforo?
 Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
Cosa determina l assorbanza di un cromoforo? I cromofori sono di solito caratterizzati da doppi legami e sistemi di risonanza Lo spettro di assorbimento di un cromoforo è solo parzialmente determinato
TECNICHE PER SEGUIRE L ANDAMENTO DI UNA REAZIONE
 Per effettuare una reazione chimica correttamente: 1. Si purificano (se necessario) reagenti e solventi. 2. Si mescolano i reagenti nelle opportune condizioni di reazione. 3. Si segue l andamento della
Per effettuare una reazione chimica correttamente: 1. Si purificano (se necessario) reagenti e solventi. 2. Si mescolano i reagenti nelle opportune condizioni di reazione. 3. Si segue l andamento della
SCHEMA DI UN GASCROMATOGRAFO
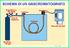 SCHEMA DI UN GASCROMATOGRAFO Regolatore a due Stadi Iniettore Rivelatore Gas di Trasporto Colonna Raccolta dei Dati Bombola del gas GC 2 14/15 1 REQUISITI DEL GAS DI TRASPORTO Filtro molecolare di 5 Angstrom
SCHEMA DI UN GASCROMATOGRAFO Regolatore a due Stadi Iniettore Rivelatore Gas di Trasporto Colonna Raccolta dei Dati Bombola del gas GC 2 14/15 1 REQUISITI DEL GAS DI TRASPORTO Filtro molecolare di 5 Angstrom
Tecniche di purificazione: cromatografia
 Tecniche di purificazione: cromatografia Il termine cromatografia indica un insieme di tecniche che hanno lo scopo di separare una miscela nei suoi componenti, per permetterne il riconoscimento qualitativo
Tecniche di purificazione: cromatografia Il termine cromatografia indica un insieme di tecniche che hanno lo scopo di separare una miscela nei suoi componenti, per permetterne il riconoscimento qualitativo
5- Estrazione ed analisi di DNA
 5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
5- Estrazione ed analisi di DNA Corso 240/350: Didattica di biochimica e biologia molecolare con laboratorio (2 CFU) 16 ore) Marco Scocchi ( BIO/10-11) La struttura del DNA La traduzione dell informazione
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI
 METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
METODI DI BASE PER L ANALISI DEGLI ACIDI NUCLEICI SPETTRI UV E QUANTIZZAZIONE SPETTROFOTOMETRICA DEGLI ACIDI NUCLEICI FIGURA 7.6A METODOLOGIA BIOCHIMICA (WILSON) a a = a 1 Assorbimento = a b a 1 b FIGURA
19a.5.1 Flaconcini in vetro, tipo Vial, con tappo in gomma rivestito in politetrafluoroetilene da 1.8-3.5-15 - 20 ml.
 Giugno 1993 19a. Fenoli 19a.l Principio del metodo II metodo si basa sull'analisi tramite cromatografia liquida ad alta prestazione (HPLC) di un estratto organico, ottenuto da un campione di fango o di
Giugno 1993 19a. Fenoli 19a.l Principio del metodo II metodo si basa sull'analisi tramite cromatografia liquida ad alta prestazione (HPLC) di un estratto organico, ottenuto da un campione di fango o di
Estrazione con solvente 18/01/2010. Laboratorio di chimica. Prof. Aurelio Trevisi
 Laboratorio di chimica Prof. Aurelio Trevisi Estrazione con solvente SCOPO: Estrarre mediante cicloesano lo iodio da una soluzione idroalcolica L estrazione con solventi si basa sulla diversa affinità
Laboratorio di chimica Prof. Aurelio Trevisi Estrazione con solvente SCOPO: Estrarre mediante cicloesano lo iodio da una soluzione idroalcolica L estrazione con solventi si basa sulla diversa affinità
