Prof. Giorgio Sartor. Cinetica enzimatica. Spontaneità
|
|
|
- Ada Antonelli
- 8 anni fa
- Visualizzazioni
Transcript
1 Prof. Giorgio Sartor Cinetica enzimatica Copyright by Giorgio Sartor. All rights reserved. Versione /03/2014 Spontaneità Una qualunque reazione chimica avviene spontaneamente se esolo se la variazione di energia libera ( G) è negativa: G T,p < 0 G T = T S A T e p costanti v gsartor Cinetica enzimatica - 2-1
2 Spontaneità Quindi, data una qualunque reazione chimica A B Essa avviene spontaneamente se le energie libere molari G B < G A Più in generale qualunque trasformazione avviene se e solo se: G finale < G iniziale v gsartor Cinetica enzimatica Spontaneità ed equilibrio Quando G B = G A Quindi G = 0 La reazione è all equilibrio A B v gsartor Cinetica enzimatica - 4-2
3 Spontaneità e realtà Questo non significa che una reazione chimica (un processo) esoergonica ( G < 0) avvenga con velocità apprezzabile. ATP + 2 P P P.. 2 ADP + Pi P + P P 2 G = -7.3 kcal mole -1 (-30.6 kj mole -1 ) a p 7 v gsartor Cinetica enzimatica Energia di attivazione In soluzione l ATP è stabile perché esiste l energia di attivazione. v gsartor Cinetica enzimatica - 6-3
4 Catalisi In assenza di catalizzatore: A + B C + D v gsartor Cinetica enzimatica Catalisi G = Energia di attivazione Energia libera A + B G G C + D Coordinate di reazione v gsartor Cinetica enzimatica - 8-4
5 Catalisi In presenza di catalizzatore: A + K AK AK + B ABK ABK C + D + K v gsartor Cinetica enzimatica Catalisi G c = Energia di attivazione in presenza di catalizzatore Energia libera G c A + B + K G AK + B C + D + K Coordinate di reazione v gsartor Cinetica enzimatica
6 Controllo termodinamica e controllo cinetico di una reazione gni reazione può avvenire se e solo se è termodinamicamente favorita ( G < 0), Avviene se e solo se vi è abbastanza energia per superare l energia di attivazione: ½ 2 Catalizzatore : essuno = 18 kcal mole -1 Platino = 11.7 kcal mole -1 Catalasi = 5.5 kcal mole -1 ( = energia di attivazione) v gsartor Cinetica enzimatica In una reazione chimica A B v = k [A] Velocità di reazione [A] v gsartor Cinetica enzimatica
7 Una reazione enzimatica k 1 k E + S ES 2 E + P k -1 v gsartor Cinetica enzimatica In una reazione enzimatica E + S ES E + P Velocità di reazione Bassa concentrazione di substrato >[E] v = k' [E o ] Alta concentrazione di substrato >>[E] v = k'' [E o ] v gsartor Cinetica enzimatica
8 Enzimi Gli enzimi sono sistemi catalitici, in genere proteine v gsartor Cinetica enzimatica Enzimi Gli enzimi sono sistemi catalitici, in genere proteine v gsartor Cinetica enzimatica
9 Specificità degli enzimi Specificità Stereochimica Assoluta Di gruppo Di legame v gsartor Cinetica enzimatica Specificità degli enzimi Specificità stereochimica steroide 11-β-monossigenasi β-idrossi steroide v gsartor Cinetica enzimatica
10 Specificità degli enzimi Specificità assoluta mannitolo-1-fosfato deidrogenasi C 2 C 2 C 2 P 3 - C 2 P 3 - mannitolo-1-fosfato fruttoso-6-fosfato v gsartor Cinetica enzimatica Specificità degli enzimi Specificità di gruppo Proteasi -Leu-Arg-Gly-Phe- Taglia qui v gsartor Cinetica enzimatica
11 Centro catalitico is57 Asp102 Ser195 v gsartor Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 E is57 Ser195 Gly193 Sito Specifico v gsartor Cinetica enzimatica
12 Meccanismo delle proteasi a serina Asp102 ES R is57 R Ser195 Gly193 Sito Specifico v gsartor Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 Intermedio tetraedrico R + is57 R Ser195 Gly193 Sito Specifico v gsartor Cinetica enzimatica
13 Meccanismo delle proteasi a serina Asp102 R + is57 R Ser195 Gly193 Sito Specifico v gsartor Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 is57 Ser195 Gly193 R R Acilenzima Sito Specifico v gsartor Cinetica enzimatica
14 Meccanismo delle proteasi a serina Asp102 R is57 R Sito Specifico Ser195 Gly193 v gsartor Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 is57 Ser195 Gly193 R Sito Specifico v gsartor Cinetica enzimatica
15 Meccanismo delle proteasi a serina Asp102 is57 + Intermedio tetraedrico R Ser195 Gly193 Sito Specifico v gsartor Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 is57 + R Ser195 Gly193 Sito Specifico v gsartor Cinetica enzimatica
16 Meccanismo delle proteasi a serina Asp102 is57 R Ser195 Gly193 Sito Specifico v gsartor Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 is57 Ser195 Gly193 Sito Specifico v gsartor Cinetica enzimatica
17 Meccanismo delle proteasi a serina v gsartor Cinetica enzimatica Proteasi a serina (1AX) v gsartor Cinetica enzimatica
18 Proteasi a serina (1AX) Gly193 Ser195 is57 v gsartor Cinetica enzimatica Specificità degli enzimi Specificità di legame Esterasi Estere Acido + Alcool v gsartor Cinetica enzimatica
19 Classificazione degli enzimi Singolo enzima Ureasi Complesso enzimatico Complesso piruvato deidrogenasi v gsartor Cinetica enzimatica Classificazione gerarchica degli enzimi gni enzima viene classificato a secondo della reazione che catalizza. Viene classificato con un numero: EC X.Y.Z.T X = classe Y = sottoclasse Z = sotto-sottoclasse T = numero dell enzima nella sottosottoclasse v gsartor Cinetica enzimatica
20 Classificazione gerarchica degli enzimi Classi: 1. ssidoreduttasi Catalizzano una reazione redox. 2. Transferasi Catalizzano il trasferimento di un gruppo da una molecola ad un altra: X-Y + Z X-Z + Y le chinasi trasferiscono un gruppo fosfato. 3. Idrolasi Catalizzano la scissione idrolitica di legami C=, C-, C-C, P--P, v gsartor Cinetica enzimatica Classificazione gerarchica degli enzimi Classi: 4. Liasi Catalizzano scissioni di legami con meccanismi diversi dalle ssidoreduttasi e dalle Idrolasi. 5. Isomerasi Catalizzano modificazioni geometriche. 6. Ligasi (Sintetasi) Catalizzano l unione di due molecole accoppiata al consumo di ATP o di un altro nucleotide trifosfato. v gsartor Cinetica enzimatica
21 Classificazione gerarchica degli enzimi Per esempio: Alcool + AD + Aldeide o chetone + AD ome comune: alcool deidrogenasi ome sistematico: alcool:ad + ossidoreduttasi EC umero dell enzima nella sotto-sottoclasse La sotto-sottoclasse con AD + o ADP + come accettori La sottoclasse Agiscono sul gruppo di donatori C- La classe - ssidoreduttasi v gsartor Cinetica enzimatica v gsartor Cinetica enzimatica
22 v gsartor Cinetica enzimatica v gsartor Cinetica enzimatica
23 v gsartor Cinetica enzimatica Isoenzimi Questa classificazione riguarda gli enzimi in quanto proteine ma in quanto CATALIZZATRI La classificazione riguarda quindi gli enziomi che catalizzano una reazione. Proteine diverse (con diversa struttura primaria) che catalizzano la stessa reazione, sono ISEZIMI v gsartor Cinetica enzimatica
24 Isoenzimi Sono le forme multiple dovute a differenze, determinate geneticamente, di struttura primaria Sono anche isoenzimi quelle proteine che svolgono la stessa funzione ma sono geneticamente indipendenti, per esempio: EC malato deidrogenasi Citosolica (codificata dal DA nucleare) Mitocondriale (codificata dal DA mitocondriale) v gsartor Cinetica enzimatica Cenni di cinetica chimica A k 1 k -1 B All equilibrio Velocità diretta v 1 = - Velocità inversa v -1 = - d[a] dt d[b] dt = k 1 [A] = k -1 [B] v 1 = v -1 k 1 [A] eq = k -1 [B] eq k 1 k -1 [B] eq = = K [A] eq eq v gsartor Cinetica enzimatica
25 Cenni di cinetica chimica rdine di reazione I ordine II ordine I ordine rispetto ad A I ordine rispetto a B II ordine globale v 1 = k 1 [A] v 1 = k 1 [A] 2 oppure v 1 = k 1 [A][B] rdine 0 v 1 = k 1 indipendente dalla concentrazione dei reagenti v gsartor Cinetica enzimatica Dipendenza dalla temperatura La velocità di una reazione dipende dalla temperatura attraverso la costante di velocità k v = k[a] All equilibrio k = A e - E att1 RT k A 1 e - E att1 RT 1 K - eq = = = Z e k -1 E - att1 A -1 e RT E att RT v gsartor Cinetica enzimatica
26 Dipendenza dalla temperatura K eq = Z e - E att RT = Z e - G - T S RT = Z e - RT S = Z e - RT - R K eq = e - RT lnk eq =- RT E att 1 Energia Reagenti E att -1 E att 1 -E att -1 = E att E att Η Prodotti Coordinate di reazione v gsartor Cinetica enzimatica Dipendenza dalla temperatura ln K eq ln K eq = - /R 1/T pendenza = - /R 1/T (K) v gsartor Cinetica enzimatica
27 Dipendenza dalla temperatura All equilibrio G = G + RT ln [Prodotti] [Reagenti] [Prodotti] [Reagenti] = K eq ; G = 0 0 = G + RT ln K eq G = - RT ln K eq G = - T S v gsartor Cinetica enzimatica Enzima e substrato In una reazione tra enzima (E) e substrato (S), possiamo distinguere tre fasi: 1. Legame tra E e S per formare il complesso ES E + S ES >>[E] d[es] Stato prestazionario 2. Stato stazionario dt = 0; 3. Scompare il substrato, [ES] diminuisce, v diminuisce v gsartor Cinetica enzimatica
28 Enzima e substrato Concentrazione [P] [ES] [ES]/ t 0 [E] Tempo v gsartor Cinetica enzimatica Enzima e substrato 1 a fase Stato Pre-stazionario 2 a fase Stato stazionario 3 a fase Fine Concentrazione d[p]/dt cost. [P] [ES] [ES]/ t 0 [E] µs ms s m h Tempo v gsartor Cinetica enzimatica
29 Enzima e substrato 1 a fase Stato Pre-stazionario 2 a fase Stato stazionario 3 a fase Fine Concentrazione d[p]/dt cost. [P] [ES] [ES]/ t 0 [E] µs ms s m h Tempo v gsartor Cinetica enzimatica Enzima e substrato 1 a fase Stato Pre-stazionario 2 a fase Stato stazionario 3 a fase Fine Concentrazione d/dt =cost d[p]/dt cost. d[p]/dt =cost d[es]/dt = 0 d[e]/dt =0 µs ms s m h Tempo v gsartor Cinetica enzimatica
30 Enzima e substrato In una reazione enzimatica l ordine di reazione è variabile Velocità di reazione v = k[e] rdine 1 v = k[e] Pseudo ordine 0 v gsartor Cinetica enzimatica Enzima e substrato In una reazione enzimatica l ordine di reazione è variabile rdine 1 rdine 0 Velocità Velocità v gsartor Cinetica enzimatica
31 Trattamento secondo Michaelis e Menten In una reazione enzimatica >>[E]: k 1 E + S ES (veloce) (1) k -1 k 2 ES E + P (lento) (2) v diretta = k 2 [ES] Per l equilibrio veloce (1) IDETERMIABILE k 1 K = = k -1 [ES] [E] IDETERMIABILE [ES] = k 1 k -1 [E] v gsartor Cinetica enzimatica Trattamento secondo Michaelis e Menten Per l equilibrio veloce (1) k 1 K = = k -1 [ES] [E] IDETERMIABILE [ES] = k 1 k -1 [E] [E tot ] misurabile [E tot ] = [E] + [ES] [ES] = k 1 k -1 ([E tot ]-[ES]) v gsartor Cinetica enzimatica
32 Trattamento secondo Michaelis e Menten Da cui [ES] = [E tot ] k -1 k 1 + k -1 = K d k 1 Costante di dissociazione del complesso ES ES k -1 E + S [E] [ES] k 1 = K d = Costante di Michaelis e Menten v gsartor Cinetica enzimatica Trattamento secondo Michaelis e Menten La concentrazione del complesso ES [ES] = [E tot ] + Poiché: v diretta = k 2 [ES] v diretta = k 2 [E tot ] + v gsartor Cinetica enzimatica
33 Trattamento secondo Michaelis e Menten Quando tutto E tot diventa ES allora la velocità sarà massima. = k 2 [E tot ] v = + Quando il substrato satura l enzima allora la velocità sarà massima v gsartor Cinetica enzimatica Equazione di Michaelis e Menten v = + v gsartor Cinetica enzimatica
34 Michaelis e Menten Leonor Michaelis ( ) Maud Menten ( ) v gsartor Cinetica enzimatica Efficienza catalitica o numero di turnover k 2 è detta anche k cat e si ottiene: k cat = [E tot ] k 2 è detto anche numero di turnover (Moli di substrato consumate per secondo per moli di enzima) si esprime in s -1. ~1 s -1 < k 2 < 10 6 s -1 v gsartor Cinetica enzimatica
35 Trattamento secondo Michaelis e Menten Bassa concentrazione (relativamente) di substrato: << (rdine 1) v = Velocità di reazione Alta concentrazione di substrato: >> (rdine 0) v = = v gsartor Cinetica enzimatica Trattamento secondo Briggs-aldane Da un punto di vista formale il trattamento è lo stesso di M.M., cambia il significato cinetico di E + S k 1 ES k 2 k -1 k -2 E + P Allo stato stazionario: d[es] dt = 0 = k 1 [E] - (k -1 [ES] + k 2 [ES]) formazione di ES scomparsa di ES [ES] = k 1 [E] (k -1 + k 2 ) v = + = k -1 + k 2 k 1 v gsartor Cinetica enzimatica
36 Significato di descrive l interazione substrato-enzima a livello del sito di legame. è, dimensionalmente, una concentrazione: k [E] -1 = K d = = ; moli l -1 [ES] k 1 È la concentrazione di substrato al quale la velocità della reazione è metà della v = = ; = ; + = v gsartor Cinetica enzimatica Significato di E + S k 1 ES k 2 k -1 k -2 E + P è legata a k 2 = k 2 [E tot ] Dipende dalla concentrazione dell enzima (induzione). v gsartor Cinetica enzimatica
37 Significato di k 2 k 2 è una frequenza /[E tot ] = k 2 (moli l -1 s -1 )/(moli l -1 ) k 2 = s -1 umero di eventi per unità di tempo (numero di turnover). Proprietà cinetica dell enzima. v gsartor Cinetica enzimatica Significato di e v = v v = 2 v gsartor Cinetica enzimatica
38 Enzima Sorgente Substrato Km (mm) n di turnover (1/s) Acetil-CoA sintasi Cuore di bue Acetato 1.4 ATP-asi Muscolo di coniglio ATP Alcool deidrogenasi Fegato di cavallo Etanolo 0.5 Anidrasi carbonica Eritrociti Anidride carbonica Acido aspartico 0.9 Aspartato aminotransferasi Cuore di maiale Acido α-chetoglutarico Acido ossalacetico acido glutammico 4 Butirril-CoA deidrogenasi Fegato di bue Butirril-CoA benziltirosinamide 2.5 -formiltirosinamide 12 Chimotripsina Pancreas bovino -acetiltirosinamide 32 gliciltirosinamide 122 Creatina fosfochinasi Muscolo di coniglio Creatina 19 Esochinasi Lievito Glucosio 0.15 Esochinasi Cervello Glucosio Fosfatasi acida Prostata α-glicerofosfato 3 Fosfogliceraldeide deidrogenasi Muscolo di coniglio Gliceraldeide-3-fosfato 0.05 Acido glutammico 0.12 Acido α-chetoglutarico 2 Glutamato deidrogenasi Fegato bovino Ione ammonio 57 AD AD Xantina 0.03 Xantina ossidasi Latte v gsartor Cinetica Acetaldeide enzimatica Enzima Sorgente Substrato Km (mm) n di turnover (1/s) Acetil-CoA sintasi Cuore di bue Acetato 1.4 ATP-asi Muscolo di coniglio ATP Alcool deidrogenasi Fegato di cavallo Etanolo 0.5 Anidrasi carbonica Eritrociti Anidride carbonica Acido aspartico 0.9 Aspartato aminotransferasi Cuore di maiale Acido α-chetoglutarico Acido ossalacetico acido glutammico 4 Butirril-CoA deidrogenasi Fegato di bue Butirril-CoA benziltirosinamide 2.5 -formiltirosinamide 12 Chimotripsina Pancreas bovino -acetiltirosinamide 32 gliciltirosinamide 122 Creatina fosfochinasi Muscolo di coniglio Creatina 19 Esochinasi Lievito Glucosio 0.15 Esochinasi Cervello Glucosio Fosfatasi acida Prostata α-glicerofosfato 3 Fosfogliceraldeide deidrogenasi Muscolo di coniglio Gliceraldeide-3-fosfato 0.05 Acido glutammico 0.12 Acido α-chetoglutarico 2 Glutamato deidrogenasi Fegato bovino Ione ammonio 57 AD AD Xantina 0.03 Xantina ossidasi Latte v gsartor Cinetica Acetaldeide enzimatica
39 Enzima Sorgente Substrato Km (mm) n di turnover (1/s) Acetil-CoA sintasi Cuore di bue Acetato 1.4 ATP-asi Muscolo di coniglio ATP Alcool deidrogenasi Fegato di cavallo Etanolo 0.5 Anidrasi carbonica Eritrociti Anidride carbonica Acido aspartico 0.9 Aspartato aminotransferasi Cuore di maiale Acido α-chetoglutarico Acido ossalacetico acido glutammico 4 Butirril-CoA deidrogenasi Fegato di bue Butirril-CoA benziltirosinamide 2.5 -formiltirosinamide 12 Chimotripsina Pancreas bovino -acetiltirosinamide 32 gliciltirosinamide 122 Creatina fosfochinasi Muscolo di coniglio Creatina 19 Esochinasi Lievito Glucosio 0.15 Esochinasi Cervello Glucosio Fosfatasi acida Prostata α-glicerofosfato 3 Fosfogliceraldeide deidrogenasi Muscolo di coniglio Gliceraldeide-3-fosfato 0.05 Acido glutammico 0.12 Acido α-chetoglutarico 2 Glutamato deidrogenasi Fegato bovino Ione ammonio 57 AD AD Xantina 0.03 Xantina ossidasi Latte v gsartor Cinetica Acetaldeide enzimatica Linearizzazione dell equazione di Michaelis e Menten v gsartor Cinetica enzimatica
40 Inversione Lineweaver-Burk v = + 1 v + K = = M v gsartor Cinetica enzimatica Lineweaver-Burk 1 v K = M /v 1/ Pendenza = / -1/ 0 1/ v gsartor Cinetica enzimatica
41 Eadie-ofstee Trasformazione v ( + ) = v + v = v v + = V max v v + = v/[s] / Pendenza = - 1/ v = - v 1 KM v v gsartor Cinetica enzimatica Eadie-ofstee (oppure) Trasformazione v ( + ) = v + v = v v + = V max v v + = v Pendenza = - / v v= - + v/[s] v gsartor Cinetica enzimatica
42 Reazioni enzimatiche con più substrati Meccanismo sequenziale: i substrati si legano in modo sequenziale: Prima uno poi l altro in ordine preciso: Meccanismo sequenziale ordinato Senza un ordine preciso: Meccanismo sequenziale casuale Meccanismo a ping-pong v gsartor Cinetica enzimatica Meccanismo sequenziale ordinato A + B E P + Q E + A EA; EA + B EAB; EAB EPQ; EPQ EQ + P; EQ E + Q v gsartor Cinetica enzimatica
43 Meccanismo sequenziale casuale A + B E P + Q E + A EA B Q EP E + P A EAB EPQ P E + B EB EQ E + Q DA PLIMERASI DIIDRFLAT REDUTTASI v gsartor Cinetica enzimatica Meccanismo a ping-pong A + B E P + Q E + A EA E'P E' + P E' + B E'B EQ E + Q A P B Q E E'A E'P E' E'B EQ E v gsartor Cinetica enzimatica
44 Centro catalitico is57 Asp102 Ser195 v gsartor Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 E + A R is57 R Ser195 Gly193 Sito Specifico v gsartor Cinetica enzimatica
45 Meccanismo delle proteasi a serina E A Asp102 R + is57 R Ser195 Gly193 Sito Specifico v gsartor Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 E A E P R + is57 R Ser195 Gly193 Sito Specifico v gsartor Cinetica enzimatica
46 Meccanismo delle proteasi a serina Asp102 E P + B R is57 R Sito Specifico Ser195 Gly193 Acilenzima v gsartor Cinetica enzimatica Reazioni enzimatiche con più substrati Il trattamento è complesso, occorre fare lo studio cinetico tenendo fissa la concentrazione di uno dei substrati (B) variando l altro (A), così, di grafici di Lineweaver-Burk si può avere una descrizione del meccanismo: [B] 1/v 1/v [B] Sequenziale casuale 1/[A] Ping-pong 1/[A] v gsartor Cinetica enzimatica
47 Regolazione dell attività enzimatica I fattori che regolano l attività enzimatica sono: Temperatura Enzimi solubili o di membrana p Effettori Inibitori (inattivatori) Attivatori Effetti allosterici Concentrazione di substrati e prodotti Vie metaboliche Repressione o induzione genica v gsartor Cinetica enzimatica Temperatura La velocità delle reazioni chimiche dipende dalla temperatura. La stabilità di una proteina dipende dalla temperatura. Denaturazione Aumento cinetico Velocità optimum Temperatura v gsartor Cinetica enzimatica
48 Temperatura Ln v La temperatura influenza la fluidità di membrana Enzima solubile Ln v Enzima di membrana Temperatura di transizione della fase lipidica Temperatura alta 1/T Temperatura Temperatura 1/T bassa alta Temperatura bassa v gsartor Cinetica enzimatica p La stabilità di una proteina dipende dal p. Alcuni processi coinvolgono valori estremi di p Pepsina Tripsina Aceticolinesterasi Velocità relativa 2 6 p 10 v gsartor Cinetica enzimatica
49 Effettori Attivatori Inibitori La differenza non è netta, la stessa molecola può funzionare in entrambi i modi a seconda delle condizioni Carica Concentrazione Enzima legato ad altre molecole v gsartor Cinetica enzimatica Inibitori Si definiscono inibitori quelle molecole che diminuiscono l attività di un enzima, possono dare Inibizione reversibile Modificano in modo reversibile (in genere attraverso un legame non covalente) l enzima Inibizione irreversibile Modificano in modo irreversibile l enzima v gsartor Cinetica enzimatica
50 Inibitori reversibili A secondo delle loro caratteristiche si definiscono: Inibitori competitivi Inibitori non competitivi Inibitori acompetitivi v gsartor Cinetica enzimatica Inibitori competitivi Agiscono competendo con il substrato per lo stesso sito di legame, agiscono quindi sulla formazione del complesso ES. L inibizione è rimossa aumentando la concentrazione di S E + S ES E + P = K i I EI E + P Ki = [E] [ES] [I][E] [EI] v gsartor Cinetica enzimatica
51 Inibitori competitivi Senza inibitore v = + v Con inibitore v = ( 1 + [I] K i ) + v gsartor Cinetica enzimatica Inibitori competitivi Senza inibitore 1 v K = M /V 1/ Con inibitore 1 v -1/(app) K = M [I] 1 1 ( 1 + ) + K i 0 1/ v gsartor Cinetica enzimatica
52 Sono molecole simili al substrato ccupano lo stesso sito di legame Inibitori competitivi SIT ATTIV DELL IZIMA SUBSTRAT IIBITRE PRDTTI SUBSTRAT ED IIBITRE SI LEGA ALL STESS SIT IL LEGAME DELL IIBITRE PREVIEE IL LEGAME DEL SUBSTRAT v gsartor Cinetica enzimatica Biosintesi del colesterolo C 3 Viene sintetizzato nelle cellule epatiche a partire da acetil-coa per formare 3-R-mevalonato. C 3 CoA S Acetil-CoA (C n ) CoA S Tiolasi S CoA 3 C C 3 Acetoacetil-CoA S CoA CoA S MG sintasi S CoA MG-CoA reduttasi I riduzione II riduzione APD + ADP idrossi-3-metil glutaril-coa MG-CoA C 3 S CoA ADP + + APD + C 3 3-R-mevalonato S CoA S CoA C 3 Intermedio legato all'enzima v gsartor Cinetica enzimatica
53 MG reduttasi EC È una glicoproteina di membrana del reticolo endoplamatico, Il suo peso molecolare è di 97 kd, Il sito attivo è rivolto verso il citoplasma. È anch essa regolata dal sistema protein chinasi. MG CoA ADP v gsartor Cinetica enzimatica MG reduttasi EC Viene inibita dalle statine, usate come farmaci per ridurre elevati livelli di colesterolo. Mevastatina v gsartor Cinetica enzimatica
54 Inibitori competitivi v gsartor Cinetica enzimatica Inibitori non competitivi Agiscono legandosi in un sito diverso dal sito di legame del substrato il quale può comunque legarsi. L inibizione è rimossa aumentando la concentrazione di S E + S + I ES + I E + P = [E] [ES] K K i [I][E] i [I][ES] K K i = = M [EI] [ESI] EI + S ESI v gsartor Cinetica enzimatica
55 Inibitori non competitivi Senza inibitore v = + v Con inibitore v = [I] ( 1 + ) K i + v gsartor Cinetica enzimatica Inibitori non competitivi Senza inibitore 1 v K = M /V 1/ Con inibitore -1/ 0 1/ 1 v K = M [I] 1 1 [I] ( 1 + ) + ( 1 + ) K i K i v gsartor Cinetica enzimatica
56 Inibitori non competitivi Sono molecole diverse dal substrato, si legano ad un proprio sito SIT ATTIV DELL IZIMA SIT IIBITRI (REGLATRI) IIBITRE SUBSTRAT Ioni metallici (Cu ++ ) Complessanti (EDTA) Modulatori I ASSEZA DI IBITRE SI FRMA I PRDTTI SUBSTRAT ED IIBITRE SI LEGA A SITI DIVERSI LA PRESEZA DELL IIBITRE RIDUCE LA VELCITÀ DI FRMAZIE DEL PRDTT v gsartor Cinetica enzimatica Inibitori acompetitivi Agiscono legandosi e bloccando il complesso enzima-substrato. E + S ES + I E + P = K i K i = [E] [ES] [I][ES] [ESI] ESI v gsartor Cinetica enzimatica
57 Inibitori acompetitivi Senza inibitore v = + Con inibitore v v = [I] ( 1 + ) K i [I] ( 1 + ) + K i v gsartor Cinetica enzimatica Inibitori acompetitivi Senza inibitore 1/V 1 v K = M / Con inibitore -1/(app) 0 1/ 1 v K = M 1 1 [I] + ( 1 + ) K i v gsartor Cinetica enzimatica
58 Riassumendo Inibizione competitiva K i E + S + I ES E + P = K i = [E] [ES] [I][E] [EI] Inibizione non competitiva EI + S E + S + I K i ES + I K i ' E + P K i ' = [I][ES] [ESI] EI + S ESI Inibizione acompetitiva E + S ES + I K i ' E + P ESI v gsartor Cinetica enzimatica riassumendo [I] a = (1 + ) K i [I] a' = (1 + ) K i ' Tipo di inibizione V MAX app app essuna V MAX Competitiva on competitiva Acompetitiva V MAX V MAX /a V MAX /a a a /a /a v gsartor Cinetica enzimatica
59 Inibitori irreversibili Inibitore Formula rigine Meccanismo Ione cianuro C - Mandorle amare Complessa gli ioni metallici nelle proteine Diisopropil fluorofosfato (DFP) 3 C C 3 F C 3 P C 3 Sintetico Inibisce gli enzimi con serina nel sito attivo Sarin 3 C C 3 F P C 3 Sintetico Come il DFP Fisostigmina 3 C 3 C C 3 Frutto del calabar Come il DFP C 3 v gsartor Cinetica enzimatica Inibitori irreversibili Inibitore Formula rigine Meccanismo Parathion C C 2 5 P S Sintetico Come il DFP (particolarmente attivo su acetilcolinesterasi di insetti) -tosil-lfenilalanina clorometil chetone (TPCK) S Cl Sintetico Reagisce con l is- 57 della chimotripsina R Penicillina S C 3 C 3 C 3 Penicillum otatum Inibisce gli enzimi della sintesi della parete batterica v gsartor Cinetica enzimatica
60 Attivatori Sono molecole che aumentano (o permettono) l attività enzimatica Protezione dell enzima Glutatione Ioni metallici Attivazione per azione sulle subunità Enzima inattivo + camp Subunità + Subunità catalitica regolatrice Azione proteolitica su proenzimi v gsartor Cinetica enzimatica Attivatori Azione proteolitica su proenzimi Tripsinogeno + Tripsina Enteropeptidasi Chimotripsinogeno + Proelastasi Elastasi + Procarbossipeptidasi + Carbossipeptidasi π-chimotripsina + α-chimotripsina v gsartor Cinetica enzimatica
61 Effetti allosterici Un enzima allosterico è, in genere, un oligomero con subunità correlate. Gli effetti allosterici consistono nel legame di un effettore ad un sito diverso da quello del substrato con conseguente variazione delle proprietà cinetiche dell enzima. L effettore può essere lo stesso substrato (effettori omotropici) o diverso (effettori eterotropici). Sito attivo Sito dell effettore v gsartor Cinetica enzimatica Effetto allosterico Un enzima allosterico è un oligomero con subunità correlate la cui attività (K m ) viene influenzate dal legame del substrato v gsartor Cinetica enzimatica
62 Effetti allosterici Il legame con l effettore modifica (modula) le proprietà di legame del substrato. La velocità dipende da come una sigmoide. v v = n K + n n = indice di cooperatività (costante di ill) n = 1 nessuna cooperatività n > 1 cooperatività positiva n < 1 cooperatività negativa v gsartor Cinetica enzimatica Effetti allosterici Il legame con l effettore modifica (modula) le proprietà di legame del substrato. La velocità dipende da come una sigmoide. v v = n K + n n = indice di cooperatività Emoglobina v gsartor Cinetica enzimatica
63 Vie metaboliche Una via metabolica è data da un insieme di reazioni catalizzate da enzimi che si susseguono l una all altra. Le vie metaboliche sono regolate: Inibizione da prodotto A B C D E Attivazione da substrato Attivazione compensatoria A B C D E A B C D E P K X Y Z v gsartor Cinetica enzimatica Vie metaboliche ramificate Inibizione multivalente A B C D E F G K X Y Inibizione cooperativa A B C D E F G K X Y v gsartor Cinetica enzimatica
64 Vie metaboliche ramificate Inibizione cumulativa A B C D E F G K I Z X Y Inibizione di enzimi multipli A B C D E F G K X Y v gsartor Cinetica enzimatica Catabolismo e anabolismo C S A B E F T Z X Y v gsartor Cinetica enzimatica
65 Regolazione genica Un altra via con la quale viene regolata l attività di uno o più enzimi è attraverso l induzione o la repressione genica della sintesi proteica di quella proteina con attività enzimatica. Anche per gli enzimi esiste una sorta di omeostasi. EZIMA mra SITESI DEMLIZIE AMIACIDI Induzione Repressione DA v gsartor Cinetica enzimatica Regolazione genica Un altra via con la quale viene regolata l attività di uno o più enzimi è attraverso l induzione o la repressione genica della sintesi proteica di quella proteina con attività enzimatica. Anche per gli enzimi esiste una sorta di omeostasi. EZIMA mra SITESI DEMLIZIE AMIACIDI Induzione Repressione DA v gsartor Cinetica enzimatica
66 Crediti e autorizzazioni all utilizzo Questo materiale è stato assemblato da informazioni raccolte dai seguenti testi di Biochimica: CAMPE Pamela, ARVEY Richard, FERRIER Denise R. LE BASI DELLA BICIMICA [ISB ] Zanichelli ELS David L., CX Michael M. I PRICIPI DI BICIMICA DI LEIGER - Zanichelli GARRETT Reginald., GRISAM Charles M. BICIMICA con aspetti molecolari della Biologia cellulare - Zanichelli VET Donald, VET Judith G, PRATT Charlotte W FDAMETI DI BICIMICA [ISB ] - Zanichelli E dalla consultazione di svariate risorse in rete, tra le quali: Kegg: Kyoto Encyclopedia of Genes and Genomes Brenda: Protein Data Bank: Rensselaer Polytechnic Institute: Il materiale è stato inoltre rivisto e corretto dalla Prof. Giancarla rlandini dell Università di Parma alla quale va il mio sentito ringraziamento. Questo ed altro materiale può essere reperito a partire da: oppure da gsartor.org/ Il materiale di questa presentazione è di libero uso per didattica e ricerca e può essere usato senza limitazione, purché venga riconosciuto l autore usando questa frase: Materiale ottenuto dal Prof. Giorgio Sartor Università di Bologna a Ravenna Giorgio Sartor - giorgio.sartor@unibo.it 66
Struttura delle proteine
 Struttura delle proteine I II III Copyright 2001-2015 by Giorgio Sartor. All rights reserved. Versione 1.0.2 oct 2015 Struttura quaternaria Èil livello di organizzazione per il quale si formano strutture
Struttura delle proteine I II III Copyright 2001-2015 by Giorgio Sartor. All rights reserved. Versione 1.0.2 oct 2015 Struttura quaternaria Èil livello di organizzazione per il quale si formano strutture
Prof. Giorgio Sartor. Cinetica enzimatica. Spontaneità
 Prof. Giorgio Sartor Cinetica enzimatica Copyright 2001-2017 by Giorgio Sartor. All rights reserved. B06 - Versione 1.9.4 Mar-17 Spontaneità Una qualunque reazione chimica avviene se e solo se la variazione
Prof. Giorgio Sartor Cinetica enzimatica Copyright 2001-2017 by Giorgio Sartor. All rights reserved. B06 - Versione 1.9.4 Mar-17 Spontaneità Una qualunque reazione chimica avviene se e solo se la variazione
BIOLOGIA GENERALE 22-24 ottobre 2007
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso a secco.
 Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso a secco. Svolgono funzioni biologiche di fondamentale importanza e possono
Le PROTEINE sono i biopolimeri maggiormente presenti all interno delle cellule, dal momento che costituiscono dal 40 al 70% del peso a secco. Svolgono funzioni biologiche di fondamentale importanza e possono
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 17
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 17 Enzimi Concetti chiave: Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni, specificità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 17 Enzimi Concetti chiave: Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni, specificità
Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti:
 Cinetica enzimatica Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti: ribozimi e abzimi Quasi tutti gli enzimi sono proteine
Cinetica enzimatica Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti: ribozimi e abzimi Quasi tutti gli enzimi sono proteine
ENZIMI CINETICA ENZIMATICA
 ENZIMI PERCHE UNA REAZIONE AVVENGA, SI DEVONO SODDISFARE TRE CONDIZIONI I SUBSTRATI DEVONO ENTRARE IN COLLISIONE LA COLLISIONE DEVE AVVENIRE CON ORIENTAMENTO CORRETTO I REAGENTI DEVONO AVERE ENERGIA SUFFICIENTE
ENZIMI PERCHE UNA REAZIONE AVVENGA, SI DEVONO SODDISFARE TRE CONDIZIONI I SUBSTRATI DEVONO ENTRARE IN COLLISIONE LA COLLISIONE DEVE AVVENIRE CON ORIENTAMENTO CORRETTO I REAGENTI DEVONO AVERE ENERGIA SUFFICIENTE
IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA.
 CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA FACOLTA DI MEDICINA E CHIRURGIA. IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA. Un enzima è una proteina capace di catalizzare una specifica reazione
CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA FACOLTA DI MEDICINA E CHIRURGIA. IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA. Un enzima è una proteina capace di catalizzare una specifica reazione
Tutte le reazioni che avvengono nelle cellule sono reazioni catalizzate I catalizzatori di tali reazioni prendono il nome di enzimi Gli enzimi sono
 Tutte le reazioni che avvengono nelle cellule sono reazioni catalizzate I catalizzatori di tali reazioni prendono il nome di enzimi Gli enzimi sono grosse molecole proteine e ribozimi (RNA) TEORIA DELLE
Tutte le reazioni che avvengono nelle cellule sono reazioni catalizzate I catalizzatori di tali reazioni prendono il nome di enzimi Gli enzimi sono grosse molecole proteine e ribozimi (RNA) TEORIA DELLE
1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi
 1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi ATP + glucosio glucochinasi ADP + glucosio-6-p E.C 2.7.1.2 glucochinasi E.C 2.7.1.1 esochinasi Energia libera,g S k 1 k 1 =
1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi ATP + glucosio glucochinasi ADP + glucosio-6-p E.C 2.7.1.2 glucochinasi E.C 2.7.1.1 esochinasi Energia libera,g S k 1 k 1 =
Metabolismo degli amminoacidi. Ciclo dell urea
 Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
Metabolismo degli amminoacidi Ciclo dell urea Biosintesi di amminoacidiporfirine, creatina, carnitina, ormoni, nucleotidi Gli amminoacidi possono subire una degradazione ossidativa in 3 diverse situazioni
Prof. Giorgio Sartor. Invertebrati marini. I nutrienti. Fonti di carbonio ed energia. Fonte di carbonio. Fonte di energia. Composti organici.
 Prof. Giorgio Sartor Invertebrati marini I nutrienti Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.1 nov 2008 Fonti di carbonio ed energia Organismo Fonte di carbonio Fonte di
Prof. Giorgio Sartor Invertebrati marini I nutrienti Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.1 nov 2008 Fonti di carbonio ed energia Organismo Fonte di carbonio Fonte di
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Biotecnologie Biochimiche DISPENSA
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 26 La gluconeogenesi Concetti chiave: Il fegato e il rene possono sintetizzare glucosio da lattato, piruvato e amminoacidi.
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 26 La gluconeogenesi Concetti chiave: Il fegato e il rene possono sintetizzare glucosio da lattato, piruvato e amminoacidi.
Regolazione del metabolismo del glucosio
 Regolazione del metabolismo del glucosio Regolazione coordinata di glicolisi e gluconeogenesi Glicolisi e gluconeogenesi sono regolate in modo reciproco La regolazione è a livello dei punti di deviazione
Regolazione del metabolismo del glucosio Regolazione coordinata di glicolisi e gluconeogenesi Glicolisi e gluconeogenesi sono regolate in modo reciproco La regolazione è a livello dei punti di deviazione
Metabolismo: Introduzione
 Metabolismo: Introduzione METABOLISMO Insieme delle reazioni chimiche coordinate e integrate che hanno luogo in tutte le cellule C A T A B O L I S M O Ossidazioni esoergoniche Alimenti: Carboidrati Lipidi
Metabolismo: Introduzione METABOLISMO Insieme delle reazioni chimiche coordinate e integrate che hanno luogo in tutte le cellule C A T A B O L I S M O Ossidazioni esoergoniche Alimenti: Carboidrati Lipidi
Importanza degli enzimi in Medicina
 ENZIMI Importanza degli enzimi in Medicina 1. Chiave per capire errori del metabolismo 2. Importanti nelle reazioni di detossificazione 3. Targets di chemioterapia 4. Essenziali per formulare il razionale
ENZIMI Importanza degli enzimi in Medicina 1. Chiave per capire errori del metabolismo 2. Importanti nelle reazioni di detossificazione 3. Targets di chemioterapia 4. Essenziali per formulare il razionale
Enzimi. Nomenclatura:
 Enzimi Nelle cellule, ad una temperatura di soli 37 C, avvengono reazioni (di ossidazione, di idrolisi, di sintesi, etc,) a velocità straordinarie, che richiederebbero temperature e pressioni elevate.
Enzimi Nelle cellule, ad una temperatura di soli 37 C, avvengono reazioni (di ossidazione, di idrolisi, di sintesi, etc,) a velocità straordinarie, che richiederebbero temperature e pressioni elevate.
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
Helena Curtis N. Sue Barnes LA RESPIRAZIONE CELLULARE INDICE Demolizione del glucosio Glicolisi Fermentazione lattica Fermentazione alcolica Respirazione cellulare Ciclo di Krebs Catena di trasporto degli
Cinetica enzimatica Inibitori enzimatici
 Cinetica enzimatica Inibitori enzimatici CINETICA ENZIMATICA Determinazione della velocità della reazione e di come questa cambia in risposta a modificazioni dei parametri sperimentali E il metodo più
Cinetica enzimatica Inibitori enzimatici CINETICA ENZIMATICA Determinazione della velocità della reazione e di come questa cambia in risposta a modificazioni dei parametri sperimentali E il metodo più
Metabolismo degli aminoacidi
 Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
Metabolismo degli aminoacidi Quando gli aminoacidi provenienti dalla digestione gastrica e intestinale, non vengono utilizzati per la costruzione di nuove proteine vengono demoliti Transaminazione Per
GLUCONEOGENESI. Sintesi (GENESI) di nuove (NEO) molecole di glucosio
 GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
GLUCONEOGENESI Sintesi (GENESI) di nuove (NEO) molecole di glucosio CATABOLISMO ANABOLISMO OSSIDAZIONI Produzione di ATP RIDUZIONI Consumo di ATP La GLUCONEOGENESI è un PROCESSO ANABOLICO La gluconeogenesi
Il metabolismo del glicogeno e la gluconeogenesi. Copyright 2013 Zanichelli editore S.p.A.
 Il metabolismo del glicogeno e la gluconeogenesi Copyright 2013 Zanichelli editore S.p.A. Capitolo 16 La demolizione del glicogeno Concetti chiave 16.1 Il glicogeno, la forma di immagazzinamento del glucosio,
Il metabolismo del glicogeno e la gluconeogenesi Copyright 2013 Zanichelli editore S.p.A. Capitolo 16 La demolizione del glicogeno Concetti chiave 16.1 Il glicogeno, la forma di immagazzinamento del glucosio,
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
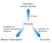 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) Metabolismo del glucosio La gluconeogenesi epatica è regolata
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) Metabolismo del glucosio La gluconeogenesi epatica è regolata
glicogeno Glucosio 6-P Piruvato Acetil CoA Intermedi del ciclo di Krebs
 PIRUVAT glicogeno Glicogeno sintesi glicogenolisi Glucosio Glucosio 6-P Ribosio 5-P glicolisi Gluconeogenesi Amino acidi Piruvato Acetil CoA lattato Intermedi del ciclo di Krebs Concentrazione di glicogeno
PIRUVAT glicogeno Glicogeno sintesi glicogenolisi Glucosio Glucosio 6-P Ribosio 5-P glicolisi Gluconeogenesi Amino acidi Piruvato Acetil CoA lattato Intermedi del ciclo di Krebs Concentrazione di glicogeno
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione
 REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
REAZIONI ORGANICHE Variazioni di energia e velocità di reazione Abbiamo visto che i composti organici e le loro reazioni possono essere suddivisi in categorie omogenee. Per ottenere la massima razionalizzazione
Gli enzimi. L azione degli enzimi è caratterizzata da alcune proprietà fondamentali:
 Gli enzimi Nel metabolismo energetico le cellule producono notevoli quantità di CO 2 che deve essere eliminata con l apparato respiratorio. Il trasferimento della CO 2 dalle cellule al sangue e da esso
Gli enzimi Nel metabolismo energetico le cellule producono notevoli quantità di CO 2 che deve essere eliminata con l apparato respiratorio. Il trasferimento della CO 2 dalle cellule al sangue e da esso
Prof. Giorgio Sartor. Il metabolismo. Metabolismo. È il processo che permette di ricavare energia da legami chimici (sottoforma di
 Prof. Giorgio Sartor Il metabolismo Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.4 oct 2008 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Prof. Giorgio Sartor Il metabolismo Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.4 oct 2008 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
GLUCONEOGENESI SINTESI DI NUOVO GLUCOSIO A PARTIRE DA FONTI NON GLUCIDICHE. L UOMO CONSUMA QUASI 160 g DI GLUCOSIO AL GIORNO
 GLUCONEOGENESI SINTESI DI NUOVO GLUCOSIO A PARTIRE DA FONTI NON GLUCIDICHE L UOMO CONSUMA QUASI 160 g DI GLUCOSIO AL GIORNO 75% DI TALE GLUCOSIO E NEL CERVELLO I FLUIDI CORPOREI CONTENGONO SOLO 20 g DI
GLUCONEOGENESI SINTESI DI NUOVO GLUCOSIO A PARTIRE DA FONTI NON GLUCIDICHE L UOMO CONSUMA QUASI 160 g DI GLUCOSIO AL GIORNO 75% DI TALE GLUCOSIO E NEL CERVELLO I FLUIDI CORPOREI CONTENGONO SOLO 20 g DI
METABOLISMO DEL Glucosio
 METABLISM DEL Glucosio Il metabolismo del glucosio può essere suddiviso nelle seguenti vie metaboliche: Glicolisi ssidazione del glucosio in acido piruvico e acido lattico. Via del pentoso fosfato Via
METABLISM DEL Glucosio Il metabolismo del glucosio può essere suddiviso nelle seguenti vie metaboliche: Glicolisi ssidazione del glucosio in acido piruvico e acido lattico. Via del pentoso fosfato Via
Respirazione cellulare
 Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2! 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2! 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Farmaci del sistema nervoso autonomo
 Farmaci del sistema nervoso autonomo Farmaci colinergici Esercitano i loro effetti farmacologici sul sistema nervoso parasimpatico che utilizza Acetilcolina come mediatore chimico L acetilcolina (Ach)
Farmaci del sistema nervoso autonomo Farmaci colinergici Esercitano i loro effetti farmacologici sul sistema nervoso parasimpatico che utilizza Acetilcolina come mediatore chimico L acetilcolina (Ach)
- CINETICA ENZIMATICA
 - CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
- CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
dieta vengono convertiti in composti dei corpi chetonici.
 Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
Metabolismo degli aminoacidi Metabolismo degli aminoacidi Gli aminoacidi introdotti in eccesso con la dieta vengono convertiti in composti precursori del glucosio, degli acidi grassi e dei corpi chetonici.
CONTROLLO ORMONALE DEL METABOLISMO GLUCIDICO DA PARTE DI GLUCAGONE, ADRENALINA E INSULINA
 CONTROLLO ORMONALE DEL METABOLISMO GLUCIDICO DA PARTE DI GLUCAGONE, ADRENALINA E INSULINA QUESTI ORMONI REGOLANO IL FLUSSO DEI METABOLITI NELLA GLICOLISI, NELLA GLICOGENO-SINTESI, NELLA GLIGENO-LISI E
CONTROLLO ORMONALE DEL METABOLISMO GLUCIDICO DA PARTE DI GLUCAGONE, ADRENALINA E INSULINA QUESTI ORMONI REGOLANO IL FLUSSO DEI METABOLITI NELLA GLICOLISI, NELLA GLICOGENO-SINTESI, NELLA GLIGENO-LISI E
Biosintesi non ribosomiale di metaboliti peptidici bioattivi
 Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
Biosintesi non ribosomiale di metaboliti peptidici bioattivi Principali bersagli degli antibiotici Gli antibiotici derivano per la maggior parte da composti naturali Strutture di alcuni peptidi bioattivi
MOVIMENTO. Motori molecolari. IV Movimento Miosina e actina. Prof. Giorgio Sartor. P04 - Versione 2.0 oct 2013
 Prof. Giorgio Sartor Motori molecolari IV Movimento Miosina e actina Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P04 - Versione 2.0 oct 2013 MOVIMENTO Miosina Actina P04 v. 2.0 gsartor
Prof. Giorgio Sartor Motori molecolari IV Movimento Miosina e actina Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P04 - Versione 2.0 oct 2013 MOVIMENTO Miosina Actina P04 v. 2.0 gsartor
Mediatore chimico. Recettore. Trasduzione del segnale. Risposta della cellula
 Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
Mediatore chimico Recettore Trasduzione del segnale Risposta della cellula I mediatori chimici sono prodotti da cellule specializzate e sono diffusi nell organismo da apparati di distribuzione Sistemi
Il glicogeno (riserva di glucosio) è immagazzinato nel fegato e nei muscoli (con finalità diverse )
 Glicogeno Glicogeno...1 Glicogenolisi...3 Glicogenosintesi...7 Regolazione ormonale della glicogenolisi e delle glicogenosintesi...13 Il recettore del glucagone e quello dell adrenalina sono 2 GPCR (G-Protein
Glicogeno Glicogeno...1 Glicogenolisi...3 Glicogenosintesi...7 Regolazione ormonale della glicogenolisi e delle glicogenosintesi...13 Il recettore del glucagone e quello dell adrenalina sono 2 GPCR (G-Protein
Prof. Maria Nicola GADALETA DISPENSA N. 18
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Metabolismo degli amminoacidi
 Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare e energia. La quantità di energia
Metabolismo degli amminoacidi Gli amminoacidi derivati in gran parte dalla degradazione delle proteine della dieta o intracellulari possono essere ossidati per generare e energia. La quantità di energia
N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi
 Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Glicina (Gly) Alanina (Ala) N 2, malgrado la sua abbondanza, è un fattore limitante la crescita della maggior parte degli organismi La digestione delle proteine endopeptidasi H O R H O R R H 3+ N -C-C-NH-C-C-NH-C-C-NH-C-C-NH-C-COO
Elettroforesi. Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita.
 Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
Elettroforesi Elettroforesi: processo per cui molecole cariche si separano in un campo elettrico a causa della loro diversa mobilita. A qualunque ph diverso dal pi le proteine hanno una carica netta quindi,
L adattamento dei batteri. Strategie di adattamento
 L adattamento dei batteri Strategie di adattamento mutazione trasferimento genico orizzontale regolazione dell espressione genica regolazione della trascrizione regolazione della traduzione regolazione
L adattamento dei batteri Strategie di adattamento mutazione trasferimento genico orizzontale regolazione dell espressione genica regolazione della trascrizione regolazione della traduzione regolazione
Il ciclo dell acido citrico
 Il ciclo dell acido citrico Il catabolismo di proteine, grassi e carboidrati avviene nelle tre fasi della respirazione cellulare Il piruvato viene ossidato ad acetil-coa e CO 2 La decarbossilazione
Il ciclo dell acido citrico Il catabolismo di proteine, grassi e carboidrati avviene nelle tre fasi della respirazione cellulare Il piruvato viene ossidato ad acetil-coa e CO 2 La decarbossilazione
Metabolismo degli Ammino Acidi
 Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
Metabolismo degli Ammino Acidi (La proteina stimola la secrezione della gastrina che stimola la secrezione di l e pepsinogeno) R 1 - R 2 - N 3 Transaminasi R 1 - R 2 - N 3 Transaminasi (amminotransferasi)
Casi più complicati. inibizione mista (competitiva e non competitiva)
 Casi più complicati inibizione mista (competitiva e non competitiva) reazioni reversibili reazioni a più substrati effetto del ph inibizione mista (competitiva e non competitiva) K I K I E + I EI ES +
Casi più complicati inibizione mista (competitiva e non competitiva) reazioni reversibili reazioni a più substrati effetto del ph inibizione mista (competitiva e non competitiva) K I K I E + I EI ES +
Prof. Giorgio Sartor. Il metabolismo. Metabolismo. È il processo che permette di ricavare energia da legami chimici (sottoforma di
 Prof. Giorgio Sartor Il metabolismo Copyright 2001-2017 by Giorgio Sartor. All rights reserved. Versione 1.6.1 Mar-17 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Prof. Giorgio Sartor Il metabolismo Copyright 2001-2017 by Giorgio Sartor. All rights reserved. Versione 1.6.1 Mar-17 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Attivitá e cinetica enzimatica
 Attivitá e cinetica enzimatica PAS : Classe di insegnamento A60 Biologia e scienze A.A. 2013/2014 09/05/2014 Cinetica Enzimatica La cinetica enzimatica è misurata come velocità di conversione del substrato
Attivitá e cinetica enzimatica PAS : Classe di insegnamento A60 Biologia e scienze A.A. 2013/2014 09/05/2014 Cinetica Enzimatica La cinetica enzimatica è misurata come velocità di conversione del substrato
MODULO 2 ENZIMI CARATTERISTICHE GENERALI
 MODULO 2 ENZIMI CARATTERISTICHE GENERALI Introduzione L elevatissimo numero di reazioni chimiche, che in ogni istante avvengono all interno e all esterno delle cellule che costituiscono i nostri tessuti
MODULO 2 ENZIMI CARATTERISTICHE GENERALI Introduzione L elevatissimo numero di reazioni chimiche, che in ogni istante avvengono all interno e all esterno delle cellule che costituiscono i nostri tessuti
Da dove prendono energia le cellule animali?
 Da dove prendono energia le cellule animali? La cellula trae energia dai legami chimici contenuti nelle molecole nutritive Probabilmente le più importanti sono gli zuccheri, che le piante sintetizzano
Da dove prendono energia le cellule animali? La cellula trae energia dai legami chimici contenuti nelle molecole nutritive Probabilmente le più importanti sono gli zuccheri, che le piante sintetizzano
FARMACODINAMICA RECETTORI ED EFFETTORI
 FARMACODINAMICA I recettori per i farmaci Prof. Renato Bernardini RECETTORI ED EFFETTORI Farmaco (Φαρµακον) = principio attivo Recettore = macromolecole deputate alla trasmissione di un segnale chimico
FARMACODINAMICA I recettori per i farmaci Prof. Renato Bernardini RECETTORI ED EFFETTORI Farmaco (Φαρµακον) = principio attivo Recettore = macromolecole deputate alla trasmissione di un segnale chimico
Prof. Maria Nicola GADALETA DISPENSA N. 16
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA DISPENSA N. 16
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Energia nelle reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Energia nelle reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO Introduzione (I) L energia chimica è dovuta al particolare arrangiamento degli atomi nei composti chimici e le varie forme di
Metabolismo dei composti azotati: aminoacidi e nucleotidi
 Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Metabolismo dei composti azotati: aminoacidi e nucleotidi Metabolismo degli aminoacidi I composti azotati L azoto contenuto nella cellula è presente soprattutto negli AMINOACIDI delle proteine e nelle
Metabolismo dei nucleotidi
 rof. Giorgio Sartor Metabolismo dei nucleotidi 1: introduzione 2: biosintesi de-novo delle purine 3: biosintesi de-novo delle pirimidine 4: catabolismo delle purine 5: catabolismo delle pirimidine 6: sintesi
rof. Giorgio Sartor Metabolismo dei nucleotidi 1: introduzione 2: biosintesi de-novo delle purine 3: biosintesi de-novo delle pirimidine 4: catabolismo delle purine 5: catabolismo delle pirimidine 6: sintesi
MACROSTRUTTURA DEL MUSCOLO STRIATO SCHELETRICO
 FUNZIONE DEL MUSCOLO SCHELETRICO Ultrastruttura della cellula muscolare. Miofilamenti. Meccanismo della contrazione. Trasmissione neuromuscolare. Scossa semplice e tetano muscolare. Unità motoria. PROPRIETA
FUNZIONE DEL MUSCOLO SCHELETRICO Ultrastruttura della cellula muscolare. Miofilamenti. Meccanismo della contrazione. Trasmissione neuromuscolare. Scossa semplice e tetano muscolare. Unità motoria. PROPRIETA
Selezione test GIOCHI DELLA CHIMICA
 Selezione test GIOCHI DELLA CHIMICA CLASSE A Velocità - Equilibrio - Energia Regionali 2010 36. Se il valore della costante di equilibrio di una reazione chimica diminuisce al crescere della temperatura,
Selezione test GIOCHI DELLA CHIMICA CLASSE A Velocità - Equilibrio - Energia Regionali 2010 36. Se il valore della costante di equilibrio di una reazione chimica diminuisce al crescere della temperatura,
Continua. Peptidasi H 2 O
 Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Continua Peptidasi H 2 O Classificazione delle peptidasi 1. Meccanismo catalitico 2. Tipo di reazione catalizzata 3. Struttura molecolare e omologia 1. Meccanismo catalitico (mostrato per la chimotripsina)
Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.
![Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro. Ke = ] = Kw = 10 = 10-7 moli/litro, ed in base a quanto avevamo affermato in precedenza: [H + ] = [OH - ] = 10-7 moli/litro.](/thumbs/27/12374782.jpg) Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
Prodotto ionico dell acqua e ph Prodotto ionico dell acqua L acqua è un elettrolita debolissimo e si dissocia secondo la reazione: H 2 O H + + OH - La costante di equilibrio dell acqua è molto piccola
SISTEMI ENERGETICI. L ATP privato di uno dei suoi 3 radicali fosforici diventa ADP (adenosindifosfato).
 SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
SISTEMI ENERGETICI LE FONTI ENERGETICHE MUSCOLARI I movimenti sono resi possibili, dal punto di vista energetico, grazie alla trasformazione, da parte dei muscoli, dell energia chimica ( trasformazione
Cofattori e vitamine
 Enzimi: concetti di base e meccanismi di catalisi enzimatica a. Classificazione, meccanismo d azione b. Esempi di reazioni catalizzate c. Descrizione di alcune tipiche proteine enzimatiche. Cofattori e
Enzimi: concetti di base e meccanismi di catalisi enzimatica a. Classificazione, meccanismo d azione b. Esempi di reazioni catalizzate c. Descrizione di alcune tipiche proteine enzimatiche. Cofattori e
Catena di Trasporto degli elettroni
 Chimica Biologica A.A. 2010-2011 Catena di Trasporto degli elettroni Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Respirazione - il catabolismo di tutti i combustibili
Chimica Biologica A.A. 2010-2011 Catena di Trasporto degli elettroni Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Respirazione - il catabolismo di tutti i combustibili
ENZIMI. Gli enzimi sono dei catalizzatori biologici
 ENZIMI Gli enzimi sono dei catalizzatori biologici catalizzatore: una sostanza che senza subire variazioni produce come effetto macroscopicamente apprezzabile un incremento della velocità di reazione La
ENZIMI Gli enzimi sono dei catalizzatori biologici catalizzatore: una sostanza che senza subire variazioni produce come effetto macroscopicamente apprezzabile un incremento della velocità di reazione La
Elementi di Cinetica Enzimatica
 Elementi di Cinetica Enzimatica Dalla Termodinamica sappiamo che una reazione chimica può avvenire solo se il G è minore di zero. Riferiamoci alla ben nota reazione A): reazione A) ATP + H 2 O ADP + P
Elementi di Cinetica Enzimatica Dalla Termodinamica sappiamo che una reazione chimica può avvenire solo se il G è minore di zero. Riferiamoci alla ben nota reazione A): reazione A) ATP + H 2 O ADP + P
FUNZIONI DEI MITOCONDRI
 FUNZIONI DEI MITOCONDRI La funzione principale dei mitocondri è di compiere le trasformazioni energetiche indispensabili per le funzioni cellulari. Metabolismo energetico: insieme delle reazioni chimiche
FUNZIONI DEI MITOCONDRI La funzione principale dei mitocondri è di compiere le trasformazioni energetiche indispensabili per le funzioni cellulari. Metabolismo energetico: insieme delle reazioni chimiche
Giovanni Di Bonaventura, Ph.D., B.Sc. Università di Chieti-Pescara
 Giovanni Di Bonaventura, Ph.D., B.Sc. Università di Chieti-Pescara Richieste metaboliche: elementi essenziali In generale, i batteri per la loro crescita hanno bisogno di elementi essenziali. In particolare
Giovanni Di Bonaventura, Ph.D., B.Sc. Università di Chieti-Pescara Richieste metaboliche: elementi essenziali In generale, i batteri per la loro crescita hanno bisogno di elementi essenziali. In particolare
METABOLISMO DEL GLICOGENO
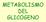 METABOLISMO DEL GLICOGENO Struttura del glicogeno DEMOLIZIONE DEL GLICOGENO: GLICOGENOLISI 1) distacco progressivo di unità glucosidiche con formazione di glucosio-1- fosfato: enzima: glicogeno fosforilasi
METABOLISMO DEL GLICOGENO Struttura del glicogeno DEMOLIZIONE DEL GLICOGENO: GLICOGENOLISI 1) distacco progressivo di unità glucosidiche con formazione di glucosio-1- fosfato: enzima: glicogeno fosforilasi
unità C2. Le trasformazioni energetiche nelle cellule
 unità 2. Le trasformazioni energetiche nelle cellule Il trasporto nelle cellule avviene senza consumo di energia con consumo di energia trasporto passivo trasporto attivo attraverso il doppio strato fosfolipidico
unità 2. Le trasformazioni energetiche nelle cellule Il trasporto nelle cellule avviene senza consumo di energia con consumo di energia trasporto passivo trasporto attivo attraverso il doppio strato fosfolipidico
GLICOGENOLISI & GLICOGENOSINTESI
 GLICOGENOLISI & GLICOGENOSINTESI ALIMENTARE Glucosio GLUCONEOGENESI GLICOGENOLISI (epatica) Glicemia: 70-90 mg/100ml ~ 5 mm GLICOGENO Nel fegato fino al 6-10% della massa epatica (~100 grammi) Nel muscolo
GLICOGENOLISI & GLICOGENOSINTESI ALIMENTARE Glucosio GLUCONEOGENESI GLICOGENOLISI (epatica) Glicemia: 70-90 mg/100ml ~ 5 mm GLICOGENO Nel fegato fino al 6-10% della massa epatica (~100 grammi) Nel muscolo
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici Studio delle macromolecole Lipidi
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
Farmacodinamica II. Mariapia Vairetti. Dipartimento di Medicina Interna e Terapia Sezione di Farmacologia e Tossicologia Cellulare e Molecolare
 Farmacodinamica II Mariapia Vairetti Dipartimento di Medicina Interna e Terapia Sezione di Farmacologia e Tossicologia Cellulare e Molecolare Processo di riconoscimento fra farmaco e recettore TIPI DI
Farmacodinamica II Mariapia Vairetti Dipartimento di Medicina Interna e Terapia Sezione di Farmacologia e Tossicologia Cellulare e Molecolare Processo di riconoscimento fra farmaco e recettore TIPI DI
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I
 Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I I TRASPORTI ATTRAVERSO MEMBRANE BIOLOGICHE Movimenti di piccoli soluti attraverso le membrane 2 categorie generali Trasporto
Corso di Laurea Magistrale in Medicina e Chirurgia Biofisica e Fisiologia I I TRASPORTI ATTRAVERSO MEMBRANE BIOLOGICHE Movimenti di piccoli soluti attraverso le membrane 2 categorie generali Trasporto
Niccolò Taddei Biochimica
 Niccolò Taddei Biochimica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono
Niccolò Taddei Biochimica VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido
 Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Il mantenimento dell omeostasi cellulare dipende dai sistemi che permettono lo scambio di molecole tra citoplasma e liquido extracellulare e dalla loro regolazione. Membrana cellulare Ogni cellula presenta
Domande relative alla specializzazione in: Biochimica clinica
 Domande relative alla specializzazione in: Biochimica clinica Domanda #1 (codice domanda: n.403) : Nell'ibridazione fluorescente in situ (Fluorescent in situ hybridization "FISH"), che tipo di sonde fluorescenti
Domande relative alla specializzazione in: Biochimica clinica Domanda #1 (codice domanda: n.403) : Nell'ibridazione fluorescente in situ (Fluorescent in situ hybridization "FISH"), che tipo di sonde fluorescenti
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Valitutti, Taddei, Kreuzer, Massey, Sadava, Hills, Heller, Berenbaum
 Dal carbonio agli OGM VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono evidenziate
Dal carbonio agli OGM VERSO L UNIVERSITÀ Le domande sono tratte dalle prove di ammissione emesse annualmente dal Ministero dell Istruzione, dell Università e della Ricerca (MIUR) e le soluzioni sono evidenziate
CHIMICA GENERALE MODULO
 Corso di Scienze Naturali CHIMICA GENERALE MODULO 6 Termodinamica Entalpia Entropia Energia libera - Spontaneità Relatore: Prof. Finelli Mario Scienza che studia i flussi energetici tra un sistema e l
Corso di Scienze Naturali CHIMICA GENERALE MODULO 6 Termodinamica Entalpia Entropia Energia libera - Spontaneità Relatore: Prof. Finelli Mario Scienza che studia i flussi energetici tra un sistema e l
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti.
 Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Una soluzione è un sistema omogeneo (cioè costituito da una sola fase, che può essere liquida, solida o gassosa) a due o più componenti. Solvente (componente presente in maggior quantità) SOLUZIONE Soluti
Esempio di domande possibili alla prova orale di Biochimica AA 2011-12 Farmacia1 - FERIOTTO
 Esempio di domande possibili alla prova orale di Biochimica AA 2011-12 Farmacia1 - FERIOTTO Lo studente spieghi: - Geometria dei legami del carbonio. - Principali gruppi funzionali delle biomolecole. -
Esempio di domande possibili alla prova orale di Biochimica AA 2011-12 Farmacia1 - FERIOTTO Lo studente spieghi: - Geometria dei legami del carbonio. - Principali gruppi funzionali delle biomolecole. -
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
Gli enzimi. Proprietà generali Classificazione e nomenclatura Catalisi enzimatica
 Gli enzimi Proprietà generali Classificazione e nomenclatura Catalisi enzimatica En-zima εν ζυμη nel lievito Enzima termine generico per definire un catalizzatore biologico Tranne che diversamente indicato,
Gli enzimi Proprietà generali Classificazione e nomenclatura Catalisi enzimatica En-zima εν ζυμη nel lievito Enzima termine generico per definire un catalizzatore biologico Tranne che diversamente indicato,
Prof. Maria Nicola GADALETA DISPENSA N. 19
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
SINTESI DELL RNA. Replicazione. Trascrizione. Traduzione
 SINTESI DELL RNA Replicazione Trascrizione Traduzione L RNA ha origine da informazioni contenute nel DNA La TRASCRIZIONE permette la conversione di una porzione di DNA in una molecola di RNA con una sequenza
SINTESI DELL RNA Replicazione Trascrizione Traduzione L RNA ha origine da informazioni contenute nel DNA La TRASCRIZIONE permette la conversione di una porzione di DNA in una molecola di RNA con una sequenza
Traduzione dell informazione genetica (1)
 Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
Traduzione dell informazione genetica (1) 1 Traduzione dell informazione genetica (2) Il processo negli eucarioti richiede: 70 diverse proteine ribosomiali >20 enzimi che attivano i precursori degli amminoacidi
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA
 PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
PROTEINE RESPIRATORIE DEI VERTEBRATI EMOGLOBINA E MIOGLOBINA Svolgono la loro funzione legando reversibilmente l OSSIGENO. Aumentano la solubilità dell ossigeno nel plasma, da 3ml/L a 220 ml/l. La mioglobina
La catalasi: un enzima in azione
 Percorso di Didattica laboratoriale La catalasi: un enzima in azione Scuola Secondaria di Secondo Grado IISS - IPSIA E. Majorana Bari Classe IV B Docente: Miralma Serio Organizzatore cognitivo: Le trasformazioni
Percorso di Didattica laboratoriale La catalasi: un enzima in azione Scuola Secondaria di Secondo Grado IISS - IPSIA E. Majorana Bari Classe IV B Docente: Miralma Serio Organizzatore cognitivo: Le trasformazioni
in Terminazione Neurone Dendriti Soma Fessura sinaptica sinaptica Nucleo dendrite Segmento iniziale Sinapsi inibitoria Segmento mielinico Assone
 Le funzioni del sistema nervoso si basano sull attività dei neuroni che consiste nel generare, trasmettere ed elaborare informazioni nervose, che dipendono da modificazioni del potenziale di membrana,
Le funzioni del sistema nervoso si basano sull attività dei neuroni che consiste nel generare, trasmettere ed elaborare informazioni nervose, che dipendono da modificazioni del potenziale di membrana,
DISCIPLINA CHIMICA ORGANICA E LABORATORIO A.S. 2013-2014
 DISCIPLINA CHIMICA ORGANICA E LABORATORIO A.S. 2013-2014 Personale dei docenti Loredana Decarlo Mascaro Salvatore per la classe V CH. Serale 1) PREREQUISITI Conoscenza dei gruppi funzionali e dei modelli
DISCIPLINA CHIMICA ORGANICA E LABORATORIO A.S. 2013-2014 Personale dei docenti Loredana Decarlo Mascaro Salvatore per la classe V CH. Serale 1) PREREQUISITI Conoscenza dei gruppi funzionali e dei modelli
CARBOSSILAZIONE/OSSIGENAZIONE
 CARBOSSILAZIONE/OSSIGENAZIONE COSA SUCCEDE SE LA TEMPERATURA AUMENTA? LEGGE DI HENRY: a T costante, la quantità di un gas che si scioglie in un dato liquido è proporzionale alla pressione parziale del
CARBOSSILAZIONE/OSSIGENAZIONE COSA SUCCEDE SE LA TEMPERATURA AUMENTA? LEGGE DI HENRY: a T costante, la quantità di un gas che si scioglie in un dato liquido è proporzionale alla pressione parziale del
CELLULE EUCARIOTICHE
 CELLULE EUCARIOTICHE Le cellule eucariotiche sono di maggiori dimensioni, rispetto a quelle procariotiche (almeno 10 volte più grandi) Oltre a: membrana plasmatica, citoplasma, DNA e ribosomi (comuni a
CELLULE EUCARIOTICHE Le cellule eucariotiche sono di maggiori dimensioni, rispetto a quelle procariotiche (almeno 10 volte più grandi) Oltre a: membrana plasmatica, citoplasma, DNA e ribosomi (comuni a
Regolazione della trascrizione. Operoni catabolici nei procarioti (controllo negativo)
 Regolazione della trascrizione Operoni catabolici nei procarioti (controllo negativo) I geni possono essere accesi e spenti In un organismo pluricellulare adulto, vi sono molti tipi di cellule differenti,
Regolazione della trascrizione Operoni catabolici nei procarioti (controllo negativo) I geni possono essere accesi e spenti In un organismo pluricellulare adulto, vi sono molti tipi di cellule differenti,
Biochimica Strutturale con Elementi di Enzimologia corso integrato di Struttura e Funzione delle Macromolecole Biologiche
 Biochimica Strutturale con Elementi di Enzimologia corso integrato di Struttura e Funzione delle Macromolecole Biologiche Codice Disciplina : BT019 Settore : BIO/10 N CFU: 6 Codice Corso integrato : BT067
Biochimica Strutturale con Elementi di Enzimologia corso integrato di Struttura e Funzione delle Macromolecole Biologiche Codice Disciplina : BT019 Settore : BIO/10 N CFU: 6 Codice Corso integrato : BT067
Nota dell editore Presentazione
 00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
00PrPag 3-08-2007 11:42 Pagina V Autori Nota dell editore Presentazione XI XIII XV Parte I Chimica 1 Struttura dell atomo 3 Teorie atomiche 3 Costituenti dell atomo 4 Numeri quantici 5 Tipi di orbitali
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 24
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 24 Una panoramica del metabolismo Concetti chiave: Organismi diversi utilizzano strategie differenti per catturare l'energia
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 24 Una panoramica del metabolismo Concetti chiave: Organismi diversi utilizzano strategie differenti per catturare l'energia
Le cellule eucariotiche svolgono durante la loro vita una serie ordinata di eventi che costituiscono il Ciclo Cellulare
 Le cellule eucariotiche svolgono durante la loro vita una serie ordinata di eventi che costituiscono il Ciclo Cellulare Interfase comprende le fasi G 1, S, and G 2 Sintesi di macromolecole durante la
Le cellule eucariotiche svolgono durante la loro vita una serie ordinata di eventi che costituiscono il Ciclo Cellulare Interfase comprende le fasi G 1, S, and G 2 Sintesi di macromolecole durante la
