Prof. Giorgio Sartor. Cinetica enzimatica. Spontaneità
|
|
|
- Carla Biagi
- 6 anni fa
- Visualizzazioni
Transcript
1 Prof. Giorgio Sartor Cinetica enzimatica Copyright by Giorgio Sartor. All rights reserved. B06 - Versione Mar-17 Spontaneità Una qualunque reazione chimica avviene se e solo se la variazione di energia libera ( G) è negativa: spontaneamente GT,p < 0 GT = T S A T e p costanti v gsartor B06 - Cinetica enzimatica -2-1
2 Spontaneità Quindi, data una qualunque reazione chimica A B Essa avviene spontaneamente se le energie libere molari G B < G A Più in generale qualunque trasformazione avviene se e solo se: G finale < G iniziale v gsartor B06 - Cinetica enzimatica - 3- Spontaneità ed equilibrio Quando G B = G A Quindi G = 0 La reazione è all equilibrio A B v gsartor B06 - Cinetica enzimatica - 4-2
3 Spontaneità e realtà Questo non significa che una reazione chimica (un processo) esoergonica ( G < 0) avvenga con velocità apprezzabile. ATP + 2 P P P.. 2 ADP + Pi P + P P 2 G = -7.3 kcal mole -1 (-30.6 kj mole -1 ) a p 7 v gsartor B06 - Cinetica enzimatica - 5- Energia di attivazione In soluzione l ATP è stabile perché esiste l energia di attivazione. v gsartor B06 - Cinetica enzimatica - 6-3
4 Catalisi In assenza di catalizzatore: A + B C + D v gsartor B06 - Cinetica enzimatica - 7- Catalisi G = Energia di attivazione Energia libera A + B G G C + D Coordinate di reazione v gsartor B06 - Cinetica enzimatica - 8-4
5 Catalisi In presenza di catalizzatore: A + K AK AK + B ABK ABK C + D + K v gsartor B06 - Cinetica enzimatica - 9- Catalisi G c = Energia di attivazione in presenza di catalizzatore Energia libera G c A + B + K G AK + B C + D + K Coordinate di reazione v gsartor B06 - Cinetica enzimatica
6 Controllo termodinamica e controllo cinetico di una reazione gni reazione può avvenire se e solo se è termodinamicamente favorita ( G < 0), Avviene se e solo se vi è abbastanza energia per superare l energia di attivazione: ½ 2 Catalizzatore : essuno = 18 kcal mole -1 Platino = 11.7 kcal mole -1 Catalasi = 5.5 kcal mole -1 ( = energia di attivazione) v gsartor B06 - Cinetica enzimatica In una reazione chimica A B v = k [A] Velocità di reazione [A] v gsartor B06 - Cinetica enzimatica
7 Una reazione enzimatica k 1 k E + S ES 2 E + P k -1 ES EP v gsartor B06 - Cinetica enzimatica In una reazione enzimatica E + S ES E + P Velocità di reazione Bassa concentrazione di substrato >[E] v = k' [E o ] Alta concentrazione di substrato >>[E] v = k'' [E o ] v gsartor B06 - Cinetica enzimatica
8 Enzimi Gli enzimi sono sistemi catalitici, in genere proteine v gsartor B06 - Cinetica enzimatica Enzimi Gli enzimi sono sistemi catalitici, in genere proteine v gsartor B06 - Cinetica enzimatica
9 Specificità degli enzimi Specificità Stereochimica Assoluta Di gruppo Di legame v gsartor B06 - Cinetica enzimatica Specificità degli enzimi Specificità stereochimica steroide 11-β-monossigenasi β-idrossi steroide v gsartor B06 - Cinetica enzimatica
10 Specificità degli enzimi Specificità assoluta mannitolo-1-fosfato deidrogenasi C 2 C 2 C 2 P 3 - C 2 P 3 - mannitolo-1-fosfato fruttoso-6-fosfato v gsartor B06 - Cinetica enzimatica Specificità degli enzimi Specificità di gruppo Proteasi -Leu-Arg-Gly-Phe- Taglia qui v gsartor B06 - Cinetica enzimatica
11 Centro catalitico is57 Asp102 Ser195 v gsartor B06 - Cinetica enzimatica Meccanismo delle proteasi a serina v gsartor B06 - Cinetica enzimatica
12 Meccanismo delle proteasi a serina Asp102 is57 Ser195 Gly193 E Sito Specifico v gsartor B06 - Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 ES R is57 R Ser195 Gly193 Sito Specifico v gsartor B06 - Cinetica enzimatica
13 Meccanismo delle proteasi a serina Asp102 Intermedio tetraedrico R + is57 R Ser195 Gly193 Sito Specifico v gsartor B06 - Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 R + is57 R Ser195 Gly193 Sito Specifico v gsartor B06 - Cinetica enzimatica
14 Meccanismo delle proteasi a serina Asp102 is57 Ser195 Gly193 R R Acilenzima Sito Specifico v gsartor B06 - Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 R is57 R Sito Specifico Ser195 Gly193 v gsartor B06 - Cinetica enzimatica
15 Meccanismo delle proteasi a serina Asp102 is57 Ser195 Gly193 R Sito Specifico v gsartor B06 - Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 is57 + Intermedio tetraedrico R Ser195 Gly193 Sito Specifico v gsartor B06 - Cinetica enzimatica
16 Meccanismo delle proteasi a serina Asp102 is57 + R Ser195 Gly193 Sito Specifico v gsartor B06 - Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 is57 R Ser195 Gly193 Sito Specifico v gsartor B06 - Cinetica enzimatica
17 Meccanismo delle proteasi a serina Asp102 is57 Ser195 Gly193 Sito Specifico v gsartor B06 - Cinetica enzimatica Meccanismo delle proteasi a serina v gsartor B06 - Cinetica enzimatica
18 Proteasi a serina (1AX) v gsartor B06 - Cinetica enzimatica Proteasi a serina (1AX) Gly193 Ser195 is57 v gsartor B06 - Cinetica enzimatica
19 Specificità degli enzimi Specificità di legame Esterasi Estere Acido + Alcool v gsartor B06 - Cinetica enzimatica Classificazione degli enzimi Singolo enzima Ureasi Complesso enzimatico Complesso piruvato deidrogenasi v gsartor B06 - Cinetica enzimatica
20 Classificazione gerarchica degli enzimi gni enzima viene classificato a secondo della reazione che catalizza. Viene classificato con un numero: EC X.Y.Z.T X = classe Y = sottoclasse Z = sotto-sottoclasse T = numero dell enzima nella sottosottoclasse v gsartor B06 - Cinetica enzimatica Classificazione gerarchica degli enzimi Classi: 1. ssidoreduttasi Catalizzano una reazione redox. 2. Transferasi Catalizzano il trasferimento di un gruppo da una molecola ad un altra: X-Y + Z X-Z + Y le chinasi trasferiscono un gruppo fosfato. 3. Idrolasi Catalizzano la scissione idrolitica di legami C=, C-, C-C, P--P, v gsartor B06 - Cinetica enzimatica
21 Classificazione gerarchica degli enzimi Classi: 4. Liasi Catalizzano scissioni di legami con meccanismi diversi dalle ssidoreduttasi e dalle Idrolasi. 5. Isomerasi Catalizzano modificazioni geometriche. 6. Ligasi (Sintetasi) Catalizzano l unione di due molecole accoppiata al consumo di ATP o di un altro nucleotide trifosfato. v gsartor B06 - Cinetica enzimatica Classificazione gerarchica degli enzimi Per esempio: Alcool + AD + Aldeide o chetone + AD ome comune: alcool deidrogenasi ome sistematico: alcool:ad + ossidoreduttasi EC umero dell enzima nella sotto-sottoclasse La sotto-sottoclasse con AD + o ADP + come accettori La sottoclasse Agiscono sul gruppo di donatori C- La classe - ssidoreduttasi v gsartor B06 - Cinetica enzimatica
22 v gsartor B06 - Cinetica enzimatica v gsartor B06 - Cinetica enzimatica
23 v gsartor B06 - Cinetica enzimatica v gsartor B06 - Cinetica enzimatica
24 Isoenzimi Questa classificazione riguarda gli enzimi in quanto proteine ma in quanto CATALIZZATRI La classificazione riguarda quindi gli enziomi che catalizzano una reazione. Proteine diverse (con diversa struttura primaria) che catalizzano la stessa reazione, sono ISEZIMI v gsartor B06 - Cinetica enzimatica Isoenzimi Sono le forme multiple dovute a differenze, determinate geneticamente, di struttura primaria Sono anche isoenzimi quelle proteine che svolgono la stessa funzione ma sono geneticamente indipendenti, per esempio: EC malato deidrogenasi Citosolica (codificata dal DA nucleare) Mitocondriale (codificata dal DA mitocondriale) v gsartor B06 - Cinetica enzimatica
25 Cenni di cinetica chimica A k 1 k -1 B All equilibrio Velocità diretta v 1 = - Velocità inversa v -1 = - d[a] dt d[b] dt = k 1 [A] = k -1 [B] v 1 = v -1 k 1 [A] eq = k -1 [B] eq k 1 k -1 [B] eq = = K [A] eq eq v gsartor B06 - Cinetica enzimatica Cenni di cinetica chimica rdine di reazione I ordine II ordine I ordine rispetto ad A I ordine rispetto a B II ordine globale v 1 = k 1 [A] v 1 = k 1 [A] 2 oppure v 1 = k 1 [A][B] rdine 0 v 1 = k 1 indipendente dalla concentrazione dei reagenti v gsartor B06 - Cinetica enzimatica
26 Dipendenza dalla temperatura La velocità di una reazione dipende dalla temperatura attraverso la costante di velocità k v = k[a] All equilibrio k = A e - E att1 RT k A 1 e - E att1 RT 1 K - eq = = = Z e k -1 E - att1 A -1 e RT E att RT v gsartor B06 - Cinetica enzimatica Dipendenza dalla temperatura K eq = Z e - E att RT = Z e - G - T S RT = Z e - RT S = Z e - RT - R K eq = e - RT lnk eq =- RT E att 1 Energia Reagenti E att -1 E att 1 -E att -1 = E att E att Η Prodotti Coordinate di reazione v gsartor B06 - Cinetica enzimatica
27 Dipendenza dalla temperatura ln K eq ln K eq = - /R 1/T pendenza = - /R 1/T (K) v gsartor B06 - Cinetica enzimatica Dipendenza dalla temperatura All equilibrio G = G + RT ln [Prodotti] [Reagenti] [Prodotti] [Reagenti] = K eq ; G = 0 0 = G + RT ln K eq G = - RT ln K eq G = - T S v gsartor B06 - Cinetica enzimatica
28 Reazione enzimatica k 1 k E + S ES 2 E + P k -1 ES EP v gsartor B06 - Cinetica enzimatica Enzima e substrato In una reazione tra enzima (E) e substrato (S), possiamo distinguere tre fasi: 1. Legame tra E e S per formare il complesso ES E + S ES >>[E] d[es] Stato prestazionario 2. Stato stazionario dt = 0; 3. Scompare il substrato, [ES] diminuisce, v diminuisce v gsartor B06 - Cinetica enzimatica
29 Enzima e substrato Concentrazione [P] [ES] [ES]/ t 0 [E] Tempo v gsartor B06 - Cinetica enzimatica Enzima e substrato 1 a fase Stato Pre-stazionario 2 a fase Stato stazionario 3 a fase Fine Concentrazione d[p]/dt cost. [P] [ES] [ES]/ t 0 [E] µs ms s m h Tempo v gsartor B06 - Cinetica enzimatica
30 Enzima e substrato 1 a fase Stato Pre-stazionario 2 a fase Stato stazionario 3 a fase Fine Concentrazione d[p]/dt cost. [P] [ES] [ES]/ t 0 [E] µs ms s m h Tempo v gsartor B06 - Cinetica enzimatica Enzima e substrato 1 a fase Stato Pre-stazionario 2 a fase Stato stazionario 3 a fase Fine Concentrazione d/dt =cost d[p]/dt cost. d[p]/dt =cost d[es]/dt = 0 d[e]/dt =0 µs ms s m h Tempo v gsartor B06 - Cinetica enzimatica
31 Enzima e substrato In una reazione enzimatica l ordine di reazione è variabile Velocità di reazione v = k[e] rdine 1 v = k[e] Pseudo ordine 0 v gsartor B06 - Cinetica enzimatica Enzima e substrato In una reazione enzimatica l ordine di reazione è variabile rdine 1 rdine 0 Velocità Velocità v gsartor B06 - Cinetica enzimatica
32 Trattamento secondo Michaelis e Menten In una reazione enzimatica >>[E]: k 1 E + S ES (veloce) (1) k -1 k 2 ES E + P (lento) (2) v diretta = k 2 [ES] Per l equilibrio veloce (1) IDETERMIABILE k 1 K = = k -1 [ES] [E] IDETERMIABILE [ES] = k 1 k -1 [E] v gsartor B06 - Cinetica enzimatica Trattamento secondo Michaelis e Menten Per l equilibrio veloce (1) k 1 K = = k -1 [ES] [E] IDETERMIABILE [ES] = k 1 k -1 [E] [E tot ] misurabile [E tot ] = [E] + [ES] [ES] = k 1 k -1 ([E tot ]-[ES]) v gsartor B06 - Cinetica enzimatica
33 Trattamento secondo Michaelis e Menten Da cui [ES] = [E tot ] k -1 k 1 + k -1 = K d k 1 Costante di dissociazione del complesso ES ES k -1 E + S [E] [ES] k 1 = K d = Costante di Michaelis e Menten v gsartor B06 - Cinetica enzimatica Trattamento secondo Michaelis e Menten La concentrazione del complesso ES [ES] = [E tot ] + Poiché: v diretta = k 2 [ES] v diretta = k 2 [E tot ] + v gsartor B06 - Cinetica enzimatica
34 Trattamento secondo Michaelis e Menten Quando tutto E tot diventa ES allora la velocità sarà massima. = k 2 [E tot ] v = + Quando il substrato satura l enzima allora la velocità sarà massima v gsartor B06 - Cinetica enzimatica Equazione di Michaelis e Menten v = + v gsartor B06 - Cinetica enzimatica
35 Michaelis e Menten Leonor Michaelis ( ) Maud Menten( ) v gsartor B06 - Cinetica enzimatica Efficienza catalitica o numero di turnover k 2 è detta anche k cat e si ottiene: k cat = [E tot ] k 2 è detto anche numero di turnover (Moli di substrato consumate per secondo per moli di enzima) si esprime in s -1. ~1 s -1 < k 2 < 10 6 s -1 v gsartor B06 - Cinetica enzimatica
36 Trattamento secondo Michaelis e Menten Bassa concentrazione (relativamente) di substrato: << (rdine 1) v = + Velocità di reazione Alta concentrazione di substrato: >> (rdine 0) v = + = TRASCURABILE TRASCURABILE v gsartor B06 - Cinetica enzimatica Trattamento secondo Briggs-aldane Da un punto di vista formale il trattamento è lo stesso di M.M., cambia il significato cinetico di E + S k 1 ES k 2 k -1 k -2 E + P Allo stato stazionario: d[es] dt = 0 = k 1 [E] - (k -1 [ES] + k 2 [ES]) formazione di ES scomparsa di ES [ES] = k 1 [E] (k -1 + k 2 ) v = + = k -1 + k 2 k 1 v gsartor B06 - Cinetica enzimatica
37 Significato di descrive l interazione substrato-enzima a livello del sito di legame. è una concentrazione: k [E] -1 = K d = = ; moli l -1 [ES] k 1 È la concentrazione di substrato al quale la velocità della reazione è metà della v = = ; = ; + = v gsartor B06 - Cinetica enzimatica Significato di E + S k 1 ES k 2 k -1 k -2 E + P è legata a k 2 = k 2 [E tot ] Dipende dalla concentrazione dell enzima: induzione genica, sintesi e degradazione delle proteine. v gsartor B06 - Cinetica enzimatica
38 Significato di k 2 k 2 è una frequenza /[E tot ] = k 2 (moli l -1 s -1 )/(moli l -1 ) k 2 = s -1 umero di eventi per unità di tempo (numero di turnover). Proprietà cinetica dell enzima. v gsartor B06 - Cinetica enzimatica Significato di e v = v v = 2 v gsartor B06 - Cinetica enzimatica
39 Enzima Sorgente Substrato Km (mm) n di turnover (1/s) Acetil-CoA sintasi Cuore di bue Acetato 1.4 ATP-asi Muscolo di coniglio ATP Alcool deidrogenasi Fegato di cavallo Etanolo 0.5 Anidrasi carbonica Eritrociti Anidride carbonica Acido aspartico 0.9 Aspartato aminotransferasi Cuore di maiale Acido α-chetoglutarico Acido ossalacetico acido glutammico 4 Butirril-CoA deidrogenasi Fegato di bue Butirril-CoA benziltirosinamide 2.5 -formiltirosinamide 12 Chimotripsina Pancreas bovino -acetiltirosinamide 32 gliciltirosinamide 122 Creatina fosfochinasi Muscolo di coniglio Creatina 19 Esochinasi Lievito Glucosio 0.15 Esochinasi Cervello Glucosio Fosfatasi acida Prostata α-glicerofosfato 3 Fosfogliceraldeide deidrogenasi Muscolo di coniglio Gliceraldeide-3-fosfato 0.05 Acido glutammico 0.12 Acido α-chetoglutarico 2 Glutamato deidrogenasi Fegato bovino Ione ammonio 57 AD AD Xantina 0.03 Xantina ossidasi Latte v gsartor B06 - Cinetica Acetaldeide enzimatica Enzima Sorgente Substrato Km (mm) n di turnover (1/s) Acetil-CoA sintasi Cuore di bue Acetato 1.4 ATP-asi Muscolo di coniglio ATP Alcool deidrogenasi Fegato di cavallo Etanolo 0.5 Anidrasi carbonica Eritrociti Anidride carbonica Acido aspartico 0.9 Aspartato aminotransferasi Cuore di maiale Acido α-chetoglutarico Acido ossalacetico acido glutammico 4 Butirril-CoA deidrogenasi Fegato di bue Butirril-CoA benziltirosinamide 2.5 -formiltirosinamide 12 Chimotripsina Pancreas bovino -acetiltirosinamide 32 gliciltirosinamide 122 Creatina fosfochinasi Muscolo di coniglio Creatina 19 Esochinasi Lievito Glucosio 0.15 Esochinasi Cervello Glucosio Fosfatasi acida Prostata α-glicerofosfato 3 Fosfogliceraldeide deidrogenasi Muscolo di coniglio Gliceraldeide-3-fosfato 0.05 Acido glutammico 0.12 Acido α-chetoglutarico 2 Glutamato deidrogenasi Fegato bovino Ione ammonio 57 AD AD Xantina 0.03 Xantina ossidasi Latte v gsartor B06 - Cinetica Acetaldeide enzimatica
40 Enzima Sorgente Substrato Km (mm) n di turnover (1/s) Acetil-CoA sintasi Cuore di bue Acetato 1.4 ATP-asi Muscolo di coniglio ATP Alcool deidrogenasi Fegato di cavallo Etanolo 0.5 Anidrasi carbonica Eritrociti Anidride carbonica Acido aspartico 0.9 Aspartato aminotransferasi Cuore di maiale Acido α-chetoglutarico Acido ossalacetico acido glutammico 4 Butirril-CoA deidrogenasi Fegato di bue Butirril-CoA benziltirosinamide 2.5 -formiltirosinamide 12 Chimotripsina Pancreas bovino -acetiltirosinamide 32 gliciltirosinamide 122 Creatina fosfochinasi Muscolo di coniglio Creatina 19 Esochinasi Lievito Glucosio 0.15 Esochinasi Cervello Glucosio Fosfatasi acida Prostata α-glicerofosfato 3 Fosfogliceraldeide deidrogenasi Muscolo di coniglio Gliceraldeide-3-fosfato 0.05 Acido glutammico 0.12 Acido α-chetoglutarico 2 Glutamato deidrogenasi Fegato bovino Ione ammonio 57 AD AD Xantina 0.03 Xantina ossidasi Latte v gsartor B06 - Cinetica Acetaldeide enzimatica Linearizzazione dell equazione di Michaelis e Menten v gsartor B06 - Cinetica enzimatica
41 Inversione Lineweaver-Burk v = + 1 v + K = = M v gsartor B06 - Cinetica enzimatica Lineweaver-Burk 1 v K = M /v 1/ Pendenza = / -1/ 0 1/ v gsartor B06 - Cinetica enzimatica
42 Eadie-ofstee Trasformazione v ( + ) = v + v = v v + = V max v v + = v/[s] / Pendenza = - 1/ v = - v 1 KM v v gsartor B06 - Cinetica enzimatica Eadie-ofstee (oppure) Trasformazione v ( + ) = v + v = v v + = V max v v + = v Pendenza = - / v v= - + v/[s] v gsartor B06 - Cinetica enzimatica
43 Reazioni enzimatiche con più substrati Meccanismo sequenziale: i substrati si legano in modo sequenziale: Prima uno poi l altro in ordine preciso: Meccanismo sequenziale ordinato Senza un ordine preciso: Meccanismo sequenziale casuale Meccanismo a ping-pong v gsartor B06 - Cinetica enzimatica Meccanismo sequenziale ordinato A + B E P + Q E + A EA; EA + B EAB; EAB EPQ; EPQ EQ + P; EQ E + Q v gsartor B06 - Cinetica enzimatica
44 Meccanismo sequenziale casuale A + B E P + Q E + A EA B Q EP E + P A EAB EPQ P E + B EB EQ E + Q DA PLIMERASI DIIDRFLAT REDUTTASI v gsartor B06 - Cinetica enzimatica Meccanismo a ping-pong A + B E P + Q E + A EA E'P E' + P E' + B E'B EQ E + Q A P B Q E E'A E'P E' E'B EQ E v gsartor B06 - Cinetica enzimatica
45 Centro catalitico is57 Asp102 Ser195 v gsartor B06 - Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 E + A R is57 R Ser195 Gly193 Sito Specifico v gsartor B06 - Cinetica enzimatica
46 Meccanismo delle proteasi a serina E A Asp102 R + is57 R Ser195 Gly193 Sito Specifico v gsartor B06 - Cinetica enzimatica Meccanismo delle proteasi a serina Asp102 E A E P R + is57 R Ser195 Gly193 Sito Specifico v gsartor B06 - Cinetica enzimatica
47 Meccanismo delle proteasi a serina Asp102 E P + B R is57 R Sito Specifico Ser195 Gly193 Acilenzima v gsartor B06 - Cinetica enzimatica Reazioni enzimatiche con più substrati Il trattamento è complesso, occorre fare lo studio cinetico tenendo fissa la concentrazione di uno dei substrati (B) variando l altro (A), così, di grafici di Lineweaver-Burk si può avere una descrizione del meccanismo: [B] 1/v 1/v [B] Sequenziale casuale 1/[A] Ping-pong 1/[A] v gsartor B06 - Cinetica enzimatica
48 Regolazione dell attività enzimatica I fattori che regolano l attività enzimatica sono: Temperatura Enzimi solubili o di membrana p Effettori Inibitori (inattivatori) Attivatori Effetti allosterici Concentrazione di substrati e prodotti Vie metaboliche Repressione o induzione genica v gsartor B06 - Cinetica enzimatica Temperatura La velocità delle reazioni chimiche dipende dalla temperatura. La stabilità di una proteina dipende dalla temperatura. Denaturazione Aumento cinetico Velocità optimum Temperatura v gsartor B06 - Cinetica enzimatica
49 Temperatura La temperatura influenza la fluidità di membrana Ln v Enzima solubile Ln v Enzima di membrana Temperatura di transizione della fase lipidica Temperatura alta 1/T Temperatura Temperatura 1/T bassa alta Temperatura bassa v gsartor B06 - Cinetica enzimatica p La stabilità di una proteina dipende dal p. Alcuni processi coinvolgono valori estremi di p Pepsina Tripsina Aceticolinesterasi Velocità relativa 2 6 p 10 v gsartor B06 - Cinetica enzimatica
50 Effettori Attivatori Inibitori La differenza non è netta, la stessa molecola può funzionare in entrambi i modi a seconda delle condizioni Carica Concentrazione Enzima legato ad altre molecole v gsartor B06 - Cinetica enzimatica Inibitori Si definiscono inibitori quelle molecole che diminuiscono l attività di un enzima, possono dare Inibizione reversibile Modificano in modo reversibile (in genere attraverso un legame non covalente) l enzima Inibizione irreversibile Modificano in modo irreversibile l enzima v gsartor B06 - Cinetica enzimatica
51 Inibitori reversibili A secondo delle loro caratteristiche si definiscono: Inibitori competitivi Inibitori non competitivi Inibitori acompetitivi v gsartor B06 - Cinetica enzimatica Inibitori competitivi Agiscono competendo con il substrato per lo stesso sito di legame, agiscono quindi sulla formazione del complesso ES. L inibizione è rimossa aumentando la concentrazione di S E + S ES E + P = K i I EI E + P Ki = [E] [ES] [I][E] [EI] v gsartor B06 - Cinetica enzimatica
52 Inibitori competitivi Senza inibitore v = + v Con inibitore v = ( 1 + [I] K i ) + v gsartor B06 - Cinetica enzimatica Inibitori competitivi Senza inibitore 1 v K = M /V 1/ Con inibitore 1 v -1/(app) K = M [I] 1 1 ( 1 + ) + K i 0 1/ v gsartor B06 - Cinetica enzimatica
53 Sono molecole simili al substrato ccupano lo stesso sito di legame Inibitori competitivi SIT ATTIV DELL IZIMA SUBSTRAT IIBITRE PRDTTI SUBSTRAT ED IIBITRE SI LEGA ALL STESS SIT IL LEGAME DELL IIBITRE PREVIEE IL LEGAME DEL SUBSTRAT v gsartor B06 - Cinetica enzimatica Biosintesi del colesterolo C 3 Viene sintetizzato nelle cellule epatiche a partire da acetil-coa per formare 3-R-mevalonato. C 3 CoA S Acetil-CoA (C n ) CoA CoA S S Tiolasi 3 C C 3 Acetoacetil-CoA S CoA CoA CoA S S MG sintasi MG-CoA reduttasi I riduzione II riduzione APD + ADP idrossi-3-metil glutaril-coa MG-CoA C 3 S CoA ADP + + APD + C 3 3-R-mevalonato S CoA S CoA C 3 Intermedio legato all'enzima v gsartor B06 - Cinetica enzimatica
54 MG reduttasi EC È una glicoproteina di membrana del reticolo endoplamatico, Il suo peso molecolare è di 97 kd, Il sito attivo è rivolto verso il citoplasma. È anch essa regolata dal sistema protein chinasi. MG CoA ADP v gsartor B06 - Cinetica enzimatica MG reduttasi EC Viene inibita dalle statine, usate come farmaci per ridurre elevati livelli di colesterolo. Mevastatina v gsartor B06 - Cinetica enzimatica
55 Inibitori competitivi v gsartor B06 - Cinetica enzimatica Inibitori non competitivi Agiscono legandosi in un sito diverso dal sito di legame del substrato il quale può comunque legarsi. L inibizione è rimossa aumentando la concentrazione di S E + S + I ES + I E + P = [E] [ES] K K i [I][E] i [I][ES] K K i = = M [EI] [ESI] EI + S ESI v gsartor B06 - Cinetica enzimatica
56 Inibitori non competitivi Senza inibitore v = + v Con inibitore v = [I] ( 1 + ) K i + v gsartor B06 - Cinetica enzimatica Inibitori non competitivi Senza inibitore 1 v K = M /V 1/ Con inibitore -1/ 0 1/ 1 v K = M [I] 1 1 [I] ( 1 + ) + ( 1 + ) K i K i v gsartor B06 - Cinetica enzimatica
57 Inibitori non competitivi Sono molecole diverse dal substrato, si legano ad un proprio sito SIT ATTIV DELL IZIMA SIT IIBITRI (REGLATRI) IIBITRE SUBSTRAT Ioni metallici (Cu ++ ) Complessanti (EDTA) Modulatori I ASSEZA DI IBITRE SI FRMA I PRDTTI SUBSTRAT ED IIBITRE SI LEGA A SITI DIVERSI LA PRESEZA DELL IIBITRE RIDUCE LA VELCITÀ DI FRMAZIE DEL PRDTT v gsartor B06 - Cinetica enzimatica Inibitori acompetitivi Agiscono legandosi e bloccando il complesso enzima-substrato. E + S ES + I E + P = K i K i = [E] [ES] [I][ES] [ESI] ESI v gsartor B06 - Cinetica enzimatica
58 Inibitori acompetitivi Senza inibitore v = + Con inibitore v v = [I] ( 1 + ) K i [I] ( 1 + ) + K i v gsartor B06 - Cinetica enzimatica Inibitori acompetitivi Senza inibitore 1/V 1 v K = M / Con inibitore -1/(app) 0 1/ 1 v K = M 1 1 [I] + ( 1 + ) K i v gsartor B06 - Cinetica enzimatica
59 Riassumendo Inibizione competitiva K i E + S + I ES E + P = K i = [E] [ES] [I][E] [EI] Inibizione non competitiva EI + S E + S + I K i ES + I K i ' E + P K i ' = [I][ES] [ESI] EI + S ESI Inibizione acompetitiva E + S ES + I K i ' E + P ESI v gsartor B06 - Cinetica enzimatica riassumendo [I] a = (1 + ) K i [I] a' = (1 + ) K i ' Tipo di inibizione V MAX app app essuna V MAX Competitiva on competitiva Acompetitiva V MAX V MAX /a V MAX /a a a /a /a v gsartor B06 - Cinetica enzimatica
60 Inibitori irreversibili Inibitore Formula rigine Meccanismo Ione cianuro C - Mandorle amare Complessa gli ioni metallici nelle proteine Diisopropil fluorofosfato (DFP) 3 C C 3 F C 3 P C 3 Sintetico Inibisce gli enzimi con serina nel sito attivo Sarin 3 C C 3 F P C 3 Sintetico Come il DFP Fisostigmina 3 C 3 C C 3 Frutto del calabar Come il DFP C 3 v gsartor B06 - Cinetica enzimatica Inibitori irreversibili Inibitore Formula rigine Meccanismo Parathion C C 2 5 P S Sintetico Come il DFP (particolarmente attivo su acetilcolinesterasi di insetti) -tosil-lfenilalanina clorometil chetone (TPCK) S Cl Sintetico Reagisce con l is- 57 della chimotripsina R Penicillina S C 3 C 3 C 3 Penicillum otatum Inibisce gli enzimi della sintesi della parete batterica v gsartor B06 - Cinetica enzimatica
61 Attivatori Sono molecole che aumentano (o permettono) l attività enzimatica Protezione dell enzima Glutatione Ioni metallici Attivazione per azione sulle subunità Enzima inattivo + camp Subunità + Subunità catalitica regolatrice Azione proteolitica su proenzimi v gsartor B06 - Cinetica enzimatica Attivatori Azione proteolitica su proenzimi Tripsinogeno + Tripsina Enteropeptidasi Chimotripsinogeno + Proelastasi Elastasi + Procarbossipeptidasi + Carbossipeptidasi π-chimotripsina + α-chimotripsina v gsartor B06 - Cinetica enzimatica
62 Effetti allosterici Un enzima allosterico è, in genere, un oligomero con subunità correlate. Gli effetti allosterici consistono nel legame di un effettore ad un sito diverso da quello del substrato con conseguente variazione delle proprietà cinetiche dell enzima. L effettore può essere lo stesso substrato (effettori omotropici) o diverso (effettori eterotropici). Sito attivo Sito dell effettore v gsartor B06 - Cinetica enzimatica Effetto allosterico Un enzima allosterico è un oligomero con subunità correlate la cui attività (K m ) viene influenzate dal legame del substrato v gsartor B06 - Cinetica enzimatica
63 Effetti allosterici Il legame con l effettore modifica (modula) le proprietà di legame del substrato. La velocità dipende da come una sigmoide. v v = n K + n n = indice di cooperatività (costante di ill) n = 1 nessuna cooperatività n > 1 cooperatività positiva n < 1 cooperatività negativa v gsartor B06 - Cinetica enzimatica Effetti allosterici Il legame con l effettore modifica (modula) le proprietà di legame del substrato. La velocità dipende da come una sigmoide. v v = n K + n n = indice di cooperatività Emoglobina v gsartor B06 - Cinetica enzimatica
64 Vie metaboliche Una via metabolica è data da un insieme di reazioni catalizzate da enzimi che si susseguono l una all altra. Le vie metaboliche sono regolate: Inibizione da prodotto A B C D E Attivazione da substrato A B C D E Attivazione compensatoria A B C D E K X Y Z P v gsartor B06 - Cinetica enzimatica Vie metaboliche ramificate Inibizione multivalente A B C D E F G K X Y Inibizione cooperativa A B C D E F G K X Y v gsartor B06 - Cinetica enzimatica
65 Vie metaboliche ramificate Inibizione cumulativa A B C D E F G K I Z X Y Inibizione di enzimi multipli A B C D E F G K X Y v gsartor B06 - Cinetica enzimatica Catabolismo e anabolismo C S A B E F T Z X Y v gsartor B06 - Cinetica enzimatica
66 Regolazione genica Un altra via con la quale viene regolata l attività di uno o più enzimi è attraverso l induzione o la repressione genica della sintesi proteica di quella proteina con attività enzimatica. Anche per gli enzimi esiste una sorta di omeostasi. EZIMA mra SITESI DEMLIZIE AMIACIDI Induzione Repressione DA v gsartor B06 - Cinetica enzimatica Regolazione genica Un altra via con la quale viene regolata l attività di uno o più enzimi è attraverso l induzione o la repressione genica della sintesi proteica di quella proteina con attività enzimatica. Anche per gli enzimi esiste una sorta di omeostasi. EZIMA mra SITESI DEMLIZIE AMIACIDI Induzione Repressione DA v gsartor B06 - Cinetica enzimatica
67 Crediti e autorizzazioni all utilizzo Questo materiale è stato assemblato da informazioni raccolte dai seguenti testi di Biochimica: CAMPE Pamela, ARVEY Richard, FERRIER Denise R. LE BASI DELLA BICIMICA [ISB ] Zanichelli ELS David L., CX Michael M. I PRICIPI DI BICIMICA DI LEIGER -Zanichelli GARRETT Reginald., GRISAM Charles M. BICIMICA con aspetti molecolari della Biologia cellulare - Zanichelli VET Donald, VET Judith G, PRATT Charlotte W FDAMETI DI BICIMICA [ISB ] - Zanichelli E dalla consultazione di svariate risorse in rete, tra le quali: Kegg: Kyoto Encyclopedia of Genes and Genomes Brenda: Protein Data Bank: Rensselaer Polytechnic Institute: Il materiale è stato inoltre rivisto e corretto dalla Prof. Giancarla rlandini dell Università di Parma alla quale va il mio sentito ringraziamento. Questo ed altro materiale può essere reperito a partire da: gsartor.org/pro Il materiale di questa presentazione è di libero uso per didattica e ricerca e può essere usato senza limitazione, purché venga riconosciuto l autore usando questa frase: Materiale ottenuto dal Prof. Giorgio Sartor Università di Bologna Giorgio Sartor Ufficiale: giorgio.sartor@unibo.it Personale: giorgio.sartor@gmail.com Aggiornato il 07/03/ :15:52 67
Prof. Giorgio Sartor. Cinetica enzimatica. Spontaneità
 Prof. Giorgio Sartor Cinetica enzimatica Copyright 2001-2014 by Giorgio Sartor. All rights reserved. Versione 1.9.2 25/03/2014 Spontaneità Una qualunque reazione chimica avviene spontaneamente se esolo
Prof. Giorgio Sartor Cinetica enzimatica Copyright 2001-2014 by Giorgio Sartor. All rights reserved. Versione 1.9.2 25/03/2014 Spontaneità Una qualunque reazione chimica avviene spontaneamente se esolo
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Prof. Giorgio Sartor. Il metabolismo. Metabolismo. È il processo che permette di ricavare energia da legami chimici (sottoforma di
 Prof. Giorgio Sartor Il metabolismo Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.4 oct 2008 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Prof. Giorgio Sartor Il metabolismo Copyright 2001-2008 by Giorgio Sartor. All rights reserved. Versione 1.4 oct 2008 Metabolismo È il processo che permette di ricavare energia da legami chimici (sottoforma
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Metabolismo dei nucleotidi
 rof. Giorgio Sartor Metabolismo dei nucleotidi 1: introduzione 2: biosintesi de-novo delle purine 3: biosintesi de-novo delle pirimidine 4: catabolismo delle purine 5: catabolismo delle pirimidine 6: sintesi
rof. Giorgio Sartor Metabolismo dei nucleotidi 1: introduzione 2: biosintesi de-novo delle purine 3: biosintesi de-novo delle pirimidine 4: catabolismo delle purine 5: catabolismo delle pirimidine 6: sintesi
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Struttura delle proteine
 Struttura delle proteine I II III Copyright 2001-2015 by Giorgio Sartor. All rights reserved. Versione 1.0.2 oct 2015 Struttura quaternaria Èil livello di organizzazione per il quale si formano strutture
Struttura delle proteine I II III Copyright 2001-2015 by Giorgio Sartor. All rights reserved. Versione 1.0.2 oct 2015 Struttura quaternaria Èil livello di organizzazione per il quale si formano strutture
Il trasporto del glucosio
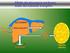 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe.
 INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA
 TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori.
 Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
catabolismo anabolismo
 Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in un organismo o in una cellula Il catabolismo è l insieme delle reazioni che portano alla scissione di molecole complesse (ricche
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Cap.16 GLICOLISI. Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP H 2 O 2 NAD + 2 NADH + 2H +
 Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Utilizzo del glucosio: la glicolisi
 Utilizzo del glucosio: la glicolisi GLUCOSIO Sistema rapido, reversibile, GLICOLISI avviene anche in assenza di ossigeno. Produce poca energia OSSIDAZIONE PIRUVATO Fermentazione LATTATO ACETATO CICLO DI
Utilizzo del glucosio: la glicolisi GLUCOSIO Sistema rapido, reversibile, GLICOLISI avviene anche in assenza di ossigeno. Produce poca energia OSSIDAZIONE PIRUVATO Fermentazione LATTATO ACETATO CICLO DI
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio
 Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Inibizione Enzimatica
 Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Energia di attivazione
 1 ENZIMI Caratteristiche fondamentali della catalisi enzimatica e del meccanismo di azione degli enzimi Componenti strutturali e funzionali degli enzimi Nomenclatura e classificazione internazionale degli
1 ENZIMI Caratteristiche fondamentali della catalisi enzimatica e del meccanismo di azione degli enzimi Componenti strutturali e funzionali degli enzimi Nomenclatura e classificazione internazionale degli
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
Gli ENZIMI sono proteine (eccezioni: RIBOZIMI = RNA con attività catalitica) che sono strutturalmente suddivise in due classi:
 ENZIMI Gli ENZIMI sono proteine (eccezioni: RIBOZIMI = RNA con attività catalitica) che sono strutturalmente suddivise in due classi: PROTEINE SEMPLICI (costituite solo dalla parte di natura proteica)
ENZIMI Gli ENZIMI sono proteine (eccezioni: RIBOZIMI = RNA con attività catalitica) che sono strutturalmente suddivise in due classi: PROTEINE SEMPLICI (costituite solo dalla parte di natura proteica)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione.
 Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Regolazione della Glicolisi
 Regolazione della Glicolisi Enzimi regolati della glicolisi: 1) esochinasi. da: Champe La esochinasi: ha bassa Km per Glu 0,2mM: questo assicura la captazione anche di poche molecole di glucosio, presenti
Regolazione della Glicolisi Enzimi regolati della glicolisi: 1) esochinasi. da: Champe La esochinasi: ha bassa Km per Glu 0,2mM: questo assicura la captazione anche di poche molecole di glucosio, presenti
Nucleotidi e coenzimi
 rof. Giorgio Sartor ucleotidi e coenzimi Copyright 2001-2012 by Giorgio Sartor. All rights reserved. B05 -Versione 1.7 mar 2012 Basi azotate Le basi azotate coinvolte nella formazione di nucleotidi e coenzimi
rof. Giorgio Sartor ucleotidi e coenzimi Copyright 2001-2012 by Giorgio Sartor. All rights reserved. B05 -Versione 1.7 mar 2012 Basi azotate Le basi azotate coinvolte nella formazione di nucleotidi e coenzimi
Ioni inorganici (Mg 2+, Zn 2+ ), o molecole organiche o metallorganiche (coenzimi)
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI. A + B AB (100 Kcal= E. Attiv.) A + B AB (50 Kcal) SUBSTRATO ENZIMA E N E R G I A
 ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
CICLO DI KREBS (o DELL ACIDO CITRICO)
 CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
CICLO DI KREBS (o DELL ACIDO CITRICO) È un processo ossidativo che ha un ruolo centrale nel metabolismo energetico delle cellule eucariotiche. Avviene nella matrice mitocondriale. È alimentato soprattutto
Biosintesi degli aminoacidi
 Biosintesi degli aminoacidi Per l uomo la fonte principale di gruppi NH 4 + sono gli AA contenuti nelle proteine della dieta Parte di NH 4 + che si genera dalla degradazione degli AA viene riciclata e
Biosintesi degli aminoacidi Per l uomo la fonte principale di gruppi NH 4 + sono gli AA contenuti nelle proteine della dieta Parte di NH 4 + che si genera dalla degradazione degli AA viene riciclata e
CLASSIFICAZIONE ENZIMI
 CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
Glycogen Synthesis Glicogeno sintesi UTP UDP + 2 P i glycogen (n) + glucose-1-p glycogen (n + 1) Glycogen Phosphorylase P i Glicogeno lisi
 Glycogen Synthesis Glicogeno sintesi UTP UDP + 2 P i glycogen (n) + glucose-1-p glycogen (n + 1) Glycogen Phosphorylase P i Glicogeno lisi Se entrambe le vie fossero attive simultaneamente nella cellula
Glycogen Synthesis Glicogeno sintesi UTP UDP + 2 P i glycogen (n) + glucose-1-p glycogen (n + 1) Glycogen Phosphorylase P i Glicogeno lisi Se entrambe le vie fossero attive simultaneamente nella cellula
Carboidrati! Oligosaccaridi Polisaccaridi. B) Carboidrati complessi
 Carboidrati! Sono i composti organici più abbondanti sulla terra Contengono: C, H, O Sono Aldeidi o Chetoni poliossidrilici Possono essere suddivisi in: A) Zuccheri semplici Monosaccaridi B) Carboidrati
Carboidrati! Sono i composti organici più abbondanti sulla terra Contengono: C, H, O Sono Aldeidi o Chetoni poliossidrilici Possono essere suddivisi in: A) Zuccheri semplici Monosaccaridi B) Carboidrati
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia.
 La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato si ottiene molta più energia. Il ciclo dell acido citrico è una via metabolica centrale
Il metabolismo: concetti di base
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Il metabolismo: concetti di base Caratteristiche generali Strategie Trofiche Il metabolismo:
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Il metabolismo: concetti di base Caratteristiche generali Strategie Trofiche Il metabolismo:
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
Fonte diretta di Energia è l ATP.
 Una cellula compie tre tipi di lavoro: -Lavoro meccanico: movimenti muscolari.. -Lavoro di trasporto: trasporto contro gradiente -Lavoro chimico: assemblaggio di polimeri da monomeri Fonte diretta di Energia
Una cellula compie tre tipi di lavoro: -Lavoro meccanico: movimenti muscolari.. -Lavoro di trasporto: trasporto contro gradiente -Lavoro chimico: assemblaggio di polimeri da monomeri Fonte diretta di Energia
1/v
 1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
(2 x) (2 x) (2 x) Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi. Gliceraldeide 3-fosfato deidrogenasi
 Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi (2 x) (2 x) Gliceraldeide 3-fosfato Fosfato inorganico Gliceraldeide 3-fosfato deidrogenasi Reazione di ossidoriduzione:
Il NADH prodotto in questa reazione DEVE essere ri-ossidato affinché la glicolisi non si fermi (2 x) (2 x) Gliceraldeide 3-fosfato Fosfato inorganico Gliceraldeide 3-fosfato deidrogenasi Reazione di ossidoriduzione:
scaricato da www.sunhope.it
 CICLO DEGLI ACIDI TRICARBOSSILICI o CICLO DELL ACIDO CITRICO o CICLO DI KREBS scaricato da www.sunhope.it IL CICLO DI KREBS È LA VIA OSSIDATIVA FINALE DEL CATABOLISMO DI GLUCIDI LIPIDI PROTEINE IL CICLO
CICLO DEGLI ACIDI TRICARBOSSILICI o CICLO DELL ACIDO CITRICO o CICLO DI KREBS scaricato da www.sunhope.it IL CICLO DI KREBS È LA VIA OSSIDATIVA FINALE DEL CATABOLISMO DI GLUCIDI LIPIDI PROTEINE IL CICLO
ENERGIA LIBERA DI GIBBS (G)
 METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Introduzione al Metabolismo
 Chimica Biologica A.A. 2010-2011 Introduzione al Metabolismo Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Metabolismo Metabolismo l insieme dei processi attraverso
Chimica Biologica A.A. 2010-2011 Introduzione al Metabolismo Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Metabolismo Metabolismo l insieme dei processi attraverso
Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale
 Ciclo di Krebs 1 Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale 2 Complesso della piruvato deidrogenasi (2) FAD Diidrolipoil deidrogenasi Piruvato decarbossilasi E 3 Diidrolipoil
Ciclo di Krebs 1 Complesso della piruvato deidrogenasi (1) Stechiometria della reazione finale 2 Complesso della piruvato deidrogenasi (2) FAD Diidrolipoil deidrogenasi Piruvato decarbossilasi E 3 Diidrolipoil
Struttura esame Biochimica per Sc. Biologiche DM270 e DM509 da gennaio 2017
 Struttura esame Biochimica per Sc. Biologiche DM270 e DM509 da gennaio 2017 Prof. G. Gilardi : biomolecole, enzimi, vitamine Prof. S.J. Sadeghi : metabolismo ed esercitazioni Prof. G. Gilardi - Biological
Struttura esame Biochimica per Sc. Biologiche DM270 e DM509 da gennaio 2017 Prof. G. Gilardi : biomolecole, enzimi, vitamine Prof. S.J. Sadeghi : metabolismo ed esercitazioni Prof. G. Gilardi - Biological
Laboratorio Fitness & Wellness
 Laboratorio Fitness & Wellness Anno Accademico 2015/2016 Ewan Thomas, MSc Principi di Bioenergetica e Biomeccanica Metabolismo Catabolismo Processi di degradazione che permettono di liberare energia Anabolismo
Laboratorio Fitness & Wellness Anno Accademico 2015/2016 Ewan Thomas, MSc Principi di Bioenergetica e Biomeccanica Metabolismo Catabolismo Processi di degradazione che permettono di liberare energia Anabolismo
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
a. La Piruvato chinasi catalizza il trasferimento di un gruppo fosfato dal fosfoenolpiruvato all adenosina
 apitolo 18 Risposte a Domande interne al capitolo 18.1 (p. 548) a. La Piruvato chinasi catalizza il trasferimento di un gruppo fosfato dal fosfoenolpiruvato all adenosina difosfato. b. L alanina transaminasi
apitolo 18 Risposte a Domande interne al capitolo 18.1 (p. 548) a. La Piruvato chinasi catalizza il trasferimento di un gruppo fosfato dal fosfoenolpiruvato all adenosina difosfato. b. L alanina transaminasi
FADH ADP + Pi ATP...29 AG ' = -30,5 kj/mol...29 Resa di ATP per l ossidazione completa del glucosio...31
 FOSFORILAZIONE OSSIDATIVA FOSFORILAZIONE OSSIDATIVA...1 Glicolisi e ciclo di Krebs...3 il NADH il NADPH e il FADH2 sono traportatori solubili di elettroni...4 LA FOSFORILAZIONE OSSIDATIVA...5 Il mitocondrio...5
FOSFORILAZIONE OSSIDATIVA FOSFORILAZIONE OSSIDATIVA...1 Glicolisi e ciclo di Krebs...3 il NADH il NADPH e il FADH2 sono traportatori solubili di elettroni...4 LA FOSFORILAZIONE OSSIDATIVA...5 Il mitocondrio...5
REGOLAZIONE DEL METABOLISMO GLUCIDICO
 REGOLAZIONE DEL METABOLISMO GLUCIDICO IL METABOLISMO DEL GLICOGENO E FINEMENTE REGOLATO: Quando è attiva la sua sintesi non è attiva la sua demolizione e viceversa I principali ormoni che controllano il
REGOLAZIONE DEL METABOLISMO GLUCIDICO IL METABOLISMO DEL GLICOGENO E FINEMENTE REGOLATO: Quando è attiva la sua sintesi non è attiva la sua demolizione e viceversa I principali ormoni che controllano il
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
da: Nelson & Cox (IV Ed.)
 da: Nelson & Cox (IV Ed.) da: Nelson & Cox (IV Ed.) Il prodotto finale dopo 7 cicli è il palmitil ACP. Il processo di allungamento si ferma a C 16 e l acido palmitico viene liberato dalla molecola di ACP
da: Nelson & Cox (IV Ed.) da: Nelson & Cox (IV Ed.) Il prodotto finale dopo 7 cicli è il palmitil ACP. Il processo di allungamento si ferma a C 16 e l acido palmitico viene liberato dalla molecola di ACP
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI
 METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
METABOLISMO del GLUCOSIO: GLUCONEOGENESI e VIA DEI PENTOSI Glicolisi: Glucosio Glucosio Piruvato Piruvato Gluconeogenesi La Glicolisi (dal greco glykys dolce e lysis scissione) E` la via metabolica che
Enzimi. 1. Definizione 2. Numero di Turn-over 3. Nomenclatura 4. Cofattori 5. Sito attivo
 Enzimi 1. Definizione 2. Numero di Turn-over 3. Nomenclatura 4. Cofattori 5. Sito attivo 6. Specificità o Modello di Fischer (chiave-serratura) o Modello dell adattamento indotto 7. Cinetica enzimatica
Enzimi 1. Definizione 2. Numero di Turn-over 3. Nomenclatura 4. Cofattori 5. Sito attivo 6. Specificità o Modello di Fischer (chiave-serratura) o Modello dell adattamento indotto 7. Cinetica enzimatica
NADH FADH 2 (trasportatori ridotti di elettroni) Catena respiratoria (trasferimento degli
 NADH FADH 2 (trasportatori ridotti di elettroni) Fase 3 Trasferimento degli elettroni e fosforilazione ossidativa Catena respiratoria (trasferimento degli elettroni) Nicotinamide adenin dinucleotide (NAD
NADH FADH 2 (trasportatori ridotti di elettroni) Fase 3 Trasferimento degli elettroni e fosforilazione ossidativa Catena respiratoria (trasferimento degli elettroni) Nicotinamide adenin dinucleotide (NAD
Catalisi. Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A Modulo di Biologia Strutturale
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Attenzione: Lunedì 15 la lezione sarà dalle 14 alle 16 (al posto di L. Migliore)
 Attenzione: Lunedì 15 la lezione sarà dalle 14 alle 16 (al posto di L. Migliore) La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato
Attenzione: Lunedì 15 la lezione sarà dalle 14 alle 16 (al posto di L. Migliore) La glicolisi non è l unica via catabolica in grado di produrre energia. Se il suo prodotto viene ulteriormente ossidato
ENZIMI. Catalizzatori delle reazioni biologiche
 ENZIMI Catalizzatori delle reazioni biologiche Le tre proprietà distintive degli enzimi sono A capacità catalitica B specificità C regolazione NOMENCLATURA Gli enzimi sono classificati in base alle reazioni
ENZIMI Catalizzatori delle reazioni biologiche Le tre proprietà distintive degli enzimi sono A capacità catalitica B specificità C regolazione NOMENCLATURA Gli enzimi sono classificati in base alle reazioni
Il metabolismo cellulare
 Il metabolismo cellulare L obesità è problema sanitario e sociale Tessuto adiposo bianco e bruno È tutta una questione di energia: Se si assumono più molecole energetiche di quelle che ci servono per costruire
Il metabolismo cellulare L obesità è problema sanitario e sociale Tessuto adiposo bianco e bruno È tutta una questione di energia: Se si assumono più molecole energetiche di quelle che ci servono per costruire
Indice generale 1. Introduzione alla biochimica 2. Acqua, ph, acidi, basi, sali, tamponi
 Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Indice generale 1. Introduzione alla biochimica 1 Unità di misura 1 Energia e calore 3 Struttura dell atomo 3 Tavola periodica degli elementi 4 Legami chimici 8 Legami covalenti 8 Legami non covalenti
Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali:
 Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali: proteine strutturali (collagene, cheratine); proteine catalitiche (enzimi); proteine di trasporto
Svolgono funzioni biologiche di fondamentale importanza e possono essere divise in 7 gruppi principali: proteine strutturali (collagene, cheratine); proteine catalitiche (enzimi); proteine di trasporto
Cine%ca enzima%ca. Copyright 2013 Zanichelli editore S.p.A.
 Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti:
 Cinetica enzimatica Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti: ribozimi e abzimi Quasi tutti gli enzimi sono proteine
Cinetica enzimatica Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti: ribozimi e abzimi Quasi tutti gli enzimi sono proteine
I più comuni polisaccaridi sono: AMIDO CELLULOSA GLICOGENO DESTRINA
 GLICOGENO POLISACCARIDI La maggior parte dei carboidrati che si ritrovano in natura sono polimeri ad alto peso molecolare chiamati polisaccaridi L u n i t à m o n o s a c c a r i d i c a p i ù frequente
GLICOGENO POLISACCARIDI La maggior parte dei carboidrati che si ritrovano in natura sono polimeri ad alto peso molecolare chiamati polisaccaridi L u n i t à m o n o s a c c a r i d i c a p i ù frequente
fornire energia chimica in vettori attivati ATP e NADH e NADPH e FADH.
 Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Cibo ed Energia Il glucosio e altre molecole nutritive per esempio i grassi vengono demolite attraverso un ossidazione graduale controllata per fornire energia chimica in una forma utilizzabile dalla cellula,
Introduzione al metabolismo
 Introduzione al metabolismo 1 2 Funzioni del metabolismo 1- Ottenere energia chimica 2- Convertire le molecole 3-Polimerizzare i precursori monomerici 4- Sintetizzare e degradare le biomolecole Il metabolismo
Introduzione al metabolismo 1 2 Funzioni del metabolismo 1- Ottenere energia chimica 2- Convertire le molecole 3-Polimerizzare i precursori monomerici 4- Sintetizzare e degradare le biomolecole Il metabolismo
USO DEGLI ENZIMI PER PRODURRE AMMINOACIDI E PEPTIDI
 USO DEGLI ENZIMI PER PRODURRE AMMINOACIDI E PEPTIDI Biocatalisi sintesi biocatalitica Forma L Asimmetrica Per risoluzione con enzimi idrolitici Forma L e D Aggiunta di ammoniaca al doppio legame di un
USO DEGLI ENZIMI PER PRODURRE AMMINOACIDI E PEPTIDI Biocatalisi sintesi biocatalitica Forma L Asimmetrica Per risoluzione con enzimi idrolitici Forma L e D Aggiunta di ammoniaca al doppio legame di un
Scaricato da 21/01/2011
 1 2 Le due principali vie di rimozione del gruppo -NH 2 sono TRANSAMINAZIONE - transaminazione - deaminazione ossidativa La transaminazione è la prima tappa del catabolismo della maggior parte degli aa
1 2 Le due principali vie di rimozione del gruppo -NH 2 sono TRANSAMINAZIONE - transaminazione - deaminazione ossidativa La transaminazione è la prima tappa del catabolismo della maggior parte degli aa
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 17
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 17 Enzimi Concetti chiave: Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni, specificità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 17 Enzimi Concetti chiave: Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni, specificità
Energia e metabolismi energetici
 Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Biosintesi dei carboidrati
 Biosintesi dei carboidrati Gluconeogenesi: sintesi di glucosio da precursori non saccaridici La riserva di glucosio dell organismo (glucosio + glicogeno) è sufficiente per circa 1 giorno. La via gluconeogenetica
Biosintesi dei carboidrati Gluconeogenesi: sintesi di glucosio da precursori non saccaridici La riserva di glucosio dell organismo (glucosio + glicogeno) è sufficiente per circa 1 giorno. La via gluconeogenetica
Mioglobina ed emoglobina
 Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Proprietà di permeabilità della membrana
 Proprietà di permeabilità della membrana Il Trasporto attraverso le membrane La fase lipidica delle membrane le rende impermeabili alla maggior parte degli ioni e delle sostanze polari. Questi composti
Proprietà di permeabilità della membrana Il Trasporto attraverso le membrane La fase lipidica delle membrane le rende impermeabili alla maggior parte degli ioni e delle sostanze polari. Questi composti
Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico
 Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico Dalla glicolisi alla fosforilazione ossidativa NAD + e NADP + Sono coinvolti nelle reazioni di trasferimento dell idruro H: -. Tutte le reazioni
Il ciclo degli acidi tricarbossilici o ciclo dell acido citrico Dalla glicolisi alla fosforilazione ossidativa NAD + e NADP + Sono coinvolti nelle reazioni di trasferimento dell idruro H: -. Tutte le reazioni
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) 1 2 Il glucosio viene trasportato all interno della cellula
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) 1 2 Il glucosio viene trasportato all interno della cellula
La cinetica chimica. Velocità media di reazione
 La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
L ATP è sintetizzato in tre principali modi: 30/04/15
 L ATP è sintetizzato in tre principali modi: mediante fosforilazione a livello del substrato, mediante fosforilazione ossidativa, mediante fotofosforilazione 1 Prima via metabolica ad essere compresa.
L ATP è sintetizzato in tre principali modi: mediante fosforilazione a livello del substrato, mediante fosforilazione ossidativa, mediante fotofosforilazione 1 Prima via metabolica ad essere compresa.
B. Classificazione degli organismi 1. Autotrofi - si nutrono da soli a. ottengono il carbonio dalla CO 2 b. fonte di energia - fotosintetica: uso
 Outline Classificazione degli organismi Energia e metabolismo Energia libera Composti ad alta energia Ossidazione, riduzione e trasferimento energetico Ruolo degli enzimi Introduzione A. La vita è organica
Outline Classificazione degli organismi Energia e metabolismo Energia libera Composti ad alta energia Ossidazione, riduzione e trasferimento energetico Ruolo degli enzimi Introduzione A. La vita è organica
Applicazioni biotecnologiche degli enzimi: le proteasi
 Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Applicazioni biotecnologiche degli enzimi: le proteasi Campi di applicazione delle proteasi Le proteasi catalizzano l idrolisi di legami peptidici Esopeptidasi ed endopeptidasi Specificità di riconoscimento
Cap.19. Ciclo di Krebs. o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico
 Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
Cap.19 Ciclo di Krebs o Ciclo degli acidi Tricarbossilici o Ciclo dell acido Citrico Acetil-CoA OSSIDAZIONE DEL GLUCOSIO C 6 H 12 O 6 (glucosio) + 6O 2.. 6CO 2 + 6H 2 O I tappa: GLICOLISI 2 + 2 H 2 O II
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
DESTINI METABOLICI DEL PIRUVATO
 DETINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
DETINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Piruvato Complesso della Piruvato
I FLAGELLI NEI BATTERI
 Prof. Giorgio Sartor Motori molecolari VI Flagello batterico Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P06 - Versione 2.0 oct 2013 I FLAGELLI NEI BATTERI Un diverso movimento Un diverso
Prof. Giorgio Sartor Motori molecolari VI Flagello batterico Copyright 2001-2013 by Giorgio Sartor. All rights reserved. P06 - Versione 2.0 oct 2013 I FLAGELLI NEI BATTERI Un diverso movimento Un diverso
LE REAZIONI DI FISSAZIONE DEL CARBONIO
 LE REAZIONI DI FISSAZIONE DEL CARBONIO Reazioni al buio ogni anno 200 miliardi di tonnellate di CO 2 vengono convertite in biomassa 40% fitoplancton CICLO DI CALVIN ciclo riduttivo dei pentosi fosfati,
LE REAZIONI DI FISSAZIONE DEL CARBONIO Reazioni al buio ogni anno 200 miliardi di tonnellate di CO 2 vengono convertite in biomassa 40% fitoplancton CICLO DI CALVIN ciclo riduttivo dei pentosi fosfati,
Tutte le reazioni che avvengono nelle cellule sono reazioni catalizzate I catalizzatori di tali reazioni prendono il nome di enzimi Gli enzimi sono
 Tutte le reazioni che avvengono nelle cellule sono reazioni catalizzate I catalizzatori di tali reazioni prendono il nome di enzimi Gli enzimi sono grosse molecole proteine e ribozimi (RNA) TEORIA DELLE
Tutte le reazioni che avvengono nelle cellule sono reazioni catalizzate I catalizzatori di tali reazioni prendono il nome di enzimi Gli enzimi sono grosse molecole proteine e ribozimi (RNA) TEORIA DELLE
