di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori.
|
|
|
- Isabella Calabrese
- 7 anni fa
- Visualizzazioni
Transcript
1 Enzimi
2 Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
3
4 I cofattori che sono piccole molecole organiche sono detti coenzimi
5 Gli enzimi sono classificati in base alle reazioni che catalizzzano Classificazione internazionale degli enzimi N. Classe Tipo di reazione catalizzata 1. Ossidoreduttasi Trasferimento di elettroni A - +B A + B - 2. Transferasi Trasferimento di gruppi A-B B + C A + B-C B
6 Classificazione internazionale degli enzimi N. Classe Tipo di reazione catalizzata 3. Idrolasi Reazioni di idrolisi (Trasferimento di gruppi funzionali all acqua) acqua) A-B B + H 2 O A-H H + B-OH B 4. Liasi Addizione di gruppi a doppi legami o formazione di doppi legami mediante rimozione di gruppi X Y A B A = B + X-YX
7 Classificazione internazionale degli enzimi N. Classe Tipo di reazione catalizzata 5. Isomerasi Trasferimento di gruppi all interno della molecola con la formazione di isomeri X Y Y X A B A B 6. Ligasi Formazione di legami C-C, C C, C-S, C C-O, C e C-N C N mediante reazioni di condensazione accoppiate alla scissione di ATP. A + B A-B
8
9 I legge della termodinamica L energia totale di un sistema e del suo ambiente è costante ΔE E = E B - E A = Q + W E A = Energia del sistema all inizio del processo E B = Energia del sistema alla fine del processo Q = Calore assorbito dal sistema W = Lavoro svolto La prima legge della termodinamica non può essere usata per predire se una reazione avviene spontaneamente
10 Bisogna introdurre il concetto di Entropia: Entropia (S) = grado di disordine del sistema II legge della termodinamica Un processo può avvenire spontaneamente soltanto se la somma delle entropie del sistema e dell ambiente aumenta. In un processo spontaneo (ΔS sistema + ΔS ambiente ) > 0
11 Nel 1878 J. W. Gibbs introdusse la funzione energia libera (G) combinando la I e la II legge della termodinamica: ΔG G = ΔH - TΔS ΔG G = Variazione di energia libera di un sistema a pressione (P) e temperatura (T) costanti ΔH H = Variazione di entalpia ΔS S = Variazione di entropia ΔH = ΔE + PΔVP ΔE E = Variazione dell energia energia interna del sistema. Poiché nelle reazioni biochimiche la variazione di volume (ΔV)( è molto piccola: ΔH ΔE quindi ΔG ΔE - TΔS Il ΔG G di una reazione dipende sia dalla variazione di energia interna che dal cambio di entropia del sistema
12 La variazione di energia libera (ΔG)( può essere utilizzata per stabilire se un processo avviene in modo spontaneo: Una reazione può avvenire spontaneamente se il ΔG è negativo Un sistema è all equilibrio quando il ΔG G = 0 Una reazione non può procedere spontaneamente se il il ΔG G > 0. In tal caso sarà necessario fornire energia libera alla reazione Il ΔG G di una reazione è indipendente dalla via seguita dalla trasformazione Il ΔG G non fornisce informazioni sulla velocità della reazione Un ΔG G negativo indica che una reazione può avvenire spontaneamente, ma non significa che essa proceda ad una velocità apprezzabile
13 L enzima è un catalizzatore La funzione di un catalizzatore è quella di aumentare la velocità di una reazione I catalizzatori non modificano l equilibriol di una reazione Gli enzimi accelerano il raggiungimento dell equilibrio equilibrio ma non modificano la sua posizione
14 Diagramma della coordinata di reazione di una reazione chimica Nella reazione S P il substrato S passa attraverso lo stato di transizione che possiede più energia libera di S e P. L energia libera di attivazione di Gibbs (ΔG ) indica la differenza tra l energia dello stato di transizione e quella del substrato
15 Gli enzimi accellerano le reazioni abbassando l energia di attivazione L enzima non viene consumato durante la reazione. Il punto di equilibrio rimane inalterato. La reazione raggiunge l equilibrio più rapidamente.
16 V = k [S] (legge della velocità) Dalla teoria dello strato di transizione si può ricavare l equazione : k = kt h e ΔG /RT k = costante di Boltzman h = costante di Plank La relazione tra la costante di velocità (k)) e l energia l di attivazione (ΔG ) è inversa ed esponenziale. Più bassa è l energia di attivazione più alta è la velocità della reazione.
17 La formazione di un complesso enzima-substrato è la prima tappa nella catalisi enzimatica.
18 Quali sono le evidenze dell esistenza di un complesso enzima-substrato? Una reazione catalizzata ha una velocità massima.
19 Per molti enzimi: A concentrazione costante di enzima, la velocità della reazione aumenta in modo proporzionale all aumento della concentrazione del substrato finchè non viene raggiunta una velocità massima. Velocità della reazione Velocità massima [ ] del substrato Le reazioni non catalizzate non presentano questo effetto di saturazione
20 I complessi enzima-substrato possono essere visualizzati direttamente al microscopio elettronico Fotografia al microscopio elettronico di molecole di DNA polimerasi I (sfere bianche) legate ad uno stampo di DNA sintetico (Dr. Iack Griffith)
21 L enzima chimotripsina con un substrato legato (in rosso)
22 I substrati si legano ad una specifica regione dell enzima, chiamato sito attivo. - Il sito attivo occupa una parte relativamente piccola del volume totale della molecola - Il sito attivo è formato da gruppi che derivano da parti diverse della sequenza amminoacidica lineare. - L interazione enzima-substrato è mediata dalle stesse forze che stabilizzano la struttura delle proteine (legami idrogeno, interazioni idrofobiche, forze di van der Waals, legami ionici)
23 Il substrato ha una forma complementare al sito attivo dell enzima Enzima diidrofolato reduttasi insieme al suo substrato NADP +
24 Il substrato ha una forma complementare al sito attivo dell enzima Enzima diidrofolato reduttasi insieme al suo substrato NADP +
25 Il sito attivo può essere formato da residui distanti nella sequenza primaria Lisozima
26
27 L energia che si libera dalle interazioni enzima-substrato viene detta energia di legame. L energia di legame è la fonte principale di energia libera usata dall enzima per abbassare l energia l di attivazione della reazione. I siti attivi sono cavità da cui l acqua l è normalmente esclusa a meno che non sia un reagente. Il carattere non polare favorisce l interazione l con il substrato. Possono essere presenti residui polari coinvolti nell interazione enzima-substarto substarto.
28 Le interazioni fra molecole polari risultano fortemente indebolite in un mezzo acquoso. I sistemi biologici hanno risolto questo problema creando dei microambienti privi di acqua (idrofobici) dove le interazioni polari sono molto forti Enzima - Sacca idrofobica + Substrato Un enzima che lega un substrato carico positivamento (+) spesso ha un amminoacido con catena laterale carica negativamente (-) in corrispondenza del sito di riconoscimento
29 La specificità del legame enzima-substrato dipende dalla precisa disposizione degli atomi del sito attivo. Vi è perfetta complementarietà tra il substrato ed il sito attivo. Modello chiave - serratura per l interazione enzima-substrato proposto da Emil Fisher nel 1890.
30 Modello di adattamento indotto per l interazione enzima-substrato proposto da Daniel E. Korshland nel L enzima cambia forma in seguito al legame del substrato. - Il sito attivo ha una forma complementare al substrato solo dopo che questo si è legato.
31 Adattamento indotto dell esochinasi
32 In rosso il glucosio
33
34 L aumento della velocità prodotto da alcuni enzimi
35 Un enzima immaginario ( metallasi) che catalizza la rottura di una barretta di metallo
36
37 Per poter catalizzare una reazione, un enzima deve essere complementare allo stato di transizione Le interazioni deboli tra enzima e substrato sono ottimali nello stato di transizione. Le interazioni deboli di legame tra enzima e substrato sono la principale forza trainante della catalisi
38 ΔG B = Energia di legame
39
40 Per comprendere come funzionano gli enzimi abbiamo bisogno di una descrizione cinetica della loro attività
41 La velocità di una reazione, definita come il numero di moli di prodotto formate nell unit unità di tempo, dipende dalla concentrazione del reagente e da una costante di velocità (k) Per la reazione S P V = k [S] (legge della velocità)
42 V = k [S] (legge della velocità) Dalla teoria dello strato di transizione si può ricavare l equazione : k = kt h e ΔG /RT k = costante di Boltzman h = costante di Plank La relazione tra la costante di velocità (k)) e l energia l di attivazione (ΔG ) è inversa ed esponenziale. Più bassa è l energia di attivazione più alta è la velocità della reazione.
43 Per molti enzimi: A concentrazione costante di enzima, la velocità della reazione aumenta in modo proporzionale all aumento della concentrazione del substrato finchè non viene raggiunta una velocità massima. Velocità della reazione Velocità massima [ ] del substrato Le reazioni non catalizzate non presentano questo effetto di saturazione
44 ad elevate [S] V risulta indipendente da [S] La concentrazione del substrato modifica la velocità delle reazioni catalizzate dagli enzimi - Studiando gli effetti della concentrazione del substrato sulla velocità delle reazioni bisogna tener presente che la [S] varia durante il corso o della reazione perché il substrato viene convertito in prodotto. - Per semplificare l analisi l degli esperimenti di cinetica enzimatica, si può valutare la velocità iniziale (V 0 ), quando la [S] è in genere molto più grande della concentrazione dell enzima. enzima. E E possibile in queste condizioni ignorare la reazione P S. - Se l analisi l è rapida la variazione di [S] può essere trascurata e la [S] può essere considerata costante. Per molti enzimi: ad una concentrazione fissa di enzima la velocità della reazione (V) è linearmente proporzionale alla concentrazione del substrato [S] quando [S] è bassa;
45
46 La formazione del complesso ES è la chiave per comprendere il comportamento cinetico degli enzimi. Nel 1913 Leonor Michaelis e Maud Menten,, elaborando una teoria generale sull azione degli enzimi, hanno proposto un modello e trovato l equazione l che spiega l andamento l della velocità di una reazione enzimatica in funzione della [S]. Modello di Michealis e Menten (a) L enzima prima si combina con il substrato in una tappa veloce e reversibile: E + S k 1 k 2 ES
47 Modello di Michealis e Menten (b) Il complesso ES si decompone poi in una seconda tappa più lenta in E + P ES k 3 k 4 X E + P Nei primi tempi della reazione la concentrazione di prodotto, [P], è molto bassa e quindi si può assumere che il prodotto non si converta in substrato e quindi la k 4 può essere ignorata.
48 Modello di Michealis e Menten (c) I ricercatori Michaelis e Menten hanno trovato l equazione l che spiega l andamento della velocità di una reazione enzimatica in funzione della concentrazione del substrato partendo dall ipotesi che la trasformazione del complesso ES in E + P è la tappa limitante della reazione, quindi: ES k 3 E + P Tappa limitante della reazione La velocità complessiva della reazione, che è definita dalla velocità della tappa più lenta è: V 0 = k 3 [ES] Il termine [ES] non è facilmente misurabile. Bisogna pertanto esprimere [ES] in termini noti.
49 Esprimiamo [ES] in termini noti.. E + S k 1 ES k 3 E + P k 2 Velocità di formazione di ES = k 1 [E] [S] Velocità di scissione di ES = k 2 [ES] + k 3 [ES] = (k 2 +k 3 ) [ES] Quando l enzima l viene mescolato con un grande eccesso di substrato la reazione raggiunge rapidamente lo stato stazionario in cui la [ES] resta costante nel tempo.
50 Allo stato stazionario,, la concentrazione dell intermedio di reazione, nel caso di una reazione catalizzata [ES], rimane la stessa anche se le concentrazioni dei substrati di partenza e dei prodotti cambiano. Velocità di formazione di ES = k 1 [E] [S] è uguale alla Velocità di scissione di ES = k 2 [ES] + k 3 [ES] = (k 2 +k 3 ) [ES]
51
52 Esprimiamo [ES] in termini noti.. E + S k 1 ES k 3 E + P k 2 Velocità di formazione di ES = k 1 [E] [S] Velocità di scissione di ES = k 2 [ES] + k 3 [ES] = (k 2 +k 3 ) [ES] Quando l enzima l viene mescolato con un grande eccesso di substrato la reazione raggiunge rapidamente lo stato stazionario in cui la [ES] resta costante nel tempo. La V 0 che misuriamo è la V 0 dello stato stazionario,, dove: k 1 [E] [S] = (k 2 +k 3 ) [ES]
53 da cui: Esprimiamo [ES] in termini noti.. allo stato stazionario: k 1 [E] [S] = (k 2 +k 3 ) [ES] [ ES]= [ ][ S] E (k 2 + k 3 ) k 1 quindi: k 2 + k 3 k 1 = K M K M = costante di Michaelis [ ES]= E [ ][] S K M
54 Esprimiamo [ES] in termini noti.. [ ES]= E [ ][ S] K M La concentrazione del substrato non combinato con l enzima, l [S], è molto vicina alla concentrazione totale di substrato quando [E] << [S]. La concentrazione di enzima libero, [E] è: [E] = [E[ t ] - [ES]
55 Esprimiamo [ES] in termini noti.. Sostituendo [E] = [E t ] - [ES] in: [ ES]= E [ ][ S] K M abbiamo: [ ES]= ( [ E t ] [ ES]) [ S] K M [ = E ][ t S] [ ES] [ S] K M K M [ES] = [E t ][S] - [ES][S] K M [ES] + [ES] [S] = [E t ][S] [ES] (K M + [S]) = [E t ][S]
56 Esprimiamo [ES] in termini noti.. [ES] (K M + [S]) = [E t ][S] = [ ][ S] [ ES]= E t K + S M []
57 V 0 = k 3 [ES] quindi: [ ][ S] [ ES]= E t K + S M [ E ][] S t [] V 0 = k 3 K + [] S M Poiché la velocità massima viene raggiunta quando l enzima l è stato completamente saturato con il substrato e cioè [ES] = [E[ t ]: V max = k 3 [E t ] [ S] V = V max 0 K + S M []
58 [ S] V = V max 0 K + S M [] Equazione di Michaelis - Menten Questa equazione è in accordo con i dati cinetici sperimentali: Quando [S] è molto bassa ([S] << K M ) cioè V 0 è direttamente proporzionale a [S] V 0 = V max K M [] S Quando [S] è molto alta ([S] >> K M ) V 0 =V max cioè V 0 è indipendente da [S]
59 [ S] V = V max 0 K + S M [] Equazione di Michaelis - Menten Quando [S] = K semplificando: [ ] [S] = K M V 0 = V max S 2[] S V 0 = V max 2 K M = concentrazione del substrato che determina metà della velocità massima.
60
61 [] S V 0 = V max K M + S [] Equazione di Michaelis - Menten Descrive il comportamento cinetico di molti enzimi. Tutti gli enzimi che presentano una relazione di tipo iperbolico tra la velocità della reazione catalizzata e la concentrazione del substrato seguono la cinetica di Michaelis - Menten K M = [S] quando V = 1/2 V max Molti enzimi che seguono la cinetica di Michaelis - Menten hanno meccanismi di reazione diversi dal semplice meccanismo a 2 tappe originariamente proposto da Michaelis e Menten: E + S k 1 ES k 3 E + P k 2
62 Se un enzima reagisce secondo un meccanismo a 2 tappe (modello di d Michaelis- Menten): E + S k 1 k 2 ES k 3 E + P V max = k 3 [E t ] e k 3 = costante che limita la V 0 Se un enzima reagisce secondo lo schema seguente: E + S k 1 ES k 3 EP k 5 E + P k 2 k 4 in cui il rilascio del prodotto (EP E + P) diventa la tappa limitante, V max = k 5 [E t ]
63 Significato dei valori di K M e di V max Si definisce K cat la costante di velocità della tappa limitante. V max = k cat [E t ] L equazione di Michaelis- Menten: [ S] V 0 = V max K M + S [] può essere riscritta: [ E ][ t S] [] V 0 = k cat K M + S
64 Significato dei valori di K M e di V max K cat = numero di turnover Il numero di turnover di un enzima = il numero di molecole di substrato che viene convertito in prodotto nell unit unità di tempo da una singola molecola di enzima quando l enzima è completamente saturato con il substrato.
65
66
67 Il valore di V max La V max può essere utilizzata per determinare il numero di turnover di un enzima se si conosce la concentrazione dei siti attivi (= [E[ t ]) in quanto: V max = k cat [E t ] Esempio: Una soluzione 10-6 M di anidrasi carbonica catalizza la formazione di 0,6 moli di H 2 CO 3 per secondo quando è completamente saturata con il substrato. k cat = V max [ E ] = 0,6Ms 1 t 10 6 M = 6x10 5 s 1
68 V max e K M sono parametri calcolabili sperimentalmente
69 Un metodo grafico molto semplice per ottenere il valore di K M e di V max il grafico dei doppi reciproci. max : La costante di Michaelis-Menten Menten (K M ), e la velocità masima (V max ) possono essere facilmente derivate dalla velocità di catalisi misurata a diverse concentrazioni di substrato se l enzima l segue la cinetica di Michaelis-Menten Menten L equazione: [] equazione: V 0 = V max S K M + S [] può essere trasformata algebricamente in una forma più utile per analizzare i dati sperimentali: 1 V 0 = K M V max x 1 S [] + 1 V max
70 la trasformazione algebrica. [ S] V 0 = V max K M + S [] 1 = K M + S V 0 S V max [ ] [] = = 1 V 0 = K M V max [] [] S + S V max S [] semplificando.. 1 V 0 = K M V max x 1 S [] + 1 V max
71 1 = K M x 1 V 0 V [] max S + 1 V max Equazione di Lineweaver-Burk Per enzimi che obbediscono alla relazione di Michaelis - Menten mettendo in 1 1 grafico i valori di in funzione di (grafico( dei doppi reciproci) V 0 S otteniamo una linea retta. []
72 pendenza = intercetta sull asse delle Y = intercetta sull asse delle X
73 Significato del valore di K M K M = concentrazione del substrato che determina metà della velocità massima (metà dei siti attivi sono occupati) K M ci fornisce una indicazione sulla concentrazione di substrato necessaria n perché la catalisi avvenga in modo significativo E + S k 1 k 2 ES k 3 ES K M = k 2 + k 3 Se k 2 >> k 3 K M E + P k 2 [ ][ S] = E k 1 ES [ ] k 1 Cioè: K M è uguale alla costante di dissociazione del complesso ES quando k 3 è molto più piccola di k 2. -in queste condizioni (k 2 >> k 3 ) K M misura la forza del complesso ES (valori alti di K M = legame debole)
74 Significato dei valori di K M e di k cat Per confrontare l efficienza l catalitica di enzimi diversi è necessario disporre di un parametro adeguato Il numero di turnover non è molto soddisfacente! Enzimi che catalizzano reazioni diverse possono avere lo stesso valore del numero di turnover,, mentre le velocità delle reazioni non catalizzate possono essere diverse e quindi non si ha un idea dell incremento della velocità dovuto all enzima enzima. Il numero di turnover riflette una situazione in cui l enzima l è saturato con il substrato. E meno utile quando [S] è bassa! Anche K M non è sempre un parametro adeguato! -K M deve avere una relazione con la [S] a cui l enzima l lavora Un enzima che agisce su un substrato presente in una cellula a concentrazioni c molto basse tende ad avere una K M più bassa.
75
76 Significato dei valori di K M e di V max Abbiamo visto che quando la concentrazione del substrato è molto più grande di K M, tutto l enzima l è legato al substrato e la velocità della catalisi è uguale a V max = k cat [E t ] In condizioni fisologiche il rapporto [S]/K M generalmente varia da 0.01 a 1.
77 Per paragonare le efficienze catalitiche è necessario usare un parametro che comprenda sia k cat che K M Quando, come spesso accade in condizioni fisiologiche, [S] << K M l equazione V 0 = k [ cat E ][ t S] K M + [] S può essere scritta: V 0 = k cat K M [ E ][] t S V 0 quindi dipende da [E[ t ], da [S] e dalla costante k cat K M
78 Per paragonare le efficienze catalitiche è necessario usare un parametro che comprenda sia k cat che K M Quando [S] << K M, pertanto, k cat /K M è la costante di velocità dell interazione di S con E e può essere utilizzato per misurare l efficienza l catalitica di un enzima. Il fattore k cat K M è il migliore parametro cinetico per confrontare l efficienza l catalitica
79 Utilizzando il rapporto k cat /K M, è possibile paragonare la preferenza di un enzima per diversi substrati
80 Quanto può essere efficiente un enzima? E + S k 1 k 2 ES k 3 E + P Ricordando che.. K M = k 2 + k 3 k 1 e k 3 = k cat k cat K M = k cat = k 2 + k cat k 1 k cat k 2 + k cat k 1 In condizioni in cui la velocità di formazione del prodotto (k( cat ) è molto più veloce della velocità di dissociazione del complesso ES (k 2 ), cioè k cat >> k 2, il valore di /K M è dato da k 1, la velocità di formazione del complesso ES. k cat /K
81 Quanto può essere efficiente un enzima? La velocità di formazione del complesso ES (k 1 ) non può essere più veloce della velocità di incontro per diffusione del substrato e dell enzima enzima in soluzione k cat Il limite superiore del rapporto è imposto dalla velocità con cui i due K M reagenti diffondono l uno l verso l altro l nelle soluzioni acquose k cat Il valore limite di è compreso tra 10 8 e 10 9 M - 1 s -1 K M k cat Alcuni enzimi hanno valori di vicini a questo limite K M
82
83
84 Con un enzima ideale la velocità di una reazione è limitata soltanto dalla velocità con cui l enzima l e il substrato si incontrano nella soluzione. Nei complessi multienzimatici i limiti imposti dalla velocità di diffusione possono essere superati! Il prodotto di un enzima rapidamenta trova l enzima successivo quando i substrati ed i prodotti vengono confinati nel piccolo volume di un complesso multienzimatico
85 Molti enzimi catalizzano reazioni a due o più substrati Le reazioni con substrati multipli possono essere divise in due classi: a spostamento sequenziale a doppio spostamento (o reazioni ping-pong pong) Nelle reazioni con meccanismo sequenziale tutti i substrati si devono d legare all enzima prima che vengano rilasciati i prodotti. Nel caso di una reazione a due substrati pertanto l enzima l formerà un complesso ternario con i due substrati Nelle reazioni con meccanismo a doppio spostamento (o ping-pong pong) ) uno o più prodotti vengono rilasciati prima che tutti i substrati si siano legati all enzima.
86 Le reazioni con meccanismo sequenziale possono essere di due tipi: i: ordinate, in cui i substrati si legano all enzima in una sequenza definita. (il substrato 1 deve legarsi per primo in modo che il substrato 2 possa legarsi produttivamente) casuali, in cui i substrati possono legarsi in qualsiasi ordine.
87 Nelle reazioni a doppio spostamento (o reazioni ping-pong pong) ) si forma un complesso enzima-substrato e il primo prodotto esce dal complesso; l enzima l modificato forma un secondo complesso con una molecola di substrato 2 e si genera il secondo prodotto mentre l enzima l ritorna libero
88 Esempio di reazione con meccanismo a spostamento sequenziale di tipo ordinato, la reazione catalizzata dalla lattato deidrogenasi. Molti enzimi che utilizzano il NAD + o il NADH come substrati hanno un meccanismo sequenziale ordinato
89 Esempio di reazione con meccanismo a spostamento sequenziale di tipo casuale, la reazione catalizzata dalla creatin chinasi.
90 Esempio di reazione con meccanismo a spostamento doppio, la reazione catalizzata dalla aspartato aminotransferasi. L enzima è temporaneamente modificato
91 Le proprietà cinetiche di alcuni enzimi non possono essere spiegate dal modello di Michaelis-Menten. Gli enzimi allosterici spesso mostrano una curva della velocità catalitica in funzione della concentrazione del substrato con andamenro sigmoidale invece che iperbolico. Gli enzimi allosterici sono costituiti da più subunità e presentano più siti attivi Negli enzimi allosterici il legame del substrato ad un sito attivo può modificare le proprietà di altri siti attivi nella stessa molecola (enzimi omotropici). E possibile così un legame di tipo cooperativo.
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Ioni inorganici (Mg 2+, Zn 2+ ), o molecole organiche o metallorganiche (coenzimi)
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici
 La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
La Termodinamica è la disciplina che si occupa dello studio degli scambi di energia e di materia nei processi fisici e chimici Materia = tutto ciò che possiede una massa ed occupa uno spazio Energia =
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione.
 Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
delle curve isoterme dell anidride carbonica
 COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
COMPORTAMENTO DEI GAS REALI l andamento delle curve isoterme dell anidride carbonica mostra che: a temperature elevate le isoterme assomigliano a quelle di un gas perfetto Diagramma di Andrews a temperature
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA
 TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
Cine%ca enzima%ca. Copyright 2013 Zanichelli editore S.p.A.
 Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
L ATP E L ENERGIA LA CHIMICA DELLA VITA GSCATULLO
 L ATP E L ENERGIA LA CHIMICA DELLA VITA GSCATULLO ( L ATP e l energia L energia Energia e reazioni chimiche Una reazione chimica avviene quando gli atomi possiedono energia a sufficiente a combinarsi tra
L ATP E L ENERGIA LA CHIMICA DELLA VITA GSCATULLO ( L ATP e l energia L energia Energia e reazioni chimiche Una reazione chimica avviene quando gli atomi possiedono energia a sufficiente a combinarsi tra
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
Le reazioni chimiche
 Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Le reazioni chimiche Reazioni di sintesi Reazioni di sintesi o di combinazione diretta: A + B à AB. Nelle reazioni di sintesi due o più atomi o molecole reagiscono tra loro per dare un unico composto come
Termodinamica. Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico
 Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
Termodinamica Scienza che studia le relazioni tra il calore e le altre forme di energia coinvolte in un processo fisico o chimico La termodinamica fa uso di modelli astratti per rappresentare sistemi e
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA.
 CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA FACOLTA DI MEDICINA E CHIRURGIA. IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA. Un enzima è una proteina capace di catalizzare una specifica reazione
CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA FACOLTA DI MEDICINA E CHIRURGIA. IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA. Un enzima è una proteina capace di catalizzare una specifica reazione
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
1/v
 1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
Catalisi. Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A Modulo di Biologia Strutturale
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
FARMACODINAMICA. La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci.
 FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Macromolecole Biologiche Interazioni non covalenti
 Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
Interazioni non covalenti D H A δ - δ + δ - Le interazioni non covalenti Interazioni fra atomi che non sono legati da legami covalenti. Le interazioni non covalenti sono molto meno intense rispetto alle
Legge dell azione di massa. Misura sperimentale della costante di equilibrio. Corso di Studi di Fisica Corso di Chimica
 Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Corso di Studi di Fisica Corso di Chimica Luigi Cerruti www.minerva.unito.it Legge dell azione di massa Il caso dei gas: utilizziamo le pressioni parziali Lezione 7-8 1 Per definizione le concentrazioni
Velocità di reazione Una trasformazione chimica modifica completamente la natura delle sostanze iniziali ( i reagenti), formando altre specie (i prodo
 Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
CLASSIFICAZIONE ENZIMI
 CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
relazioni tra il calore e le altre forme di energia.
 Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Sapienza, Università di Roma. Antonella Goggiamani
 Sapienza, Università di Roma CHIMICA ORGANICA Antonella Goggiamani antonella.goggiamani@uniroma1.it Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea in Scienze Naturali, canale M Z LEZIONI
Sapienza, Università di Roma CHIMICA ORGANICA Antonella Goggiamani antonella.goggiamani@uniroma1.it Facoltà di Scienze Matematiche, Fisiche e Naturali Corso di Laurea in Scienze Naturali, canale M Z LEZIONI
ENZIMI. A + B AB (100 Kcal= E. Attiv.) A + B AB (50 Kcal) SUBSTRATO ENZIMA E N E R G I A
 ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
Le interazioni deboli:
 Le interazioni deboli: sono legami non covalenti sono da 1 a 3 ordini di grandezza più deboli dei legami covalenti sono alcune volte maggiori della tendenza a dissociare dovuta all agitazione termica delle
Le interazioni deboli: sono legami non covalenti sono da 1 a 3 ordini di grandezza più deboli dei legami covalenti sono alcune volte maggiori della tendenza a dissociare dovuta all agitazione termica delle
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 19 L energia si trasferisce 3 Sommario (I) 1. L «ABC» dei trasferimenti energetici 2. Durante le reazioni varia l energia chimica
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA. Angela Chambery Lezione 17
 Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 17 Enzimi Concetti chiave: Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni, specificità
Corso di Laurea in Farmacia Insegnamento di BIOCHIMICA Angela Chambery Lezione 17 Enzimi Concetti chiave: Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni, specificità
Energia di attivazione
 Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Fondamenti di Chimica Farmaceutica. Recettori come bersagli dei farmaci
 Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
Bilancio di energia: il Primo Principio della Termodinamica. Termodinamica dell Ingegneria Chimica
 Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
Bilancio di energia: il Primo Principio della Termodinamica Termodinamica dell Ingegneria Chimica 1 I Sistemi termodinamici Un sistema è definito da una superficie di controllo, reale o immaginaria, che
1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5.
 Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Unità n 6 Le leggi dei gas 1. Lo studio dei gas nella storia 2. I gas ideali e la teoria cinetico-molecolare 3. La pressione dei gas 4. La legge di Boyle o legge isoterma 5. La legge di Gay-Lussac o legge
Un modello per il gas ideale
 Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
Un modello per il gas ideale Un gas ideale consiste di particelle (atomi o molecole) che hanno le seguenti proprietà 1. Il volume proprio delle particelle è trascurabile rispetto al volume occupato dal
PROGRAMMA DISCIPLINARE SVOLTO a. s / N.B. il programma è pubblico ad uso degli studenti e delle famiglie.
 Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Pagina 1 di 5 PROGRAMMA DISCIPLINARE SVOLTO a. s. 2015 / 2016 DOCENTE: Ghezzi Maria Grazia CLASSE: 2^ ID DISCIPLINA: S.I.CHIMICA MACROARGOMENTI che sono stati trattate nel corso del corrente anno scolastico
Il metabolismo: concetti di base
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Il metabolismo: concetti di base Caratteristiche generali Strategie Trofiche Il metabolismo:
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Il metabolismo: concetti di base Caratteristiche generali Strategie Trofiche Il metabolismo:
SCIENZA DEI MATERIALI. Chimica Fisica. VI Lezione. Dr. Fabio Mavelli. Dipartimento di Chimica Università degli Studi di Bari
 SCIENZA DEI MATERIALI Chimica Fisica VI Lezione Dr. Fabio Mavelli Dipartimento di Chimica Università degli Studi di Bari Energia Libera di Helmholtz F 2 Definiamo la funzione di stato Energia Libera di
SCIENZA DEI MATERIALI Chimica Fisica VI Lezione Dr. Fabio Mavelli Dipartimento di Chimica Università degli Studi di Bari Energia Libera di Helmholtz F 2 Definiamo la funzione di stato Energia Libera di
Termodinamica dei sistemi biologici
 Bioenergetica Termodinamica dei sistemi biologici La bioenergetica è lo studio quantitativo delle trasduzioni energetiche, cioè dei cambiamenti di energia da una forma ad un altra Le trasformazioni biologiche
Bioenergetica Termodinamica dei sistemi biologici La bioenergetica è lo studio quantitativo delle trasduzioni energetiche, cioè dei cambiamenti di energia da una forma ad un altra Le trasformazioni biologiche
Equilibri chimici. Consideriamo la seg. reazione chimica in fase omogenea: aa + bb î cc + dd Definiamo, in ogni istante della reazione:
 Equilibri chimici Consideriamo la seg. reazione chimica in fase omogenea: aa + bb î cc + dd Definiamo, in ogni istante della reazione: con A, B, C, D espressi come concentrazioni molari. Il sistema si
Equilibri chimici Consideriamo la seg. reazione chimica in fase omogenea: aa + bb î cc + dd Definiamo, in ogni istante della reazione: con A, B, C, D espressi come concentrazioni molari. Il sistema si
Capitolo 5 L energia e il trasporto
 Capitolo 5 L energia e il trasporto La cellula e l energia 5.1 L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità
Capitolo 5 L energia e il trasporto La cellula e l energia 5.1 L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità
Dinamica delle reazioni chimiche (attenzione: mancano i disegni)
 Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
Dinamica delle reazioni chimiche (attenzione: mancano i disegni) Primo principio della termodinamica L energia non si può creare o distruggere, ma solo convertire da una forma all altra. Questo significa
TERMODINAMICA. Studia le trasformazioni dei sistemi in relazione agli scambi di calore e lavoro. GENERALITÀ SUI SISTEMI TERMODINAMICI
 TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
TERMODINAMICA Termodinamica: scienza che studia le proprietà e il comportamento dei sistemi, la loro evoluzione e interazione con l'ambiente esterno che li circonda. Studia le trasformazioni dei sistemi
Termodinamica II. Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
 Termodinamica II Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Processi Chimici e Fisici Spontanei L acqua scende a valle Un cucchiaino di zucchero si scioglio
Termodinamica II Copyright The McGraw-Hill Companies, Inc. Permission required for reproduction or display. 1 Processi Chimici e Fisici Spontanei L acqua scende a valle Un cucchiaino di zucchero si scioglio
Appendice cap. 29: applicazioni
 2 Analisi chimica strumentale Appendice cap. 29: applicazioni Per una reazione del 1 ordine, l equazione differenziale, ovvero la forma differenziale della legge cinetica, assume la forma d[a]/dt = k [A]
2 Analisi chimica strumentale Appendice cap. 29: applicazioni Per una reazione del 1 ordine, l equazione differenziale, ovvero la forma differenziale della legge cinetica, assume la forma d[a]/dt = k [A]
Cr Mn Fe Co Ni Cu Zn. Chimica Inorganica Biologica Vita ed Energia
 Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
Vita ed Energia I processi chimici alla base della chimica della vita sono due: Uso dell E solare per produrre materia e O 2 da CO 2 e H 2 O Produzione di E mediante ossidazione di materia con formazione
U.D. CHIMICA classe 2 a TECN. (CAT) CHIMICA TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO
 CHIMICA Classe 2 a TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D. Periodo Ore lezione 1. Nomenclatura molecole inorganiche (ripasso) settembre 6 2. Struttura atomica e tavola periodica
CHIMICA Classe 2 a TECNOLOGICO (CAT) PROGRAMMAZIONE ANNUALE: SEQUENZA DI LAVORO U.D. Periodo Ore lezione 1. Nomenclatura molecole inorganiche (ripasso) settembre 6 2. Struttura atomica e tavola periodica
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
ENZIMI. Catalizzatori delle reazioni biologiche
 ENZIMI Catalizzatori delle reazioni biologiche Le tre proprietà distintive degli enzimi sono A capacità catalitica B specificità C regolazione NOMENCLATURA Gli enzimi sono classificati in base alle reazioni
ENZIMI Catalizzatori delle reazioni biologiche Le tre proprietà distintive degli enzimi sono A capacità catalitica B specificità C regolazione NOMENCLATURA Gli enzimi sono classificati in base alle reazioni
Tensione di vapore evaporazione
 Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Transizioni di fase Una sostanza può esistere in tre stati fisici: solido liquido gassoso Il processo in cui una sostanza passa da uno stato fisico ad un altro è noto come transizione di fase o cambiamento
Introduzione al Metabolismo
 Chimica Biologica A.A. 2010-2011 Introduzione al Metabolismo Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Metabolismo Metabolismo l insieme dei processi attraverso
Chimica Biologica A.A. 2010-2011 Introduzione al Metabolismo Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Metabolismo Metabolismo l insieme dei processi attraverso
CORSO DI CHIMICA. Esercitazione del 7 Giugno 2016
 CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
CORSO DI CHIMICA Esercitazione del 7 Giugno 2016 25 ml di una miscela di CO e CO 2 diffondono attraverso un foro in 38 s. Un volume uguale di O 2 diffonde nelle stesse condizioni in 34,3 s. Quale è la
Energia per la vita Bibliografia I colori della biologia Giusti- Gatti- Anelli Pearson Ed.
 Energia per la vita Bibliografia I colori della biologia Giusti- Gatti- Anelli Pearson Ed. Ogni alimento che ingeriamo viene scomposto attraverso i processi digestivi nelle sue molecole costituenti come
Energia per la vita Bibliografia I colori della biologia Giusti- Gatti- Anelli Pearson Ed. Ogni alimento che ingeriamo viene scomposto attraverso i processi digestivi nelle sue molecole costituenti come
PRIMI ELEMENTI DI TERMODINAMICA. La termodinamica studia le leggi con cui i sistemi scambiano (cedono e ricevono) energia con l ambiente.
 PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
PRIMI ELEMENTI DI TERMODINAMICA Un sistema è un insieme di corpi che possiamo immaginare avvolti da una superficie chiusa, ma permeabile alla materia e all energia. L ambiente è tutto ciò che si trova
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
L equilibrio dell acqua
 L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
Il livello a cui verrà condotto l'esame sarà il livello con cui le materie vengono insegnate alle scuole superiori.
 Programma corso Chimica e metodologie d insegnamento, modulo Chimica Generale, Inorganica e Analitica. (1 cfu 8 ore CHIM/03) Claudia Dragonetti claudia.dragonetti@unimi.it -Configurazione elettronica,
Programma corso Chimica e metodologie d insegnamento, modulo Chimica Generale, Inorganica e Analitica. (1 cfu 8 ore CHIM/03) Claudia Dragonetti claudia.dragonetti@unimi.it -Configurazione elettronica,
1.Pressione di un Gas
 1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
1.Pressione di un Gas Un gas è formato da molecole che si muovono in modo disordinato, urtandosi fra loro e urtando contro le pareti del recipiente che le contiene. Durante gli urti, le molecole esercitano
Siena, 10 Giugno 2015 Sandra Defazio Serena Fedi
 CLASSE I A Costruzione Ambiente e Territorio omogenei ed eterogenei e curva di riscaldamento di un miscuglio. nobili. Distinzione fra molecole e atomi. Principio di conservazione della massa. Teoria atomica
CLASSE I A Costruzione Ambiente e Territorio omogenei ed eterogenei e curva di riscaldamento di un miscuglio. nobili. Distinzione fra molecole e atomi. Principio di conservazione della massa. Teoria atomica
Le reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Le reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO VIDEO Introduzione (I) La cinetica chimica è la branca della chimica che si interessa della velocità delle reazioni chimiche, cioè la variazione
Le reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO VIDEO Introduzione (I) La cinetica chimica è la branca della chimica che si interessa della velocità delle reazioni chimiche, cioè la variazione
Le proteine III. Corso di Biochimica 1. Prof. Giuseppina Pitari
 Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Le proteine III Corso di Biochimica 1 Prof. Giuseppina Pitari Ossi-mioglobina legame idrogeno lato distale La mioglobina L eme quindi consiste di una struttura organica alla quale è legato un atomo di
Energia di attivazione
 1 ENZIMI Caratteristiche fondamentali della catalisi enzimatica e del meccanismo di azione degli enzimi Componenti strutturali e funzionali degli enzimi Nomenclatura e classificazione internazionale degli
1 ENZIMI Caratteristiche fondamentali della catalisi enzimatica e del meccanismo di azione degli enzimi Componenti strutturali e funzionali degli enzimi Nomenclatura e classificazione internazionale degli
Capitolo n 5 ELEMENTI DI TERMODINAMICA E DI CINETICA
 Capitolo n 5 ELEMENTI DI TERMODINAMICA E DI CINETICA 5.1 Elementi di Termodinamica chimica 5.1.1 Introduzione alla Termodinamica La Termodinamica è una parte della Fisica che studia i sistemi e le loro
Capitolo n 5 ELEMENTI DI TERMODINAMICA E DI CINETICA 5.1 Elementi di Termodinamica chimica 5.1.1 Introduzione alla Termodinamica La Termodinamica è una parte della Fisica che studia i sistemi e le loro
DESTINI DEL PIRUVATO
 DESTINI DEL PIRUVATO LA GLICOLISI RILASCIA SOLO UNA PICCOLA PARTE DELL ENERGIA TOTALE DISPONIBILE NELLA MOLECOLA DI GLUCOSIO Le due molecole di piruvato prodotte dalla glicolisi sono ancora relativamente
DESTINI DEL PIRUVATO LA GLICOLISI RILASCIA SOLO UNA PICCOLA PARTE DELL ENERGIA TOTALE DISPONIBILE NELLA MOLECOLA DI GLUCOSIO Le due molecole di piruvato prodotte dalla glicolisi sono ancora relativamente
Stampa Preventivo. A.S Pagina 1 di 11
 Stampa Preventivo A.S. 2009-2010 Pagina 1 di 11 Insegnante BADALINI RENZO Classe 2BT Materia elementi di chimica e fisica preventivo consuntivo 99 84 titolo modulo 1. STRUTTURA E TRASFORM. DELL 2. L'ATOMO
Stampa Preventivo A.S. 2009-2010 Pagina 1 di 11 Insegnante BADALINI RENZO Classe 2BT Materia elementi di chimica e fisica preventivo consuntivo 99 84 titolo modulo 1. STRUTTURA E TRASFORM. DELL 2. L'ATOMO
BIOLOGIA GENERALE 22-24 ottobre 2007
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 22-24 ottobre 2007 Facoltà di Psicologia Tecniche di Psicologia Generale e Sperimentale Alessandro Massolo Dip.
Laboratorio Fitness & Wellness
 Laboratorio Fitness & Wellness Anno Accademico 2015/2016 Ewan Thomas, MSc Principi di Bioenergetica e Biomeccanica Metabolismo Catabolismo Processi di degradazione che permettono di liberare energia Anabolismo
Laboratorio Fitness & Wellness Anno Accademico 2015/2016 Ewan Thomas, MSc Principi di Bioenergetica e Biomeccanica Metabolismo Catabolismo Processi di degradazione che permettono di liberare energia Anabolismo
Digestione e assorbimento dei lipidi. β-ossidazione degli acidi grassi
 Digestione e assorbimento dei lipidi β-ossidazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500
Digestione e assorbimento dei lipidi β-ossidazione degli acidi grassi I grassi della dieta sono assorbiti nell intestino tenue Il diametro della particella dei chilomicroni varia da circa 100 a circa 500
Dipartimento Scientifico-Tecnologico
 ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
ISTITUTO TECNICO STATALE LUIGI STURZO Castellammare di Stabia - NA Anno scolastico 2012-13 Dipartimento Scientifico-Tecnologico CHIMICA, FISICA, SCIENZE E TECNOLOGIE APPLICATE Settore Economico Indirizzi:
Il trasporto del glucosio
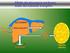 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
ISTITUTO D ISTRUZIONE SECONDARIA SUPERIORE GIAN TOMMASO GIORDANI MONTE SANT ANGELO PROGRAMMA SVOLTO DURANTE L ANNO SCOLASTICO 2015/2016
 ISTITUTO D ISTRUZIONE SECONDARIA SUPERIORE GIAN TOMMASO GIORDANI MONTE SANT ANGELO PROGRAMMA SVOLTO DURANTE L ANNO SCOLASTICO 2015/2016 DISCIPLINA D INSEGNAMENTO SCIENZE: BIOLOGIA CHIMICA CLASSE III LICEO
ISTITUTO D ISTRUZIONE SECONDARIA SUPERIORE GIAN TOMMASO GIORDANI MONTE SANT ANGELO PROGRAMMA SVOLTO DURANTE L ANNO SCOLASTICO 2015/2016 DISCIPLINA D INSEGNAMENTO SCIENZE: BIOLOGIA CHIMICA CLASSE III LICEO
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
ENERGIA LIBERA DI GIBBS (G)
 METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
La cinetica chimica. Velocità media di reazione
 La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
La cinetica chimica 1. Velocità di reazione. Leggi cinetiche semplici 3. Meccanismi di reazione 4. Effetto della temperatura: legge di Arrhenius e teoria del complesso attivato 5. Catalizzatori Velocità
Le trasformazioni chimiche e fisiche della materia. Lezioni d'autore di Giorgio Benedetti
 Le trasformazioni chimiche e fisiche della materia Lezioni d'autore di Giorgio Benedetti INTRODUZIONE (I) VIDEO INTRODUZIONE (II) La comprensione delle proprietà delle sostanze e le trasformazioni che
Le trasformazioni chimiche e fisiche della materia Lezioni d'autore di Giorgio Benedetti INTRODUZIONE (I) VIDEO INTRODUZIONE (II) La comprensione delle proprietà delle sostanze e le trasformazioni che
Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A
 1 Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A. 2006.2007 La cinetica delle reazioni chimiche Studiare una reazione dal punto di vista cinetico significa
1 Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A. 2006.2007 La cinetica delle reazioni chimiche Studiare una reazione dal punto di vista cinetico significa
2. Indicare l'affermazione che descrive più accuratamente il comportamento di un catalizzatore:
 1. "L'energia di attivazione, cioè l'energia necessaria a formare un composto ad alta energia potenziale, intermedio della reazione (il cosiddetto complesso attivato), è una grandezza caratteristica di
1. "L'energia di attivazione, cioè l'energia necessaria a formare un composto ad alta energia potenziale, intermedio della reazione (il cosiddetto complesso attivato), è una grandezza caratteristica di
Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti:
 Cinetica enzimatica Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti: ribozimi e abzimi Quasi tutti gli enzimi sono proteine
Cinetica enzimatica Gli enzimi sono catalizzatori nelle reazioni dei sistemi biologici Essi non sono gli unici catalizzatori biologici, esistono infatti: ribozimi e abzimi Quasi tutti gli enzimi sono proteine
IL LEGAME CHIMICO. Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
 IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
IL LEGAME CIMICO Come dagli atomi si costruiscono le molecole 02/19/08 0959 PM 1 Per descrivere come gli elettroni si distribuiscono nell atomo attorno al nucleo si può far riferimento al MODELLO A GUSCI
Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA
 Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Anno Scolastico 2009/2010 Corso di Meccanica, Macchine e Impianti Termici CAPITOLO 5 TERMODINAMICA Prof. Matteo Intermite 1 5.1 LEGGE DEI GAS I gas sono delle sostanze che in determinate condizioni di
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa
 Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Corso di Chimica e Propedeutica Biochimica Reazioni in soluzione acquosa Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione 1 Ioni in soluzione
Termodinamica e termochimica
 Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Termodinamica e termochimica La termodinamica è una scienza che studia proprietà macroscopiche della materia e prevede quali processi chimici e fisici siano possibili, in quali condizioni e con quali energie
Università telematica Guglielmo Marconi. Chimica
 Università telematica Guglielmo Marconi Chimica 1 Termodinamica 1 Argomenti Nell unità didattica dedicata alla termodinamica verranno affrontati i seguenti argomenti: L energia interna di un sistema Le
Università telematica Guglielmo Marconi Chimica 1 Termodinamica 1 Argomenti Nell unità didattica dedicata alla termodinamica verranno affrontati i seguenti argomenti: L energia interna di un sistema Le
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA
 REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
REAZIONI CHIMICHE: LEGGI CINETICHE, MECCANISMI DI REAZIONE E BILANCI DI MASSA Reazione chimica in condizione di equilibrio: concentrazioni costanti che obbediscono al vincolo determinato dalla costante
