Enzimi come catalizzatori biologici
|
|
|
- Flavia Masini
- 7 anni fa
- Visualizzazioni
Transcript
1 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede attraverso la formazione di complessi tra l'enzima e i reagenti. La più semplice reazione catalizzata da un enzima può essere così rappresenta da: E + S <====>ES <====>EP <====> E + P L'enzima E si combina con l'unico reagente S, detto substrato, per formare un complesso enzima-substrato, ES. ES è poi trasformato in EP che si scinde in prodotto P ed enzima libero, che è nuovamente disponibile per reagire con un'altra molecola di S. La velocità di una reazione catalizzata da un enzima può essere fino a volte superiore alla velocità della stessa reazione non catalizzata.
2
3
4 Alcuni enzimi esplicano la loro funzione catalitica utilizzando esclusivamente la reattività chimica dei loro residui amminoacidici. Molti enzimi richiedono invece la partecipazione di cofattori o gruppi prostetici di natura non proteica. Questi cofattori sono spesso legati saldamente, anche covalentemente, all'enzima e possono essere ioni metallici o complesse molecole organiche. Se il cofattore viene rimosso, la proteina assume il nome di apoenzima che è privo di attività.
5 Il complesso enzima-substrato Il meccanismo chimico della catalisi enzimatica include la formazione di un complesso enzima-substrato ES. La maggior parte delle reazioni enzimatiche utilizza substrati che sono di piccole dimensioni se comparati alla molecola enzimatica. Di conseguenza solo una piccola parte della proteina enzimatica si trova a diretto contatto con la molecola del substrato a formare il complesso enzimasubstrato (ES).
6 Il sito attivo La porzione di enzima a contatto con il substrato che gioca un ruolo diretto nel processo catalitico costituisce il sito attivo (o catalitico). Il sito attivo è situato generalmente sulla superficie della molecola enzimatica e coinvolge solo una piccola parte della proteina enzimatica. Il resto della struttura proteica fornisce una specie di scheletro strutturale che garantisce il giusto posizionamento del substrato e dei gruppi catalitici.
7 Tutti gli enzimi presentano il fenomeno della specificità di substrato. Ai livelli più elevati di specificità, gli enzimi, non solo, sono in grado di discriminare in base all identità chimica del substrato, ma anche sulla base della sua configurazione. geometrica e stereochimica. Ad esempio se un enzima utilizza come substrato la forma D di uno zucchero, ne consegue che il corrispondente stereoisomero L non sarà oggetto di reazione, se non in misura del tutto trascurabile. Gli enzimi possono distinguere due gruppi uguali all'interno di una molecola simmetrica in modo da reagire sempre con lo stesso gruppo.
8 Ipotesi della serratura e della chiave Nel 1894 Fischer propose la sua "ipotesi della serratura e della chiave" (lock and key hypothesis) implicante una complementarietà tra substrato ed enzima legata a rigide conformazioni molecolari. Per quanto questa ipotesi sia in grado di spiegare le interazioni enzima substrato per un gran numero di enzimi, diviene difficilmente sostenibile quando si consideri che composti chimicamente molto simili al substrato ma che posseggono gruppi meno voluminosi spesso non reagiscono con l'enzima, sebbene dovrebbero facilmente adattarsi allo stampo.
9 E' sulla base di queste osservazioni che Koshland (1958) dedusse l'ipotesi che va sotto il nome di "ipotesi dell'adattamento indotto" (induced fit) e si basa sulla complementarietà esistente tra una mano e un guanto, più che tra una serratura ed una chiave. A) Modello dell adattamento indotto: enzima e substrato si modificano a vicenda. B) Modello dell adattamento indotto: in alcune in reazioni a due substrati solo il cambiamento conformazionale indotto nell'enzima dal legame con il primo substrato permette al secondo substrato di legarsi.
10 La classificazione degli enzimi Tradizionalmente il nome di un enzima era assegnato liberamente dal suo scopritore. Oggi l Intenational Union of Biochemists (I.U.B) raggruppa gli oltre 1500 enzimi noti in sei classi funzionali. Ciascuna classe funzionale comprende numerose sottoclassi,a loro volta suddivise in sotto-sottoclassi. Ogni enzima è identificato da quattro numeri, i primi tre corrispondenti alla classe,sottoclasse e sotto-sottoclasse; il quarto è caratteristico di ogni singolo enzima all interno della sotto-sottoclasse. Il nome di un enzima si forma indicando i substrati su cui agisce ed il tipo di reazione catalizzata con suffisso asi.
11 Numero Classificazione Azione 1 Ossidoreduttasi 2 Trasferasi Aggiunta o rimozione di atomi di idrogeno da molti gruppi chimici Trasferimento di gruppi funzionali da molecole donatrici a molecole accettrici. Le cinasi sono specifiche trasferasi adibite al traserimento di un gruppo fosfato. 3 Idrolasi Aggiunta di acqua ad un legame con contestuale rottura. 4 Liasi 5 Isomerasi 6 Ligasi Aggiunta di acqua, ammoniaca o anidride carbonica ad un doppio legame o loro rimozione Isomerizzazione cis-trans, cheto-enolica, aldoso-chetoso (isomerasi). Epimerizzazione (epimerasi e racemasi). Trasferimento intramolecolare di gruppi (mutasi) Formazione di un legame covalente accoppiata alla rottura di un legame ad alto contenuto di energia di idrolisi (sintetasi)
12 L enzima che catalizza la seguente reazione: alcool + NAD+ <====> aldeide (o chetone) + NADH normalmente chiamato alcool deidrogenasi ha il nome I.U.B. di alcool NAD + ossidoreduttasi ed è identificato dai numeri il primo 1 è quello della classe funzionale delle ossidoreduttasi il secondo 1 è quello della sottoclasse che identifica gli enzimi che agiscono sui gruppi CH-OH il terzo 1 è quello della sotto-sottoclasse che identifica gli enzimi che si servono di NAD o NADP il quarto 1 identifica l enzima all interno della sottosottoclasse.
13 Cinetica di reazioni enzimatiche Gli enzimi mostrano spesso cinetiche caratterizzate da una relazione iperbolica fra la velocità di reazione v e la concentrazione del substrato [S. Questo tipo di curva è detta di saturazione, perché quando l enzima viene saturato dal substrato la velocità diventa indipendente dalla concentrazione del substrato. Ciò implica l esistenza di un equilibrio che precede il passaggio che limita la velocità: K 1 E + S ES E + P dove E rappresenta l enzima, S il substrato, P il prodotto ed ES il complesso enzima-substrato. K -1 K 2 K -2
14 Michaelis e Menten (1913) hanno dato il nome alla equazione generale di velocità di reazioni enzimatiche che può esser scritta nella forma semplificata come: v = V max S S + K m dove (moli L -1 sec -1 ) è la velocità iniziale osservata, V max è la velocità massima osservata (a saturazione) e K m (molarità) è la costante caratteristica del particolare sistema enzima substrato.
15 Rappresentazione grafica dell equazione di Michaelis-Menten
16 Il loro approccio cinetico si basa sull assunzione che quando l enzima viene miscelato con un substrato, in forte eccesso, vi sarà un periodo iniziale in cui la velocità con cui si forma il complesso enzima substrato ES aumenterà fino a un certo valore (stato prestazionario). Una volta che tutto il substrato è stato saturato la velocità rimarrà costante fin quando almeno il substrato viene consumato (stato stazionario).
17 v = V max S S + K m se [S] << K m v = V max Km S se [S] = K m v = 1 2 V max se [S] >> K m v = V max
18
19 K m è quindi quella concentrazione di substrato alla quale la velocità della reazione è uguale ad un mezzo di V max. Ovvero la K m rappresenta la concentrazione di substrato richiesta per saturare metà dell enzima. Più piccolo è il valore di Km e più forte sarà il legame fra enzima e il substrato. La K m è una costante specifica per ogni enzima, per cui il suo valore numerico ci fornisce un mezzo per comparare enzimi differenti: se due enzimi hanno lo stesso valore di K m ci sono buone probabilità che siano lo stesso enzima.
20 Analisi grafica L' equazione di Michaelis-Menten descrive come abbiamo già detto un' iperbole equilatera, in cui V max e K m sono gli asintoti. Il valore di K m può essere determinato graficamente semplicemente ricordando che quando la velocità v della reazione è uguale a metà della V max, K m = [S]. L' equazione di Michaelis-Menten può però essere manipolata per ottenere l' equazione di una retta in cui V ma x e K m siano delle intercette e non più degli asintoti. Il metodo più usati e quello di Lineweaver-Burk che usa la forma reciproca dell' equazione di Michaelis-Menten:
21
22 dove le variabili sono 1/v e 1/[S]. 1/V max è l' intercetta sull' asse y e -1/K m è l' intercetta sull' asse x.
23 Inibizione enzimatica Qualsiasi agente in grado di diminuire la velocità di una reazione catalizzata da un enzima è definito inibitore. Gli inibitori possono essere classificati come reversibili e irreversibili. Gli inibitori irreversibili si legano all enzima con legami covalenti o possono denaturarlo. Se l inibitore è del tipo irreversibile viene definito inattivatore. Gli inibitori reversibili si legano all enzima con legami deboli e possono dar luogo a inibizione competitiva, inibizione non competitiva e inibizione mista. Mentre gli agenti che migliorano l efficienza di un enzima vengono definiti attivatori.
24 A) Inibizione competitiva Un inibitore competitivo è una sostanza che mostra una affinità simile al substrato per l'enzima libero e compete con il substrato per la formazione del complesso enzima-substrato. Se l affinità dell inibitore è più forte del substrato impedisce la formazione del complesso enzimasubstrato. Esso può essere un analogo non metabolizzabile del substrato o un substrato alternativo per l'enzima. L inibizione di solito è dovuta alla somiglianza dell inibitore con il substrato. L inibizione competitiva porta di norma ad un aumento della K m e nessun effetto sulla V max.
25 L'inibizione della succinicodeidrogenasi da parte dell'acido malonico è un classico esempio di inibizione competitiva da analogo non metabolízzabile: l'acido malonico è in grado di legarsi nel sito attivo dell' enzima, ma non può essere ossidato avendo un solo gruppo CH 2.
26 B) Inibizione non-competitiva Nel caso dell inibizione non-competitiva l' inibitore I non compete con il substrato in quanto si lega all' enzima in un sito diverso dal sito attivo (complesso EI). Il legame di I a E non ha effetto sulla formazione del legame tra S ed E, in quanto entrambi si legano all' enzima in siti differenti. Ciò significa che l inibitore I si lega tanto ad E (complesso EI) che a ES (complesso ESI) e che S si lega sia ad E (complesso ES) che a EI (complesso ESI). Quando la costante di dissociazione del complesso EI è la stessa del complesso ESI si ha inibizione del tipo non-competitiva. La presenza di uno dei complessi non ha alcun effetto sulla costante K m, ma la V max diminuisce all aumentare della quantità di inibitore.
27
28 C) Inibizione mista Nell inibizione mista il legame dell inibitore I influenza il legame di S ad E. Questo avviene o perché i siti di legame di I ed di S sono vicini, oppure perché I causa un cambiamento conformazionale in E che influenza il legame di S. In entrambi i casi il complesso ternario ESI non porta alla formazione di prodotti. In questo caso si osserverà ad un aumento della K m ed ad una diminuzione della V max.
29 Effetto del ph e della temperatura sull attività enzimatica La maggior parte degli enzimi hanno un particolare ph in cui la loro attività è massima. I profili di attività-ph di molti enzimi hanno una forma a campana, però la loro forma può variare considerevolmente. Infatti la relazione tra l attività e il ph ottimale di ciascun enzima dipende dal comportamento acido-basico dell enzima e del substrato. La K m della maggior parte degli enzimi cambia con il ph. Come per molte reazioni chimiche, così anche la velocità delle reazioni enzimatiche aumenta in genere con la temperatura, naturalmente entro i limiti in cui l enzima è stabile e mantiene la sua attività. La velocità della maggior parte delle reazioni enzimatiche raddoppia per ogni aumento di 10 C. Un aumento di temperatura elevato può portare alla denaturazione dell enzima e quindi alla perdita di attività catalitica. In genere la maggior parte degli enzimi sono inattivati a temperature superiori ai C, sebbene esistano batteri termofili che sono attivi a temperature superiori agli 85 C.
30
31 Enzimi con siti catalitici multipli cooperativi: enzimi allosterici Se il legame di una molecola con l' enzima induce cambiamenti conformazionali nell enzima tali da alterare le affinità dei siti vacanti per il substrato, l'enzima sarà classificato come allosterico. La curva di v / [S] non seguirà più la cinetica di Michaelis-Menten, ma generalmente, gli enzimi allosterici hanno delle curve v/[s] di tipo sigmoidale. Se il legame di una molecola di substrato facilita il legarsi di ulteriori molecole di substrato come conseguenza di una aumentata affinità dei siti vacanti si parla di effetto cooperativo positivo.
32
33 I vantaggi potenziali di una risposta sigmoidale si possono constatare comparando tra loro una curva iperbolica con una sigmoidale. Dal grafico si può ricavare che nel caso della risposta iperbolica che il rapporto [S0,9] / [S0,1] = 81; ciò vuol dire che per passare da un decimo della Vmax ai nove decimi della Vmax, la concentrazione di substrato deve incrementare di ben 81 volte. Nel caso della curva sigmoidale riportata in figura il rapporto [ S0,9] / [ S0,1] = 4,4; ciò significa che in questo caso è sufficiente un incremento molto minore della concentrazione del substrato per passare da Vmax = 0,1 a Vmax = 0,9. In altri termini con la risposta sigmoidale le variazioni della velocità appaiono più sensibili a variazioni di [S].
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
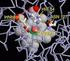 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
Enzimi e loro ruolo nel metabolismo
 Enzimi e loro ruolo nel metabolismo Definizioni e ruoli degli enzimi Cinetica enzimatica Localizzazione degli enzimi Enzimi come bersaglio di farmaci Enzimi come markers in Biochimica Clinica Errori congeniti
Enzimi e loro ruolo nel metabolismo Definizioni e ruoli degli enzimi Cinetica enzimatica Localizzazione degli enzimi Enzimi come bersaglio di farmaci Enzimi come markers in Biochimica Clinica Errori congeniti
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Fondamenti di Chimica Farmaceutica. Inibizione enzimatica
 Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
Fondamenti di Chimica Farmaceutica Inibizione enzimatica Cinetica enzimatica E + S k 1 k 1 ES k2 E + P La reazione catalizzata dall enzima avviene in due passaggi: la formazione del complesso enzima-substrato:
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
CLASSIFICAZIONE ENZIMI
 CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi
 1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi ATP + glucosio glucochinasi ADP + glucosio-6-p E.C 2.7.1.2 glucochinasi E.C 2.7.1.1 esochinasi Energia libera,g S k 1 k 1 =
1. Ossidoreduttasi 2. Transferasi 3. Idrolasi 4. Liasi 5. Isomerasi 6. Ligasi ATP + glucosio glucochinasi ADP + glucosio-6-p E.C 2.7.1.2 glucochinasi E.C 2.7.1.1 esochinasi Energia libera,g S k 1 k 1 =
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA
 TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
proteine enzimi RNA ribozimi substrati altamente specifici -asi
 I catalizzatori sono sostanze che aumentano la velocità delle reazioni senza subire modificazioni. Un catalizzatore non induce una reazione che non può avvenire, fa solo in modo che avvenga più velocemente.
I catalizzatori sono sostanze che aumentano la velocità delle reazioni senza subire modificazioni. Un catalizzatore non induce una reazione che non può avvenire, fa solo in modo che avvenga più velocemente.
CINETICA ENZIMATICA - velocità di reazione
 [P] Velocità iniziale (V 0 ) CINETICA ENZIMATICA - velocità di reazione + + k 1 E + S ES ES E + P k 2 k 3 k 4 V = d[p]/dt = k 3 [ES] Velocità iniziale (V 0 ) quando [S] >> [P] V max t CINETICA ENZIMATICA:
[P] Velocità iniziale (V 0 ) CINETICA ENZIMATICA - velocità di reazione + + k 1 E + S ES ES E + P k 2 k 3 k 4 V = d[p]/dt = k 3 [ES] Velocità iniziale (V 0 ) quando [S] >> [P] V max t CINETICA ENZIMATICA:
v = Δ[P] = _ Δ[S] S P
![v = Δ[P] = _ Δ[S] S P v = Δ[P] = _ Δ[S] S P](/thumbs/98/137173050.jpg) CINETICA ENZIMATICA Gli esperimenti di cinetica enzimatica si basano sulla determinazione della velocità di reazione, misurata come variazione della concentrazione del prodotto o del reagente in un dato
CINETICA ENZIMATICA Gli esperimenti di cinetica enzimatica si basano sulla determinazione della velocità di reazione, misurata come variazione della concentrazione del prodotto o del reagente in un dato
k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica)
 Costante catalitica o n di Turnover k 1 k 2 S + E ES E + P k -1 Vmax = k 2 [ES] = k 2 [E] TOT k Vmax 2 = [E] TOT k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica)
Costante catalitica o n di Turnover k 1 k 2 S + E ES E + P k -1 Vmax = k 2 [ES] = k 2 [E] TOT k Vmax 2 = [E] TOT k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica)
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Determinazione dell attività enzimatica
 Determinazione dell attività enzimatica Gli enzimi sono una percentuale rilevante delle proteine cellulari anche se ciascun tipo di enzima è presente nella cellula in quantità molto bassa. Controllano
Determinazione dell attività enzimatica Gli enzimi sono una percentuale rilevante delle proteine cellulari anche se ciascun tipo di enzima è presente nella cellula in quantità molto bassa. Controllano
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
2) La presenza di gruppi funzionali specifici che partecipano alla catalisi (quelli delle catene laterali dei suoi residui amminoacidici e/o quelli
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari (sono in grado di aumentare la velocità delle reazioni biologiche anche di 10 20 volte). Durante
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio
 Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe. Substrato
 Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright 2014 6 11
ENZIMI : catalizzatori biologici
 ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
Esempi di funzioni svolte dalle proteine
 Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
ENZIMI. Catalizzatori delle reazioni biologiche
 ENZIMI Catalizzatori delle reazioni biologiche I CATALIZZATORI ABBASSANO L ENERGIA DI ATTIVAZIONE FACILITANDO LA FORMAZIONE DELLO STATO DI TRANSIZIONE Il legame tra enzima e substrato genera un percorso
ENZIMI Catalizzatori delle reazioni biologiche I CATALIZZATORI ABBASSANO L ENERGIA DI ATTIVAZIONE FACILITANDO LA FORMAZIONE DELLO STATO DI TRANSIZIONE Il legame tra enzima e substrato genera un percorso
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
STRUTTURA E MECCANISMI D AZIONE DEGLI ENZIMI
 STRUTTURA E MECCANISMI D AZIONE DEGLI ENZIMI Confronto tra gli enzimi e i catalizzatori chimici Gli enzimi sono caratterizzati da: Velocità di reazione più elevate Condizioni di reazione più moderate
STRUTTURA E MECCANISMI D AZIONE DEGLI ENZIMI Confronto tra gli enzimi e i catalizzatori chimici Gli enzimi sono caratterizzati da: Velocità di reazione più elevate Condizioni di reazione più moderate
REAZIONI CHIMICHE. Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: I reagenti (substrati) devono entrare in collisione
 ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
Lezione n. 11. Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione -
 Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Inibizione Enzimatica
 Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
REAZIONI CHIMICHE. Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: I reagenti (substrati) devono entrare in collisione
 ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
ENZIMI 1 REAZIONI CHIMICHE Perché una reazione chimica avvenga devono essere soddisfatte tre condizioni: 2 I reagenti (substrati) devono entrare in collisione Le collisione tra le molecole dei reagenti
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
TARGETS DEI FARMACI ATTUALMENTE IN USO
 TARGETS DEI FARMACI ATTUALMENTE IN USO INIBITORI ENZIMATICI INIBITORI ENZIMATICI Sintesi dell'uridine-5'-monophosphate (UMP) INIBITORI ENZIMATICI EFFICACIA DI INIBITORI COME AGENTI TERAPEUTICI Potenza
TARGETS DEI FARMACI ATTUALMENTE IN USO INIBITORI ENZIMATICI INIBITORI ENZIMATICI Sintesi dell'uridine-5'-monophosphate (UMP) INIBITORI ENZIMATICI EFFICACIA DI INIBITORI COME AGENTI TERAPEUTICI Potenza
di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori.
 Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
2. Quale delle seguenti affermazioni relative ad una reazione enzimatica è vera?
 1. Gli enzimi agendo come catalizzatori: a) innalzano l'energia di attivazione b) innalzano il livello energetico dei prodotti c) abbassano il livello energetico dei reagenti d) diminuiscono l'energia
1. Gli enzimi agendo come catalizzatori: a) innalzano l'energia di attivazione b) innalzano il livello energetico dei prodotti c) abbassano il livello energetico dei reagenti d) diminuiscono l'energia
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Trattamento quantitativo della complessazione e della reattività nei sistemi supramolecolari
 Trattamento quantitativo della complessazione e della reattività nei sistemi supramolecolari Assunzione di principio: i sistemi si trovano in condizioni di controllo termodinamico e non cinetico (tutti
Trattamento quantitativo della complessazione e della reattività nei sistemi supramolecolari Assunzione di principio: i sistemi si trovano in condizioni di controllo termodinamico e non cinetico (tutti
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Ioni inorganici (Mg 2+, Zn 2+ ), o molecole organiche o metallorganiche (coenzimi)
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Scaricato da 1
 A AB B Scaricato da www.sunhope.it 1 1 1 1 2 2 2 3 45 5 5 4 20 20 5 40 40 6 40 20 23 7 5 12 8 35 2 6 9 1 1 Numero di mole ecole 30 25 20 15 10 5 0 0 2 4 6 8 10 Energia Scaricato da www.sunhope.it 2 Scaricato
A AB B Scaricato da www.sunhope.it 1 1 1 1 2 2 2 3 45 5 5 4 20 20 5 40 40 6 40 20 23 7 5 12 8 35 2 6 9 1 1 Numero di mole ecole 30 25 20 15 10 5 0 0 2 4 6 8 10 Energia Scaricato da www.sunhope.it 2 Scaricato
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
La cinetica enzimatica
 La cinetica enzimatica Cinetica chimica All equilibrio Ordine di reazione I ordine II ordine Ordine zero La cinetica di una reazione chimica Cinetica di una reazione enzimatica Ordine 1 (enzima costante)
La cinetica enzimatica Cinetica chimica All equilibrio Ordine di reazione I ordine II ordine Ordine zero La cinetica di una reazione chimica Cinetica di una reazione enzimatica Ordine 1 (enzima costante)
Regolazione dell attività enzimatica. Allosteria Modificazioni covalenti Isoenzimi
 Regolazione dell attività enzimatica Allosteria Modificazioni covalenti Isoenzimi Regolazione della attività enzimatica L attività enzimatica deve potere essere regolata in base alle specifiche richieste
Regolazione dell attività enzimatica Allosteria Modificazioni covalenti Isoenzimi Regolazione della attività enzimatica L attività enzimatica deve potere essere regolata in base alle specifiche richieste
catalizzatori biologici RUOLO DEGLI ENZIMI: 16/03/15
 I sistemi viventi sono caratterizzati da un enorme varietà reazioni chimiche la maggior parte delle quali è mediata da una serie di eccezionali CATALIZZATORI BIOLOGICI : GLI ENZIMI L ENZIMOLOGIA E UNA
I sistemi viventi sono caratterizzati da un enorme varietà reazioni chimiche la maggior parte delle quali è mediata da una serie di eccezionali CATALIZZATORI BIOLOGICI : GLI ENZIMI L ENZIMOLOGIA E UNA
ENZIMI : catalizzatori biologici
 ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
ENZIMI : catalizzatori biologici 1 Nell organismo sono indispensabili alla vita: per esempio le reazioni chimiche connesse con un singolo respiro, in assenza di enzimi, durerebbero ore. L enzima anidrasi
ENZIMI. A + B AB (100 Kcal= E. Attiv.) A + B AB (50 Kcal) SUBSTRATO ENZIMA E N E R G I A
 ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
 www.fisiokinesiterapia.biz Unità chimica Diversità biologica diversi livelli di analisi: macroscopico/microscopico Composto organico Subunità monomeriche (Es. Proteine) (Aminoacidi) Le Subunità monomeriche
www.fisiokinesiterapia.biz Unità chimica Diversità biologica diversi livelli di analisi: macroscopico/microscopico Composto organico Subunità monomeriche (Es. Proteine) (Aminoacidi) Le Subunità monomeriche
I catalizzatori della cellula: gli ENZIMI
 I catalizzatori della cellula: gli ENZIMI LA CATALISI ENZIMATICA E NECESSARIA PER PERMETTERE A MOLTE REAZIONI BIOCHIMICHE DI PROCEDERE AD UNA VELOCITA CONVENIENTE IN CONDIZIONI BIOLOGICHE UNA REAZIONE
I catalizzatori della cellula: gli ENZIMI LA CATALISI ENZIMATICA E NECESSARIA PER PERMETTERE A MOLTE REAZIONI BIOCHIMICHE DI PROCEDERE AD UNA VELOCITA CONVENIENTE IN CONDIZIONI BIOLOGICHE UNA REAZIONE
In questo caso parliamo di un processo entalpico. Si tratta di un processo entalpico.
 LEZIONE DEL 10/04/2017 ENZIMOLOGIA - APPLICAZIONI DELLA CINETICA ENZIMATICA Essa trova applicazioni nel processamento dei rifiuti, nelle materie organiche. Si tratta dell'ingegnerizzazione dei processi
LEZIONE DEL 10/04/2017 ENZIMOLOGIA - APPLICAZIONI DELLA CINETICA ENZIMATICA Essa trova applicazioni nel processamento dei rifiuti, nelle materie organiche. Si tratta dell'ingegnerizzazione dei processi
Ioni metallici: Cu 2+, Fe 3+, Zn 2+ Coenzimi : NAD +, FAD + COSUBSTRATI GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Enzimi: catalizzatori biologici
 Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Ioni metallici: Cu 2+, Fe 3+, Zn 2+ Coenzimi : NAD +, FAD + COSUBSTRATI GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
2015 /2016. scaricato da
 Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Alcuni Cofattori sono associati in modo permanente con la proteina, anche mediante legami covalenti: GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
La via per accelerare i processi biologici
 La via per accelerare i processi biologici ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa.
La via per accelerare i processi biologici ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa.
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica
 Brevetti Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Committente:
Brevetti Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Committente:
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
Catalisi. Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A Modulo di Biologia Strutturale
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
ESERCIZI ESERCIZI. 3) Data la reazione chimica: H 2
 ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
BIOLOGIA GENERALE 19 dicembre 2006
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
Alcuni Cofattori sono associati in modo permanente con la proteina, anche mediante legami covalenti: GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Per la stessa reazione possono essere utilizzati catalizzatori diversi. es. HCOOH H 2 + CO 2 viene catalizzata da Ni, Cd, Pt, Cu.
 CATALISI L'uso di un catalizzatore, sostanza capace di accelerare una reazione senza intervenire sulla T, è di enorme importanza in alcuni tipi di reazione. Ad esempio le proteine reagiscono velocemente
CATALISI L'uso di un catalizzatore, sostanza capace di accelerare una reazione senza intervenire sulla T, è di enorme importanza in alcuni tipi di reazione. Ad esempio le proteine reagiscono velocemente
Fondamenti di Chimica Farmaceutica. Recettori come bersagli dei farmaci
 Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
Velocità di reazione
 1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
Cine%ca enzima%ca. Copyright 2013 Zanichelli editore S.p.A.
 Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
CATALISI COVALENTE. H 2 O Enz-R-OH + P. Enz-R-O S Enz-R-O-S
 CATALISI COVALENTE Comporta la formazione di intermedi in cui il substrato è legato covalentemente con un residuo amminoacidico del sito attivo dell enzima. La catena laterale re dell enzima può comportarsi
CATALISI COVALENTE Comporta la formazione di intermedi in cui il substrato è legato covalentemente con un residuo amminoacidico del sito attivo dell enzima. La catena laterale re dell enzima può comportarsi
Cinetica Chimica 07/01/2016
 Cinetica Chimica Rappresenta lo studio del modo in cui le reazioni vanno verso l equilibrio. Si misura la variazione nel tempo della concentrazione di prodotti e reagenti (velocità di reazione) e l effetto
Cinetica Chimica Rappresenta lo studio del modo in cui le reazioni vanno verso l equilibrio. Si misura la variazione nel tempo della concentrazione di prodotti e reagenti (velocità di reazione) e l effetto
Cinetica Chimica. Cinetica chimica
 Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
Energia di attivazione
 Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Enzimi. 1. Definizione 2. Numero di Turn-over 3. Nomenclatura 4. Cofattori 5. Sito attivo
 Enzimi 1. Definizione 2. Numero di Turn-over 3. Nomenclatura 4. Cofattori 5. Sito attivo 6. Specificità o Modello di Fischer (chiave-serratura) o Modello dell adattamento indotto 7. Cinetica enzimatica
Enzimi 1. Definizione 2. Numero di Turn-over 3. Nomenclatura 4. Cofattori 5. Sito attivo 6. Specificità o Modello di Fischer (chiave-serratura) o Modello dell adattamento indotto 7. Cinetica enzimatica
NOTE DI CINETICA ENZIMATICA
 NOTE DI CINETICA ENZIMATICA - 1 - Sommario Cinetica chimica... 5 Velocità di reazione.... 5 Cinetica di reazioni enzimatiche ad un substrato.... 7 Le equazioni di Michaelis-Menten e di Briggs-Haldane....
NOTE DI CINETICA ENZIMATICA - 1 - Sommario Cinetica chimica... 5 Velocità di reazione.... 5 Cinetica di reazioni enzimatiche ad un substrato.... 7 Le equazioni di Michaelis-Menten e di Briggs-Haldane....
Termodinamica ENTALPIA...6
 Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
ENZIMI. Catalizzatori delle reazioni biologiche
 ENZIMI Catalizzatori delle reazioni biologiche Le tre proprietà distintive degli enzimi sono A capacità catalitica B specificità C regolazione NOMENCLATURA Gli enzimi sono classificati in base alle reazioni
ENZIMI Catalizzatori delle reazioni biologiche Le tre proprietà distintive degli enzimi sono A capacità catalitica B specificità C regolazione NOMENCLATURA Gli enzimi sono classificati in base alle reazioni
Energia e metabolismi energetici
 Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Corso di Chimica e Propedeutica Biochimica Cinetica chimica ed enzimatica
 Corso di Chimica e Propedeutica Biochimica Cinetica chimica ed enzimatica 2 H 2 (g) + 2 (g) 2 H 2 (g) 1 Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007,
Corso di Chimica e Propedeutica Biochimica Cinetica chimica ed enzimatica 2 H 2 (g) + 2 (g) 2 H 2 (g) 1 Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007,
Cap.16 GLICOLISI. Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP H 2 O 2 NAD + 2 NADH + 2H +
 Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
Cap.16 GLICOLISI Glucosio + 2 ADP + 2 Pi + 2 NAD + 2 Piruvato + 2 ATP + 2 H 2 O+ 2 NADH + 2H + 2 ADP + 2 Pi 2 ATP 2 + 2 H 2 O 2 NAD + 2 NADH + 2H + Via metabolica in 10 tappe (reazioni) La glicolisi può
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
