Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe. Substrato
|
|
|
- Rocco Franceschi
- 6 anni fa
- Visualizzazioni
Transcript
1 Se il sito attivo fosse perfettamente complementare al substrato la reazione non procederebbe Substrato Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright
2 La specificità del legame enzima/substrato può essere spiegata col modello chiave-serratura di Fisher Il sito attivo possiede dei punti di ancoraggio specifici per i gruppi funzionali del substrato Il potere catalitico di un enzima può essere spiegato col modello dell adattamento indotto di Koshland L enzima ha un sito che può alloggiare in modo specifico un substrato ma questo sito diventa complementare al substrato solo nello stato di transizione e solo attraverso un cambiamento conformazionale dell enzima stesso
3 Quando si forma il complesso ES nel distorcere il substrato l enzima stesso cambia conformazione adattando perfettamente la forma del sito catalitico allo stato di transizione del substrato e presentando ad esso i suoi gruppi catalitici. esochinasi (è una trasferasi: trasferisce sul C-6 del glucosio un gruppo fosfato donato dall ATP e produce glucosio-6-fosfato)
4 velocità di reazione Effetto della temperatura sulla velocità di una reazione enzimatica La velocità di reazione aumenta all aumentare della temperatura sino a raggiungere un valore massimo (Mantenendo costanti ph, [E] e [S]) Optimum di temperatura: è diverso per i diversi enzimi A T superiori a quella ottimale: - sono alterate le interazioni che consentono la formazione di ES; - l enzima va incontro a modificazioni strutturali del sito attivo (rottura dei legami deboli, denaturazione)
5 Velocità di reazione Effetto del ph sulla velocità di una reazione enzimatica Da ricollegare al diverso stato di protonazione delle catene laterali di residui amminoacidici che costituiscono il sito catalitico e il sito di legame per il substrato.
6 velocità di reazione Cys-25 Massima attività Cys-25 His-159 His-159 Cys-25 PAPAINA = enzima proteolitico, scinde i legami peptidici delle proteine. Nel sito attivo sono presenti una cisteina molto acida e un istidina molto basica. FORMANO UNA COPPIA IONICA His ph Massima attività: intervallo di ph compreso fra i pka di due residui amminoacidici del sito attivo (fra ph 4.2 e 8.2). In questo intervallo le catene laterali di entrambi i residui amminoacidici sono ionizzati. O=C l HN C H l CH 2 l H C N+ CH C N H H O=C l HN C H l CH 2 l S His-159 (pk R 8.2) Cys-25 (pk R 4.2)
7 1) Perché studiare la cinetica di una reazione enzimatica? Per determinare dei parametri specifici e caratterizzanti per un dato enzima che ci dicono: - Quanto un enzima è affine ad un dato substrato - Quanto l enzima è efficiente - Come posso controllare la velocità della reazione - Come posso regolare l attività catalitica dell enzima (inibendolo o attivandolo) 2) Cosa devo misurare per studiare la cinetica enzimatica? LA VELOCITA DI REAZIONE AL TEMPO ZERO IN FUNZIONE DELLA CONCENTRAZIONE DI SUBSTRATO (misurata come variazione della concentrazione di prodotto ottenuto nel tempo, o di substrato consumato nel tempo) 3) Come interpreto i dati ottenuti? Applico delle equazioni matematiche. Il modello matematico BASE per elaborare i dati di una cinetica enzimatica (per enzimi non allosterici) è quello proposto da L. Michaelis e M. Menten (1913)/Haldane e Briggs (1925)
8 CINETICA ENZIMATICA Gli esperimenti di cinetica enzimatica si basano sulla determinazione della velocità di reazione, misurata come variazioni della concentrazione del prodotto o del reagente in un dato intervallo di tempo. S P v = Δ[P] = _ Δ[S] Δt Δt [S] [P] = aumenta nel tempo [S]= diminuisce nel tempo [P] Col procedere della reazione le curve cinetiche si appiattiscono: la velocità non subisce variazioni. S è consumato perché trasformato in P e la reazione tenderà a raggiungere l equilibrio. tempo
9 S P v = Δ[P] = _ Δ[S] Δt Δt [S] [P] = aumenta nel tempo [S]= diminuisce nel tempo [P] Problema: Voglio misurare in che modo varia la velocità della reazione se uso diverse concentrazioni di substrato (1, 5, o 10 mm, per es ). tempo Devo misurare la velocità della reazione al MOMENTO INIZIALE (entro i primi sec), quando la quantità di prodotto formato è molto bassa e la concentrazione del substrato ha un valore preciso che conosco (quello iniziale stabilito dallo sperimentatore). In questo modo posso associare al valore di [S] utilizzato un dato valore di V 0 (velocità iniziale)
10 COME DETERMINO LA VELOCITA INIZIALE? Studio di una reazione enzimatica semplice (1 solo substrato e 1 solo stadio intermedio): 1) miscelo l enzima con il suo substrato, lavoro a temperatura e ph costanti, 2) Preparo un certo numero di miscele di reazione in cui la [E] è inalterata, ma la [S] è diversa: per ogni esperimento misuro come varia la velocità di reazione nel tempo. 3) Velocità di reazione: misuro la concentrazione di prodotto che si formerà in tempi diversi nelle diverse miscele di reazione. La velocità di reazione aumenta all aumentare della concentrazione del substrato utilizzata. v = Δ[P] = _ Δ[S] Δt Δt v = k [S] k = -1/Δt (costante di velocità specifica per ogni reazione) -Reazione di 1 ordine- v = Δ[P] = _ Δ[S] Δt Δt
11 4) Calcolo il valore della velocità di reazione nello stadio iniziale (v 0 ) alle diverse [S]. VELOCITA INIZIALE (v 0 ) è calcolata come pendenza della tangente alla curva cinetica. Per ognuna delle curve cinetiche ottenute a diverse [S] viene calcolata la v 0 (4) v 0 (3) v 0 (2) v 0 (1) Ogni punto rappresenta un diverso esperimento, ed è definito da due parametri: v 0 e [S] v 0 = k [S] La v 0 è direttamente proporzionale alla concentrazione di reagente [S] usata per la reazione. Per gli enzimi che seguono la cinetica di Micaelis- Menten la dipendenza della v 0 dalla [S] è descritta da una curva iperbolica
12 Velocità iniziale v 0 (μm/min) ENZIMI CHE SEGUONO LA CINETICA DI MICHAELIS-MENTEN Inserendo in un grafico i valori di v 0 ottenuti per le diverse [S] utilizzate ottengo una curva iperbolica Alte [S] = la v 0 non varia molto al variare di [S], l enzima è quasi completamente saturato, viene raggiunta asintoticamente una velocità di reazione massima. La v 0 non dipende più da [S]. Basse [S] = la velocità di reazione v 0 dipende strettamente dalla [S], aumenta all aumentare della [S] Concentrazione substrato [S] (mm) Posso spiegare questo comportamento con un equazione che correla la v 0 alla [S], alla Vmax e ad una costante di affinità (Km)
13 ENZIMI CHE SEGUONO LA CINETICA DI MICHAELIS-MENTEN Mostrano una dipendenza della velocità iniziale (v 0 ) dalla concentrazione di substrato di tipo IPERBOLICO. Catalizzano una reazione enzimatica che nel caso più semplice prevede: 1 prima tappa veloce e reversibile (ΔG minore e k maggiore) S + E k 1 k -1 ES 1 seconda tappa lenta e irreversibile (ΔG maggiore e k minore) che determina la velocità globale di reazione ES k 2 k -2 E + P k 1 = cost cinetica reazione di formazione del complesso ES k -1 = cost cinetica reazione di decomposizione del complesso ES in E + S k 2 = cost cinetica reazione di decomposizione del complesso ES in E + P k -2 = talmente piccola da essere trascurabile
14 v = k 1 [E] + [S] v = k 2 [ES] 1a tappa: Passaggio rapido k 1 k 2 S + E ES E + P k -1 2a tappa: Passaggio lento v = k -1 [ES] La v 0 GLOBALE della reazione enzimatica dipende da [ES] Questa equazione non è sufficiente a spiegare la relazione iperbolica esistente tra v 0 e [S]. v 0 = k 2 [ES] [ES] = non è facilmente misurabile, e k 2 non è nota Bisogna ricavare un equazione alternativa partendo dalla considerazione che la [ES] rimane costante nel tempo della reazione, e che la 1a tappa della reazione enzimatica raggiunge rapidamente lo STATO STAZIONARIO k 1 S + E ES k -1
15 COMPLESSIVAMENTE [ES] RIMANE COSTANTE NEL TEMPO La concentrazione dell enzima libero [E] in soluzione diminuisce man mano che aumenta la concentrazione del complesso [ES]. Ma poiché il complesso ES è demolito continuamente (in E + S o in E + P), l ENZIMA è di nuovo reso libero. STATO STAZIONARIO
16 [ES] rimane costante: la velocità della sua formazione è uguale alla velocità della sua demolizione Velocità di Formazione di ES (E + S ES): V = k 1 [E] [S] = k 1 ([E] TOT [ES]) [S] k 1 k 2 S + E ES k E + P -1 k -1 k 2 Velocità di Demolizione di ES (ES S + E..ES P + E): V = k -1 [ES] + k 2 [ES] [E] = [E] TOT [ES] poiché la concentrazione TOTALE di Enzima è [E] TOT = [E] + [ES] Se è raggiunto lo stato stazionario posso dire che: V formazione ES = V demolizione ES k 1 ([E] TOT [ES]) [S] = k -1 [ES] + k 2 [ES] Riarrangiando l equazione tramite operazioni algebriche si ottiene che: ([E] TOT [ES]) [S] = ( k -1 + k 2 ) k -1 + k 2 [ES] k 1 K m = k 1 Costante di Michaelis-Menten
17 K m = k -1 + k 2 k 1 Costante di Michaelis-Menten Il rapporto fra le costanti cinetiche della dissociazione di ES e quella della sua formazione è uguale alla COSTANTE DI DISSOCIAZIONE DEL COMPLESSO ES Semplificando i termini dell equazione precedente si ottiene che: Poiché la v 0 globale di reazione è : v 0 = k 2 [ES] e quindi: [ES] = v 0 / k 2 [ES] = [E] TOT [S] [S] + K m v 0 = k 2 [E] TOT [S] [S] + K m
18 v 0 = k 2 [E] TOT [S] [S] + K m k 2 [E] TOT = Vmax Introduciamo un altro parametro importante: la Velocità massima di reazione. Quando sono presenti nella miscela di reazione concentrazioni saturanti di substrato, allora, tutto l enzima è complessato col substrato e la [E] TOT = [ES] La velocità globale di reazione non dipende più dalla concentrazione di substrato, ma solo dalla concentrazione totale dell enzima: v 0 = k 2 [ES] diventa Vmax = k 2 [E] TOT v 0 = Vmax [S] [S] + K m EQUAZIONE DI MICHAELIS-MENTEN
19 v 0 (μm/min) Equazione di Michaelis-Menten v 0 = Vmax [S] Km + [S] La velocità iniziale della reazione enzimatica dipende dalla [S] in modo iperbolico ed è correlata alla Vmax (= k 2 [E] tot ) e alla Km Il valore della Km si può determinare sperimentalmente = Corrisponde alla [S] alla quale raggiungo la metà della Vmax. Ha le unità di misura di una concentrazione k 1 k 2 S + E ES E + P k -1 [S] (mm) v 0 = ½ Vmax = Vmax [S] [S] + Km 1 [S] = 2 [S] + Km Km + [S] = 2 [S] Km = [S] Solo se v 0 = ½ Vmax
20 Km = k -1 + k 2 k 1 (k 2 << k -1 = trascurabile) La Km è uguale alla costante di dissociazione del complesso ES Km = La Km fornisce informazioni sull affinità che un enzima ha nei confronti del suo substrato ed è SPECIFICA per ogni diverso enzima nei confronti di un dato substrato. Più è grande, minore sarà l affinità dell enzima per il substrato (maggiore sarà la costante di dissociazione del complesso ES, k -1 > k 1 ) Più è piccola maggiore sarà l affinità (minore la costante di dissociazione di ES, k 1 > k -1 ) Considerazioni valide per reazioni enzimatiche semplici a due tappe e in cui k 2 << k -1, non per tutti gli enzimi, molte reazioni enzimatiche sono a più tappe e la Km diventa una funzione più complessa che dipende da varie costanti cinetiche. k -1 k 1
21 La Km fornisce informazioni sulla efficienza della catalisi e sul controllo della velocità se [S] >> 10 Km concentrazioni saturanti di substrato, la reazione è molto efficiente perché quasi a Vmax, ma non controllabile variando la [S] se [S] << 0.1 Km concentrazioni bassissime di substrato, la reazione non è efficiente ma la si può controllare variando [S], poiché la v 0 aumenta all aumentare della [S]. [S] >> 10 Km Nelle cellule [S] Km la reazione ha velocità intermedia ed è regolabile variando [S] [S] << 0.1 Km Berg et al., BIOCHIMICA 6/E, Zanichelli editore S.p.A. Copyright 2007
22 v 0 (μm/min) 1 enzima 2 substrati simili A e B medesime condizioni di reazione Verso quale dei due l enzima è più affine? A A B ½ Vmax Km A Km B [S] mm
23 Costante catalitica o n di Turnover k 1 k 2 S + E ES E + P k -1 Vmax = k 2 [ES] = k 2 [E] TOT k Vmax 2 = [E] TOT k 2 per una reazione semplice ad uno stadio corrisponde alla k cat (costante catalitica) Indica il numero di eventi catalitici che avvengono nel sito attivo dell enzima nell unità di tempo (le sue unità di misura sono s -1 o min -1 ). Misura quanto velocemente un dato enzima può catalizzare una data reazione. E SPECIFICA per ogni enzima. Se lavoro con una miscela di reazione enzimatica in cui utilizzo una [S] saturante e voglio raddoppiare la velocità di reazione cosa devo modificare nella miscela di reazione? In che modo?
24 v 0 (μm/sec) A [S] saturante la v 0 raggiunge il suo valore massimo (Vmax), non può più variare in funzione della concentrazione di substrato, perché tutto l enzima presente è saturato. Se voglio aumentare la Velocità di reazione devo aggiungere altro enzima alla miscela di reazione. Vmax = k 2 [E] tot per raddoppiare la velocità di reazione (Vmax) devo raddoppiare la concentrazione dell enzima Vmax B = k 2 [E] B [E] B = 2 [E] A Vmax A = k 2 [E] A LA Km RIMANE INVARIATA Km [S] mm
25 EFFICIENZA CATALITICA DI UN ENZIMA Costante di specificità: k cat /Km (M -1 sec -1 ) Parametro che utilizziamo per confrontare l efficienza catalitica e la specificità di enzimi diversi per uno stesso substrato o di uno stesso enzima per substrati diversi. ENZIMA SUBSTRATO kcat (sec -1 ) Km (M) kcat/km (M -1 sec -1 ) Acetilcolinesterasi Acetilcolina 1.4x10 4 9x x10 8 Anidrasi carbonica CO 2 1x x x10 7 Anidrasi carbonica HCO 3-4x x x10 7 Catalasi H 2 O 1.4x10 4 9x x10 8 Fumarasi Fumarato 8x10 2 5x x10 8 Fumarasi Malato 9x x x10 7
26 In reazioni più complesse a più stadi: la k cat corrisponderà alla k 2 dello stadio limitante la velocità della reazione complessiva Oppure in situazioni più complesse sarà uguale alla combinazione di molte costanti di velocità diverse Es: reazione multistadio e multisubstrato a PING PONG Nelson Cox, I PRINCIPI DI BIOCHIMICA DI LEHNINGER, Zanichelli editore S.p.A. Copyright
27 1/v 0 min/μm Determinazione sperimentale di Km e Vmax per una reazione enzimatica: GRAFICO DEI DOPPI RECIPROCI (Eq. di Lineweaver-Burk) (linearizzazione della curva iperbolica) >>>> 1 Km 1 1 = + Vmax [S] Vmax I valori sperimentali di v 0 sono trasformati nei loro reciproci: 1/v 0 e i valori sperimentali di [S] nei corrispettivi reciproci 1/[S] v 0 La curva iperbolica del grafico di Micaelis- Menten diventa una retta che interseca gli assi in punti precisi consentendo di determinare con esattezza Km e Vmax, e quindi anche k cat 1/v 0 = 1/Vmax -1/Km [S] = 10 mm 0,1 Pendenza della retta = Km/Vmax 1/[S] mm -1 [S] = 1,0 mm 1,0
28 v 0 (μm/min) 1/v 0 min/μm 1/Vmax = 0,02-0,5 = -1/Km Vmax [S] = 10 mm 0,1 50 μm/min 1/[S] mm -1 [S] = 1,0 mm 1,0 Per calcolare la Vmax devo fare il reciproco del reciproco = 1 = 0,02 min/μm Vmax = 1 Vmax 0,02 min/ μm Vmax = 50 μm/min Per calcolare il valore della Km devo fare il reciproco negativo del reciproco = -1/Km = -0,5 mm -1 Km = - 1 = 2mM -0,5 mm -1 1 Km 1 1 v = 0 Vmax [S] + Vmax Vmax 2 v 0 = Vmax [S] Km + [S] 2,0 (Km) [S] mm
Ioni inorganici (Mg 2+, Zn 2+ ), o molecole organiche o metallorganiche (coenzimi)
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione -
 Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Il meccanismo d azione degli enzimi può essere trattato: -analizzando i cambiamenti energetici che si verificano nel corso della reazione - esaminando il modo in cui il sito attivo favorisce la catalisi
Prof. Maria Nicola GADALETA
 Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
Prof. Maria Nicola GADALETA E-mail: m.n.gadaleta@biologia.uniba.it Facoltà di Scienze Biotecnologiche Corso di Laurea in Biotecnologie Sanitarie e Farmaceutiche Biochimica e Tecnologie Biochimiche DISPENSA
CLASSIFICAZIONE O.T.I.L.Is. Lig
 GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
GLI ENZIMI CHE COSA SONO? Sono delle proteine altamente specializzate con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa. CLASSIFICAZIONE O.T.I.L.Is.
Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio
 Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
Cinetica enzimatica Cenni alla cinetica delle reazioni Velocita di reazione Reazioni di I e II ordine Molecolarita di una reazione t 1/2 Velocita e costanti di equilibrio OVVERO: CINETICA ENZIMATICA LO
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
REGOLAZIONE DELL ATTIVITA ENZIMATICA 1) MODULAZIONE ALLOSTERICA NON-COVALENTE (REVERSIBILE)
 REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
REGOLAZIONE DELL ATTIVITA ENZIMATICA - Regolazione a lungo termine: la quantità di enzima può essere controllata regolando la velocità della sua sintesi o degradazione (minuti o ore) - Regolazione a breve
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori.
 Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
1/v
 1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
INIBIZIONE ENZIMATICA REVERSIBILE
 INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
INIBIZIONE ENZIMATICA REVERSIBILE La reazione enzimatica in vitro o in vivo può essere INIBITA REVERSIBILMENTE. Un inibitore (I) legandosi all enzima interferisce con la sua attività modificando la Vmax,
Cinetica Chimica. Cinetica chimica
 Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
Cinetica Chimica CH 3 Cl + NaOH CH 3 OH + NaCl Le reazioni chimiche possono decorrere con cinetica molto veloce (come le reazioni di salificazione di un acido con una base) o lenta (come alcune reazioni
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Regolazione enzimatica Isoenzimi
 Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
Regolazione enzimatica Isoenzimi Gli enzimi regolatori nel metabolismo gruppi di enzimi lavorano insieme per produrre una via metabolica in cui il prodotto del primo enzima diventa il substrato del secondo
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
Cine%ca enzima%ca. Copyright 2013 Zanichelli editore S.p.A.
 Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
Cine%ca enzima%ca Copyright 2013 Zanichelli editore S.p.A. La cinetica delle reazioni Conce, chiave Le semplici equazioni di velocità descrivono il progredire delle reazioni di primo e di secondo ordine.
In questo caso parliamo di un processo entalpico. Si tratta di un processo entalpico.
 LEZIONE DEL 10/04/2017 ENZIMOLOGIA - APPLICAZIONI DELLA CINETICA ENZIMATICA Essa trova applicazioni nel processamento dei rifiuti, nelle materie organiche. Si tratta dell'ingegnerizzazione dei processi
LEZIONE DEL 10/04/2017 ENZIMOLOGIA - APPLICAZIONI DELLA CINETICA ENZIMATICA Essa trova applicazioni nel processamento dei rifiuti, nelle materie organiche. Si tratta dell'ingegnerizzazione dei processi
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione.
 Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Gli enzimi. Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici
 Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Gli enzimi Gli enzimi sono le proteine 1 che catalizzano 2 le reazioni chimiche che avvengono nei sistemi biologici 1 con l eccezione dei ribozimi (RNA catalitici) 2 un catalizzatore è una sostanza che
Velocità di reazione
 1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
1 Velocità di reazione A B V = - d[a] dt = d[b] dt V= Velocità istantanea: coefficiente angolare della retta tangente alla curva in quel punto Quando t=0 la velocità istantanea sarà massima (V 0 ) 2 Energia
La via per accelerare i processi biologici
 La via per accelerare i processi biologici ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa.
La via per accelerare i processi biologici ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa.
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA
 TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
IL GRUPPO EME. PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici.
 IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
IL GRUPPO EME PROTOPORFIRINA IX: struttura organica ad anello costituita da 4 anelli pirrolici uniti da ponti metinici. L inserimento di un atomo di ferro nello stato di ossidazione ferroso (Fe 2+ ) determina
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Lezione n. 11. Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T. Antonino Polimeno 1
 Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Chimica Fisica Biotecnologie sanitarie Lezione n. 11 Reazioni enzimatiche Michaelis-Menten Dipendenza di k da T Antonino Polimeno 1 senza catalizzatore... con catalizzatore... Antonino Polimeno 2 Catalisi
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
Per la stessa reazione possono essere utilizzati catalizzatori diversi. es. HCOOH H 2 + CO 2 viene catalizzata da Ni, Cd, Pt, Cu.
 CATALISI L'uso di un catalizzatore, sostanza capace di accelerare una reazione senza intervenire sulla T, è di enorme importanza in alcuni tipi di reazione. Ad esempio le proteine reagiscono velocemente
CATALISI L'uso di un catalizzatore, sostanza capace di accelerare una reazione senza intervenire sulla T, è di enorme importanza in alcuni tipi di reazione. Ad esempio le proteine reagiscono velocemente
ENZIMI Alcuni sono costituiti solo da a.a. Altri richiedono per la loro attività catalitica la presenza di COFATTORI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Esistono reazioni energeticamente favorite (ΔH<0) che non avvengono.es. C(diamante) à C(grafite)
 CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
CINETICA CHIMICA Esistono reazioni energeticamente favorite (ΔH
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
La cinetica chimica. Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento)
 La cinetica chimica Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento) omogenee Reazioni eterogenee Termodinamica: permette di prevedere
La cinetica chimica Si occupa dello studio dei meccanismi di reazione con i quali i reagenti si trasformano in prodotti (kinesis = movimento) omogenee Reazioni eterogenee Termodinamica: permette di prevedere
Reazione di Briggs Rauscher
 Cinetica chimica 1 Reazione di Briggs Rauscher a) Come varia nel tempo la composizione chimica di un sistema? b) Qual è il meccanismo secondo cui avviene una reazione chimica? c) Come è possibile modificare
Cinetica chimica 1 Reazione di Briggs Rauscher a) Come varia nel tempo la composizione chimica di un sistema? b) Qual è il meccanismo secondo cui avviene una reazione chimica? c) Come è possibile modificare
Inibizione Enzimatica
 Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine:
 La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
La struttura di una proteina e ruolo biologico da essa svolto sono strettamente connessi. Alcune funzioni biologiche delle proteine: Catalizzatori = Enzimi Accumulo e trasporto di ossigeno = mioglobina
Cinetica chimica. Capitolo 13
 Cinetica chimica Capitolo 13 Cinetica chimica Termodinamica si verifica la reazione? Cinetica con che velocità si verifica la reazione? Velocità di reazione è la variazione di concentrazione di un reagente
Cinetica chimica Capitolo 13 Cinetica chimica Termodinamica si verifica la reazione? Cinetica con che velocità si verifica la reazione? Velocità di reazione è la variazione di concentrazione di un reagente
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
SOLUZIONI derivate da: Acido debole/ sale (CH 3 COOH/CH 3 COONa) Base debole/ suo sale (NH 4 OH/NH 4 Cl)
 Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
Soluzioni Tampone Si definiscono soluzioni tampone quelle soluzioni in grado di mantenere pressoché costante il proprio ph per aggiunta di una ragionevole quantità di acido o di base forte o per moderata
Appendice cap. 29: applicazioni
 2 Analisi chimica strumentale Appendice cap. 29: applicazioni Per una reazione del 1 ordine, l equazione differenziale, ovvero la forma differenziale della legge cinetica, assume la forma d[a]/dt = k [A]
2 Analisi chimica strumentale Appendice cap. 29: applicazioni Per una reazione del 1 ordine, l equazione differenziale, ovvero la forma differenziale della legge cinetica, assume la forma d[a]/dt = k [A]
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
CINETICA CHIMICA. Ogni reazione chimica però impiega un certo tempo per raggiungere le condizioni di equilibrio.
 Facendo reagire delle sostanze si arriva ad uno stato di equilibrio in cui le concentrazioni di reagenti e prodotto rispettano la legge di equilibrio chimico, definita da una costante di equilibrio. Ogni
Facendo reagire delle sostanze si arriva ad uno stato di equilibrio in cui le concentrazioni di reagenti e prodotto rispettano la legge di equilibrio chimico, definita da una costante di equilibrio. Ogni
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
INTRODUZIONE ALLA BIOCHIMICA
 INTRODUZIONE ALLA BIOCHIMICA Sistema vivente sistema complesso ed altamente organizzato dotato di una composizione chimica determinata e unica grazie a tale composizione chimica al suo interno si formano
INTRODUZIONE ALLA BIOCHIMICA Sistema vivente sistema complesso ed altamente organizzato dotato di una composizione chimica determinata e unica grazie a tale composizione chimica al suo interno si formano
Analisi quantitativa dell interazione proteina-proteina
 Analisi quantitativa dell interazione proteina-proteina Legame recettore-ligando (proteina-proteina) Il legame per il ligando deve essere: reversibile ad alta affinità saturabile deve portare ad una risposta
Analisi quantitativa dell interazione proteina-proteina Legame recettore-ligando (proteina-proteina) Il legame per il ligando deve essere: reversibile ad alta affinità saturabile deve portare ad una risposta
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
Enzimi: catalizzatori biologici
 Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
Enzimi: catalizzatori biologici praticamente tutte le reazioni biochimiche della chimica della vita sono catalizzate da enzimi gli enzimi sono proteine la velocità di reazioni enzimatiche è aumentata di
GLICOLISI ADP ATP. Condizioni aerobiche. Condizioni anaerobiche ATP
 GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA.
 CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA FACOLTA DI MEDICINA E CHIRURGIA. IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA. Un enzima è una proteina capace di catalizzare una specifica reazione
CORSO DI CHIMICA E PROPEDEUTICA BIOCHIMICA FACOLTA DI MEDICINA E CHIRURGIA. IL MODELLO DI MICHAELIS E MENTEN PER LA CINETICA ENZIMATICA. Un enzima è una proteina capace di catalizzare una specifica reazione
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
BIOLOGIA GENERALE 19 dicembre 2006
 Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
Biologia generale Massolo Alessandro massolo@unifi.it; Tel. 347-9403330 BIOLOGIA GENERALE 19 dicembre 2006 Facoltà di Psicologia Corso di Laurea in Scienze e Tecniche di Psicologia Generale e Sperimentale
ESERCIZI ESERCIZI. 3) Data la reazione chimica: H 2
 ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
ESERCIZI 1) La velocità di una reazione chimica dipende: a. solo dalla temperatura b. solo dalla pressione c. dal fatto che la reazione sia eso- o endotermica d. dalla temperatura, dalle concentrazioni
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe.
 INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro.
 Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Cos è n? po n 2 Y= n n p50 + po 2 Coefficiente di Hill ( n o n H ) = quanto i siti di legame per l O 2 sono cooperativi tra di loro. Per l Hb non è mai uguale al numero dei siti per l O 2, Le diverse emoproteine
Cinetica chimica. 2 H 2 (g) + O 2 (g) 2 H 2 O (g)
 Cinetica chimica 2 H 2 (g) + O 2 (g) 2 H 2 O (g) Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione La cinetica chimica A differenza della termodinamica
Cinetica chimica 2 H 2 (g) + O 2 (g) 2 H 2 O (g) Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007, III edizione La cinetica chimica A differenza della termodinamica
Esempi di funzioni svolte dalle proteine
 Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Esempi di funzioni svolte dalle proteine Trasporto di sostanze Esempi di funzioni svolte dalle proteine Trasporto di sostanze Funzioni strutturali Esempi di funzioni svolte dalle proteine Trasporto di
Funzioni dei nucleotidi
 Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
Funzioni dei nucleotidi monomeri degli acidi nucleici esempi di altre funzioni ATP: moneta energetica GTP: fonte di energia nella sintesi proteica camp: secondo messaggero nella trasduzione del segnale
ECONOMIA APPLICATA ALL INGEGNERIA (Docente: Prof. Ing. Donato Morea)
 ESERCIZIO n. 1 - La produzione ed i costi di produzione (1 ) Un impresa utilizza una tecnologia descritta dalla seguente funzione di produzione: I prezzi dei fattori lavoro e capitale sono, rispettivamente,
ESERCIZIO n. 1 - La produzione ed i costi di produzione (1 ) Un impresa utilizza una tecnologia descritta dalla seguente funzione di produzione: I prezzi dei fattori lavoro e capitale sono, rispettivamente,
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia. a.a
 Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia a.a. 2016-17 Cinetica Chimica studia i fenomeni connessi con la VELOCITA di una REAZIONE Reazioni
Precorsi Test AMMISSIONE Medicina e Chirurgia - Professioni Sanitarie Università degli Studi di Perugia a.a. 2016-17 Cinetica Chimica studia i fenomeni connessi con la VELOCITA di una REAZIONE Reazioni
I catalizzatori della cellula: gli ENZIMI
 I catalizzatori della cellula: gli ENZIMI LA CATALISI ENZIMATICA E NECESSARIA PER PERMETTERE A MOLTE REAZIONI BIOCHIMICHE DI PROCEDERE AD UNA VELOCITA CONVENIENTE IN CONDIZIONI BIOLOGICHE UNA REAZIONE
I catalizzatori della cellula: gli ENZIMI LA CATALISI ENZIMATICA E NECESSARIA PER PERMETTERE A MOLTE REAZIONI BIOCHIMICHE DI PROCEDERE AD UNA VELOCITA CONVENIENTE IN CONDIZIONI BIOLOGICHE UNA REAZIONE
Catalisi. Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A Modulo di Biologia Strutturale
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Reazioni opposte. Reazioni opposte o reversibili A + B 2C (k 1 e k -1 )
 Reazioni complesse Reazioni opposte o reversibili A B ( e - ) Reazioni consecutive A B C ( e ) Reazioni competitive o parallele A B ( ) A C ( ) Reazioni opposte Reazioni opposte o reversibili A + B C (
Reazioni complesse Reazioni opposte o reversibili A B ( e - ) Reazioni consecutive A B C ( e ) Reazioni competitive o parallele A B ( ) A C ( ) Reazioni opposte Reazioni opposte o reversibili A + B C (
ISIS A PONTI Gallarate
 4 A TCB 1 IL CROMATOGRAMMA: E il tracciato che descrive l andamento del segnale del rivelatore in funzione del tempo o del volume di eluente a partire dall istante in cui la miscela viene introdotta nella
4 A TCB 1 IL CROMATOGRAMMA: E il tracciato che descrive l andamento del segnale del rivelatore in funzione del tempo o del volume di eluente a partire dall istante in cui la miscela viene introdotta nella
2015 /2016. scaricato da
 Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
Enzimi Prof Spina Riabilitativa 2015 /2016 Gli enzimi i sono catalizzatori t i biologici i i molto efficienti: i caratterizzati da potere catalitico e specificità, possegono una porzione dedicata: il
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Le reazioni chimiche. Lezioni d'autore di Giorgio Benedetti
 Le reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO VIDEO Introduzione (I) La cinetica chimica è la branca della chimica che si interessa della velocità delle reazioni chimiche, cioè la variazione
Le reazioni chimiche Lezioni d'autore di Giorgio Benedetti VIDEO VIDEO Introduzione (I) La cinetica chimica è la branca della chimica che si interessa della velocità delle reazioni chimiche, cioè la variazione
PRINCIPI ELEMENTARI DI ENZIMOLOGIA A. Bellelli, Dipartimento di Scienze Biochimiche A. Rossi Fanelli, Università di Roma Sapienza
 PRINCIPI ELEMENTARI DI ENZIMOLOGIA A. Bellelli, Dipartimento di Scienze Biochimiche A. Rossi Fanelli, Università di Roma Sapienza Come tutti sanno, gli enzimi sono proteine semplici o coniugate capaci
PRINCIPI ELEMENTARI DI ENZIMOLOGIA A. Bellelli, Dipartimento di Scienze Biochimiche A. Rossi Fanelli, Università di Roma Sapienza Come tutti sanno, gli enzimi sono proteine semplici o coniugate capaci
Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A
 1 Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A. 2006.2007 La cinetica delle reazioni chimiche Studiare una reazione dal punto di vista cinetico significa
1 Università degli Studi Mediterranea di Reggio Calabria Facoltà di Agraria Sez. Lamezia Terme A.A. 2006.2007 La cinetica delle reazioni chimiche Studiare una reazione dal punto di vista cinetico significa
VELOCITA E MECCANISMI DI REAZIONE: LA CINETICA 10.A PRE-REQUISITI 10.V VERIFICA SE HAI CAPITO 10.B PRE-TEST ESERCIZI 10.
 VELOCITA E MECCANISMI DI REAZIONE: LA CINETICA 10.A PRE-REQUISITI 10.B PRE-TEST 10.C OBIETTIVI 10.3.2 CATALISI ETEROGENEA 10.3.3 CATALISI ENZIMATICA 10.V VERIFICA SE HAI CAPITO ESERCIZI 10.1 LA VELOCITA
VELOCITA E MECCANISMI DI REAZIONE: LA CINETICA 10.A PRE-REQUISITI 10.B PRE-TEST 10.C OBIETTIVI 10.3.2 CATALISI ETEROGENEA 10.3.3 CATALISI ENZIMATICA 10.V VERIFICA SE HAI CAPITO ESERCIZI 10.1 LA VELOCITA
Enzimi. 1. Definizione 2. Numero di Turn-over 3. Nomenclatura 4. Cofattori 5. Sito attivo
 Enzimi 1. Definizione 2. Numero di Turn-over 3. Nomenclatura 4. Cofattori 5. Sito attivo 6. Specificità o Modello di Fischer (chiave-serratura) o Modello dell adattamento indotto 7. Cinetica enzimatica
Enzimi 1. Definizione 2. Numero di Turn-over 3. Nomenclatura 4. Cofattori 5. Sito attivo 6. Specificità o Modello di Fischer (chiave-serratura) o Modello dell adattamento indotto 7. Cinetica enzimatica
Il trasporto del glucosio
 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Corso di Chimica e Propedeutica Biochimica Cinetica chimica ed enzimatica
 Corso di Chimica e Propedeutica Biochimica Cinetica chimica ed enzimatica 2 H 2 (g) + 2 (g) 2 H 2 (g) 1 Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007,
Corso di Chimica e Propedeutica Biochimica Cinetica chimica ed enzimatica 2 H 2 (g) + 2 (g) 2 H 2 (g) 1 Alcune immagini sono state prese e modificate da Chimica di Kotz, Treichel & Weaver, Edises 2007,
Velocità di reazione Una trasformazione chimica modifica completamente la natura delle sostanze iniziali ( i reagenti), formando altre specie (i prodo
 Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
Termodinamica ENTALPIA...6
 Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
Termodinamica ORGANISMI PRIMO VIVENTI ED ENERGIA...2 PRINCIPIO DELLA TERMODINAMICA...5 ENTALPIA...6 SECONDO PRINCIPIO DELLA TERMODINAMICA... 7 energia libera di Gibbs (G)...9 Variazione di energia libera
La catalisi enzimatica. Copyright 2013 Zanichelli editore S.p.A.
 La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
La catalisi enzimatica Copyright 2013 Zanichelli editore S.p.A. Le proprietà generali degli enzimi Concetti chiave Gli enzimi si differenziano dai catalizzatori chimici di uso comune per velocità, condizioni,
Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà.
 TEORIE ACIDO-BASE Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà. Teoria di Arrhenius Arrhenius fu il primo a
TEORIE ACIDO-BASE Acidi e basi sono sostanze note da molto tempo e diverse classificazioni sono state fatte nel corso del tempo in base alle loro proprietà. Teoria di Arrhenius Arrhenius fu il primo a
Applicazioni biotecnologiche degli enzimi: le lipasi
 Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Applicazioni biotecnologiche degli enzimi: le lipasi Le lipasi Catalizzano l idrolisi e la sintesi di acilgliceroli Sono stabili in solventi organici Non richiedono cofattori Hanno bassa specificità di
Case study. viene espressa in unità µmol per ora per grammo di peso secco.
 Vengono studiate due specie diverse (ma dello stesso genere) di piante di interesse agronomico. In particolare, i ricercatori vogliono misurare la capacità dell'apparato radicale di tali piante di assorbire
Vengono studiate due specie diverse (ma dello stesso genere) di piante di interesse agronomico. In particolare, i ricercatori vogliono misurare la capacità dell'apparato radicale di tali piante di assorbire
Energia di attivazione
 Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M
![ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M ε 340 nm A 260 nm A 260nm = 1.36 A 340 nm = A 340nm A = c [NADH] = : 6.22 x 10 3 = x 10-6 M](/thumbs/59/43508258.jpg) ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
ESERCIZI 2 Esercizio n.1 Trovare la concentrazione di NAD e NADH in una soluzione miscelata basandosi sui seguenti dati ottenuti in una cuvetta da 1 cm : I coefficienti di estinzione molare a 260 nm sono
CHIMICA BIOLOGICA. Seconda Università degli Studi di Napoli. DiSTABiF. Corso di Laurea in SCIENZE BIOLOGICHE. Insegnamento di. Anno Accademico
 Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-17 Lezione 8 Esseri viventi Catalizzano reazioni
Seconda Università degli Studi di Napoli DiSTABiF Corso di Laurea in SCIENZE BIOLOGICHE Insegnamento di CHIMICA BIOLOGICA Antimo Di Maro Anno Accademico 2016-17 Lezione 8 Esseri viventi Catalizzano reazioni
Fondamenti di Chimica Farmaceutica. Recettori come bersagli dei farmaci
 Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
GLICOLISI ADP ATP. Condizioni aerobiche. Condizioni anaerobiche ATP
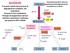 GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
GLICOLISI È la parte iniziale del processo di degradazione ossidativa dei carboidrati. Durante la loro ossidazione l energia immagazzinata nel loro scheletro carbonioso è utilizzata per produrre ATP e
Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica
 Brevetti Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Committente:
Brevetti Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Depuratore Biologico anaerobica con produzione di metano (CH4) da decomposizione organica Committente:
Attività sperimentale da laboratorio sul ciclo CaO-CaCO3 per la cattura della CO2 ad alta temperatura
 COPERTINA DEF2009-26.RdS:Layout 1 19-06-2009 12:25 Pagina 1 Attività sperimentale da laboratorio sul ciclo CaO-CaCO3 per la cattura della CO2 ad alta temperatura A. Calabrò, S. Stendardo Report RSE/2009/26
COPERTINA DEF2009-26.RdS:Layout 1 19-06-2009 12:25 Pagina 1 Attività sperimentale da laboratorio sul ciclo CaO-CaCO3 per la cattura della CO2 ad alta temperatura A. Calabrò, S. Stendardo Report RSE/2009/26
Il metabolismo: concetti di base
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Il metabolismo: concetti di base Caratteristiche generali Strategie Trofiche Il metabolismo:
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Il metabolismo: concetti di base Caratteristiche generali Strategie Trofiche Il metabolismo:
CINETICA ENZIMATICA: DETERMINAZIONE DELLA V M E DELLA K M DELL ENZIMA SACCARASI
 CINETICA ENZIMATICA: DETERMINAZIONE DELLA M E DELLA K M DELL ENZIMA SACCARASI PRINCIPI TEORICI Le reazioni che avvengono nelle cellule sono le stesse che avvengono in laboratorio, ciò che le differenzia
CINETICA ENZIMATICA: DETERMINAZIONE DELLA M E DELLA K M DELL ENZIMA SACCARASI PRINCIPI TEORICI Le reazioni che avvengono nelle cellule sono le stesse che avvengono in laboratorio, ciò che le differenzia
Schema a blocchi di uno spettrofluorimetro
 MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
MONOCROMATORE EMISSIONE EM Schema a blocchi di uno spettrofluorimetro MONOCROMATORE ECCITAZIONE SORGENTE EXC RIVELATORE (TUBO FOTOMOLTIPLICATORE) Anche il DNA assorbe nell UV Cosa determina l assorbanza
relazioni tra il calore e le altre forme di energia.
 Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Termodinamica i Termodinamica: ramo della scienza che studia le relazioni tra il calore e le altre forme di energia. Sistema e ambiente sistema: zona dello spazio all interno della quale studiamo i fenomeni
Amminoacidi/peptidi/proteine. Chimica Organica II
 Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
Amminoacidi/peptidi/proteine Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II Amminoacidi Chimica Organica II II Amminoacidi: chiralità
