Enzimi. 1. Definizione 2. Numero di Turn-over 3. Nomenclatura 4. Cofattori 5. Sito attivo
|
|
|
- Sibilla Fumagalli
- 6 anni fa
- Visualizzazioni
Transcript
1 Enzimi 1. Definizione 2. Numero di Turn-over 3. Nomenclatura 4. Cofattori 5. Sito attivo 6. Specificità o Modello di Fischer (chiave-serratura) o Modello dell adattamento indotto 7. Cinetica enzimatica o Equazione di Michaelis-Menten o Interpretazione grafica o Calcolo dei parametri cinetici con il metodo dei doppi reciproci 8. Fattori che determinano la velocità di reazione 9. Inibizione enzimatica o Reversibile competitiva o Reversibile non competitiva o Irreversibile 10. Controllo dei processi metabolici o Enzimi allosterici o Meccanismo concertato di Monod-Wyman-Changeux (MWC) o Meccanismo sequenziale di Koshland-Nemethy-Filmer (KNF) o Inibizione retroattiva (feed-back) o La regolazione allosterica dell emoglobina MARCO BONECHI
2 1. Definizione Gli enzimi sono catalizzatori biologici che consentono alle reazioni che avvengono nelle cellule viventi di procedere con sufficiente velocità nelle condizioni di vita proprie di un organismo. Dal punto di vista organico essi sono proteine globulari (macroproteine) prodotte dall organismo e presenti in quantità minime all interno delle cellule. Essendo dei catalizzatori, gli enzimi diminuiscono l energia di attivazione della reazione come è possibile dedurre dai seguenti grafici : R = reagenti, P = prodotti, E = enzima, Ea = energia di attivazione della reazione È opportuno ricordare che il catalizzatore risulta essere immutato al termine della reazione e quindi può essere usato nuovamente, inoltre esso non modifica le concentrazione dei reagenti e dei prodotti in una reazione di equilibrio ma aumenta soltanto la velocità di reazione. Rispetto ai catalizzatori inorganici, i catalizzatori biochimici sono altamente specifici e si attivano soltanto in determinate condizioni. Per esempio il glutammato di sodio (che essendo un carboidrato si riscontra in due forme, destrosa e sinestrosa) viene usato come sostanza sapida nei dadi da cucina, la cosa curiosa è che solo la forma sinestrosa ha effetto sulle nostre papille gustative. 2. Numero di Turn-over Il numero di Turn-over rappresenta la capacità di una molecola di enzima di trasformare n molecole di reagenti in un secondo.
3 Come abbiamo visto gli enzimi diminuiscono notevolmente l energia di attivazione, quindi il numero di molecole di reagenti che vengono trasformate in prodotti è notevolmente maggiore se la reazione biochimica è catalizzata da un enzima. Un esempio è fornito dall enzima anidrasi carbonica che aumenta di sette ordini di grandezza la velocità col quale l anidride carbonica viene trasformata in acido carbonico, ciò permette che il tampone H 2 CO 3 /HCO 3 - (acido carbonico/ idrogeno carbonato) mantenga il valore del ph del sangue tra 7,1 e 7,5. 3. Nomenclatura Il termine enzima proviene dal greco e letteralmente significa nei lieviti. Inizialmente furono usati nomi di fantasia per denominare i vari tipi di enzimi, oggi si è soliti usare il nome del substrato su cui agisce l enzima, seguito dalla desinenza asi (es. amilasi, ureasi, esterasi ecc.). Nel 1961 la Commissione Internazionale sugli Enzimi propose un metodo generale di nomenclatura, secondo il quale gli enzimi sono suddivisi in sei classi secondo la tipologia della reazione che catalizzano. Gli enzimi si suddividono in: 1. Ossido-riduttasi: catalizzano le reazioni di ossidoriduzione (redox) 2. Transferasi: catalizzano il trasferimento di gruppi funzionali. 3. Idrolasi: catalizzano le reazioni di idrolisi. 4. Liasi: (da Liason, che in francese significa legame) catalizzano le reazioni ove avviene una rottura di un legame, tali reazioni non devono essere né idrolisi né redox. 5. Isomerasi: catalizzano la formazione di isomeri. 6. Ligasi: catalizzano la formazione di un legame fra due molecole, a spese dell energia fornita dal legame pirofosforico di una molecola di ATP, in parole più semplici possiamo affermare che operano reazioni di condensazione in cui si libera una molecola di ATP. 4. Cofattori Alcuni enzimi possiedono la facoltà di reagire tal quali, sono immediatamente attivi e funzionanti come nel caso del lisozima, l enzima contenuto nelle lacrime che è capace di idrolizzare il legame glicosidico della parte polisaccaride delle pareti cellulari è quindi capace di rompere le membrane cellulari batteriche e svolgere una funzione disinfettante. Molti enzimi per svolgere l azione catalitica richiedono la presenza di alcuni gruppi, non proteici che hanno basso peso molecolare, detti cofattori o attivatori. Il complesso enzima-cofattore viene definito oloenzima, mentre se si rimuove il cofattore rimane l apoenzima inattivo. In altri termini possiamo affermare che cofattore e apoenzima costituiscono la proteina coniugata, denominata oloenzima.
4 I cofattori possono essere: Ioni inorganici (cationi metallici, specialmente dei metalli alcalino terrosi, come: K +, Na +, Zn 2+, Mg 2+, Ca 2+, Fe 2+ ), si ricordi il magnesio che attiva i processi neurologici e produce una maggiore attenzione nell individuo. Molecole organiche denominate anche coenzimi. Queste agiscono comunemente come trasportatori di atomi o di gruppi funzionali specifici. Alcuni esempi sono: nicotinammideadenin-dinucleotide NAD +, nicotinammide-adenin-dinucleotidefosfato NADP +, flavinadenin-dinucleotide FAD, che funzionano come accettatori e trasportatori di atomi di idrogeno. L adenosin-trifosfato è invece coinvolto nel trasferimento di gruppi fosforici, l ultimo esempio è l acetilcoenzima A. Nel nostro organismo sono presenti circa quindicimila apoenzimi e soltanto poche decine di cofattori, quindi è facile intuire che un cofattore attivi più tipi di enzimi. 5. Sito attivo Il peso molecolare del substrato è in genere molto inferiore rispetto a quello dell enzima (che può arrivare a misurare anche migliaia di Dalton). Ciò ci suggerisce che le dimensioni della molecola enzimatica siano molto superiori rispetto a quelle del substrato su cui essa agisce quindi solo alcune piccole regioni dell enzima sono responsabili della catalisi, queste vengono denominate siti attivi o siti catalitici. Tali siti sono una sorta di ripiegatura o tasca, causata dalla struttura terziaria della proteina enzimatica. La rappresentazione sottostante mostra come nel sito attivo si trovino gruppi polari ossidrilici, sulfidrilici, amminici, carbossilici, in generale gruppi capaci di formare legami ponte idrogeno. Agli estremi del sito attivo sono presenti gruppi apolari così che l acqua possa essere facilmente espulsa da questo e si crei una maggiore concentrazione del substrato. La maggior parte della molecola proteica non entra in contatto con il substrato, ma essa ha comunque un ruolo fondamentale in quanto costituisce l impalcatura adatta a favorire il corretto posizionamento del substrato nel sito attivo.
5 6. Specificità Abbiamo visto come gli enzimi siano altamente specifici, cioè riconoscono un solo substrato o un gruppo ristretto di substrati simili tra loro (come nel caso dell esochinasi, un enzima capace di riconoscere tutti gli zuccheri di tipo D). Ci sono due teorie che spiegano come avviene il riconoscimento fra l enzima e il substrato: Modello di Fischer o chiave serratura, secondo il quale l enzima ha una configurazione rigida che si adatta perfettamente al substrato Modello dell adattamento indotto, secondo il quale mentre il substrato si avvicina, modifica l enzima così che i due possano impaccarsi. 7. Cinetica enzimatica L enzima esochinasi è un esempio del modello dell adattamento indotto, quando il glucosio si avvicina al sito attivo (immagine di sinistra) l enzima cambia conformazione avvolgendosi attorno al substrato (destra).
6 7. Cinetica di reazione La cinetica enzimatica si occupa di sviluppare delle equazioni che descrivano la velocità delle reazioni catalizzate e confrontare le previsioni con i valori ottenuti sperimentalmente. Per poter fare previsioni occorre capire come agisce un enzima, il modello attualmente in uso è il seguente: l enzima (E) si lega con il substrato (S) formando un complesso intermedio enzima-substrato (E-S), successivamente il substrato si trasforma in prodotto (P) e l enzima viene rilasciato intatto capace di catalizzare un altro substrato. Per tale relazione è opportuno fare delle considerazioni: 1. Con K 1 si indica la costante della reazione diretta che porta alla formazione di ES 2. Con K -1 si indica la costante della reazione inversa alla precedente che da ES riforma il substrato e l enzima 3. K 2 indica costante della reazione che porta alla formazione del prodotto e dell enzima inalterato. A differenza della precedente tale reazione avviene in un verso solo 4. La concentrazione del complesso enzima-substrato [ES] rimane costante nel tempo, questo concetto è definito stato stazionario. Nel 1913 due ricercatori, L. Michaelis e M. Menten hanno formulato un equazione sulla dipendenza della velocità di reazione dalla concentrazione del substrato : Per dimostrare come si ricava questa equazione occorre ricordare alcuni concetti di cinetica: La reazione diretta per la formazione di [ES] è una reazione del secondo ordine, la cui velocità si calcola quindi come: V = K 1 [E] [S] La reazione inversa è del primo ordine, quindi la sua velocità è calcolata come: V = K -1 [ES] La reazione per la formazione del prodotto è di primo ordine e la sua velocità è calcolata come: V = K 2 [ES] Dato che la concentrazione del complesso attivato è costante nel tempo, la velocità con cui esso si forma deve essere uguale alla velocità col quale esso si decompone, avremo quindi : K 1 [E] [S] = K -1 [ES] + K 2 [ES]
7 Raccogliendo [ES] al secondo membro otteniamo : K 1 [E] [S] = [ES] ( K- 1 + K 2 ) Indicando con [E 0 ] la concentrazione totale dell enzima possiamo scrivere: [E 0 ] = [E] + [ES] da cui [E] = [E 0 ] [ES] Ed impostare un sistema con la precedente equazione, sostituendo [E] otteniamo: K 1 ([E 0 ] [ES]) [S] = [ES] ( K- 1 + K 2 ) svolgiamo i prodotti: K 1 [E 0 ] [S] - K 1 [ES] [S] = [ES] ( K- 1 + K 2 ) K 1 [E 0 ] [S] = K 1 [ES] [S] + [ES] ( K- 1 + K 2 ) raccogliamo [ES] al secondo membro K 1 [E 0 ] [S] = [ES] ( K 1 [S] + K- 1 + K 2 ) quindi ricaviamo [ES] Ricordando che la velocità di formazione del prodotto era: V = K 2 [ES] sostituiamo, dividiamo entrambi i membri per K 1 Il termine è chiamato costante di Michaelis-Menten e si indica con KM, tale fattore ingloba tutti e tre le costanti della reazione. Dato che, una volta raggiunto lo stato stazionario il valore della velocità massima, V max è dato dal prodotto V max = K 2 [E 0 ], l equazione di Michaelis-Menten può anche essere espressa nella forma alternativa:
8 Interpretazione grafica Sperimentalmente si ottiene un grafico di questo tipo: Si verifica che quando la concentrazione del substrato è uguale al valore di KM allora il valore della velocità è uguale alla metà della velocità massima. Riepilogando: [S] = KM V = Vmax / 2 La costante di Michaelis-Menten è una grandezza caratteristica di ogni enzima. Essa è un termine che indica l affinità tra un enzima e il suo substrato, in quanto più basso è il valore di KM e più bassa sarà la concentrazione di substrato necessaria per raggiungere una velocità di reazione pari alla metà della velocità massima. Quindi quando KM è un valore basso significa che l enzima mostra un elevata affinità per il substrato, al contrario se KM è un valore alto l enzima possiede poca affinità per il substrato e per raggiungere la velocità massima servirà un elevata concentrazione di substrato. Dal grafico risultano evidenti le seguenti considerazioni: Per basse concentrazioni di substrato notiamo che la retta ha tendenza lineare, la velocità è proporzionale alla concentrazione del substrato, quindi la reazione è praticamente del primo ordine. Per alte concentrazioni di substrato la velocità non tende all infinito, ma assume un valore massimo, oltre quel valore anche se aumentiamo [S] non aumenta la velocità. Si dice che l enzima è saturato, non ci sono più molecole di enzima disponibili e quindi la velocità diventa un valore costante. Una tale cinetica di reazione è di ordine zero e in questo caso risulta Vmax = K 2. Calcolo dei parametri cinetici con il metodo dei doppi reciproci Dal grafico di Michaelis-Menten non è facile calcolare la velocità massima perché ad alte concentrazioni di substrato essa assume un comportamento asintotico, per ovviare al problema Lineweaver e Burk hanno istituito un metodo chiamato dei doppi reciproci che permette di linearizzare l equazione, calcolando semplicemente i reciproci.
9 ne calcoliamo il reciproco = Ponendo 1/V = y 1/Vmax = q e 1/[S] = x otteniamo y= mx + q che è l equazione di una retta, dove m che è il coefficiente angolare corrisponde a KM/Vmax. Dal grafico ricaviamo alcuni punti significativi: 8. Fattori che determinano la velocità di reazione La velocità di reazione non dipende soltanto dalla concentrazione del substrato e dal valore delle costanti, come descritto nell equazione di Michaelis-Menten, ci sono molteplici fattori e parametri che possono modificarla. ph Ogni enzima è stabile e lavora in modo ottimale per un determinato valore di ph, a quel valore si ottiene la velocità massima. Se questo valore si allontana dal ph ottimale di funzionamento la velocità decresce e l enzima può addirittura denaturarsi. Occorre infatti ricordare che gli enzimi sono costituiti da proteine, le quali sono una sequenza di amminoacidi, una variazione di ph provoca un cambiamento dei gruppi legati agli amminoacidi, gruppi come -NH 3 +, -COO -, -SH si possono protonare o deprotonare, cambiando le attrazioni elettrostatiche che tengono unita la proteina globulare e quindi cambiano la forme della proteina
10 stessa. Per cui avremmo che il sito attivo può essere più o meno grande rispetto alle condizioni ottimali, quindi meno adatto a impaccarsi col substrato. Inoltre un cambiamento del ph può provocare anche un cambiamento dei gruppi acidi o basici presenti nella molecola del substrato che quindi non è più adatta a formare il complesso attivato con l enzima. Modificazione del sito attivo al variare del ph Il valore del ph ottimale di funzionamento dell enzima carbossipeptidasi è 7,5. Temperatura Una reazione enzimatica è influenzata dalla temperatura come ogni reazione chimica, infatti la costante di reazione è direttamente proporzionale alla temperatura secondo la legge di Arrehenius: Dove: A, è un fattore pre-esponenziale, una costante numerica specifica per ogni reazione e, è il numero di nepero Ea, è l energia di attivazione R, è la costante dei gas T, è la temperatura espressa in Kelvin. Se tuttavia cercassimo di aumentare la velocità di una reazione enzimatica aumentando la temperatura, l effetto sarebbe in molti casi disastroso, in quanto la denaturazione dell enzima (che è una proteina) inizia a circa C e a 55 C è quasi completa. Per questo motivo febbri molto alte sono dannose all organismo umano, superata una certa soglia il malfunzionamento degli enzimi porta un rallentamento dei processi metabolici e in casi estremi anche la morte.
11 La curva rappresenta l andamento della velocità della reazione in funzione della temperatura. Come si può facilmente notare la velocità aumenta fino ad una temperatura ottimale, oltre la quale inizia l effetto negativo dovuto alla denaturazione con una rapida discesa della velocità fino a 0 zero. 9. Inibizione enzimatica Gli enzimi sono inibiti da aspecifiche sostanze dette inibitori, questi sono capaci di rallentare la velocità di una reazione enzimatica o di impedire la reazione stessa. Esistono due tipologie di inibizione, quella irreversibile e quella reversibile (che a sua volta è suddivisa in inibizione competitiva e non competitiva) Inibizione irreversibile L inibizione irreversibile è la disattivazione definitiva di un enzima e può essere provocata da numerose cause. Dato che gli enzimi sono proteine, tutti gli agenti denaturanti disattivano gli enzimi. Queste sostanze si legano in modo irreversibile (con legami forti spesso di tipo covalente) ai gruppi presenti nel sito attivo, formando un composto molto stabile enzima-inebitore. Un esempio di tali sostanze sono i cationi metallici pesanti ( Ag+, Pb 2+, Cd 2+, Hg 2+ ) che legandosi con lo zolfo presente nell amminoacido cisteina, provocano la precipitazione dei relativi solfuri, composti estremamente stabili, inibendo in modo definitivo l enzima. Un secondo esempio di un inibizione irreversibile è quella causata dal gas nervino che inibisce l acetilcoenzima A, uno degli enzimi responsabili della trasmissione dell impulso nervoso. Gli inibitori irreversibili sono sostanze molto studiate per la loro potenziale applicazione in campo medico. Esiste però il problema che essendo sostanze molto reattive subiscono modificazioni nell organismo che le rendono inutili.
12 Inibizione reversibile competitiva Nell inibizione competitiva un inibitore si lega con l enzima, impedendo il legame con il substrato. Tuttavia l inibitore reagisce in modo reversibile, quindi l efficacia dell inibizione dipende dalla concentrazione dell inibitore rispetto a quella del substrato; l enzima si lega con la sostanza presente in quantità maggiore. Affinchè ciò avvenga le molecole di inibitore e quelle di substrato devono essere strutturalmente simili. Es. Le intossicazioni da metanolo sono molto pericolose, in quanto nel fegato il metanolo viene ossidato a formaldeide la quale crea gravi lesioni (scioglie i tessuti della ghiandola epatica). L enzima che catalizza l ossidazione del metanolo a formaldeide e quella dell etanolo a acetaldeide è il medesimo, quindi i pazienti vengono curati con una grossa dose si etanolo che ad alte concentrazioni si ossida al posto del metanolo. Un secondo esempio è fornito dai sulfamidici, prima dell avvento degli antibiotici le infezioni batteriche venivano curate con queste sostanze in quanto inibiscono l enzima che nei batteri produce l acido folico. Quest acido è necessario per la costruzione della membrana batterica, quindi i batteri non possono divedersi e crescere in numero, così che l infezione si arresta. Inibizione reversibile non competitiva Nell inibizione non competitiva una molecola di inibitore si lega alla proteina (enzima) modificando la conformazione del sito attivo e impedendo quindi la formazione del complesso enzimasubstrato. L inibitore non si lega direttamente al sito attivo dell enzima ma in un altro punto della proteina, formando il sito allosterico e così si modifica anche il sito attivo. La competizione non è competitiva in quanto non dipende dalla concentrazione dell inibitore.
13 10. Controllo dei processi metabolici I processi metabolici sono la sequenza delle molteplici reazioni che avvengono in una cellula e che ne permettono la vita. Enzimi allosterici Esistono alcuni enzimi a struttura quaternaria la cui attività può essere modificata reversibilmente da sostanze chiamate modulatori o attivatori. Tali enzimi sono chiamati enzimi allosterici, questi presentano oltre al sito attivo, altri siti detti allosterici ove si inseriscono i modulatori. Il modulatore legandosi con l enzima nel sito allosterico provoca l attivazione o la disattivazione dell enzima. I modulatori positivi agevolano e migliorano il riconoscimento enzima-substrato e quindi aumentano la velocità di reazione, viceversa i modulatori negativi diminuiscono la velocità di reazione o la annullano. Quando il substrato stesso dell enzima può essere un modulatore, l enzima è detto omotropico, mentre se il modulatore è una molecola diversa dal substrato, l enzima è detto eterotropico. All interno di un processo metabolico che può richiedere una sequenza di molte reazioni, catalizzate quindi da molti enzimi, gli enzimi allosterici catalizzano la prima reazione così che si possa avere un controllo su tutto il processo; se si interrompe la prima reazione è ovvio che si arrestano anche quelle seguenti. Tale reazione viene chiamata tappa metabolica e l enzima che la catalizza, enzima chiave regolatore. Risulta chiaro che un modello di questo tipo non obbedisce al modello semplificato di Michaelis- Menten, consideriamo come cambia la cinetica di una reazione catalizzata da un enzima allosterico: A basse concentrazioni di substrato, un aumento di questo causa solo un lieve incremento di velocità. A più alte concentrazioni di substrato si ha un accentuato incremento di velocità, in quanto man mano che si lega il substrato aumenta l attività dell enzima (siamo nel caso in cui il substrato stesso è il modulatore attivatore dell enzima allosterico, tale caso è definito operatività positiva) Ad alte concentrazioni di substrato, come nel modello semplificato, la velocità detiene un andamento asintotico verso la velocità massima. Sul grafico notiamo come il cambiamento dell andamento da iperbolico a sigmoide evidenzia l effetto cooperativo: se tutte le subunità sono tali da contribuire alla catalisi ci sarà una brusca crescita della velocità.
14 La maggior parte degli enzimi è costituita da macromolecole complesse formate da più subunità, dotate ognuna del proprio sito allosterico. Grazie a tale disposizione, il legame dell effettore a uno dei siti allosterici innesca un cambiamento nella conformazione dell enzima che viene trasmesso alle altre subunità. Il risultato è che le altre subunità vengono maggiormente attivate o disattivate, il concetto è definito azione cooperativa. Meccanismo concertato di Monod-Wyman-Changeux (MWC) La proteina allosterica è formata da due subunità che esistono in due stati differenti: Stato R (rilassato) che ha alta affinità per il substrato Stato T (teso) ha bassa affinità per il substrato Le subunità devono essere tutte nello stesso stato (o R o T). In assenza di modulatori i due stati sono in equilibrio. Quando si aggiunge un modulatore attivatore l equilibrio si sposta verso lo stato R e quindi abbiamo una maggiore affinità tra enzima e substrato che dà origine alla cooperatività positiva. Meccanismo sequenziale di Koshland-Nemethy-Filmer (KNF) Riassumiamo per punti: Le subunità possono essere sia nello stato R che nello stato T Il substrato S ha un influenza diretta sulla forma dell enzima Adattamento indotto, il substrato entra nel sito attivo a causa di collisioni casuali e la subunità si sistema attorno al substrato per produrre un buon adattamento, così avremo la conversione nello stato R Il cambio T R in una subunità tende a spingere le altre subunità ad assumere la forma R, quindi avremo una cooperatività positiva. Inibizione retroattiva (feed-back) L inibizione retroattiva è un importante caso di regolazione allosterica, dove il prodotto finale della sequenza di reazioni è il modulatore della prima reazione (tappa metabolica), questo mostra la sorprendente capacità di autocontrollo delle reazioni stesse. In altre parole il prodotto finale è colui che controlla il primo enzima affinchè questo catalizzi o arresti la prima reazione così che inizi o si arresti l intero processo metabolico. Ciò significa che le cellule interrompono la produzione di un dato composto quando esso è già presente in quantità sufficiente e la riprendono quando la sua concentrazione è troppo bassa.
15 La regolazione allosterica dell emoglobina Un esempio classico di allosteria è l emoglobina, la proteina responsabile del trasporto di ossigeno nel sangue. Sebbene l emoglobina sia una proteina di trasporto e non un enzima il suo caso viene studiato in quanto esempio di regolazione allosterica. La struttura dell emoglobina è a quattro subunità disposte in modo simmetrico. La sua capacità di legare l ossigeno è influenzata da un modulatore, il DPG, 2,3-difosfoglicerato. Il DPG, legandosi al sito allosterico di una delle quattro subunità, è in grado di ridurre l affinità per l ossigeno negli altri siti attivi comportandosi quindi come un inibitore allosterico; tanto più alta è la sua concentrazione quanto più velocemente decresce l affinità fra ossigeno e le quattro subunità dell emoglobina. Rappresentazione delle quattro subunità dell emoglobina (ααββ) e dei relativi siti attivi ove si legano le molecole di ossigeno. Marco Bonechi
Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi)
 ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI Gli enzimi sono i catalizzatori dei processi biologici. Possono essere proteine globulari oppure acidi nucleici (ribozimi) Sono in grado di aumentare la velocità dei processi catalizzati fino a
ENZIMI. Un enzima è un catalizzatore (acceleratore) di reazioni biologiche.
 ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
ENZIMI ENZIMI Un enzima è un catalizzatore (acceleratore) di reazioni biologiche. Catalizzatore = sostanza in grado di accelerare lo svolgimento di una reazione chimica e quindi di aumentarne la sua velocità,
Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi.
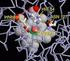 ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
ENZIMI Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. Svolgono il loro ruolo con modalità differenti
- utilizzano esclusivamente le reattività chimiche di alcuni residui AA
 Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
Enzimi semplici Enzimi coniugati - utilizzano esclusivamente le reattività chimiche di alcuni residui AA - richiedono la reattività chimica aggiuntiva di COFATTORI o COENZIMI gruppi prostetici COENZIMI
ENZIMI. Durante la reazione l enzima può essere temporaneamente modificato ma alla fine del processo ritorna nel suo stato originario, un enzima viene
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari, e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre
 Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
Enzimi = catalizzatori di una reazione biochimica Caratteristiche: Specificità: ogni enzima riconosce specificamente il/i substrato/i e non altre molecole, anche chimicamente simili al substrato. Saturabilità:
GLI ENZIMI: proteine con attività CATALITICA
 Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
Cap. 6 GLI ENZIMI: proteine con attività CATALITICA Catalizzatori biologici: permettono alle reazioni biochimiche di avvenire a temperature e pressioni fisiologiche e a velocità misurabile. Aumentano la
REGOLAZIONE ENZIMATICA
 REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
REGOLAZIONE ENZIMATICA Cambio conformazionale In molte molecole proteiche, cambiamenti strutturali possono determinare profondi cambiamenti nella funzione o nell attività. Il cambio conformazionale può
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30)
 TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
TEORIA DELLO STATO DI TRANSIZIONE (Henry Eyring anni 30) A + B-C A-B + C (A B C) Complesso attivato Stato di transizione Coordinata di reazione H A H B + H C H A + H B H C A+ K B X k' P + Q [ P] d dt =
Principi di Biochimica
 Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Principi di Biochimica Augusto Innocenti Biologo Nutrizionista Perfezionamento in Biochimica e Biologia Molecolare Phd in Neurobiologia e Neurofisiologia Materia: Atomi e Molecole La materie è costituita
Gli enzimi e la catalisi
 Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Gli enzimi e la catalisi Distribuzione di energia in una popolazione di molecole Normalmente, le molecole stabili sono per lo più presenti ad un livello di energia relativamente basso Solo una piccola
Energia di attivazione
 Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Energia di attivazione La maggior parte delle reazioni chimiche avviene con un apporto iniziale di energia per poter prendere l avvio procedere alla giusta velocità. Questo vale per le reazioni esoergoniche
Helena Curtis N. Sue Barnes
 Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Helena Curtis N. Sue Barnes LA FOTOSINTESI INDICE Organismi autotrofi ed eterotrofi Confronto tra fotosintesi e respirazione Reazioni endoergoniche ed esoergoniche Reazioni accoppiate Fase luce-dipendente
Enzimi come catalizzatori biologici
 Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
Enzimi come catalizzatori biologici Gli enzimi sono molecole proteiche aventi il compito di catalizzare praticamente tutte le reazioni chimiche che avvengono negli organismi viventi. La catalisi procede
costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più
 Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
Cinetica Enzimatica OBIETTIVO PRINCIPALE: costruire un equazione che potesse descrivere in generale il comportamento cinetico degli enzimi e quindi di determinare parametri cinetici più importanti (K M,
BIOCHIMICA APPLICATA e CLINICA
 BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
BIOCHIMICA APPLICATA e CLINICA Regolazione Enzimatica Biosegnalazione Regolazione Ormonale Specializzazioni metaboliche (Biochimica d Organo) Integrazione del metabolismo BIOCHIMICA APPLICATA e CLINICA
FUNZIONI delle PROTEINE
 FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
FUNZIONI delle PROTEINE Ha le dimensioni del reciproco di una concentrazione (M -1 ) Ha le dimensioni di una concentrazione (M) La frazione dei siti occupati rispetto ai siti totali è definita come θ FRAZIONE
Formula generale di un amminoacido
 Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Formula generale di un amminoacido Gruppo carbossilico Gruppo amminico Radicale variabile che caratterizza i singoli amminoacidi Le catene laterali R degli amminoacidi di distinguono in: Apolari o idrofobiche
Il trasporto del glucosio
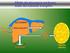 Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Il trasporto del glucosio Il glucosio non può diffondere direttamente nelle cellule Esso entra nelle cellule mediante due meccanismi di trasporto: a) diffusione facilitata Na + indipendente b) co-trasporto
Energia e metabolismi energetici
 Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Energia e metabolismi energetici L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità di effettuare un lavoro L energia
Amminoacidi Peptidi Proteine
 Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
Amminoacidi Peptidi Proteine Amminoacidi: Struttura generale COOH H NH 2 Centro chiralico Gli amminoacidi nelle molecole proteiche sono tutti stereoisomeri L IDROFOBOCI IDROFOBOCI IDROFILICI Secondo gruppo
di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori.
 Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Enzimi Con l eccezione l di piccoli gruppi di molecole di RNA catalitico tutti gli enzimi sono proteine Molti enzimi per poter funzionare richiedono la presenza di cofattori. apoenzima + cofattore = oloenzima
Capitolo 6 La respirazione cellulare
 Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
Capitolo 6 La respirazione cellulare Introduzione alla respirazione cellulare 6.1 La respirazione polmonare rifornisce le nostre cellule di ossigeno ed elimina diossido di carbonio La respirazione polmonare
INTRODUZIONE AL METABOLISMO
 INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
INTRODUZIONE AL METABOLISMO METABOLISMO Il metabolismo (dal greco metabolé = trasformazione) è il complesso delle reazioni chimiche coordinate ed integrate che avvengono in una cellula. Il metabolismo
Chimica Fisica Biologica
 Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Chimica Fisica Biologica Università degli Studi di Padova Variazione della concentrazione [1] La variazione nel tempo della composizione di un sistema oggetto della cinetica chimica Le concentrazione delle
Gli enzimi e l inibizione enzimatica.
 Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Gli enzimi e l inibizione enzimatica. Catalisi enzimatica La velocità di una reazione è descritta dall equazione di Arrhenius: k = Ae -Ea/RT in cui A è il fattore pre-esponenziale R è la costante dei gas
Ioni inorganici (Mg 2+, Zn 2+ ), o molecole organiche o metallorganiche (coenzimi)
 ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
ENZIMI Tutti gli enzimi sono PROTEINE che funzionano da catalizzatori biologici nelle reazioni cellulari e lavorano in condizioni blande di temperatura e ph (sono in grado di aumentare la velocità delle
AMMINOACIDI E PROTEINE
 AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
AMMINOACIDI E PROTEINE 1 AMMINOACIDI Gli amminoacidi sono composti organici composti da atomi di carbonio, idrogeno, ossigeno e azoto e in alcuni casi anche da altri elementi come lo zolfo. Gli amminoacidi
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione.
 Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Cinetica chimica E lo studio della velocità delle reazioni chimiche, delle leggi di velocità e dei meccanismi di reazione. Es. 2H 2(g) + O 2(g) d 2H 2 O (l) K eq (25 C)=10 83 (ricavato da lnk=-δg /RT)
Mioglobina ed emoglobina
 Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
Mioglobina ed emoglobina α β Muscolo Deposito di O 2 Alta affinità per O 2 β α Globulo rosso Trasporto di O 2 Bassa affinità per O 2 Cooperativa ed allosterica Animali Mb-knockout (2003) : funzionalità
CLASSIFICAZIONE ENZIMI
 CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
CLASSIFICAZIONE ENZIMI nome raccomandato nome sistematico reazione catalizzata Classe di enzima Reazione catalizzata 1. Ossidoreduttasi Ossido-riduzione 2. Transferasi Trasferimento di gruppi funzionali
Chimica Biologica A.A Cinetica Enzimatica. Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano
 Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
Chimica Biologica A.A. 2010-2011 Cinetica Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Macromolecole Biologiche Cinetica Chimica Termodinamica: fornisce
L ACQUA E LE SUE PROPRIETÀ
 L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
L ACQUA E LE SUE PROPRIETÀ L acqua è una sostanza indispensabile per tutte le forme di vita. Ogni molecola di acqua (H2O) è formata da due atomi di idrogeno e un atomo di ossigeno, uniti tramite due legami
ENERGIA LIBERA DI GIBBS (G)
 METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
METABOLISMO: Descrive tutte le numerose reazioni con cui le molecole biologiche sono sintetizzate e degradate, e che permettono di ricavare, accumulare e utilizzare energia Ogni reazione metabolica comporta
Immagini e concetti della biologia
 Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Sylvia S. Mader Immagini e concetti della biologia 2 A3 Le molecole biologiche 3 Il carbonio è l elemento di base delle biomolecole Una cellula batterica può contenere fino a 5000 tipi diversi di composti
Inibizione Enzimatica
 Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
Chimica Biologica A.A. 2010-2011 Inibizione Enzimatica Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie Università di Milano Inibizione enzimatica Inibitori: sostanze che riducono l
- CINETICA ENZIMATICA
 - CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
- CINETICA ENZIMATICA ENZIMI: - CATALIZZATORI aumenta la V di una reazione chimica senza subire trasformazioni durante l intero processo - PROTEINE gli enzimi sono proteine di struttura 3 o talora 4 -
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO
 L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
L EMOGLOBINA ED IL TRASPORTO DI OSSIGENO Lezione 23 1 Concentrazione di O 2 nel plasma Il contenuto totale di O2 nel sangue è pari alla quantità disciolta più quella legata all emoglobina: L O 2 totale
Regolano il metabolismo, sia come enzimi, sia come ormoni (insulina, glucagone, ecc.)
 Grazie alla elevata dinamicità delle strutture proteiche (gli atomi sono in continuo movimento fluttuante) e per la capacità che hanno di legarsi in modo selettivo ad altre molecole, le proteine svolgono
Grazie alla elevata dinamicità delle strutture proteiche (gli atomi sono in continuo movimento fluttuante) e per la capacità che hanno di legarsi in modo selettivo ad altre molecole, le proteine svolgono
ENZIMI. A + B AB (100 Kcal= E. Attiv.) A + B AB (50 Kcal) SUBSTRATO ENZIMA E N E R G I A
 ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
ENZIMI 1) sono catalizzatori di natura biologica e sono proteine 2) gli enzimi abbassano l energia di attivazione di un solo tipo di reazione senza intervenire nella reazione stessa cioè senza esserne
FUNZIONI BIOLOGICHE DELLE PROTEINE
 FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
FUNZIONI BIOLOGICHE DELLE PROTEINE ENZIMI PROTEINE DI TRASPORTO PROTEINE DI RISERVA PROTEINE CONTRATTILI PROTEINE DI DIFESA PROTEINE REGOLATRICI PROTEINE STRUTTURALI ENERGIA LIBERA (G) ΔG = ΔH - TΔS Variazioni
Il metabolismo cellulare
 Il metabolismo cellulare L obesità è problema sanitario e sociale Tessuto adiposo bianco e bruno È tutta una questione di energia: Se si assumono più molecole energetiche di quelle che ci servono per costruire
Il metabolismo cellulare L obesità è problema sanitario e sociale Tessuto adiposo bianco e bruno È tutta una questione di energia: Se si assumono più molecole energetiche di quelle che ci servono per costruire
Il metabolismo: concetti di base
 Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Il metabolismo: concetti di base Caratteristiche generali Strategie Trofiche Il metabolismo:
Corso di Laurea Magistrale in Ingegneria Biomedica Complementi di Chimica e Biochimica per le Tecnologie Biomediche Il metabolismo: concetti di base Caratteristiche generali Strategie Trofiche Il metabolismo:
Organizzazione della materia
 Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
Organizzazione della materia Elementi: sostanze che non possono essere scisse in altre più semplici mediante reazioni chimiche ordinarie. Atomo: è la porzione più piccola di un elemento, formato da 3 particelle
5. Trasporto di membrana
 5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
5. Trasporto di membrana contiene materiale protetto da copyright, ad esclusivo uso personale; 1 non è consentita diffusione ed utilizzo di tipo commerciale Le membrane biologiche hanno una permeabilità
Respirazione cellulare
 Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Respirazione cellulare L equazione generale della respirazione C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O + 36 ATP 1 molec zucchero 6 molec ossigeno 6 molec anidride carbonica 6 molec acqua + = + + 36 molecole
Legami chimici. Covalente. Legami deboli
 Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Legami chimici Covalente Legami deboli Legame fosfodiesterico Legami deboli Legami idrogeno Interazioni idrofobiche Attrazioni di Van der Waals Legami ionici STRUTTURA TERZIARIA La struttura tridimensionale
Valitutti, Falasca, Tifi, Gentile. Chimica. concetti e modelli.blu
 Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
Valitutti, Falasca, Tifi, Gentile Chimica concetti e modelli.blu 2 Capitolo 20 La velocità di reazione 3 Sommario 1. Che cos è la velocità di reazione 2. L equazione cinetica 3. Gli altri fattori che influiscono
INTRODUZIONE AL METABOLISMO. dal gr. metabolè = trasformazione
 INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
INTRODUZIONE AL METABOLISMO dal gr. metabolè = trasformazione IL Metabolismo Il metabolismo è la somma di tutte le trasformazioni chimiche che avvengono in una cellula o in un organismo. E costituito da
Ioni metallici: Cu 2+, Fe 3+, Zn 2+ Coenzimi : NAD +, FAD + COSUBSTRATI GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Fondamenti di Chimica Farmaceutica. Recettori come bersagli dei farmaci
 Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
Fondamenti di Chimica Farmaceutica Recettori come bersagli dei farmaci Recettori come bersaglio dei farmaci I farmaci che agiscono sui recettori: a somiglianza dei farmaci che agiscono sugli enzimi vanno
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA
 TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
TUTTI GLI ENZIMI POSSONO ESSERE ANALIZZATI IN MODO DA POTER QUANTIFICARE SIA LA VELOCITA DI REAZIONE CHE LA LORO EFFICIENZA ENZIMATICA Lo studio della cinetica enzimatica inizia nel 1909 con ADRIAN BROWN
Introduzione alla biologia della cellula. Lezione 2 Le biomolecole
 Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Introduzione alla biologia della cellula Lezione 2 Le biomolecole Tutte le molecole contenute nelle cellule sono costituite da composti del carbonio Zuccheri Lipidi Proteine Acidi nucleici Polimeri Sono
Fonte diretta di Energia è l ATP.
 Una cellula compie tre tipi di lavoro: -Lavoro meccanico: movimenti muscolari.. -Lavoro di trasporto: trasporto contro gradiente -Lavoro chimico: assemblaggio di polimeri da monomeri Fonte diretta di Energia
Una cellula compie tre tipi di lavoro: -Lavoro meccanico: movimenti muscolari.. -Lavoro di trasporto: trasporto contro gradiente -Lavoro chimico: assemblaggio di polimeri da monomeri Fonte diretta di Energia
La via per accelerare i processi biologici
 La via per accelerare i processi biologici ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa.
La via per accelerare i processi biologici ENZIMI Sono delle proteine altamente specializzare con attività catalitica, accelerano le reazioni chimiche rimanendo inalterati al termine della reazione stessa.
1/v
 1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
1. Nel seguente grafico sono descritti i risultati di cinetica enzimatica ottenuti in 3 esperimenti condotti in assenza di inibitori e in presenza di un inibitore a due diverse concentrazioni. a) Individuare
Velocità di reazione Una trasformazione chimica modifica completamente la natura delle sostanze iniziali ( i reagenti), formando altre specie (i prodo
 Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
Dinamica chimica (cinetica) Studio della velocità di reazione Bibliografia David W. Oxtoby, Norman H. Nachtrieb, Wade A. Freeman Chimica Edises Mario Nardelli Chimica generale Darrell D. Ebbing, Steven
METABOLISMO CELLULARE
 METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
METABOLISMO CELLULARE Struttura dell ATP (Adenosintrifosfato) Adenina (base azotata), Ribosio (zucchero) e un gruppo fosforico ATP Il legame covalente tra i gruppi fosforici si spezza facilmente liberando
Laboratorio Fitness & Wellness
 Laboratorio Fitness & Wellness Anno Accademico 2015/2016 Ewan Thomas, MSc Principi di Bioenergetica e Biomeccanica Metabolismo Catabolismo Processi di degradazione che permettono di liberare energia Anabolismo
Laboratorio Fitness & Wellness Anno Accademico 2015/2016 Ewan Thomas, MSc Principi di Bioenergetica e Biomeccanica Metabolismo Catabolismo Processi di degradazione che permettono di liberare energia Anabolismo
I LEGAMI CHIMICI. I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune
 I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
I LEGAMI CHIMICI I legami chimici si formano quando gli atomi cedono, acquistano oppure mettono in comune alcuni elettroni con altri atomi, per completare il guscio elettronico più esterno. 1. LEGAME IONICO
L ATTIVITA DELLA CELLULA
 L ATTIVITA DELLA CELLULA nutrizione crescita eliminare i rifiuti mantenimento delle strutture movimento riproduzione comunicazione per svolgere tutte queste attività, le cellule hanno bisogno di ENERGIA
L ATTIVITA DELLA CELLULA nutrizione crescita eliminare i rifiuti mantenimento delle strutture movimento riproduzione comunicazione per svolgere tutte queste attività, le cellule hanno bisogno di ENERGIA
Gli equilibri di solubilità
 Gli equilibri di solubilità Abbiamo definito la solubilità come la concentrazione della soluzione satura, che è una soluzione il cui il composto in soluzione è in equilibrio con il composto indisciolto.
Gli equilibri di solubilità Abbiamo definito la solubilità come la concentrazione della soluzione satura, che è una soluzione il cui il composto in soluzione è in equilibrio con il composto indisciolto.
FARMACODINAMICA. La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci.
 FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
FARMACODINAMICA La farmacodinamica studia gli effetti biochimici e il meccanismo d azione dei farmaci. La farmacodinamica si propone di: * identificare i siti d azione dei farmaci * delineare le interazioni
I materiali della vita
 I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
I materiali della vita I componenti chimici dei viventi Il corpo dei viventi è formato da relativamente pochi elementi chimici e in percentuale diversa da quella del mondo non vivente. Le molecole dei
Capitolo 5 L energia e il trasporto
 Capitolo 5 L energia e il trasporto La cellula e l energia 5.1 L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità
Capitolo 5 L energia e il trasporto La cellula e l energia 5.1 L energia è la capacità di produrre lavoro Tutti gli organismi hanno bisogno di energia per vivere. L energia è definita come la capacità
Regolazione allosterica
 Macromolecole Biologiche Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Regolazione allosterica Marco Nardini Dipartimento
Macromolecole Biologiche Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Regolazione allosterica Marco Nardini Dipartimento
Chimica Analitica con elementi di statistica Lezione n 5
 Chimica Analitica con elementi di statistica Lezione n 5 Christian Durante E-mail: christian.durante@unipd.it Tel. 049-8275112 Zona quadrilatero ufficio 00 215 02 142 (orario di ricevimento: tutti I giorni
Chimica Analitica con elementi di statistica Lezione n 5 Christian Durante E-mail: christian.durante@unipd.it Tel. 049-8275112 Zona quadrilatero ufficio 00 215 02 142 (orario di ricevimento: tutti I giorni
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE
 Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Molti sali contengono un anione o un catione che possono reagire con acqua rendendo le loro soluzioni ACIDE o BASICHE Molti sali reagiscono con l acqua alterando il suo rapporto molare tra [H] e [OH] -
Ioni metallici: Cu 2+, Fe 3+, Zn 2+ Coenzimi : NAD +, FAD + COSUBSTRATI GRUPPI PROSTETICI
 ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
ENZIMI Tutti gli enzimi sono proteine Elevata specificità e senza la formazione di sottoprodotti Non vengono modificati o consumati durante la reazione alla fine si ritrovano inalterati Agiscono in condizioni
Energia di attivazione
 1 ENZIMI Caratteristiche fondamentali della catalisi enzimatica e del meccanismo di azione degli enzimi Componenti strutturali e funzionali degli enzimi Nomenclatura e classificazione internazionale degli
1 ENZIMI Caratteristiche fondamentali della catalisi enzimatica e del meccanismo di azione degli enzimi Componenti strutturali e funzionali degli enzimi Nomenclatura e classificazione internazionale degli
Composti organici. I composti organici. Atomi e molecole di carbonio. Atomi e molecole di carbonio. Gruppi funzionali. Isomeri
 I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
I composti organici Atomi e molecole di carbonio Carboidrati Lipidi Proteine Acidi nucleici Composti organici Materiale composto da biomolecole - Formate in buona parte da legami ed anelli di carbonio.
L ATP E L ENERGIA LA CHIMICA DELLA VITA GSCATULLO
 L ATP E L ENERGIA LA CHIMICA DELLA VITA GSCATULLO ( L ATP e l energia L energia Energia e reazioni chimiche Una reazione chimica avviene quando gli atomi possiedono energia a sufficiente a combinarsi tra
L ATP E L ENERGIA LA CHIMICA DELLA VITA GSCATULLO ( L ATP e l energia L energia Energia e reazioni chimiche Una reazione chimica avviene quando gli atomi possiedono energia a sufficiente a combinarsi tra
Esploriamo la chimica
 1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
1 Valitutti, Tifi, Gentile Esploriamo la chimica Seconda edizione di Chimica: molecole in movimento Capitolo 15 La termodinamica e la cinetica 1. Le reazioni producono energia 2. Il primo principio della
Gerard Tortora, Brian Derrickson. Conosciamo
 1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
1 Gerard Tortora, Brian Derrickson Conosciamo il corpo umano Capitolo 1 L organizzazione del corpo umano 1. Che cosa sono l anatomia e la fisiologia 2. I livelli di organizzazione e gli apparati del corpo
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe.
 INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
INIBIZIONE ENZIMATICA REVERSIBILE Gli inibitori (I) legano l enzima e interferiscono con la loro attività modificando la Vmax, la Km o entrambe. Gli inibitori reversibili si legano all enzima mediante
Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico
 I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
I LEGAMI CHIMICI Legami atomici o forti Legami molecolari o deboli Legame covalente Puro Polare Legame dativo o di coordinazione Legame ionico Legame metallico Legame dipolo-dipolo Legame idrogeno Legame
B. Classificazione degli organismi 1. Autotrofi - si nutrono da soli a. ottengono il carbonio dalla CO 2 b. fonte di energia - fotosintetica: uso
 Outline Classificazione degli organismi Energia e metabolismo Energia libera Composti ad alta energia Ossidazione, riduzione e trasferimento energetico Ruolo degli enzimi Introduzione A. La vita è organica
Outline Classificazione degli organismi Energia e metabolismo Energia libera Composti ad alta energia Ossidazione, riduzione e trasferimento energetico Ruolo degli enzimi Introduzione A. La vita è organica
IL METABOLISMO ENERGETICO
 IL METABOLISMO ENERGETICO IL METABOLISMO L insieme delle reazioni chimiche che riforniscono la cellula e l organismo di energia e materia SI DIVIDE IN: CATABOLISMO produce ENERGIA METABOLISMO ENERGETICO
IL METABOLISMO ENERGETICO IL METABOLISMO L insieme delle reazioni chimiche che riforniscono la cellula e l organismo di energia e materia SI DIVIDE IN: CATABOLISMO produce ENERGIA METABOLISMO ENERGETICO
DESTINI METABOLICI DEL PIRUVATO
 DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
DESTINI METABOLICI DEL PIRUVATO Glicolisi Piruvato Metabolismo aerobico: il piruvato entra nel mitocondrio Acetil-CoA Ciclo di Krebs Catena di trasporto degli elettroni Complesso della Piruvato deidrogenasi
Energia per la vita Bibliografia I colori della biologia Giusti- Gatti- Anelli Pearson Ed.
 Energia per la vita Bibliografia I colori della biologia Giusti- Gatti- Anelli Pearson Ed. Ogni alimento che ingeriamo viene scomposto attraverso i processi digestivi nelle sue molecole costituenti come
Energia per la vita Bibliografia I colori della biologia Giusti- Gatti- Anelli Pearson Ed. Ogni alimento che ingeriamo viene scomposto attraverso i processi digestivi nelle sue molecole costituenti come
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio. GLUCONEOGENESI (sintesi da precursori non glucidici)
 DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
DEGRADAZIONE di polisaccaridi (glicogeno epatico, amido o glicogeno dalla dieta) Glucosio GLUCONEOGENESI (sintesi da precursori non glucidici) La gluconeogenesi utilizza il piruvato e altri composti a
SOLUZIONI DEGLI ESERCIZI
 Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
Niccolò Taddei - Biochimica Capitolo 4 GLI ENZIMI 1 Un enzima è un particolare tipo di proteina con funzione di catalizzatore, cioè è in grado di aumentare la velocità di una reazione chimica. Gli enzimi
2 INCONTRO: LA PRODUZIONE DI ENERGIA NELLA CELLULA
 INCONTRO: LA PRODUZIONE DI ENERGIA NELLA CELLULA 1 INTRODUZIONE 1 L energia chimica Esistono diversi tipi di energia e una tra queste è l energia chimica: un tipo di energia che possiedono tutte le molecole
INCONTRO: LA PRODUZIONE DI ENERGIA NELLA CELLULA 1 INTRODUZIONE 1 L energia chimica Esistono diversi tipi di energia e una tra queste è l energia chimica: un tipo di energia che possiedono tutte le molecole
L equilibrio dell acqua
 L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
L equilibrio dell acqua Il ph e la reazione di autoprotolisi dell acqua Corpaci Ivana La molecola dell acqua H O H! L acqua è un composto molecolare covalente! La sua molecola è polare per la differenza
Come le cellule traggono energia dal cibo: produzione di ATP
 Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Come le cellule traggono energia dal cibo: produzione di ATP L energia è contenuta nei legami chimici delle molecole nutritive; la cellula estrae questa energia e la conserva nell ATP: respirazione cellulare
Gli Enzimi. catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche
 catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
catalizzatori biologici rendono possibile da un punto di vista cinetico le reazioni chimiche Gli Enzimi Sono le proteine più importanti e più specializzate Presentano un elevato grado di specificità per
da: Nelson & Cox (IV Ed.)
 da: Nelson & Cox (IV Ed.) da: Nelson & Cox (IV Ed.) Il prodotto finale dopo 7 cicli è il palmitil ACP. Il processo di allungamento si ferma a C 16 e l acido palmitico viene liberato dalla molecola di ACP
da: Nelson & Cox (IV Ed.) da: Nelson & Cox (IV Ed.) Il prodotto finale dopo 7 cicli è il palmitil ACP. Il processo di allungamento si ferma a C 16 e l acido palmitico viene liberato dalla molecola di ACP
Classe prima. Classe seconda
 LICEO SCIENTIFICO (INDIRIZZO ORDINARIO) CURRICULO DI SCIENZE Classe prima Conoscere le grandezze e le unità di misura del S.I.; il metodo scientifico e le sue fasi applicative ; Conoscere la Terra nello
LICEO SCIENTIFICO (INDIRIZZO ORDINARIO) CURRICULO DI SCIENZE Classe prima Conoscere le grandezze e le unità di misura del S.I.; il metodo scientifico e le sue fasi applicative ; Conoscere la Terra nello
STRUTTURA E FUNZIONE DELLE PROTEINE
 STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
STRUTTURA E FUNZIONE DELLE PROTEINE PROTEINE 50% DEL PESO SECCO DI UNA CELLULA STRUTTURA intelaiatura citoscheletrica strutture cellulari impalcatura di sostegno extracellulare FUNZIONE catalisi enzimatica
Catalisi. Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A Modulo di Biologia Strutturale
 Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
Biotecnologie applicate alla progettazione e sviluppo di molecole biologicamente attive A.A. 2010-2011 Modulo di Biologia Strutturale Catalisi Marco Nardini Dipartimento di Scienze Biomolecolari e Biotecnologie
IN UN ATOMO SI DISTINGUE UN NUCLEO CARICO POSITIVAMENTE ATTORNO AL QUALE RUOTANO PARTICELLE CARICHE NEGATIVAMENTE: GLI ELETTRONI (e - ) (-)
 LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
LA VITA, LA CHIMICA E L ACQUA PER INIZIARE QUALCHE CENNO DI CHIMICA LA MATERIA E FATTA DI COMBINAZIONI DI ELEMENTI. GLI ELEMENTI SONO COMPOSTI DA SINGOLI ATOMI, LE PIU PICCOLE UNITA CHE MANTENGONO LE PROPRIETA
Unità fondamentale di tutti gli organismi viventi.
 La cellula Unità fondamentale di tutti gli organismi viventi. Cellula procariote Cellula animale Cellula vegetale Le cellule procariote e eucariote Cellula procariote Cellula eucariote Cromosomi Membrana
La cellula Unità fondamentale di tutti gli organismi viventi. Cellula procariote Cellula animale Cellula vegetale Le cellule procariote e eucariote Cellula procariote Cellula eucariote Cromosomi Membrana
b) Un difetto di funzionamento: la fotorespirazione
 b) Un difetto di funzionamento: la fotorespirazione A questo punto, occorre dire qualcosa su quello che si può considerare un difetto di funzionamento della fotosintesi e sui meccanismi che determinate
b) Un difetto di funzionamento: la fotorespirazione A questo punto, occorre dire qualcosa su quello che si può considerare un difetto di funzionamento della fotosintesi e sui meccanismi che determinate
scaricato da www.sunhope.it Proteine semplici costituite dai soli amminoacidi
 Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Proteine semplici costituite dai soli amminoacidi Proteine coniugate costituite dagli amminoacidi + porzioni di natura non amminoacidica dette GRUPPI PROSTETICI Le Proteine coniugate prive del gruppo prostetico
Ossidazione del glucosio
 Ossidazione del glucosio Vie metaboliche all uso del glucosio Glicolisi e Fermentazioni 1 Reazione di ossidazione C 6 H 12 O 6 + 6 O 2 => 6 CO 2 + 6 H 2 O + 686 Kcal/mole Il glucosio reagisce direttamente
Ossidazione del glucosio Vie metaboliche all uso del glucosio Glicolisi e Fermentazioni 1 Reazione di ossidazione C 6 H 12 O 6 + 6 O 2 => 6 CO 2 + 6 H 2 O + 686 Kcal/mole Il glucosio reagisce direttamente
Gli ENZIMI sono proteine (eccezioni: RIBOZIMI = RNA con attività catalitica) che sono strutturalmente suddivise in due classi:
 ENZIMI Gli ENZIMI sono proteine (eccezioni: RIBOZIMI = RNA con attività catalitica) che sono strutturalmente suddivise in due classi: PROTEINE SEMPLICI (costituite solo dalla parte di natura proteica)
ENZIMI Gli ENZIMI sono proteine (eccezioni: RIBOZIMI = RNA con attività catalitica) che sono strutturalmente suddivise in due classi: PROTEINE SEMPLICI (costituite solo dalla parte di natura proteica)
CARBOIDRATI C H O ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO
 CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
CARBOIDRATI ZUCCHERO SACCARIDE GLUCIDE CARBOIDRATO C H O carboidrati C n H 2n O n H C O C O Il glucosio è un monosaccaride con 6 atomi di carbonio GLUCOSIO Forma ciclica Forma lineare a ph 7 circa lo 0,0026%
I composti organici e i loro polimeri
 I ARBIDRATI I composti organici e i loro polimeri La diversità molecolare della vita è basata sulle proprietà del ARBNI. Un atomo di carbonio può formare quattro legami covalenti. Questi legami gli permettono
I ARBIDRATI I composti organici e i loro polimeri La diversità molecolare della vita è basata sulle proprietà del ARBNI. Un atomo di carbonio può formare quattro legami covalenti. Questi legami gli permettono
I più comuni polisaccaridi sono: AMIDO CELLULOSA GLICOGENO DESTRINA
 GLICOGENO POLISACCARIDI La maggior parte dei carboidrati che si ritrovano in natura sono polimeri ad alto peso molecolare chiamati polisaccaridi L u n i t à m o n o s a c c a r i d i c a p i ù frequente
GLICOGENO POLISACCARIDI La maggior parte dei carboidrati che si ritrovano in natura sono polimeri ad alto peso molecolare chiamati polisaccaridi L u n i t à m o n o s a c c a r i d i c a p i ù frequente
Elementi sistemati nella TAVOLA PERIODICA DEGLI ELEMENTI in base al numero atomico crescente O, H, N, C (+ del 96% della materia vivente)
 OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
OVERVIEW Atomo: più piccola porzione di un elemento che mantiene le proprietà chimiche dello stesso Teoria atomica e tavola periodica Legami e interazioni degli atomi Acqua e le sue proprietà Acidi e basi
